Fracturas en niños con afecciones óseas preexistentes
Este capítulo tiene como objetivo abordar más específicamente las fracturas que se desarrollan en niños con tales afecciones. Es importante resaltar que el alcance de este tema es amplio, lo que nos lleva a definir los temas a tratar.
Decidimos no incluir en este capítulo las fracturas relacionadas con procesos infecciosos o trastornos metabólicos, como el raquitismo o la osteopsatirosis. En cambio, nos centraremos en las fracturas por estrés, considerando el diagnóstico diferencial, así como en aquellas que surgen de lesiones óseas tumorales o pseudotumorales preexistentes.
Las fracturas por estrés son particularmente relevantes debido a su naturaleza y los desafíos asociados con el diagnóstico y el tratamiento. Además, las fracturas resultantes de lesiones óseas tumorales o pseudotumorales requieren un abordaje especializado para garantizar un tratamiento adecuado y el mejor pronóstico posible.
Por ello, al delinear este capítulo buscamos brindar una visión integral de las fracturas en niños con afecciones óseas preexistentes, destacando los aspectos más relevantes para su comprensión y manejo clínico.
Tumores óseos benignos:
Entre las lesiones tumorales benignas de la infancia, que con mayor frecuencia pueden provocar fracturas, destacamos el osteoblastoma y el condroblastoma.
Osteoblastoma –
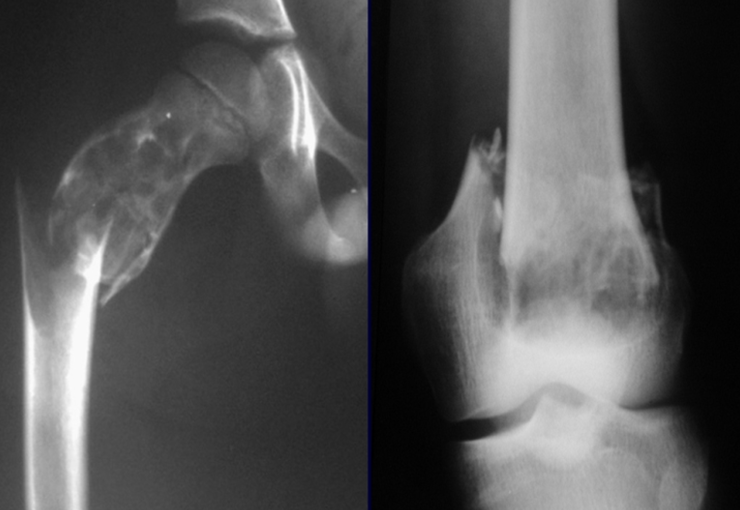
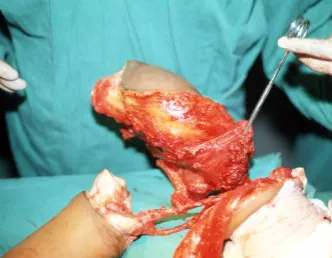
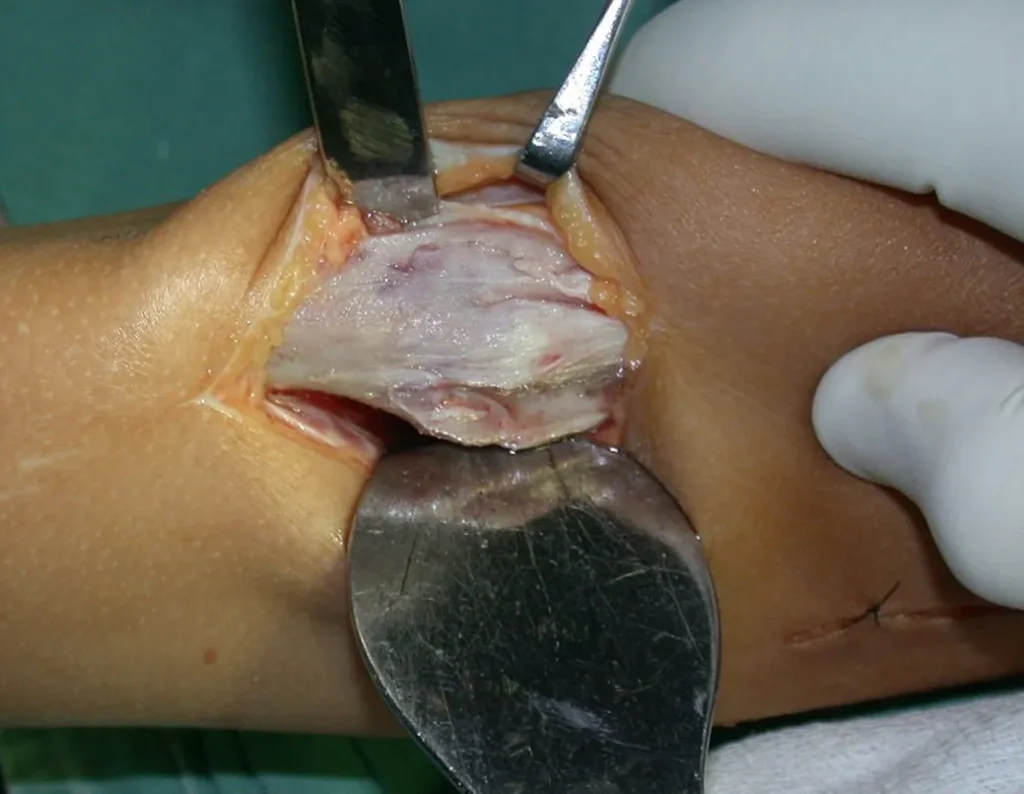
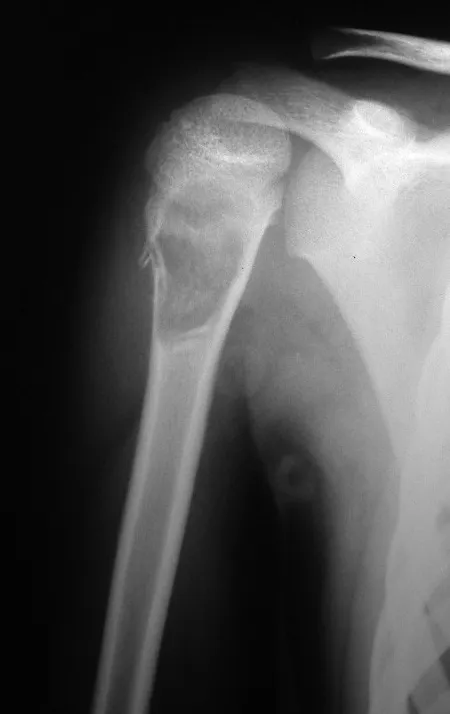
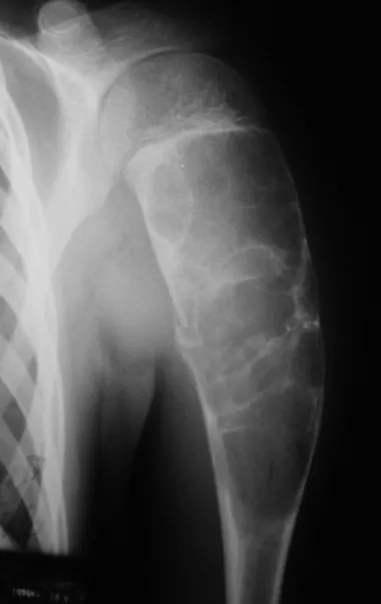
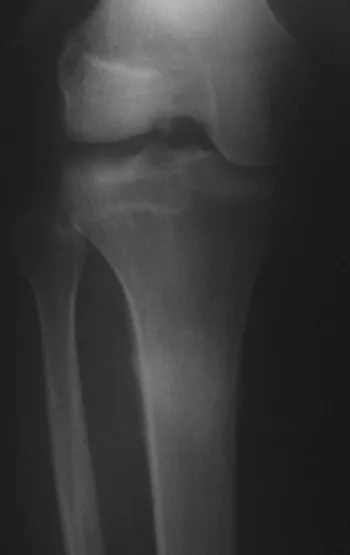
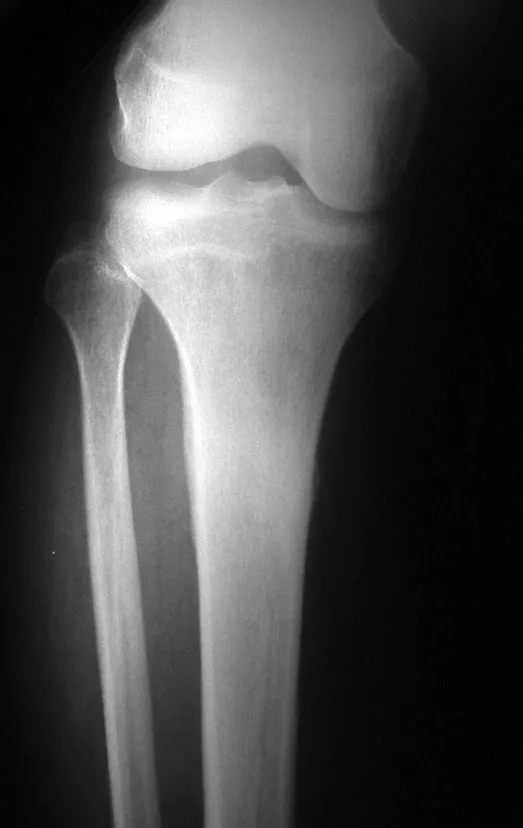
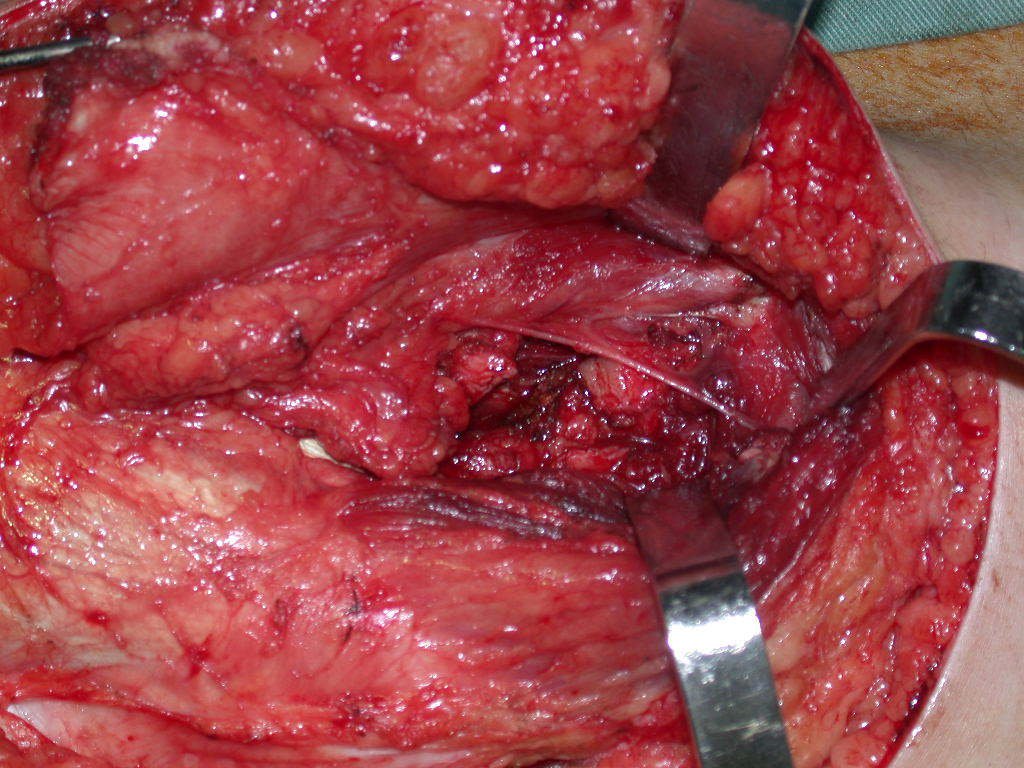
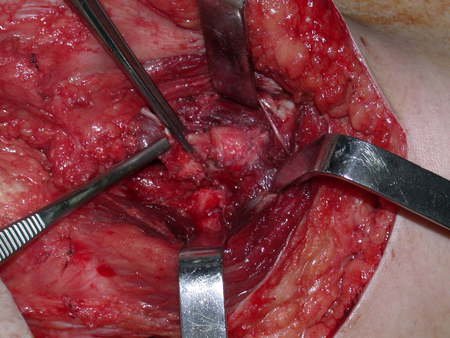
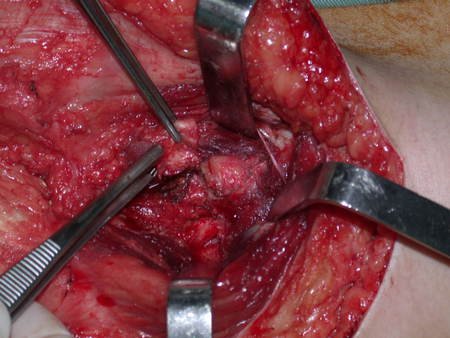
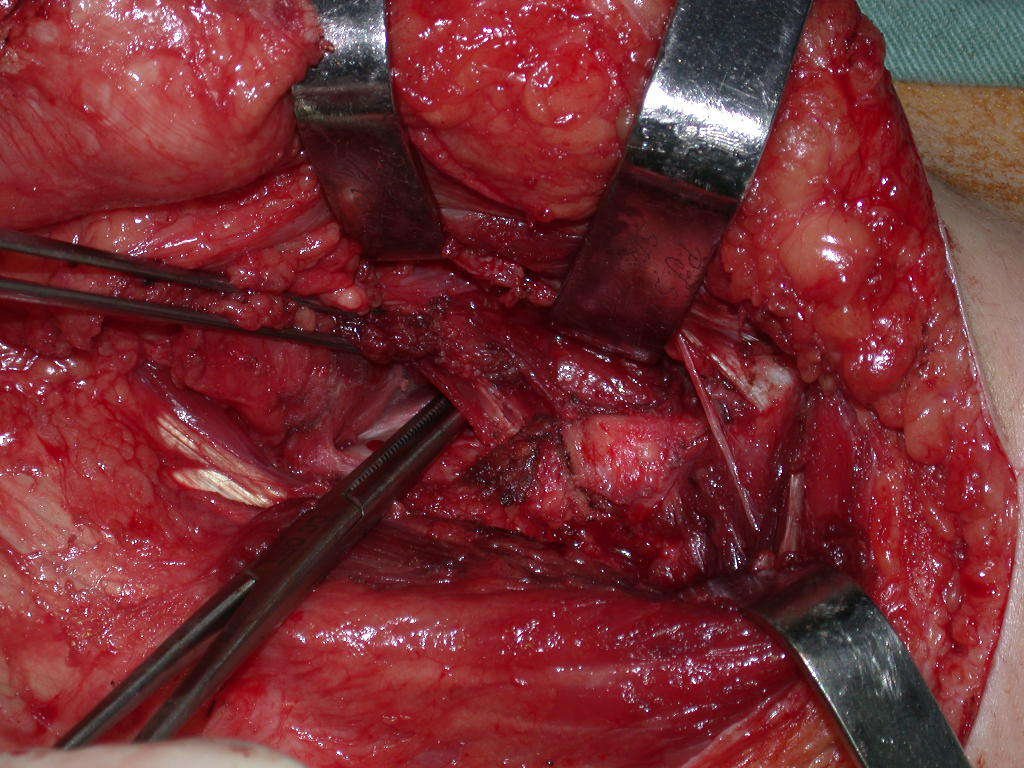
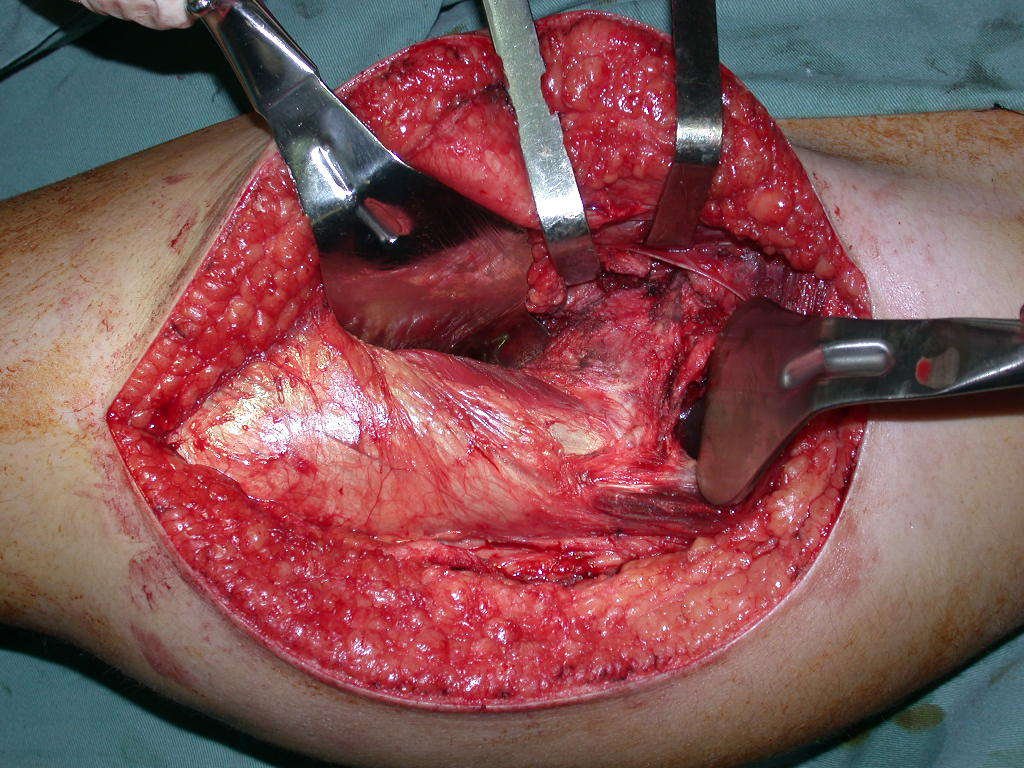
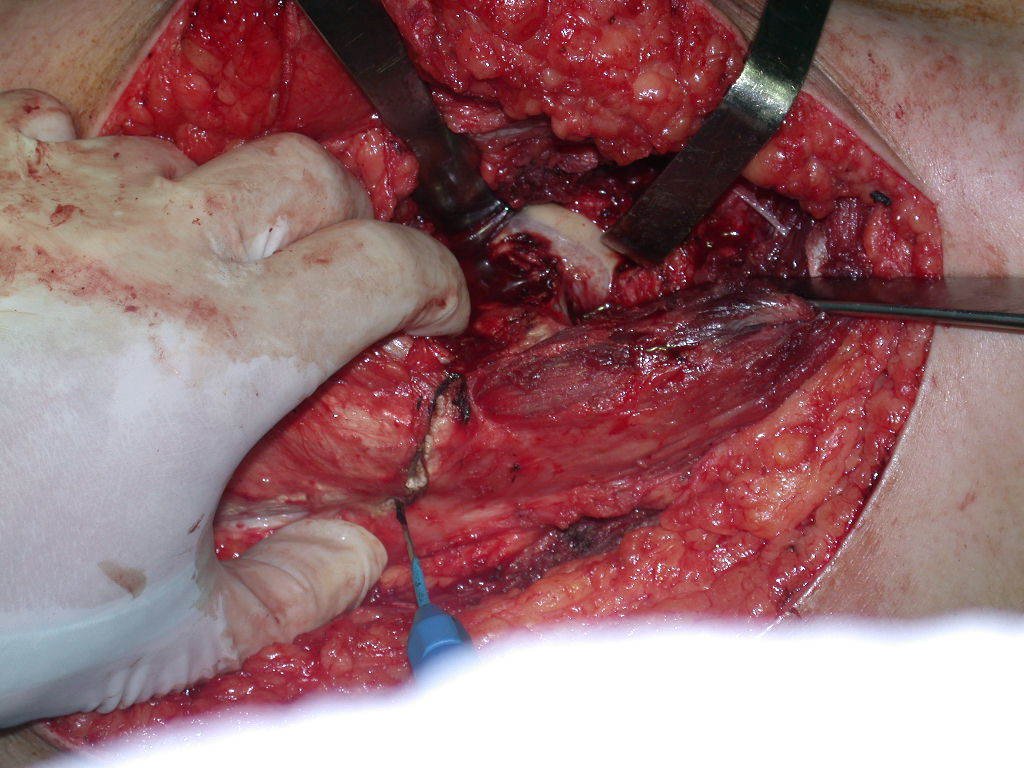
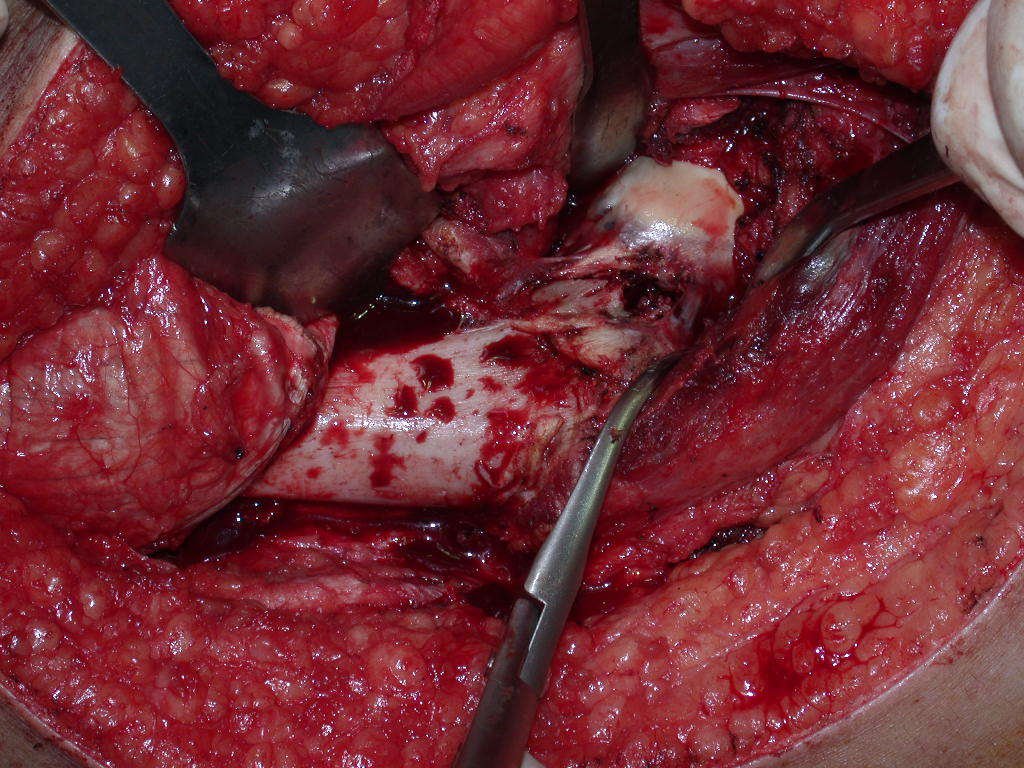
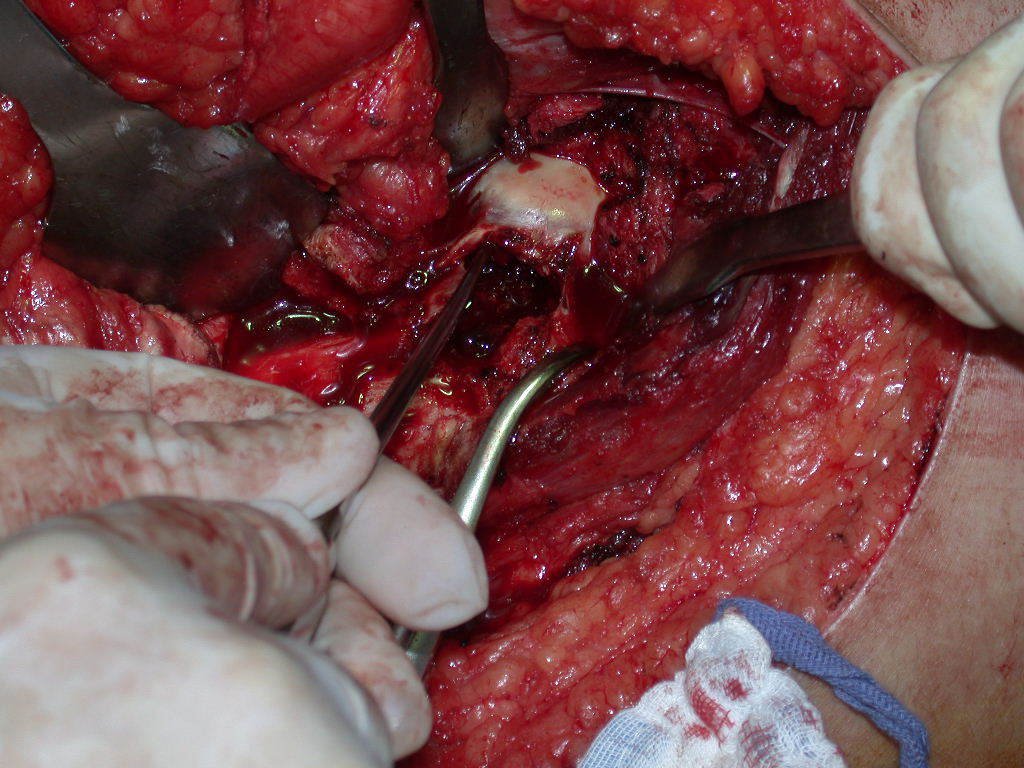
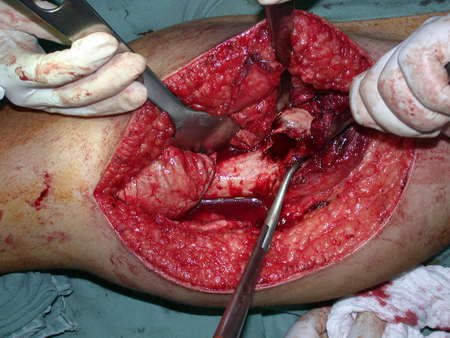
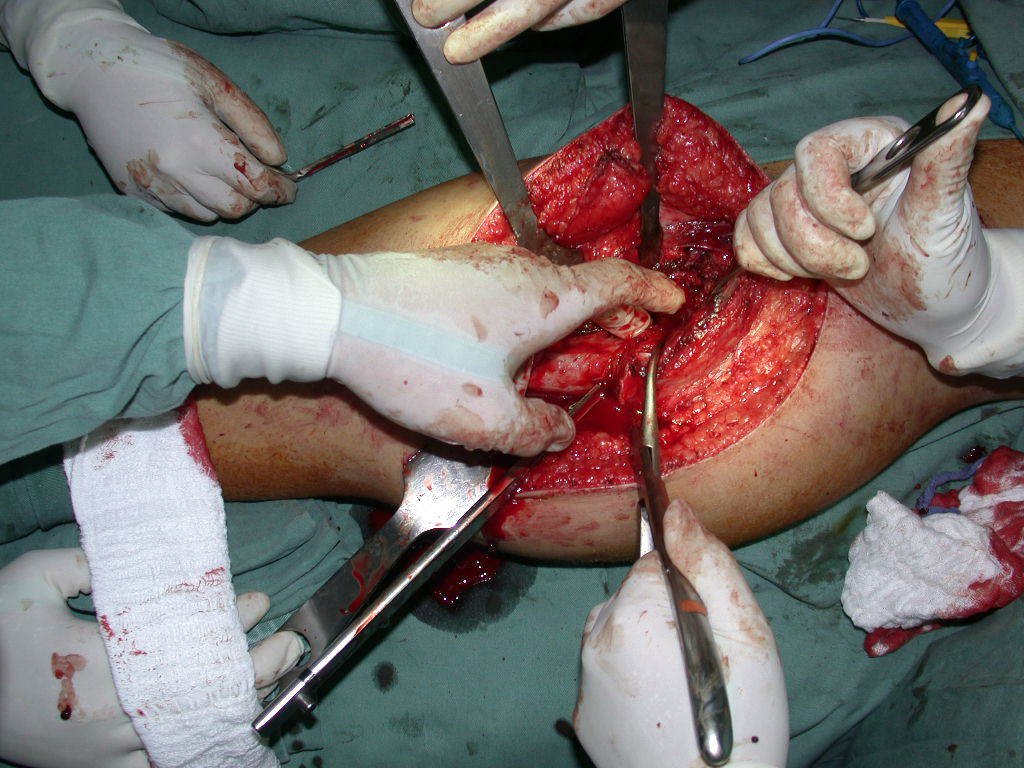
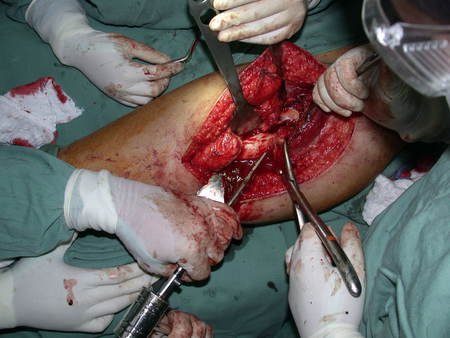
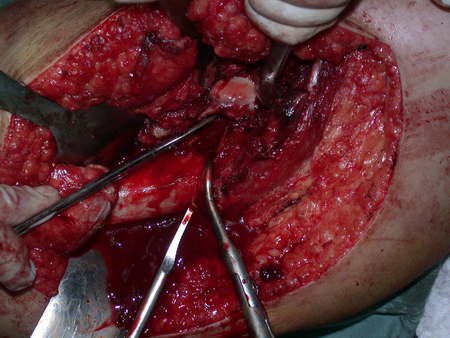
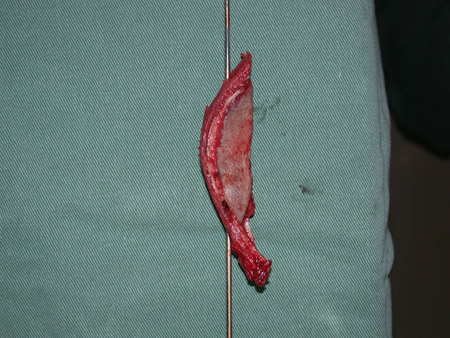
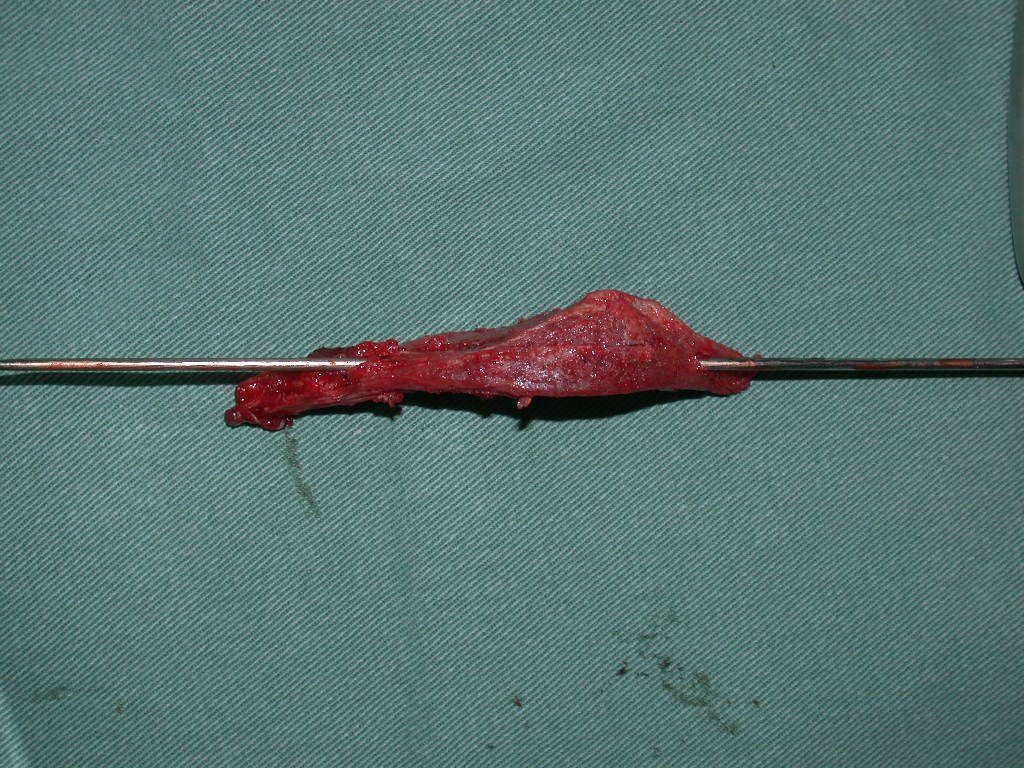
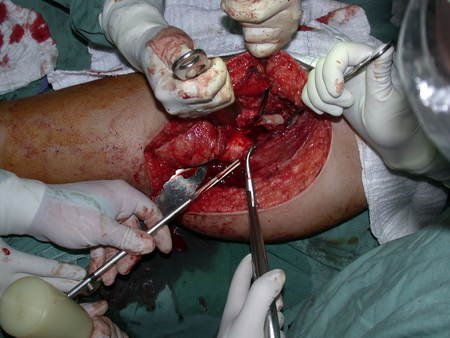
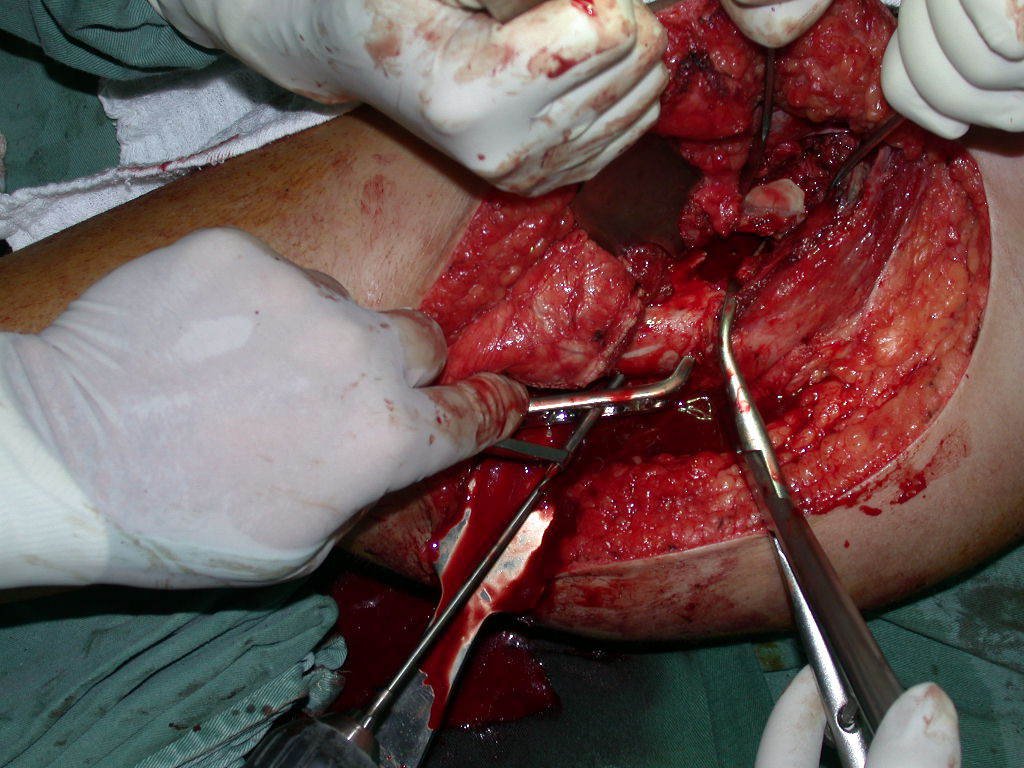
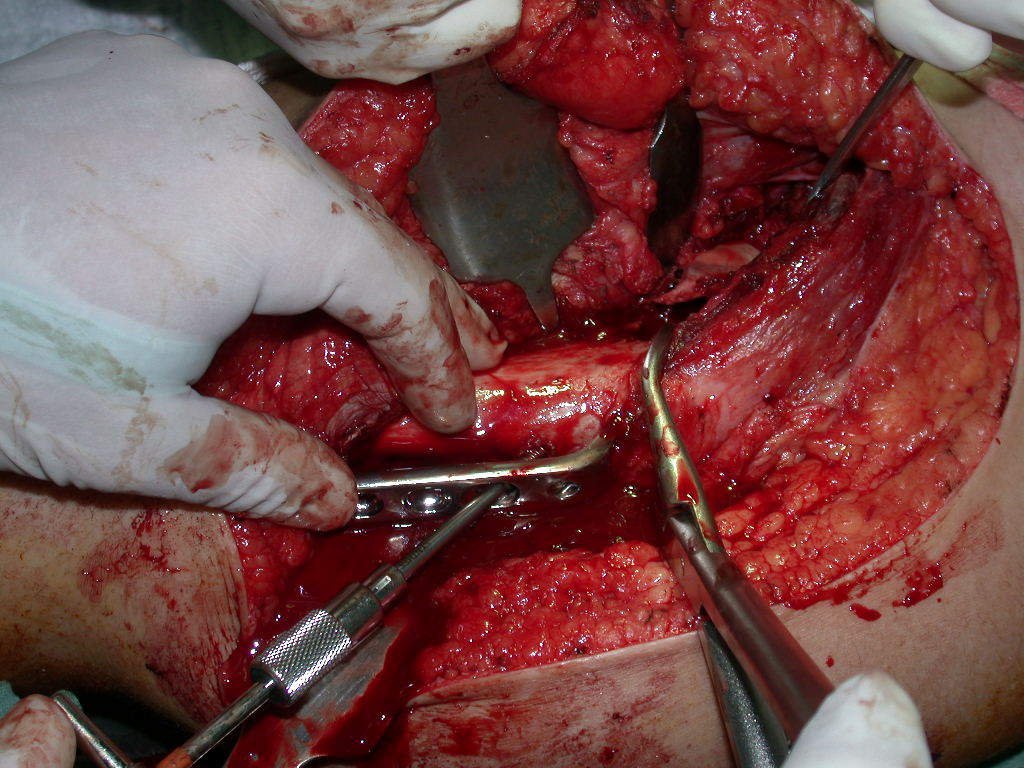
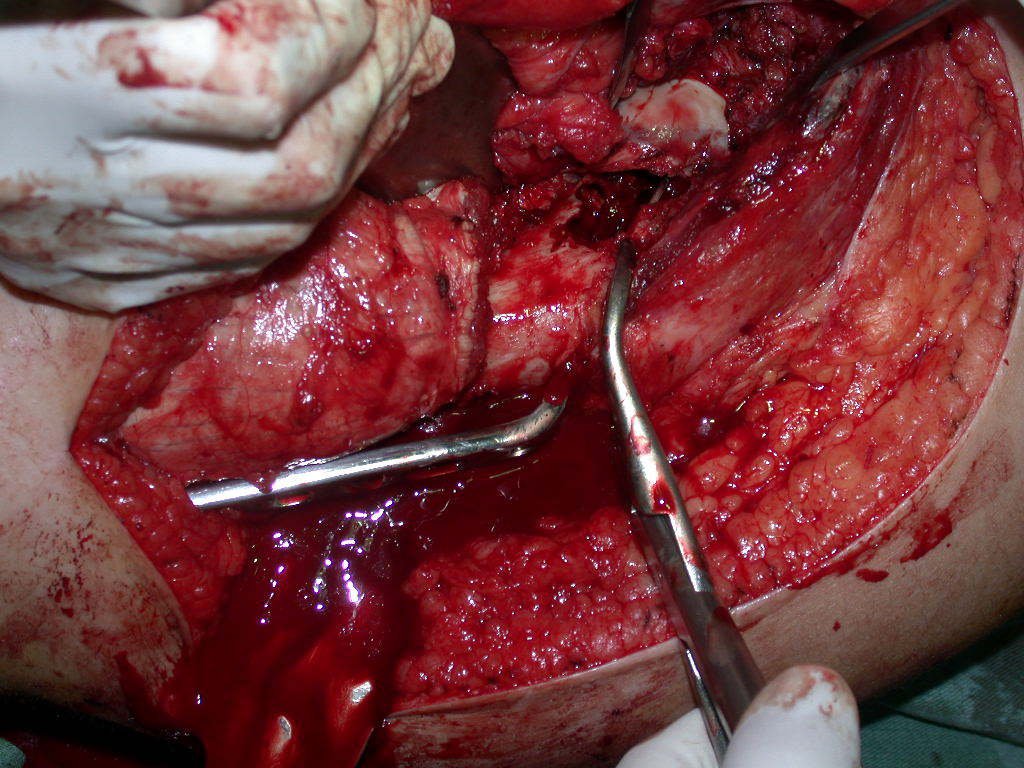
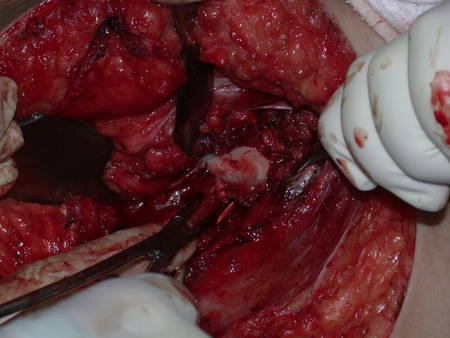
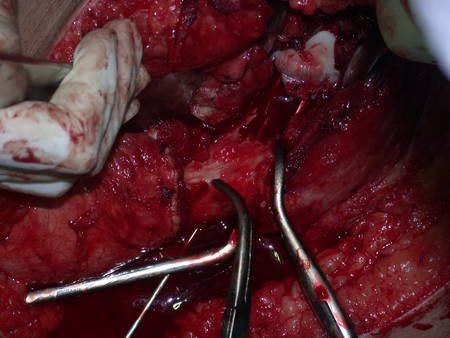
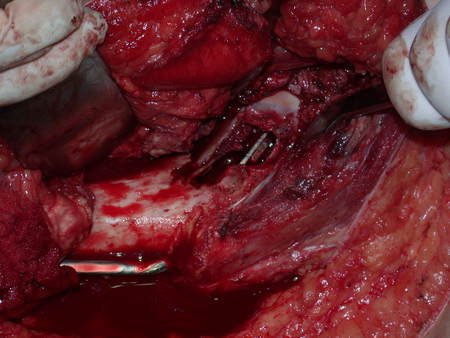
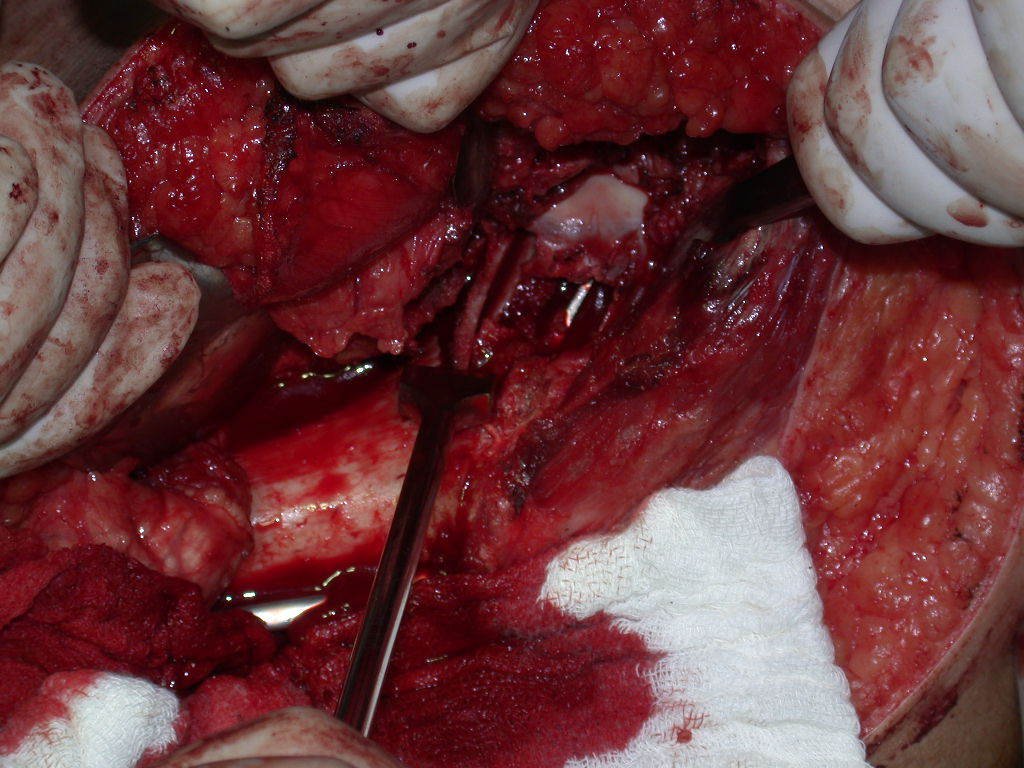
El osteoblastoma es un tumor óseo localmente agresivo que en huesos largos tiene una localización metafisaria, inicialmente cortical y excéntrica. Esta lesión, al ser localmente agresiva, con gran destrucción de la estructura ósea, provoca microfracturas, por erosión del hueso cortical (figs. 1 y 2). La destrucción progresiva de la corteza predispone a la fractura completa, cuando la afectación supera el cincuenta por ciento de la circunferencia ósea. La fractura de esta lesión facilita la diseminación local, dificultando el tratamiento oncológico, que requiere reconstrucciones elaboradas y limita la recuperación funcional (figs. 3 y 4).
Condroblastoma –
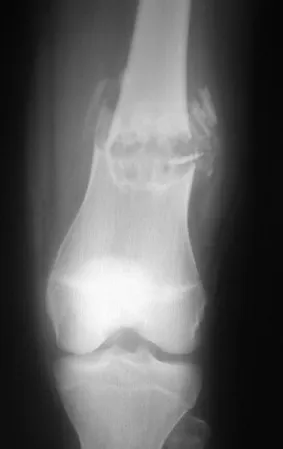
El condroblastoma afecta la región epifisaria de los huesos largos en crecimiento (figs. 7 y 8) y, con menor frecuencia, la porción apofisaria (figs. 9 y 10).
Este tumor óseo provoca reabsorción de la epífisis (o apófisis), erosión de la corteza ósea e invasión articular, dando lugar a artralgia, que puede provocar deformidad y fractura por hundimiento articular.
El tratamiento tanto del osteoblastoma como del condroblastoma es quirúrgico y debe realizarse lo antes posible, ya que estas lesiones, a pesar de ser histológicamente benignas, progresan rápidamente hasta la destrucción de la estructura ósea local.
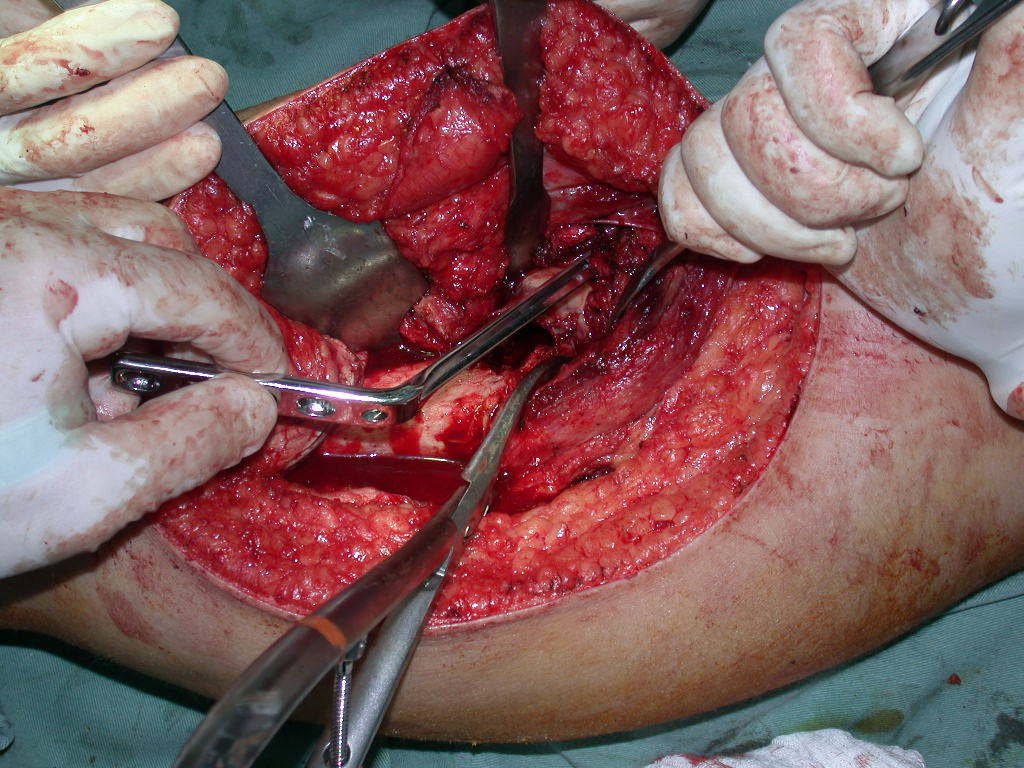
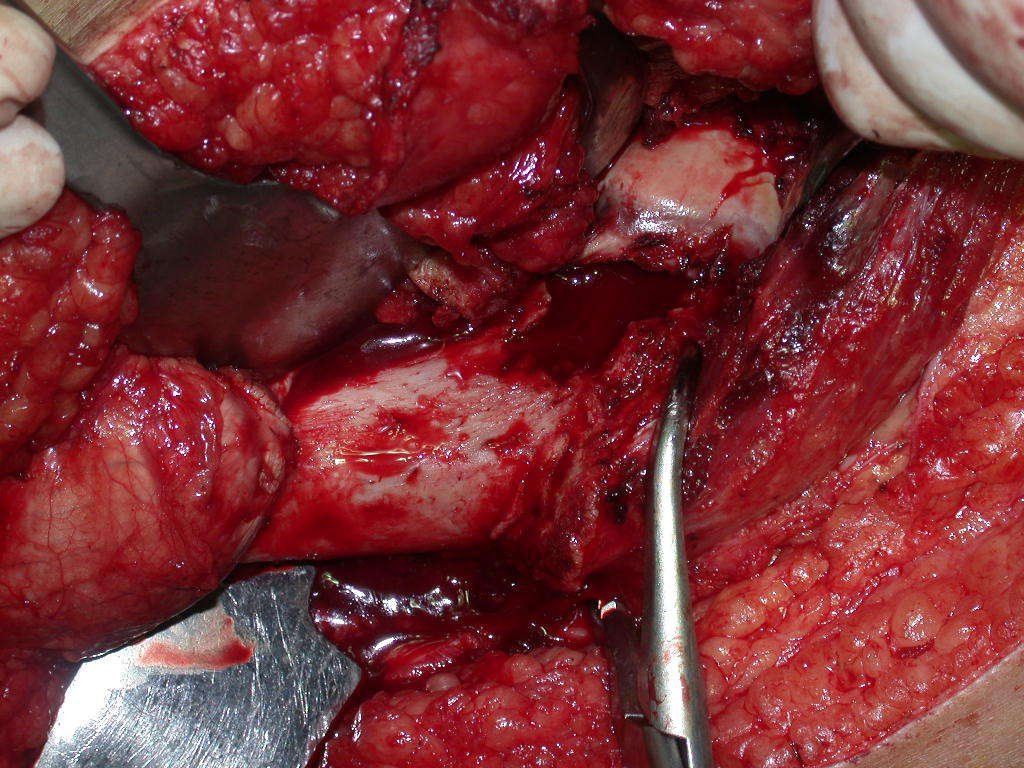
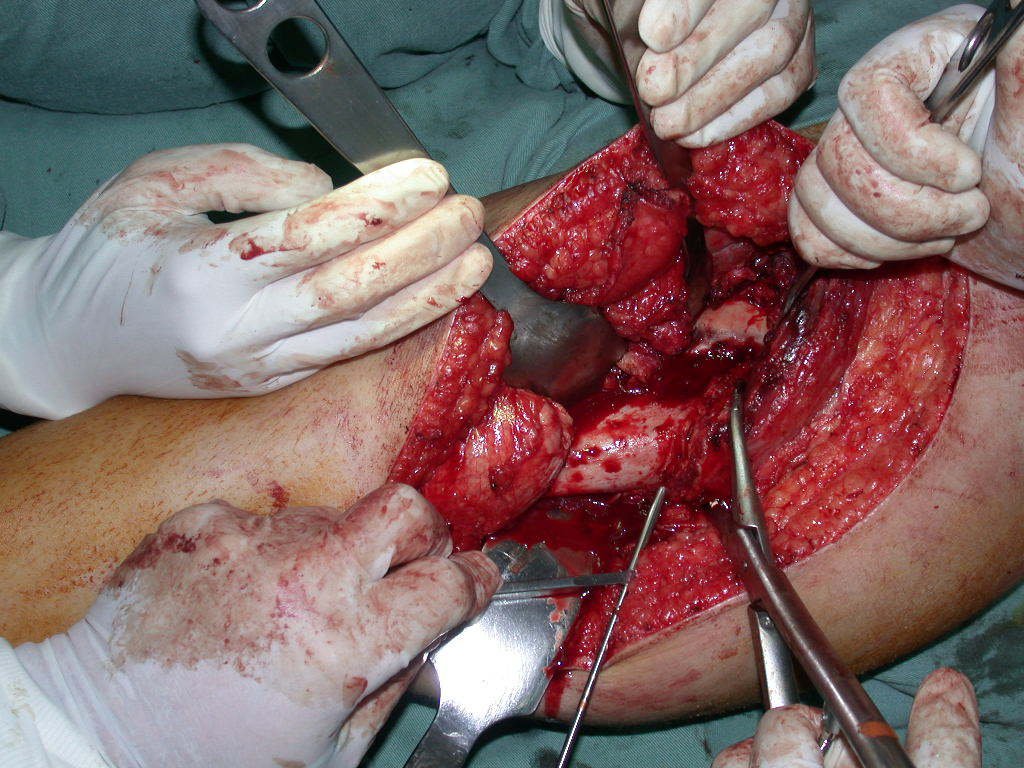
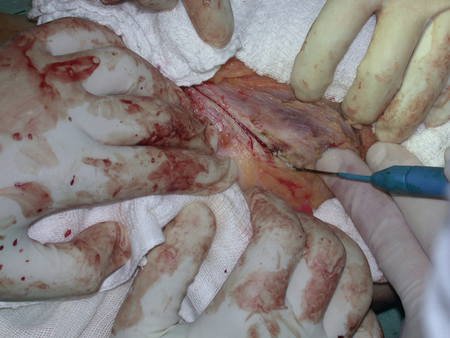
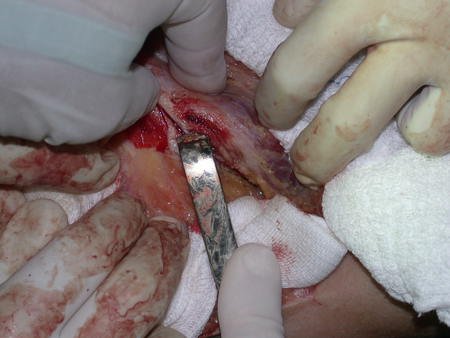
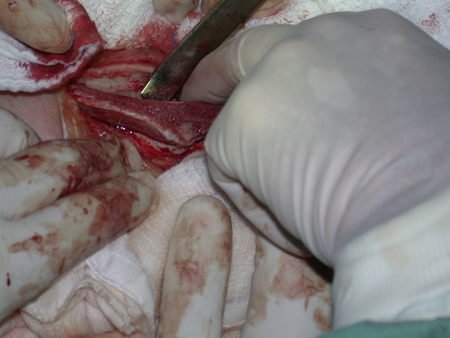
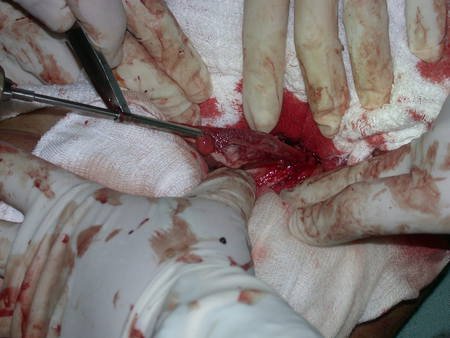
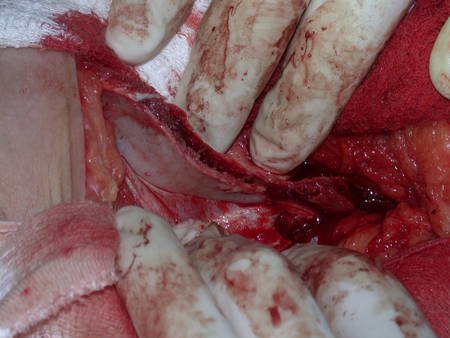
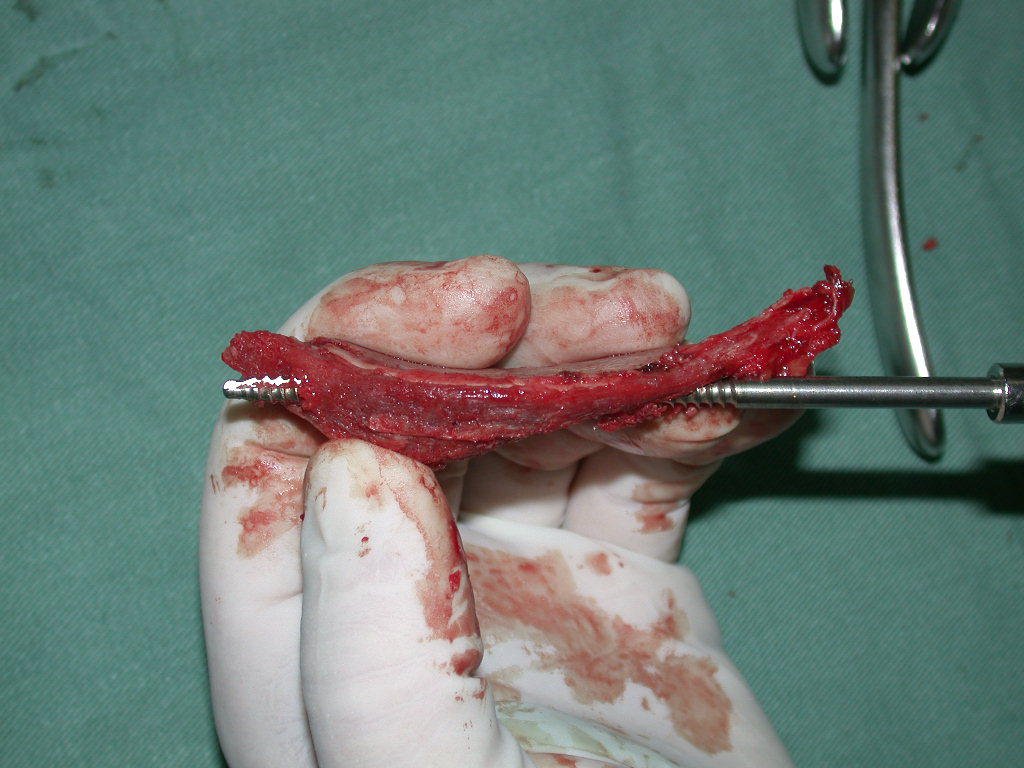
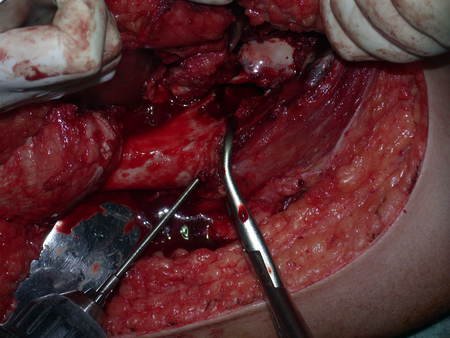
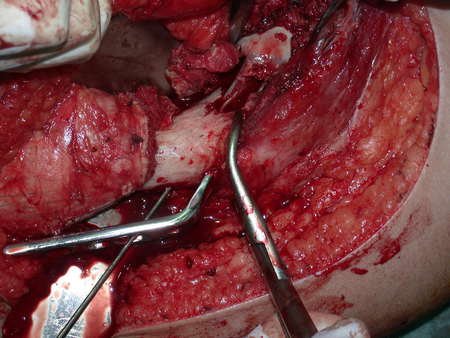
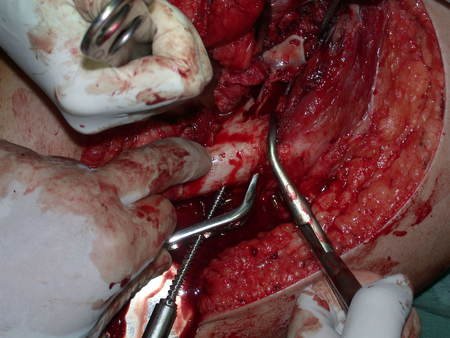
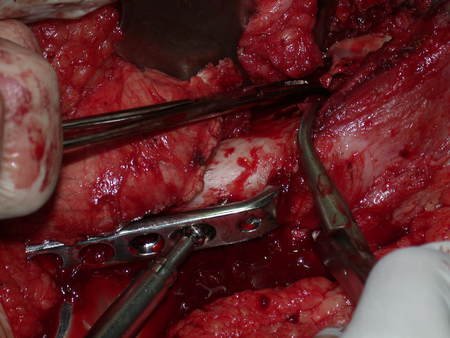
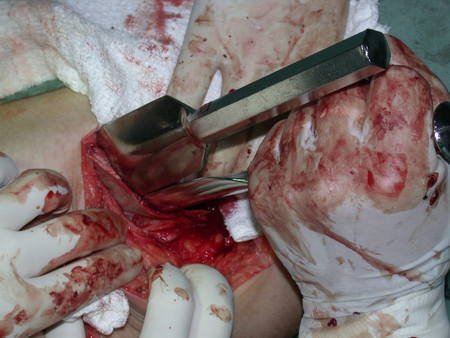
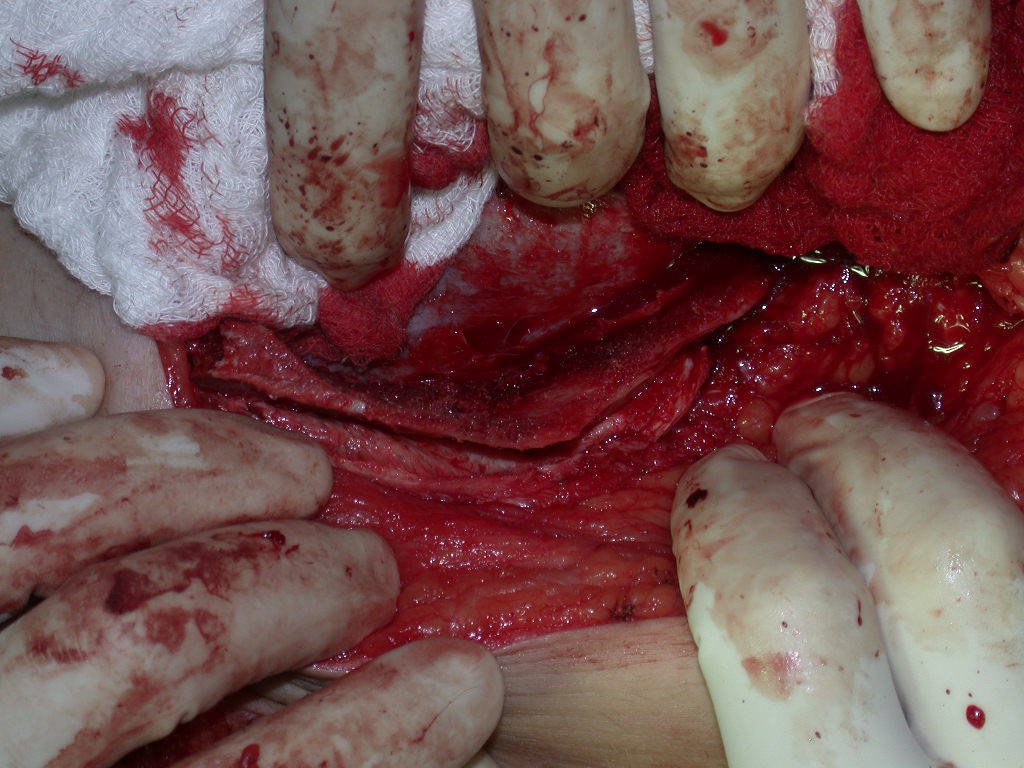
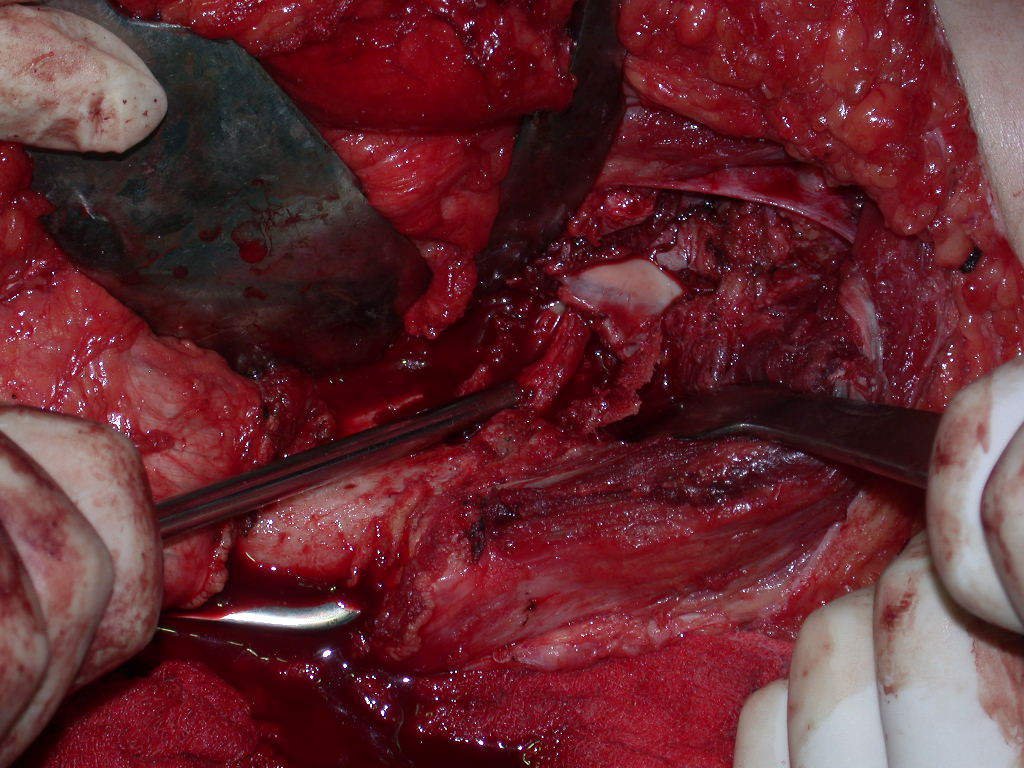
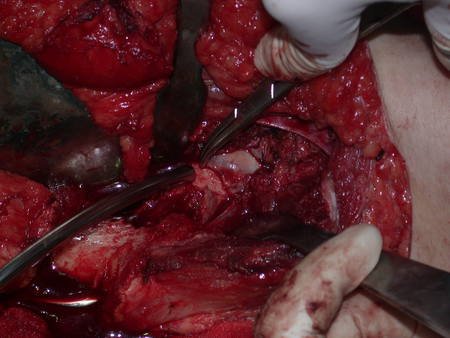
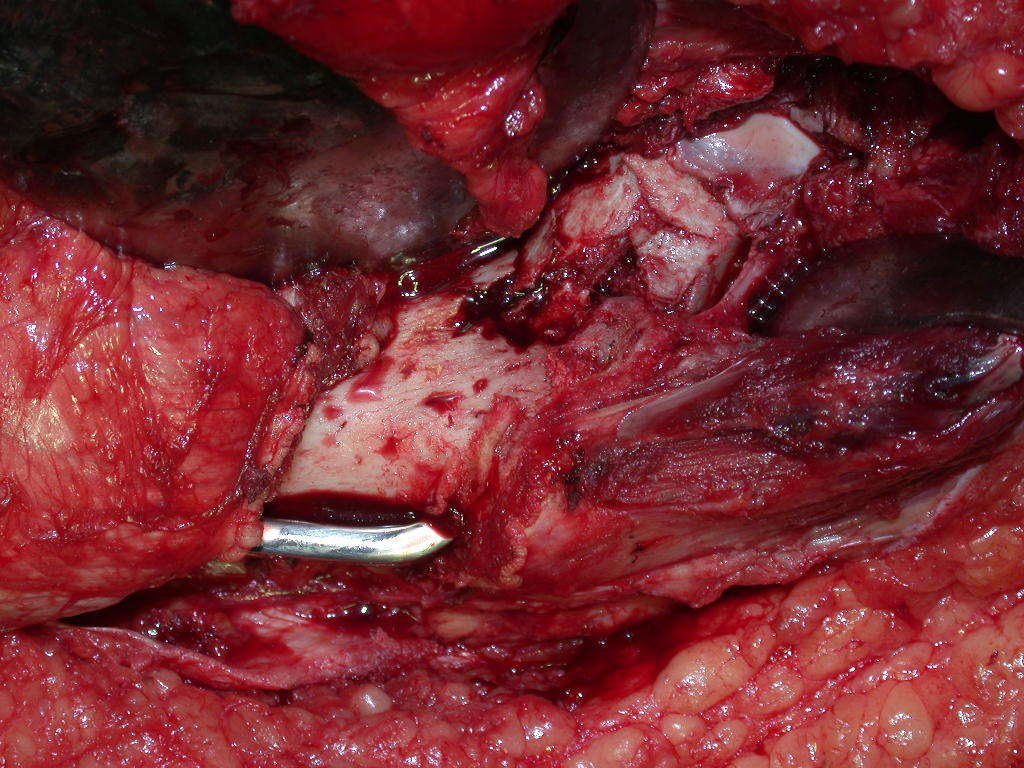
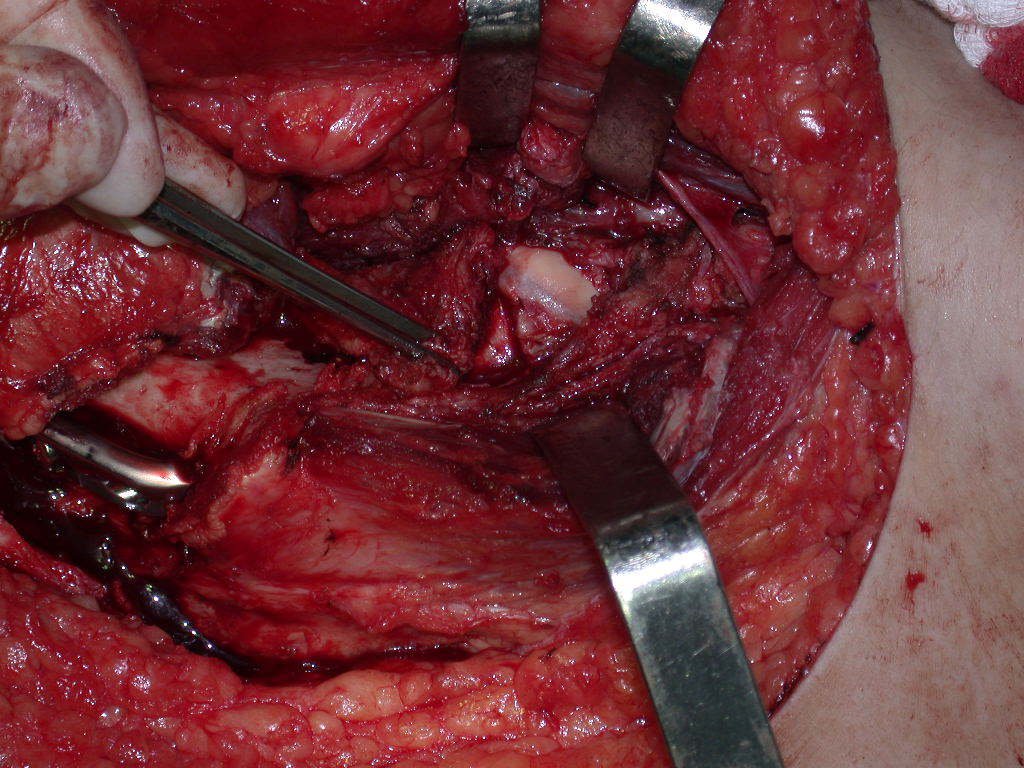
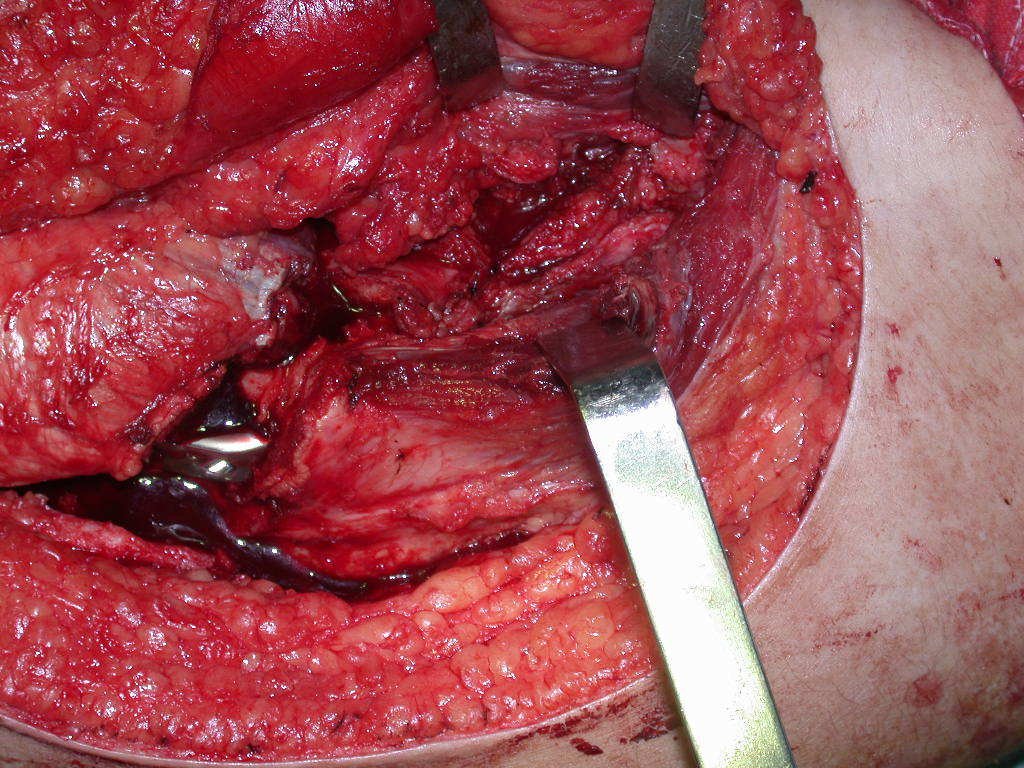
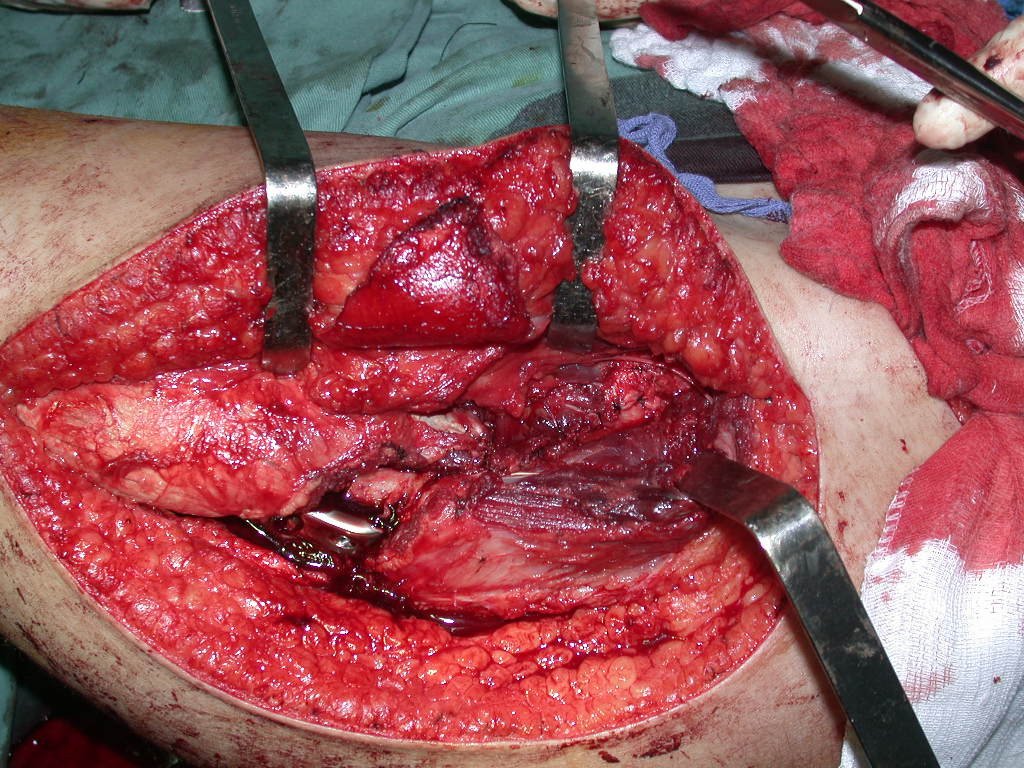
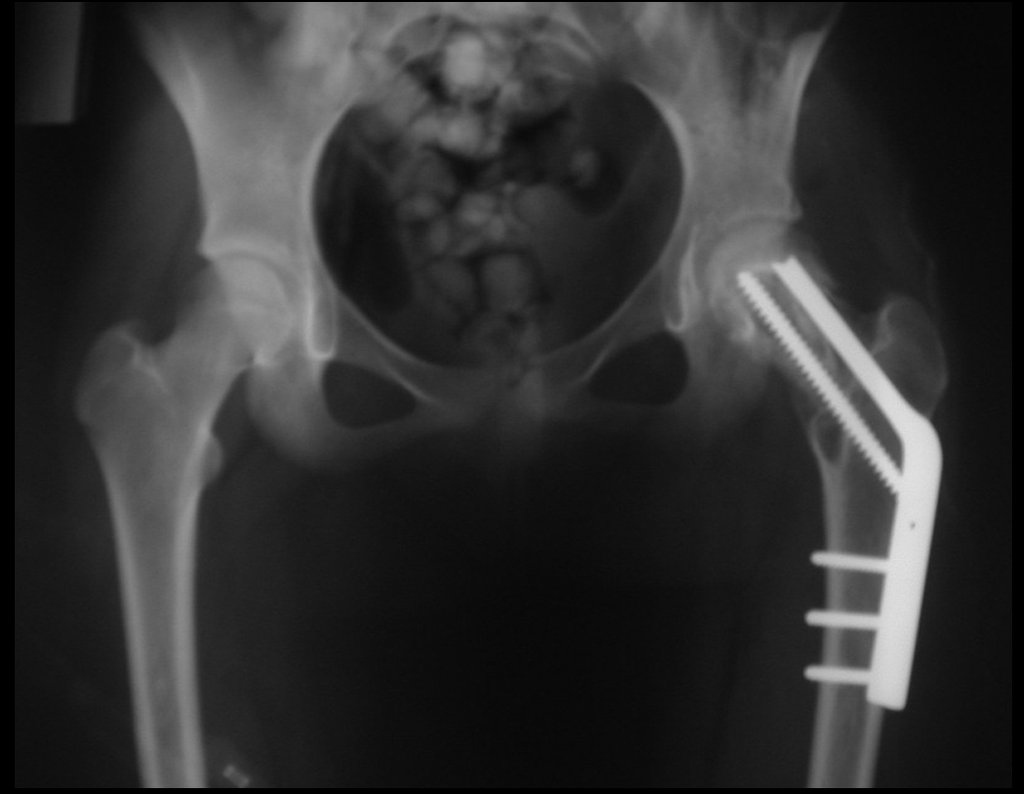
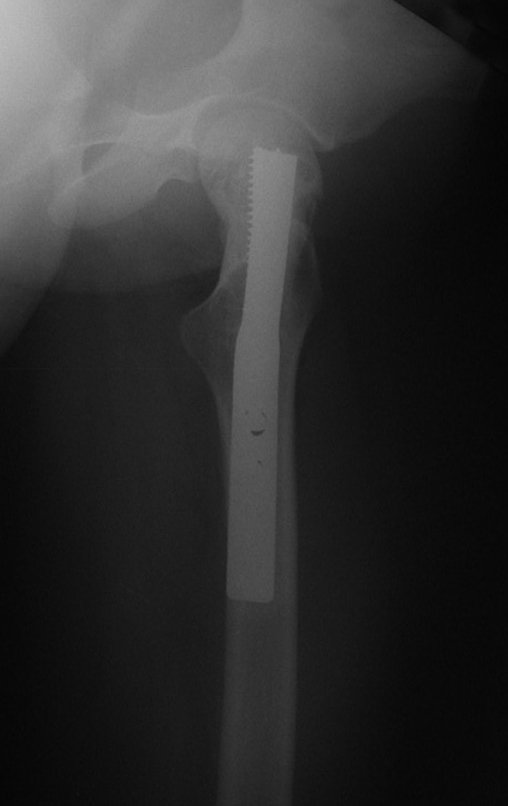
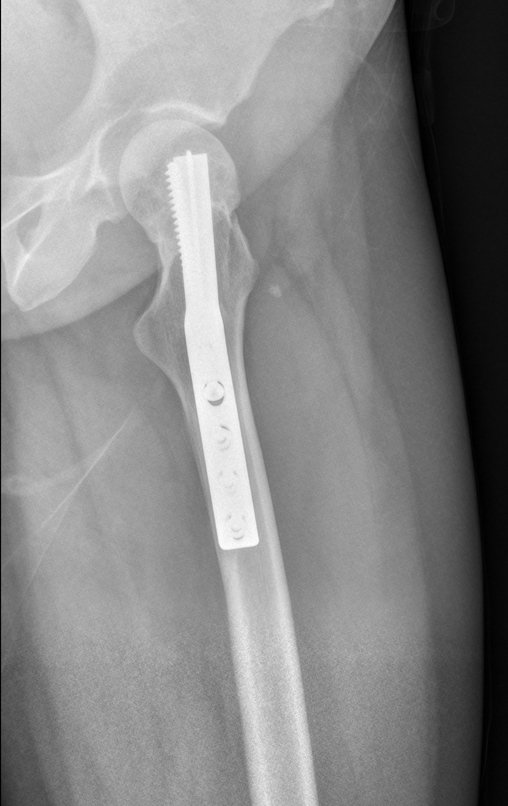
La mejor indicación para evitar la recurrencia local es la resección segmentaria. Sin embargo, debido a la localización articular del condroblastoma, es preferible proporcionar un acceso quirúrgico adecuado a cada región, como en este ejemplo que afecta a la región posteromedial de la cabeza femoral (fig. 11), para realizar un cuidadoso legrado intralesional, seguido de adyuvante local, como fenol, nitrógeno líquido o electrotermia (fig. 12), para posteriormente rellenar la cavidad con un injerto óseo autólogo, restaurando la anatomía de la región (fig. 13) y restableciendo la función (figs 14 y 15) .
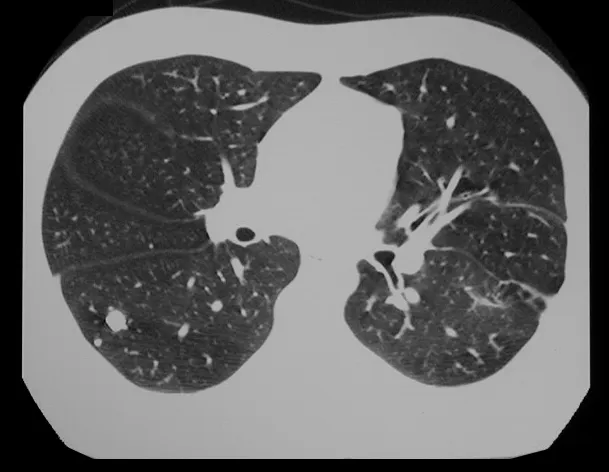
El condroblastoma, a pesar de ser una lesión benigna, además de la recurrencia local, puede evolucionar a metástasis pulmonares (fig. 16 y 17) que permanecen histológicamente benignas, lo que hace controvertida la indicación de quimioterapia adicional.
En nuestra experiencia tuvimos dos casos de osteoblastoma y un caso de condroblastoma con enfermedad pulmonar secundaria. En este caso de condroblastoma se realizó toracotomía y se encontraron numerosos nódulos pulmonares, que persisten hasta el día de hoy. Este paciente, en el momento del diagnóstico de metástasis, presentaba osteopatía pulmonar hipertrófica. No realizó ningún tratamiento complementario y se encuentra asintomático hasta el día de hoy, trece años después (fig. 18 y ’19) y quince años después de la cirugía (fig. 20 y 21).
Tumores óseos malignos:
Las neoplasias óseas malignas más frecuentes en la infancia son el osteosarcoma y el sarcoma de Ewing, que deben diagnosticarse al inicio de los síntomas, ya que provocan dolor y un tumor palpable y deben tratarse tempranamente.
Osteosarcoma –
En nuestro país no es raro que el osteosarcoma se presente con una fractura en el momento del diagnóstico (figs. 22 y 23).
Sarcoma de Ewing –
El sarcoma de Ewing es un tumor óseo maligno que puede confundirse con osteomielitis y diagnosticarse tras una fractura (figs. 30 a 36).
Haga clic aquí para ver el caso completo
En los niños, los casos de neoplasias malignas que provocan fracturas son, afortunadamente, raros.
Lesiones óseas pseudotumorosas:
Las lesiones óseas que con mayor frecuencia acompañan a las fracturas en niños son las lesiones pseudotumorales, con énfasis en los quistes óseos simples, quistes óseos aneurismáticos, displasia fibrosa y granulomas eosinofílicos, en este orden de frecuencia.
Granuloma eosinofílico –
El granuloma eosinofílico se presenta como una afección inflamatoria local y una lesión con rarefacción ósea acompañada de una reacción perióstica laminar espesa, que es una característica radiológica de benignidad. Otro aspecto del granuloma eosinofílico es que presenta una zona de enrarecimiento del hueso sin su correspondiente afectación extraósea (fig. 37), distinguiéndolo del sarcoma de Ewing, que es el tumor que más tempranamente presenta un tumor extracortical. .
El granuloma eosinofílico puede presentarse con un cuadro clínico de fractura cuando afecta la columna vertebral donde se produce una fractura en cuña del cuerpo vertebral, descrita como vértebra plana de Calvé (fig. 38). En esta situación, esta lesión puede progresar hasta la curación espontánea, pudiendo incluso producirse la restauración del cuerpo vertebral.
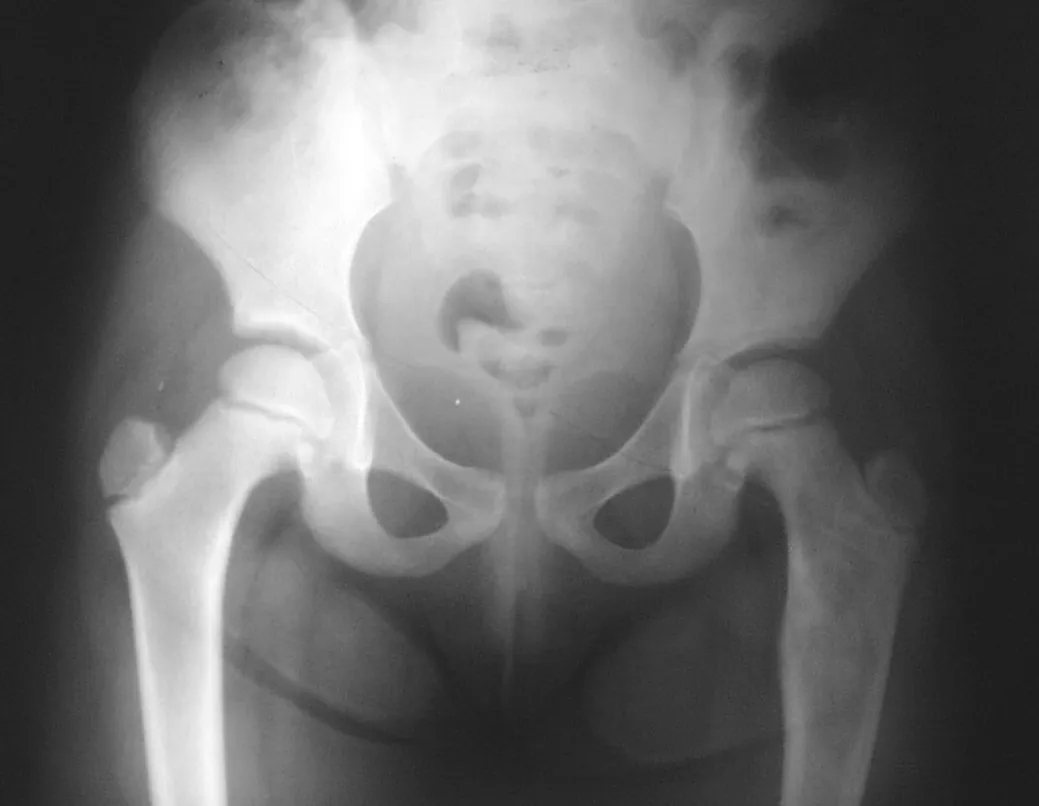
Otras localizaciones donde pueden producirse microfracturas son cuando afectan a la región supraacetabular (fig. 39), o en zonas de carga como la porción metafisaria proximal del fémur (fig. 40), debido a la erosión cortical medial. .
Esta lesión responde bien al tratamiento quirúrgico de legrado simple, siendo excepcional la necesidad de añadir un injerto óseo.
Displasia fibrosa –
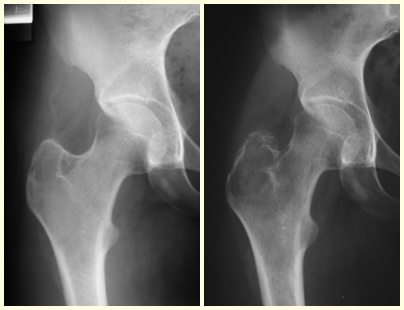
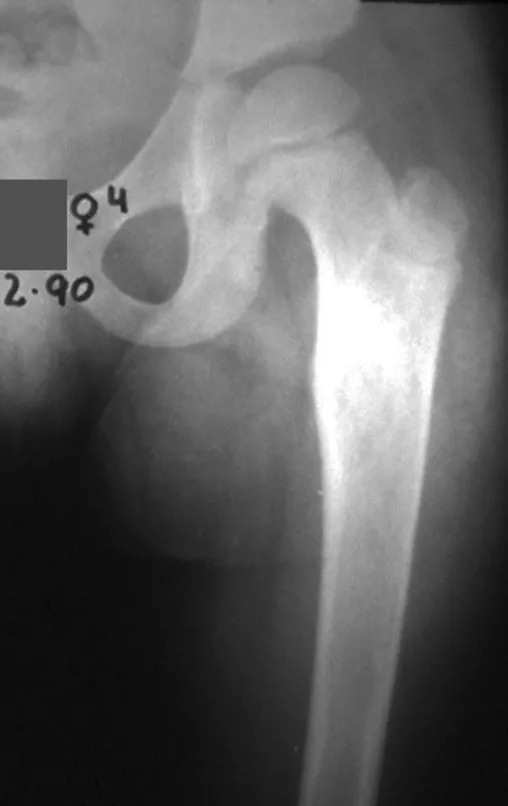
La displasia fibrosa es una lesión pseudotumoral que con mayor frecuencia conduce a deformidad ósea. Sin embargo, cuando afecta al fémur, puede provocar una deformidad previa, en forma de cayado de pastor, característica de esta patología, con la consiguiente fractura (fig. 41). La región del cuello femoral con displasia fibrosa a menudo desarrolla una fractura, incluso sin deformidad previa (fig. 42).
Para corregir el defecto es necesario raspar la lesión, rellenarla con injerto óseo autólogo y osteotomías correctoras de la deformidad (fig. 43). Una fractura en esta localización puede ser de difícil resolución, debido a la dificultad de consolidación por el aspecto displásico del hueso (fig. 44), provocando recurrencia de la enfermedad y deformidad.
La displasia fibrosa también puede formar parte de la pseudoartrosis congénita, que afecta con mayor frecuencia al tercio distal de la tibia, pero puede presentarse en otras localizaciones como el tercio proximal de la tibia (figuras 52, 53 y 54), con todas las dificultades para alcanzarla. si es consolidación.
La pseudoartrosis congénita es una afección que merece ser estudiada en un capítulo aparte.
Quiste óseo aneurismático –
El quiste óseo aneurismático, también llamado quiste hemático multilocular, es una lesión de rarefacción ósea insuflativa llena de líquido serosanguinolento, intercalada con espacios de tamaño variable y separada por septos de tejido conectivo que contienen trabéculas de tejido óseo o osteoide y células gigantes ostoclásticas (figs. 55 y 56).
El paciente generalmente presenta dolor leve en el sitio de la lesión, cuando el hueso afectado es superficial, y se pueden observar signos inflamatorios como aumento de volumen y calor. Generalmente, el paciente correlaciona la aparición de los síntomas con algún trauma.
En la evolución puede haber un aumento lento, progresivo o rápidamente expansivo. Afecta a cualquier hueso, con mayor frecuencia a los miembros inferiores, tibia (figs. 57 y 58) y fémur representando el 35% de los casos.
Las vértebras también se ven afectadas por esta lesión, incluido el sacro. En la pelvis, la rama iliopúbica es la más frecuentemente afectada. Pueden imitar síntomas articulares cuando llegan a la epífisis. El compromiso en la columna puede provocar síntomas neurológicos compresivos, aunque en la mayoría de los casos afecta a las estructuras posteriores.
El tratamiento de elección ha sido la resección marginal o legrado intralesional, seguido de relleno de la cavidad con injerto autólogo u homólogo, cuando sea necesario. La cavidad también se puede rellenar con metilmetacrilato, aunque preferimos utilizar un injerto autólogo cuando sea posible, al tratarse de una lesión benigna. Algunos autores asocian el tratamiento adyuvante intralesional con la aplicación de fenol, electrotermia o crioterapia. En los quistes óseos aneurismáticos clásicos, no veo el sentido de esta terapia, que, sin embargo, debería aplicarse cuando el cirujano encuentra un área “sospechosa” que no fue detectada en las imágenes. Si se trata de tumores benignos antes mencionados, que pueden acompañarse de áreas de quiste óseo aneurismático, la terapia adyuvante local será beneficiosa.
Algunos segmentos óseos como los extremos del peroné, clavícula, costilla, tercio distal del cúbito, radio proximal, etc. se pueden resecar, sin necesidad de reconstrucción.
En otras situaciones podemos necesitar reconstrucciones segmentarias con injertos óseos libres o incluso vascularizados o reconstrucciones articulares con prótesis en casos avanzados con afectación articular importante. En la columna, tras la resección de la lesión, puede ser necesaria una artrodesis para evitar la inestabilidad.
La radioterapia debe evitarse por el riesgo de malignidad, sin embargo puede estar indicada para el control evolutivo de lesiones en localizaciones de difícil acceso, como la columna cervical, por ejemplo, u otras situaciones en las que no se recomienda la reintervención quirúrgica.
La embolización como terapia aislada es controvertida. Sin embargo, se puede utilizar antes de la operación para minimizar el sangrado durante la cirugía. Esta práctica es más utilizada en casos de difícil acceso, aunque no siempre se consigue su eficacia. En casos aislados se ha descrito infiltración con calcitonina con resultados satisfactorios.
Puede ocurrir una recurrencia, ya que se desconoce el fenómeno que causó el quiste y no podemos garantizar que la cirugía lo haya reparado. La tasa de recurrencia puede alcanzar el treinta por ciento de los casos.
Quiste óseo simple –
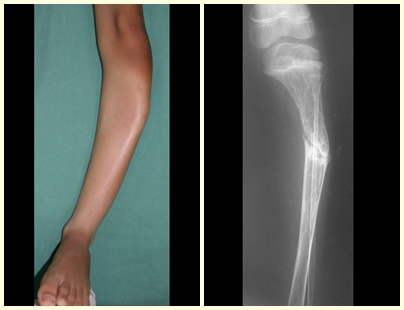
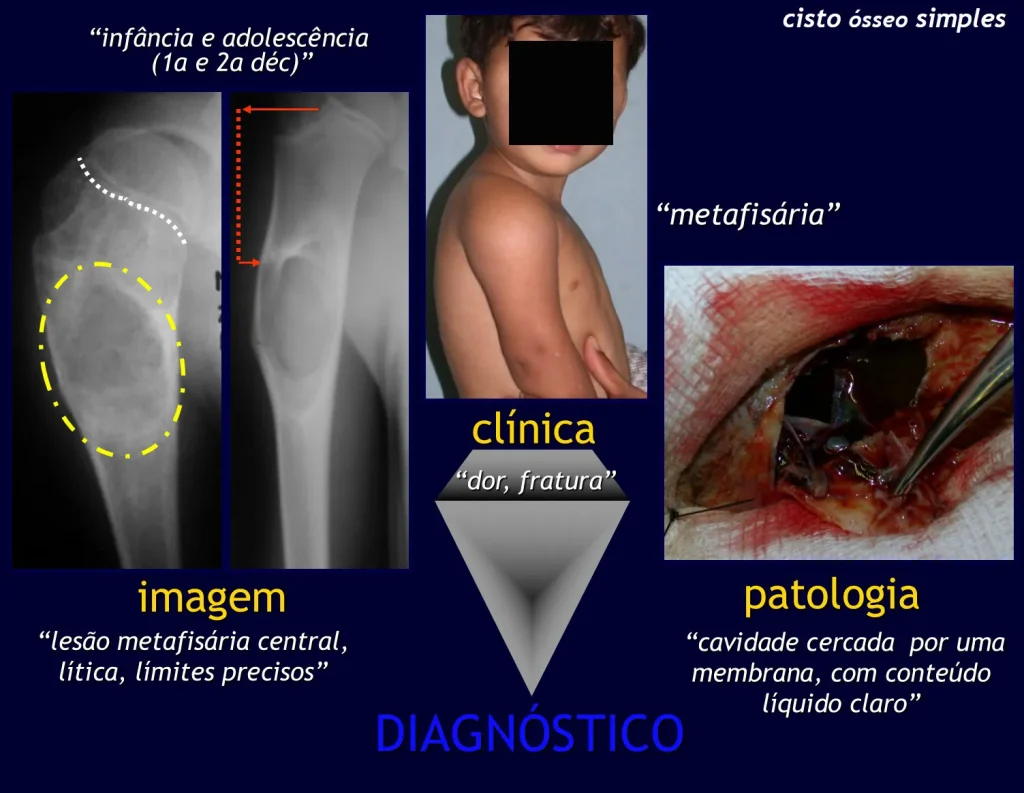
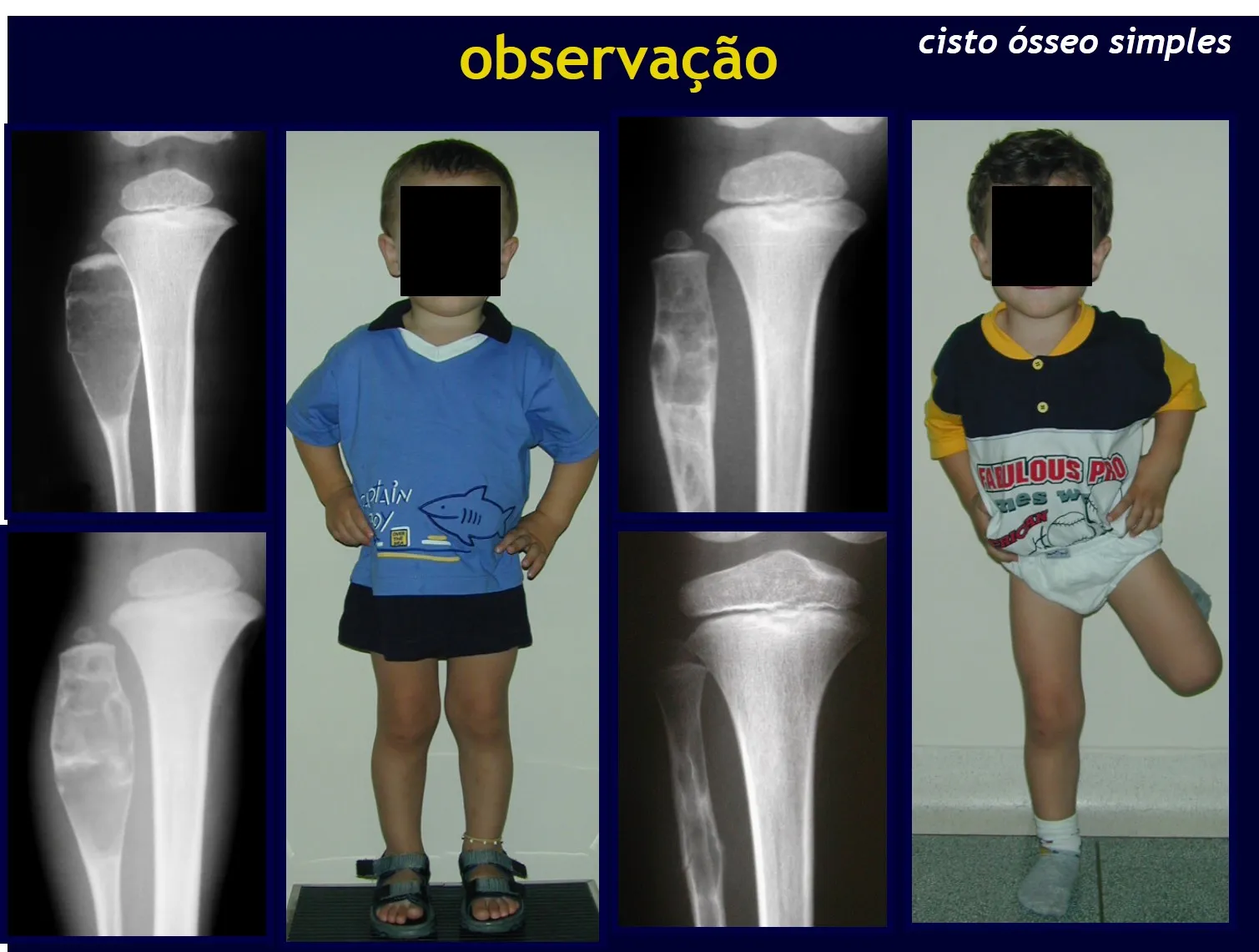
Un quiste óseo simple es una lesión pseudotumoral que puede ocurrir en cualquier parte del esqueleto y que con mayor frecuencia se presenta con fractura (figuras 59 a 64).
Un quiste óseo simple en ocasiones puede diagnosticarse por un aumento de volumen, pero cuando presenta un síntoma doloroso, generalmente se relaciona con microfracturas o muchas veces con una fractura completa.
El húmero es el hueso más afectado. Las microfracturas pueden eventualmente proporcionar una “cura” parcial en algunas áreas del quiste y con el crecimiento la metáfisis se aleja de la lesión, que comienza a ocupar la zona diafisaria (fig. 65 y 66). Esta progresión hacia la diáfisis puede ocurrir de forma asintomática y puede ocurrir de forma aguda una nueva manifestación clínica dolorosa (fig. 67).
En estas situaciones, el tratamiento adoptado debe ser el adecuado al hueso y a la fractura en cuestión, pudiendo ser cerrado o abierto, dependiendo únicamente de las necesidades específicas de la fractura la indicación de relleno con injerto óseo, cuando esté indicado el tratamiento quirúrgico. .
En los quistes óseos maduros, la fractura completa provoca una gran descompresión de la lesión y se puede conseguir simultáneamente la consolidación y curación de la lesión. Sin embargo, en algunos casos, es necesario un tratamiento adicional del quiste, después de la consolidación de la fractura, cuando se elige el tratamiento cerrado (fig. 72 a 78).
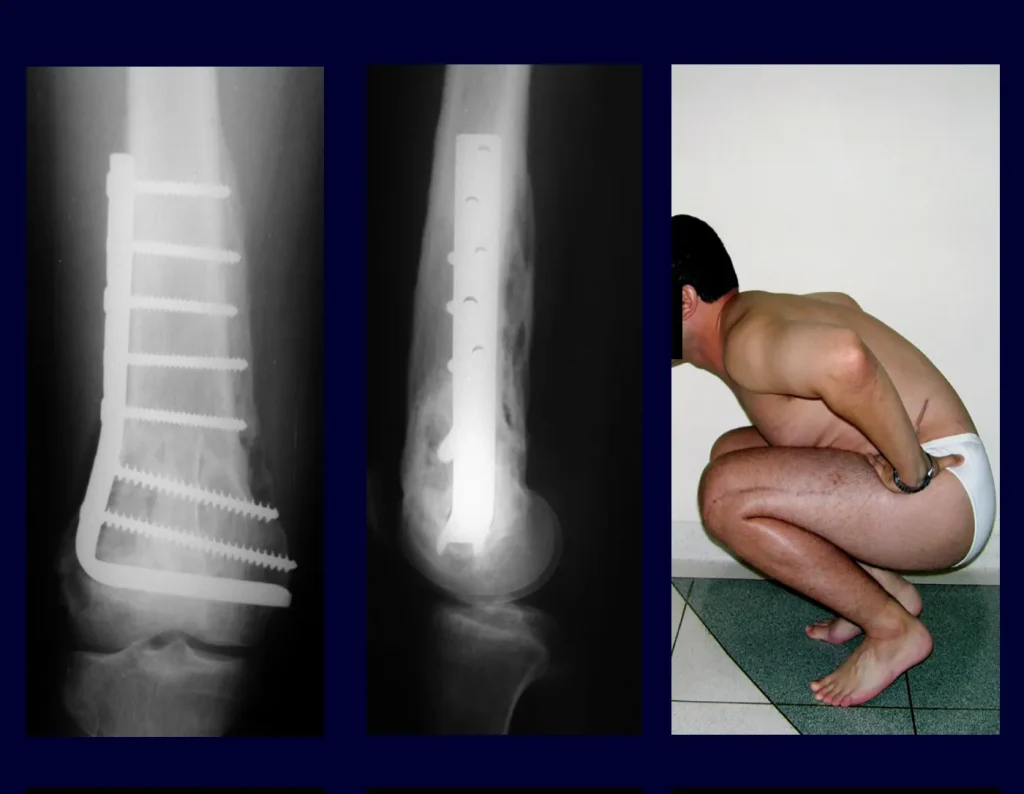
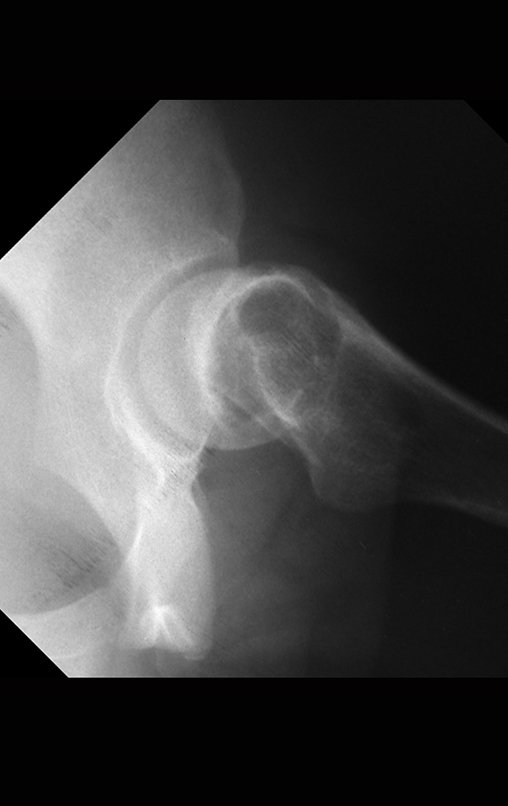
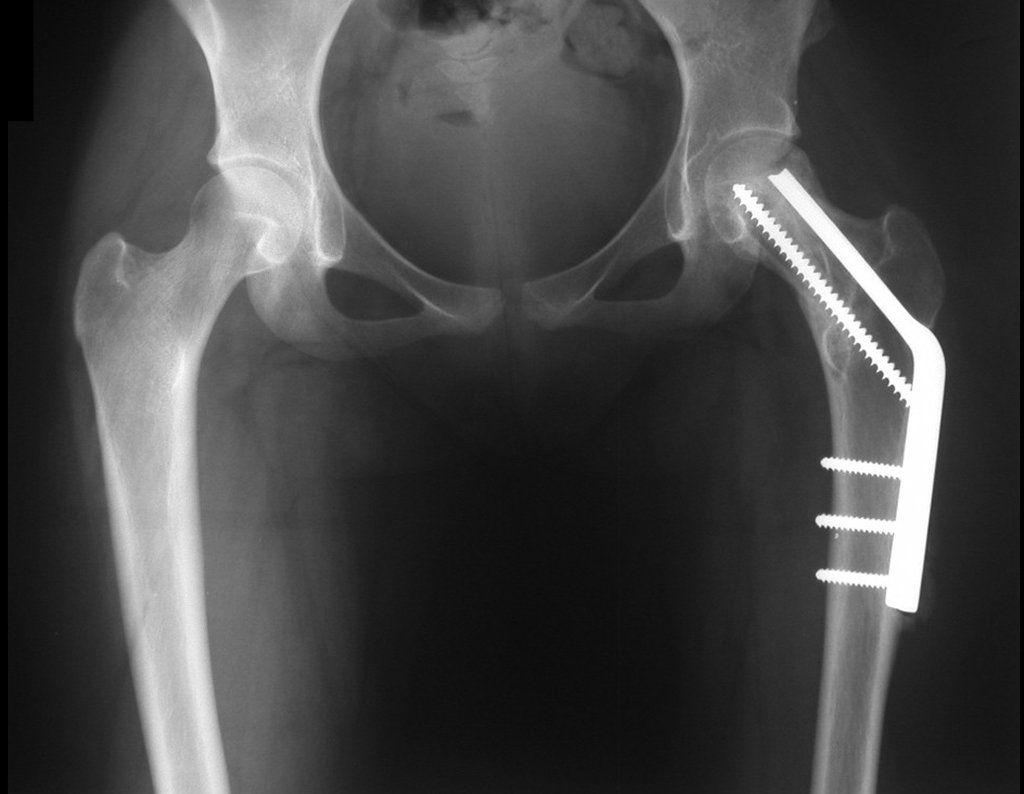
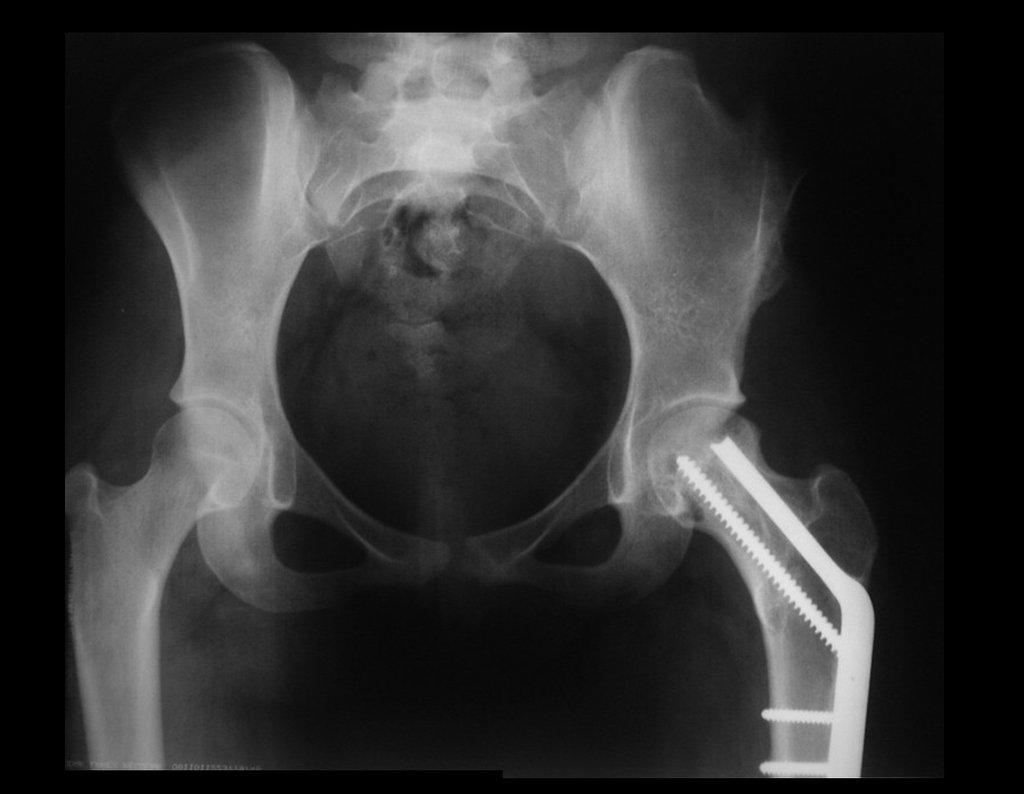
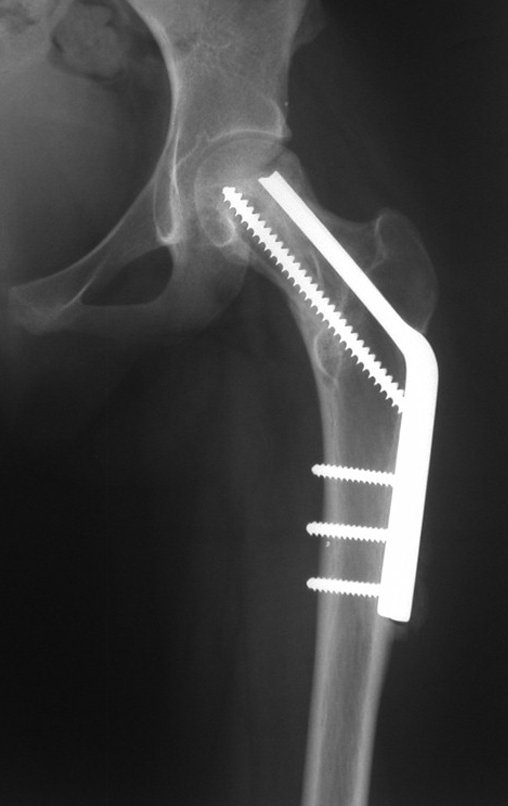
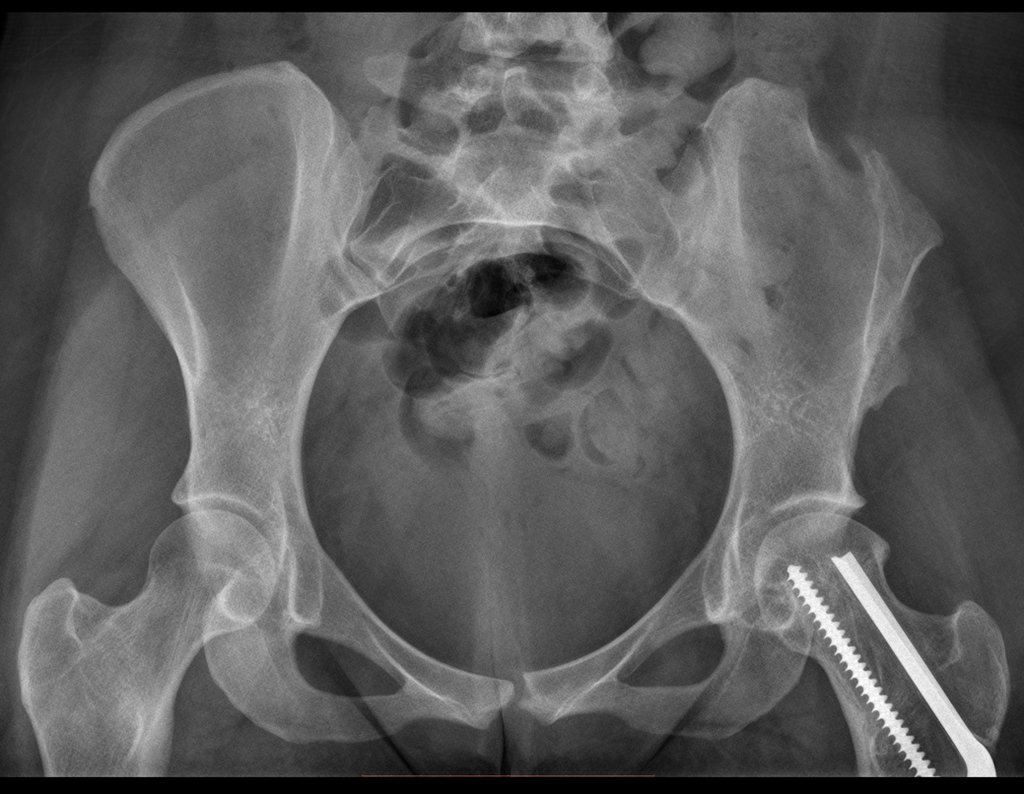
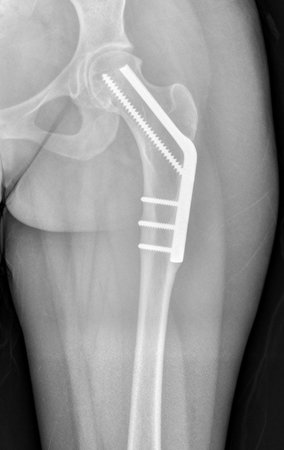
Algunas localizaciones, como el cuello femoral, merecen especial atención y preferiblemente deben operarse antes de que se produzca una fractura (fig. 87 y 88).
Haga clic aquí para ver el caso completo
Fractura por estrés –
Las fracturas por estrés merecen especial atención en este artículo tanto por ser más frecuentes de lo reportado en la literatura, ya que muchos casos pasan desapercibidos, como por el aspecto florido que presentan los estudios de imagen, dificultando el diagnóstico diferencial.
El niño se queja de dolor, normalmente tras el esfuerzo físico, que al ser leve acaba resolviendo espontáneamente.
Sin embargo, se puede consultar a un ortopedista y, al solicitar una radiografía, sorprenderse con una reacción perióstica en la región metafisaria en un paciente en crecimiento.
La preocupación por la posibilidad de osteomielitis, granuloma eosinofílico, osteosarcoma o sarcoma de Ewing está justificada, pero es necesario tener en cuenta aspectos clínicos, como tiempo de evolución, factores de mejoría, apariencia local, para no complicar este diagnóstico, que es clínico .
Es necesario evaluar y preguntarse: ¿ en el tiempo que llevó realizar estas pruebas no hubo mejoría clínica?
La resonancia magnética es un examen que debe interpretarse con mucho cuidado, ya que la fractura provoca un edema intra y extraóseo que puede asustar a las personas menos experimentadas.
Debemos observar el detalle de los dos puntos de baja señal del callo de fractura en la corteza lateral y medial en la figura 100 así como el punto de baja señal del callo óseo en la corteza posterior en la figura 101.
El proceso inflamatorio de la fractura, con marcada hemorragia y edema, es extenso. La histología del callo de fractura puede simular un osteosarcoma. Se conoce un caso de amputación por diagnóstico erróneo de osteosarcoma en un paciente con fractura por estrés.
La observación durante dos o tres semanas es fundamental para un diagnóstico preciso y no se considera una mala práctica, ni siquiera en el caso de neoplasias. La radiografía tomada tres semanas después mostró la fractura por estrés (fig. 102 y 103) y el cuadro clínico con mejoría de los síntomas y reducción del edema reafirma el diagnóstico. La clínica es soberana.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
Quiste óseo simple
1. Definición
Cavidad unicameral llena de líquido claro o sanguinolento y limitada por una membrana de espesor variable, con tejido conectivo vascularizado que muestra células gigantes osteoclásticas y algunas zonas con hemorragia reciente o antigua o fisuras con contenido rico en colesterol (OMS)
Quiste óseo simple
2. Incidencia
En nuestra clínica de tumores musculoesqueléticos observamos un predominio de casos en el grupo de edad entre 5 y 15 años, con un ligero predominio de casos en el sexo masculino, y la mayoría afectando la región metafisaria proximal del húmero y fémur. La gran mayoría son remitidos debido a un episodio de fractura provocado por un traumatismo en el sitio de la lesión o como hallazgo radiológico durante una eventual radiografía tomada por algún traumatismo sufrido por el paciente.
3. Etiología
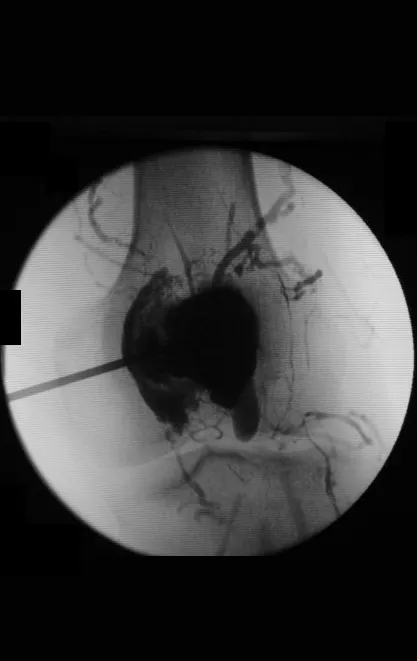
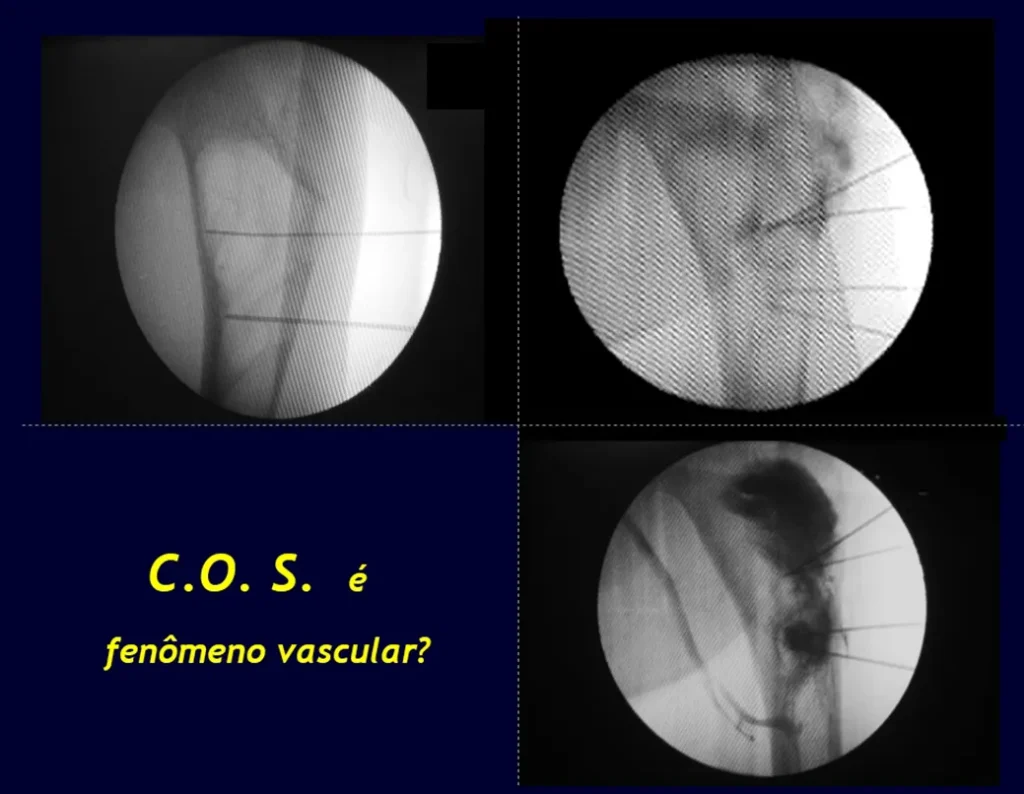
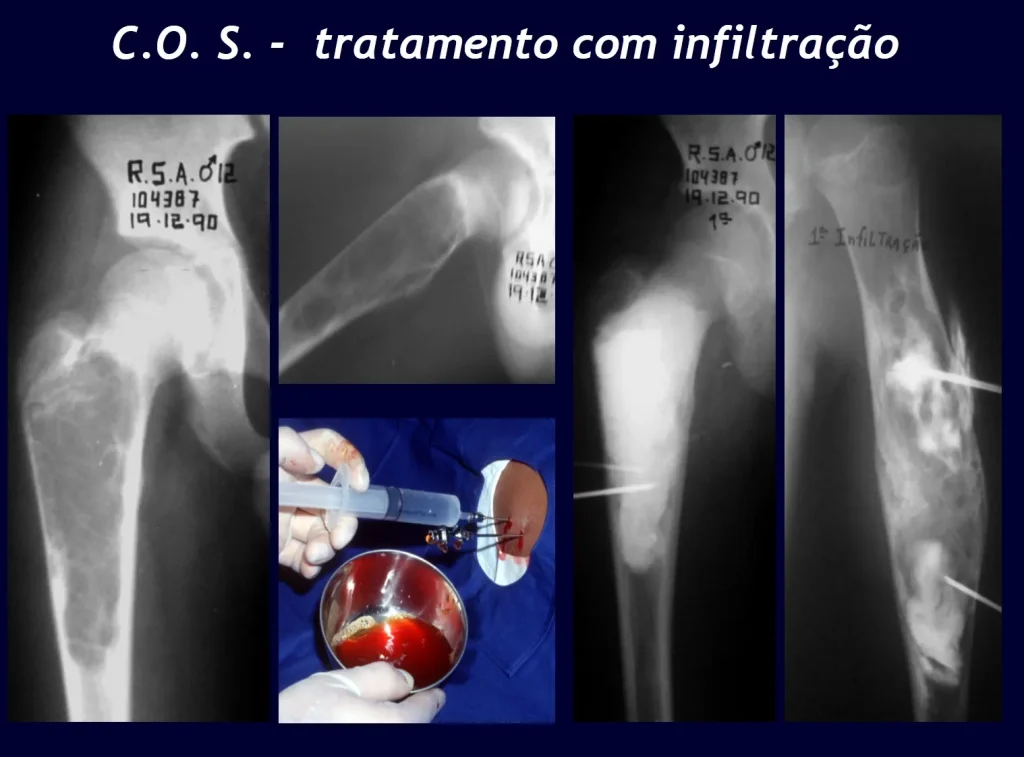
Aunque su reconocimiento desde el punto de vista radiológico es sencillo, su etiología aún es desconocida. Nuestra hipótesis es que se trata de un fenómeno vascular. En varios casos cuando se tratan con infiltración inyectamos contraste y observamos la existencia de fístulas vasculares asociadas a la persistencia de la lesión, figuras 1 a 3 y vídeo 1.
4. Evaluación clínica
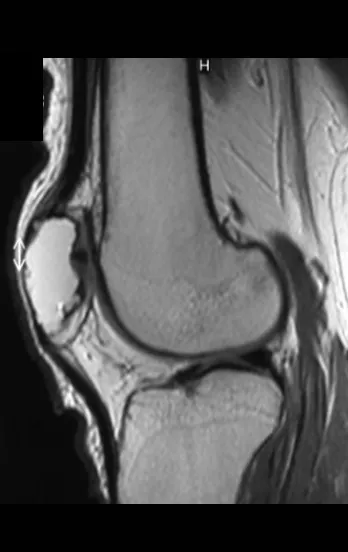
La mayoría de los pacientes se presentan asintomáticamente y las fracturas suelen ser el motivo de su primera consulta con un ortopedista. Algunos pacientes refieren episodios esporádicos de dolor o limitación funcional antes de que se diagnostique la presencia de un quiste óseo. La figura 4 ilustra sus características.
5. Características radiográficas
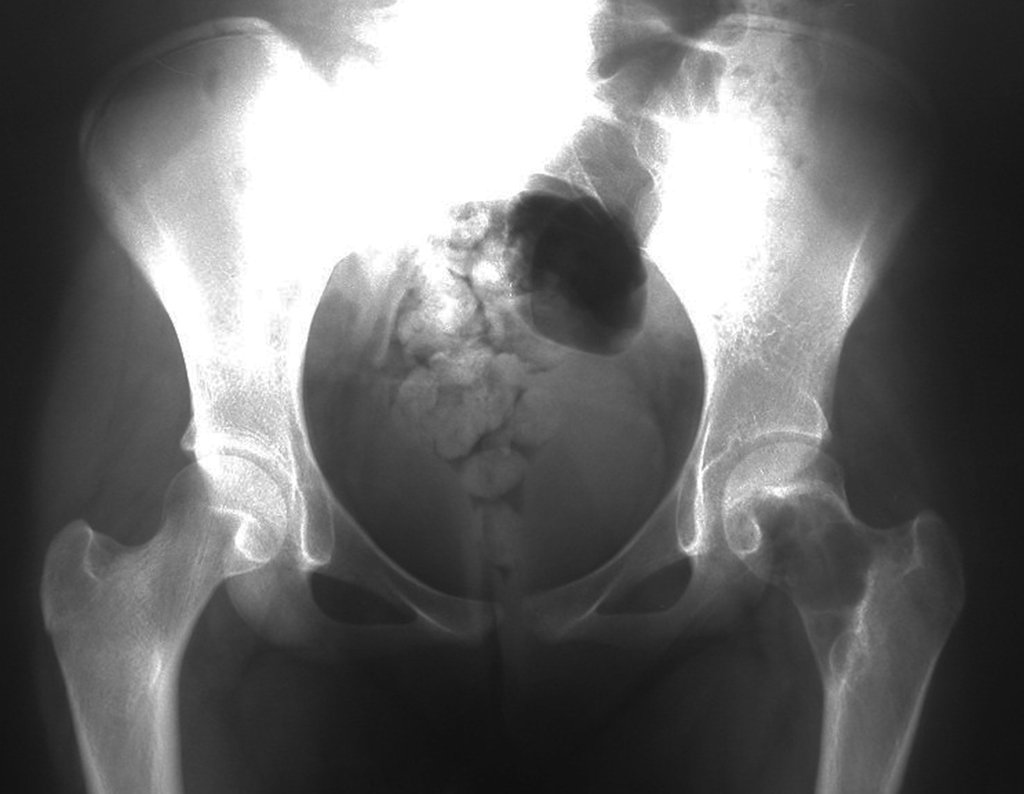
El Quiste Óseo Simple se presenta como una lesión radiotransparente en la región metafisaria de los huesos largos, de localización central, principalmente en la región proximal del húmero y fémur y cercana a la línea epifisaria. Son lesiones bien definidas, con bordes escleróticos, que rara vez traspasan los límites de la corteza o los límites del hueso, expandiéndose, adelgazando la corteza, pero casi nunca rompiéndola. En algunos casos se puede observar el signo del “fragmento caído”, que representa fragmentos de la pared cortical sueltos dentro del quiste.
6. Diagnóstico diferencial
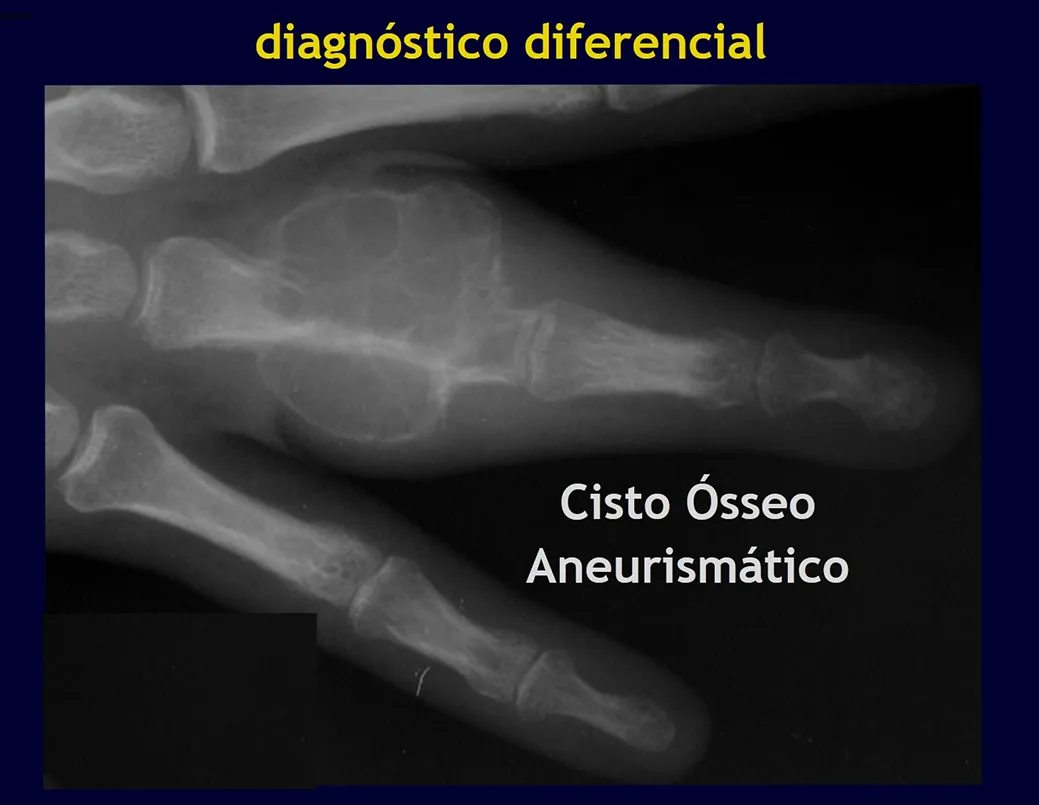
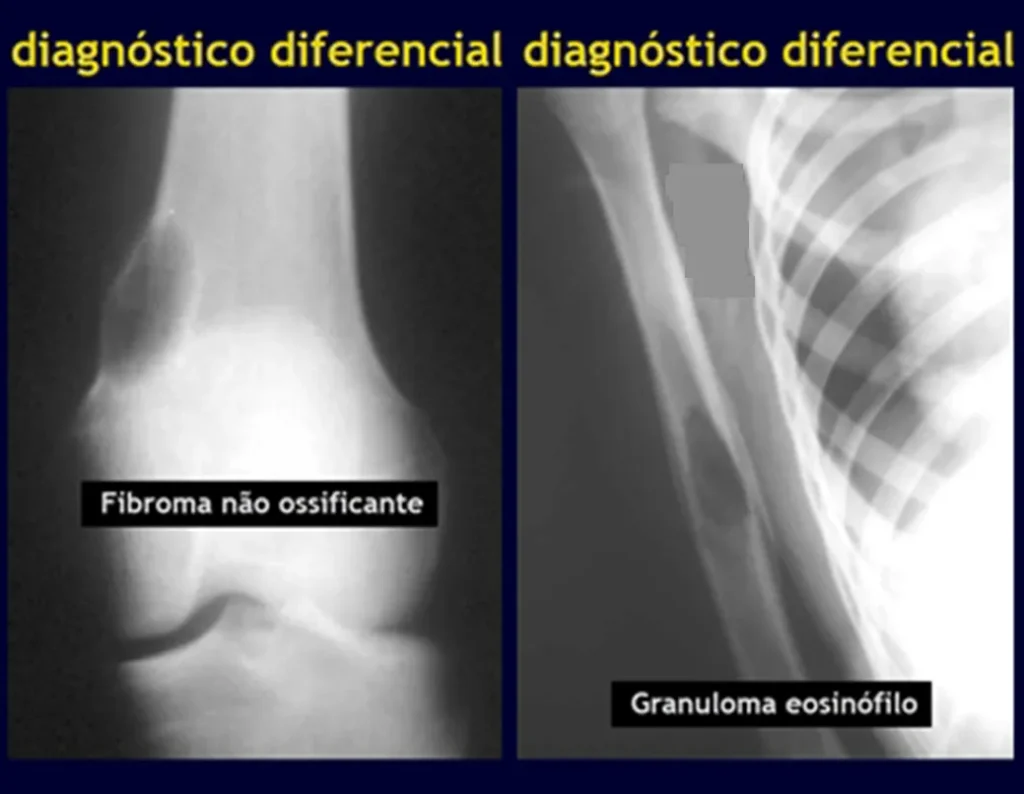
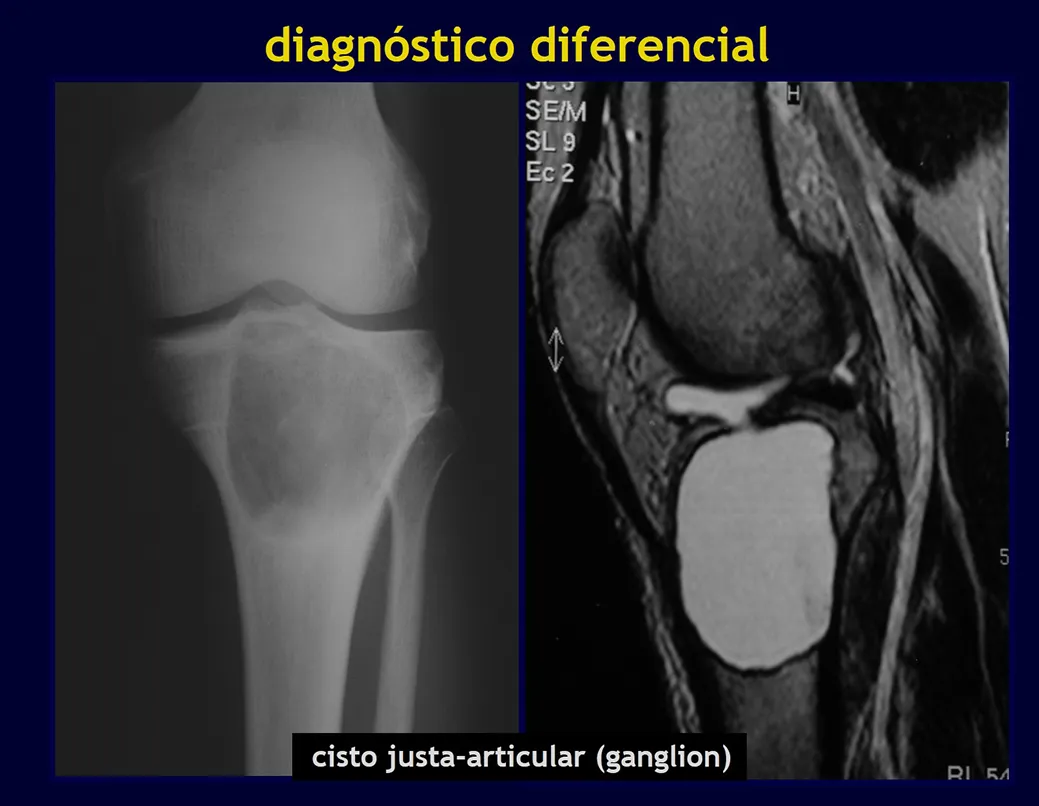
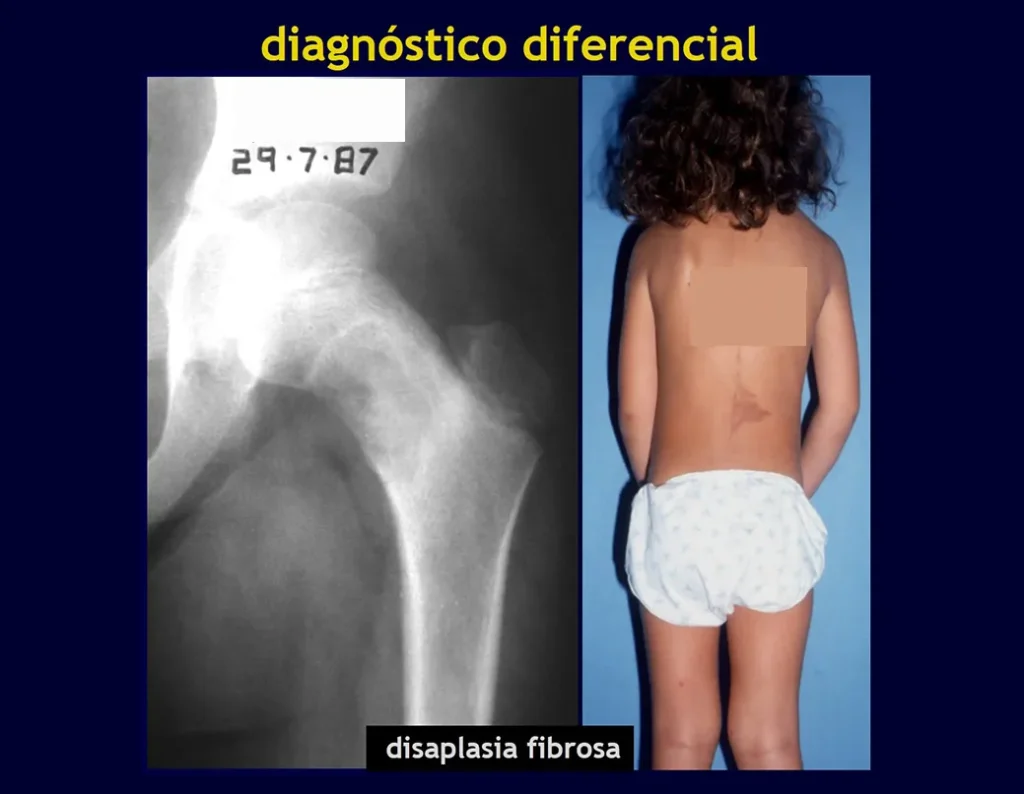
Los principales diagnósticos diferenciales son quiste óseo aneurismático, defecto fibroso cortical/fibroma no osificante, granuloma eosinofílico, quiste óseo yuxtaarticular, displasia fibrosa, entre otros, figuras 5 a 11.
7. Tratamiento
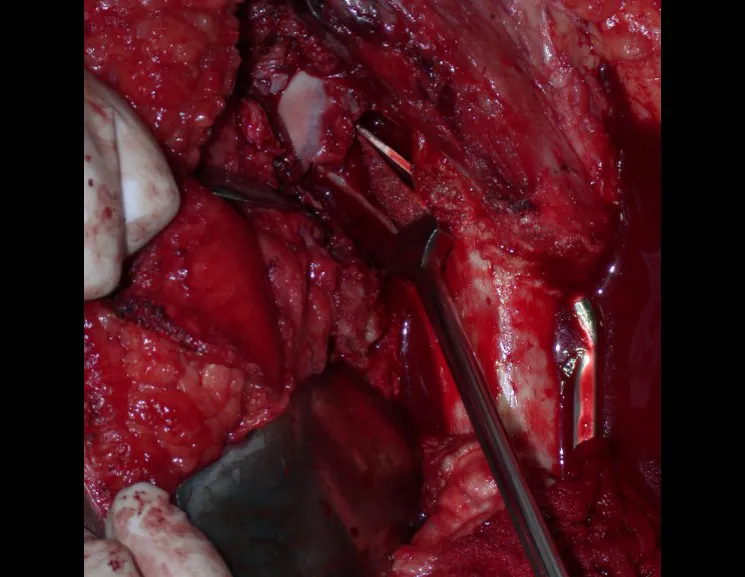
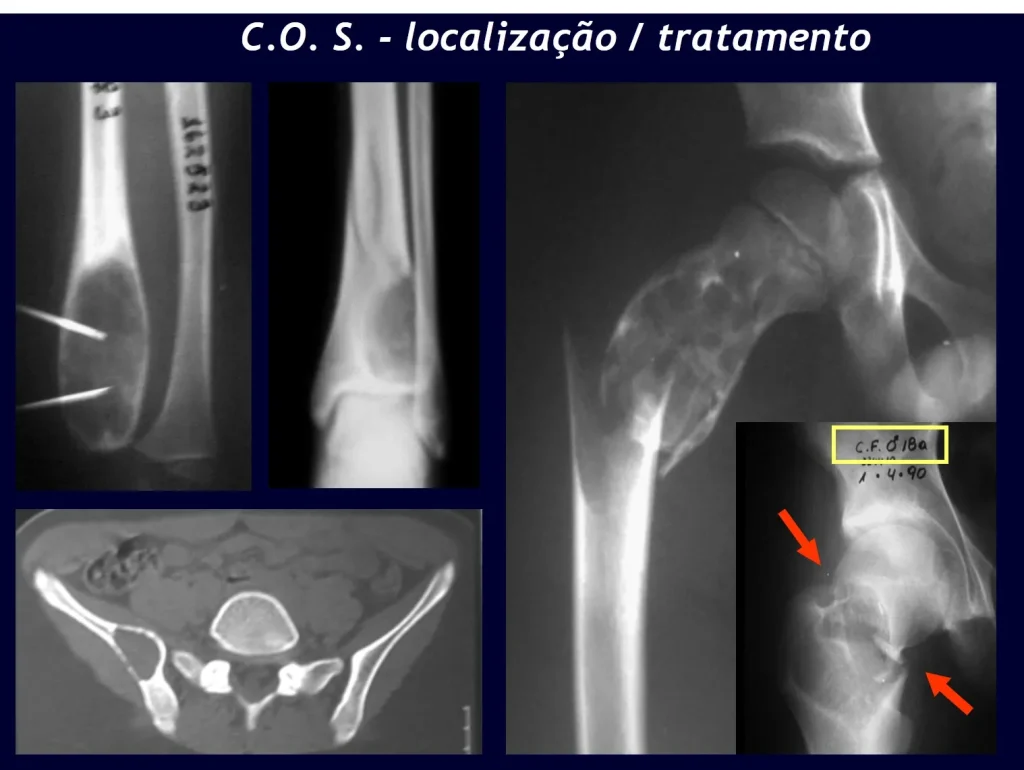
El tratamiento de COS depende de su localización y tamaño, en la gran mayoría de los casos puede ser conservador y no quirúrgico. En general, el tratamiento del miembro superior es menos quirúrgico y más conservador, mientras que el tratamiento del miembro inferior tiende a ser más quirúrgico, en un intento de evitar una fractura. El tratamiento clásico consiste en infiltraciones con corticoides (depomedrol), observando si se forma o no contenido óseo en su interior. Si hay una fractura inminente en un hueso de carga, debemos considerar seriamente la posibilidad de un tratamiento intralesional rellenando la cavidad con un injerto autólogo, preferiblemente, figuras 12 a 34.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
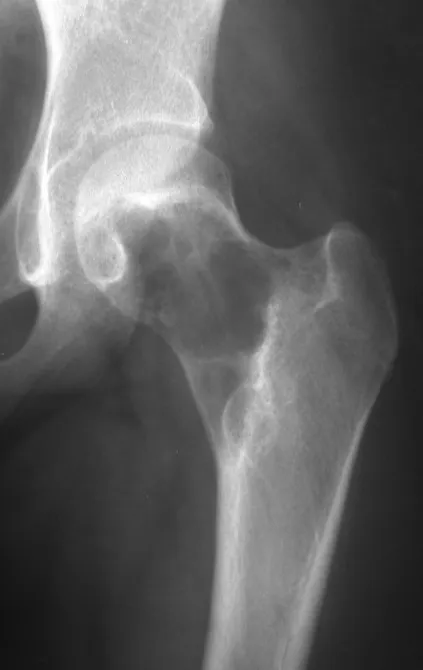
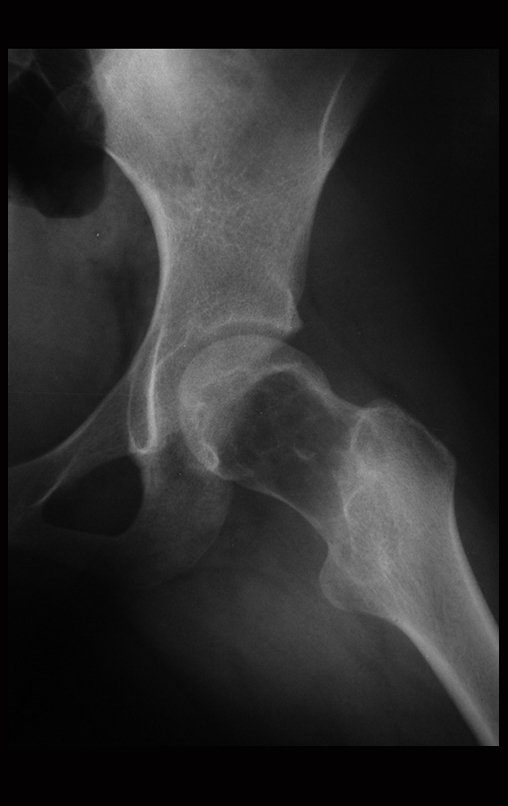
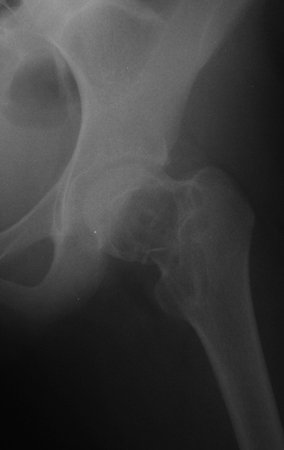
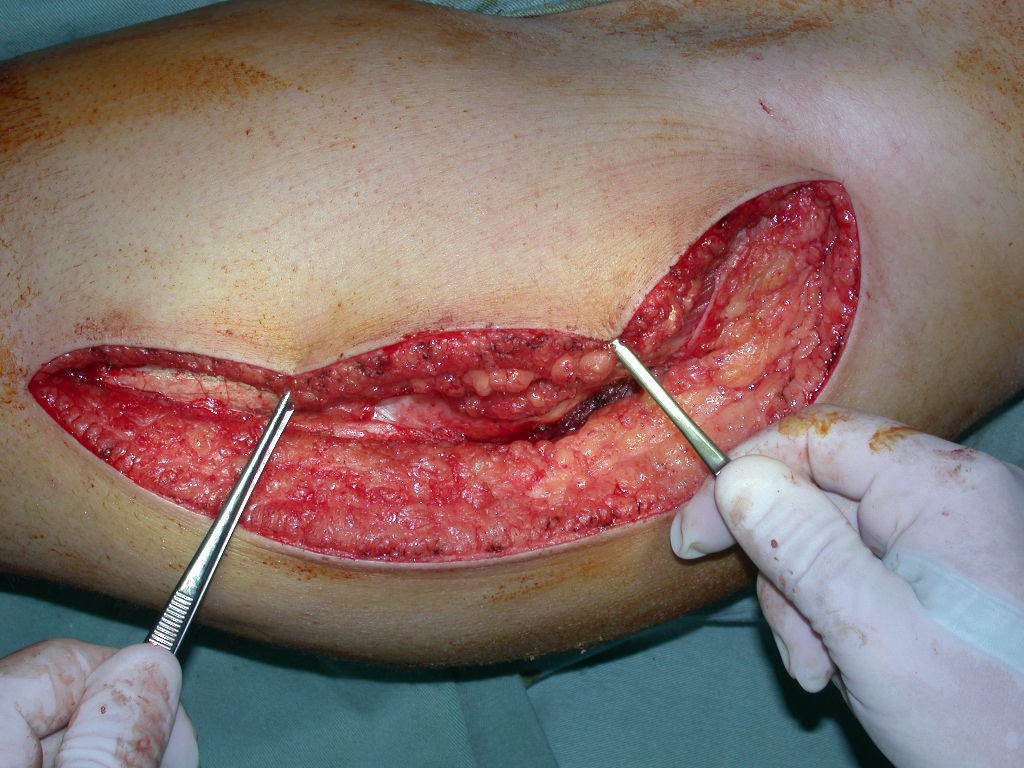
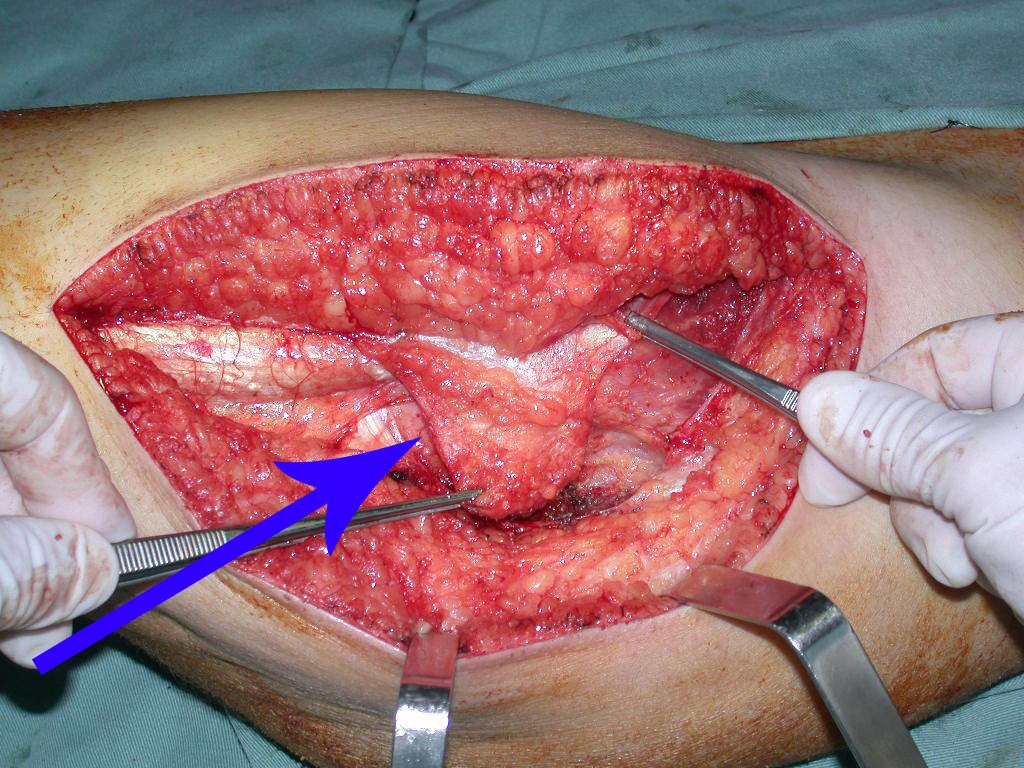
Reconstrucción de lesión de cuello femoral con fractura; Vía de acceso y placa especial con injerto autólogo; Quiste óseo del cuello femoral con fractura en un niño.
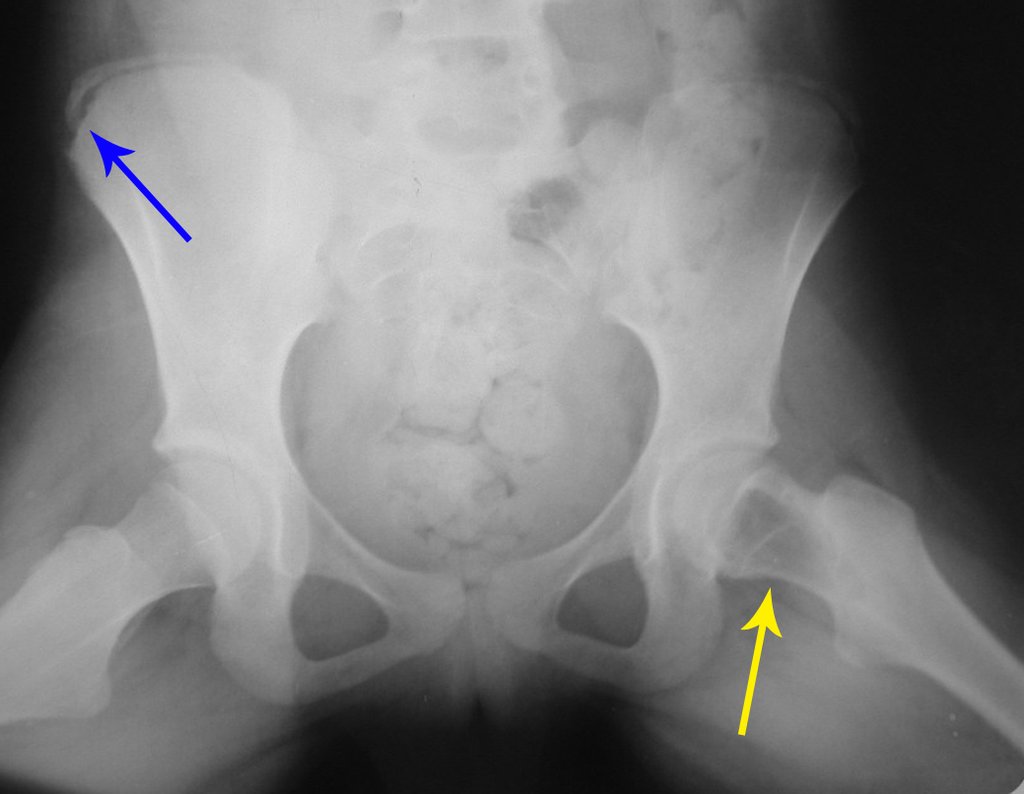
En la radiografía de esa ocasión se pudo observar una lesión de rarefacción ósea en el cuello femoral, que no se notó. La queja fue interpretada como dolores de crecimiento y el paciente fue seguido durante tres años.
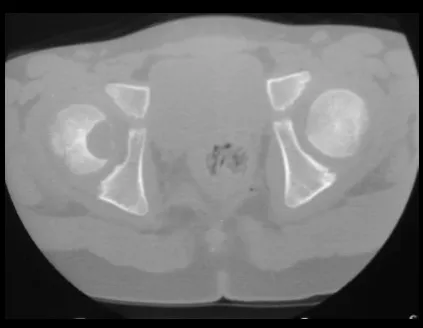
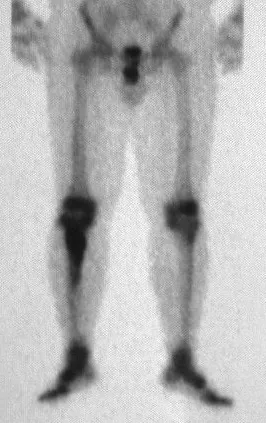
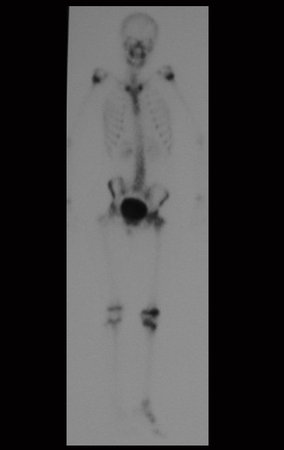
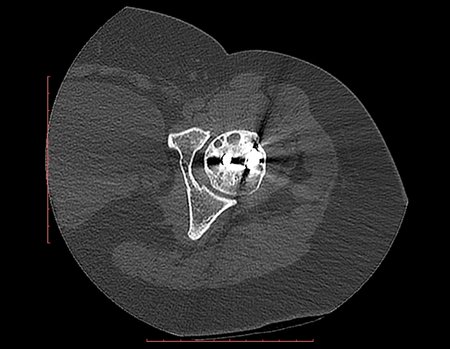
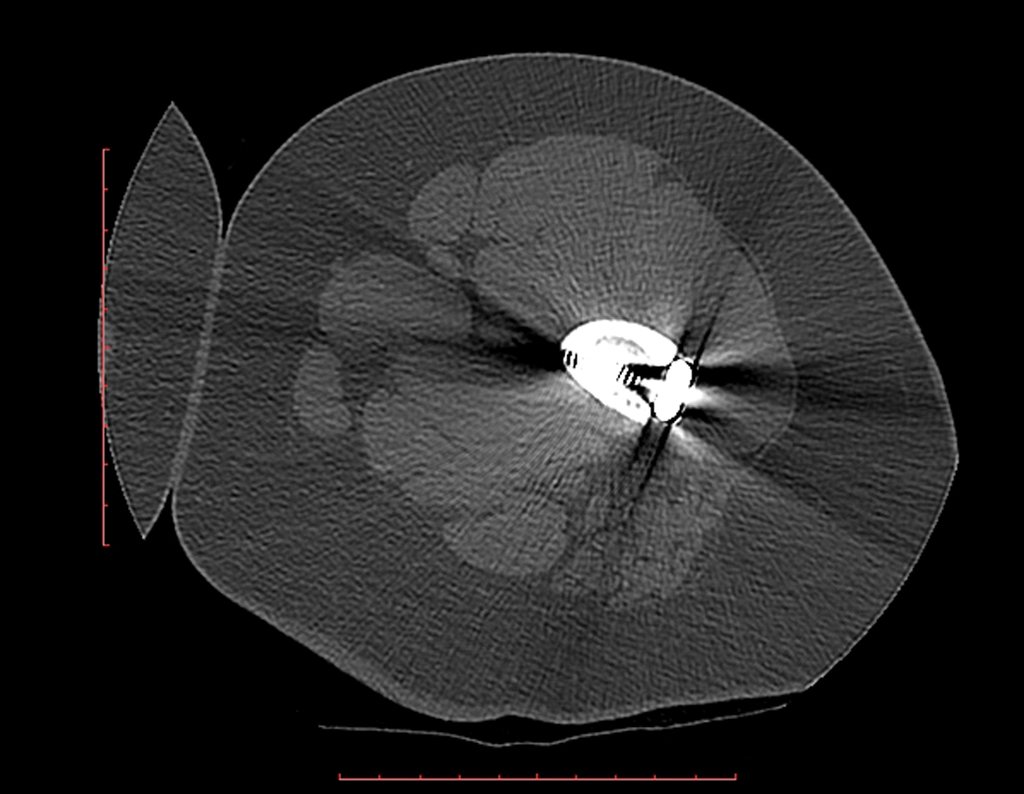
A mediados de 2004, el médico que la acompañaba pidió a otro colega que evaluara la radiografía de la paciente, en una reunión en el pasillo del hospital. Ambos no ven la lesión y creen que podría tratarse de una “inclinación de pelvis”, debido a la probable discrepancia de los miembros y optan por solicitar un escanografía de los miembros inferiores, figuras 2 a 4.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com