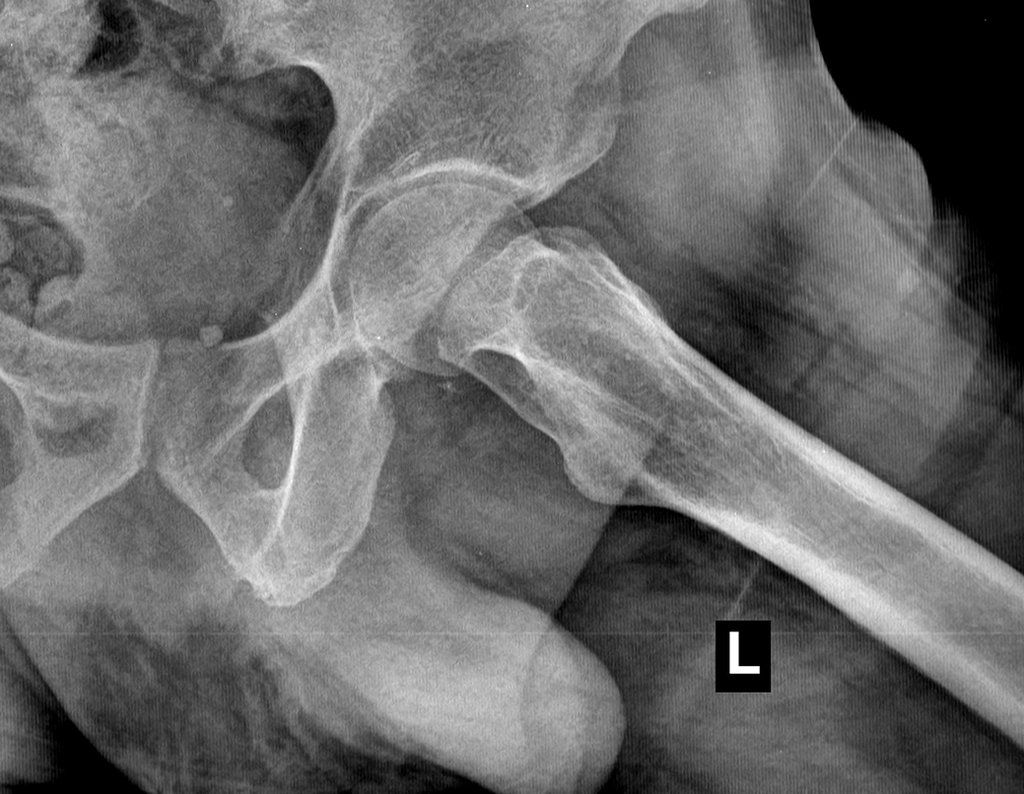
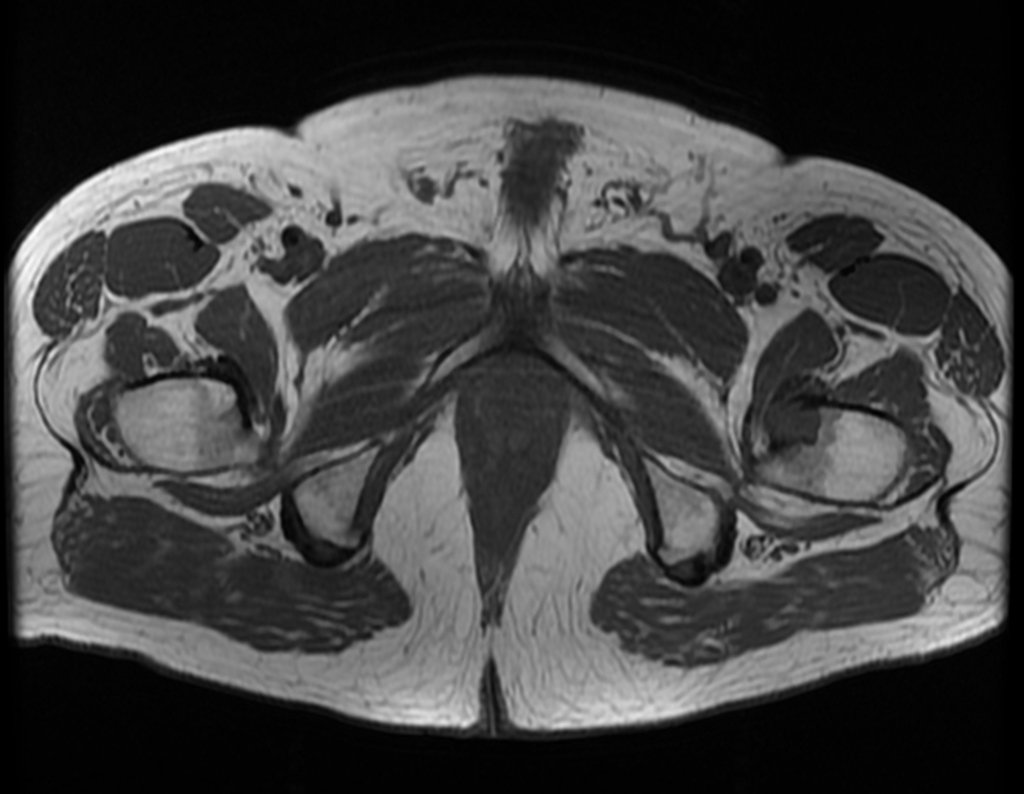
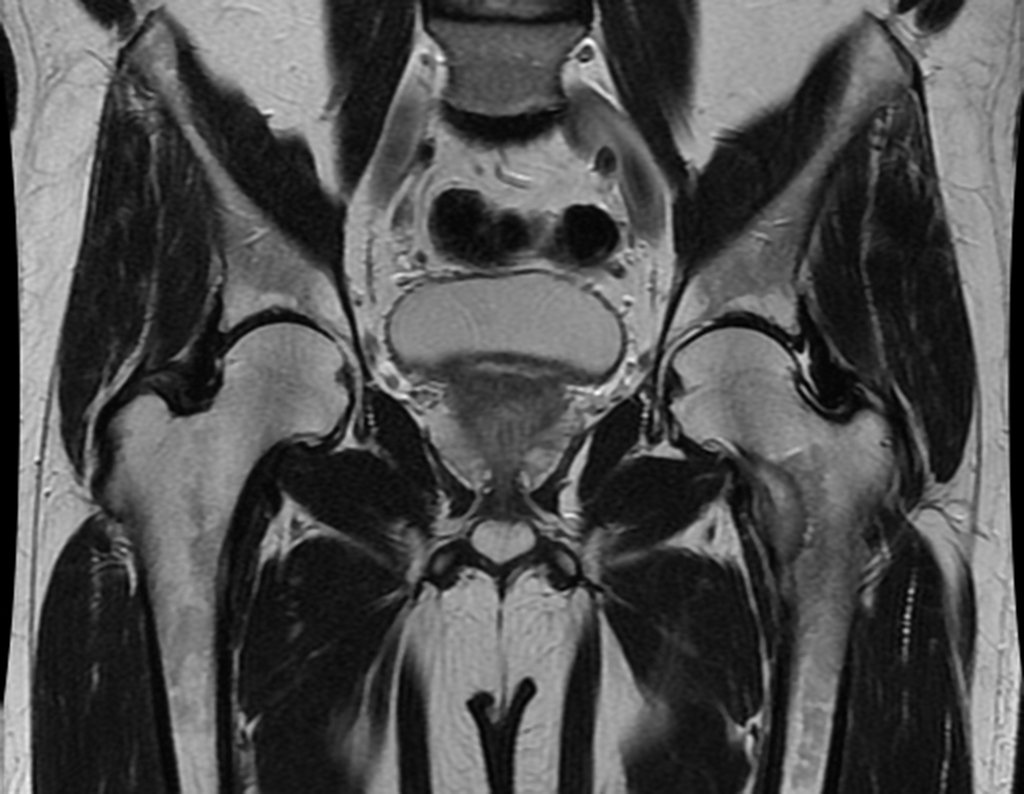
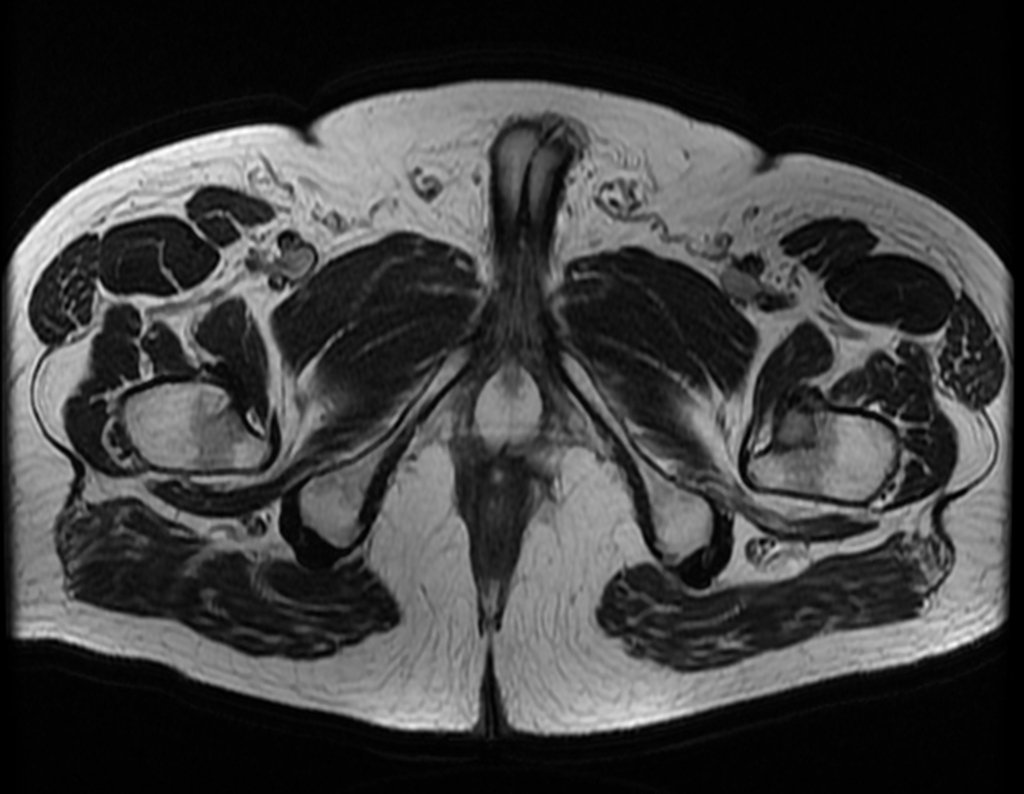
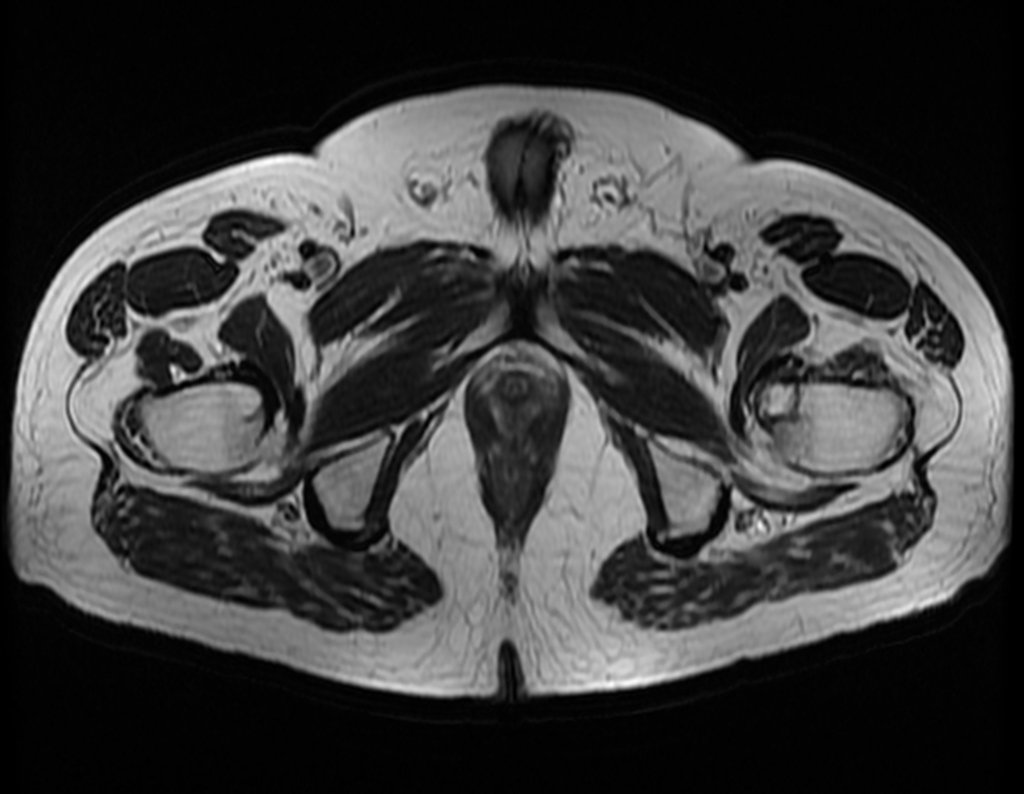
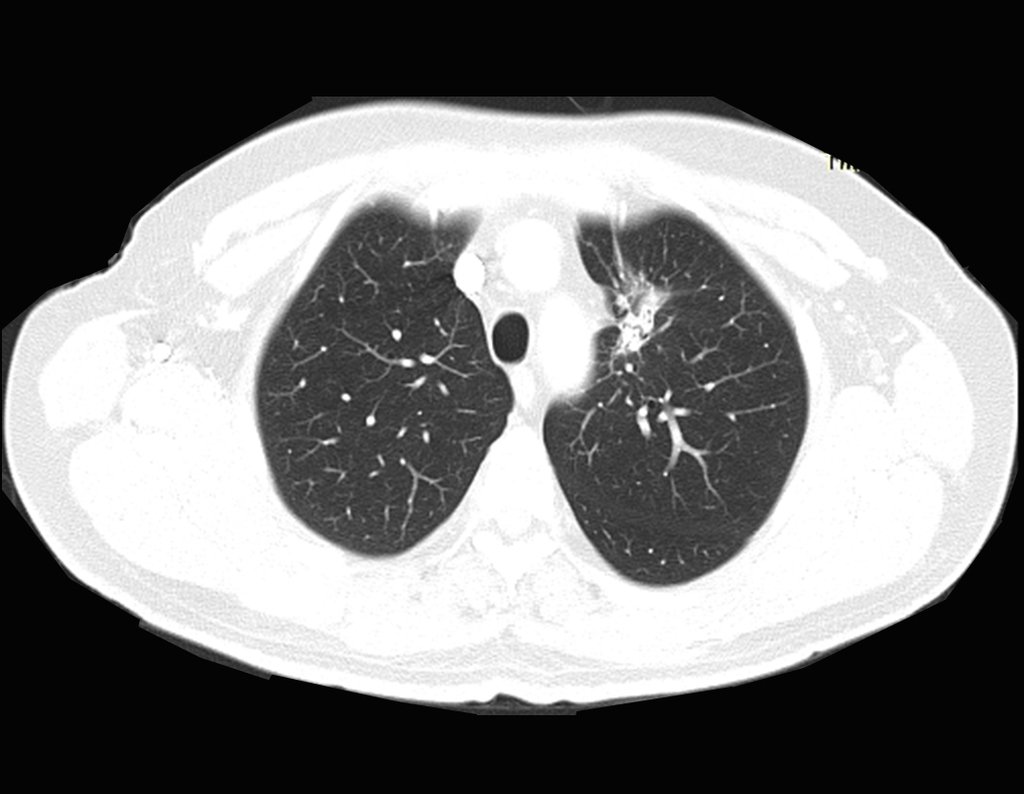
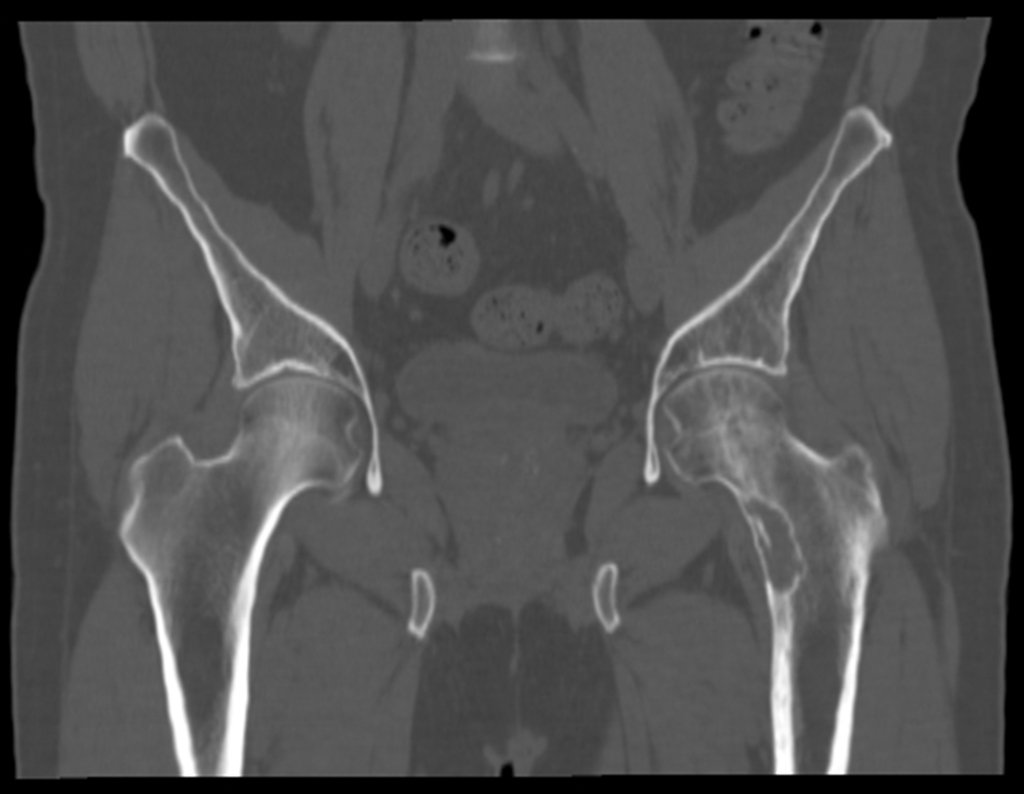
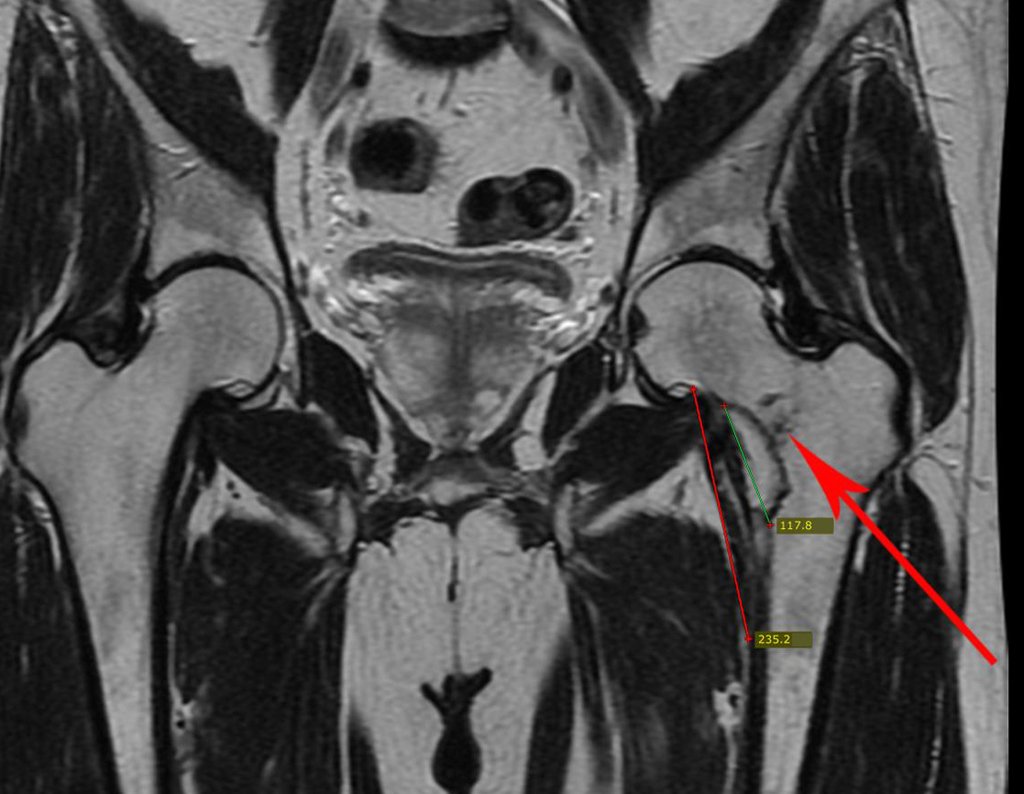
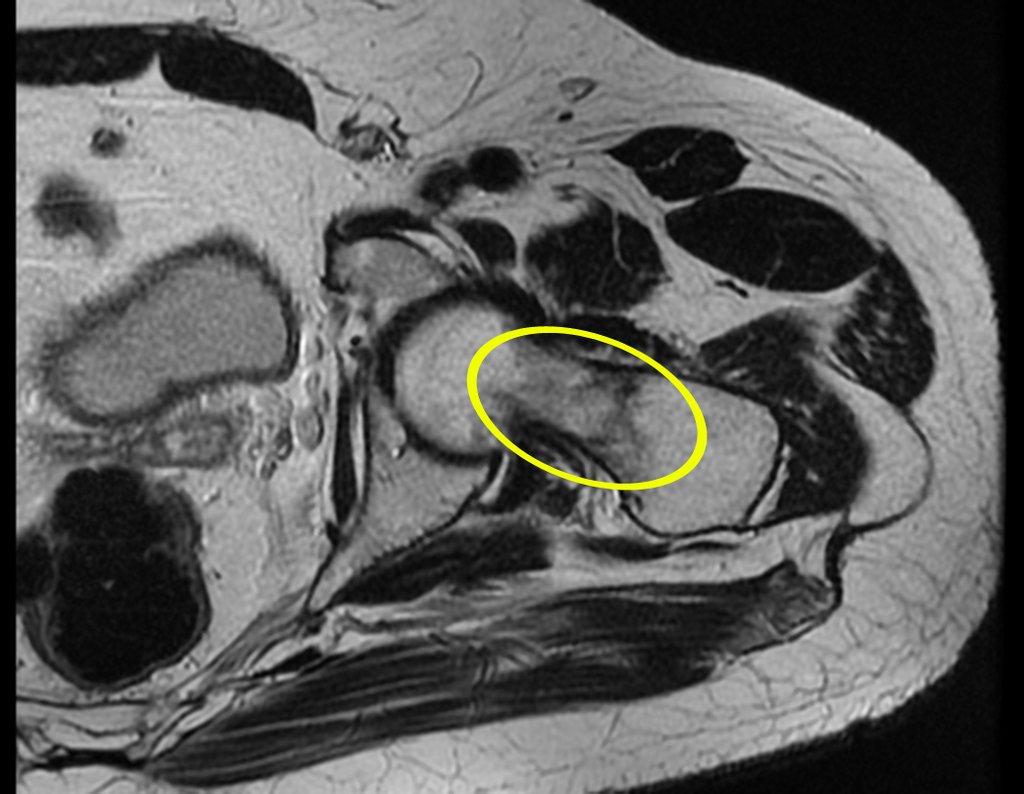
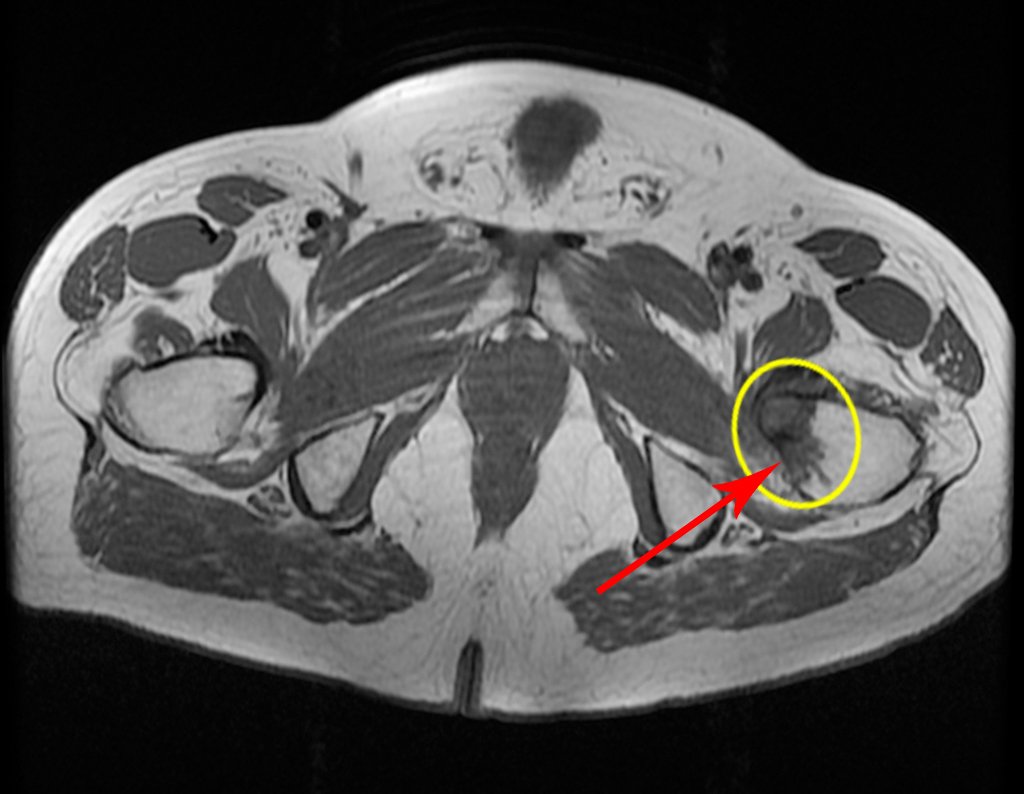
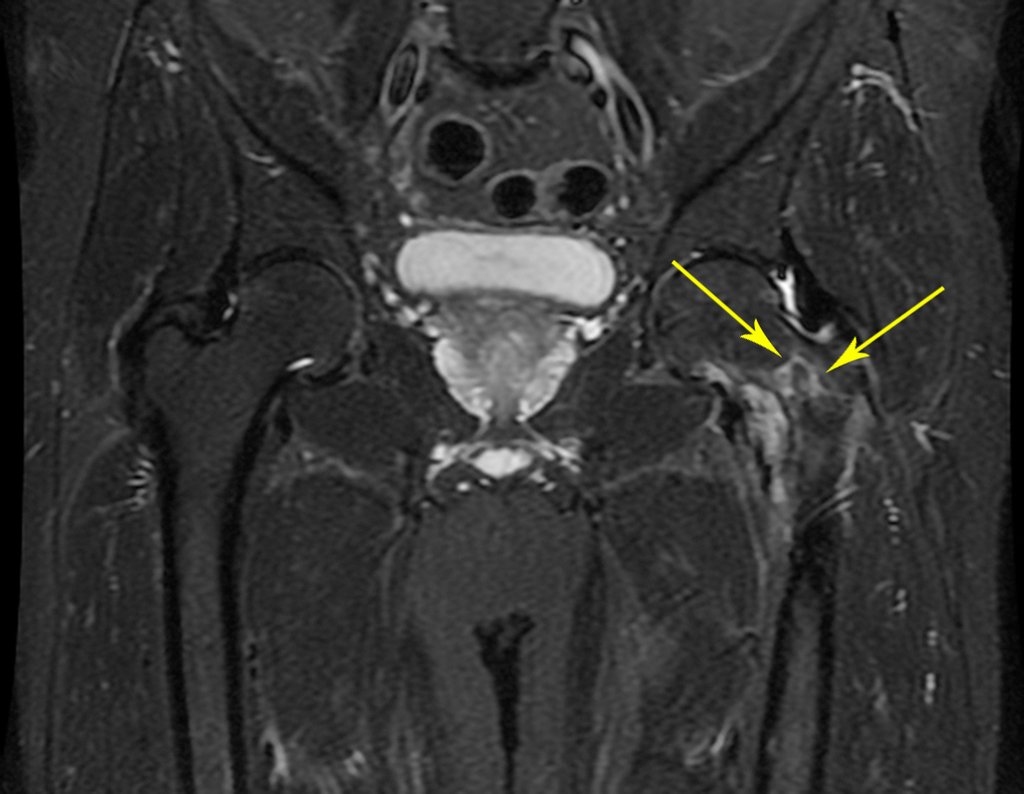
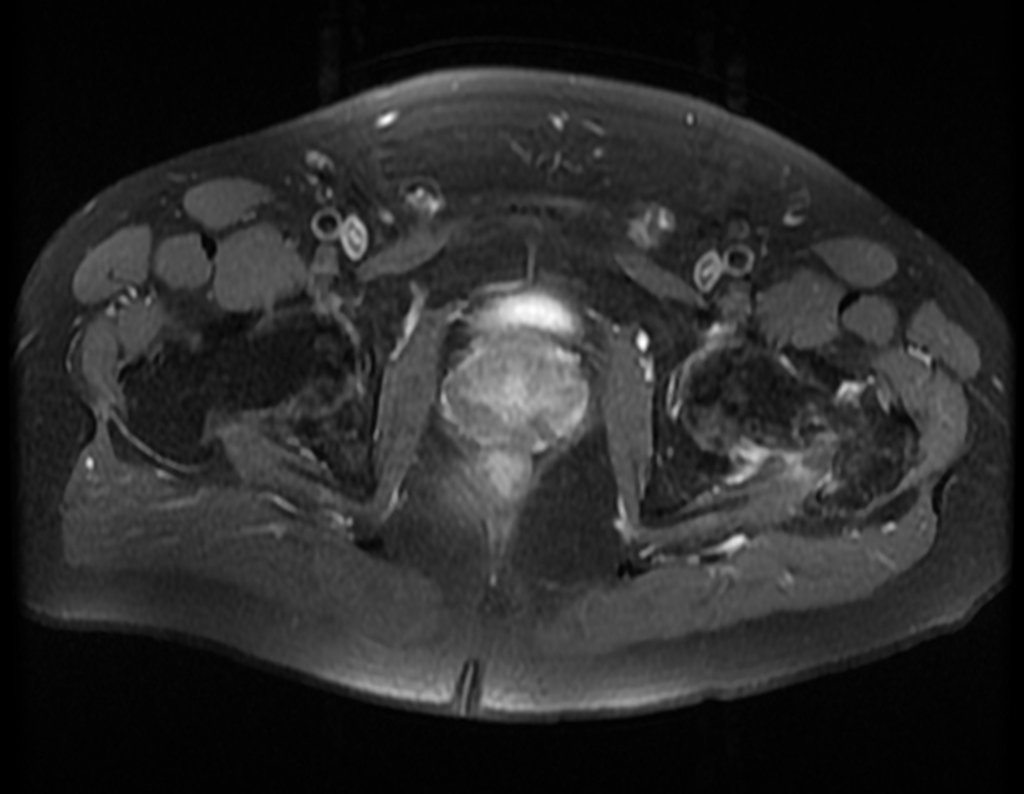
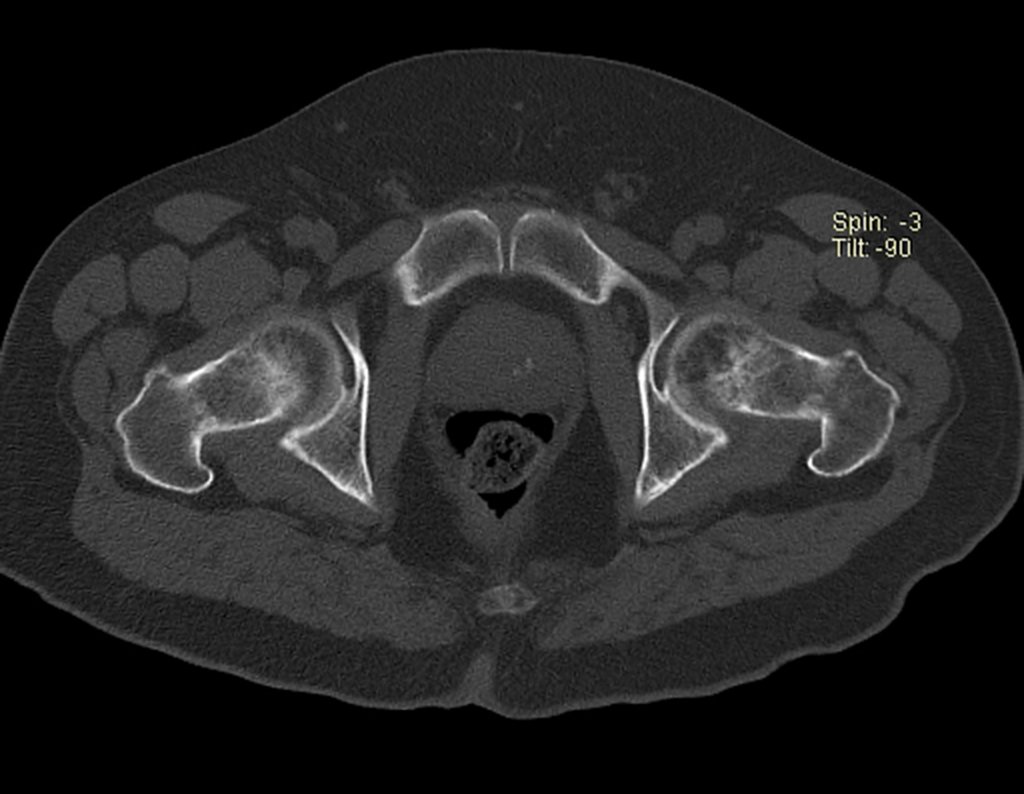
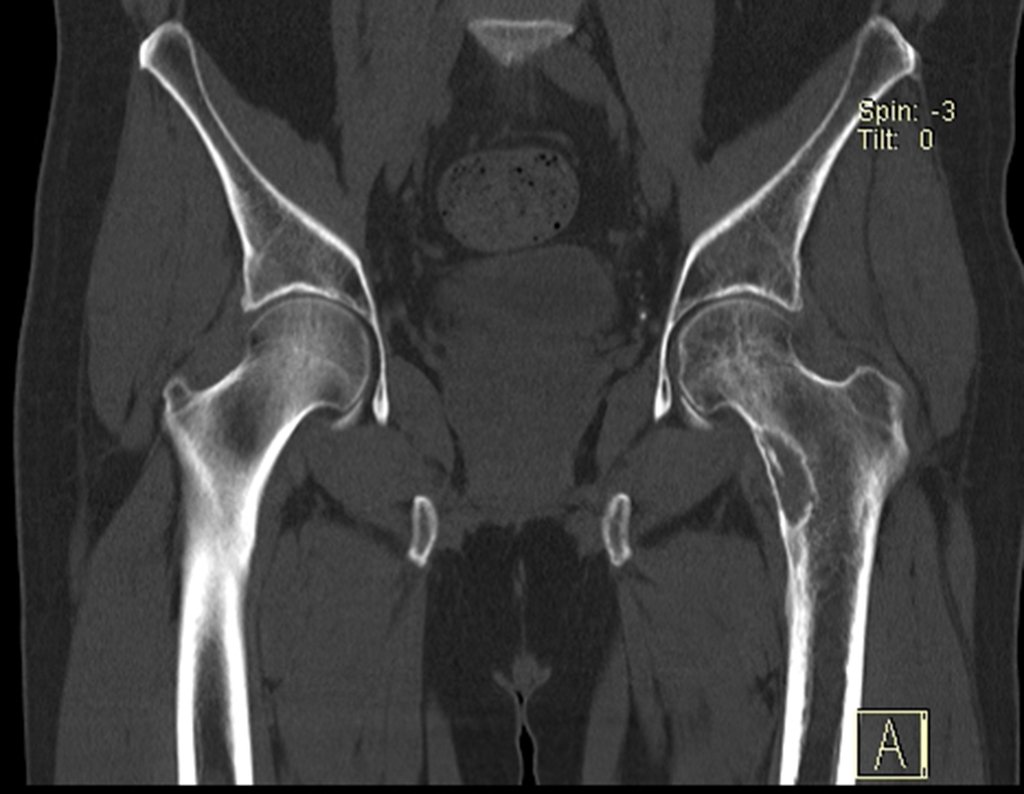
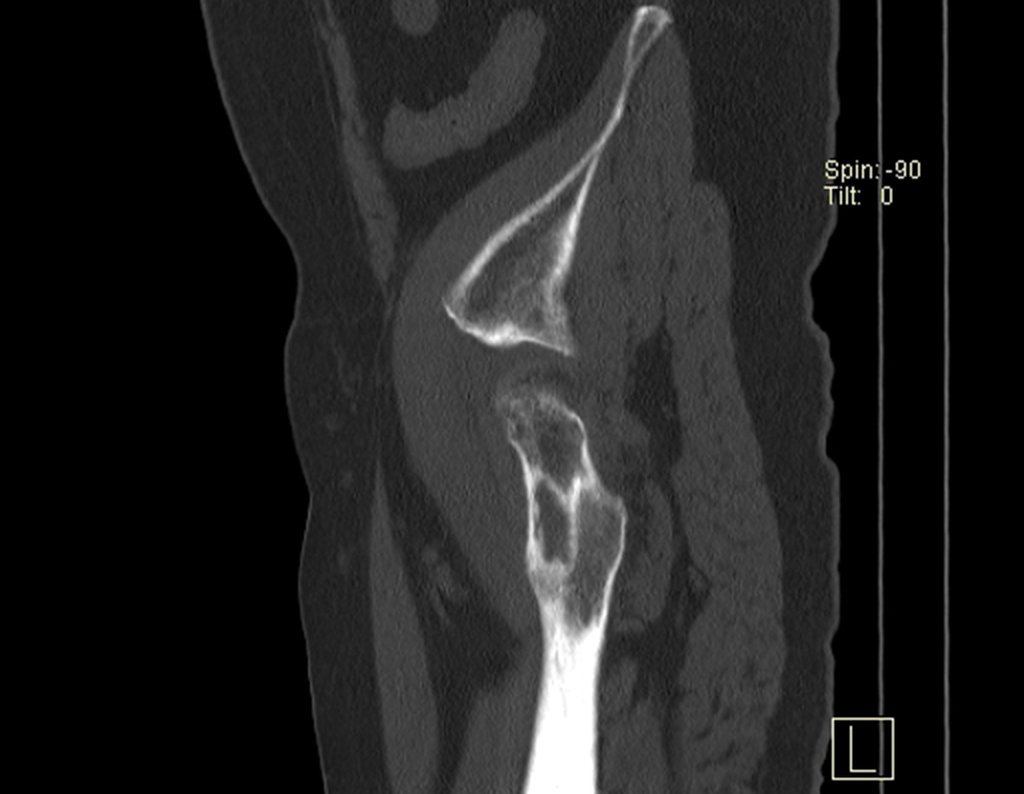
Metástasis ósea
El tejido esquelético representa el tercer gran filtro, que por su lenta circulación sinusoidal favorece el refugio de los émbolos metastásicos que pueden alcanzar el hueso.
Actualmente, con el aumento de la supervivencia de los pacientes con diferentes neoplasias, fruto de diagnósticos cada vez más tempranos, los avances de la quimioterapia con una variedad de fármacos cada vez más eficaces y el control de los efectos secundarios, aumenta el número de pacientes que tienen controlada su enfermedad primitiva y que metastatizan. al esqueleto está aumentando.
Los tumores que con mayor frecuencia producen metástasis óseas son el carcinoma de mama en mujeres, el carcinoma de próstata en hombres y el carcinoma de pulmón. riñón y tiroides en ambos.
Las lesiones óseas que con mayor frecuencia dan manifestaciones clínicas, requiriendo cirugía ortopédica, se presentan en el fémur, húmero, vértebras, pelvis, escápula y tibia, en ese orden.
La historia natural de esta condición es dolorosa y el diagnóstico generalmente puede ocurrir debido a una fractura ósea patológica que causa impotencia funcional, limitaciones en las actividades de la vida diaria, dependencia de otros, escaras y falla multiorgánica por el encamado del paciente.
El papel del ortopedista oncológico tiene como objetivo operar la lesión metastásica lo antes posible para aliviar el dolor, restaurar la función y mejorar la calidad de vida del paciente.
Para ello se realizan cirugías de resección y reconstrucción mediante osteosíntesis con cemento o endoprótesis.
La radioterapia puede eventualmente usarse como medida paliativa, con el objetivo de aliviar el dolor en pacientes que no son clínicamente aptos para la cirugía.
En relación al mieloma múltiple, que es el tumor primitivo del hueso más frecuente, un tumor del ERE, hay que añadir que se trata con quimioterapia y además es muy sensible a la radioterapia. Sin embargo, en los casos que desarrollan lesiones óseas importantes o riesgo de fractura, el manejo quirúrgico ortopédico es similar al tratamiento de las metástasis óseas.
Haga clic aquí para descargar el artículo en PDF sobre metástasis de tumores de mama masculinos.
Haga clic aquí para ver el tratamiento de metástasis de hipernefroma.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
Fractura ósea patológica
Fratura em osso patológico. Em nossa experiência dedicada ao estudo e tratamento de pacientes com doenças ósseas, vivenciamos inúmeros casos de fraturas que ocultavam doenças não diagnosticadas.
Fractura ósea patológica. En nuestra experiencia dedicada al estudio y tratamiento de pacientes con enfermedades óseas, hemos vivido numerosos casos de fracturas que ocultaban enfermedades no diagnosticadas.
Fractura ósea patológica. La denominación simplificada de “fractura patológica” no es apropiada, ya que toda fractura es un proceso patológico. Es correcto utilizar el término: fractura ósea patológica, que con mayor frecuencia se relaciona con neoplasias, ya sean primitivas o metastásicas.
Los procesos patológicos que pueden provocar fracturas se clasifican en displasias óseas, trastornos circulatorios, cambios degenerativos, inflamatorios e infecciosos o neoplásicos.
Para el correcto diagnóstico es necesario considerar los aspectos clínicos del paciente, mecanismos de fractura, aspectos imagenológicos, de laboratorio y anatomopatológicos.
Las fracturas óseas, que ocultan procesos patológicos no diagnosticados, pueden provocar un tratamiento ortopédico inadecuado.
Los organizaremos didácticamente dentro de los cinco capítulos de Patología General, a saber: disgenesias o displasias, procesos degenerativos, trastornos circulatorios, inflamaciones y enfermedades neoplásicas.
DISPLASIAS ÓSEAS:
– dis (del griego = alteración), plasien (= forma). Cualquier cambio en la morfología ósea, ya sea congénito o hereditario, puede provocar deformidades y/o fracturas. Debido a la frecuencia y polimorfismo de los cambios anatómicos que presentan, destacamos los siguientes:
1 – Osteopsatirosis u Osteogénesis imperfecta:
En cualquiera de sus manifestaciones, en la clasificación de Rubin, es una enfermedad hereditaria que predomina en la diáfisis de los huesos largos y determina cambios en la morfología ósea por deficiente aposición ósea subperióstica. El crecimiento óseo longitudinal se produce al nivel de la línea epifisaria, donde el cartílago se transforma en tejido óseo. Sin embargo, el crecimiento transversal depende de la resorción endóstica y de la aposición ósea subperióstica. El fallo de este mecanismo de modelado en los huesos provoca un deterioro del crecimiento en dirección transversal. Debido a esta patogénesis, los huesos se vuelven muy delgados y frágiles, sujetos a frecuentes fracturas.
2 – Osteopetrosis o Enfermedad de Albers Schomberg:
Es una enfermedad caracterizada por cambios en la línea epifisaria de los huesos de origen endocondral. Las lesiones se condensan debido a la falla en la actividad de los osteoclastos que, en condiciones normales, actúan en la resorción fisiológica de los huesos. Al prevalecer la aposición sobre la resorción, los huesos se condensan inicialmente en la metáfisis y, progresivamente, en todo el hueso, cuya consistencia se vuelve pétrea. Además de la anemia, que resulta de la reducción e incluso de la ausencia de los espacios medulares, sede de la hematopoyesis, los huesos más densos pierden su elasticidad y pueden fracturarse.
3 – Displasia fibrosa, mono o poliostótica:
Es una condición en la que hay reemplazo parcial del hueso por proliferación fibrosa entre haces de osteoides con poca mineralización y tiene menor densidad radiográfica. Con el crecimiento y la maduración esquelética, generalmente se produce una osificación progresiva, que incluso puede parecerse a la estructura ósea normal. La zona lesionada tiene una densidad menor que la del hueso normal y, por tanto, la principal manifestación anatómica es la deformidad, que en ocasiones conduce a la fractura.
CAMBIOS METABÓLICOS :
Para que los huesos mantengan una estructura normal, los mecanismos de aposición y reabsorción deben estar en equilibrio. La aposición depende de la actividad de los osteoblastos que elaboran el
Fibras de colágeno, matriz proteica de los huesos. A lo largo de las fibras de colágeno se producirán depósitos de minerales, fosfato tricálcico, en forma de cristales de hidroxiapatita. Las fibras proteicas de colágeno representan el 95% de la estructura de la matriz ósea. El 5% restante son mucopolisacáridos, ácido hialurónico y condroitinsulfúrico, que predominan en las “líneas de cemento” o “líneas inversas”, que delimitan las diferentes bandas de aposición de matriz, manteniendo el crecimiento óseo normal. Al mismo tiempo, la resorción ósea la llevan a cabo los osteoclastos bajo estimulación de la hormona paratiroidea. Estos mecanismos de aposición y reabsorción, que representan el llamado remodelado óseo ( recambio ), son intensos en la primera década de la vida, menos en la segunda y progresivamente menos a medida que avanza la edad, pero siempre presentes a lo largo de nuestra vida.
El metabolismo óseo normal, por tanto, consiste en: a- aposición de la matriz proteica cuyas fibras colágenas son producidas por los osteoblastos, los cuales requieren actividad muscular para cumplir sus funciones; b- ingesta dietética de proteínas, vitaminas A y C, minerales principalmente calcio y fósforo; c- las hormonas gonádicas, tiroideas, pituitarias y suprarrenales también son necesarias para la formación y mineralización de la matriz. Para la reabsorción, los osteoclastos producen enzimas que permiten la disolución de la matriz y la solubilización de minerales, que actúan bajo el estímulo de la hormona paratiroidea.
Los cambios en cualquiera de los elementos que contribuyen a alterar el recambio conducirán a la enfermedad ósea metabólica, especialmente los siguientes:
1 – Osteoporosis:
Es una causa importante y frecuente de fracturas, provocada por la reducción de la consistencia ósea debido a la reducción cuantitativa de la matriz, reduciendo el lecho de depósito mineral que conlleva mayor fragilidad ósea y fracturas, especialmente de vértebras y fémur. La osteoporosis no depende de la falta de calcio o fosfatos, ya que significa deficiencia de matriz, lo que reduce el área de aposición de minerales. Las causas surgen de una menor actividad muscular en personas con estilo de vida sedentario, especialmente personas mayores o en pacientes que llevan mucho tiempo encamados, de ahí la creciente importancia del ejercicio para tratarlo, además de una dieta con un aporte adecuado de proteínas. Los estados de deficiencia proteica por deficiencia dietética o exceso de eliminación están sujetos a osteoporosis, al igual que ocurre en estados de desnutrición y enfermedades con disproteinemia, como el mieloma múltiple y la carcinomatosis ósea. La osteoporosis también ocurre con cambios en las glándulas endocrinas, como hipoestrogenismo posmenopáusico, hipertiroidismo, adenomas hipofisarios, gigantismo y acromegalia, cambios en la corteza suprarrenal, que conducen al síndrome de Cushing, y otros.
2 – Osteomalacia y raquitismo:
Son enfermedades resultantes de la deficiencia de minerales, es decir, que no dependen de cambios en la matriz proteica. En el raquitismo, la deficiencia de minerales predomina en las líneas epifisarias o placas de crecimiento, donde la demanda es mayor y necesaria para la mineralización de los haces osteoides recién formados. Debido a la menor resistencia de estas regiones, se producirá un agrandamiento “en forma de copa” en las metáfisis de los huesos largos y un “rosario desvencijado” en las costillas. La osteomalacia también se conoce como “raquitismo adulto”. Aunque es poco común, se traduce en una deficiencia mineral generalizada, ya que no existe una placa de crecimiento en los huesos. Ocurre debido a una reducción de la absorción intestinal.
en pacientes que han sido sometidos a resecciones intestinales importantes o debido a una deficiencia dietética. Las fracturas resultan de una mayor fragilidad ósea provocada por la deficiencia de minerales.
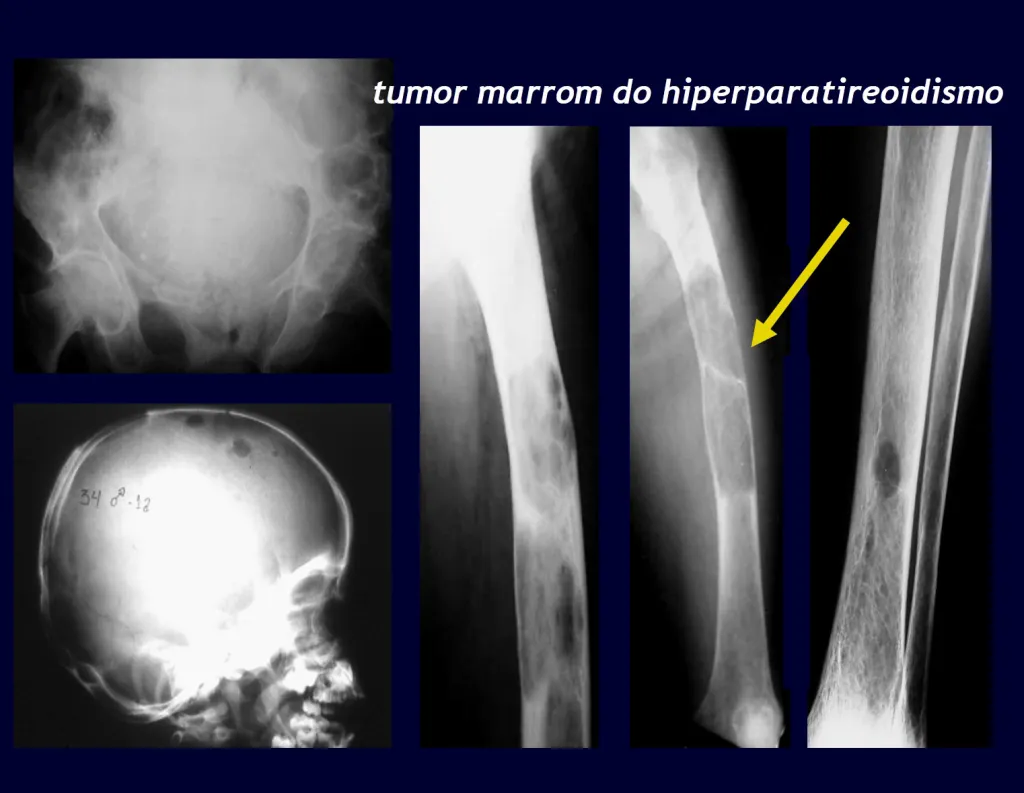
3 – Hiperparatiroidismo:
Una causa importante de fractura patológica de huesos es a menudo el signo inicial de esta enfermedad, especialmente en su forma primaria, cuya causa es el adenoma de una de las glándulas paratiroides. La parathormona normalmente actúa sobre los osteoclastos, células que llevan a cabo la reabsorción ósea. También actúa sobre los riñones, inhibiendo la reabsorción tubular de fosfatos y, de esta forma, ejerce control sobre la fosfaturia y, en consecuencia, sobre la fosfemia. Cuando hay un exceso de hormona paratiroidea se producirá hiperfosfatería, alterando el equilibrio Ca/P que, en condiciones normales, mantiene una relación 2:1, desde la sangre (9,5 calcio/4,5 mg fósforo) hasta la fórmula de hidroxiapatita. Por lo tanto, habrá hipercalcemia para mantener el equilibrio Ca/P en sangre. El calcio se elimina de los huesos, que son el mayor depósito de este mineral en nuestro organismo, reteniendo normalmente alrededor del 95% de este mineral. Como consecuencia de este proceso, los huesos se volverán más frágiles con fracturas espontáneas o por traumatismos leves. Otro signo importante de la enfermedad es la cálculos recurrente, especialmente los cálculos renales. El hiperparatiroidismo primario es una enfermedad crónica de larga duración que, si no se trata con la extirpación del adenoma paratiroideo, conducirá fatalmente a una desmineralización progresiva y generalizada de los huesos con múltiples fracturas y formaciones quísticas intraóseas, debido a la intensidad de la reabsorción por parte de los osteoclastos. Además, es común la presencia de los llamados “tumores pardos”, aislados o múltiples, cuya patogénesis se debe a hemorragias intraóseas con presencia de pigmento férrico hemosiderina, además de cúmulos de osteoclastos. Todos estos cambios óseos dan como resultado la desmineralización de los haces y su sustitución parcial por fibrosis, progresando a la llamada osteítis fibroquística generalizada o enfermedad de los huesos de Von Recklinghausen, que no debe confundirse con la neurofibromatosis, que también lleva el nombre de este autor. .
ENFERMEDADES DEGENERATIVAS:
Fractura ósea patológica
Dentro de este capítulo podemos incluir las histiocitosis de células de Langerhans , denominadas Histiocitosis X, por Lichtenstein, y las lipidosis.
1 – Histiocitosis de células de Langerhans:
-incluidos el granuloma eosinofílico y la enfermedad de Hand Schiller-Christian.
Granuloma eosinofílico:
La forma más frecuente es el Granuloma Eosinofílico , que es más común en niños, es generalmente monostótico y se caracteriza por una lesión osteolítica en la bóveda craneal en forma de lesión circular “en forma de mordida”, en el cuerpo vertebral y en la diáfisis. de huesos largos. Cuando se localiza en la vértebra, compromete el cuerpo de este hueso, con osteólisis y “colapso”, aplanando el cuerpo vertebral, lo que constituye una fractura con aspecto radiológico de la denominada vértebra plana de Calvè. En huesos largos afecta a la diáfisis y, dependiendo del tamaño de la lesión, pueden producirse fracturas.
Mano – Schuller – Enfermedad cristiana:
En la enfermedad de Hand – Schuller – Christian , que puede ser la evolución de un granuloma eosinofílico, las lesiones son múltiples con afectación ósea severa, debido a los cúmulos de macrófagos que frecuentemente se encuentran xantomilados, debido a la acumulación de ésteres de colesterol. Estos acúmulos también pueden comprometer el lecho hipofisario y la región retroocular, lo que puede derivar en la tríada sintomática, es decir, lesiones osteolíticas múltiples, diabetes insípida y exoftalmos unilateral o bilateral. Los huesos largos suelen ser el lugar de fracturas.
2 – Enfermedad de Gaucher:
Entre las lipidosis, es la forma que más compromete los huesos. En esta entidad, las células histiocíticas, debido a un defecto enzimático, se encuentran llenas de lípidos que reemplazan la estructura de los huesos, especialmente en los fémures, constituyendo una causa importante de necrosis de la cabeza de este hueso, acompañada de deformidades, que pueden provocar a fracturas.
TRASTORNOS CIRCULATORIOS :
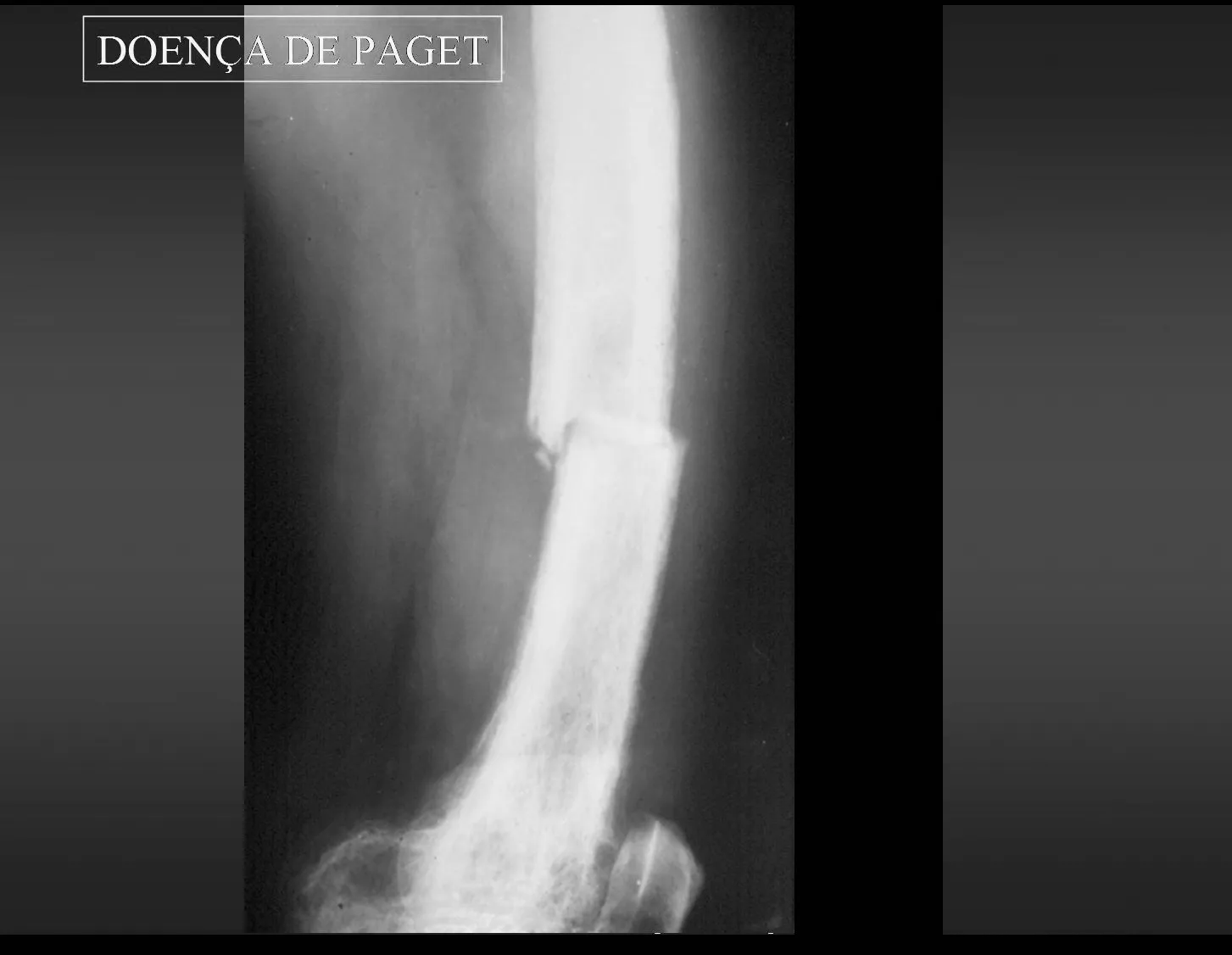
En patología ósea, el ejemplo más significativo de trastorno de la circulación sanguínea intraósea se da en la enfermedad de Paget, también conocida como osteítis deformante, descrita en 1892(), por Sir Thomas Paget, y hasta hoy considerada de causa desconocida.
1 – Enfermedad de Paget:
La enfermedad de Paget se presenta en grupos de edad avanzada, generalmente mayores de 50 años, mono o poliostótica. En las etapas iniciales de esta enfermedad existe un aumento considerable de la circulación arterial intraósea que al ser activa, arterial, hay marcada reabsorción ósea con lesiones radiológicas y anatomopatológicas que presentan características de la llamada “osteoporosis circunscrita”, más Frecuente en cráneo, pelvis, fémur y tibia. En esta etapa se pueden producir fracturas debido a la mayor fragilidad de los huesos. Los síntomas más frecuentes son dolor y malestar en la zona afectada. Algunos autores reportan casos en los que la circulación intraósea es hasta 100 veces mayor de lo normal, pudiendo progresar a insuficiencia cardíaca. Es una enfermedad de evolución lenta con deformidades y, debido al aumento progresivo de la densidad, los huesos adquieren una consistencia pétrea. El sustrato anatomopatológico muestra trastorno en los mecanismos de aposición y resorción ósea, demostrado histológicamente por el aumento numérico de las líneas de cemento que delimitan las bandas de aposición cada vez mayores en el hueso comprometido. Estas líneas se vuelven tan evidentes que asumen una “disposición en mosaico”, con un aumento numérico progresivo y desordenado de osteoclastos y osteoblastos en los márgenes de los haces óseos, que se vuelven irregulares, intercalados con fibrosis en los espacios intertrabeculares. Las “fracturas de tiza” resultan de una mayor densidad ósea y menor elasticidad, por lo que tienen una línea recta, similar a la tiza rota.
2 – Discrasias sanguíneas:
En discrasias sanguíneas como leucemia o enfermedades hemolíticas como anemia (drepanocítica, esferocítica y de Cooley). Son raros, pero pueden ocurrir trastornos circulatorios, con infartos óseos extensos, causas de fracturas óseas patológicas.
INFLAMACIONES :
Las inflamaciones en general se dividen en dos grandes grupos: inespecíficas , en las que la disposición de las células no permite identificar el agente etiológico, y específicas , o granulomatosas, en las que la disposición celular permite identificar la etiología, como en tuberculosis.
1 – Osteomielitis hematógena:
Entre los procesos inespecíficos destaca la osteomielitis hematógena , más frecuente en niños y adolescentes. Afectan principalmente a los huesos largos, con mayor frecuencia en las metáfisis del fémur y la tibia. La ubicación se debe a la estasis sanguínea en las líneas epifisarias donde la demanda es intensa, lo que la hace apta para el desarrollo de bacterias. Debido a la intensidad del proceso inflamatorio, aunque poco frecuentes, pueden producirse fracturas.
2 – Tuberculosis:
La tuberculosis es un proceso específico, cuya lesión osteolítica puede provocar fracturas. Cuando se localiza en la columna, la enfermedad de Pott, la enfermedad compromete los espacios intervertebrales, con osteólisis secundaria que puede resultar en fracturas con acuñamiento de las vértebras con posterior cifosis.
3 – Micosis profundas:
Entre las micosis profundas, la blastomicosis sudamericana , cuyo agente es paracoccidioidis brasiliensis , aunque poco común en la localización ósea, es la que con mayor probabilidad produce fracturas.
4 – Parásitos:
Echinococus granulosus, entre los parásitos, es el que provoca más fracturas óseas . Es una enfermedad rara en nuestro país, conocida como quiste hidatídico. En nuestra experiencia tuvimos dos casos, uno de ellos con lesión vertebral osteolítica severa y el otro, lesión femoral, que también se fracturó. El tratamiento es quirúrgico.
NEOPLASIAS:
Independientemente de si son benignos o malignos, los tumores pueden provocar fracturas, dependiendo de la agresividad de la estructura ósea. Los huesos con mayor sobrecarga, como las vértebras y los del miembro inferior, son más propensos a fracturarse que el resto. Los tumores benignos incluyen osteoblastoma, encondroma, fibroma condromixoide, tumor gigantocelular y hemangioma.
1 – Osteoblastoma:
El osteoblastoma es una neoplasia más agresiva, por lo que se manifiesta con osteólisis y puede ser causa de fracturas, más frecuentemente en huesos largos o en la columna.
2 – Encondroma:
El encondroma , que en aproximadamente el 50% de los casos está presente en las falanges de las manos, aunque es benigno y muchas veces asintomático, puede manifestarse como una fractura espontánea o traumática. Cuando se localizan en huesos largos, principalmente en húmero y fémur, también pueden provocar fracturas y deben diferenciarse del infarto óseo mediante métodos de imagen, a veces sólo aclarados con una biopsia de la lesión.
3 – Tumor de Células Gigantes – TGC:
El tumor gigantocelular es más común en la epífisis de los huesos largos, principalmente distal al fémur y proximal a la tibia y el húmero. La posibilidad de fractura surge de la frecuencia con la que se extiende hasta la metáfisis, en ocasiones con elevada agresividad local.
4 – Fibroma condromixoide:
El fibroma condromixoide , más común en el fémur y la tibia, es de crecimiento lento, excéntrico en relación con el eje óseo y rara vez puede ser causa de fractura.
5 – Hemangioma:
El hemangioma , en huesos largos o en la columna, puede ser asintomático y en ocasiones se diagnostica por hallazgo casual en un examen radiográfico realizado por otros motivos. Sin embargo, en determinadas condiciones se manifiesta como una fractura y/o un “colapso” del cuerpo vertebral. Puede ser aislado o múltiple, caracterizando la hemangiomatosis ósea.
6 – Osteosarcoma – Condrosarcoma:
Todas las neoplasias óseas malignas primitivas presentan posibilidad de fractura. Las que más comúnmente lo hacen son las formas osteolíticas de osteosarcoma , principalmente teleangectásicas.
7 – Hemangioendotelioma maligno:
hemangioendotelioma maligno, debido a la intensidad de la vascularización y las hemorragias intraóseas resultantes.
8 – Plasmacitoma / Mieloma múltiple:
Las lesiones osteolíticas del plasmocitoma/mieloma , causadas por grupos intramedulares de células plasmáticas atípicas, suelen ser el primer signo de la enfermedad.
9 – Linfoma:
Otros tumores líticos como los linfomas intraóseos .
10 – Fibrosarcoma / Fibrohistiocitoma Maligno:
Menos común es el fibrosarcoma , histiocitoma fibroso maligno.
11 – Liposarcoma:
El liposarcoma , el tumor de tejidos blandos más común, también puede presentarse con una fractura .
Metástasis óseas: cáncer de mama, próstata, pulmón, riñón y tiroides:
La principal manifestación de las fracturas óseas patológicas se debe a neoplasias secundarias o metástasis (del griego: meta=más allá, estasis=parada). Las metástasis óseas más frecuentes en los hombres se originan en la próstata y los pulmones. En las mujeres son de origen mamario y pulmonar. Los que se originan en el carcinoma de próstata son generalmente osteocondensantes, porque, debido a la lentitud con la que las células llegan a las vértebras, a través del plexo venoso paravertebral de Batson y en los demás huesos a través de la sangre arterial, el tejido óseo reacciona con la neoformación de inter- haces trabeculares que reducen los espacios medulares, con el fin de condensar el hueso, claramente evidente en métodos de imagen o examen patológico. Al igual que en la enfermedad de Paget, la mayor densidad y menor elasticidad de los huesos pueden provocar “fracturas en línea de tiza”. Las metástasis pulmonares, en ambos sexos, son osteolíticas con afectación más frecuente del húmero, pelvis y fémur. En la columna la lesión afecta inicialmente a los pedículos, mientras que en el plasmocitoma/mieloma la afectación predomina en el cuerpo vertebral. Las metástasis del carcinoma de mama son generalmente osteolíticas. Las fracturas osteolíticas tienen una patogénesis basada en la mayor velocidad con la que las células llegan al hueso, impidiendo una adecuada reacción osteogénica, al contrario de lo que se observa en el carcinoma de próstata. Otras neoplasias, con origen en el riñón (carcinoma de células claras) y la tiroides (carcinoma folicular), debido a la intensa vascularización que forma parte de estas estructuras, destruyen rápidamente el tejido óseo dando lugar a fracturas óseas intensamente osteolíticas, a veces clínicamente pulsátiles.
Lesiones pseudotumorales: quiste óseo simple, quiste aneurismático y fibroma no osificante:
En cuanto a las lesiones pseudoneoplásicas , la que con mayor frecuencia provoca fracturas es el quiste óseo aneurismático . Este proceso, de etiología desconocida, que no tiene aspecto quístico y mucho menos es de carácter vascular, se conoce como la lesión benigna que presenta un comportamiento más agresivo, simulando muchas veces neoplasias malignas.
Otras lesiones pseudoneoplásicas que pueden fracturar son el quiste óseo simple de localización metafisaria, cuando en un hueso con mayor carga como el fémur y la tibia, es propenso a fracturarse. El fibroma no osificante , una evolución del defecto fibroso metafisario cortical, también puede fracturarse por su progresivo aumento de volumen, cuando se localiza en la metáfisis del fémur o la tibia.
No es raro que las fracturas óseas simples o complejas oculten cambios patológicos y puedan dar lugar a un tratamiento ortopédico inadecuado.
Para tratar las fracturas óseas patológicas es necesario estudiar todo el contexto que las rodea. Las fracturas óseas siempre deben analizarse bajo aspectos multidisciplinarios, que tengan en cuenta la historia, grupo etario de los pacientes, aspectos clínicos, imágenes, pruebas de laboratorio y examen anatomopatológico. El estudio conjunto multidisciplinar de estos datos es fundamental para el diagnóstico y manejo de cada caso. Con el diagnóstico correcto, el ortopedista definirá el tratamiento. Siguiendo lo descrito en este capítulo:
Displasias óseas:
1 – Osteopsatirosis u Osteogénesis imperfecta.
Tratamiento : Clínico: Actualmente se utiliza el uso de bifosfonatos.
Ortopédico: osteosíntesis intramedulares para apoyar el crecimiento alineado, con varillas telescópicas, asociadas o no a osteotomías para corregir deformidades.
2 – Osteopetrosis
Tratamiento : Clínico: Prevención de deformidades
Ortopédico: osteosíntesis de fracturas.
3 – Displasia fibrosa, mono o poliostótica,
Tratamiento : Clínico: El uso de bifosfonatos puede tener efecto.
Ortopédico: osteosíntesis
Cambios metabólicos:
1 – Osteoporosis
Tratamiento : Clínico: prevención de fracturas, evitar la cafeína, caminar. Puede estar indicado el uso de bifosfonatos.
Ortopédico: osteosíntesis de fracturas.
2 – Osteomalacia y raquitismo
Tratamiento : Clínico: Corrección de la homeostasis, vitamina D, prevención de deformidades.
Ortopédico: osteosíntesis de fracturas.
3 – Hiperparatiroidismo
Tratamiento : Clínico: resección del tumor de paratiroides y compensación de la condición metabólica, teniendo en cuenta la marcada hipocalcemia que se produce tras la cirugía, ya que el tejido óseo comienza a compensar rápidamente la desmineralización ósea existente. El aporte de proteínas es fundamental para la creación de la matriz ósea.
Ortopédico: osteosíntesis de fracturas, que curan rápidamente, ya que el hueso carece de calcio.
Enfermedades degenerativas:
1 – Granuloma eosinofílico
Tratamiento : Clínico: terapia con corticosteroides.
Ortopédico: curetaje de la lesión ósea. En la vértebra plana de Calvé, la propia fractura en cuña conduce a la curación del proceso. En niños y adolescentes el cuerpo vertebral crece espontáneamente corrigiendo la deformidad.
2 – enfermedad de Gaucher
Tratamiento : Clínico:
Ortopédico:
Trastornos circulatorios:
1 – enfermedad de Paget
Tratamiento : Clínico: Bifosfonatos y antiinflamatorios.
Ortopédico: osteosíntesis de fracturas.
2 – En discrasias sanguíneas
Tratamiento : Clínico:
Ortopédico:
Inflamaciones:
1 – Osteomielitis hematógena
Tratamiento : Clínico: terapia con antibióticos.
Ortopédico: drenaje de abscesos, eliminación de secuestros óseos y estabilización de fracturas.
2 – Tuberculosis
Tratamiento : Clínico: pauta triple para la tuberculosis.
Ortopédico: limpieza de abscesos caseosos e inmovilización, estando frecuentemente indicada artrodesis de las articulaciones afectadas y osteosíntesis de fracturas.
3 – Blastomicosis Sudamericana , cuyo agente es paracoccidioidis brasiliensis y
Tratamiento : Clínico: tratamiento farmacológico específico para la tiña.
Ortopédico: limpieza quirúrgica y cuidados específicos para cada caso.
4 – La equinococosis, en forma de quiste hidatídico, debe tratarse quirúrgicamente.
Neoplasias:
1 – Primitivos benignos : El tratamiento ortopédico puede incluir legrado intralesional, adyuvante local, reconstrucción con osteosíntesis e injerto autólogo o metacrilato de metilo.
2 – Primitivas Malignas : Pueden requerir tratamiento de quimioterapia orientada a la neoplasia y tratamiento quirúrgico de resección y reconstrucción con endoprótesis o reconstrucción biológica, si es posible, o cirugía ablativa.
3 – Secundario a metástasis : Restaurar la función es fundamental para la calidad de vida del paciente. La opción de tratamiento para estas fracturas requiere cierta consideración para tomar la decisión adecuada para cada paciente. Algunas de ellas son subjetivas, ya que debemos asumir el tiempo probable de supervivencia del paciente, la posibilidad clínica de que recupere completamente sus funciones, la capacidad de resistir la anestesia, etc.
Buscamos sustentar nuestras decisiones en los siguientes parámetros:
- ¿La lesión es en el miembro superior, miembro inferior, cintura pélvica o columna?
- ¿La lesión es única o hay múltiples lesiones?
- ¿La fractura ya se ha producido o existe riesgo de fractura?
- Si no se produjo ninguna fractura, ¿ya está comprometido 1/3 de la circunferencia del hueso? ¿La lesión cubre un área larga?
- ¿El paciente caminaba antes de la fractura? ¿Tenía una función motora normal?
- ¿Cuánto tiempo lleva el paciente tratado por la enfermedad primaria?
- ¿Está actualmente recibiendo tratamiento de quimioterapia?
- ¿Cuál es el pronóstico temporal de este paciente?
- ¿Qué comorbilidades tienes además de la neoplasia?
- El tipo de neoplasia primaria responde a la radioterapia.
El análisis de estas cuestiones permitirá tomar una decisión terapéutica que ayude al paciente a recuperar su función motora, en consonancia con el tratamiento de su enfermedad de base.
Los pacientes con mieloma tienen una alta tasa de infecciones postoperatorias y suelen beneficiarse de la radioterapia local, especialmente en lesiones de la columna torácica o del miembro superior, en los primeros años de la enfermedad. Después de unos años, cuando la enfermedad se vuelve refractaria a la quimioterapia o al trasplante de médula ósea, incluso las opciones quirúrgicas se ven limitadas debido a la intensidad de la afectación ósea.
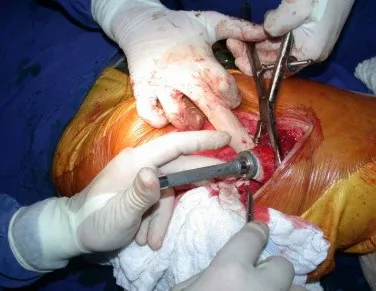
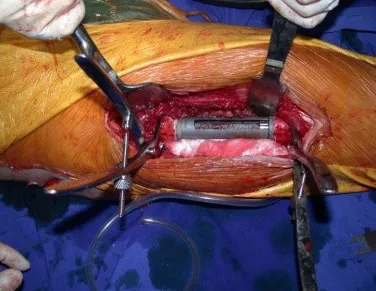
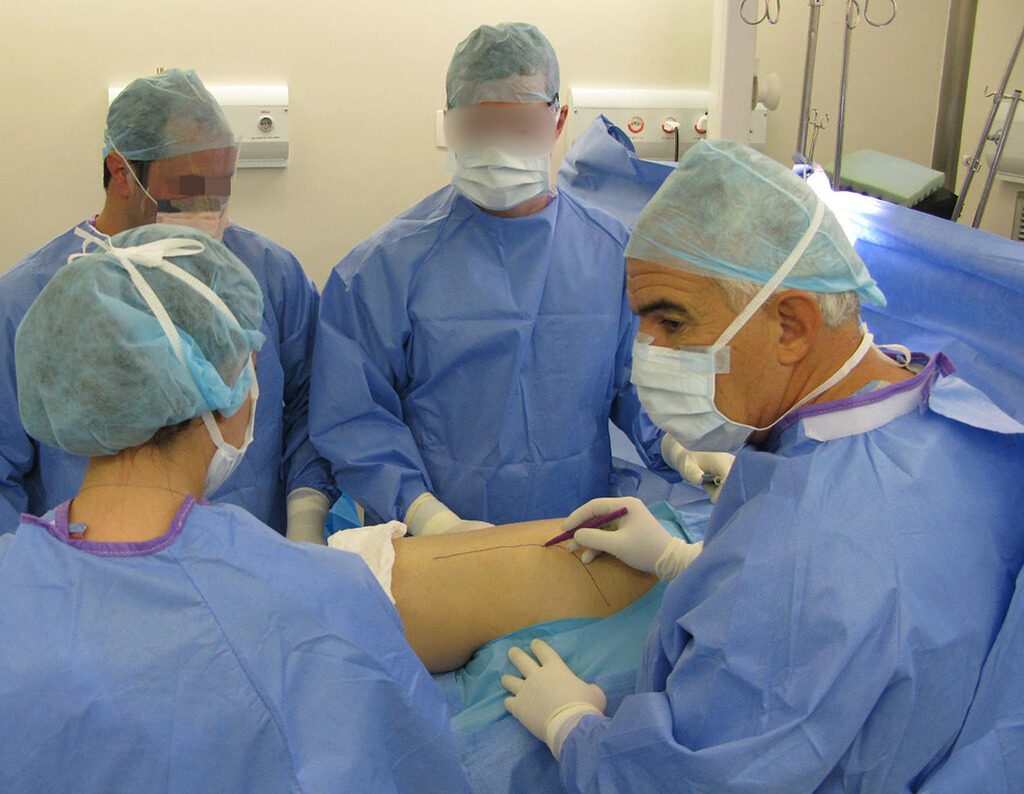
Este caso en las figuras 8 a 12 ejemplifica un paciente con mieloma múltiple, que presenta una lesión extensa en la mitad proximal del húmero derecho. A pesar de ser mieloma, que responde bien a quimioterapia y radioterapia e incluso en el miembro superior, existe indicación de resección de la lesión y reconstrucción con endoprótesis no convencional debido a la destrucción de la anatomía y al rápido restablecimiento de la función.
Las lesiones del miembro inferior, al ser un miembro de carga, se resuelven mejor con tratamiento quirúrgico. El uso de radioterapia paliativa, al considerarse de “pronóstico reservado”, puede provocar más sufrimiento cuando la lesión se fractura, ya que todas las neoplasias provocan la sustitución del tejido óseo normal por tejido tumoral. Por tanto, existe lisis ósea en todas las neoplasias, incluidas las metástasis de próstata. Muchas veces se dice erróneamente que las metástasis óseas de la próstata son osteoblásticas, pero lo que ocurre fisiopatológicamente es que en las neoplasias de evolución lenta hay tiempo para que el tejido óseo reaccione ante la lesión, en un intento de reparar el hueso lesionado, o lisado. . si tu prefieres.
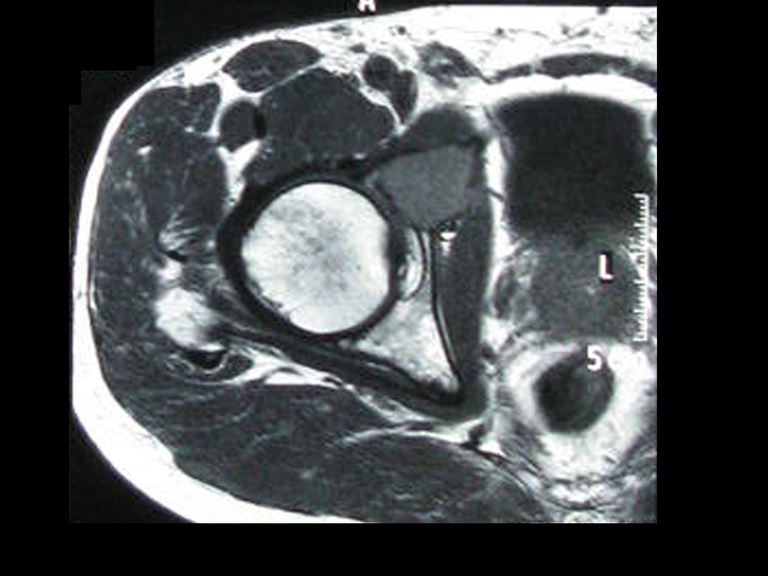
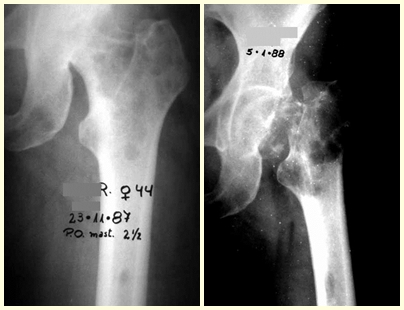
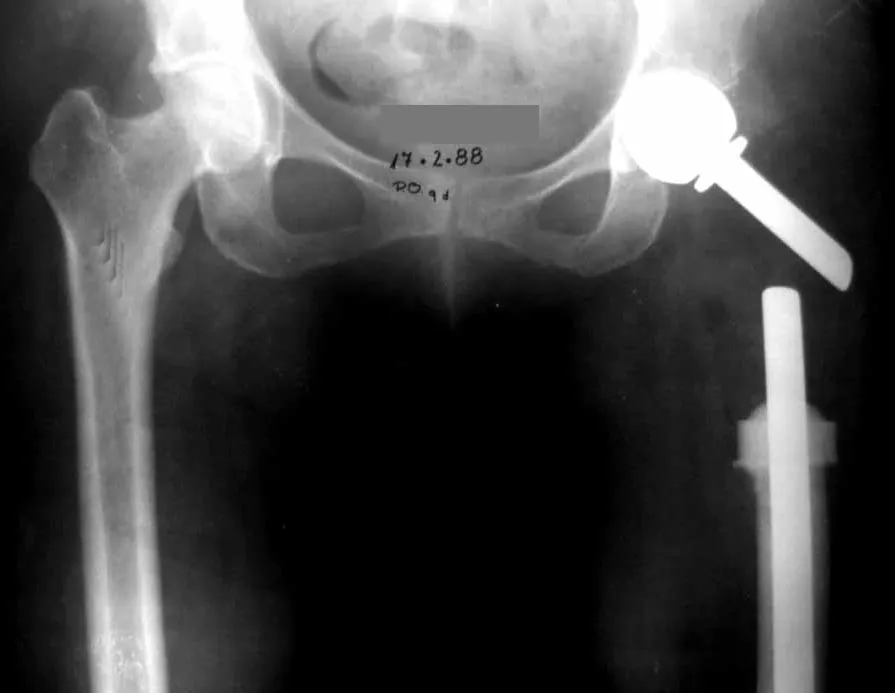
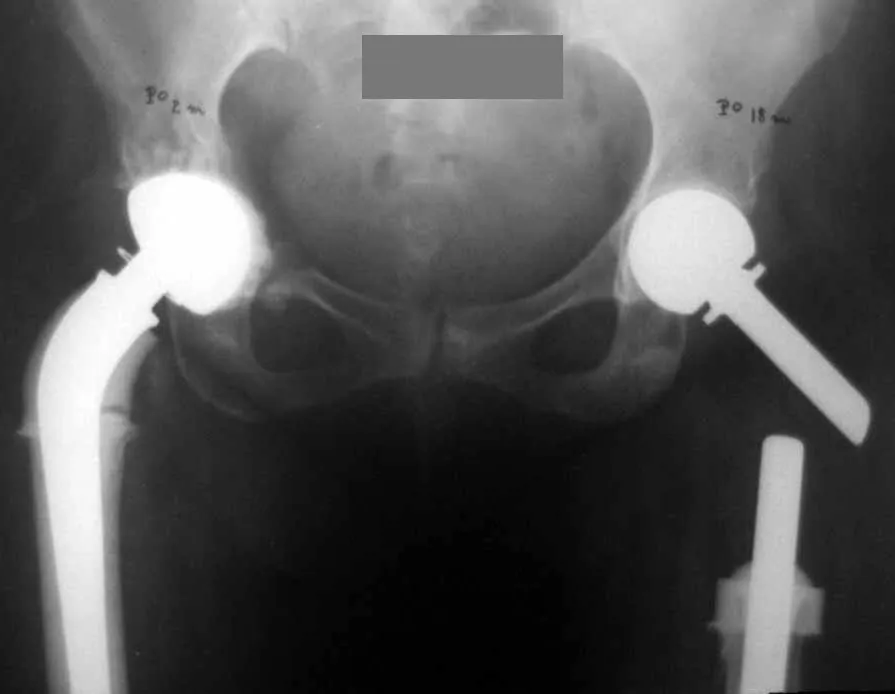
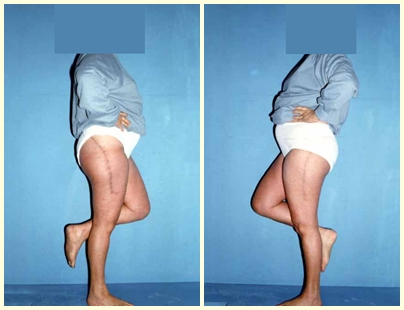
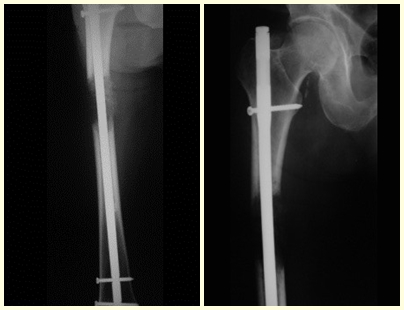
En las figuras 13 a 19 ilustramos un caso de metástasis de cáncer de mama en una paciente a la que se le realizó una mastectomía hace dos meses. Observamos numerosas lesiones líticas en la región metafisaria proximal del fémur izquierdo el 23 de diciembre de 1987. Se recomendó radioterapia local. La lesión no respondió al tratamiento y en esta localización, miembro inferior, en apenas 40 días la lesión progresó y se fracturó, aumentando el dolor del paciente y el malestar de la familia.
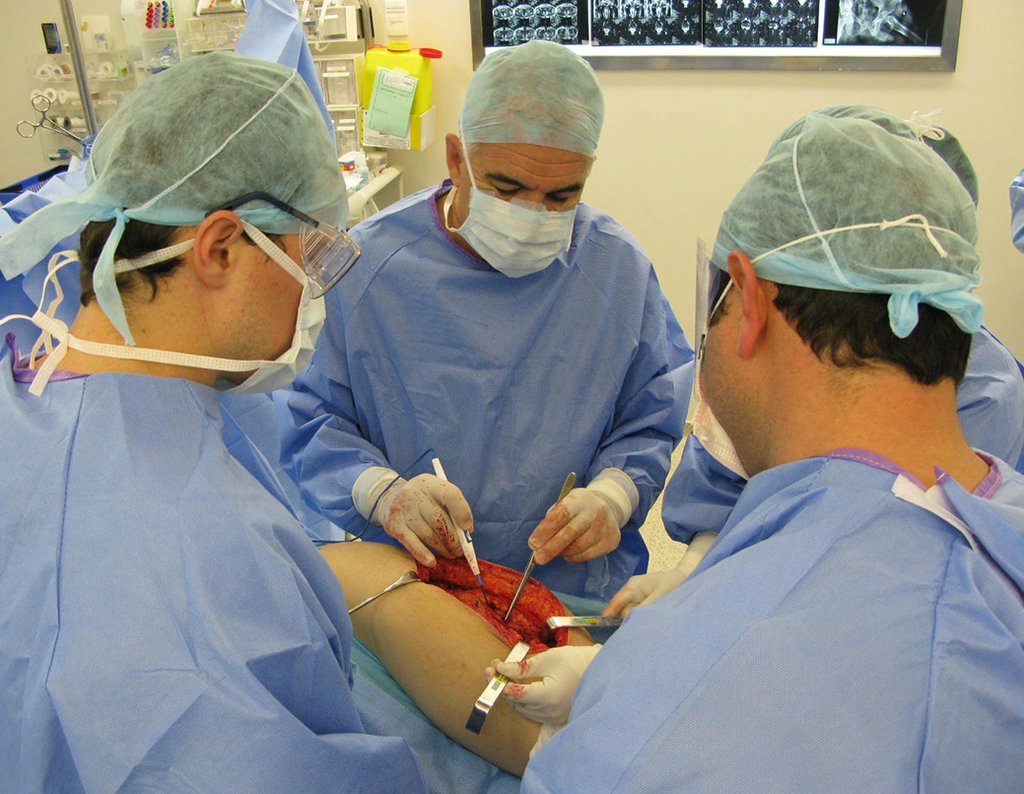
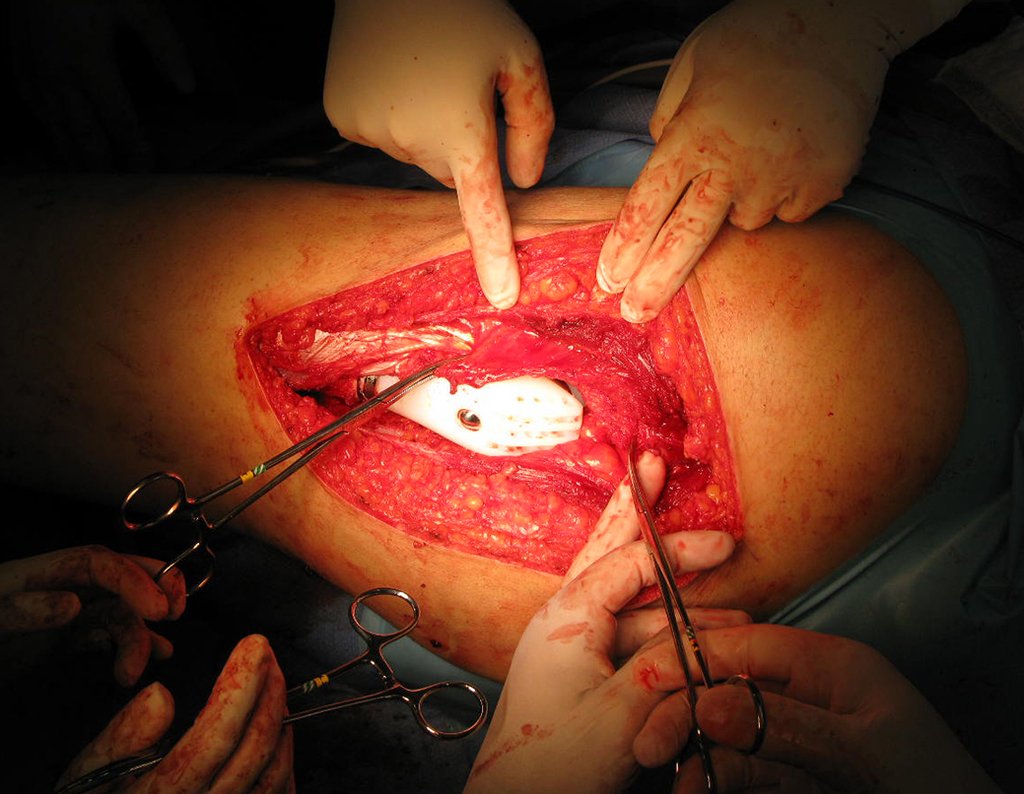
La lesión fue resecada y reemplazada por una endoprótesis.
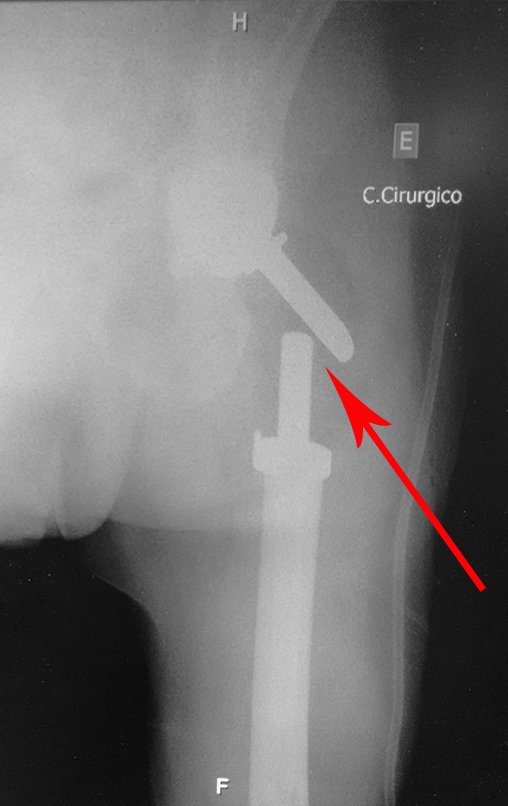
En este último ejemplo se observa una única lesión en la diáfisis femoral. Fue tratado con un clavo femoral bloqueado. Observábamos la progresión de la lesión cada mes, quejándonos de dolor y dificultad para caminar que empeoraban progresivamente. Obsérvese la destrucción local y la inestabilidad de la osteosíntesis, figuras 20 a 26.
El paciente puede caminar desde el primer día postoperatorio, pudiendo reincorporarse a su actividad laboral y tratamiento complementario de la enfermedad de base.
Estos ejemplos ilustran las dificultades en el abordaje de las fracturas patológicas y la necesidad de profesionales con experiencia en el tratamiento de estas lesiones.
Ver fractura del cuello femoral en un niño debido a un quiste óseo simple.
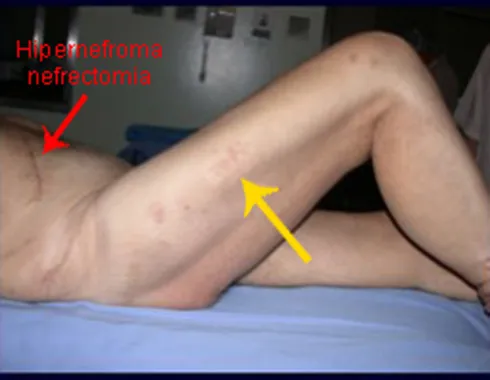
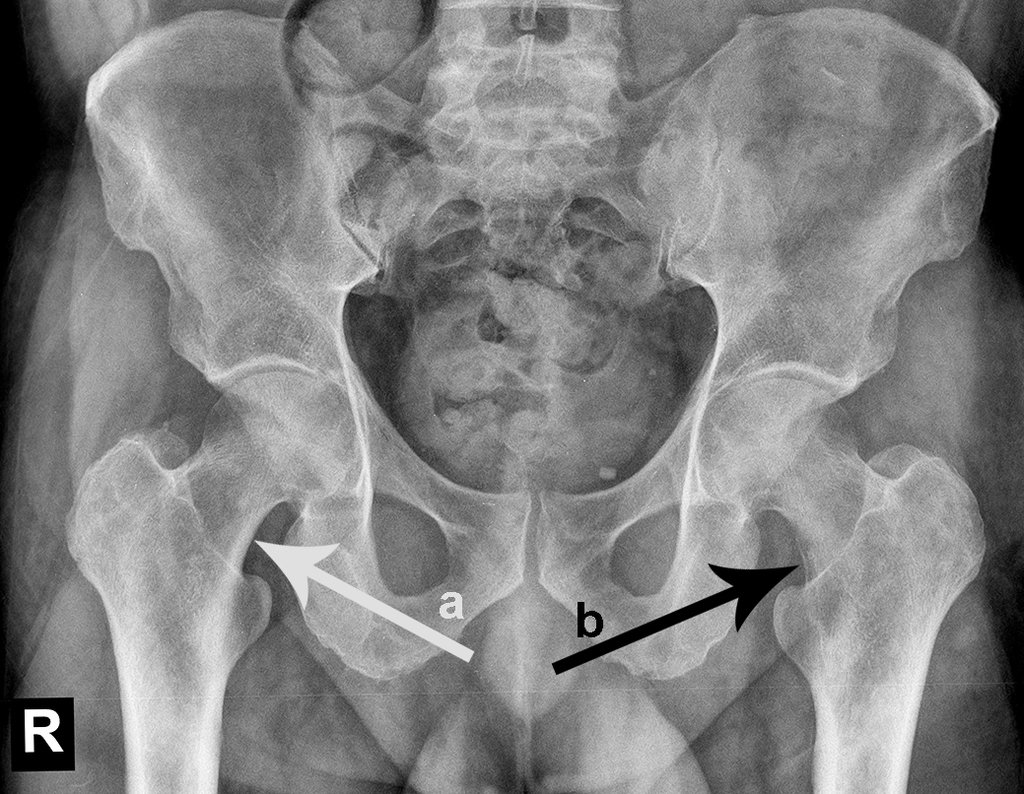
Véase fractura incompleta del cuello femoral en un adulto debido a metástasis renal.
REFERENCIAS BIBLIOGRÁFICAS:
ALBRIGHT, F., REIFENSTEIN, EC: La glándula paratiroides y el metabolismo de las enfermedades óseas. Estudios seleccionados. Baltimore: William y Wilkins; 1948.
BATSON, OV: La función de las venas vertebrales y su papel en la propagación de metástasis. Ana. Surg., 112:138, 1940.
BRASILEIRO FILHO, G.: Patología de Bogliolo. Guanabara Koogan, 7ª ed., 2006, pág. 846-847.
DORFMAN, HD & CZERNIAK, B: en tumores óseos, Mosby, St. Louis, EE.UU., 1997, pág.194-204.
GALASKO, CBS & BENNET, A.: Mecanismo de las enfermedades de metástasis óseas líticas y blásticas. Clin Orthop, 169:20, 1982.
GORHAN, LV. & WEST, WT.: Cambios circulatorios en reacciones osteolíticas y osteoblásticas. Arco Pathol, 78:673, 1964.
JAFFE, HL.: Enfermedades metabólicas, degenerativas e inflamatorias de huesos y articulaciones. Lea y Febiger, Filadelfia, 1972, págs. 17l-180.
LICHTENSTEIN, L. : Histiocitosis Camino., 56:84, 1953.
PROSPERO, JD., RIBEIRO BAPTISTA, PP, AMARY, MFA, & CREM DOS SANTOS, P.: Paratiroides: estructura, funciones y patología. Acta Orthop. Brasil., 17:2, 2009.
PRÓSPERO, JD. en Tumores Óseos. Ed. Roca, São Paulo, Brasil, 2001, págs.211-226.
RUBIN, P: Clasificación dinámica de las displasias óseas, Year Book Medical editor Inc. Osteogénesis imperfecta pág.322 -324
RUBIN, P.: Clasificación dinámica de la displasia ósea, Year Book Medical Publishers Inc., 1964. Osteopetrosis pág. 258 – 280
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
Radioterapia – Técnica de resección de metástasis ósea de un tumor renal en fémur – Reconstrucción con endoprótesis de polietileno
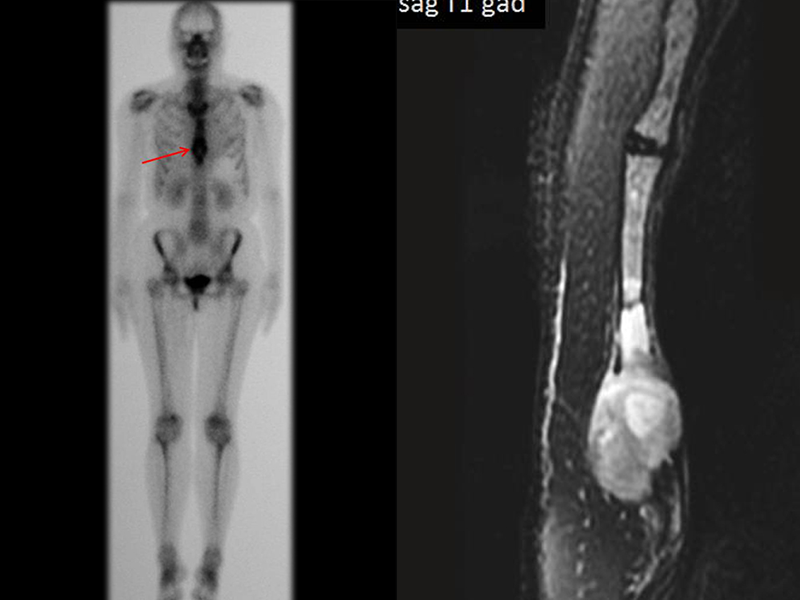
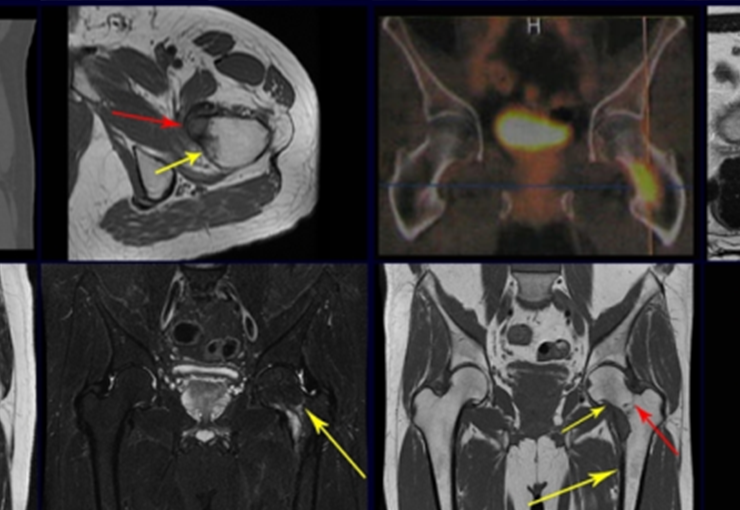
El 23/02/2015, luego de la evaluación clínica y las imágenes disponibles, solicitamos un examen Pet-Ct, para completar los estudios de imagen y estadificación de la lesión.
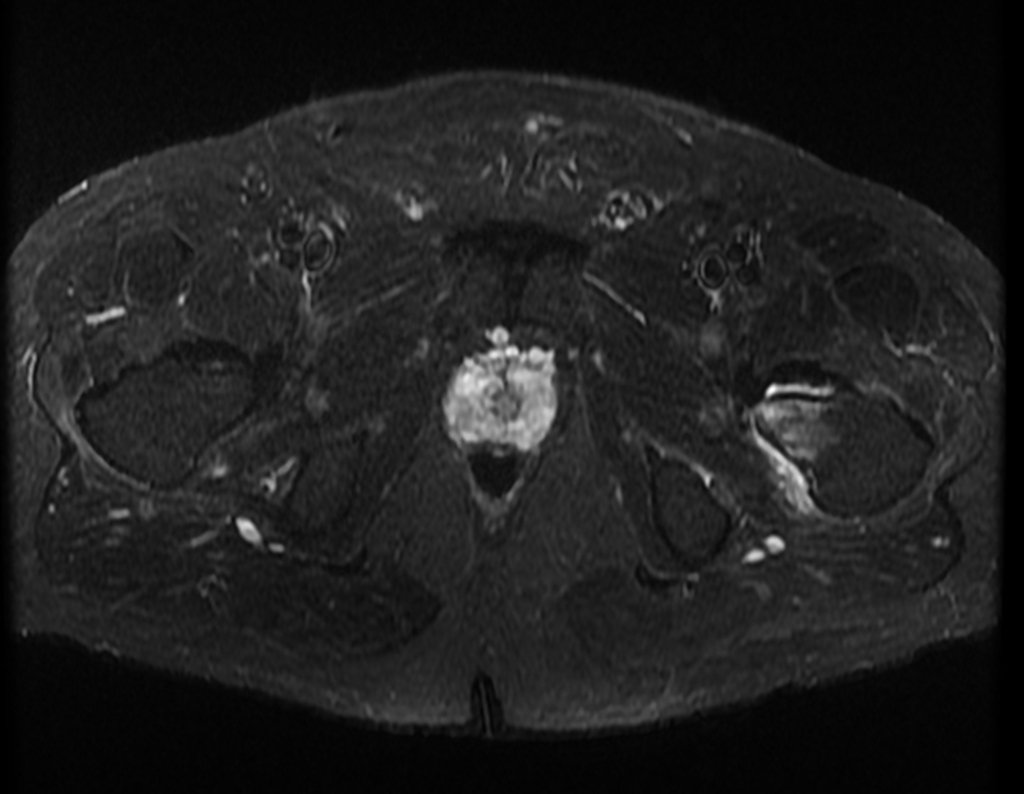
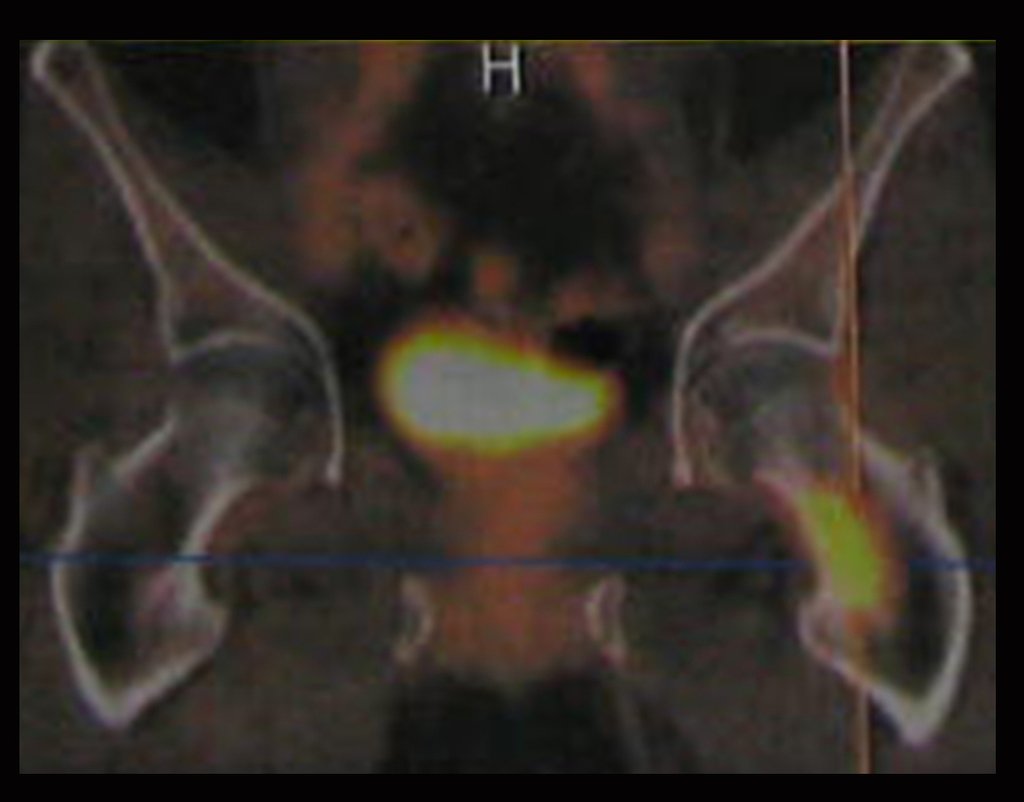
Este examen mostró lesiones hipermetabólicas: pulmón izquierdo, SUV=13,2 (probable proceso primario) y lesión en cuello femoral izquierdo, SUV=10,7 (probable proceso secundario), figuras 16 a 21.
La planificación del tratamiento de radioterapia realizada fue:
1- Técnica: Radioterapia Estereotáxica Extra Craneal (SBRT)
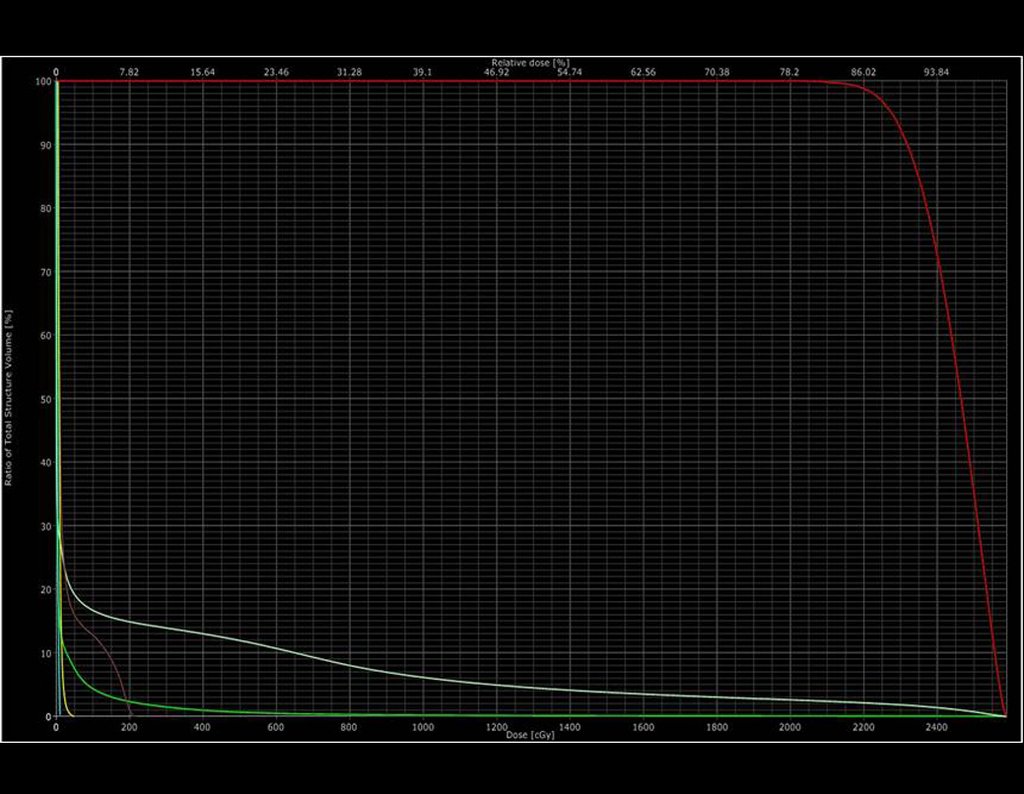
2- Dosis recetada: 2000 cGy en una sola fracción
3- Energía: 15MV
4- Técnica: 3D
5- Dosis máxima en PTV: 2362 cGy
6- Dosis mínima: 1808 cGy
7- Dosis mediana: 2195 cGy
Las figuras 26 c a 26 j documentan el tratamiento adyuvante instituido.
En la evaluación ortopédica en este momento el paciente no presentó síntomas significativos.
Se consideró el corto período de tratamiento con radioablación y quimioterapia, así como el riesgo de fractura.
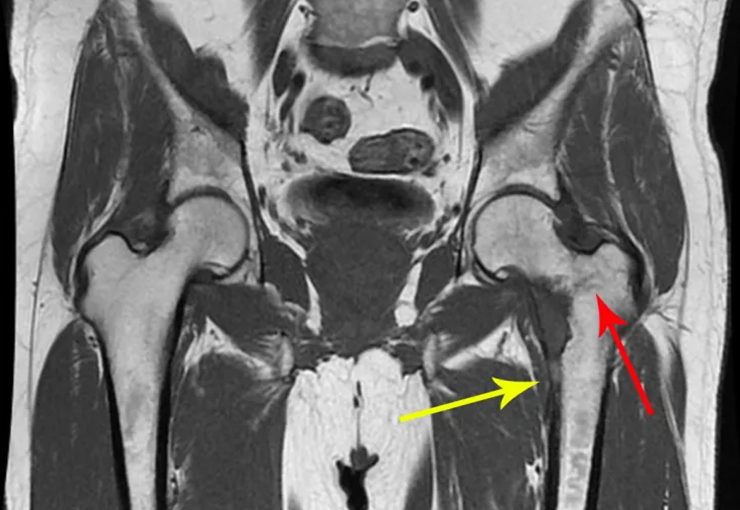
La irrigación medular del cuello femoral en adultos es retrógrada, desde la metáfisis hasta la epífisis. La principal irrigación de la epífisis es a través de la arteria circunfleja posterior, que puede haber sido la vía de diseminación metastásica e incluso puede estar comprometida. Para colmo, el cuello femoral tiene un periostio muy débil, con poca capacidad de regeneración ósea, lo que es la causa de muchos fallos en la consolidación ósea cuando se producen fracturas en esta región.
Junto con el paciente y su familia decidimos esperar, tratando de darle más tiempo y oportunidad a la reparación ósea. Optamos por reevaluar en julio, con nuevas pruebas de imagen, prestando atención a los síntomas.
Posponer la cirugía es una decisión difícil. La expectativa y la ansiedad son compartidas y experimentadas por todos.
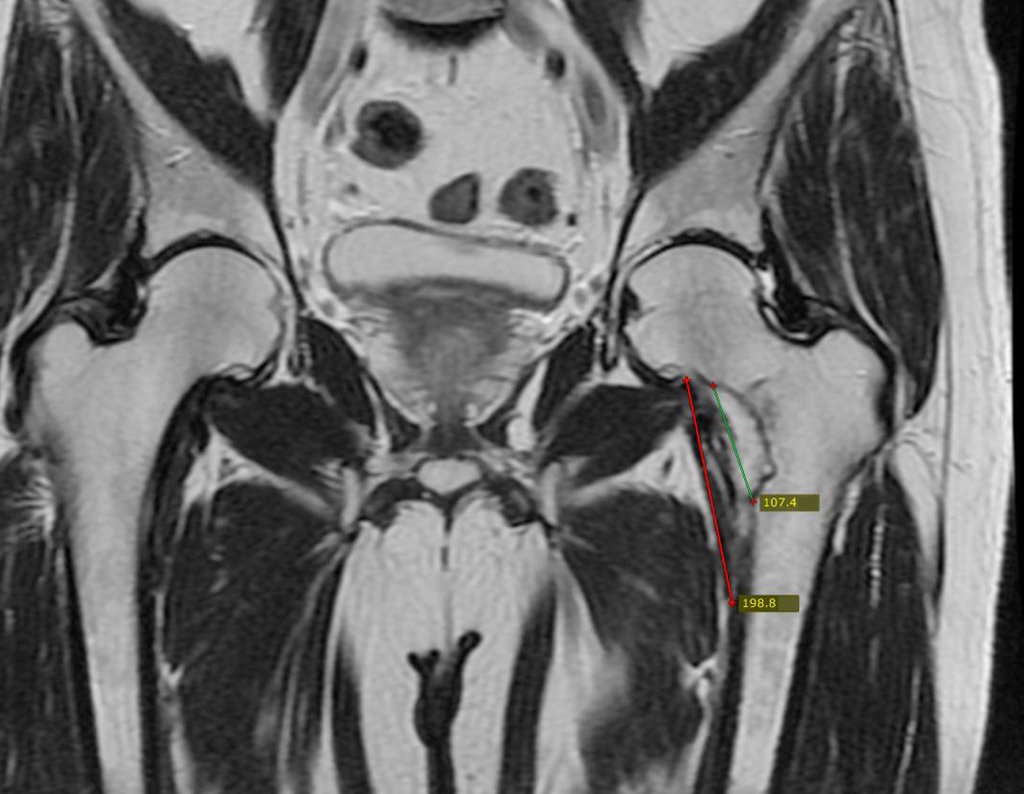
El paciente regresa el 22 de julio de 2015 quejándose de dolor al pasar de sentado a pararse, dolor al rotar la cadera y cojera. Los exámenes de imagen, provenientes de la resonancia magnética del 18 de julio de 2015, se analizan en las figuras 39 a 59.
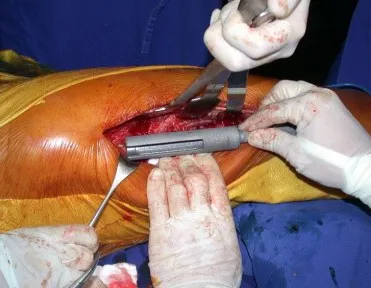
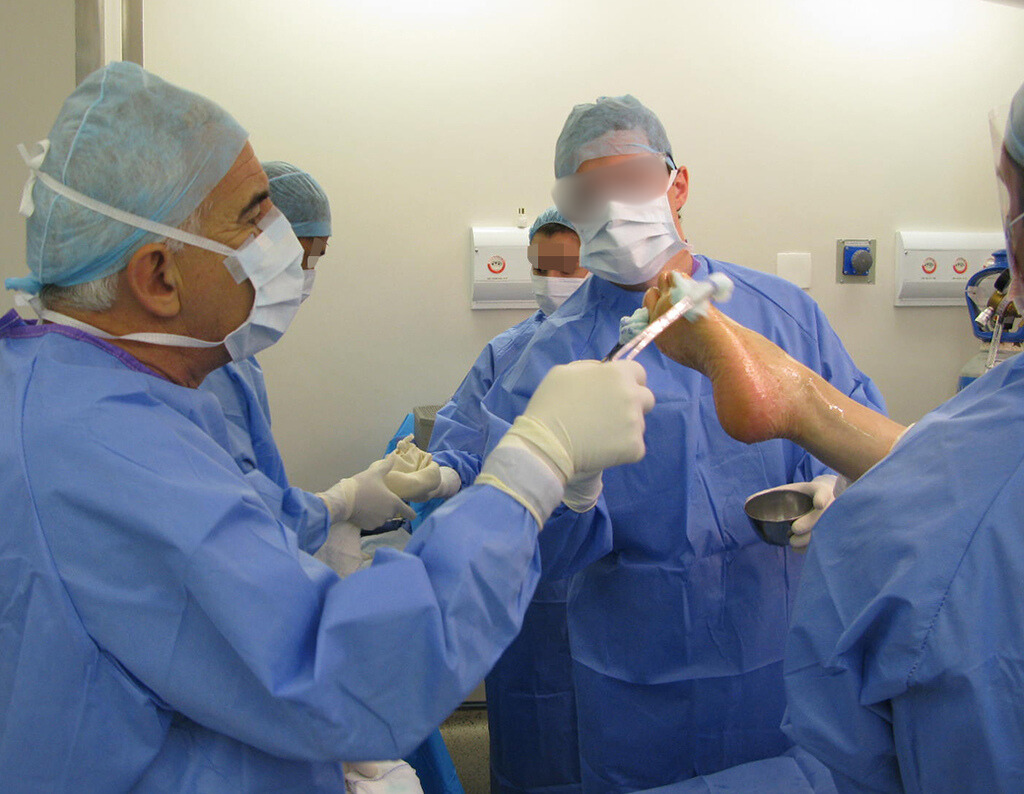
La cirugía debe realizarse con precaución, profundizando la incisión poco a poco , para lograr la hemostasia por capas . Una anestesia adecuada no debe inducir hipotensión , ya que es la única forma en que el cirujano puede observar adecuadamente los capilares seccionados y asegurarse de que está realizando una operación sin pérdida de sangre, ni en ese momento ni en un momento posterior.
En las cirugías oncológicas, el cirujano no puede tener mano “pesada”. El paciente ya está debilitado por la enfermedad, por la quimioterapia, posiblemente ya haya recibido transfusiones y se debe evitar la necesidad de reposición de sangre. El garroteo no debe utilizarse excepto en cirugías de amputación.
Durante la anestesia el paciente no puede sentir dolor. No basta con estar sedado, ya que si hay dolor aumenta la presión, dificultando la hemostasia con electrocauterio.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
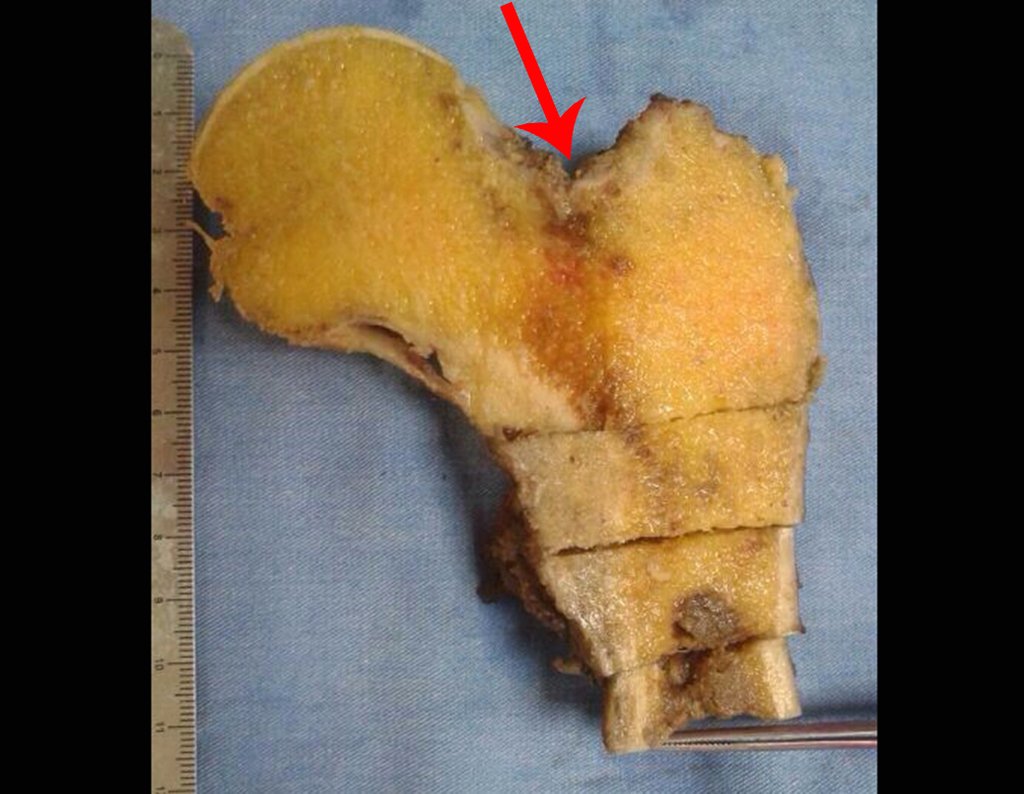
Metástasis en el fémur por carcinoma de mama masculina. Los autores describen un caso de fratura patológica debido a metástasis ósea de carcinoma de mama masculino. El paciente tenía un nódulo mamario en el lado derecho con una historia de seis años, que no fue diagnosticado cuando fue tratado por una fractura de fémur hace ocho meses. Se destaca en este trabajo la importancia de realizar un examen físico completo y cuidadoso. De esta manera, se puede evitar el diagnóstico tardío de neoplasias y metástasis óseas. Se evidencia la importancia de considerar el cáncer de mama en pacientes con fracturas patológicas, incluso en hombres. Se presenta este caso debido a que es una enfermedad rara en hombres. También se mencionan los aspectos generales del tratamiento de las metástasis óseas.
Metástasis en el fémur por carcinoma de mama masculino.
INTRODUCCIÓN
El cáncer de mama es una neoplasia que se origina más frecuentemente en los conductos excretores de la glándula y también en sus ácinos. Ocupa un lugar destacado como causa de muerte en la mujer, pero es muy raro en el hombre. Por cada 100 casos de cáncer de mama, solo uno es del sexo masculino. Ocurre en la edad adulta, generalmente por encima de los 50 años. Debido a la escasez de parénquima mamario en el hombre, el cáncer se infiltra más rápidamente y puede adherirse a la piel con ulceración. Se comporta de manera similar a los carcinomas ductales invasivos en la mujer, pero generalmente presenta menos desmoplasia. La diseminación es similar a la de la mujer, con metástasis tempranas en los ganglios axilares. Las metástasis en los pulmones, cerebro, huesos y hígado también son frecuentes, a través de la vía hematogénica. El fémur es el hueso más afectado. El objetivo de este trabajo es informar un caso raro de metástasis ósea de carcinoma de mama masculino, debido a su rareza y propensión a diagnósticos erróneos.
REPORTE DEL CASO
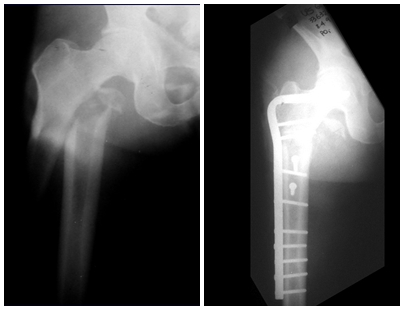
Un paciente masculino de 69 años de edad llegó al departamento de Ortopedia y Traumatología de la Santa Casa de São Paulo después de una caída al suelo hace cuatro horas, con dolor y disfunción del miembro inferior derecho. Se observó acortamiento y deformidad con rotación externa del miembro inferior derecho en la admisión. No se observó ninguna otra anormalidad en el examen físico en ese momento. En la radiografía en proyección anteroposterior de la pelvis y lateral de la cadera derecha, se observó una fractura oblicua larga sin conminución u otra lesión ósea en la región subtrocantérea del fémur derecho. Los análisis bioquímicos y hematológicos de sangre, las radiografías de tórax y el electrocardiograma fueron normales. El paciente fue sometido a reducción anatómica y osteosíntesis de la fractura con una placa angular de 95°.
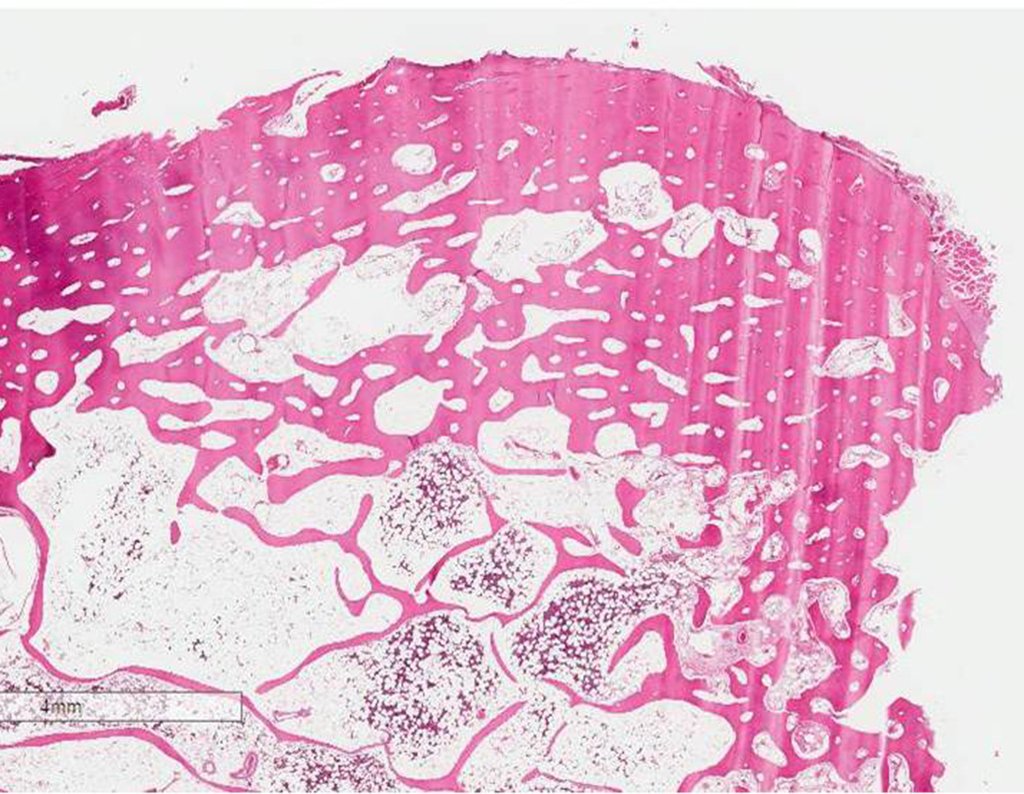
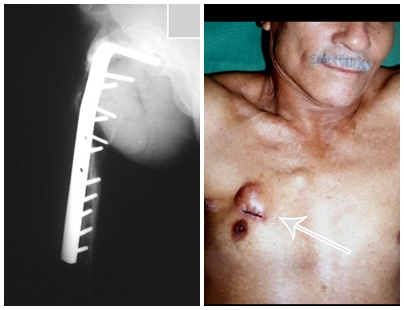
O paciente fue sometido a una biopsia por trocar de la lesión en el fémur y una biopsia incisional de la masa en la mama. Los resultados de los exámenes anatomopatológicos fueron los siguientes: metástasis de adenocarcinoma en el fémur y carcinoma ductal infiltrante en la mama. Se realizó la resección del tercio proximal del fémur derecho y la colocación de una endoprótesis no convencional de Fabroni. La evolución en el postoperatorio inmediato fue satisfactoria. Dos semanas después de la cirugía, el paciente comenzó la quimioterapia con ciclofosfamida, fluoracilo y farmorubicina con el fin de facilitar la resección de la mama y el vaciamiento ganglionar. Actualmente (seis meses después de la operación), el paciente, aún en tratamiento de quimioterapia, presenta cojera con el apoyo de muletas, examen neurológico normal y la siguiente movilidad de la cadera derecha: flexión de 90°, extensión de -15°, abducción de 30°, aducción de 20°, rotación externa de 60° y rotación interna de 0°.
DISCUSIÓN
El cáncer de mama masculino, además de ser raro, es altamente agresivo, con metástasis tempranas en los ganglios linfáticos axilares. Según un estudio realizado por Gallardo et al. en 303 casos de metástasis ósea por cáncer de mama, solo el 1,33% correspondió a pacientes masculinos. No se ha encontrado en la literatura un tratamiento específico para el carcinoma de mama masculino. El tratamiento para la metástasis ósea del cáncer de mama, cuando no hay inminencia de fractura, es principalmente la quimioterapia y la radioterapia. Algunos estudios han investigado la eficacia de diferentes regímenes de quimioterapia en el alivio del dolor óseo en pacientes con metástasis ósea de cáncer de mama. En cuanto al tratamiento de la fractura patológica, se consideran factores como la edad, el estadio de la enfermedad primaria, el tamaño de la metástasis y el estado general del paciente al elegir el mejor tratamiento. En pacientes con un estado general grave o una gran extensión tumoral, cuando las opciones quirúrgicas son muy limitadas, el tratamiento puede ser expectante. Si el paciente está en condiciones de someterse a una cirugía, pueden realizarse diferentes procedimientos, como la reducción y osteosíntesis con placa y cemento óseo, la resección de la lesión y la colocación de una endoprótesis no convencional para permitir el retorno precoz a la deambulación, o incluso la amputación en casos extremos. Es importante destacar la importancia del examen físico completo en todos los pacientes para evitar pasar por alto, como en este caso, una tumoración en la mama de varios años de evolución. Un examen físico minucioso, incluso en casos en los que no se sospecha una fractura patológica, puede permitir un diagnóstico precoz de la lesión, mejorando así el pronóstico. También es importante considerar el carcinoma de mama como un tumor primario en el diagnóstico diferencial de las lesiones óseas sugestivas de metástasis en hombres.
Haga clic aquí para ver el caso de metástasis de hipernefroma, tratado antes de fracturarse
REFERENCIAS
1. Carnelase, P.G.: “Malignant tumors of bone”, in Crenshaw, A.H.: Campbell’s operative orthopedics, St. Louis, Mosby Year Book, 1992. Cap. 10, p. 263-190.
2. Gallardo, H., Gonzales, R. & Astagno, A.: Metastasis osea del cáncer de mama. Bol Acad Nal Med Nal 66: 459-471, 1988.
3. Campanacci, M.: Tumori delle ossa e delle parti molle, Bologna, Aulo Gaggi Editore, 1981. p. 456-512.
4. Pendleburg, S.C., Bilous, M. & Langlands, S.A.: Sarcomas following radiation therapy for breast cancer: a report of three cases and a review of the literature. Int J Radiat Oncol Biol Phys 31: 405-410, 1995.
5. Robins, S.L. & Cotran, R.S.: “Mama”, in Patologia estrutural e funcional, Rio de Janeiro, Interamericana, 1986. Cap. 27, p. 1158-1168.
6. Saez, R.A., Slease, R.B., Selby, G.B. et al: Long term survival after autologous bone marrow transplantation for metastatic breast carcinoma. South Med J 88: 320-326, 1995.
7. Sanoo, H., Shimozuma, K., Kurebayashi, J. et al: Systemic therapy pain relief and quality of life of breast cancer patients with bone metastasis. Gan To Kagaku Ryoho 22 (Suppl): 10-15, 1995.
AUTORES: PEDRO PÉRICLES RIBEIRO BAPTISTA, JOSÉ DONATO DE PRÓSPERO, FLORINDO VOLPE NETO, MARCOS SANMARTIN FERNANDEZ, NABIL ABISAMBRA PINILLA
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com