Condrosarcoma y Chondroma. Para una mejor comprensión del diagnóstico diferencial de chondroma y condrosarcoma de grado I, vamos a discutir el caso:
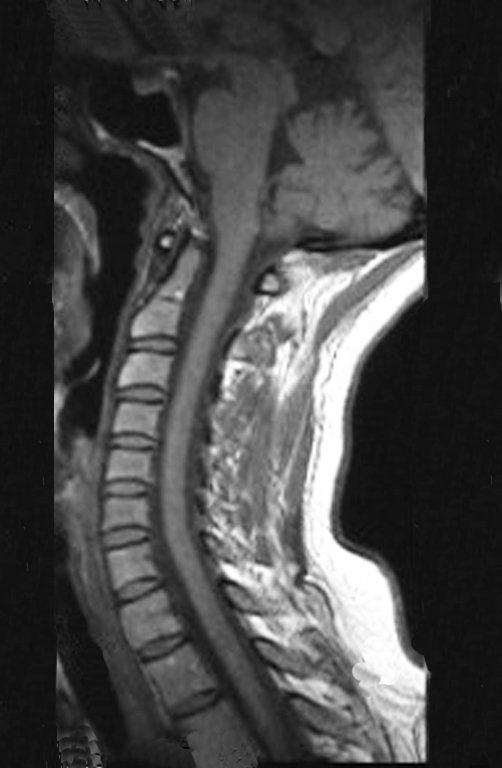
Paciente femenino de 39 años de edad, odontóloga, diestra, quien refiere dolor en hombro derecho de 8 meses de evolución. Es evaluada por facultativo quien luego de solicitar estudio radiológico indica fisioterapia para manejo de cervicobraquialgia. (Figura 1). No obtiene mejoría clínica y se solicita estudio de Resonancia Magnética de columna cervical sin evidencia de alteración cervical. (Figura 2)
Condrosarcoma y Chondroma – Diagnóstico Diferencial, Conduta e Tratamento. Reconstrução do Úmero com Endoprótese.
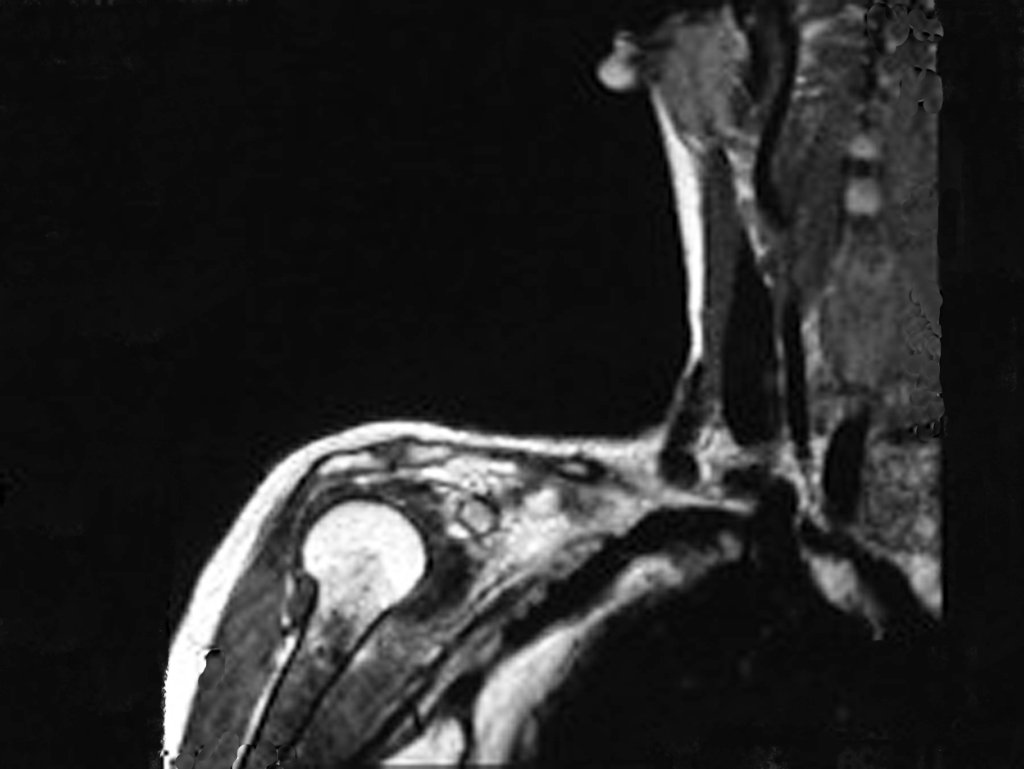
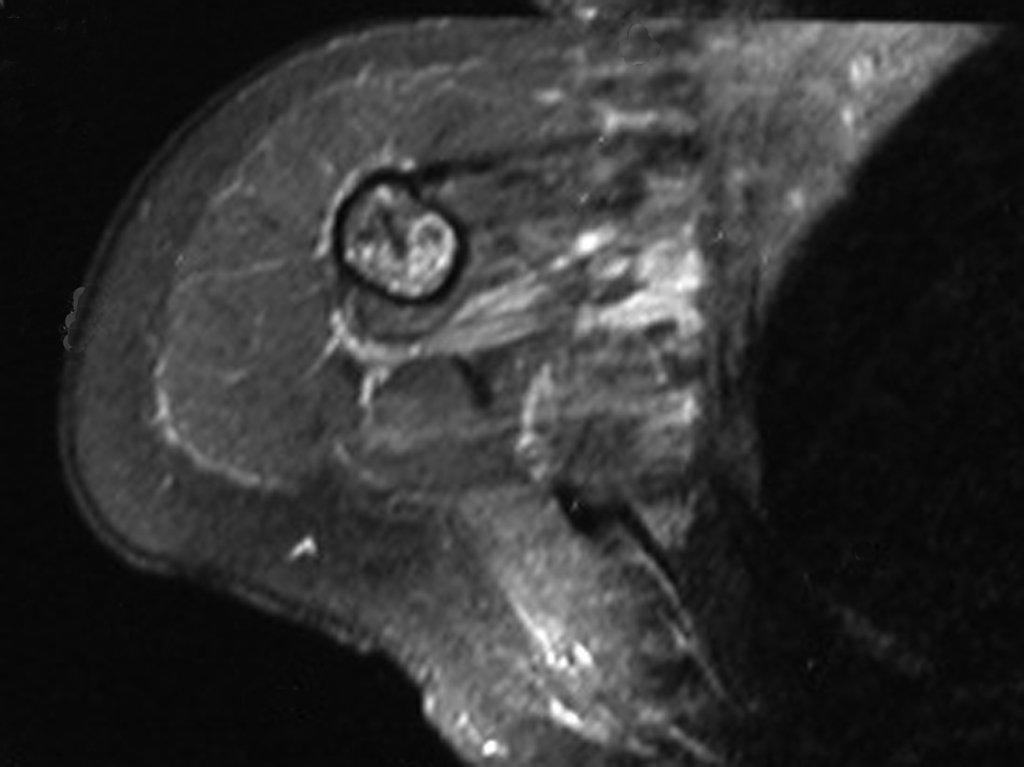
Sin embargo, el análisis de este examen evidencia como hallazgo una lesión en metáfisis proximal del húmero, hipointensa en T1 e Hipertintensa en T2. (Figuras 3 y 4)
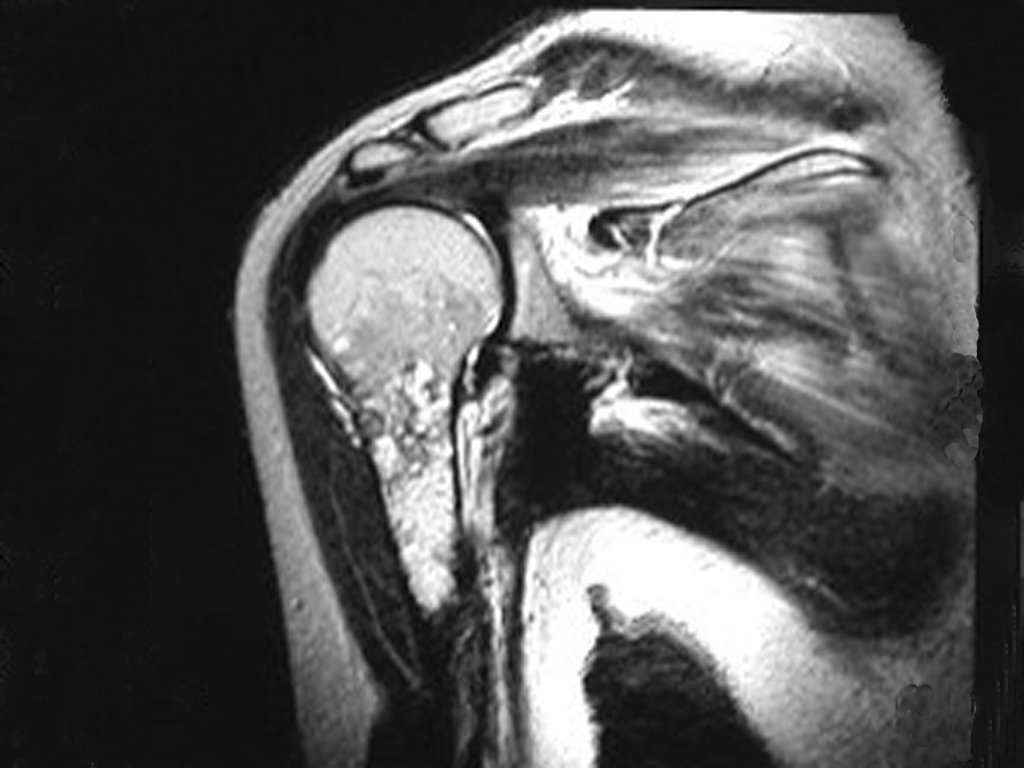
Luego de una semana se realiza nuevo estudio de resonancia magnética para evaluar este hallazgo, observando una lesión sólida, heterogénea hipointensa y de señal intermedia en T1, ocupando todo el ancho del canal endomedular (Figura 4.A). En corte sagital T1 spir, se observa erosión de la cortical interna, simulando lesiones en saca bocado (Figura 4.B).
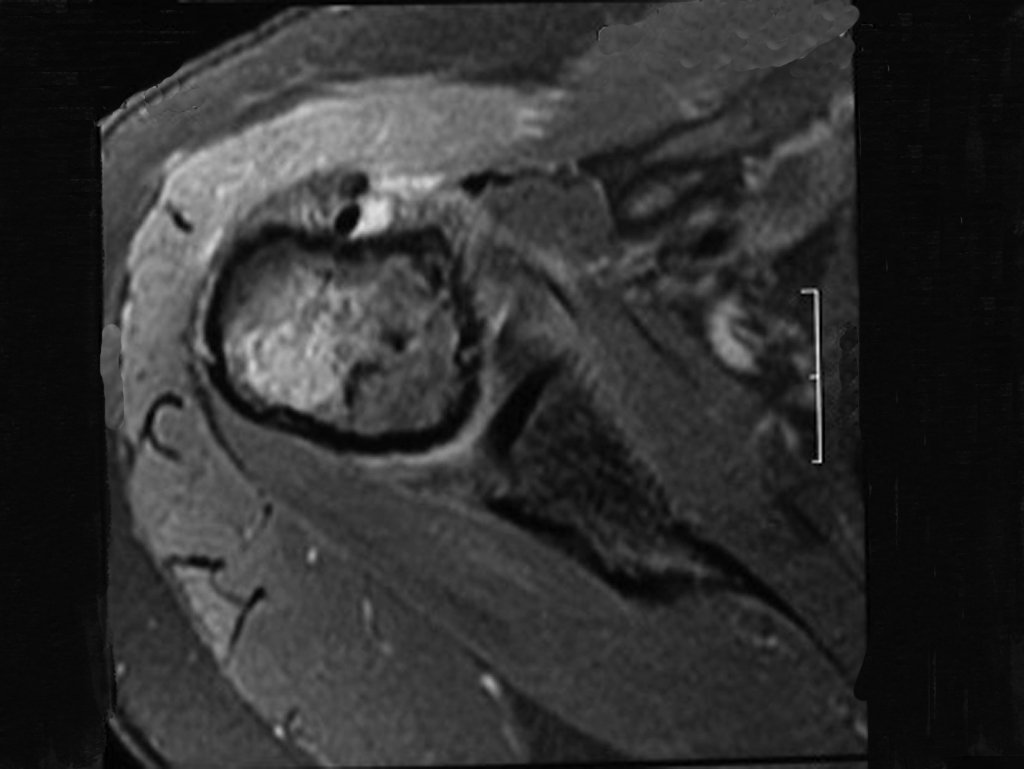
El análisis cuidadoso de las imágenes de resonancia magnética mostraba las características agresivas de la lesión, apreciando erosión de la cortical interna, áreas hipointensas e hiperintensas, heterogéneas, con captación de contraste y focos de calcificación, que son más evidentes en resonancia con densidad de protones (DP) (Figuras 5.A – 5.D).
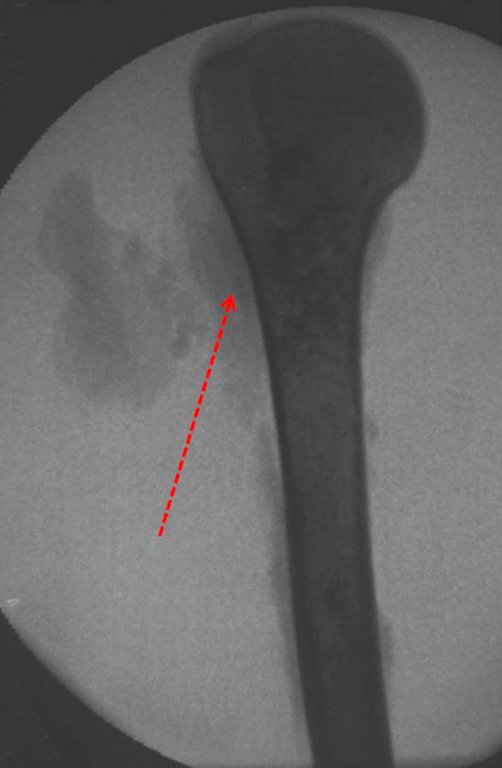
La radiografía de esta lesión se realiza el 24 de Julio de 2003, dos semanas mas tarde, destaca la presencia de esta lesión metafisodiafisiaria, ocupando dos tercios de la extremidad proximal del húmero.
Esta imagen presenta áreas de rarefacción en “saca bocado”, ensanchamiento de la medular ósea debido a erosión de la cortical interna con áreas alternas radiopacas de aspecto algodonoso que sugieren focos de calcificación (Figura 6,A).
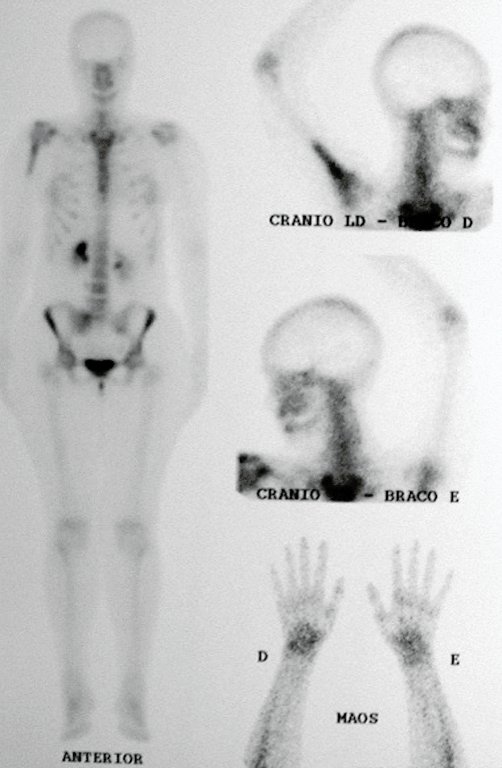
Después de este hallazgo fue referida a médico oncólogo el cual solicita estudios complementarios para estadiamiento de la lesión. Se realiza centellografía observandohipercaptación leve en húmero derecho. (Figura 6.B)
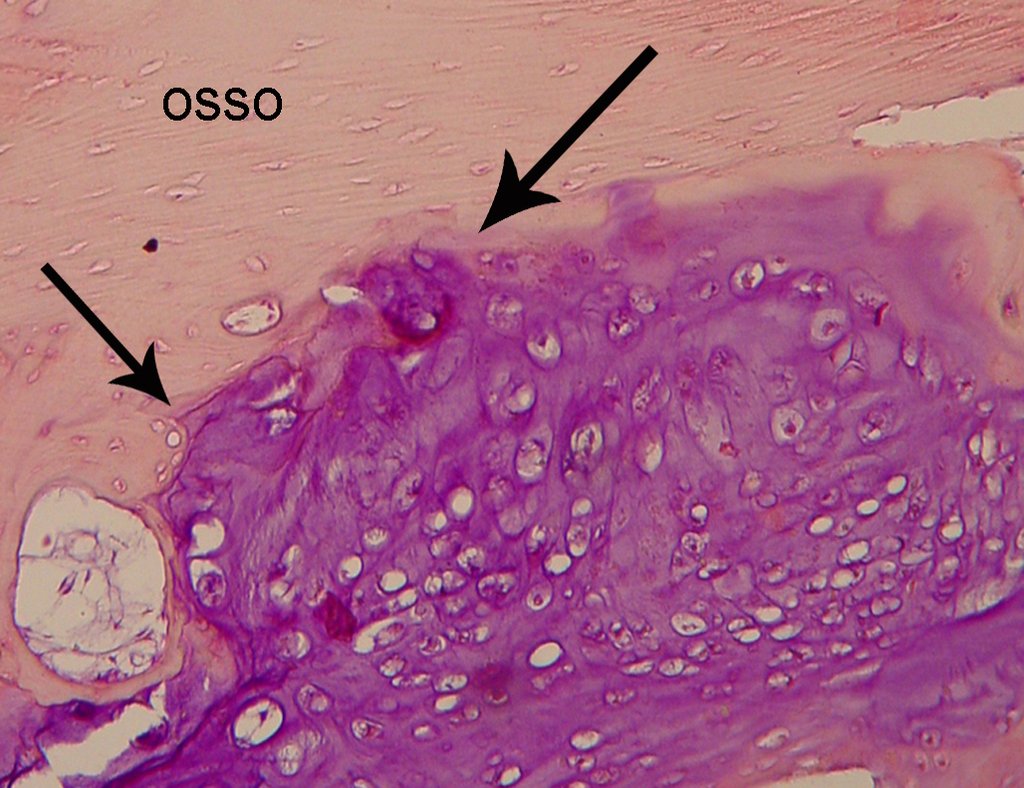
Fue entonces realizada la biopsia del húmero que reporta tejido cartilaginoso, sin atípias, y en cuyo informe sugirien nueva biopsia. (Figura 7).
Con un cuadro clínico de dolor en hombro y hallazgo de imagen de lesión agresiva con focos de calcificación surge la hipótesis de Condrosarcoma. En esta ocasión los diagnósticos diferenciales de condroma y mas remotamente de infarto óseo deben ser descartados debido a las siguientes considereciones:
- El paciente acudió al medico debido a dolor de carácter progresivo, no fue un hallazgo casual.
- La radiografía muestra ensanchamiento metafisiario, erosión cortical interna y focos de calcificación que asociados con el cuadro clínico indica que se trata de una lesión activa, con agresividad local que apunta a un diagnóstico de condrosarcoma.
- Los cortes de RMN aportan los datos de imagen que complementan el análisis apuntando a un mismo diagnóstico.
- La biopsia revela tratarse de “tejido cartilaginoso”, no se justifica realizar una nueva biopsia en esta situación.
Una nueva biopsia sería académica, pues el diagnóstico histológico entre condroma y condrosarcoma de grado I es muchas veces difícil, y el tratamiento en este caso es la cirugía. Como sabemos que la cirugía es el único tratamiento que puede curar el condrosarcoma, este caso debe ser abordado y tratado como un condrosarcoma, independientemente de un eventual diagnóstico de condroma previo por biopsia. La biopsia puede tener indicación apenas para confirmar que se trata de una lesión cartilginosa.
El primer médico opto por realizar una biopsia con aguja de JamShidi. El resultado del examen anatomopatológico fue una lesión cartilaginosa sin atipias. Preocupado con la imagen agresiva de la lesión no sintió seguridad en tratar el caso como un condroma ni de asumir la conducta de tratar como un condrosarcoma. Propuso al paciente observación durante dos meses.
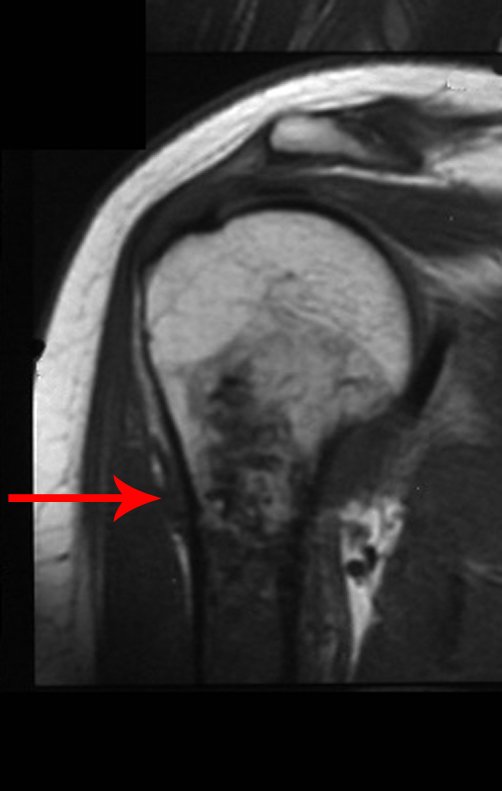
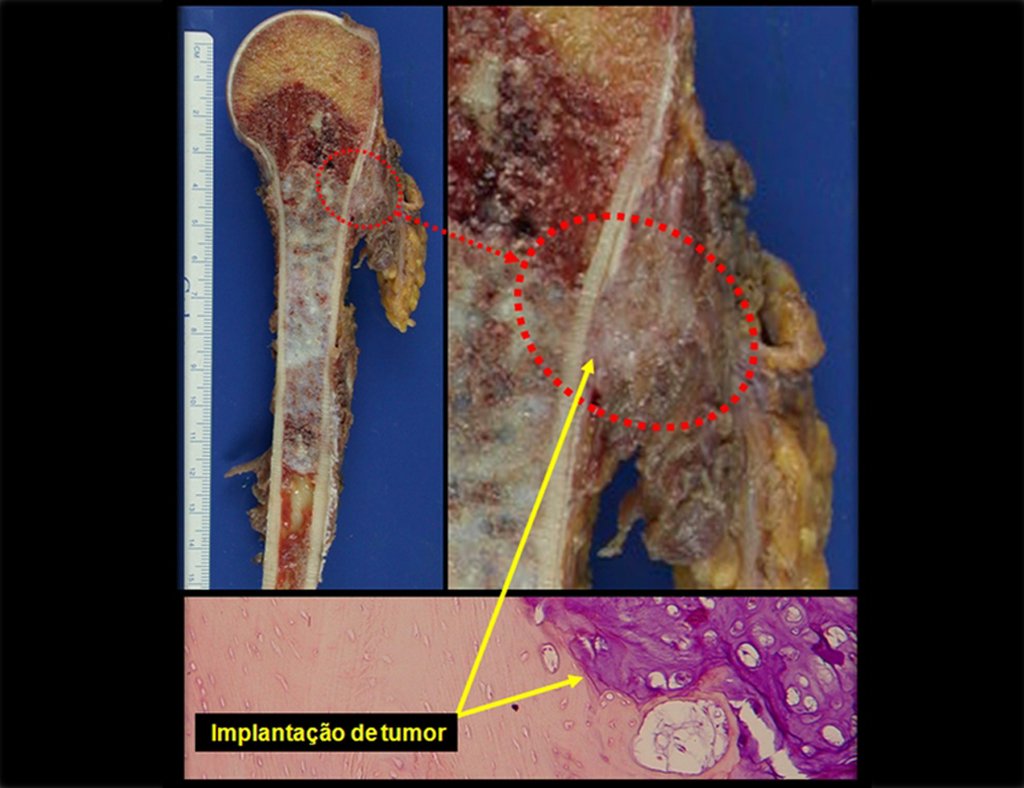
Luego de este tiempo el paciente regresa con el mismo cuadro clínico. El medico solicita nueva RMN observando los mismos aspectos anteriores y el trayecto de la biopsia ahora presenta un tumor extracortical contaminando todo el tejido subcutáneo (Figuras 8.A, 8.B, 8.C y 9).
Después de este último examen el médico propone realizar una nueva biopsia. El paciente decide consultar con otro profesional buscando una segunda opinión y nos consulta.
El especialista en oncología ortopédica debe concluir el diagnóstico y definir la conducta en este momento. No debe realizar nueva biopsia, pues ¿que conducta tomará si la biopsia no es concluyente para condrosarcoma?¿qué hacer si es condroma?
Con datos clínicos que revelan dolor de carácter progresivo, estudios de imagen con lesión agresiva localque incluyen análisisanatomopatológico de lesión cartilaginosa, el especialista tiene todos los parámetros paraindicar el tratamiento de esta lesión como condrosarcoma , pues el diagnóstico histopatológico entre condroma y condrosarcoma de grado I es difícil y a veces controversial. (Figura 10 y 11).
La misma lamina presentada al mismo patólogo después de algún tiempo puede ser interpretada como transformación de condroma a condrosarcoma grado I o de condrosarcoma grado I a condroma. Aun presentando esta lamina a distintos anatomopatólogos, podemos obtener los dos diagnósticos diferentes.
Sabemos que el diagnóstico final de estos tumores debe tener correlación CLINICA-RADIOLÓGICA y ANATOMOPATOLÓGICA. El patólogo generalmente solo analiza la lamina, y quien esta manejando el caso dispone de todos los datos, por tanto debemos evaluar los exámenes de imagen y todo el cuadro clínico en esta situación.
Luego de estas consideraciones, el tratamiento quirúrgico se impone. El condrosarcoma no responde a quimioterapia ni a radioterapia. Puede curarse con la resección quirúrgica con margen oncológico, pues lamentablemente progresa localmente cuando este margen no se obtiene. La recidiva puede ocurrir de forma desdiferenciada, invadiendo los tejidos adyacentes que dificultan o impiden la cirugía de salvamiento del miembro, y además propicia la aparición de metástasis.
No se puede perder la oportunidad de curar esta lesión con la cirugía adecuada
El análisis cuidados de las imágenes de este caso indica la necesidad de una resección amplia con márgenes y sustitución por prótesis no convencional.
Esta contraindicado el curetajeintralesional aun con adyuvancia local o relleno con cemento, pues la recurrencia a una desdiferenciación es frecuente con esta conducta.
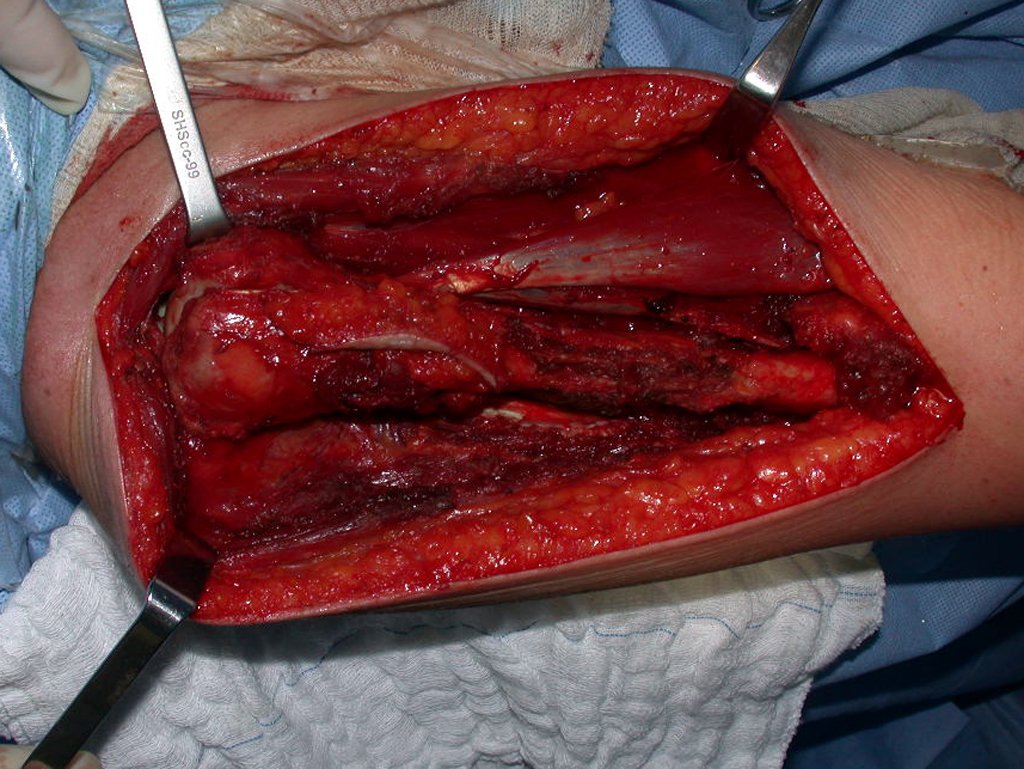
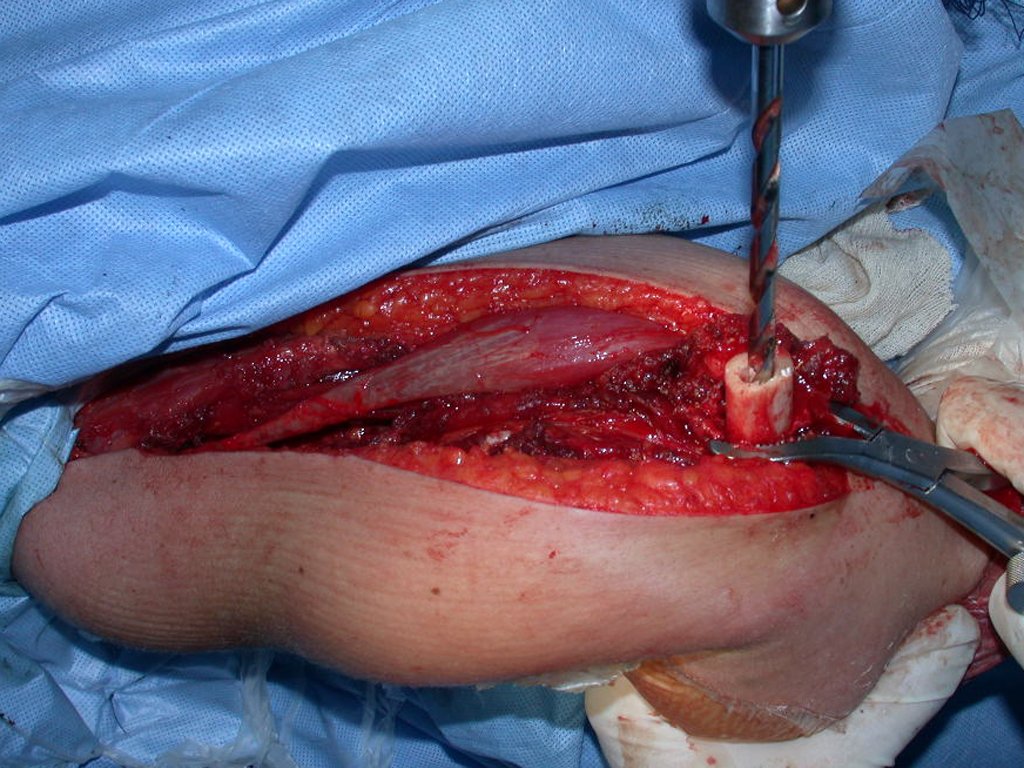
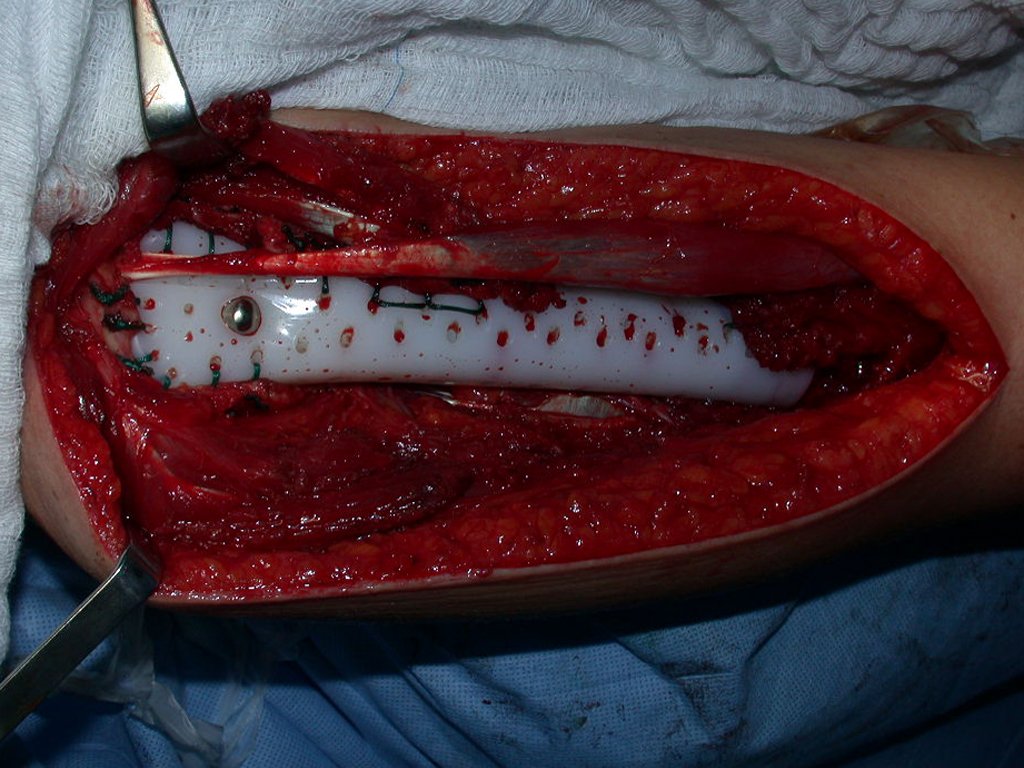
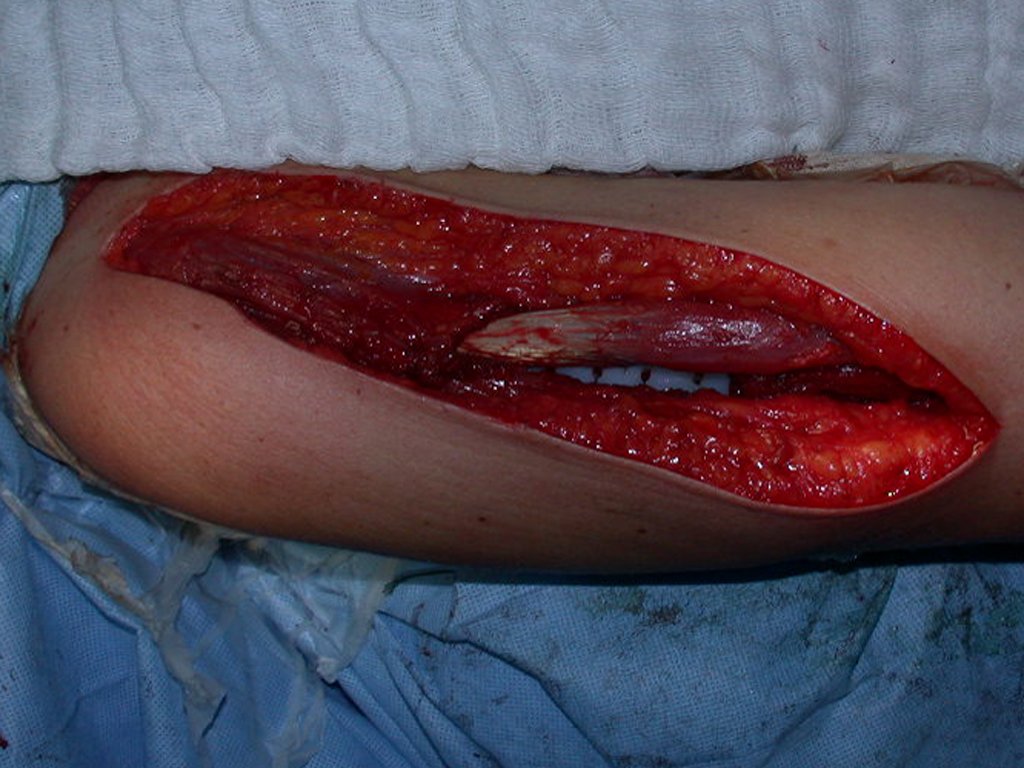
Después de explicar esto al paciente, realizamos la cirugía de resección de los dos tercios proximales del húmero incluyendo el trayecto de la biopsia, pues el condrosarcoma puede también implantarse en los tejidos blandos, y esto ya estaba ocurriendo en el trayecto de la biopsia de este caso.
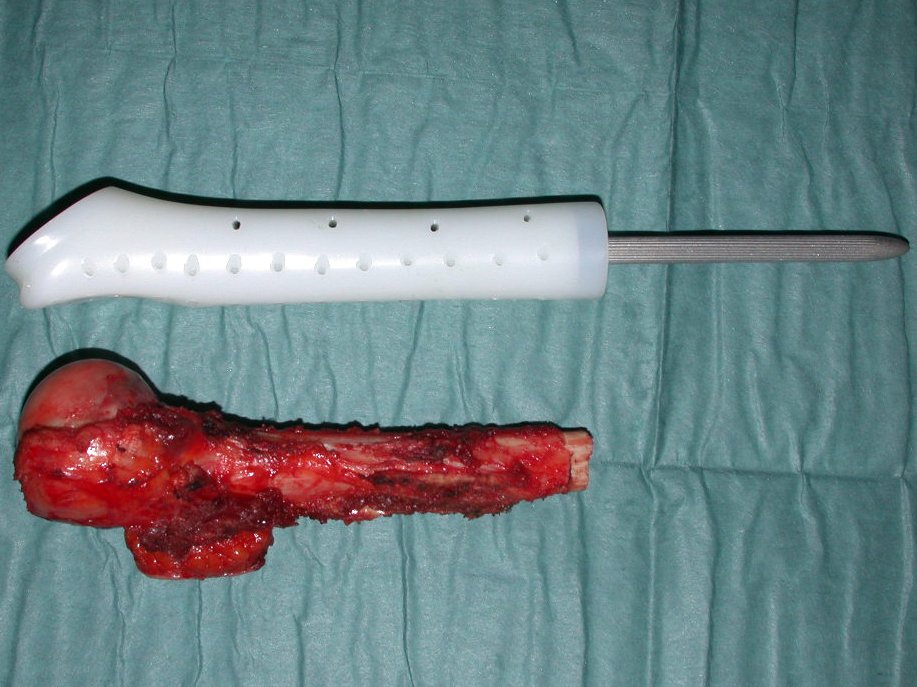
Para reconstruir el húmero empleamos una prótesis no convencional de polietileno. Estas son mas livianas que las metálicas, tienen elasticidad semejante a la ósea y permiten la realización de orificios donde fuese necesario para la reinserción de los ligamentos y músculos remanentes. Alrededor del polietileno ocurre una reacción fibrótica que envuelve la prótesis y fija definitivamente los tejidos blandos reinsertados.
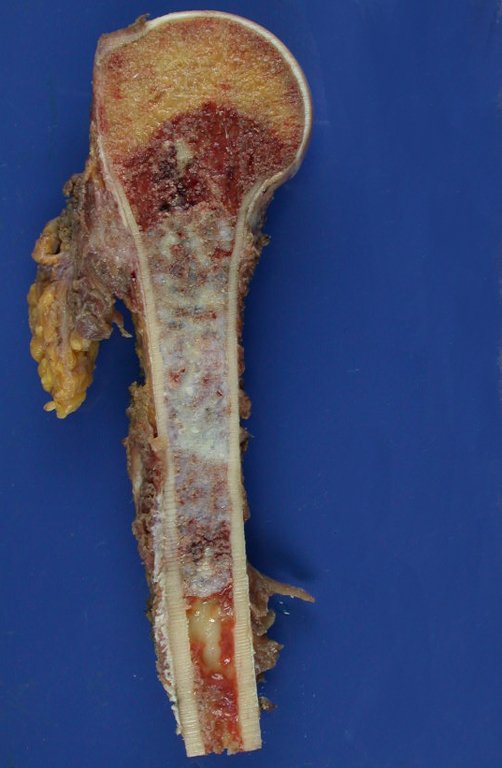
En detalle presentamos los pasos de la cirugía, la reconstrucción con la endoprotesis y la anatomía patológica de la pieza (Figuras 12 a 23)
La cirugía oncológica debe estar dirigida inicialmente a la resección con márgenes adecuados disminuyendo las posibilidades de recurrencia local. Conseguido este objetivo se debe realizar la mejor reconstrucción para restaurar la función lo mas parecido a lo normal. Con las prótesis no convencionales realizadas para reconstrucciones tumorales no podemos esperar la misma función que dan las prótesis convencionales utilizadas en artrosis y otras indicaciones , ya que en estos casos tenemos perdida mayor o menor de músculos y tejidos blandos sanos resecados por la necesidad de obtener márgenes oncológicos.
La fisioterapia orientada por profesional que conozca la cirugía es fundamental para conseguir buenos resultados funcionales (Figuras 24 a 27).
Podemos observar la función dinámica tres años después de la cirugía (Video 1)
Después de año y siete meses la paciente no presenta ninguna queja. Se apoya de forma relajada en la poltrona sobre el codo derecho del brazo operado (Figura ), consigue elevar la mano hasta la boca (Figura), buena rotación interna (Figura)
La paciente presenta buena función y ejerce muy bien sin ninguna dificultad sus actividades profesionales. (Video 2 )
REVISIÓN:
El condrosarcoma es el tumor maligno primario de hueso más frecuente después del osteosarcoma (23,24). El subtipo central es el más común y su incidencia es cinco veces mayor que el periférico (3), siendo raros los subtipos de células claras y mesenquimal (2).
El en grado I no ocurre metastasis y és uno sarcoma pues és de naturaleza mesenquimal, portanto no se trata de cancer, que és derivado del tejido ectodermico. El condrosarcoma és el tumor ósseo maligno mas frequente después del osteosarcoma e del sarcoma de Ewing.
Surge normalmente en los huesos de origen endocondral y principalmente en la raíz de los miembros (hombro,pelvis, costillas y esqueleto axial (1) siendo raros los de origen membranoso (24,11,15,14). Son de crecimiento lento y el paciente muchas veces busca tratamiento cuando la lesión es de grandes proporciones. Este tumor puede aparecer a cualquier edad con predominio entre los 30 a 40 años (7,11,22), con referencias en la literatura desde los tres años (15) hasta los setenta y tres años de edad (1).
Es una neoplasia maligna de naturaleza mesenquimal, productora de sustancia intersticial y células que asumen aspecto de cartílago hialino, con variados grados de inmadurez y focos de calcificaciones frecuentes pudiendo ocurrir en diferentes lugares.
Pueden ser clasificados en cuanto a su Localización: A- central, B- cortical (parostal o periostal)(23,2,24,6,3), C- periférico ( o exofítico, que recorre la capa cartilaginosa de un osteocondroma) (28) y D-de tejidos blandos (13); en cuanto a la histología: A- grado de anaplasia: clasificadas en grados I,II, y III, B- desdiferenciado, C- mesenquimal y D- células claras; en cuanto a su origen:1- primario y 2- secundario que se origina localmente en una lesión benigna preexistente como la enfermedad de Ollier (encondromatosis) o el Sindrome de Maffuci , la transformación a condrosarcoma es frecuente (20 a 30%) (2,28), pudiendo ocurrir a partir de osteocondroma solitario (en menos de uno %) o múltiplo (10%) (2) y más raramente secundario a enfermedad de Paget.
El dolor puede ser un síntoma insidioso durante varios años, evoluciona con crecimiento lento, aumento de volumen, restricción de la movilidad quedando a veces la piel ruborizada y caliente. El primer síntoma muchas veces es la fractura del hueso patológico.
La radiografía muestra lesiones metafisiarias radio transparentes sustituyendo la medular ósea que se extiende a la epífisis o diáfisis, erosionando la cortical interna (lesión en saca bocado), insuflando o expandiendo la porción medular del hueso pero permaneciendo delimitada por la cortical que se engrosa.
La aparición de calcificaciones (salpicadas como nubes de algodón (5)o anillos) son frecuentes (23,2,24,13,6,28). Estas son derivadas de la degeneración del cartílago que recibe nueva vascularización o se calcifica. Este proceso es acelerado en los condrosarcomas y lento en las lesiones cartilaginosas benignas de bajo grado.
El mapeo óseo ayuda al estadiamiento de la lesión y la resonancia magnética y la tomografía son importantes para valorar la extensión intramedualrextraosea de la lesión (2).
El diagnóstico de condrosarcoma bien diferenciado presenta dificultades histológicas y los datos de la historia clínica, localización y aspectos de imagen deben ser valorados para la conclusión diagnostica y definición de la conducta adecuada (23,14,12). Los detalles histológicos de irregularidades en la disposición y el numero de células dentro de la matriz condroide, las alteraciones nucleares e hipercromasia, pleomorfismo y mitosis atípicas, cuando están situadas en los extremos de los miembros deben considerarse condrosarcomas de I grado, aunque estos mismos aspectos histológicos pueden ser encontrados en condroma benignos de manos y pies. La microscopía las descripciones son semejantes a los condrosarcomas céntricos.
Para el diagnóstico es preciso aun diferenciar las semejanzas anatomopatológicas clínicas y radiológicas con otras lesiones.
Hacer diagnóstico con el quiste óseo aneurismático, por si carácter multiloculado, con el condroma, el osteocondroma, el condroblastoma, el osteosarcomaparostal y periostal (con el condrosarcomayuxtacortical) (16), miositisosificante, fibroma condromixoide, tumor de células gigantes y linfoma no Hodgkin (23,6,28). El condrosarcoma de células claras tiene formación intralesional de hueso reactivo pudiendo confundir con el osteosarcoma. El condrosarcomamesenquimal es formado por láminas de células pequeñas redondeadas que recuerdan al hemangiopericitoma y sarcoma de Ewing (14). El condroma central de los huesos largos, el condrosarcoma y el infarto óseo son muchas veces de difícil diagnóstico, necesitando periódicamente la evaluación clínica y radiológica para el acompañamiento de la evolución de la lesión y definición de la conducta.
La biopsia muchas veces puede no ser definitiva para el diagnóstico (23,28,12)
El tratamiento del condrosarcoma es exclusivamente quirúrgico (25), debiéndose elegir una resección amplia, incluyendo el trayecto de la biopsia (21,13). La radioterapia es ineficaz (6) no controla esta neoplasia. Para los casos de III grado se puede discutir la indicación de quimioterapia con protocolo empleado para los sarcomas de grandes células de alto grado. En condrosarcomamesenquimal que presenta predominio de células pequeñas indiferenciadas, la quimioterapia discutida recae sobre un protocolo de tratamiento de sarcoma de Ewing. En ambos casos la respuesta a la quimioterapia suele ser pobre (6). El tratamiento de esta neoplasia debe ser particularizado para cada subtipo clínico.
Como complicaciones ocurren metástasis hematógenas para los pulmones (28), pueden también presentar diseminación linfática y recidiva local. Muchos condrosarcomas presentan tendencia de invasión local (14), consiguiendo tamaños enormes, tornándose inoperables y causando la muerte por esta propagación local.
La recidiva local aumenta la incidencia de metástasis pulmonares.
EJERCICIOS:
1. ¿Cuales son las características radiográficas del condrosarcoma central?
a. Osificación intra y extra medular.
b. Lesión diafisiária con rarefacción ósea y triangulo de Codman con reacción lamelar gruesa
c. Áreas de rarefacción ósea, erosión de la cortical interna y focos de calcificación.
d. Áreas de condensación ósea con reacción periostal en hojas de cebolla.
Respuesta:c) el tejido cartilaginoso es mas radiopaco que el óseo y por tanto se presenta como rarefacción ósea que provoca expansión de la medular en saca bocado de la cortical interna, provocando erosiones. Este tejido cartilaginoso en reproducción recibe brotes vasculares y el cartílago entra en regresión calcificándose.
2. ¿Cuáles son las características del condrosarcoma en la resonancia?
a. Hiper señal en T1, baja señal en T2 y captación de contraste.
b. Hipo señal en T1, hipo señal en T2 y captación del contraste.
c. Hipo señal en T1, hiper señal en T2 y sin captación del contraste.
d. Baja señal en T1, alta señal en T2 y captación del contraste.
Respuesta:d) el tejido cartilaginoso tienen señal baja e intermedia en T1. Intermedio a través del cartílago y bajo a través de los focos de calcificación. Presenta captación del contraste a través del aumento del metabolismo local debido a la neoplasia.
3. ¿Cuales son los principales diagnósticos diferenciales del condrosarcoma central?
a. Infarto óseo y condroma.
b. Osteocondroma y sarcoma de Ewing
c. Osteomielitis y T.C.G.
d. Osteosarcoma y condroblastoma.
Respuesta: a) el infarto óseo ocasiona lesión condensante en la medular ósea, mas no causa erosión de la cortical interna y no presenta dolor de carácter evolutivo. Generalmente es un hallazgo diagnostico en una radiografía ocasional. El mismo ocurre con el condroma que no evoluciona y representa apenas restos cartilaginosos de desarrollo.
4. ¿Cuál es el tratamiento indicado para el condrosarcoma central?
a. Curetajeintralesional e injerto óseo autólogo.
b. Resección amplia y sustitución con endoprotesis no convencional.
c. Curetajeintralesional, adyuvante local con nitrógeno líquido e injerto óseo homologo.
d. Curetajeintralesional, adyuvante local con electrotermia y cemento óseo.
Respuesta:b) la cirugía de resección amplia segura y tratamiento oncológico y la reconstrucción con endoprótesis que confiera el mejor restablecimiento de la función.
5. Histológicamente es difícil el diagnóstico diferencial entre:
a. osteosarcoma y granuloma eosinofilo.
b. Condrosarcoma de grado I y condroma.
c. T.C.G y sarcoma de Ewing.
d. Osteoblastoma y encondroma.
Respuesta:b) el condroma central de los huesos largos y el condrosrcoma de grado I son muchas veces de difícil diagnóstico histológico, necesitándose el respaldo radiográfico para definición y conducta.
Referencias bibliográficas:
- ACKERMAN, L.V.; SPJUT, H.J. Tumors of bone and cartilage. Atlas of tumor pathology. Washington, Air Force Inst. Pathology, 1962, fasc, 4.
- CANALE, S.T. Cirurgia ortopédica de Campbell. Barueri: Manole; 2006
- DAHLIN, D.C. Tumores óseos . Barcelona: Ediciones Toray S/A; 1982
- DORFMAN, H.D.; CZERNIAK, B. Bone tumors. St Louis, C.V. Mosby Co., 1997, cap. 7, p.410.
- EDEIKEN, J.; HODES, P.J. Diagnóstico radiológico de las enfermedades de los huesos. Buenos Aires, Panamericana, 1977, cap. 15.
- ETCHEBEHERE, M. Tumores cartilaginosos malignos: Condrossarcomas. In: Camargo O.P. Clínica Ortopédica. Rio de Janeiro: Med si; 2002. p. 753-759
- FELDMAN, F. Cartilaginous tumors and cartilage-forming tumor like conditions of the bonés and soft tissues. In: Diseases of the Skeleton System (Roentgen Diagnosis). Part. 6 – Bone Tumors, New York, Springer-Verlag, 1977,p.177.
- FLETCHER, C.D.M., Unni K.K., OMS – Merters F. (Eds.): World Health Organization. Classification of Tumors. Pathology and Genetics of Tumors of Soft Tissue and Bone. IARC Press: Lyon 2002.
- GREENSPAN, A. Radiologia ortopédica. Rio de Janeiro: Guanabara; 2001.
- HENDERSON, E.D.; Le PAGE, G. A. Apud FELDAMAN, F. Cartilaginius tumors and cartilage forming tumor like conditions of the bone and soft tissues. In: Disease of the Skeletal System (Roentgen Diagnosis). Part. 6 – Bone tumors, New York, Springer Verlag, 1977, p.182.
- HUVOS, A.G. Bone tumors Diagnosis, Treatment and Prognosis. Philadelphia, W. B. Saunders Co., 1979, p. 13.
- JAFFE, H.L. Tumores y estados tumorales oseos y articulares. México: La Prensa Medica Mexicana; 1966.
- JESUS-GARCIA, R. – Reynaldo Jesus-Garcia
- LICHTENSTEIN, L. Barcelona: Talleres Gráficos Ibero-Americanos; 1975.
- LICHTESTEIN, L. Bone Tumor. 4 Ed St. Louis, C.V. Mosby Co., 1972, cap. 15.
- LICHTESTEIN, L.; BERNSTEIN, D. Unusual benign and malignant chondroid tumors of bone. Cancer, 12:1142, 1959.
- MARCOVE, R.C. Condrosarcoma: Diagnóstico y tratamiento. In: Clínicas Ortopécias de Norteamérica. Tumores del aparato musculosquelético. Buenos Aires, Panamericana, 1977, cap. 7.
- MARCOVE, R.C. et al. Chondrosarcoma of the pélvis and upper end of the femur. Na analisys of factors influencing survival time in113 cases. J. Bone Joint Surg., 54A:61, 1972.
- MARCOVE, R.C.; SHOJI, H,; HARLEN, M. Altered carbohidrate metabolism in cartilaginous tumors. Contemp. Surg. 5:53, 1974.
- McFARLAND, G.B.Jr.; McKINLEY, L.M.; REED, R.J. Dedifferentiation of low grade chondrosarcomas. Clin. Orthop., 122:157, 1971.
- MENENDEZ, L.R. Orthopaedic knowledge update: Actualizaciones en cirugía ortopédica y traumatología. Barcelona: Ars Medica; 2003.
- O’NEAL, L.W.; ACKERMAN, L. V. Chondrossarcoma of boné. Cancer, 5:551, 1952.
- PRÓSPERO, J.D. Tumores Ósseos. São Paulo, Roca, 2001, cap. II.
- ROBBINS. Patologia estrutural e funcional. Rio de Janeiro: Guanabara; 1996.
- ROMSDAHL, M.; EVANS, H.L.; AYALA, A.G. Surgical treatment of chondrosarcoma. In: Managment of primary bone and soft tissue tumors. Chicago, Year book med. Publisher Inc., 1977, p. 125.
- SCHAJOWICZ, F. Tumores y Lesiones Seudotumorales de Huesos y Articulaciones. Buenos Aires: Editora Médica Panamericana; 1982.
- TORNBERG, D.N.; RICE, R.W.; JOHNSTON, A.D. The ultrastructure of chondromyxoid fibroma. Clin. Orthop. Rel. Research, 95:295, 1973.
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com