Autotransplante de peroné con cartílago de crecimiento Tibialización del peroné en osteosarcoma de Tibia
Resumen
Las lesiones óseas que ocurren en la región proximal de la tibia en niños, pueden afectar la fisis de crecimiento y representan un desafio al tratamiento ortopédico para la reconstrucción del defecto óseo creado. Los métodos de reconstrución no siempre contemplan el potencial de crecimento óseo de este segmento. El objetivo de este trabajo es presentar una nueva técnica quirúrgica de reconstrucción ósea basada en la transposición de la fíbula ipsilateral con su fisis de crecimento sin la necesidad de técnicas de microcirugía y utilizando un dispositivo de fijación interna deslizante. Material y Métodos: Los autores relatan dos casos de pacientes portadores de sarcoma óseo en la región proximal de la tibia con compromiso del cartilago de crecimiento, los cuales fueron tratados por la técnica propuesta. Resultados: En ambos casos hubo consolidación ósea, hipertrofia y crecimiento longitudinal de la fíbula transportada. Conclusión: La técnica propuesta por los autores mantiene la vascularización del segmento óseo auto-transplantado, sin la necesidad de microcirugía y preservando el potencial de crecimiento fisario. El implante utilizado permitio el crecimiento longitudinal del hueso, evidenciado radiograficamente. Nível de evidencia IV. Série de casos.
Palabras claves: crecimiento, deslizante, dispositivo, fíbula, fisis, fijación, sarcoma tibialización, transplante.
Abstract
Bone lesions, which occur in the proximal tibia in children, can affect the growth plate and represent a challenge to the orthopedic treatment for reconstruction of bone defects created. Reconstruction methods do not always compensate the potential for bone growth in this segment. The objective of this paper is to present a new surgical technique of bone reconstruction, based on the transposition of the ipsilateral fibula with it’s growth plate, without the need for microsurgical technique and using a sliding internal fixation device. Material and Method: The authors report two cases of patients with bone sarcoma at the proximal tibia, affecting the growth cartilage, which were treated by the proposed technique. Results: In both cases, there were bone healing, hypertrophy and longitudinal growth of the fibula transposed. Conclusion: The technique proposed by the authors, kept the vascularization of bone segment auto-transplanted without the need for microsurgery and preserves physeal growth potential. The implant used allowed the longitudinal bone growth, as radiographically seen. Levels of evidence IV. Case series.
Keywords: growth, sliding, device, fibula, physis, fixation, sarcoma, tibialisation, transplant.
INTRODUCCIÓN
El tercio proximal de la tíbia de la población esqueleticamente inmadura, tiene una fisis de crecimiento responsable de aproximadamente el 30% de la longitud final del miembro en la fase adulta1. Esa región es tambien el segundo lugar mas frecuente de incidencia de tumores óseos primarios, después del tercio distal del fémur2.
Los tumores que surgen en la región proximal de la tibia antes de la madurez esquelética, pueden afectar la fisis de crecimiento y crear discrepancias en la longitud final de los miembros inferiores. Lo mismo puede ocurrir después de traumas o secundario a enfermedades como la osteomielitis de esta región.
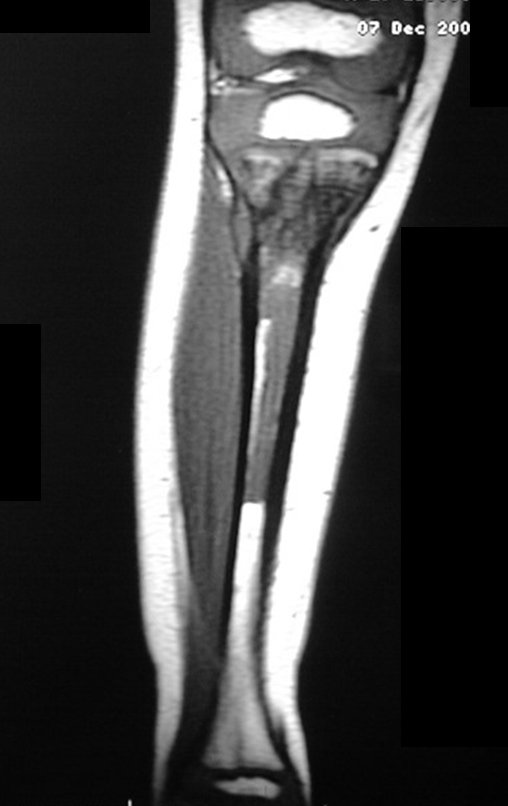
La reseción del tumor en este segmento de la tibia demanda una reconstrucción del defecto óseo generado, que por la edad, puede tener resultados insatisfactorios con métodos tradicionales, indicandose la amputación como alternativa3 (figuras 1a, 1b e 1c).
Dentro de las reconstrucciones de este segmento, podemos citar la sustitución por endoprótesis no convecional, empleo de injerto homólogo o autólogo y el trasnporte óseo 4-8.
Ninguno de los métodos arriba sustituye la fisis de crecimiento lesionada. El transporte óseo que permite el alargamiento longitudinal del hueso puede ser inviable por la necesidad del uso prolongado de fijador externo. Los pacientes oncológicos estan inmunosuprimidos por la quimioterapia adyuvante y el fijador externo favorece a las infecciones, adicionalmente pueden necesitar múltiples cirugías para la nivelación de los miembros en niños de corta edad.
El empleo de la fíbula vascularizada para cubrir los defectos óseos tomó gran impulso con el desarrollo de la técnica microquirúrgica, pues permite el uso de la fíbula contra lateral9-13.
Con la utilización del segmento proximal de la fíbula con su fisis por medio de técnicas microquirúrgicas, es posible por primera vez reconstruir las fallas óseas y restablecer el crecimiento longitudinal del hueso14. Sin embargo, exige el uso de equipos especializados, asi como materiales e intrumental especiales de alto costo, estando sujeta a diversas complicaciones.
Un hilo de Kirschner es pasado por la epifisis horizontalmente en el punto donde será hecha la fijación proximal y la posición de la placa es entonces verificada (figura 3a).
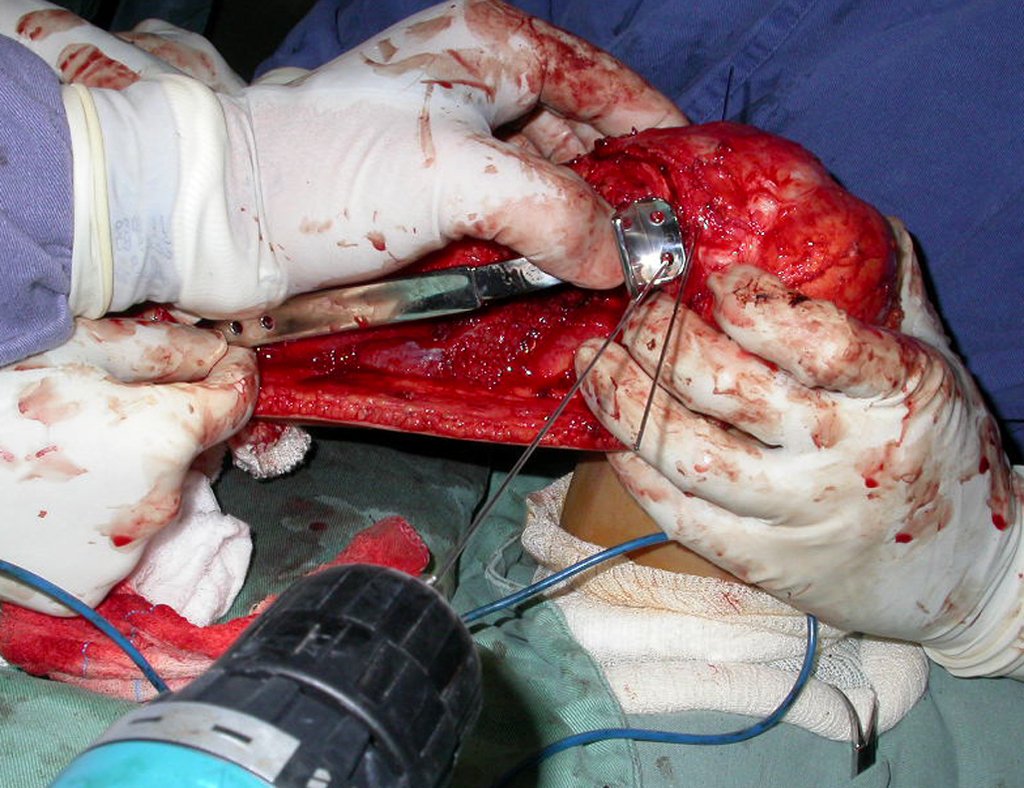
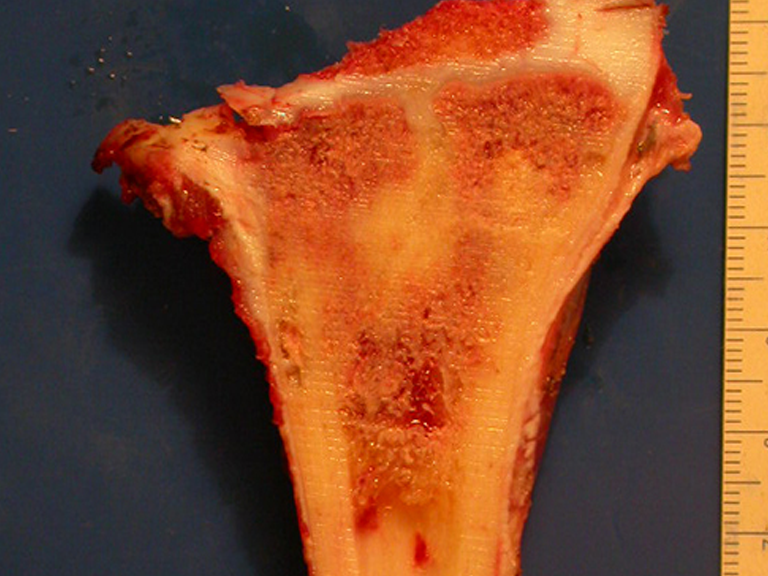
Se mide el segmento a ser resecado siguiendo el margen oncológico y se realiza la osteotomia distal de la tibia en la región diafisiaria. La musculatura posterior de esta proción es desinsertada hasta la región epifisiaria proximal. A continuación se separa la epifisis tibial del tumor por osteotomía transepifisiaria preservandose lo máximo posible el hueso epifisario con su cartilago articular y resecandose así el tumor (figuras 3b y 3c).
Para sustituir este defecto óseo, se utiliza el segmento proximal de la fíbula ipsilateral que es aislado de la articulación tibiofibular y del ligamento colateral lateral. Se realiza una pequeña desperiostización de uno a dos centímetros a la altura en donde será hecha la osteotomía de la diafisis de la fíbula (figura 4a). Después de la osteotomía, esta parte desperiostizada es clavada en la diafisis de la tibia (figura 4b).
Se traslada el segmento proximal de la fibula en conjunto con toda la musculatura y sus arterias nutricias hacia el centro de la epifisis tibial remanente y se reinserta el ligamento fibular al periostio de la tibia (figura 4c).
La osteosintesis con tornillos es realizada utilizandose el dispositivo de fijación interna extensible de Baptista, colocado en el lado medial de la pierna que es previamente confeccionado a la medida para cada caso15 (figura 4d).
La fíbula transferida fija interpuesta entre la epífisis tibial y la porción distal de la tibia.
Posteriormente se realiza reinserción de los tejidos blandos, hemostasia, colocación de drenaje aspirativo y cierre por planos. Después de la curación, el miembro inferior es colocado en una ortesis que también fue confeccionada previamente a la medida.
Esta ortesis es utilizada como tutor externo de protección hasta que la fíbula consolide y aumente su espesor para poder soportar carga (figura 6). Este periodo puede varias entre 3 a 8 meses.
Caso 1
Paciente con 12 años y 11 meses de edad, masculino, presentando osteosarcoma en región proximal de tibia derecha. Sometido a resección amplia del tumor, preservandose la epífisis proximal de la tibia. La proción proximal de la fíbula con su fisis fue trasladada medialmente para la epífisis tibial preservandose su irrigación sanguinea y la osteosintesis fue realizada con un dispositivo de fijación deslizante.
Después de la cirugía el miembro fue mantenido en una ortesis y la carga fue iniciada al cuarto mes del post operatorio cuando habian signos radiológicos de consolidación. Fueron hechos los seguimientos ortopédicos y oncológicos y la paciente retorno a sus actividades habituales siendo observada la consolidación ósea y la hipertrofia de la fíbula.
Caso 2
En el primer caso los tornillos eran bloqueados, motivo por el cual ocurrió el desvio en valgo constatado radiológicamente por la inclinación de los tornillos y clinicamente (figura 8. a-b-c). Este paciente realizo una primera escanografía de miembros inferiores al año del post operatorio, observandose crecimiento de la fíbula de 0,75 cm y la reorientación de los tornillos (figura 8. b-e).

La corrección espontanea de este desvio angular observada clinicamente y la horizontalización de los tornillos documentada radiograficamente permite confirmar el crecimiento de la epífisis fibular y el deslizamiento del dispositivo, observandose en un segundo escanograma el crecimiento de 1,2 cm (figura 8. d-e). Una segunda escanometría fue realizada a los 2 años y 2 meses del post operatorio, siendo posible observar crecimiento de 1,2 cm del segmento de la fíbula transportada (figura 8. f).
El paciente es pastor, tiene 26 años de edad y 14 años de seguimiento sin recidiva ni dolencia con los miembros nivelados y con buena función (figura 9).
Después de este período el paciente del Caso 2 presento crecimiento de aproximadamente 0,3 cm de la fíbula transposta en los primeros ocho meses después de la cirurgia, período, en que hubo seguimiento ortopédico.
El paciente fallece durante el tratamiento adyuvante, debido a complicaciones de la quimioterápia.
DISCUSIÓN
Las reconstruciones de los defectos óseos en la región proximal de la tibia, representan un desafio para el cirujano, especialmente cuando estas lesiones comprometen el cartilago de crecimiento.
La amputación transfemoral es muchas veces indicada como método de elección en niños de corta edad por la dificuldad en reconstrucción de piel y la discrepancia de longitud final de los miembros inferiores. El uso de ortesis protésica adaptada al talón de amputación, puede permitir rehabilitación precoz y autonomia de la marcha.
Este método, puede verse alterado por un importante impacto psicológico y social, devido a la mutilación de una grand articulación, com aumento del gasto energético para la ejecució de la marcha.
Las dificultades de adaptación al uso de ortesis protésica, su alto costo y la necesidad de adquirir nuevas prótesis, el largo del crecimiento del paciente, son otros aspectos negativos de la amputación.
La reconstrucción del segmento proximal de la tibia con endoprotesis no convencional es una alternativa para esos pacientes. Esta permite la preservación del miembro y la deambulación precoz. Sin embargo, tiene reportados altos indices de complicación relacionados al método, tales como infección, aflojamiento aséptico, fallas mecánicas, fracturas y limitación para las actividades físicas entre otros 4,5,16.
Otro importante punto a ser destacado es el crecimiento de los miembros, cuando el miembro operado causa dificultades de adaptación a la endoprótesis o cuando el miembro opuesto causa discrepancia de longitud entre ellos. Jeys y colaboradores relatan una serie de 661 pacientes sometidos a endoprótesis no convencional para tratamiento de tumores óseos, entre los cuales 42% presentaron fallas del implante en 10 años de seguimiento17.
La exposición de la endoprótesis en el tercio proximal de la tibia y consecuente infección esta relacionada con la dificultad de cobertura del implante por los tejidos blandos de esa región.
Wang y colaboradores relatan la utilización del gastrocnemio y sóleo para la cobertura de la prótesis en 11 pacientes con el objeto de evitar las complicaciones. Tuvieron sin embargo 3 casos de discrepancia entre los miembros inferiores que fueron tratados con epifisiodesis contralateral18.
La técnica de transferencia de la fíbula juntamente con su fisis de crecimiento presenta una rehabilitación más lenta, especialmente para el inicio de la marcha, pues es necesario esperar la consolidación ósea entre la tibia y la fíbula transportada. Posteriormente ocurre la hipertrofia de la fíbula observada en los casos presentados y que hacen a este segmento resistente.
Este método representa una reconstrucción biológica y por lo tanto una vez que ocurre la consolidación y la hipertrófia, podemos considerarlo como método de reconstrucción definitivo realizado como una única intervención quirúrgica.
La preservación de la epífisis proximal de la tibia permite que la superficie articular de la rodilla se mantenga, esto representa una ventaja en el método, cuando la osteotomía transepifisiaria pueda ser realizada y tambien es una condición necesaria para la realización de este.
La capacidad de crecimiento longitudinal del segmento fibular transportado observado en los casos presentados también es un factor importante a ser mencionado, en vista de que se puede evitar o minimizar la discrepacia de los miembros inferiores.
Los injertos óseos también pueden ser utilizados en el tratamiento de este tipo de lesión, especialmente en los casos en que la epífisis tibial puede ser preservada y que ocurre en un 20% de los casos19.
Sin embargo, por no ser un hueso vascularizado, en el injerto puede no ocurrir integración y el método está sujeto a fallas. Podemos presentar altos indices de fracturas en la no consolidación, también de no resolver el problema de discrepancia 2.0. Existe la dificltad de obtención de gran cantidad de injerto autólogo en niños de corta edad y los injertos homólogos presentan mayor dificultad de integración, ademas de la antigenicidad.
Weitan y colaboradores relatan la utilización de aloinjerto en 15 pacientes con sarcomas óseos presentando edad media de 11,75 años , (siete de 24) en la región distal del fémur y tibia proximal donde puede ser preservada la epifisis del hueso. Tambien como resultado discrepancia de miembros en 4 pacientes, retardo de consolidación en 15 pacientes, rechazo de injerto en 2 casos, infección en 1 caso y ruptura del material de síntesis con reabsorción parcial del injerto en 1 caso7.
Campanacci y colaboradores relatan la utilización de aloinjerto osteoarticular en la reconstrucción de osteosarcomas de la región distal del fémur y proximal de la tibia en el que la superficie articular fue preservada con el tumor. Luego de 5 y 10 años de seguimiento las tasas de sobrevivencia de los injertos colocados en la tibia eran de apenas 45% y 20 % respectivamente, con mejores resultados en la región femoral6.
La transposición de la fíbula tiene como ventaja sobre el injerto el hecho de ser un colgajo osteo muscular, osea, posee vascularización y “turn over” óseo, participando activamente en la consolidación y ademas de mantener el potencial de crecimiento de la fisis.
Como puede ser observado en las figuras 7 y 8, la fíbula sufre una hipertrofia progresiva, hecho que aumenta su resistencia, al contrario de los aloinjertos los cuales pueden fallar aun después de años de la integración12,21.
La osteogenesis por distracción con fijador externo puede ser considerada como opción de reconstrucción, no necesita el uso de injerto y posibilita la complementación del fallo óseo creado por la resección del tumor por medio del transporte óseo, pero demanda un tiempo prolongado del uso del fijador externo y el riesgo de infección22.
Fang y colaboradores8 relatan 3 casos de osteosarcoma en niños de 10 a 14 años, siendo uno en la región distal del fémur y dos en la región proximal de la tibia, que fueron sometidos a resección tumoral y montaje de aparato de Ilizarov siguiendo el principio de osteogénesis por distensión. En uno de los pacientes hubo necesidad de reintervención quirúrgica por perdida de la alineación ósea. Dos pacientes tubieron consolidación ósea y el tutor fue retirado a los 8 meses. El tercer paciente fue sometido a compresión y nueva distención para alcanzar la consolidación ósea. Dos casos presentaron infección en el trayecto de los pernos del fijador. Luego de dos años de seguimiento la discrepancia entre los miembros fue de 1,0 a 1,5 cm.
La utilización de la fíbula ipsilateral para el tratamiento de las lesiones de tibia en especialmente en las secuelas de traumas surgió en 1984 cuando Hahn describio su empleo para el tratamiento de una pseudoartrosis de tibia11.
Diversas técnicas fueron descritas y la ocurrencia de consolidación ósea con hipertrofia de fíbula consagran este método como alternativa para el tratamiento de las fallas de la tibia9,10,11,12,23,24,25,26,27.
Mientras tanto los trabajos no utilizaban la región epifisiaria de la fíbula limitando su uso preferencialmente para lesiones diafisiarias de la tibia.
El desenvolvimiento de la microcirugía trajo una nueva dimensión al tratamiento de las fallas ósea.
Taylor y colaboradores describian la utilización de la fíbula para restaurar defectos segmentarios en diversos huesos, tambien de la tibia, utilizando la reconstrucción vascular microquirúrgica de la fíbula13.
Pero la necesidad de equipos de cirugía especializada, el alto costo y la posibilidad de trombosis arterial o venosa post operatoria de la microcirugía constituyen importantes desventajas en relación a las técnicas que no requieren microcirugía28,29.
La microcirugía no obstante, abrió el camino para la posibilidad de poder incluir la fisis en un colgajo óseo preservando su irrigación sanguñinea y consecuentemente el potencial de crecimiento longitudinal del segmento óseo14,30.
Sin embargo los primeros relatos de cartílago de crecimiento presentaban resultados inconsistentes o malos, siendo Straub quien relato algun crecimiento óseo en su trabajo en 1929, pues fragmentos de cartilago con o sin hueso eran usados bajo la forma de injertos31,34.
A partir de la descripción de Pho y colaboradores14, varios trabajos utilizando la tecnica de microcirugía de transposición de la fíbula con la fisis y la epifisis proximal, mostraron que el potencial de crecimiento de la fisis podia ser preservado35-38.
Estos trabajos sin embargo envuelven técincas microquirúrgicas para la reconstrucción vascular de la fíbula con las desventajas y complicaciones que el método presenta.
La técnica presentada en este trabajo tiene la ventaja de no necesitar ningun método para reconstruir la vascularización del segmento fibular con la fisis y la epifisis, pues sus vasos son preservados, tratandose de un colgajo local que es posicionado bajo la epifisis de la tibia.
Constatamos la consolidación ósea e hipertrofia de la fíbula y el crecimiento longitudinal de los segmentos transportados en los dos casos presentados. En el primer caso el paciente presentó una deformidad en valgo de la rodilla derecha en el periodo del post operatorio inmediato. Con el crecimiento que ocurre en el primer año hubo corrección tanto de deformidad en valgo como de la inclinación de los pernos, señales de crecimiento del segmeto fibular. En los proximos 14 meses hubo crecimiento de 1,2cm mas del segmento fibular transplantado, (Figura 7). Este paciente que era adolescente en la época con 12 años, ahora cuenta con 26 años de edad, esta funcionalmente bien y con los miembros inferiores nivelados.
En el segundo caso, una niña con aproximadamente tres años de edad que podria haber sido ideal para el acompañamiento del crecimiento por un período mas largo, hubo una complicación clínica que determinó la muerte. Sin embargo en los primeros seis meses después de la cirugía pudimos observar crecimiento de por lo menos 0,3cm del segmento de la fíbula transportada, lo que indica que el potencial de crecimiento habia sido preservado.
Conclusiones:
El dispositivo de fijación interna extensible estabiliza la reconstrucción y posibilita el crecimiento a través del mecanismo de deslizamiento entre las placas. Y el segmento fibular proximal transferido por esta técnica tiene preservada su irrigación sanguínea y la función del crecimiento de la fisis transplantada. Consideramos que esta técnica de transferencia de la fibula con su cartilago de crecimiento puede ser utilizada en reconstruccion de lesiones que acompañan el segmento metadiafisiario proximal de la tibia en niños donde la epifisis de la tibia puede ser preservada.
Referencias bibliográficas
1. Digby KH. The measurement of diaphysial growth in proximal and distal directions. J Anat Physiol 1916 Jan;50(Pt 2):187-8.
2. Mercuri M, Capanna R, Manfrini M et al. The management of malignant bone tumors in children and adolescents. Clin Orthop Related Res 1991; 264:156-68.
3. Boyer MI, Bray PW, Bowen CVA. Epiphyseal plate transplantation: an historical rewiew. Br J Plast Surg 1994; 47:563-9.
4. Saghieg S, Abboud MR, Muwakkit SA, Saab R, Haidar R. Seven-year experience of using Rephiphysis expandable prosthesis in children with bone tumors. Pediatr Blood Cancer. 2010; 55(3): 457-63.
5. Gosheger G, Gebert C, Ahrens H, Streitbuerger A, Winkelmann W, Hardes J. Endoprosthetic reconstruction in 250 patients with sarcoma. Clin Orthop Relat Res 2006; 450:164-71.
6. Campanacci L, Manfrini M, Colangeli M, Ali N, Mercury M. Long-term results in children with massive bone osteoarticular allografts of the knee for high-grade osteosarcoma. J Pediatr Orthop 2010; 30(8): 919-27.
7. Weitao Y, Qiqing C, Sogtao G, Jiaqiang W. Epiphysis preserving operations for the treatment of lower limb malignant bone tumors. Eur J Surg Oncol 2012: 38(12)1165-70.
8. Fang B, Yi C, Zhang Q, Li Y, Wei Q, He W Zeng Z. Combined epiphyseal preservation and autograft bone transfer in treatment of children osteosarcoma. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi 2013: 27(1): 45-9.
9. Davis A G. Fibular substitution for tibial defects. J Bone Joint Surg 1944; Vol XXVI. NO. 2. April.
10. Agiza ARH. Treatment of tibial osteomyelitic defects and infected pseudoarthroses by the Huntigton fibular transference operation. J Bone Joint Surg 1981; 63-A(5):814-9.
11. Langenskiöld A. Hahn’s operation for pseudoarthrosis after osteomyelitis of the tibia in children: A report of three cases. Acta Orthop Scand 1983; 54:714-20.
12. Date AS, Solanki SB, Badhe NP, Sonsale PD, Pandit HG. Management of gap non-union of tibia by tibialisation of ipsilateral vascular fibula. J Postgrad Med 1996; 42(4):109-11.
13. Taylor GI, Miller GDH, Ham FJ. The free vascularized bone graft: A clinical extension of microvascular techniques. Plast Reconstr Surg 1975; 55(5):533-44.
14. Pho RWH, Patterson MH, Kour AK, Kumar VP. Free vascularised epiphyseal transplantation in upper extremity reconstruction. J Hand Surg 1988; 13B:440-7.
15. Baptista PPR, Yonamine ES. Dispositivo para fixação interna extensível. Rev Bras Ortop 2001; 36(7): 273-8.
16. Justolin LT, Rahal SC, Baptista PPR, Yonamine MJ, Mamprim J, Balieiro CC. Use of extensible internal device in the femur of Young dogs. Veterinary and Comparative Orthopaedics and Traumatology 2008 21 2: 133-139.
17. Holzapfel BM, Pilge H, Toepfer A, Jakubietz RG, Gollwitzer H, Rechl H, von Eisenhart-Rothe R, Rudert M. Proximal tibial replacement and alloplastic reconstruction of the extensor mechanism after bone tumor resection. Oper Ortuop Traumatol 2012; 24(3):247-62.
18. Jeys LM, Kulkami A, Grimer RJ, Carter SR, Tilman RM, Abudu A. Endoprosthetic reconstruction for the treatment of musculoskeletal tumors of the appendicular skeleton and pelvis. J Bone Joint Surg Am 2008: 90(6): 1265-71.
19. Wang TY, Dormand JP, Chang B. Soft-tissue optimization of limb salvage with knee endoprosthesis: 10 year experience at the Children‘s Hospital of Philadelphia. Ann Plast Surg, 2012: 69(5): 560-64.
20. Honoki K, Kobata Y, Miyauchi Y et al. Epiphyseal preservation and an intercalary vascularized fibular graft with hydroxypatite composites: Reconstruction in metaphyseal osteosarcoma of the proximal tibia: A case report. Arch Orthop Trauma Surg 2008; 128(2):189-93.
21. Muscolo DL, Ayerza MA, Aponte-Tinao LA, Ranalletta M. Partial epiphyseal preservation and intercalary allograft reconstruction in high-grade metaphyseal osteosarcoma of the knee. J Bone Joint Surg Am 2004 Dec;86-A(12):2686-93.
22. Hriscu M, Mojallal A, Breton P, Bouletreau P, Carret J-P. Limb salvage in proximal humerus malignant tumors: The place of free vascularized fibular graft. J Reconstr Microsurg 2006; 22(6):415-21.
23. Kapukaya A, Subasi M, Kandiya E, Ozates M, Ylmaz F. Limb reconstruction with the callus distraction method after bone tumor resection. Arch Orthop Trauma Surg. 2000;120(3-4): 215-8.
24. Baptista PPR, Guedes A, Reggiani R, Lavieri R, Pires CEF. Tibialização da fíbula: Descrição de abordagem cirúrgica. Rev Bras Ortop 1998; 33(11):861-6.
25. Campbell WC. Transference of the fibula as an adjunct to free bone graft deficiency: Report of three cases. J Orthop Surg 1919; 1:625.
26. Carnesale PL, Guerrieri AG. Fibular transplant for loss of substance of tibia. J Bone Joint Surg 1955; 37A(1):204-6.
27. Chung YK, Chung S. Ipsilateral island fibula transfer for segmental tibial defects: Antegrade and retrograde fashion. Plast Reconstr Surg 1998; 101(2):375-82.
28.Shapiro MS, Endrizzi DP, Cannon RM, Dick HM. Treatment of tibial defects and nonunions using ipsilateral vascularized fibular transposition. Clin Orthop Related Res 1993; 296:207-12.
29. Weiland AJ, Moore JR, Daniel RK. Vascularized bone autografts: Experience with 41 cases. Clin Orthop Related Res 1983; 174:87-95.
30. Arai K, Toh S, Tsubo K, Nishikawa S, Narita S, Miura H. Complications of vascularized fibula graft for reconstruction of long bones. Plast Reconstr Surg 2002; 109:2301-6.
31. Tsai TM, Ludwig L, Tonkin M. Vascularized fibular epiphyseal transfer. Clin Orthoped 1986; 210:228-34.
32. Helferich U. Versuche über die Transplantation des Intermediarknorpels wachsender Rohrenknochen. Deutsche Z Chir 1899; 51:564-73.
33. Heller E. Experimentelle Utersuchungen über die Transplantation des Intermediarknorpels in Form der halbseitigen Gelenktransplantation. Arch Klin Chir 1914; 104:843-954.
34. Haas SL. Further observations on the transplatation of the epiphyseal cartilage plate. Surg Gynecol Obstet 1931; 52:958-63.
35. Straub GF. Anatomic survival, growth and physiological function of an epiphyseal bone transplant. Surg Gynecol Obstet 1929; 48:687-90.
36. Sawaizumi M, Maruyama Y, Okajima K, Motegi M. Free vascularized ephiphyseal transfer designed on the reverse anterior tibial artery. British Journal of Plastic Surgery(1991, 44, 57-59.
37. Concannon MJ, Croll GH, Boschert MK, Gaines RW, Puckett CL. Free fibular transfer in a growing individual (long-term results). Microsurgery 1993; 14:624-7.
38. Becker LM, Zuker RM. Vascularized fibular epiphyseal transplantation for limb salvage following bone tumour excision. Can J Plast Surg 1999; 7(2):65-73.
39. Menezes-Leite MC, Dautel G, Duteille F, Lascombes P. Transplantation of the proximal fibula based on the anterior tibial artery: Anatomical study and clinical application. Surg Radiol Anat 2000; 22:235-8.
Autores do caso
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com