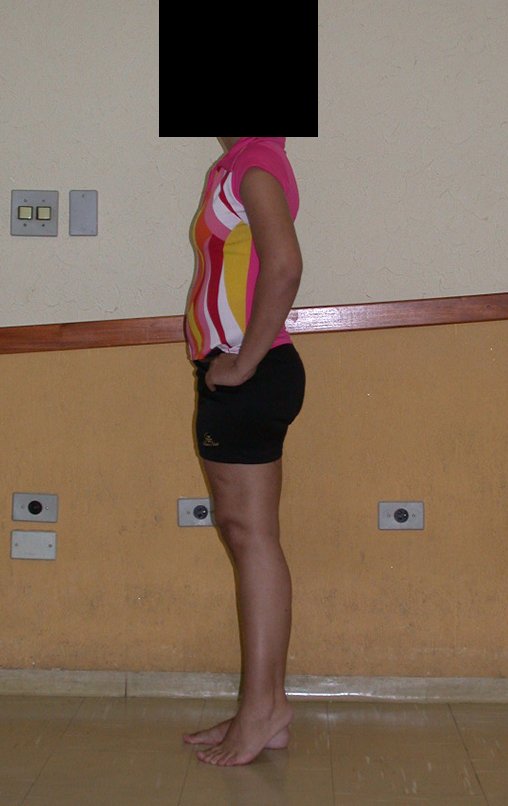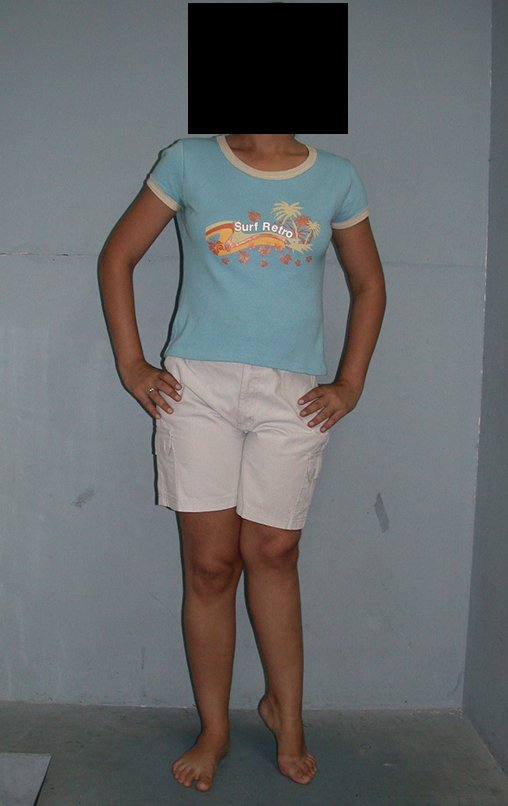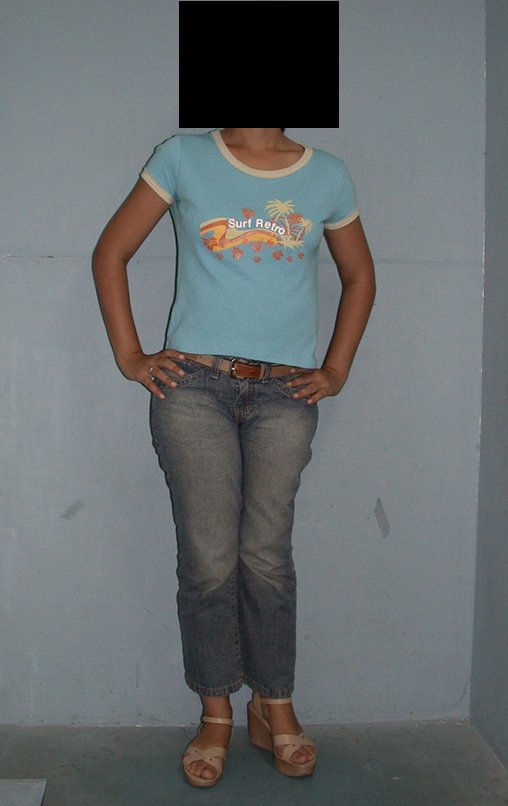Tumor radial de células gigantes – Técnica de resección del tumor – Técnica de obtención de injerto autólogo de peroné – Técnica de reconstrucción de muñeca

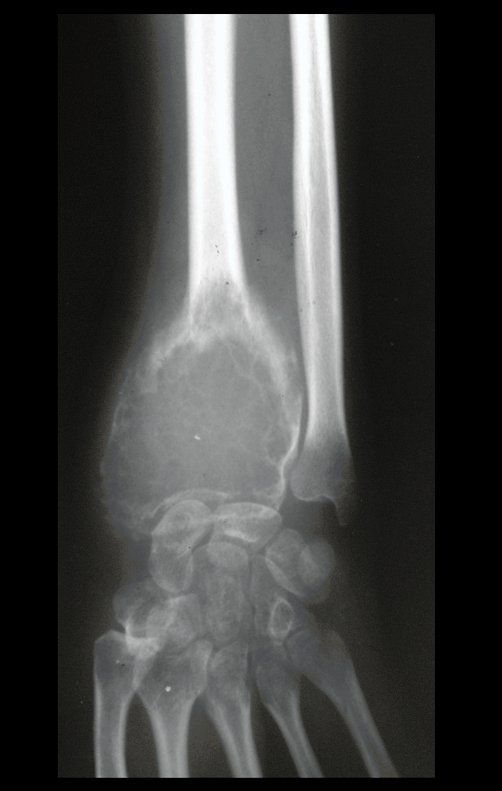
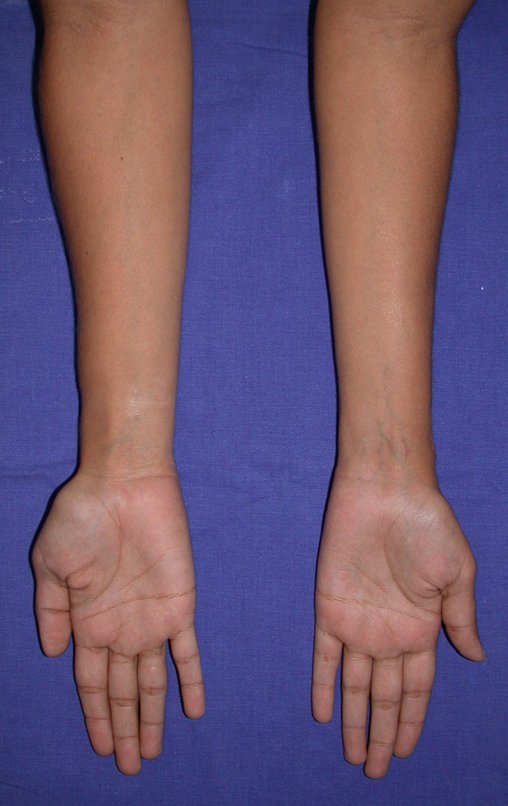
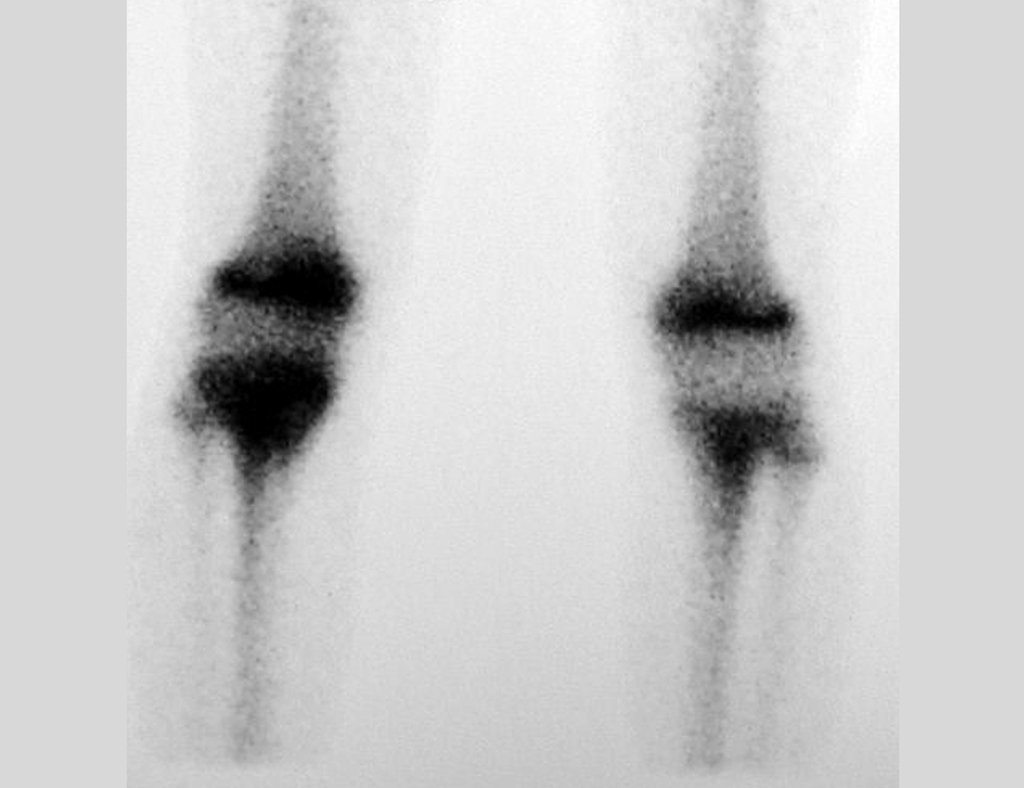
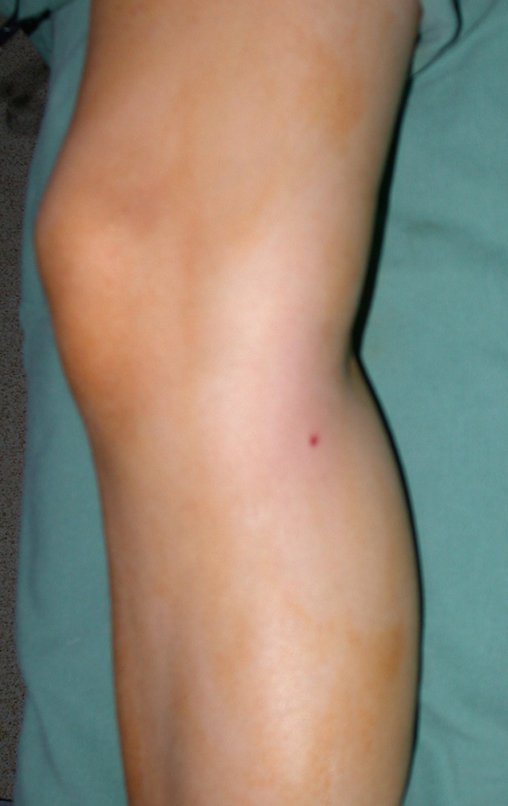
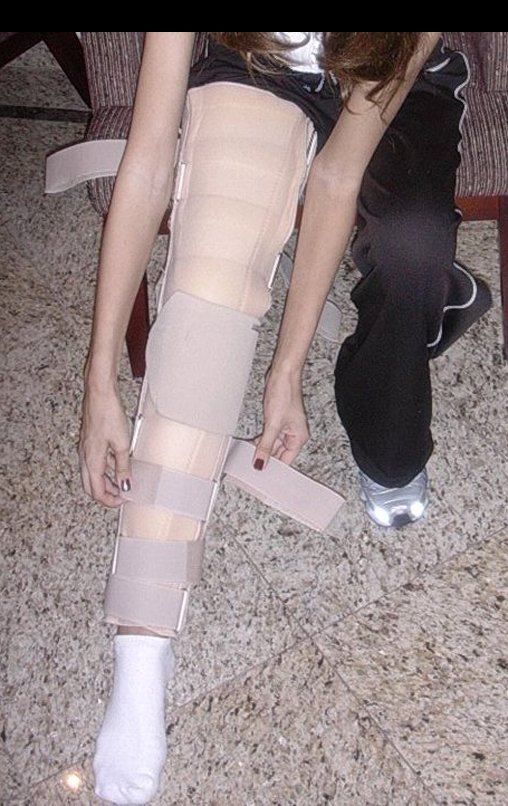
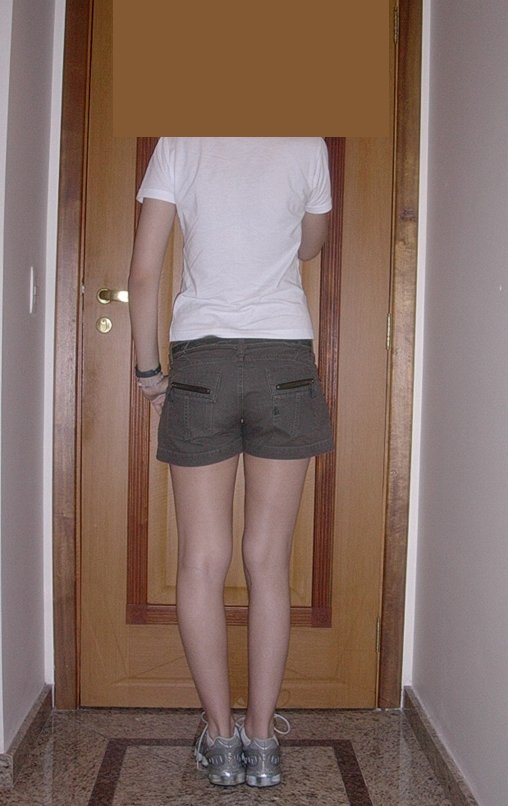
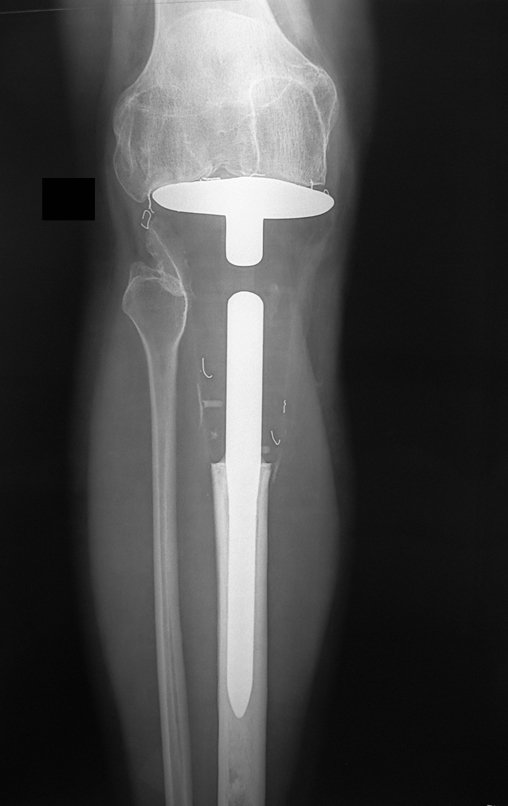
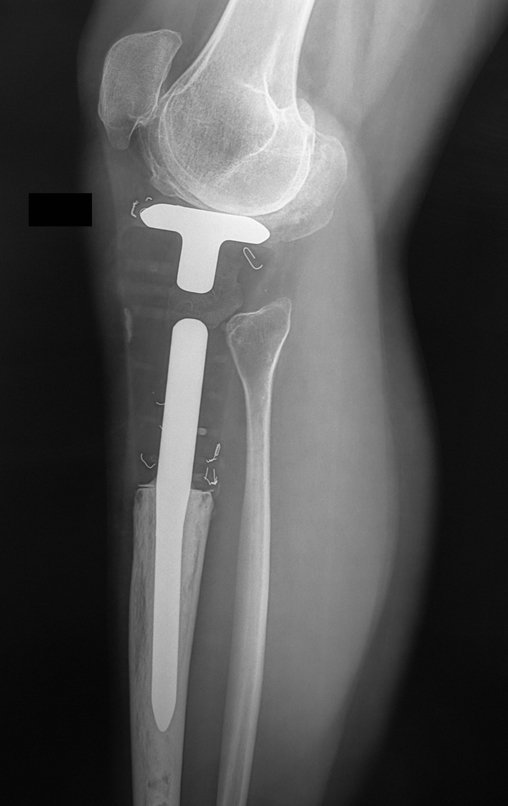
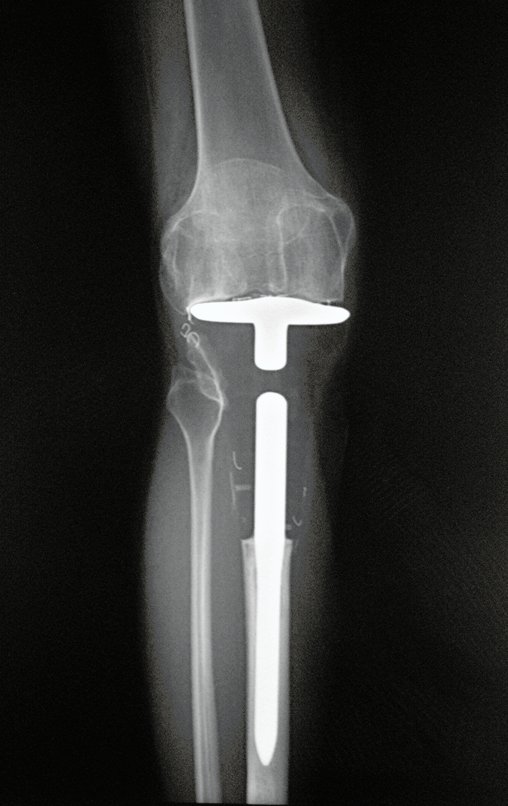
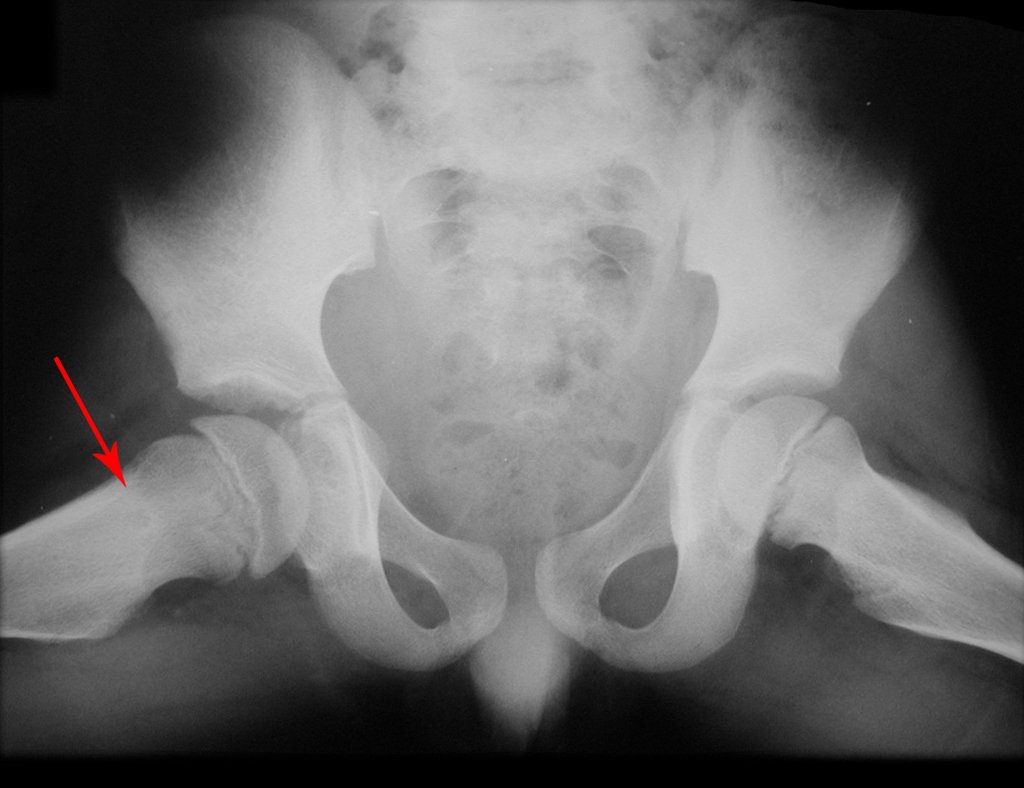
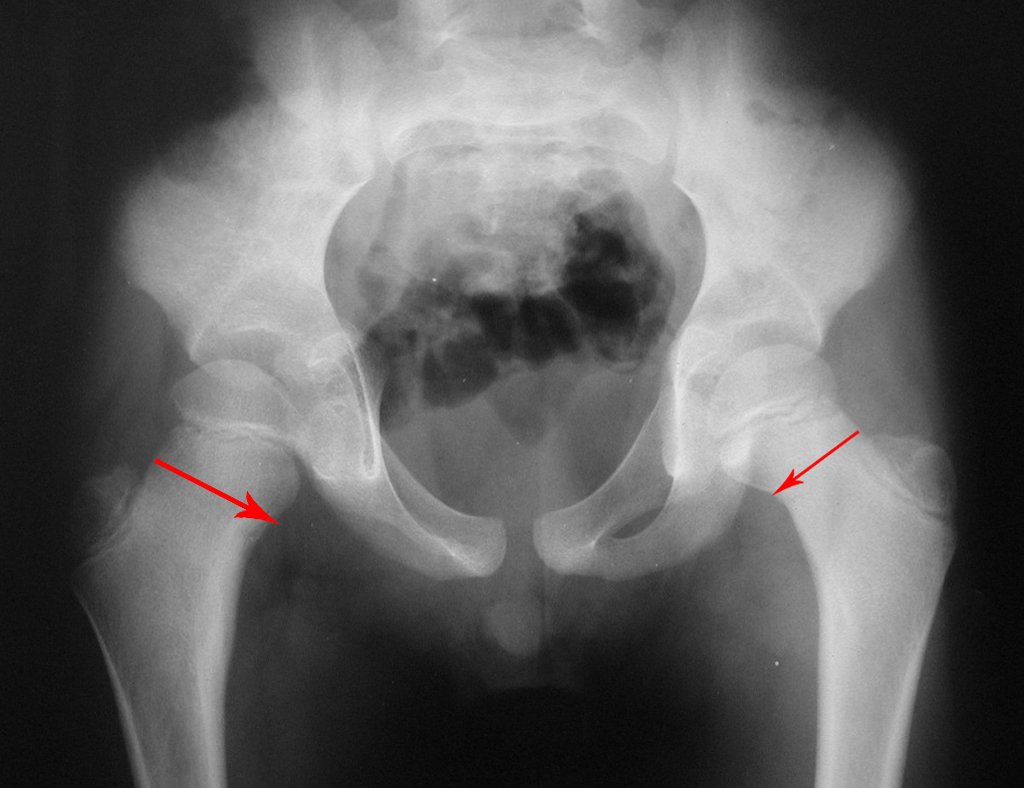
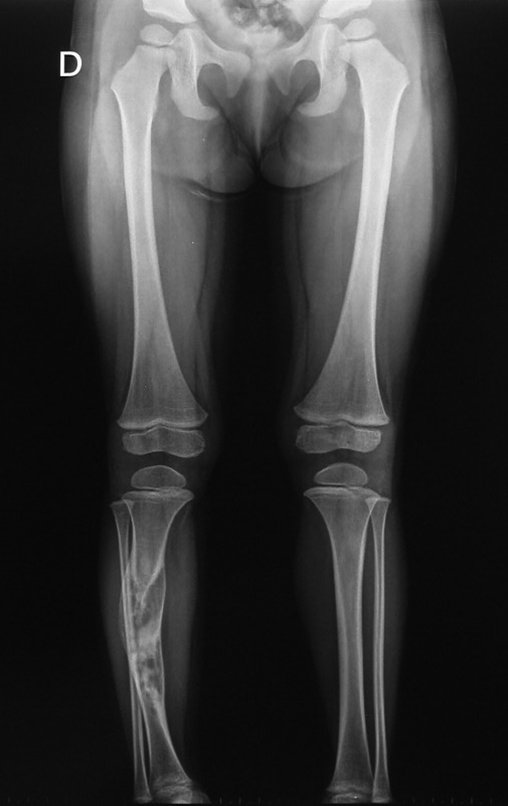
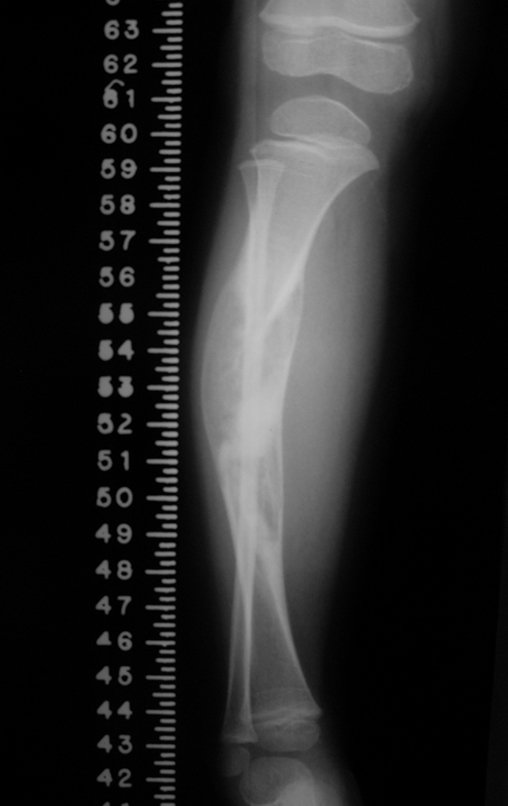
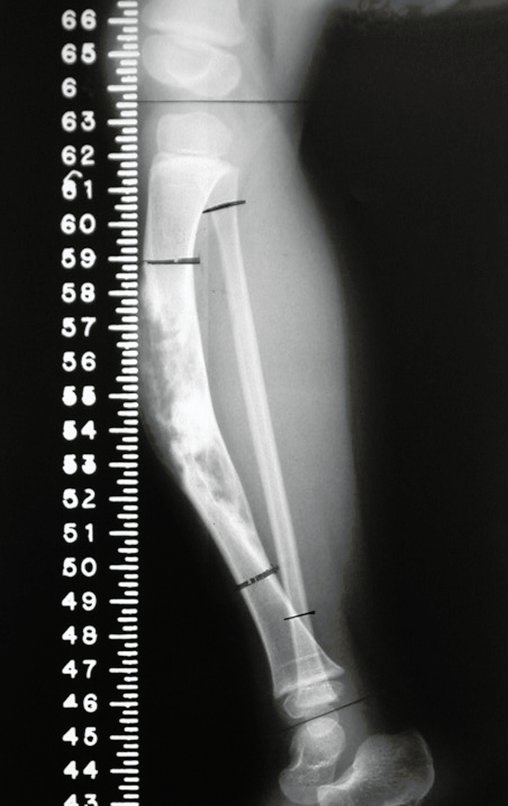
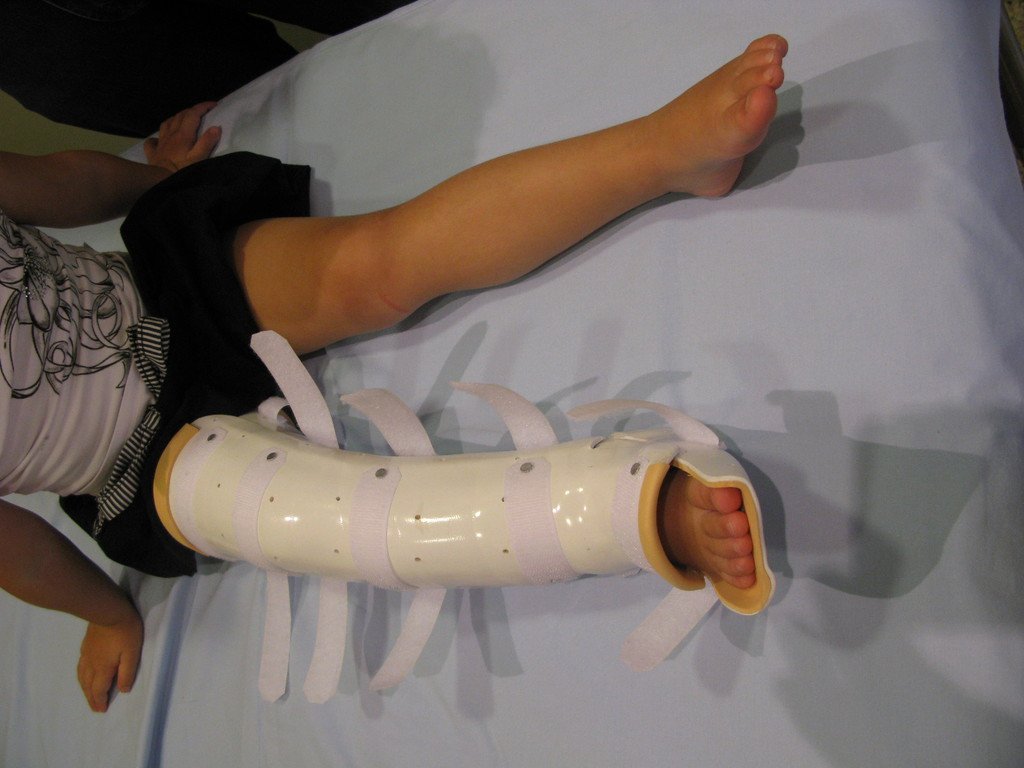
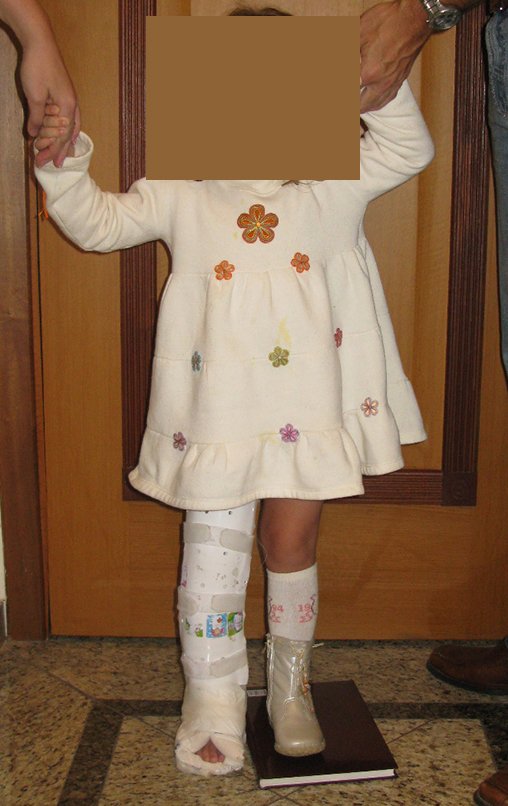
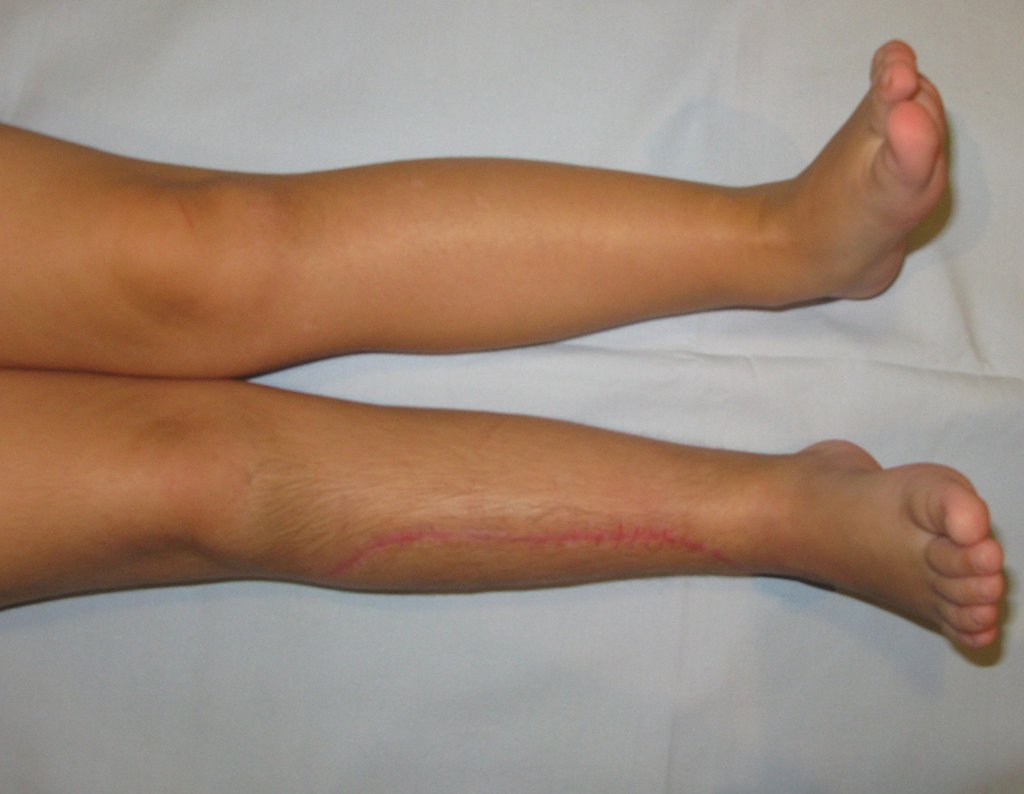
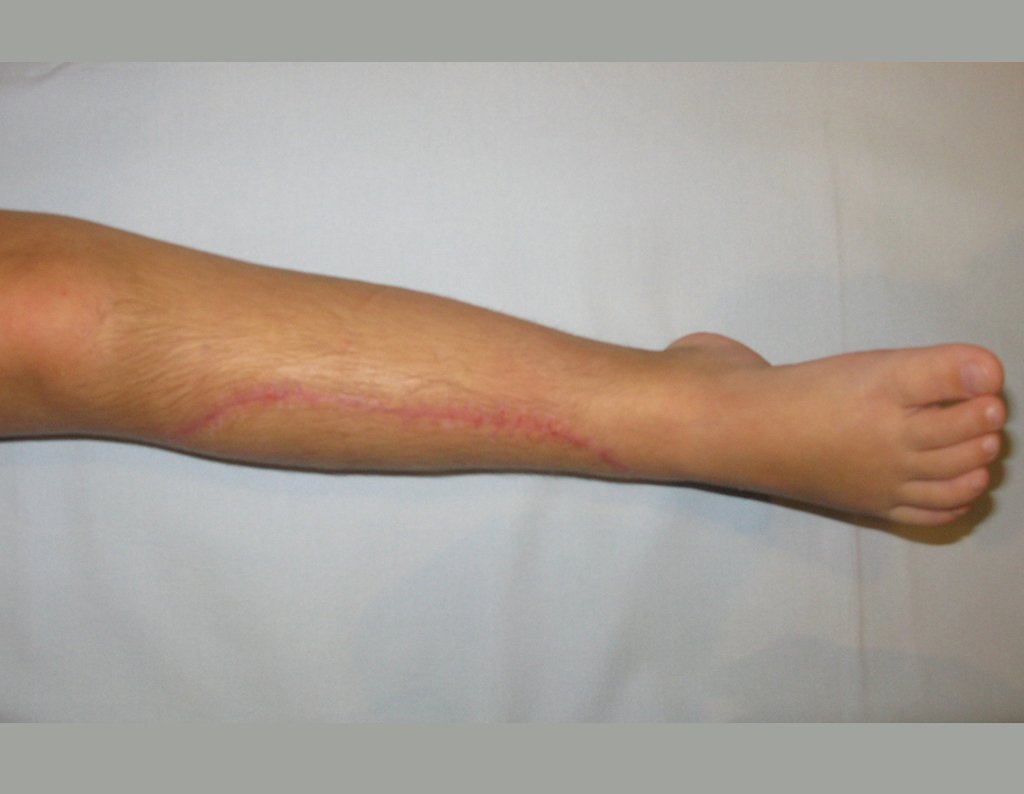
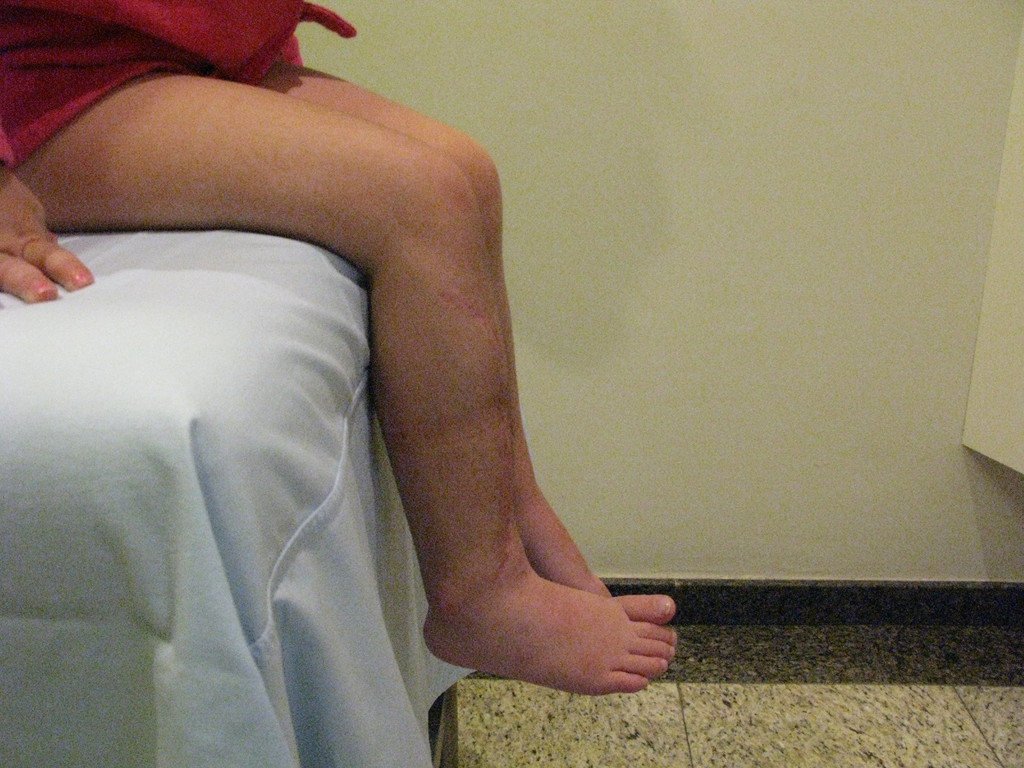
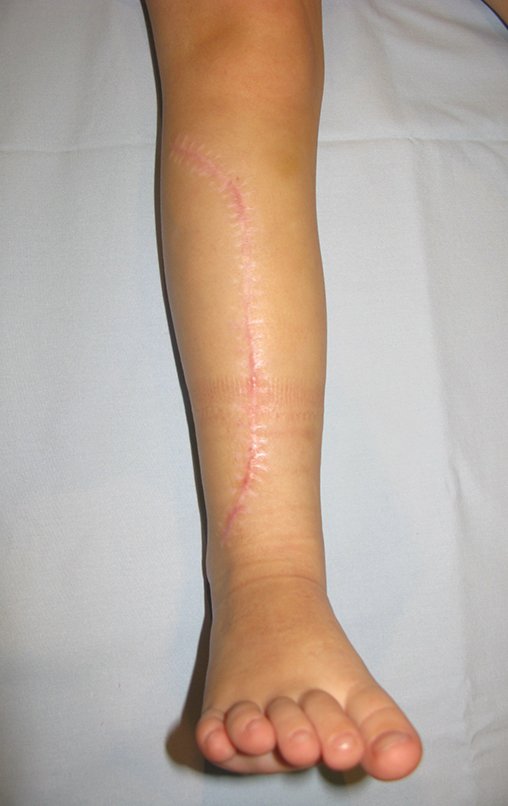
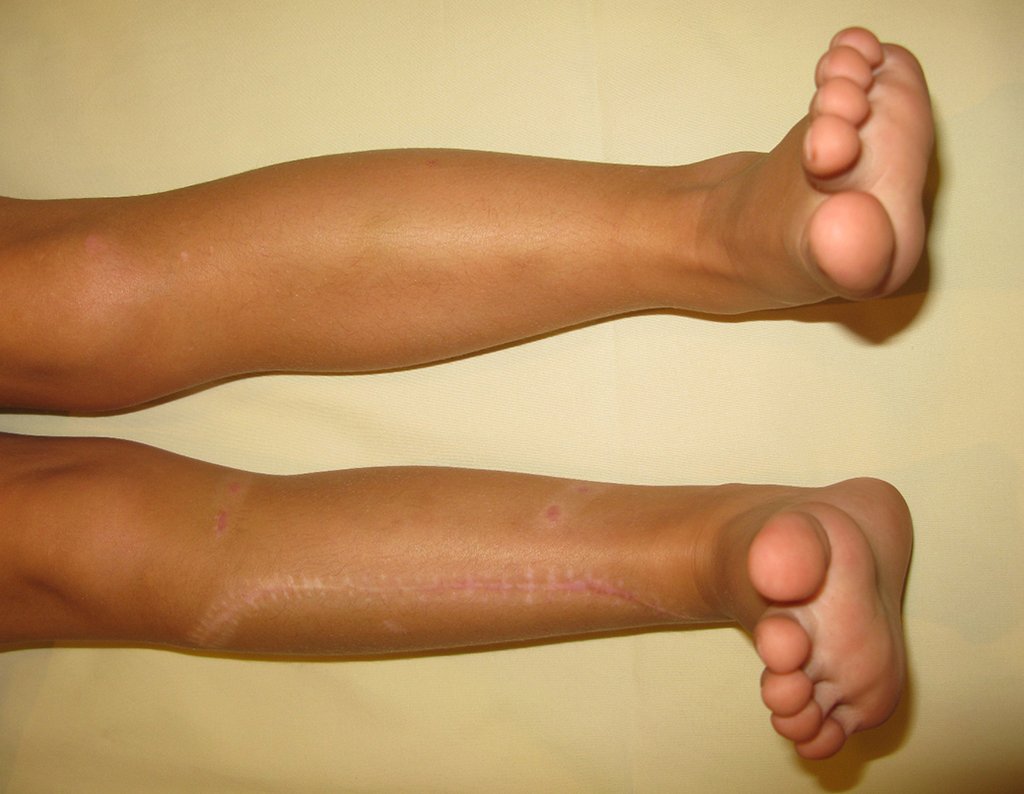
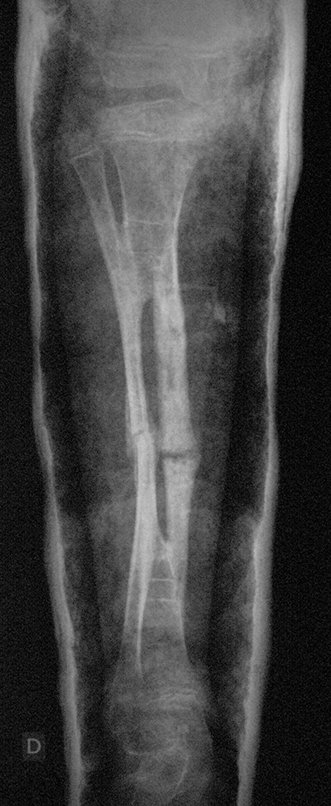
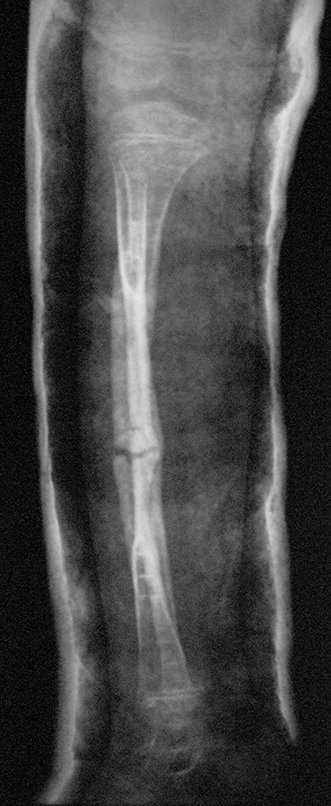
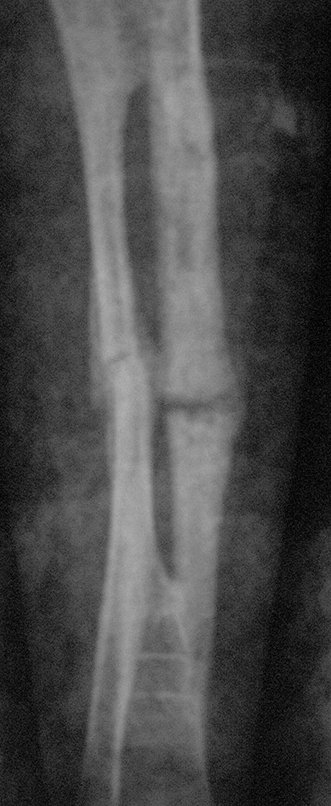
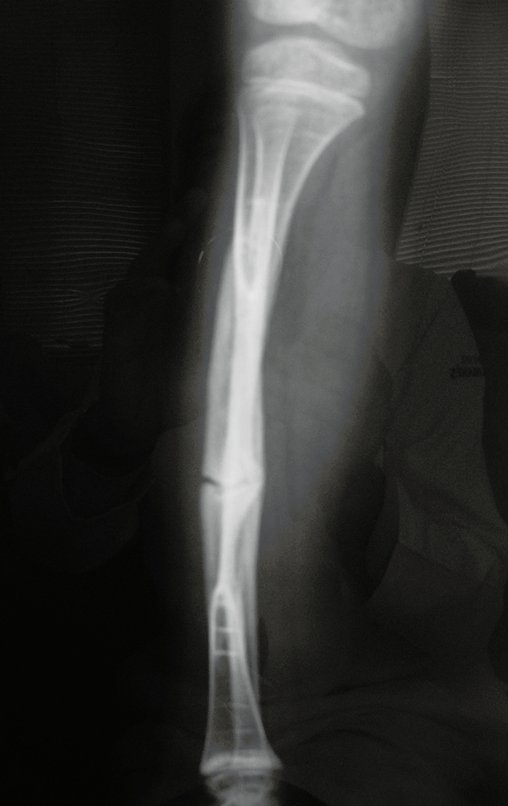
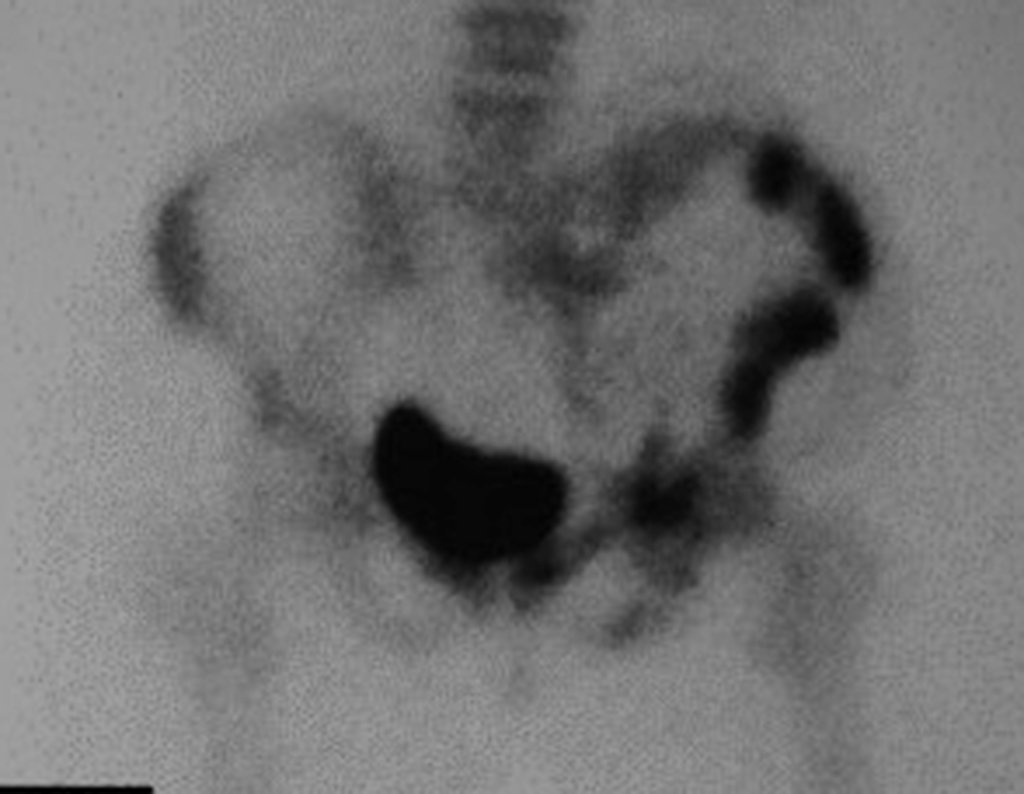
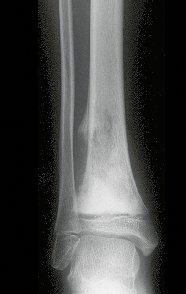
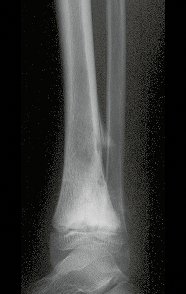
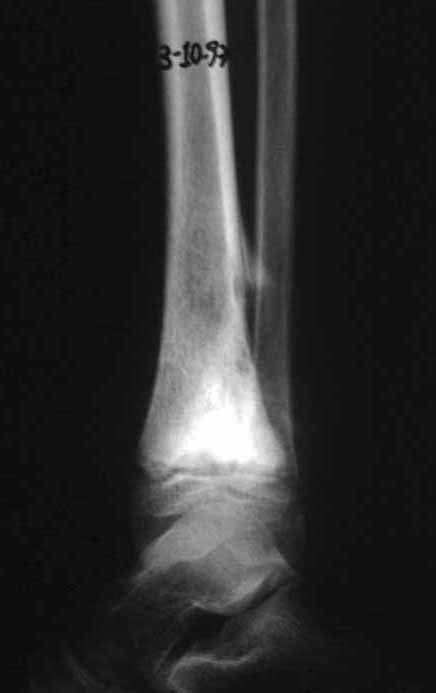
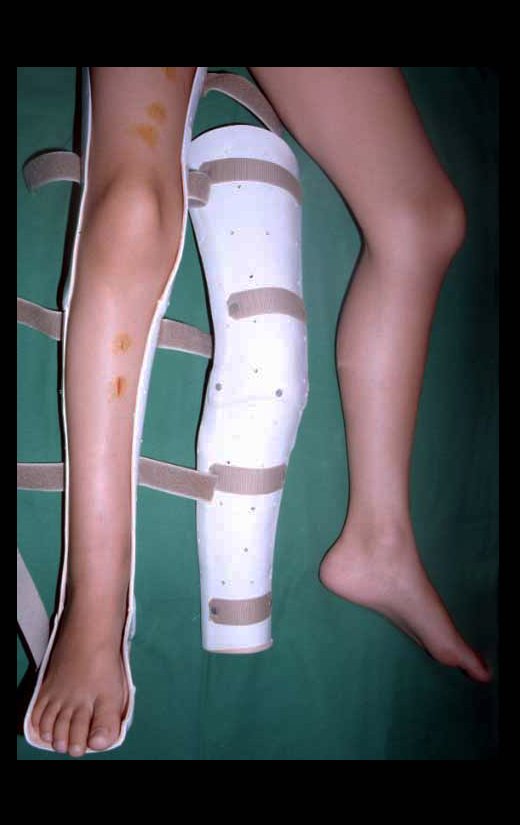
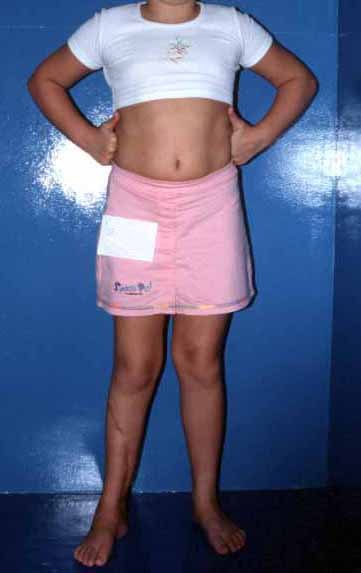
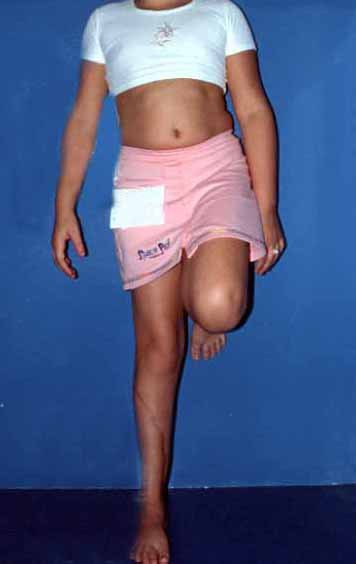
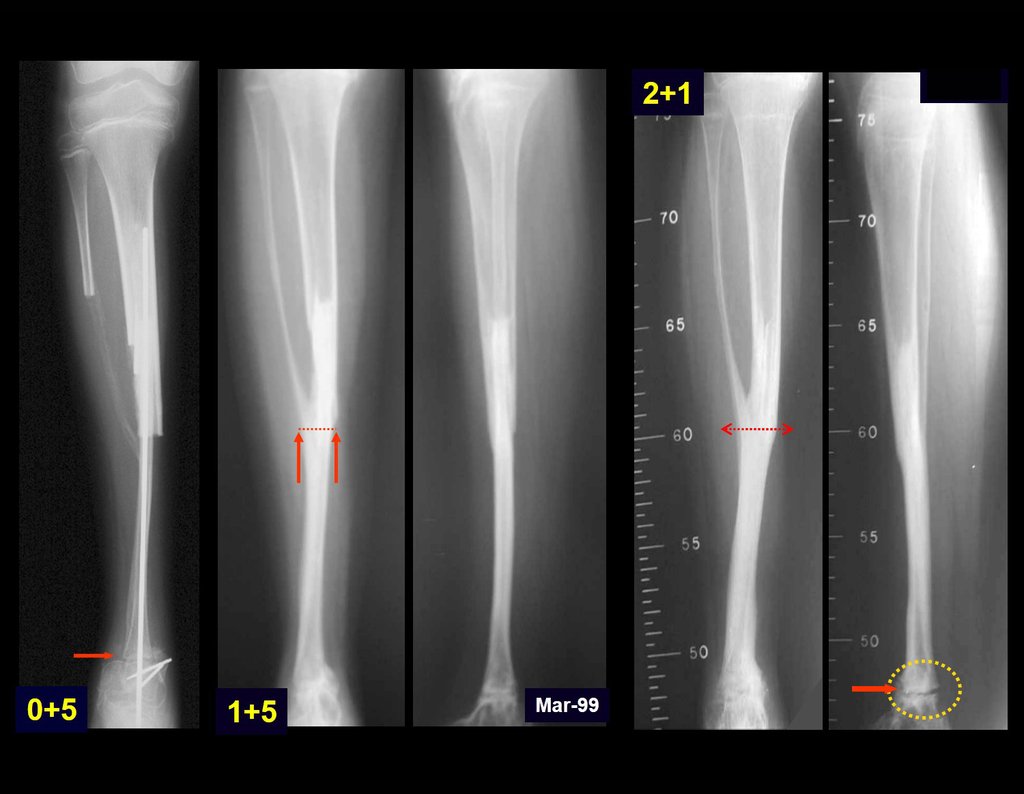
En Mayo de 2005, con sospecha de tumor de células gigantes, fue referida a un segundo hospital, cinco meses después de la primera atención. Se hizo nueva referencia ahora para nuestra atención, en Octubre del mismo año (Figuras 7 a 10).
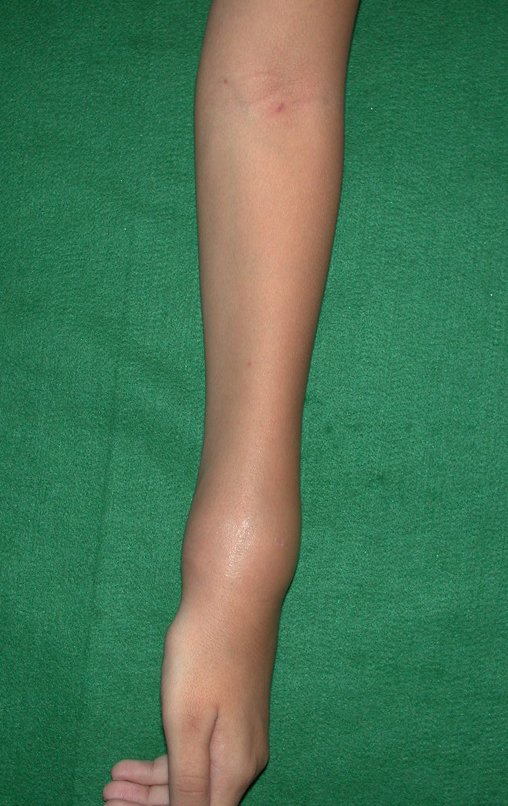
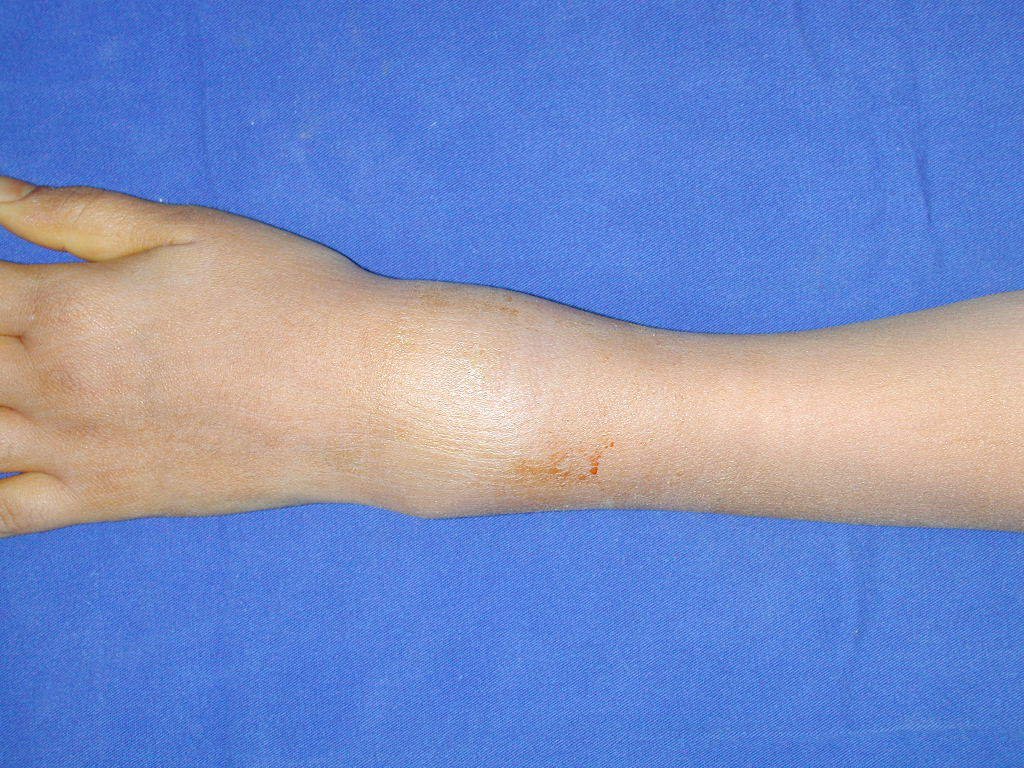
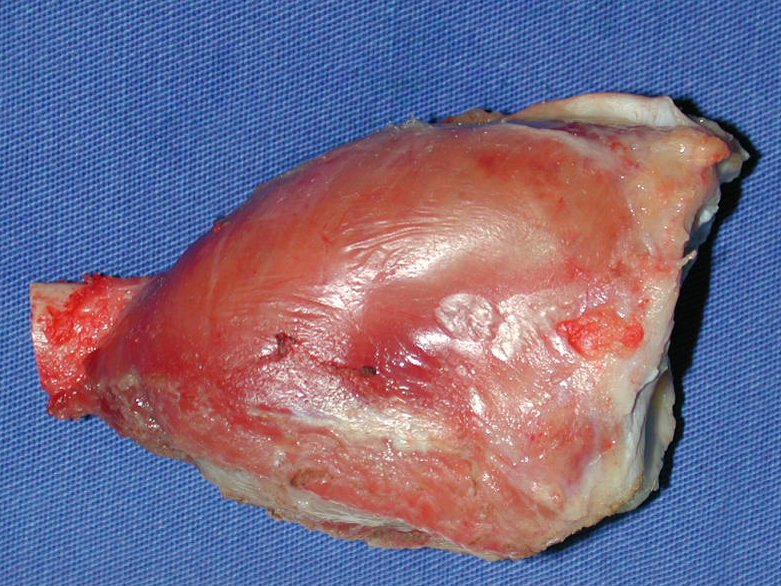
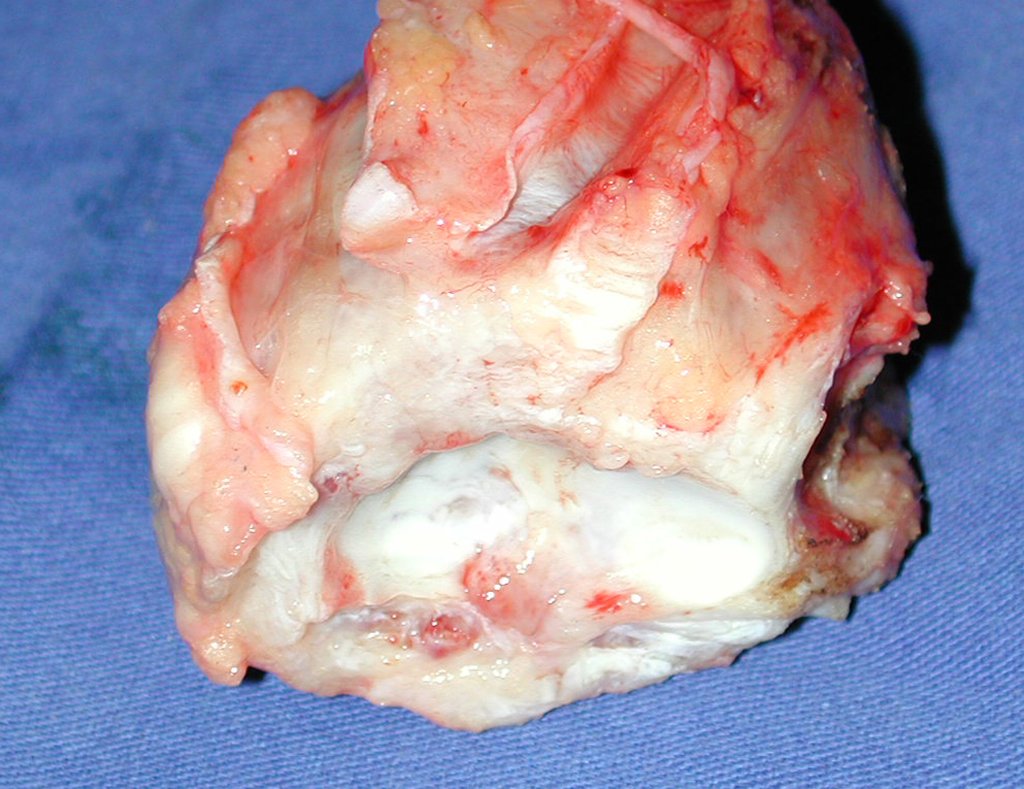
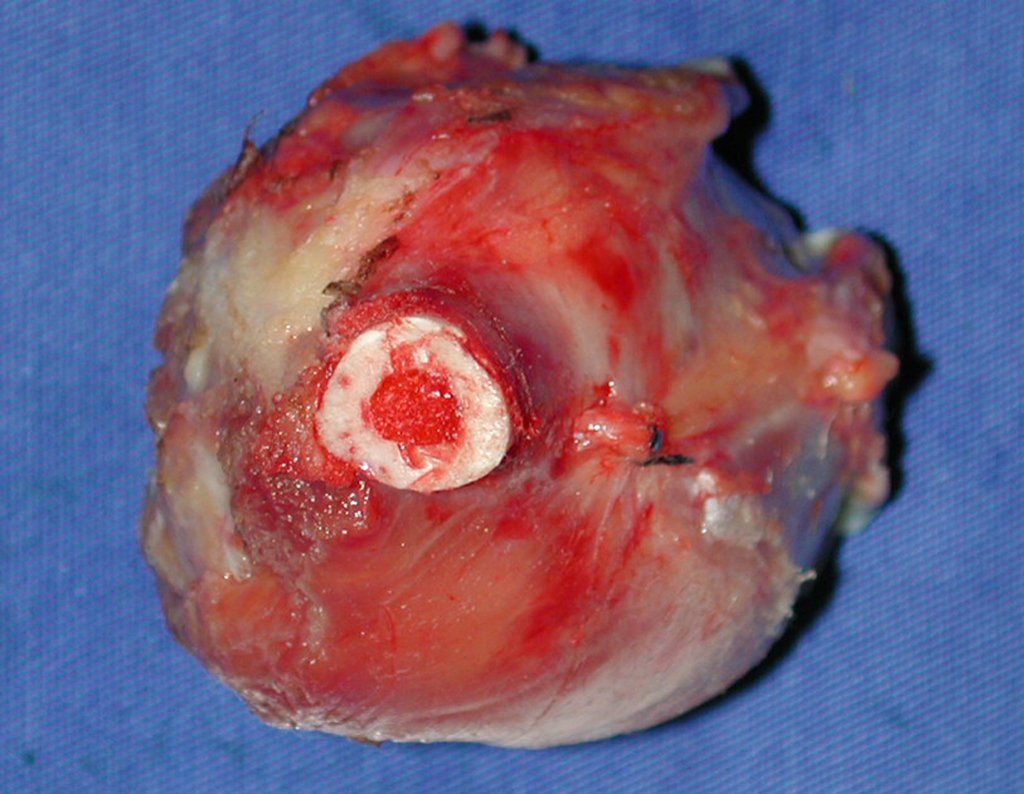
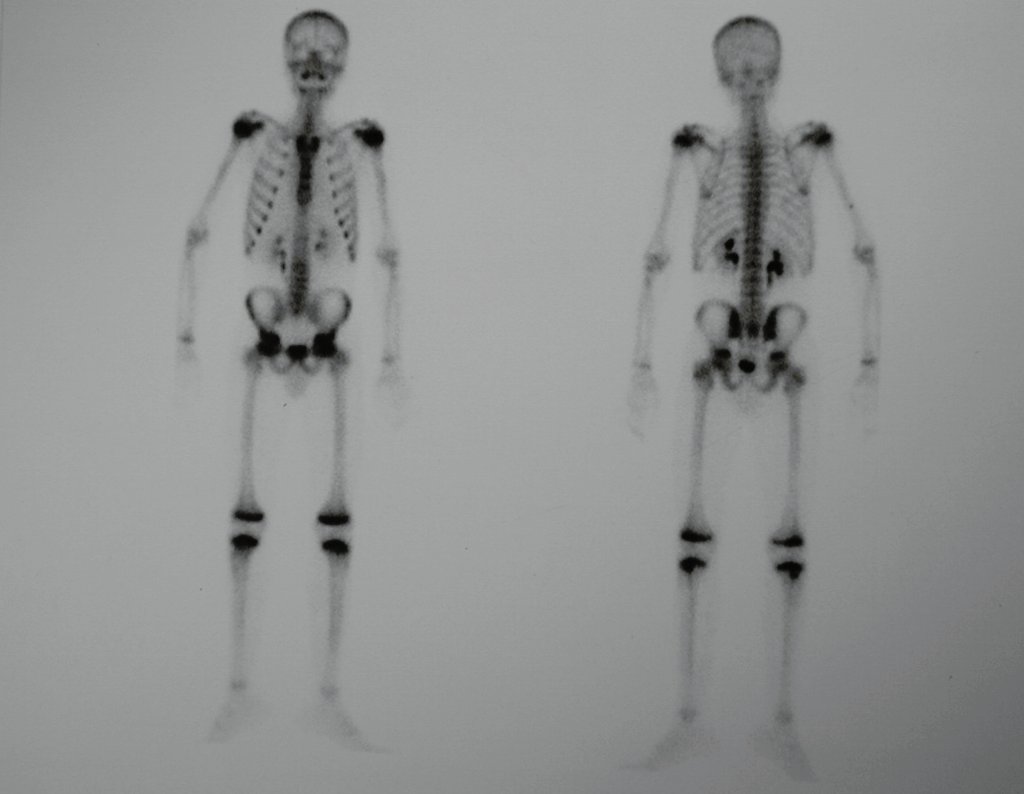
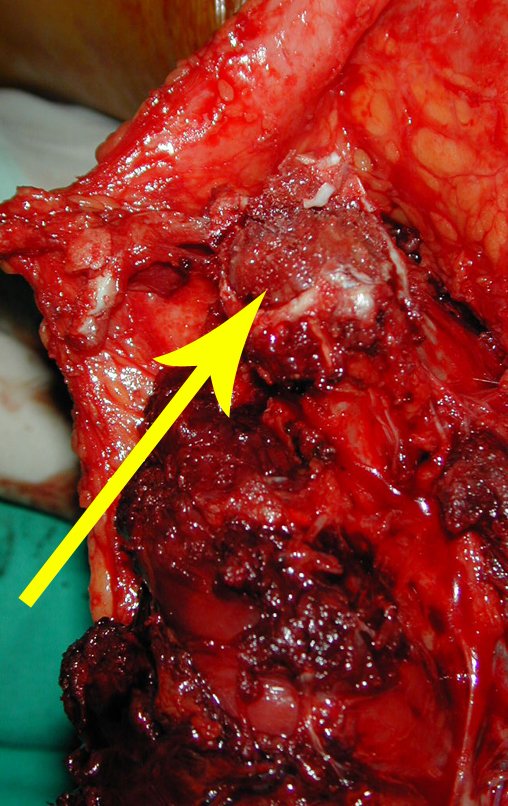
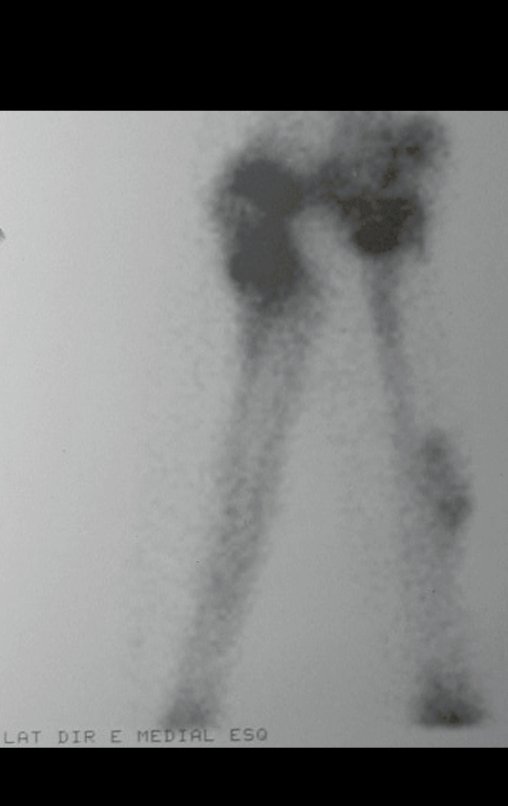
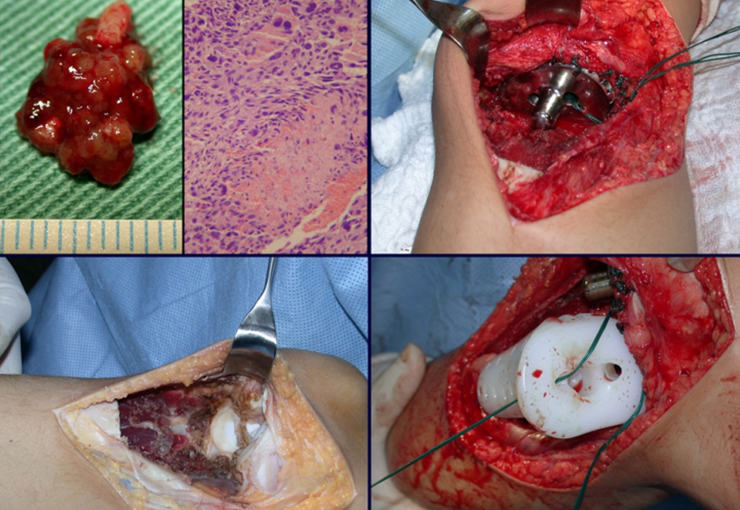
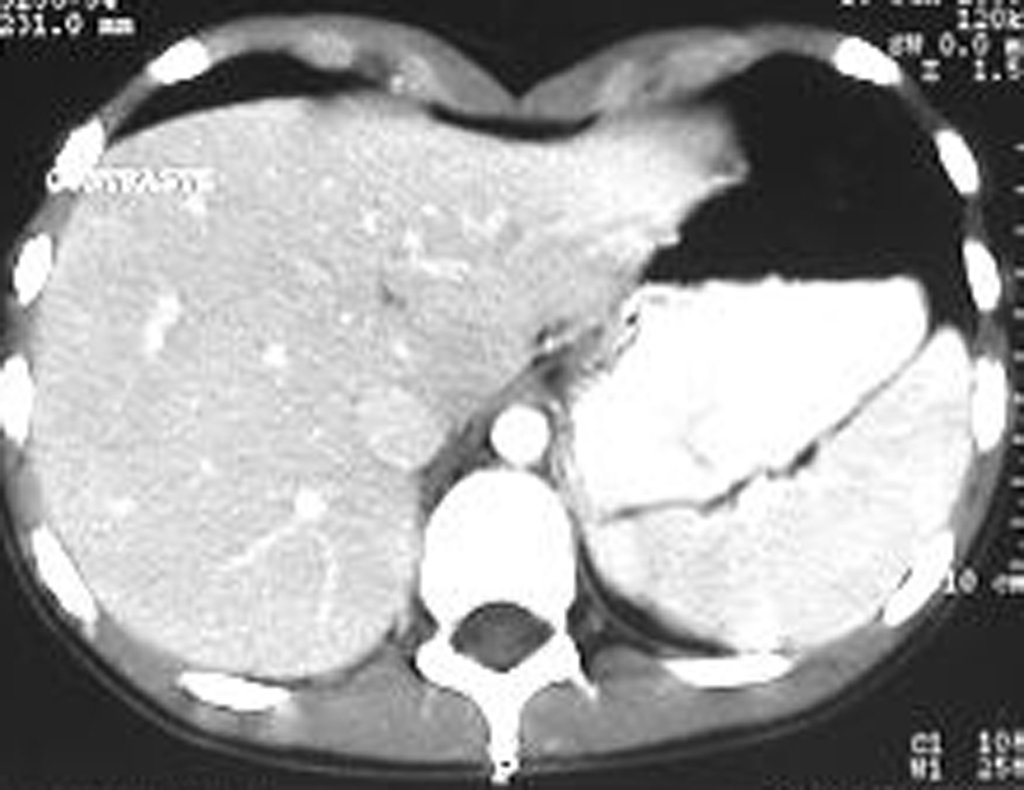
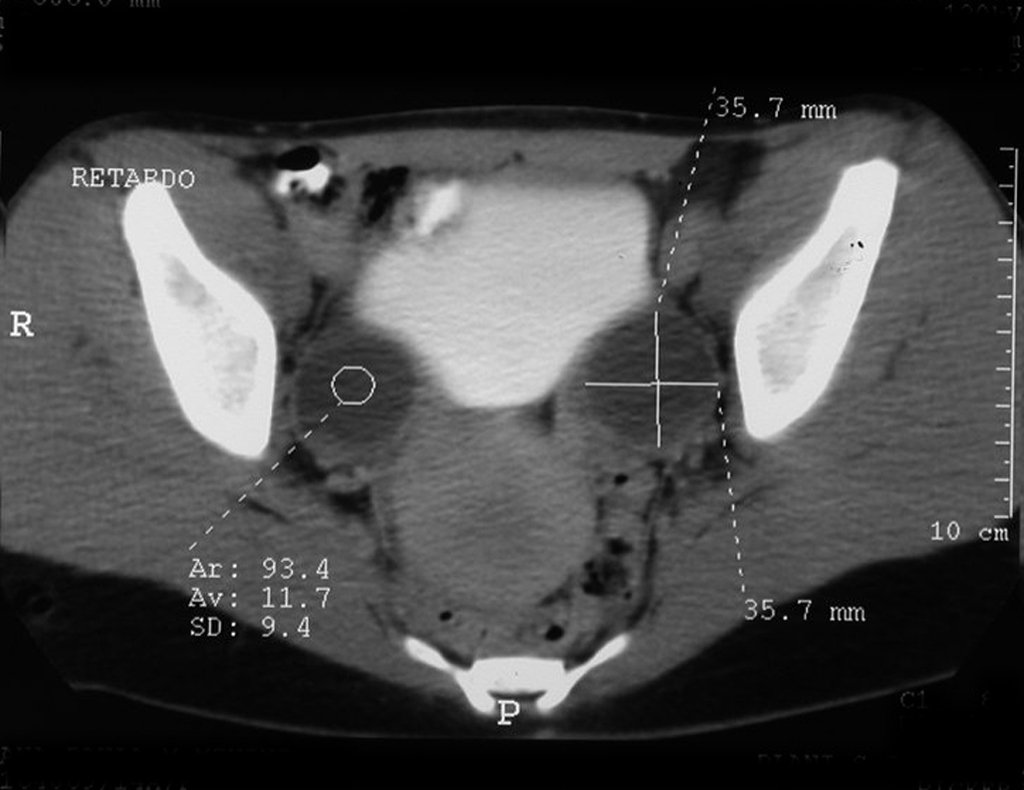
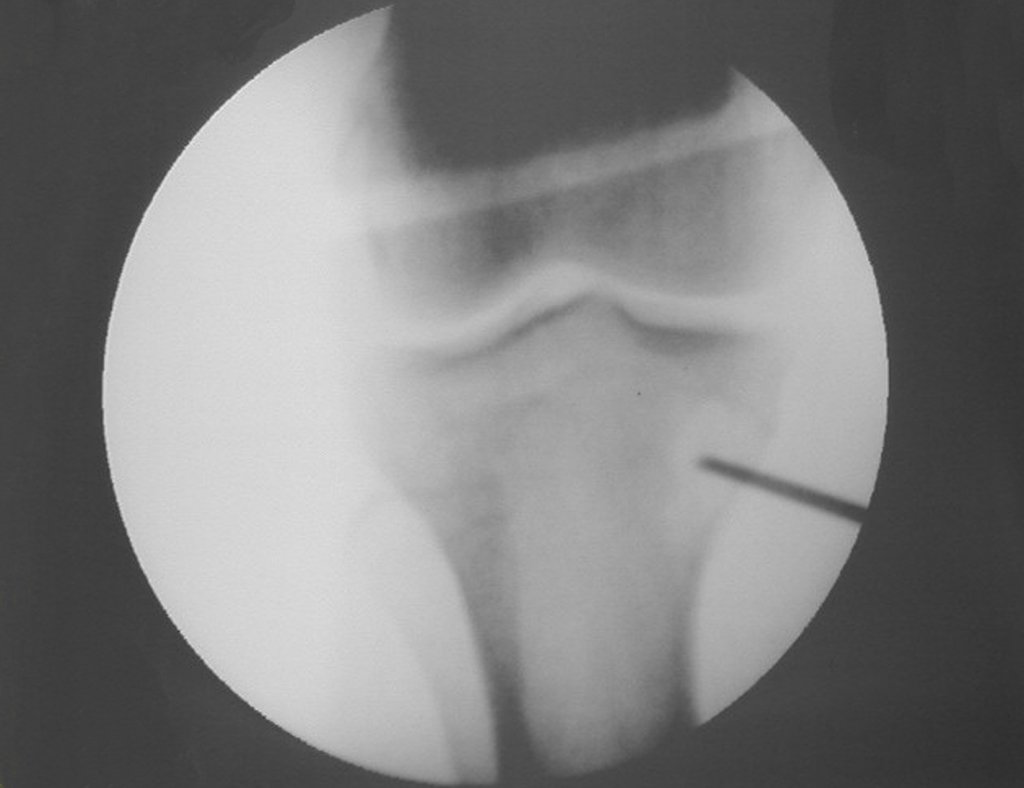
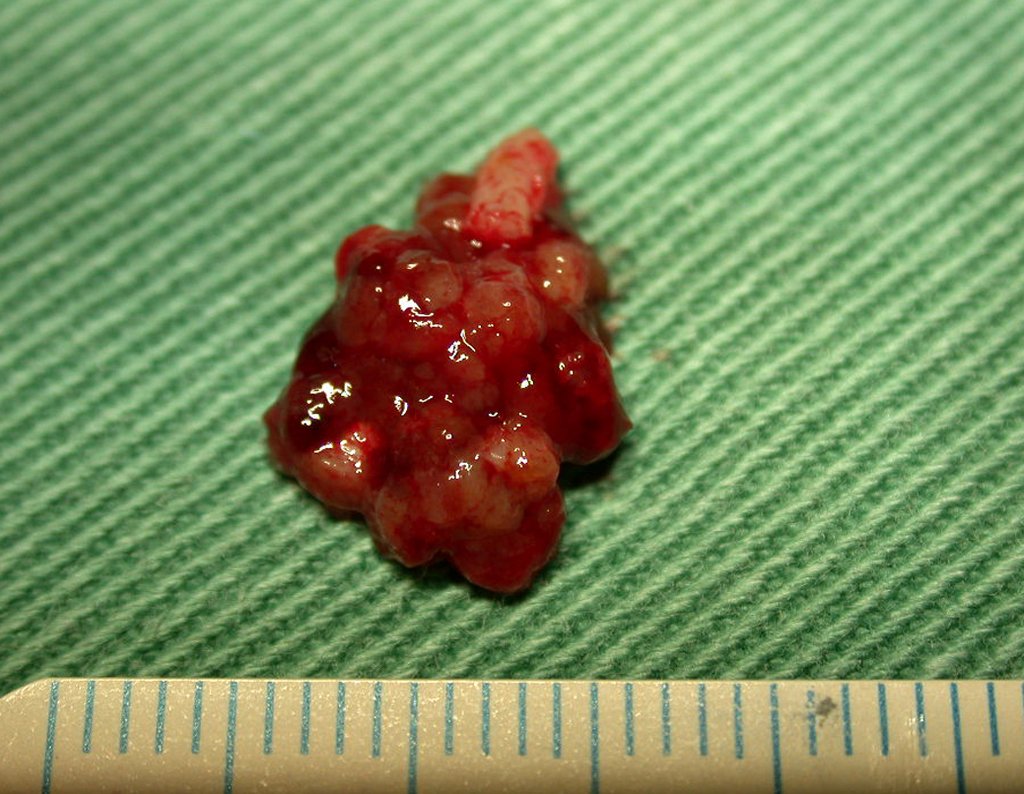
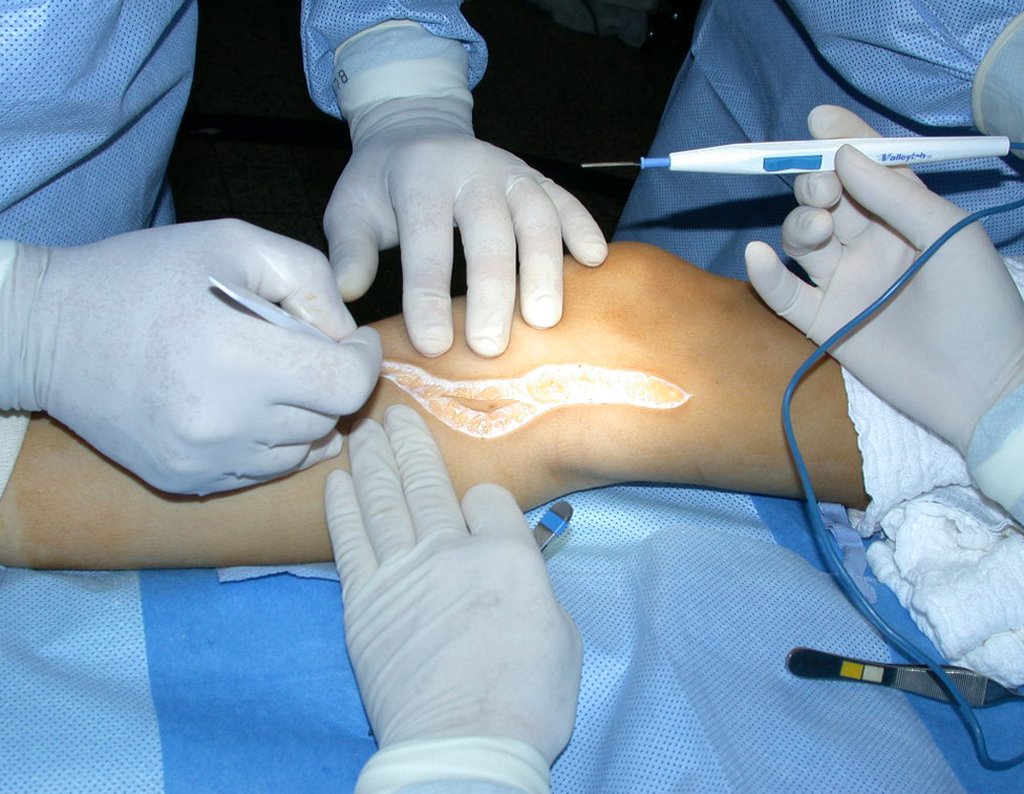
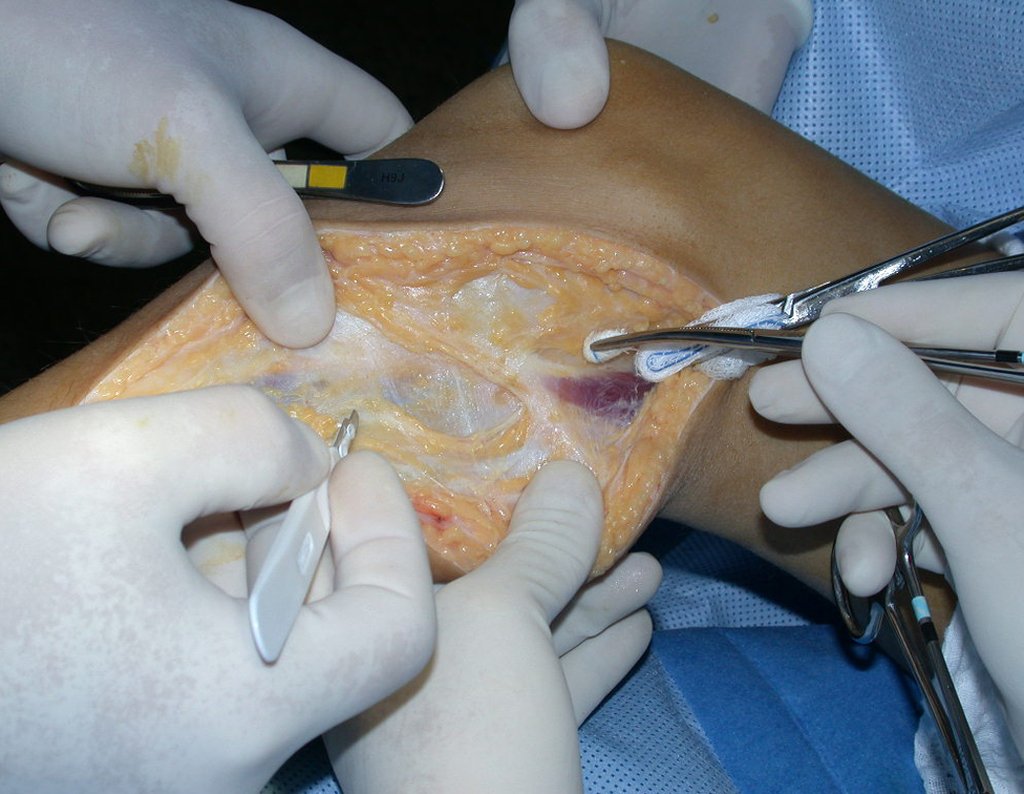
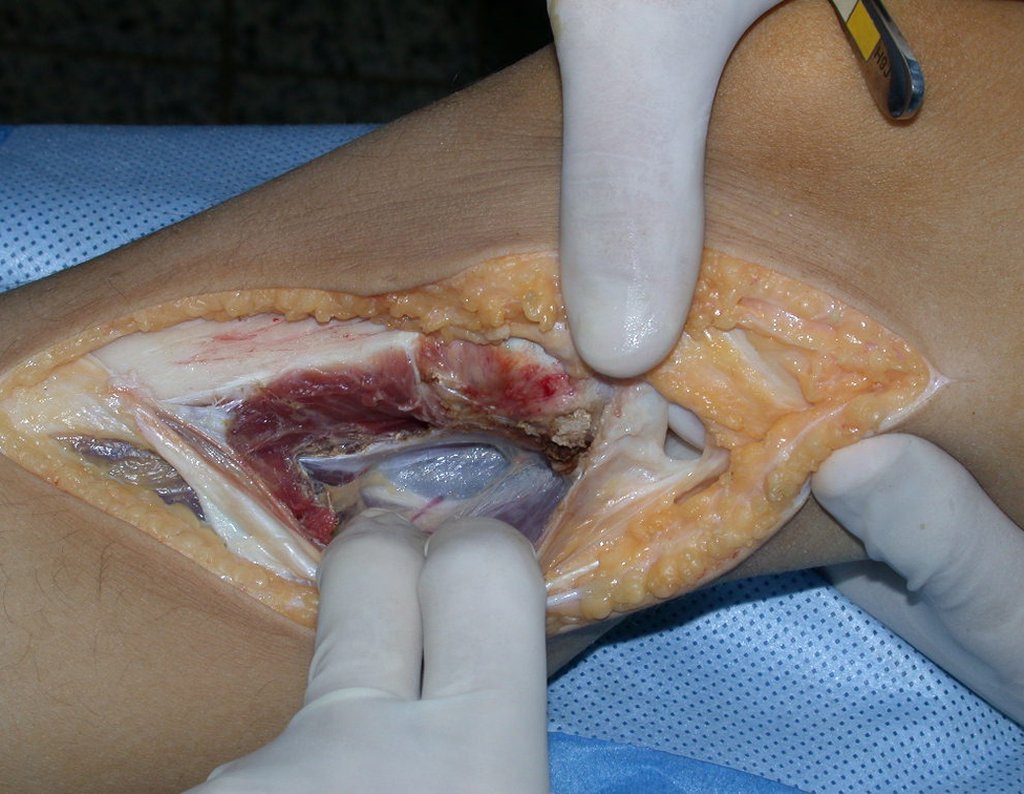
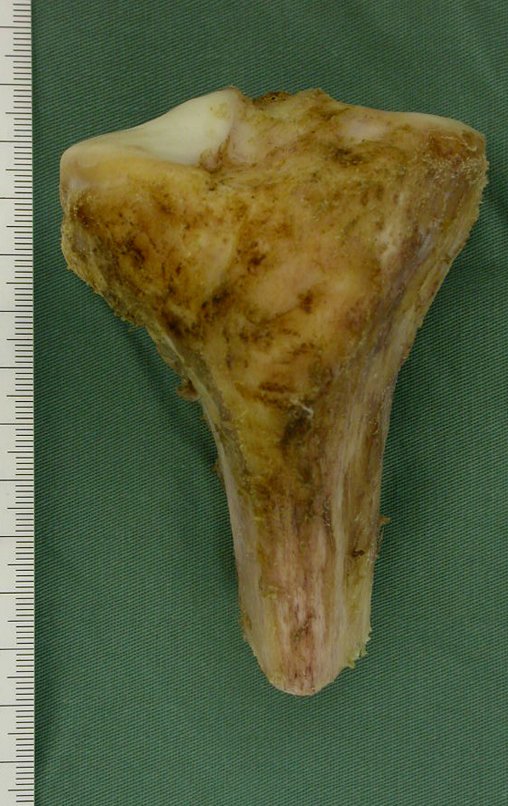
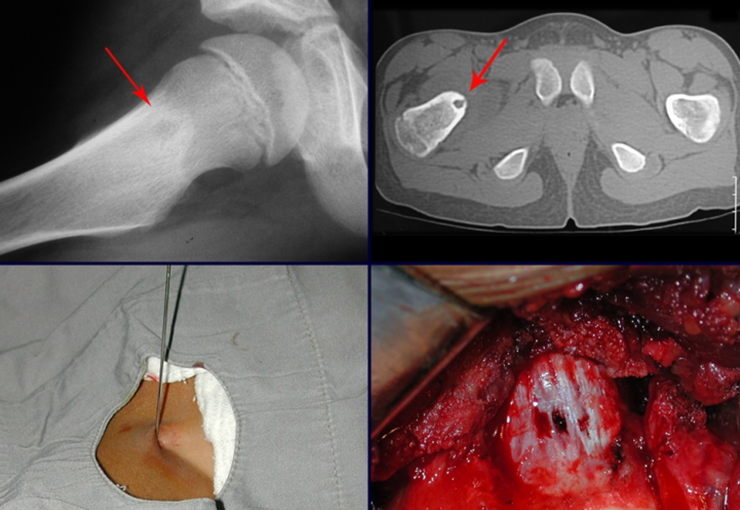
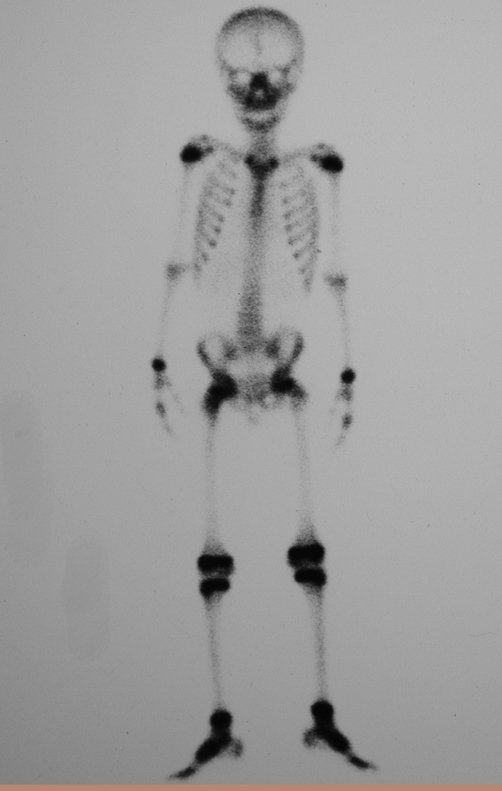
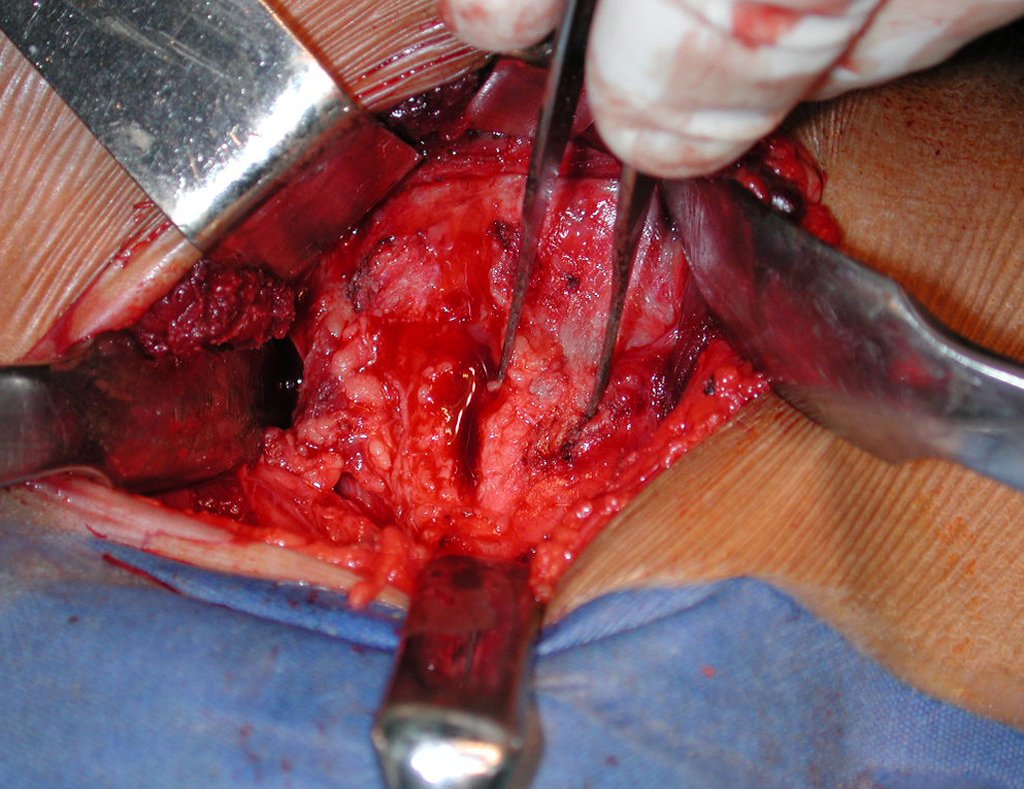
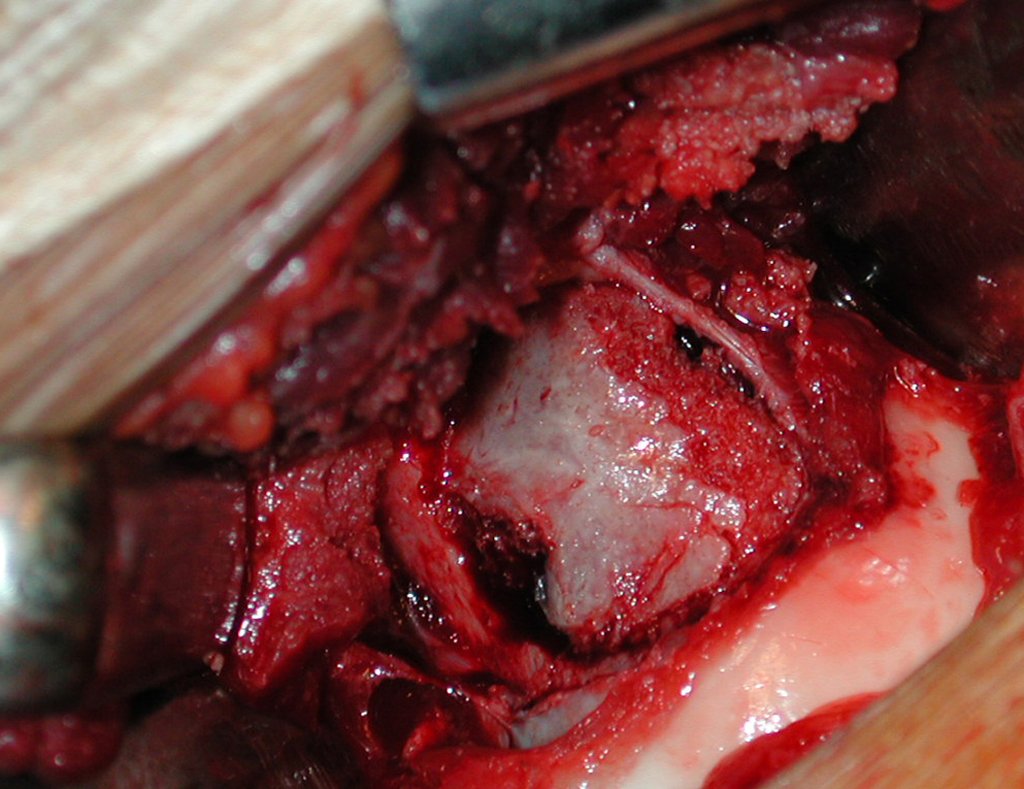
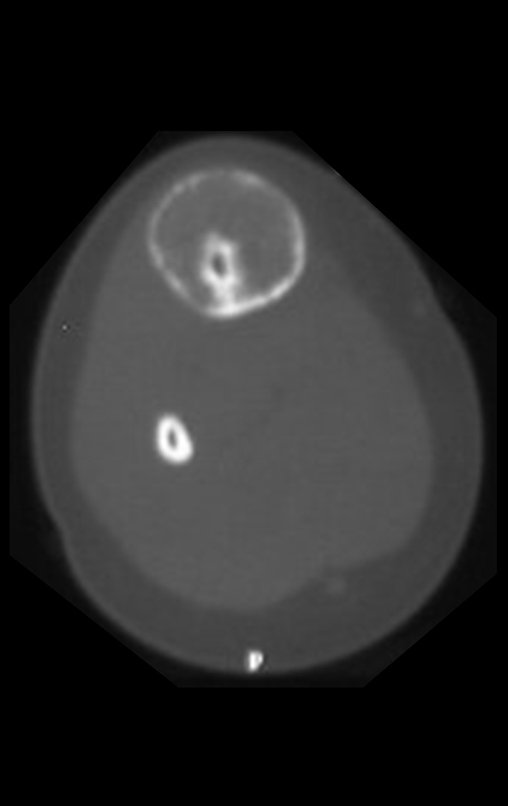
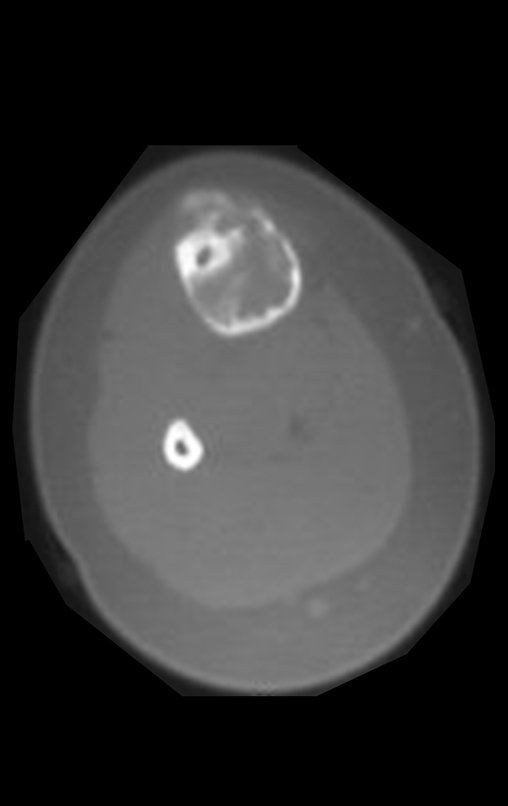
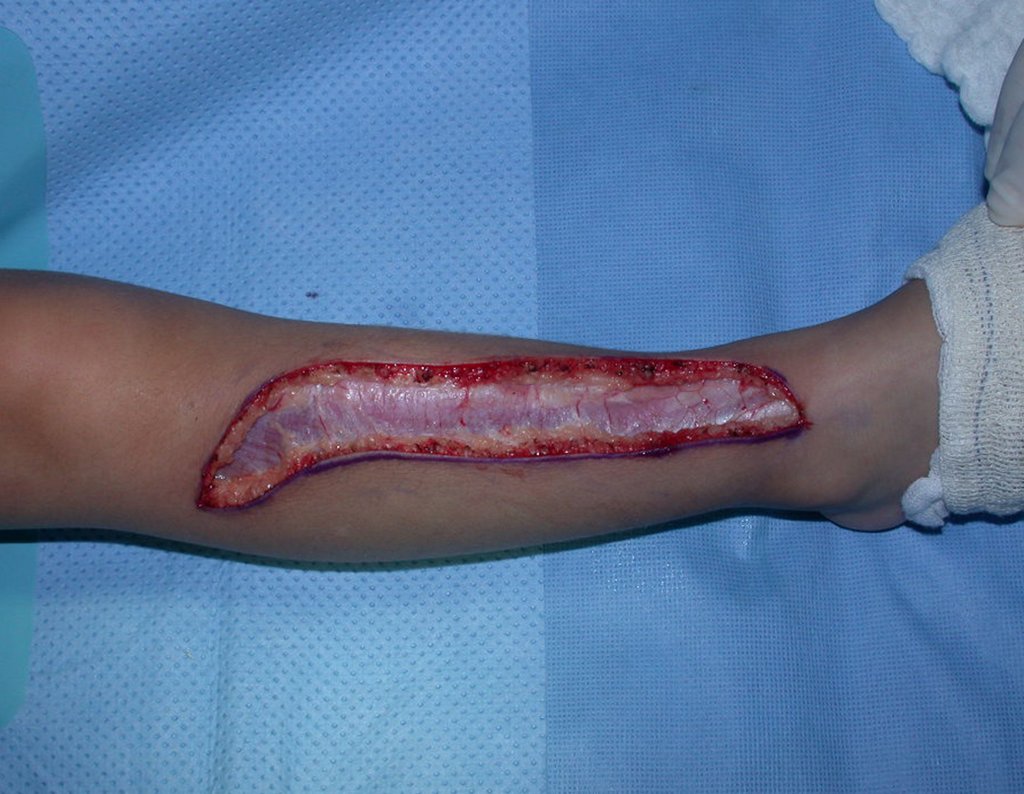
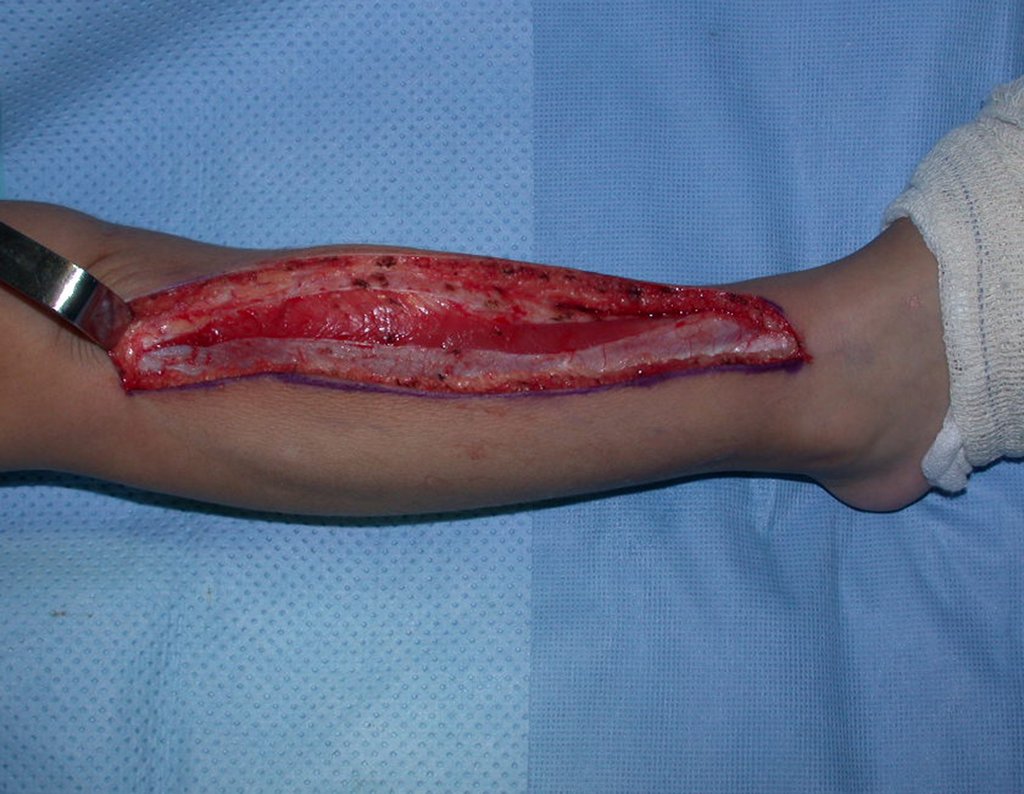
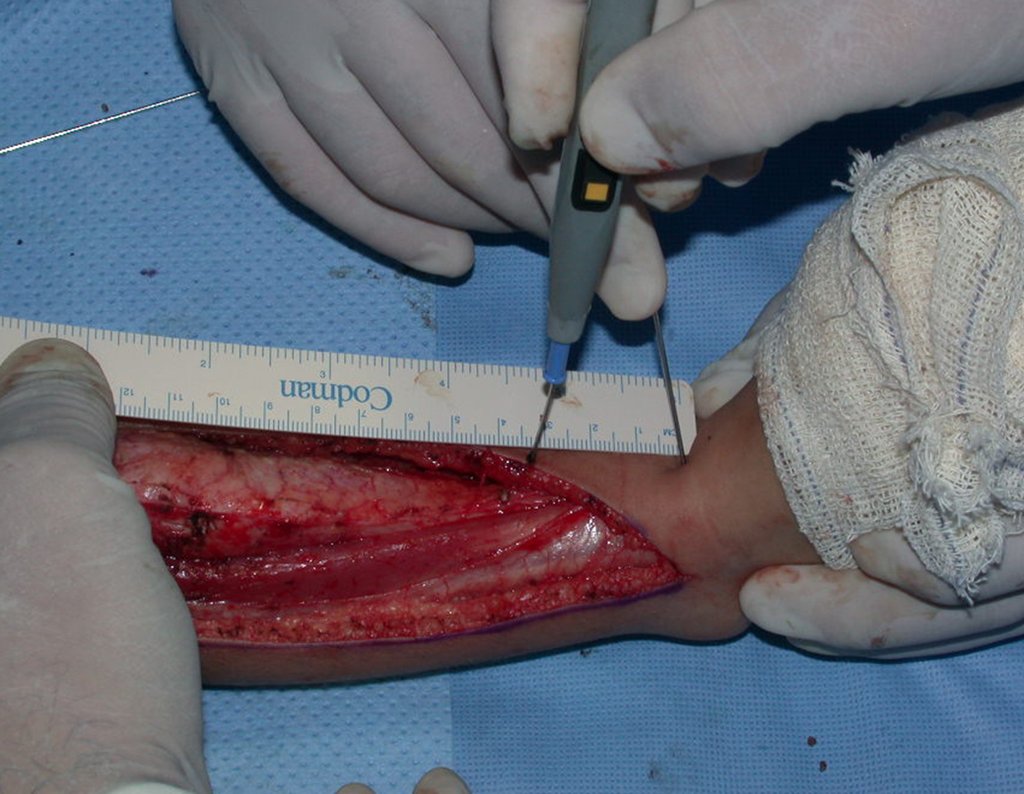
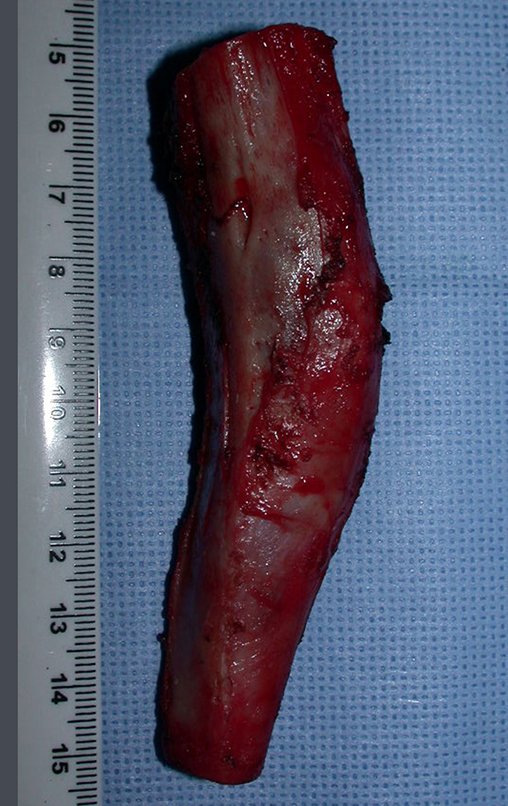
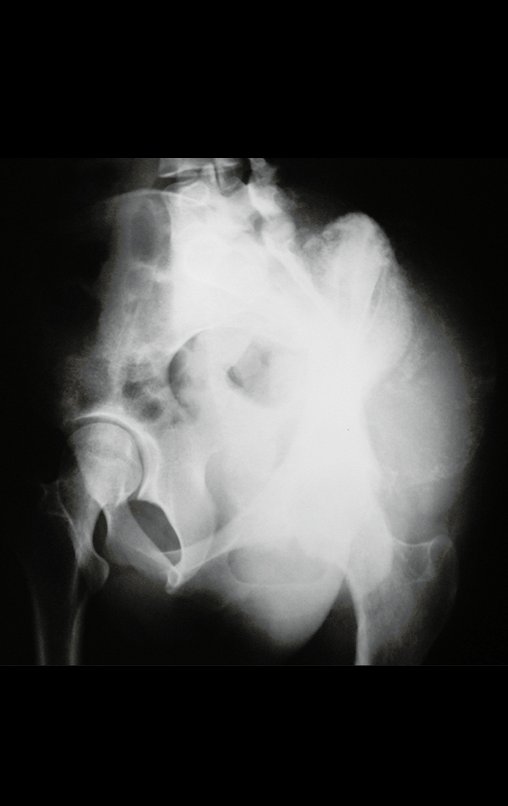
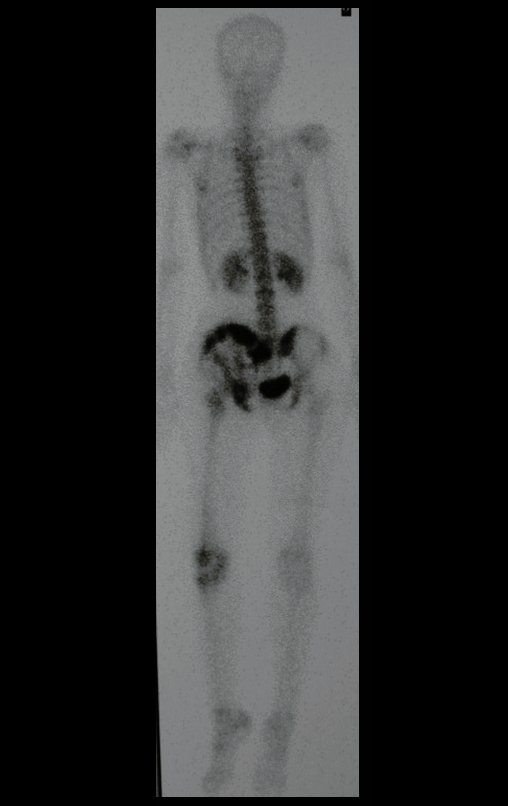
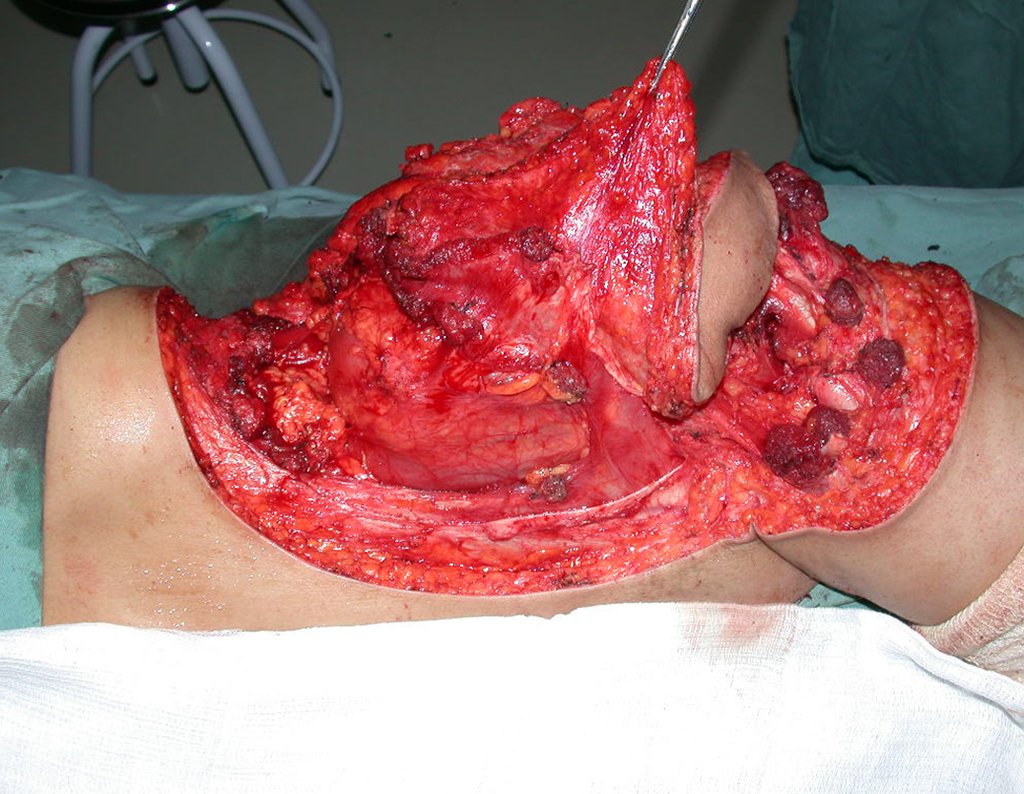
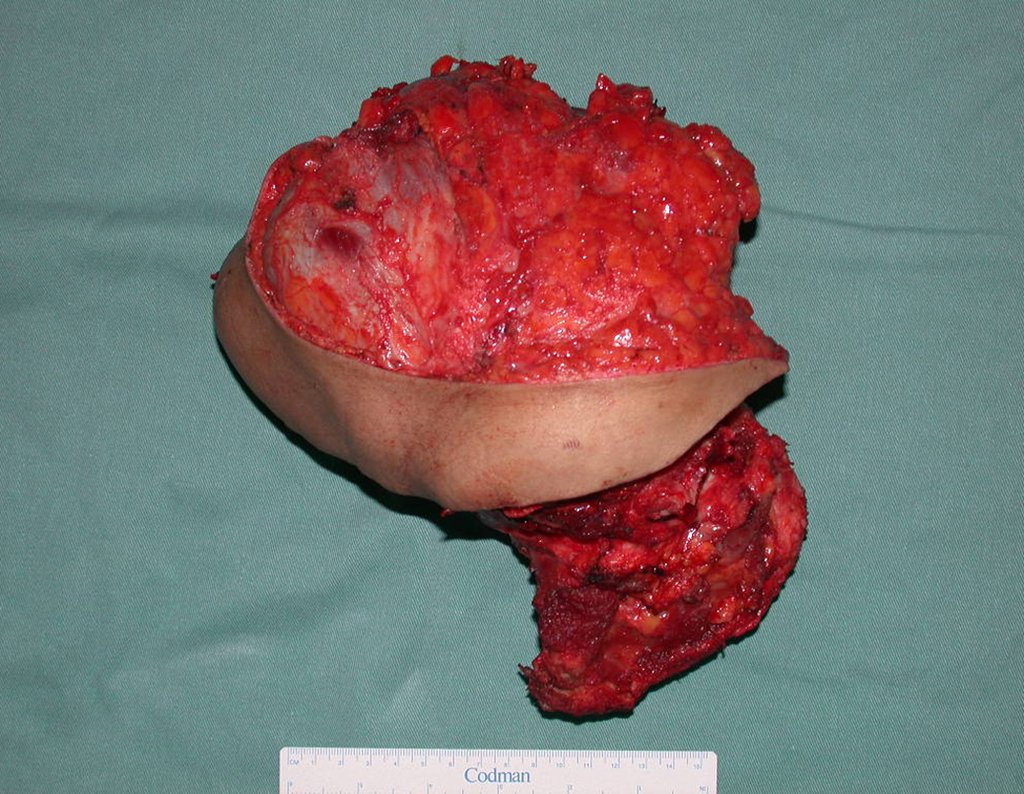
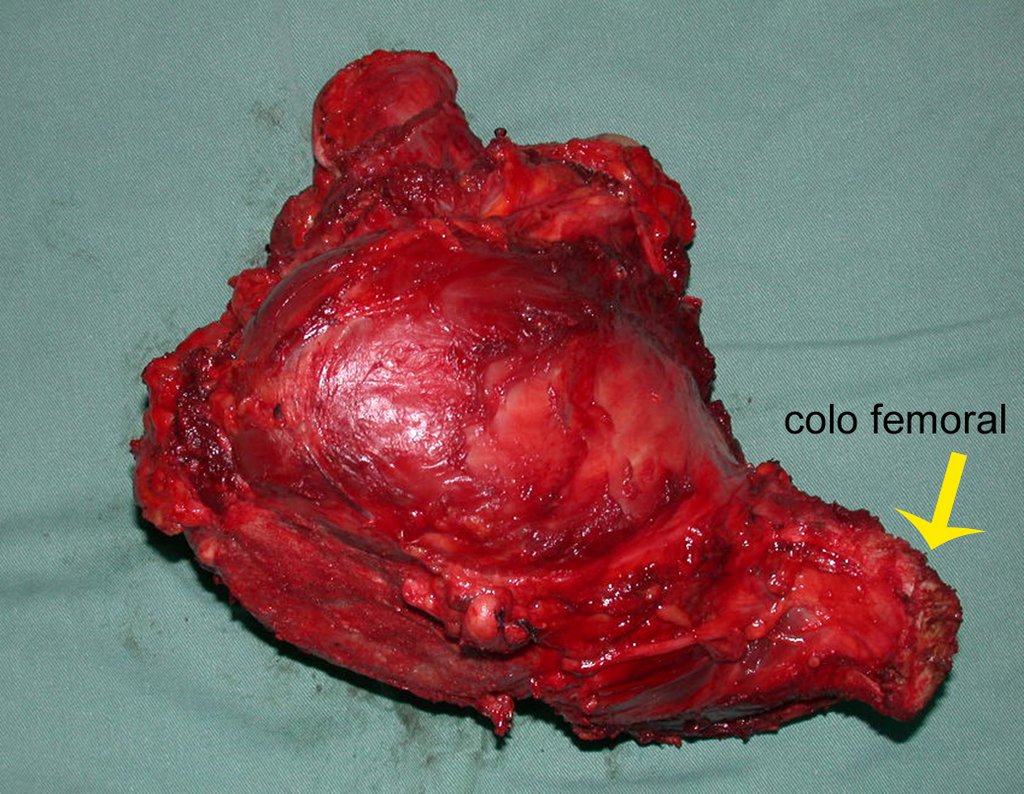
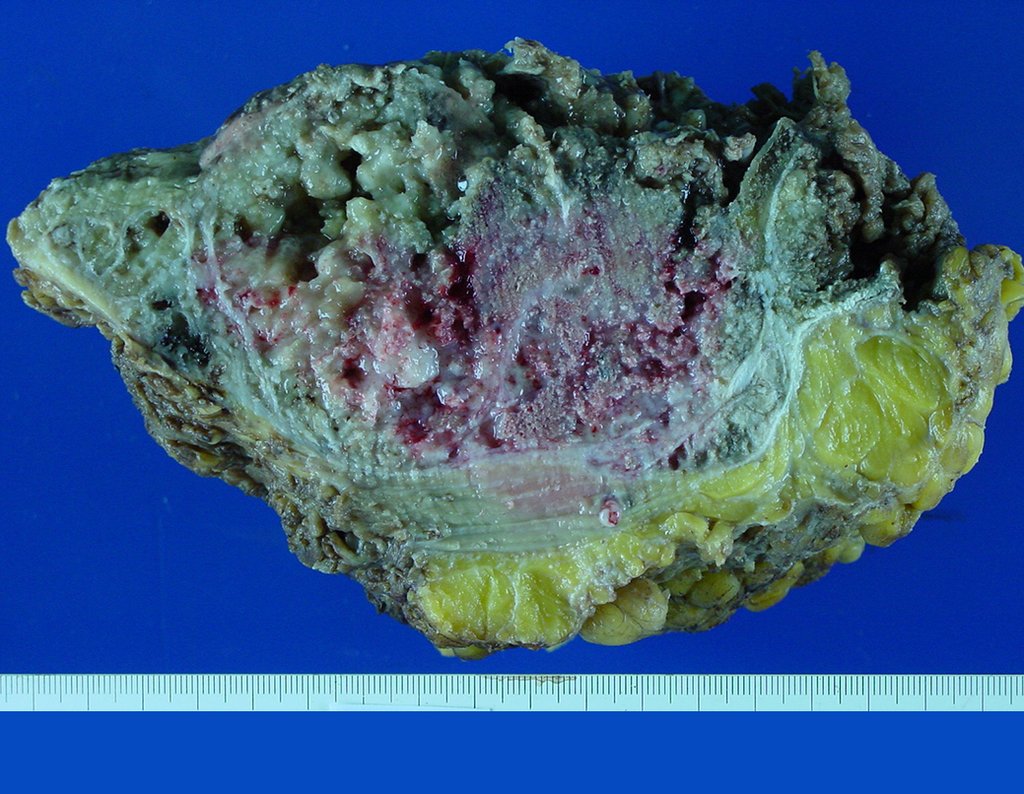
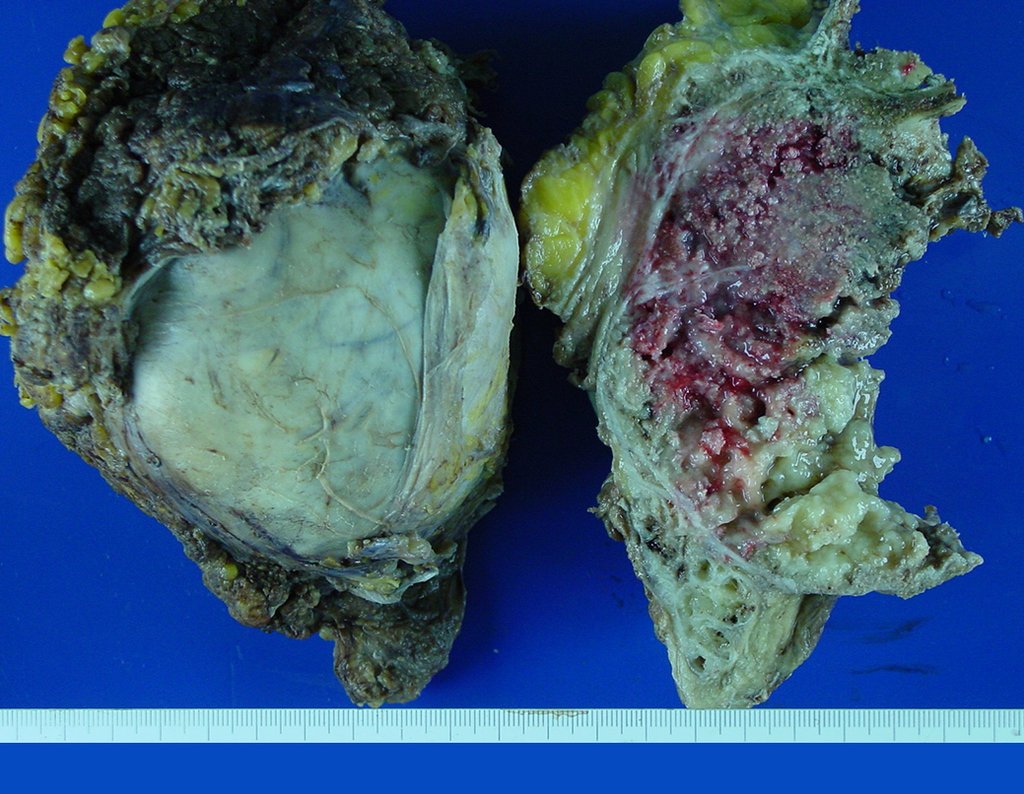
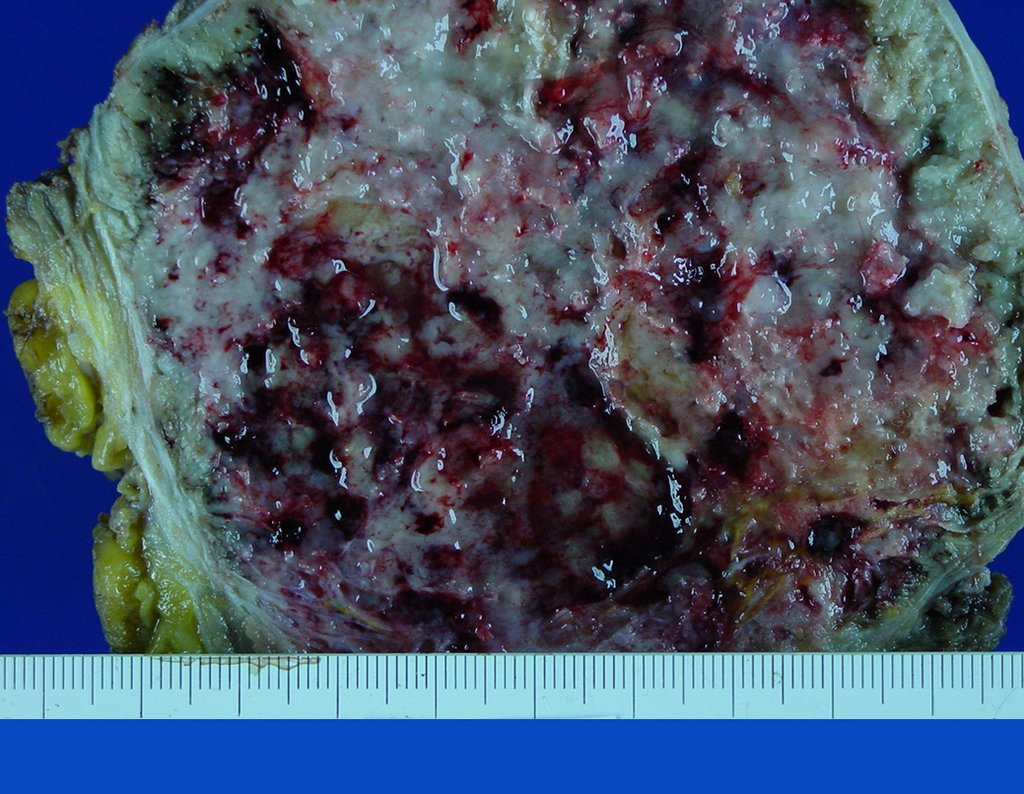
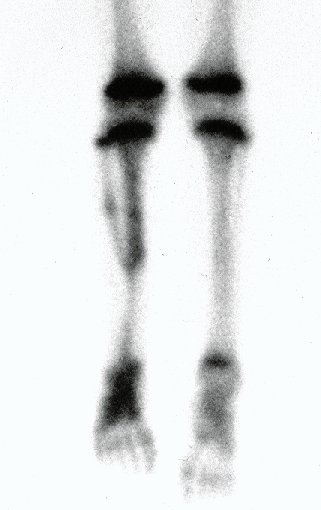
La demora de la atención compromete el tratamiento. La lesión evoluciona, destruye la estructura ósea, fractura y requiere procedimientos quirúrgicos mayores. En esta ocasión fue realizado el estadiamiento del tumor, que no presentó otro foco de enfermedad. Fue realizada la biopsia de la lesión, con aguja de Jamshidi con anestesia local y control radiológico, planificación de resección y aspecto clínico pre operatorio (Figuras 11 a 18).
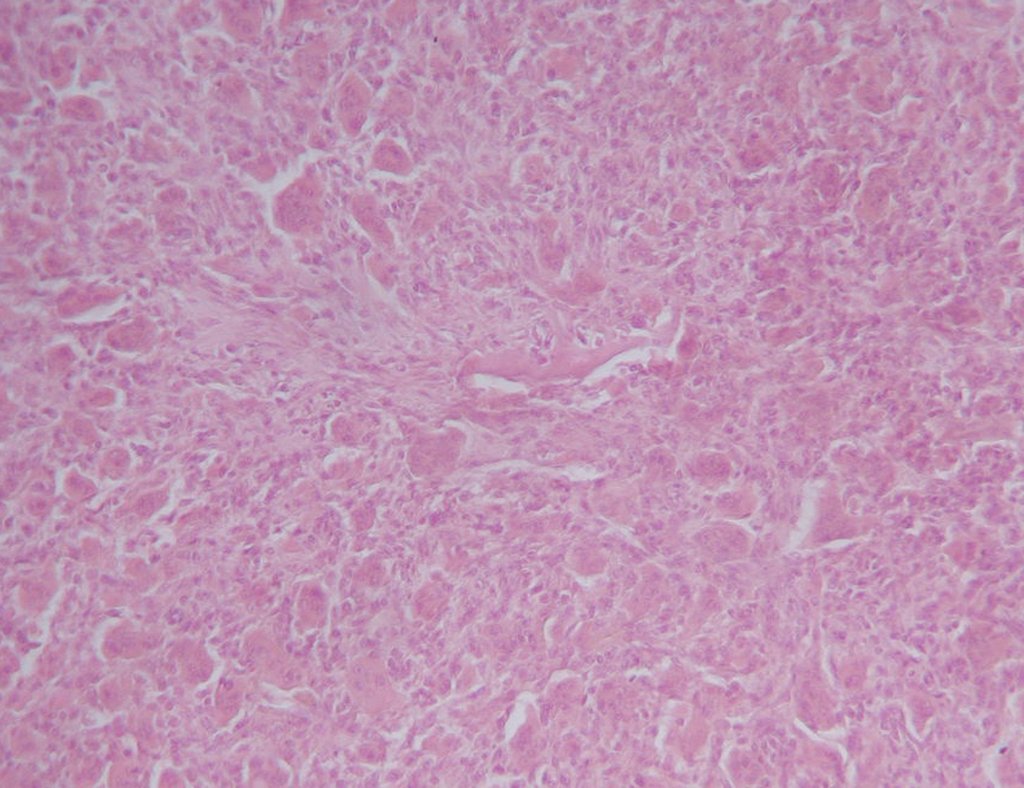
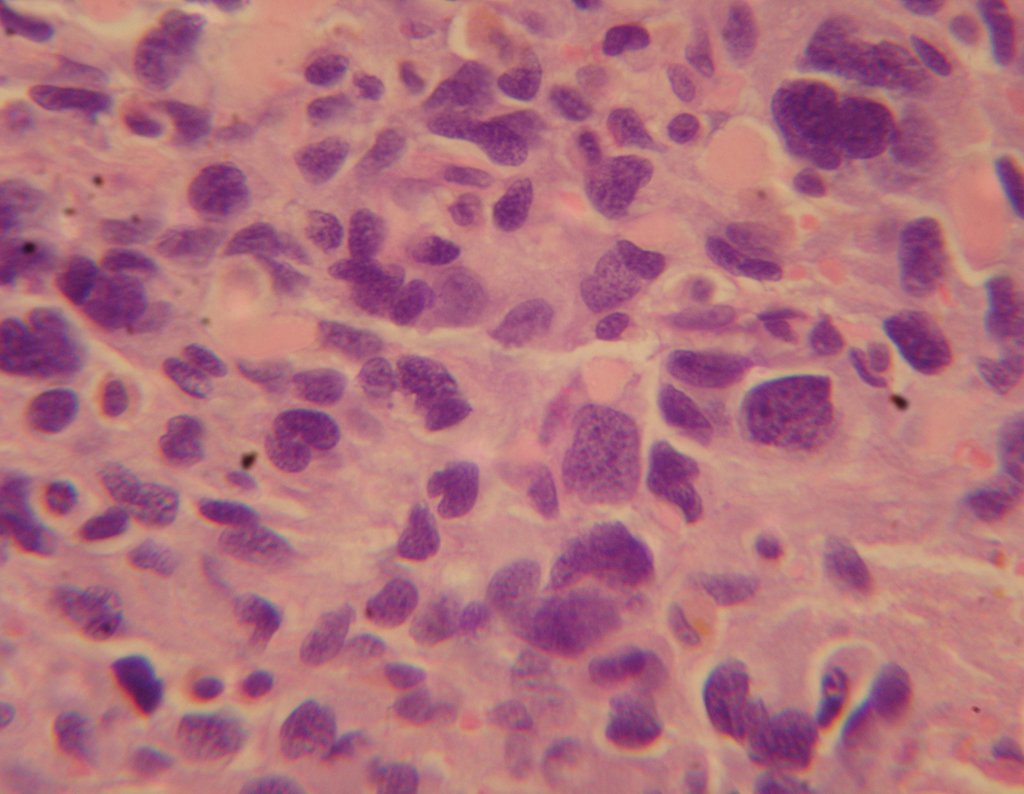
El diagnóstico histológico de la biopsia confirma la sospecha clínica de tumor de células gigantes (Figura 19 a 24).
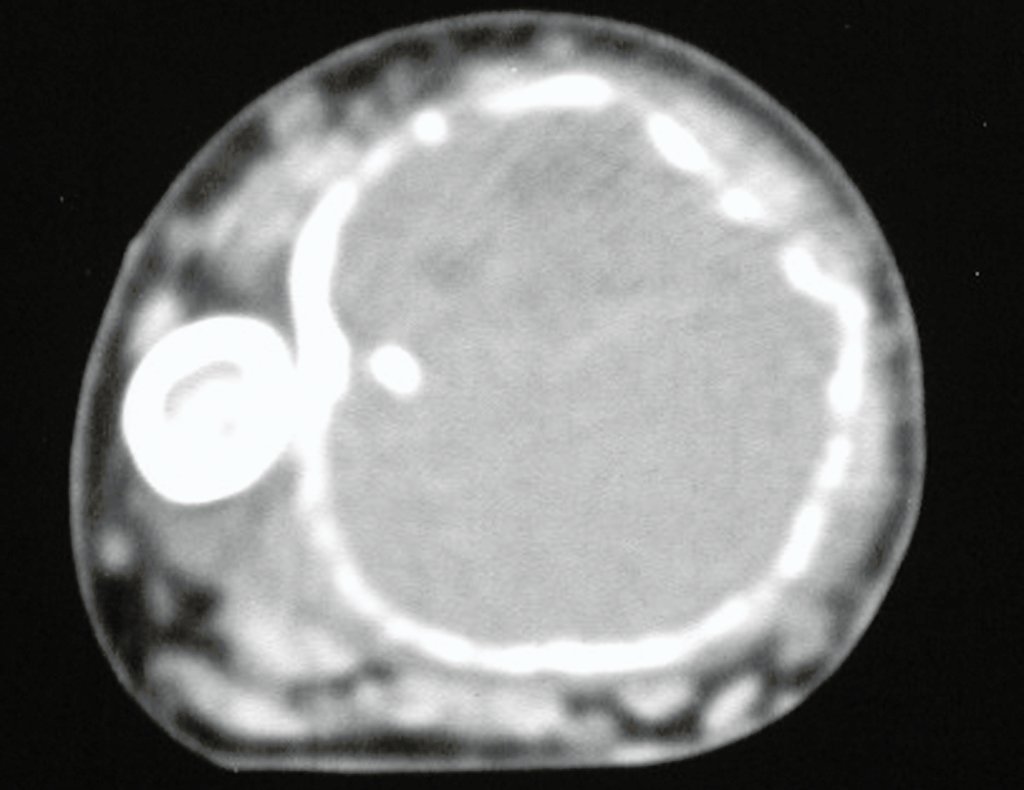
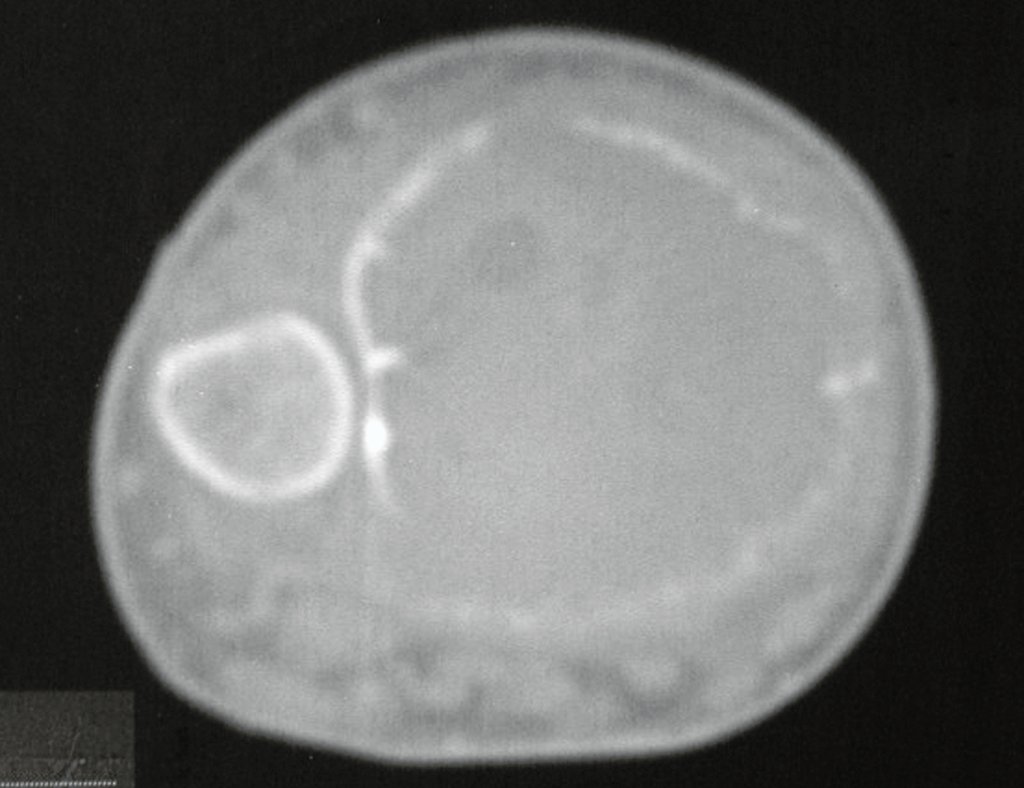
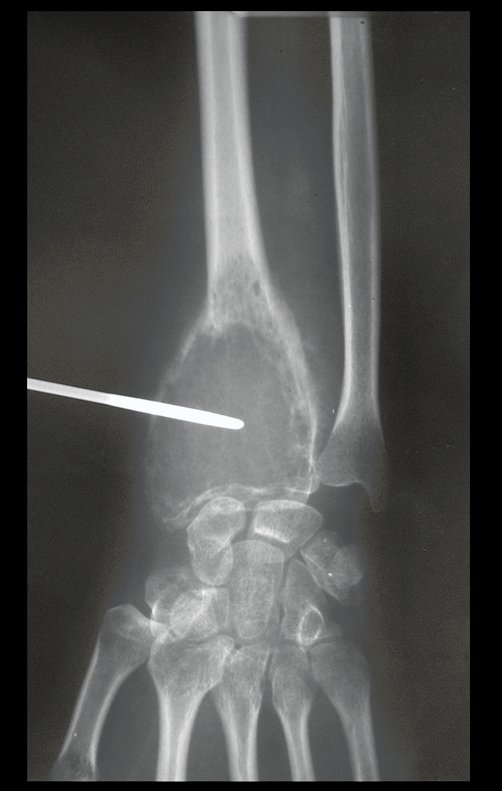
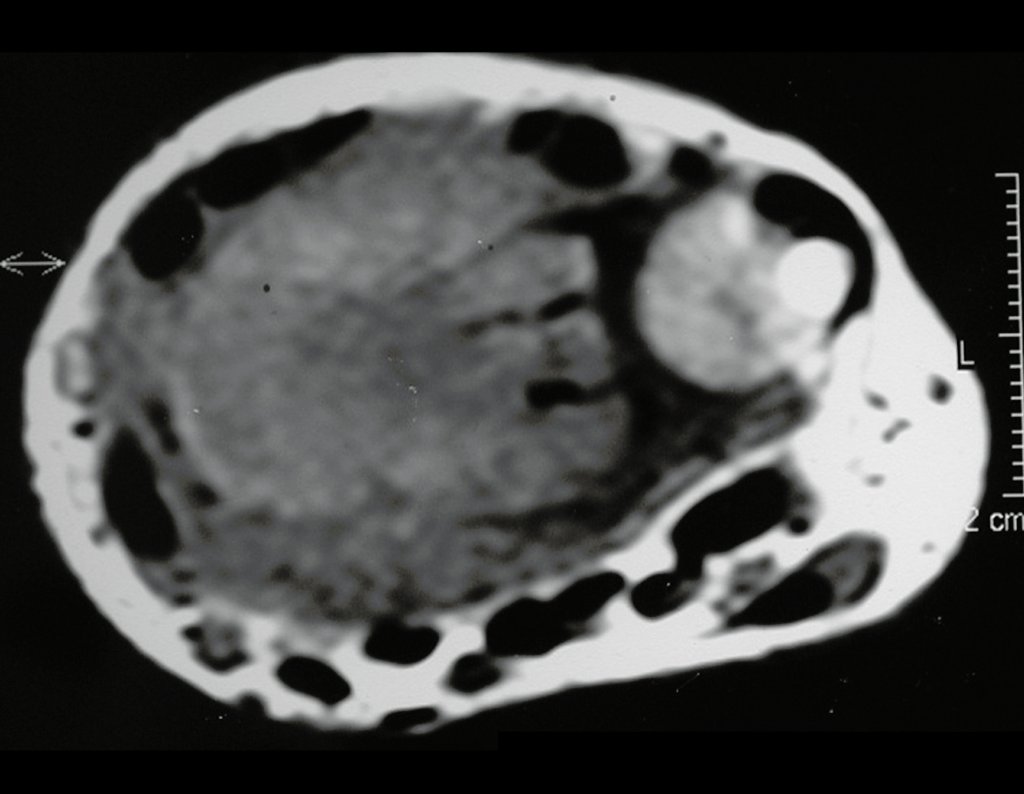
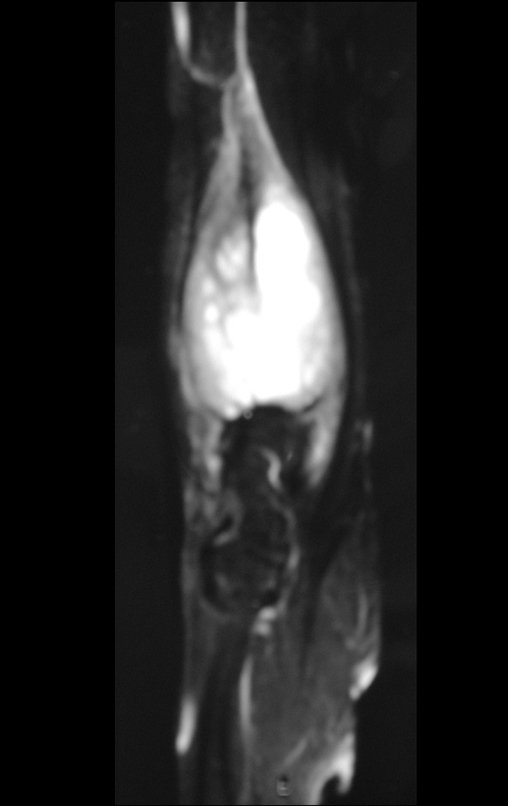
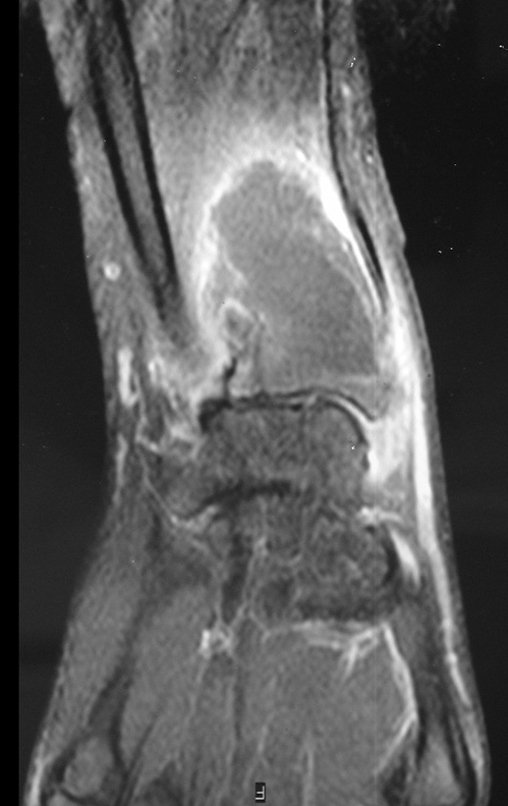
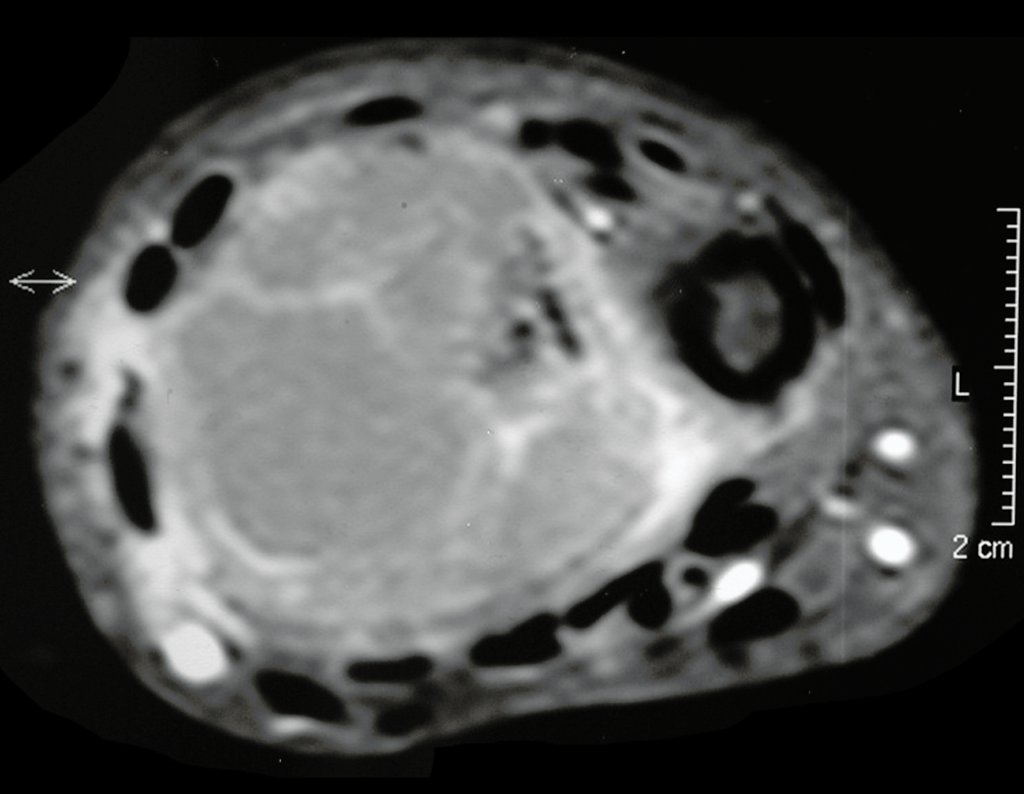
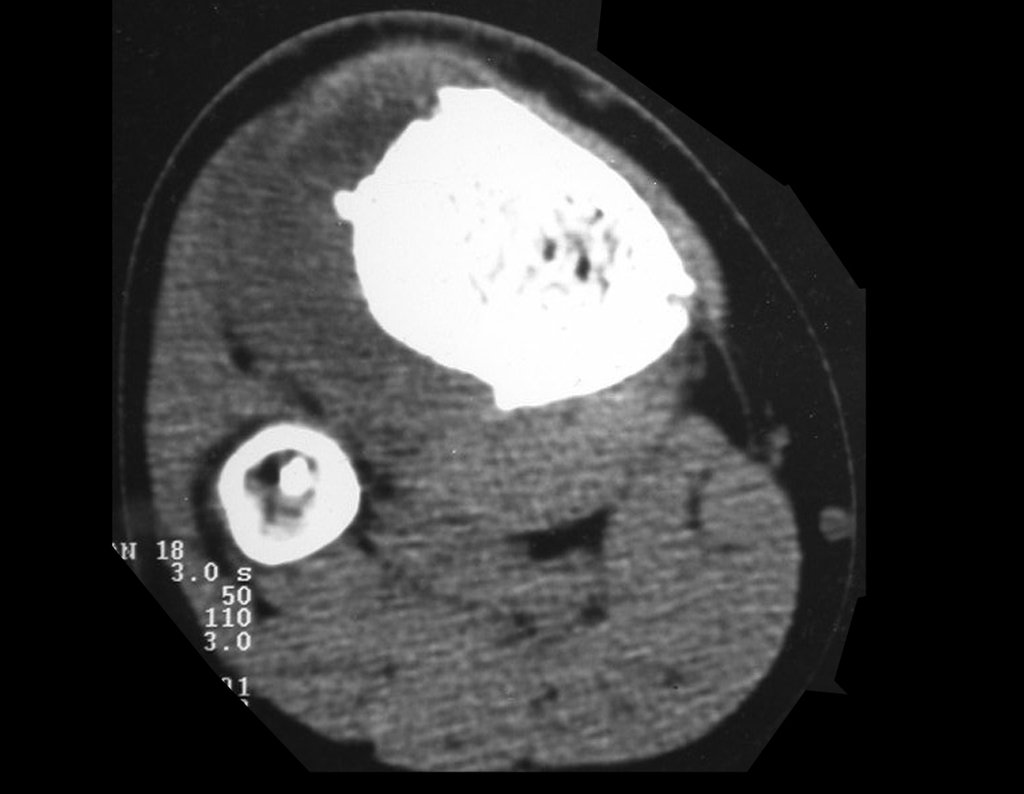
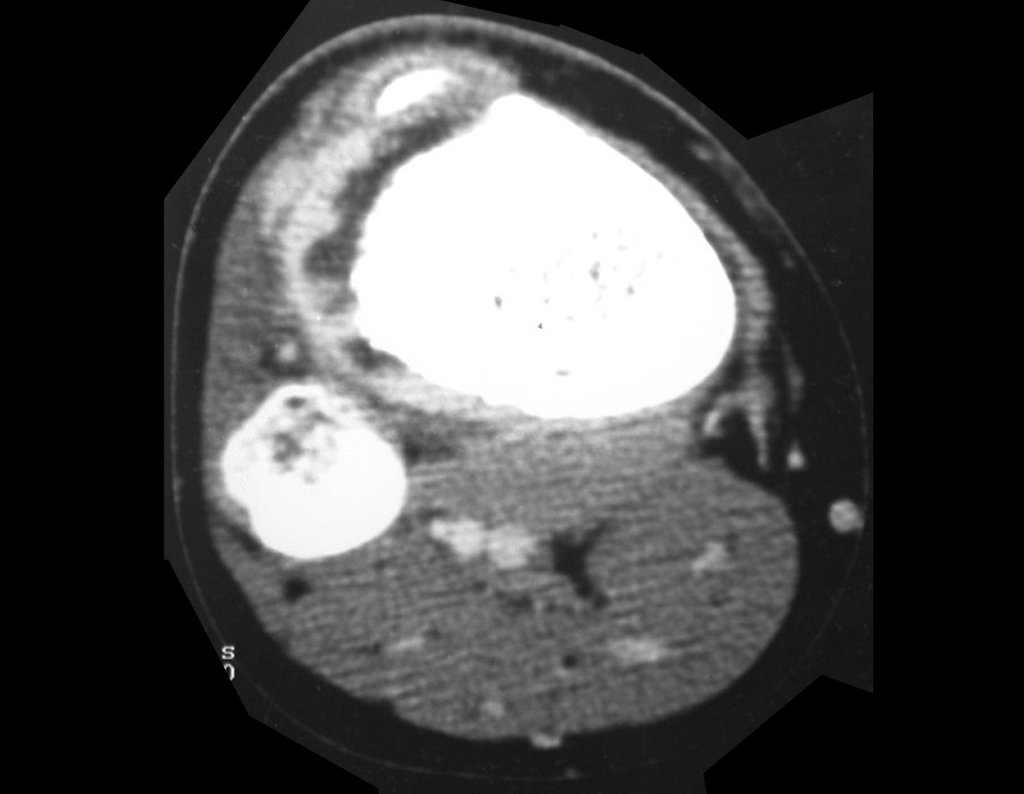
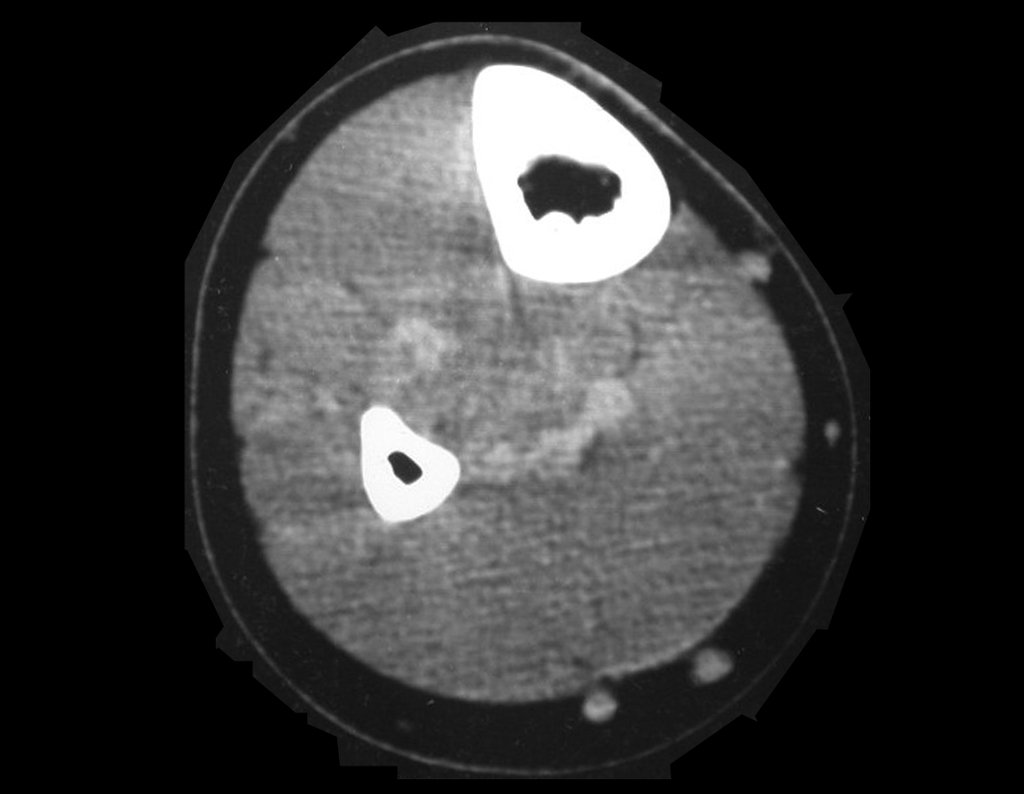
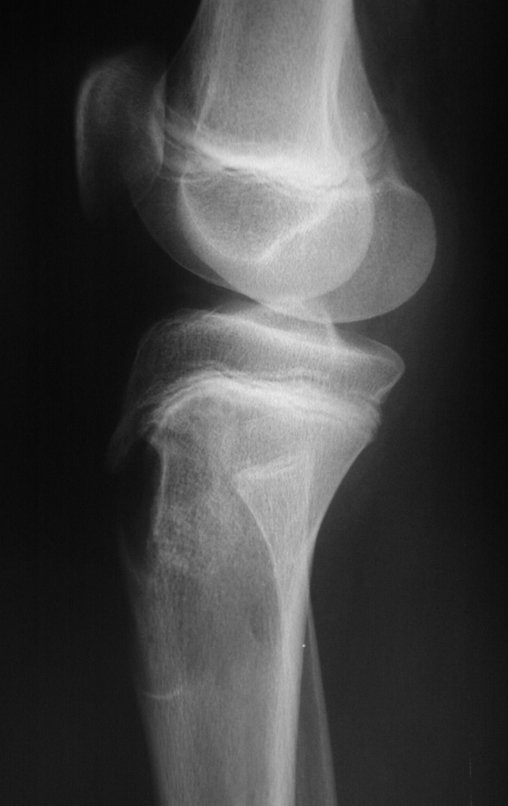
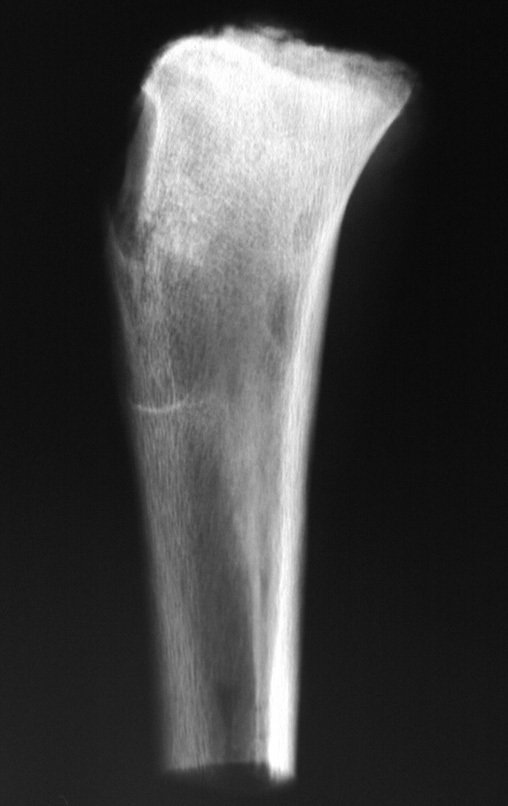
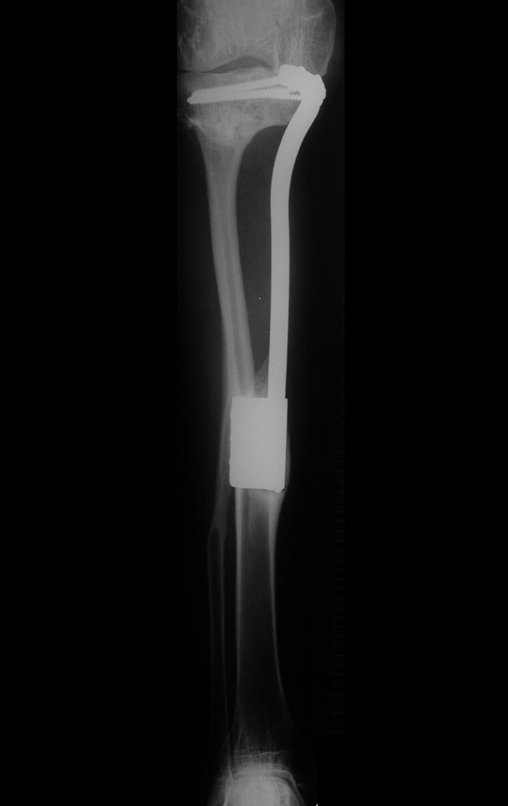
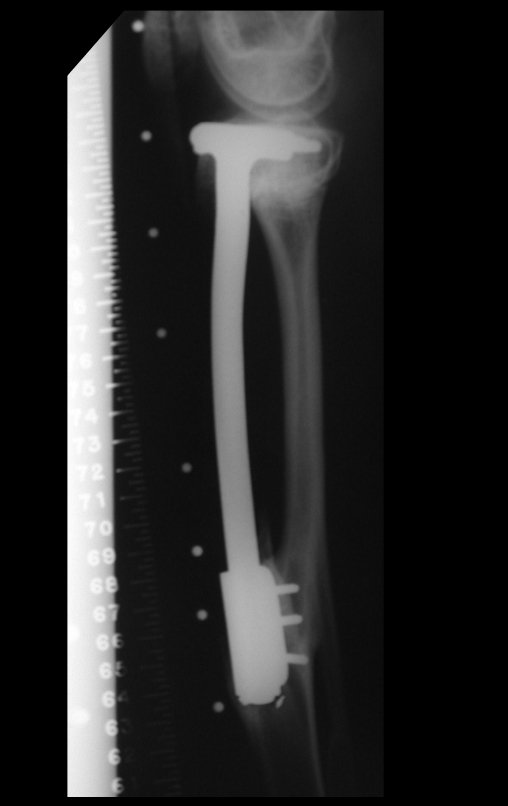
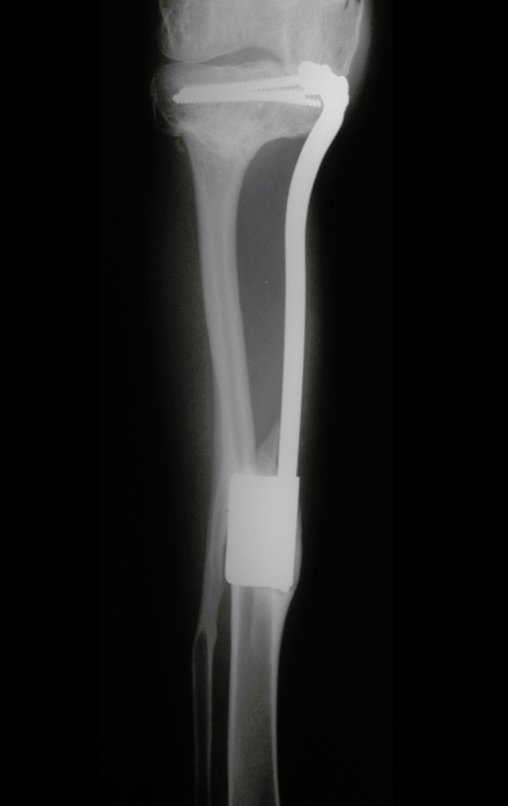
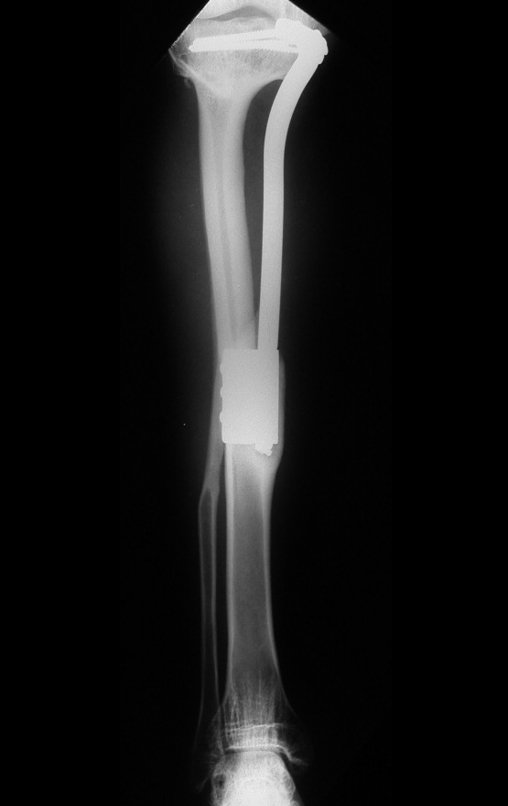
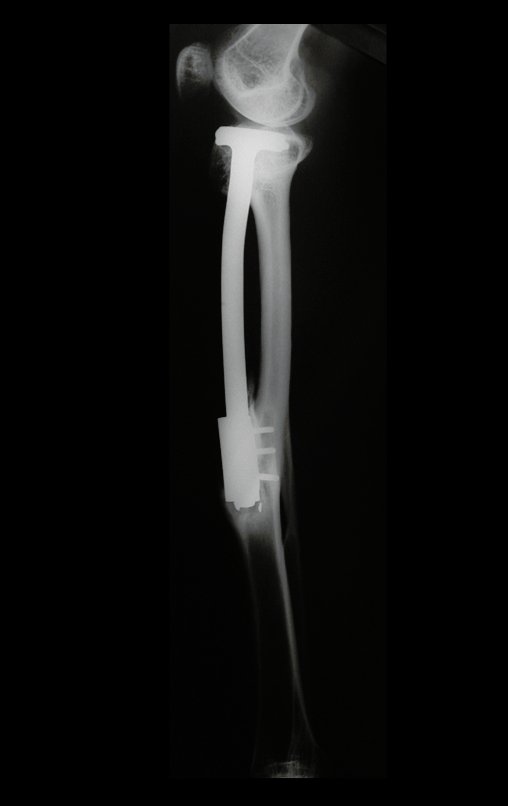
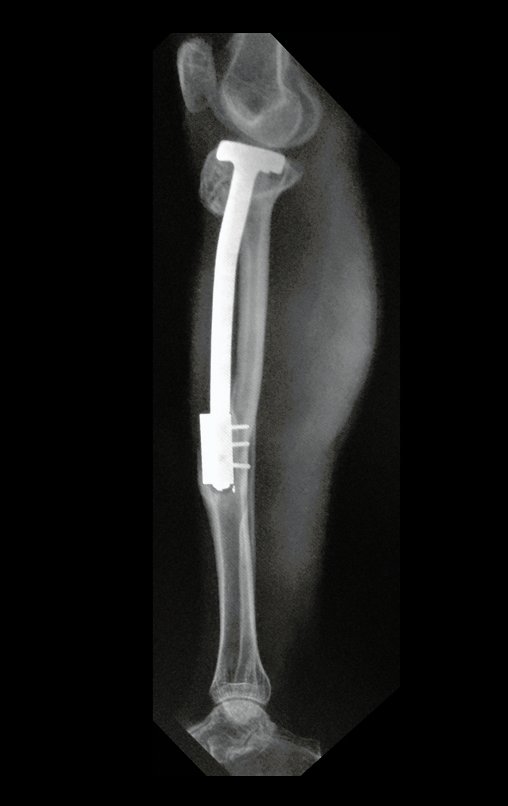
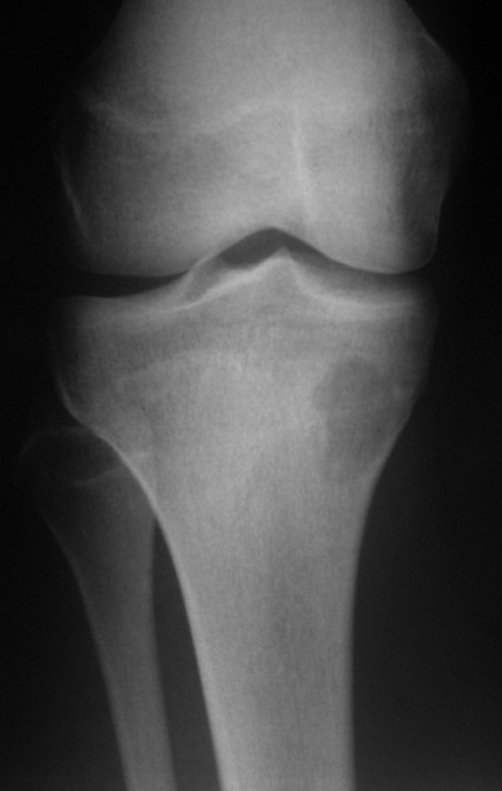
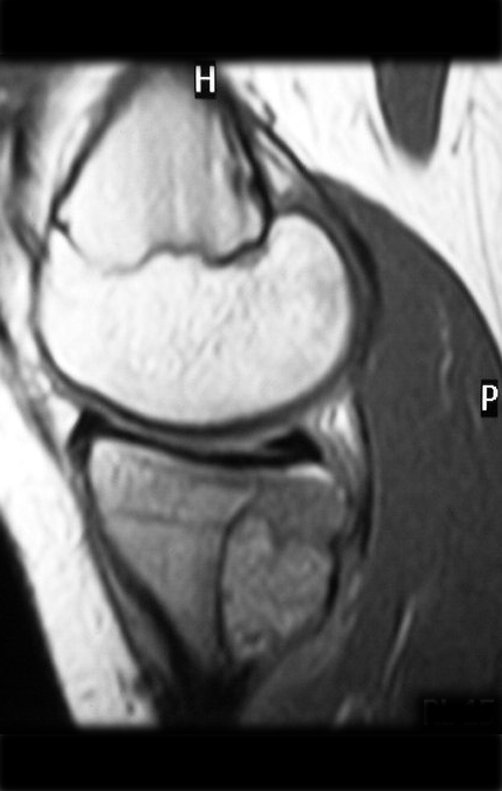
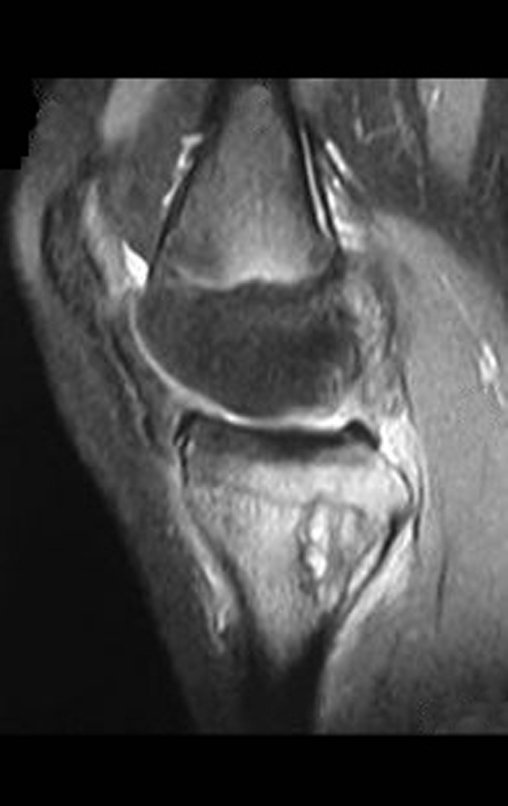
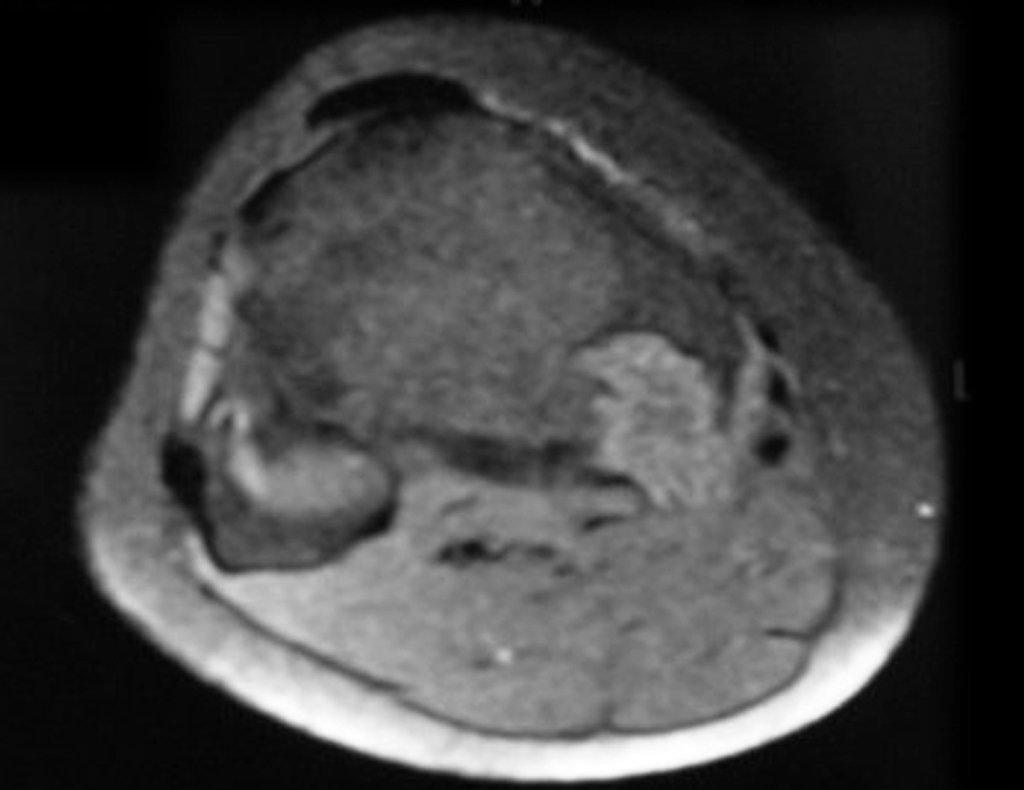
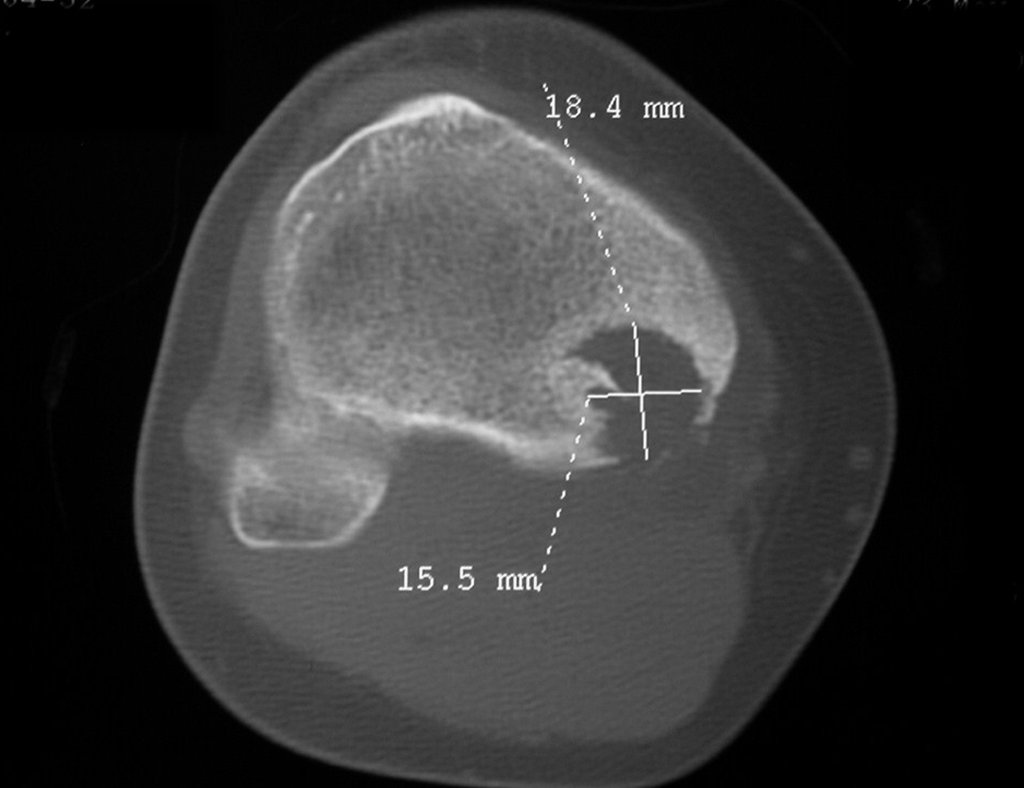
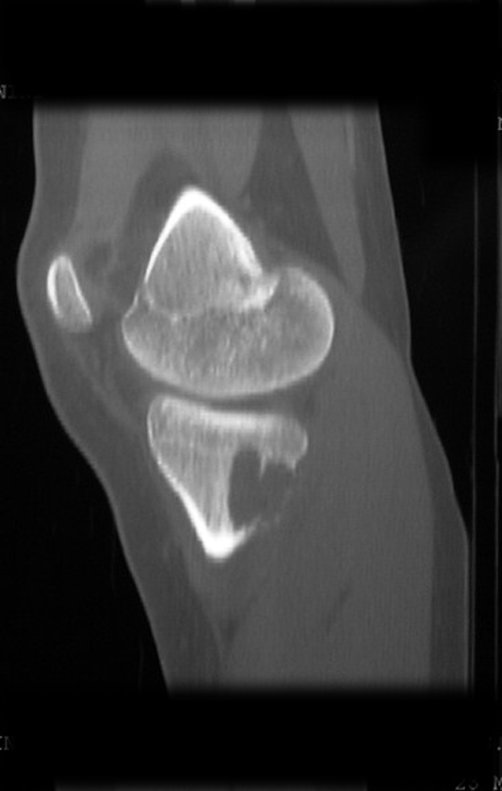
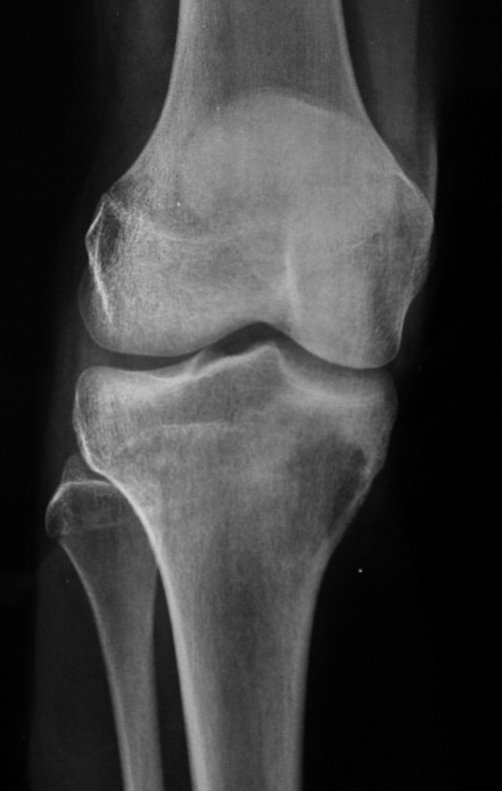
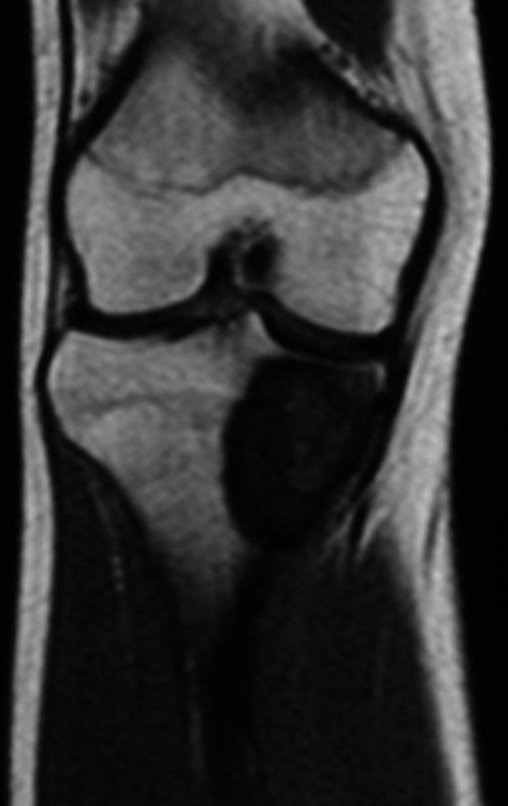
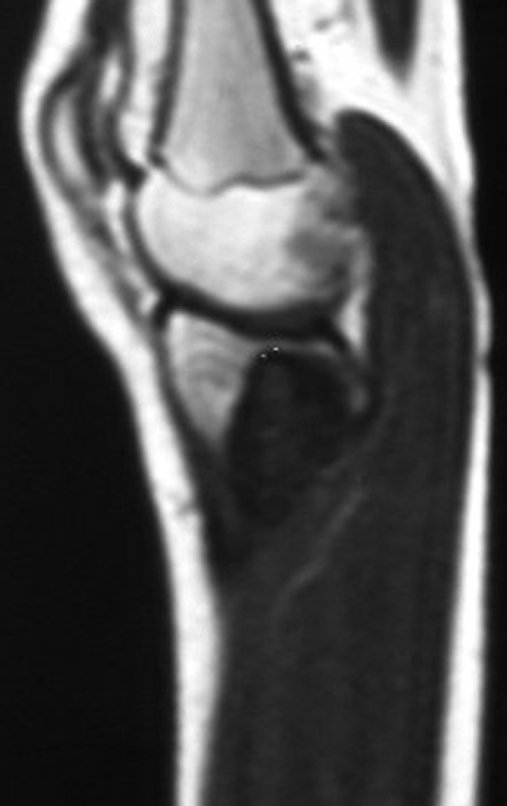
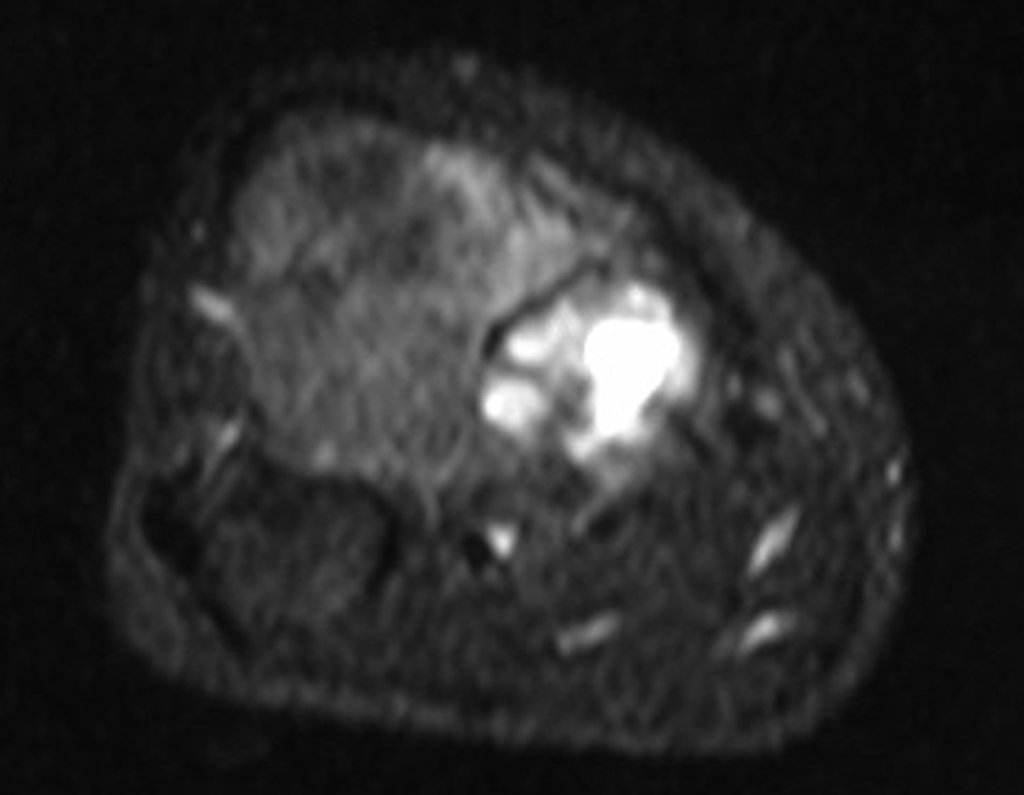
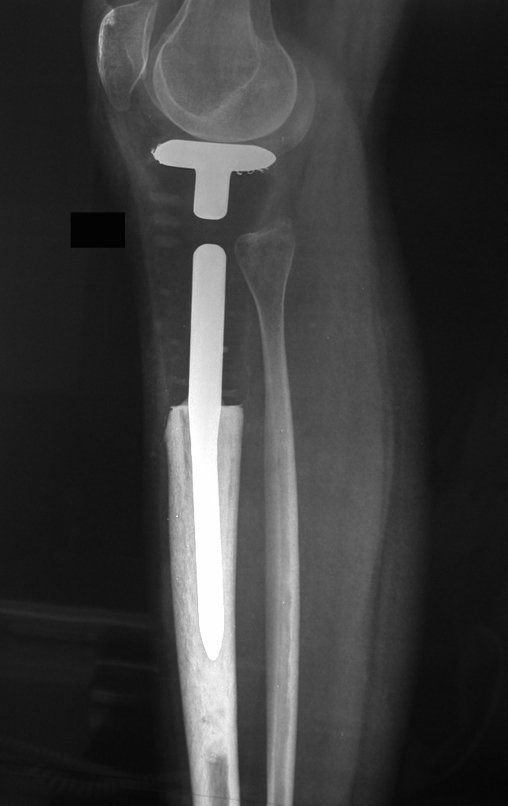
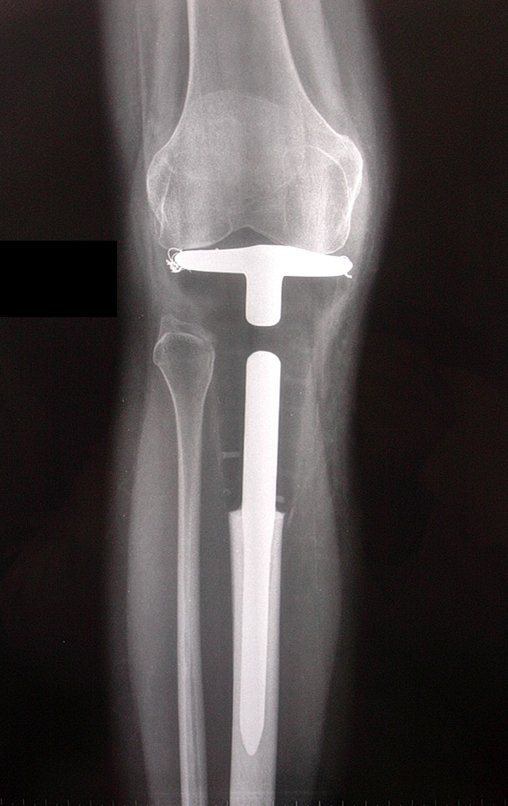
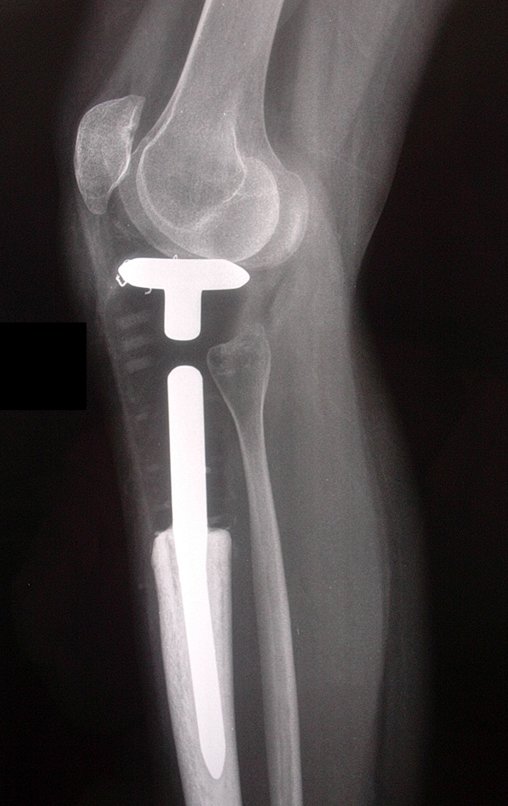
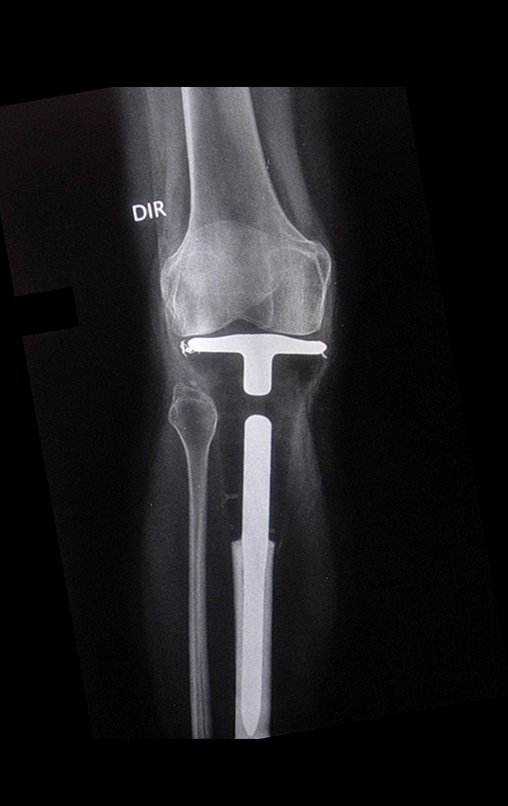
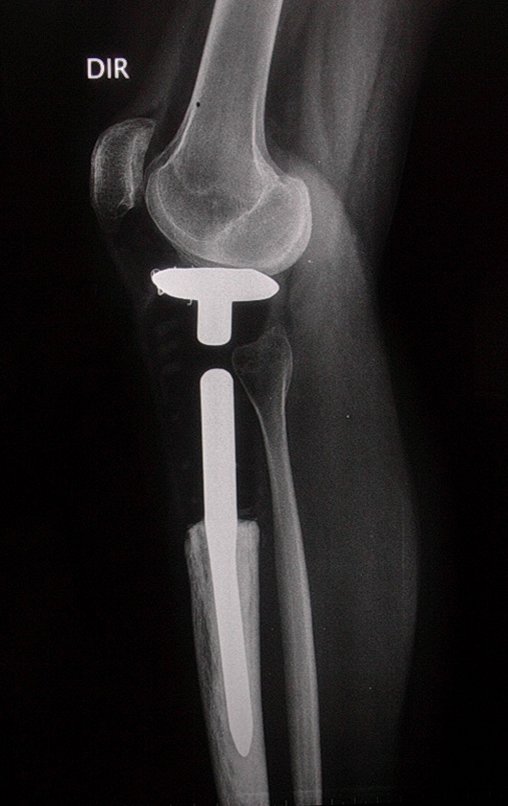
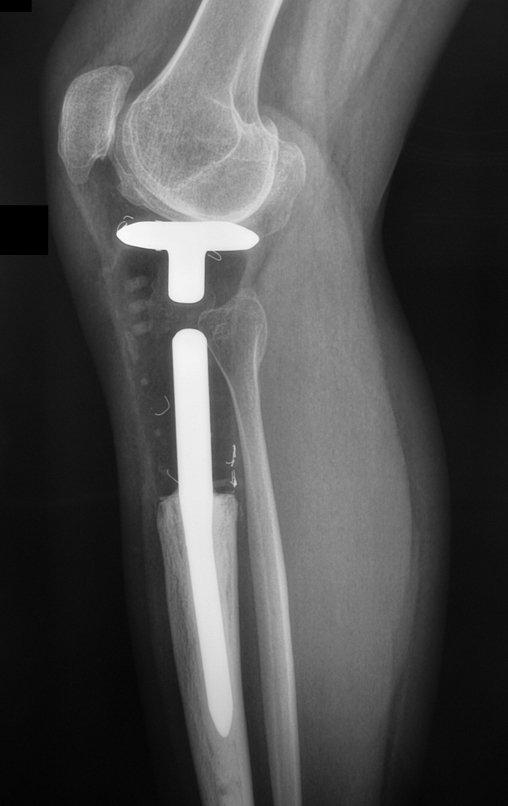
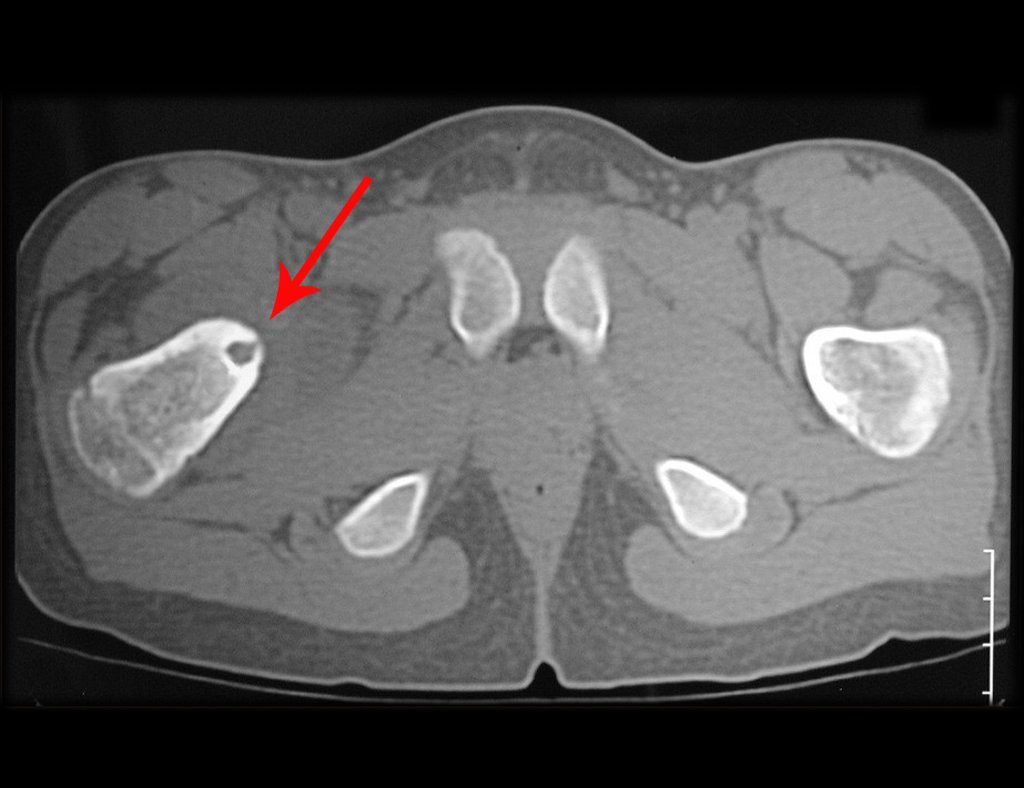
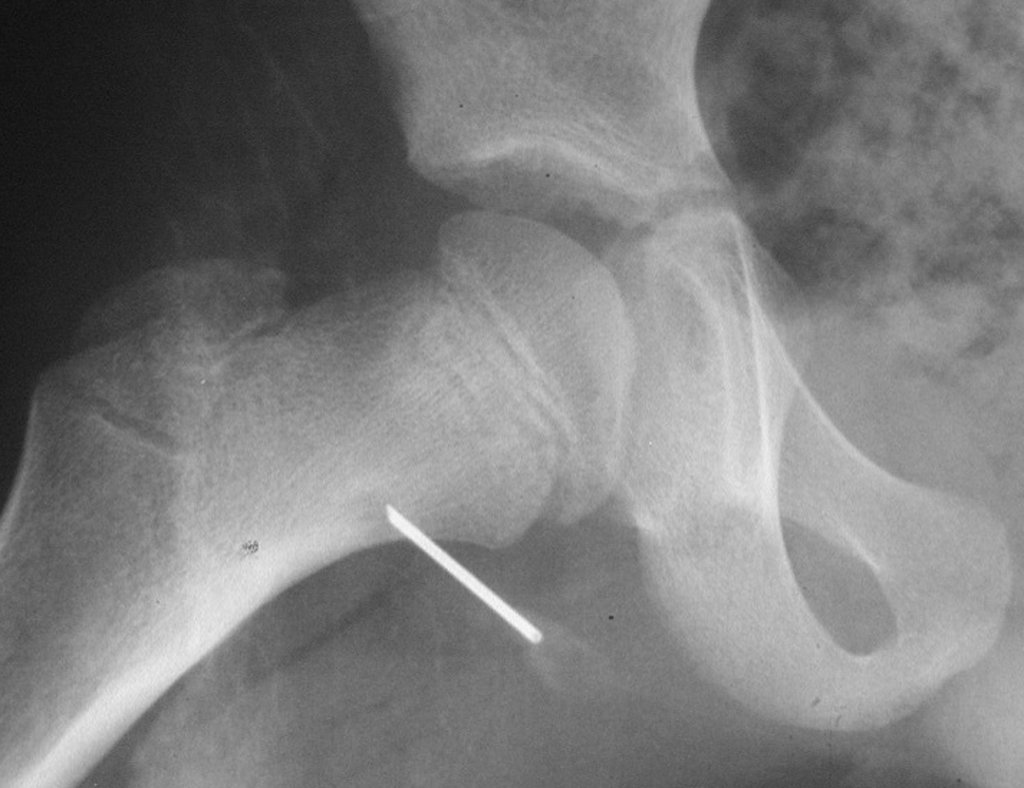
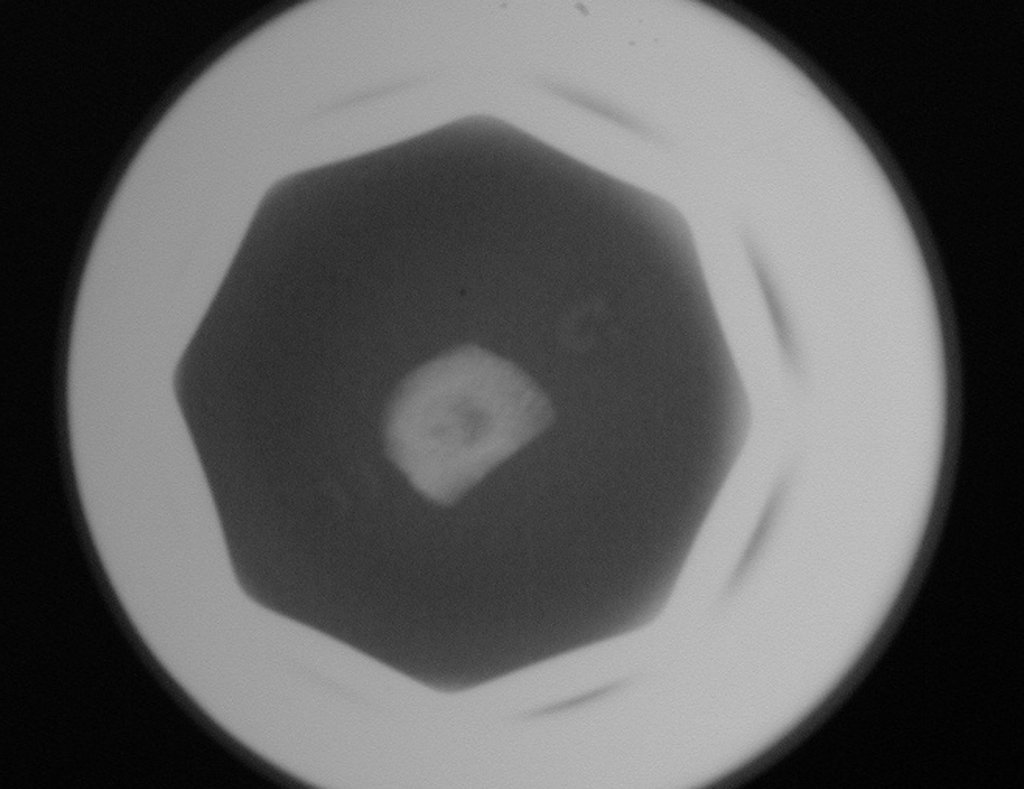
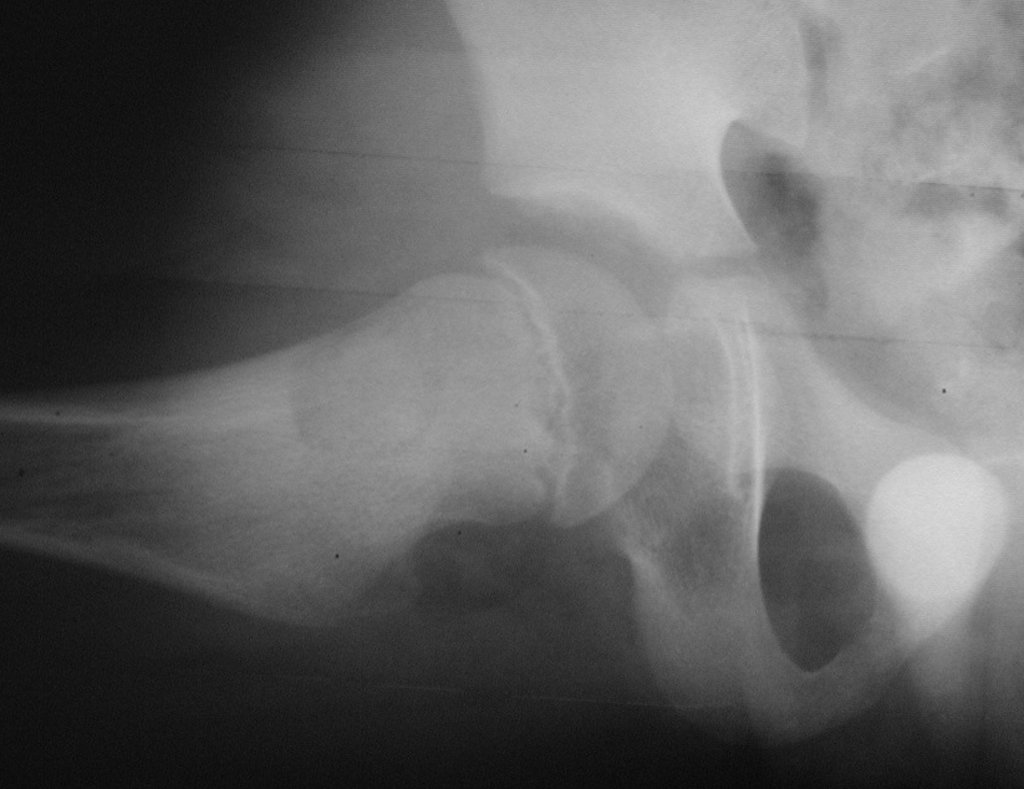
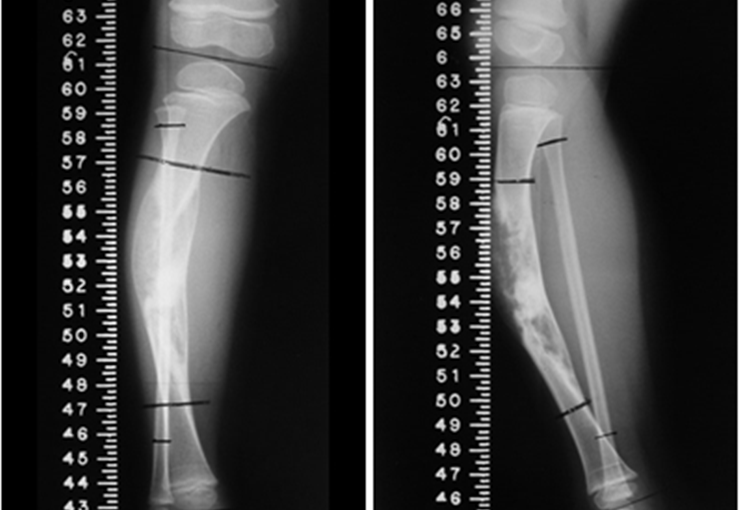
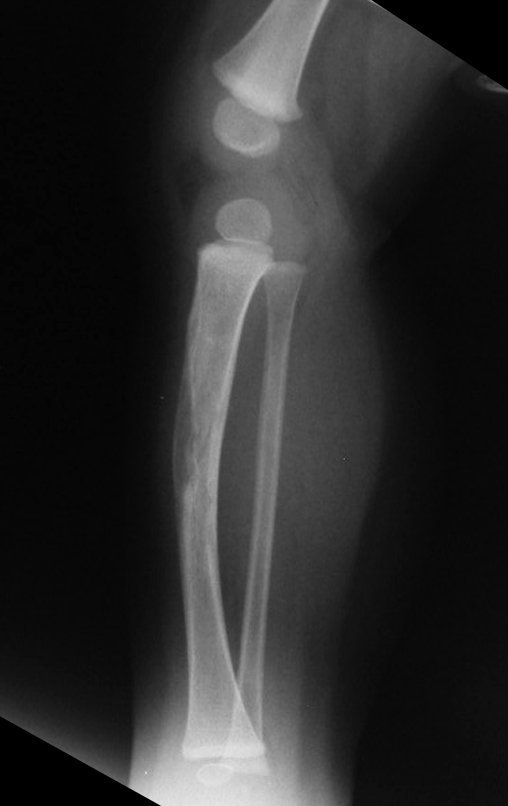
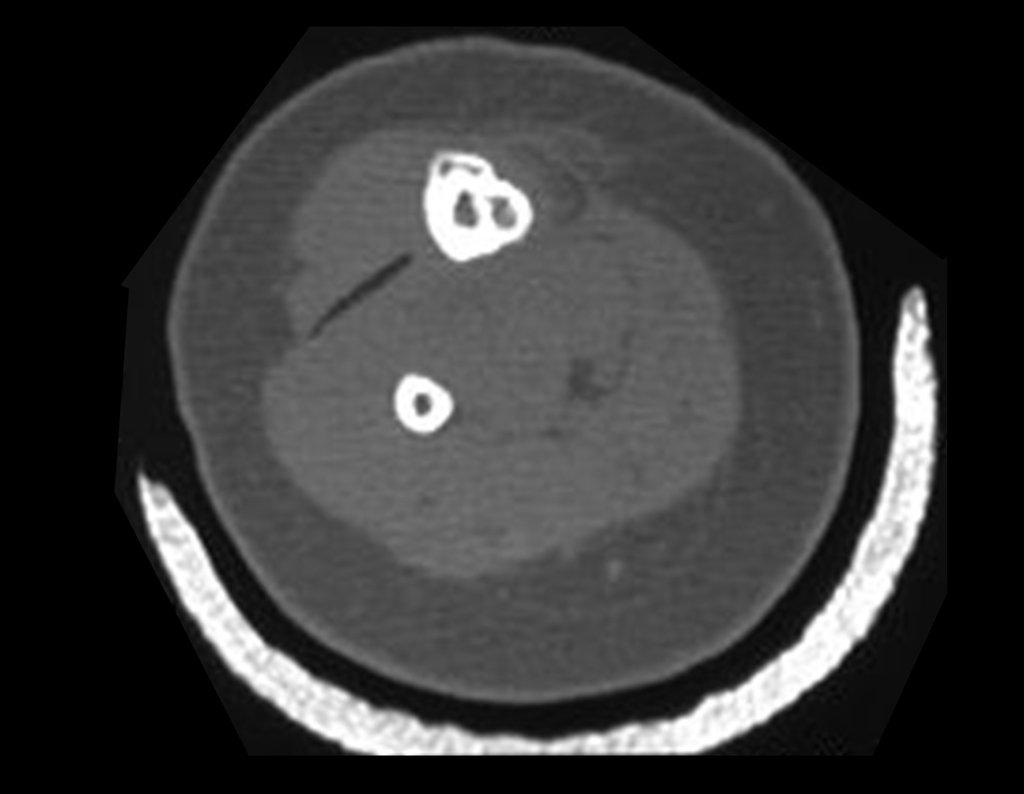
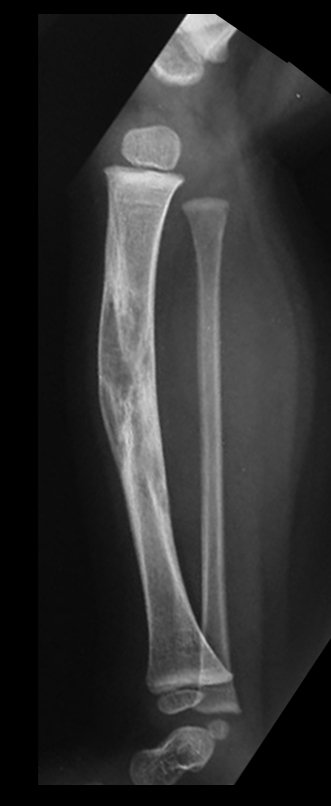
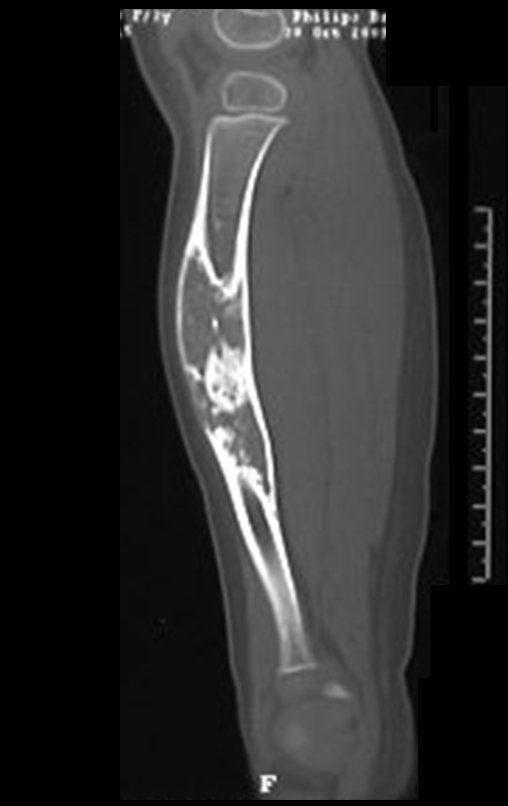
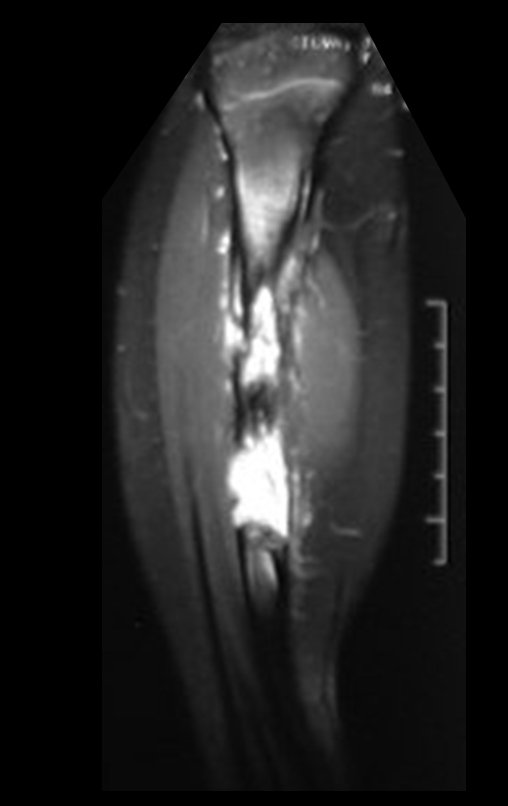
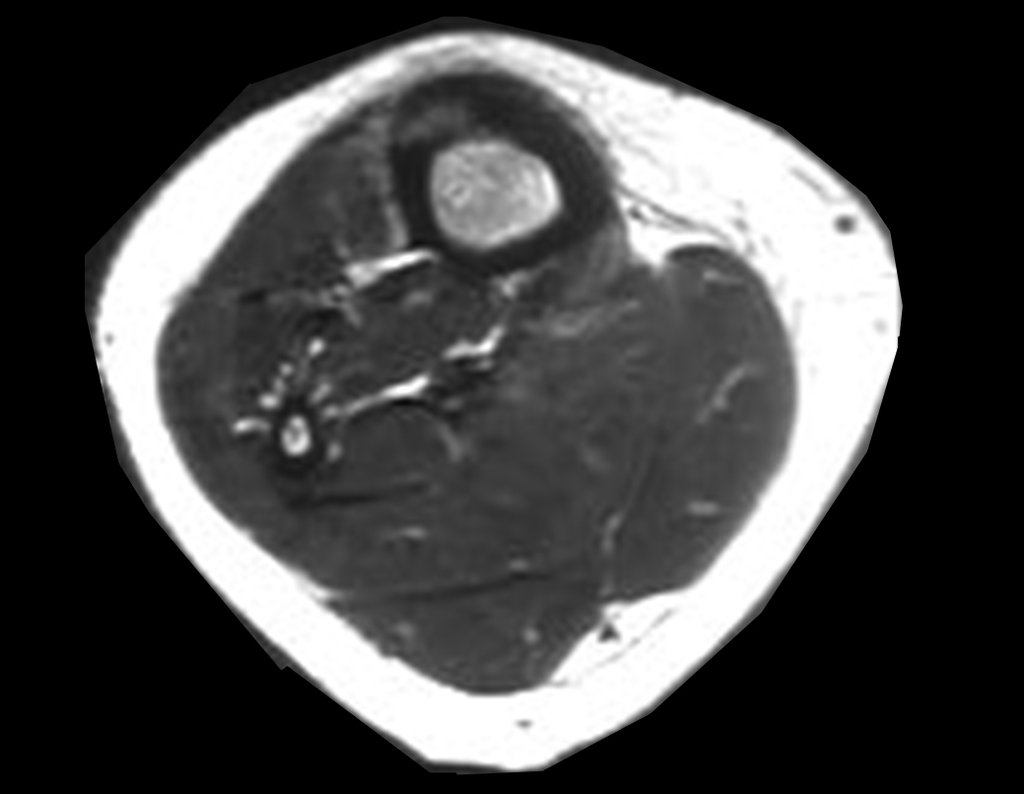
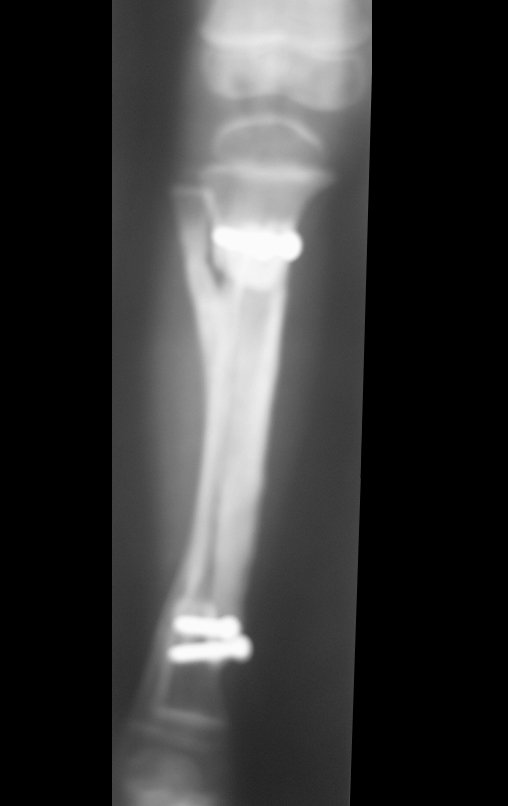
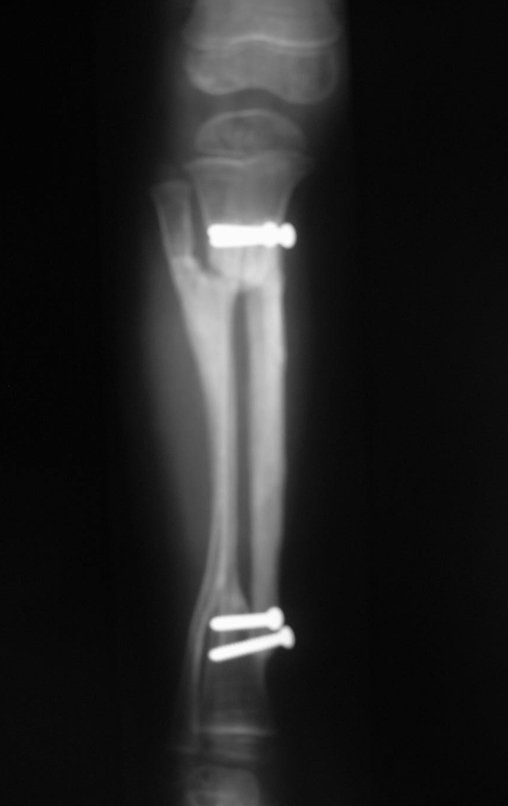
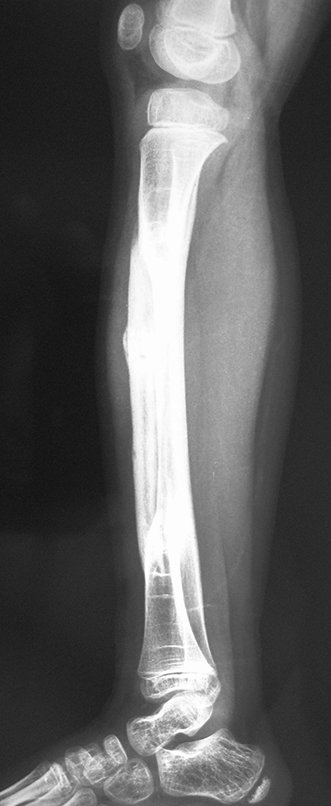
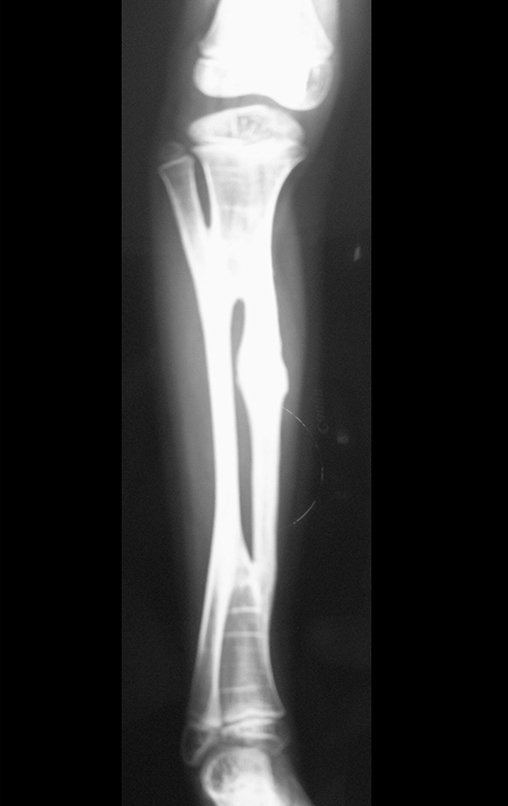
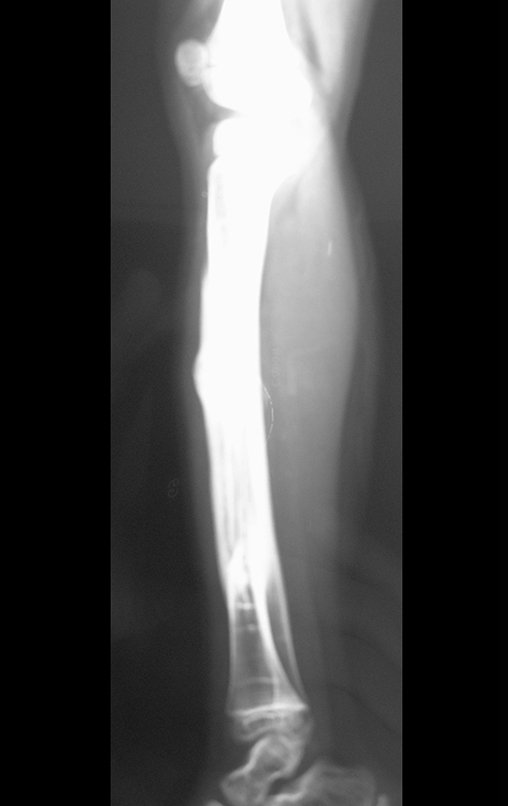
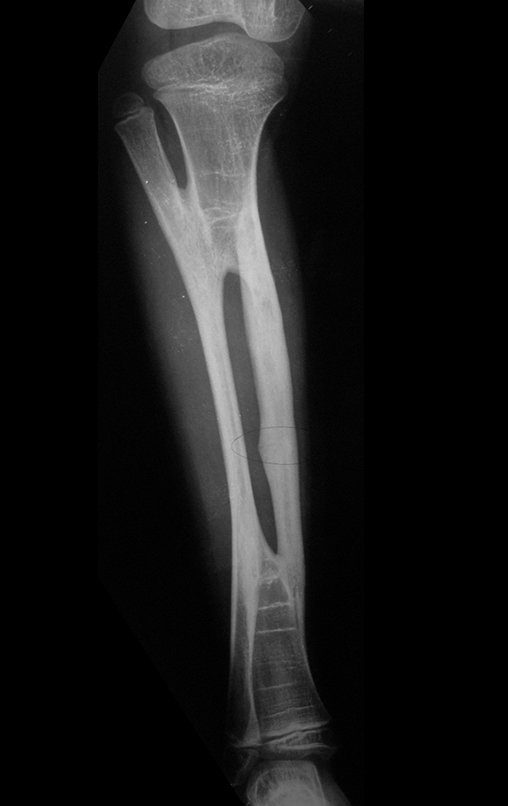
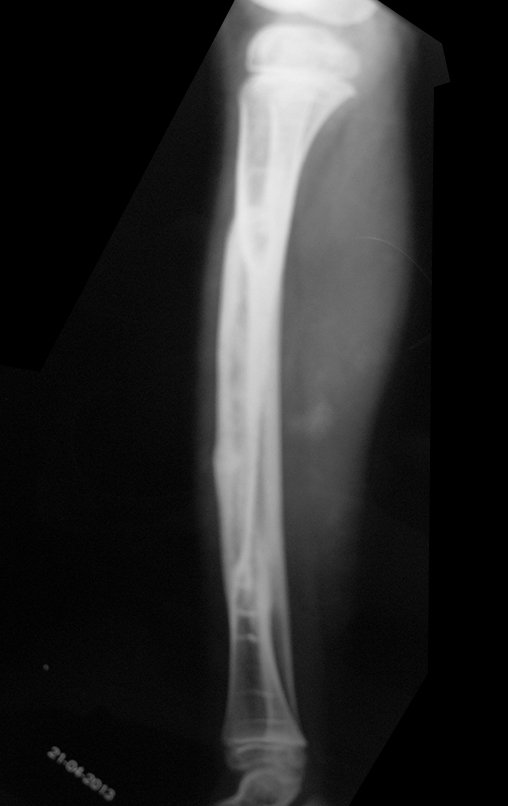
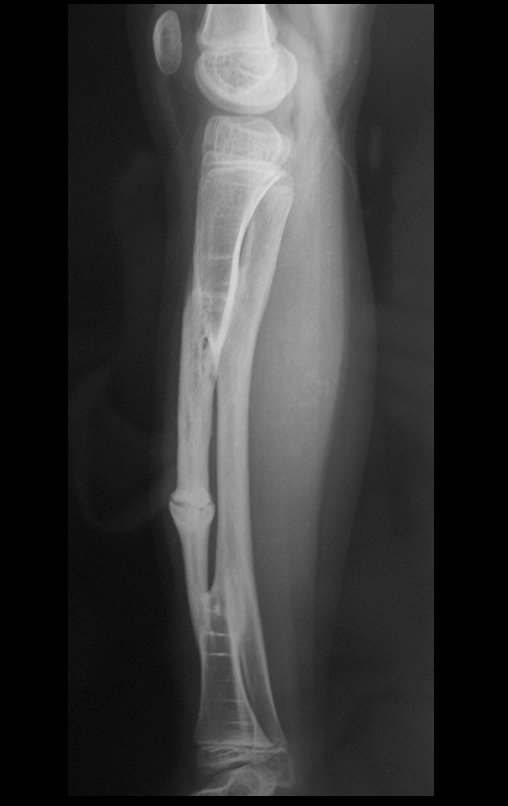
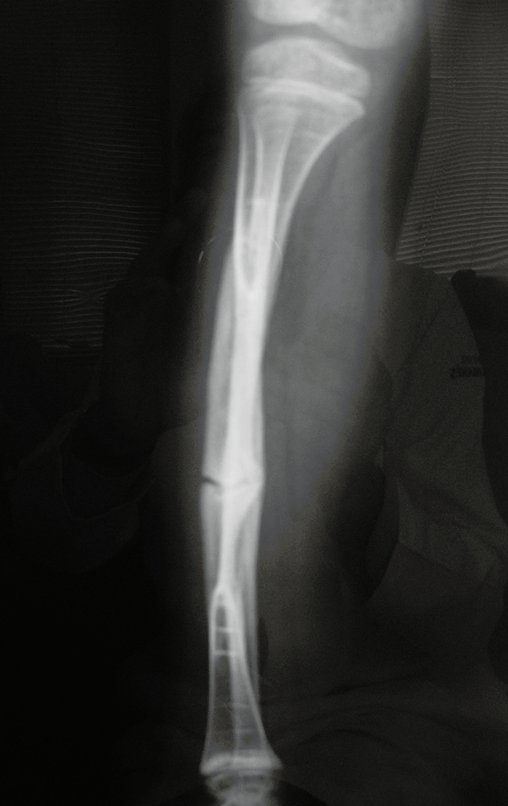
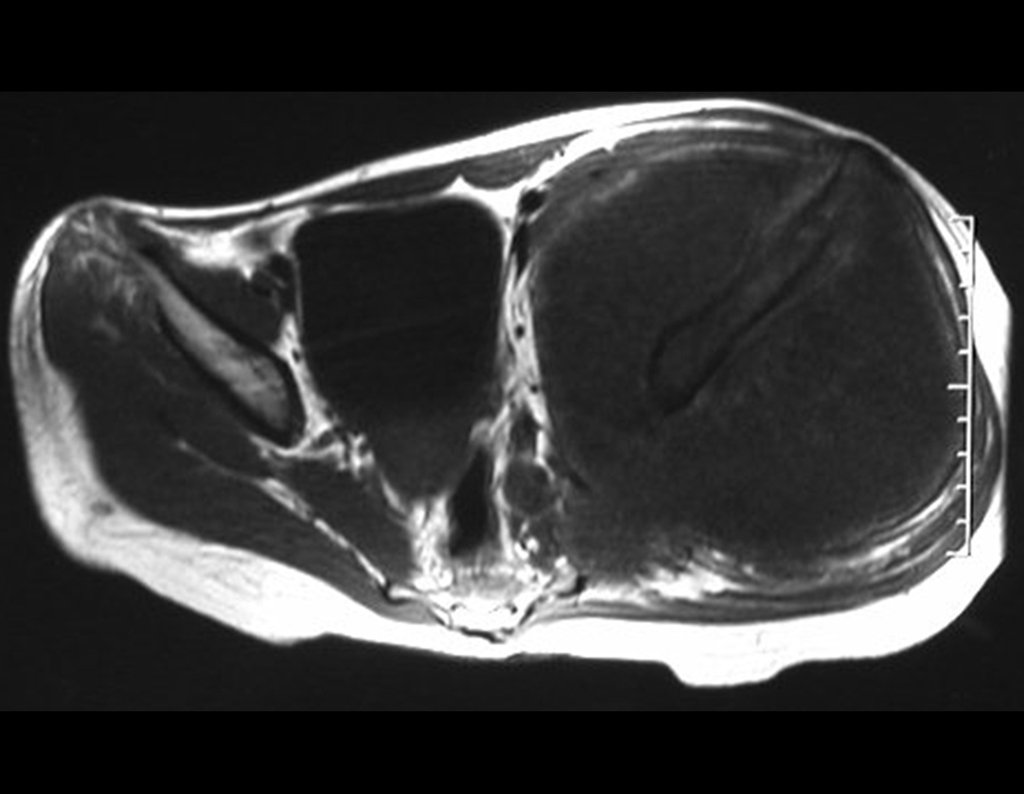
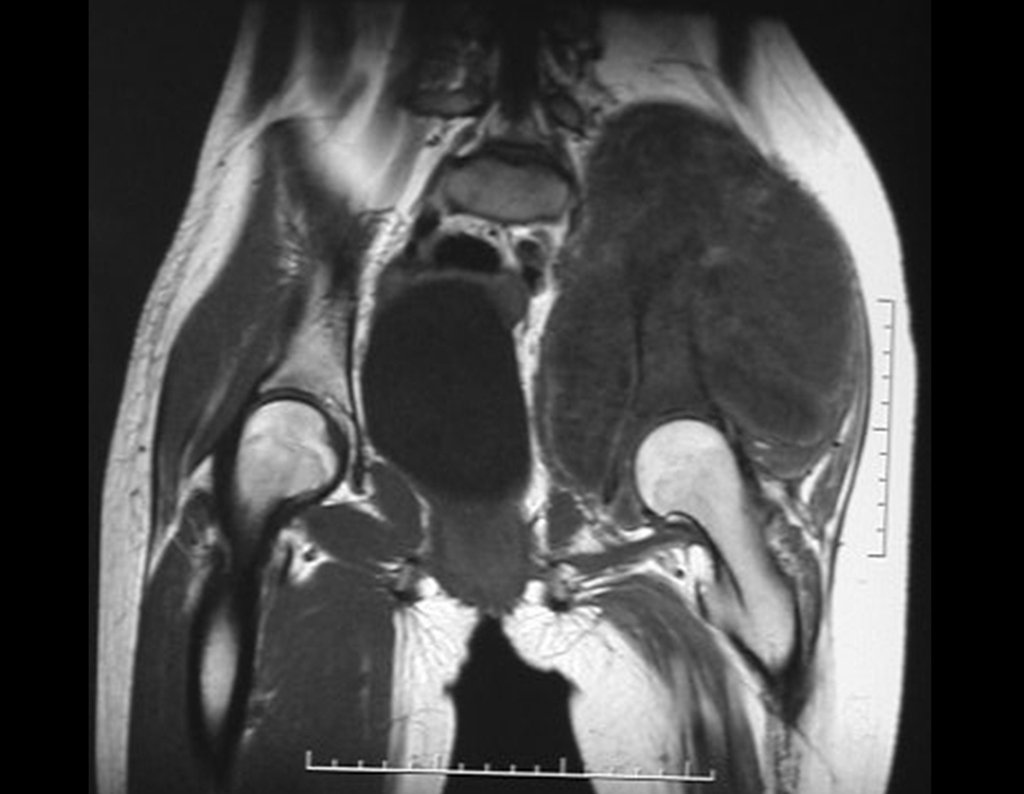
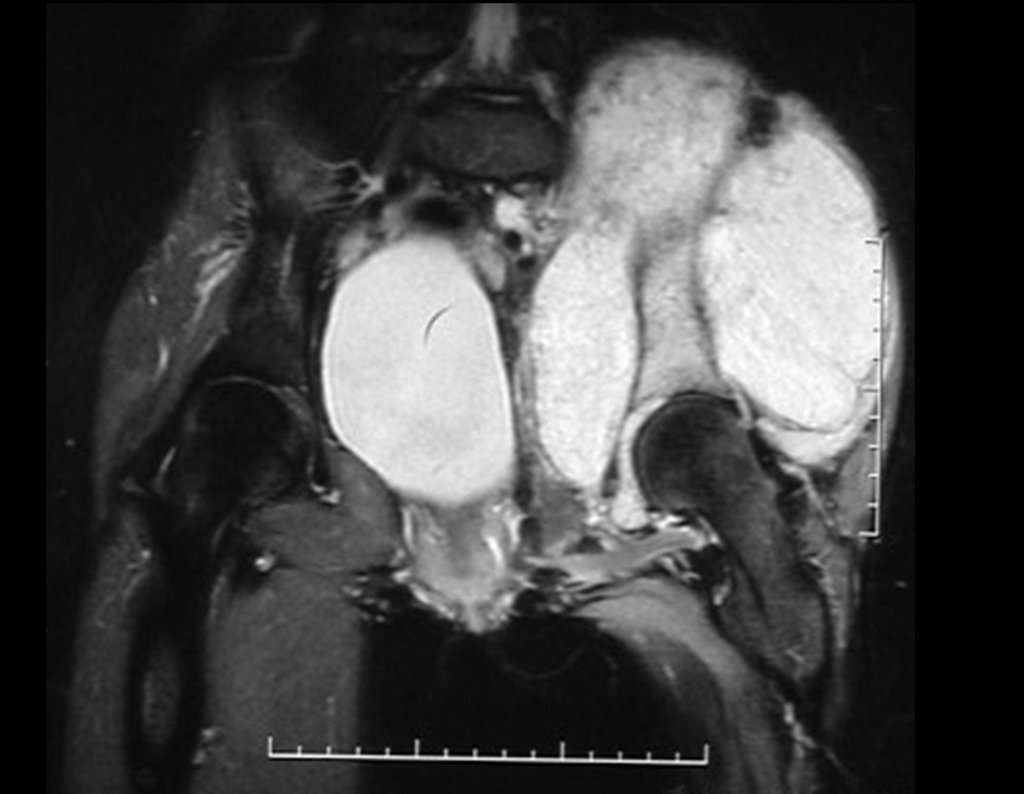
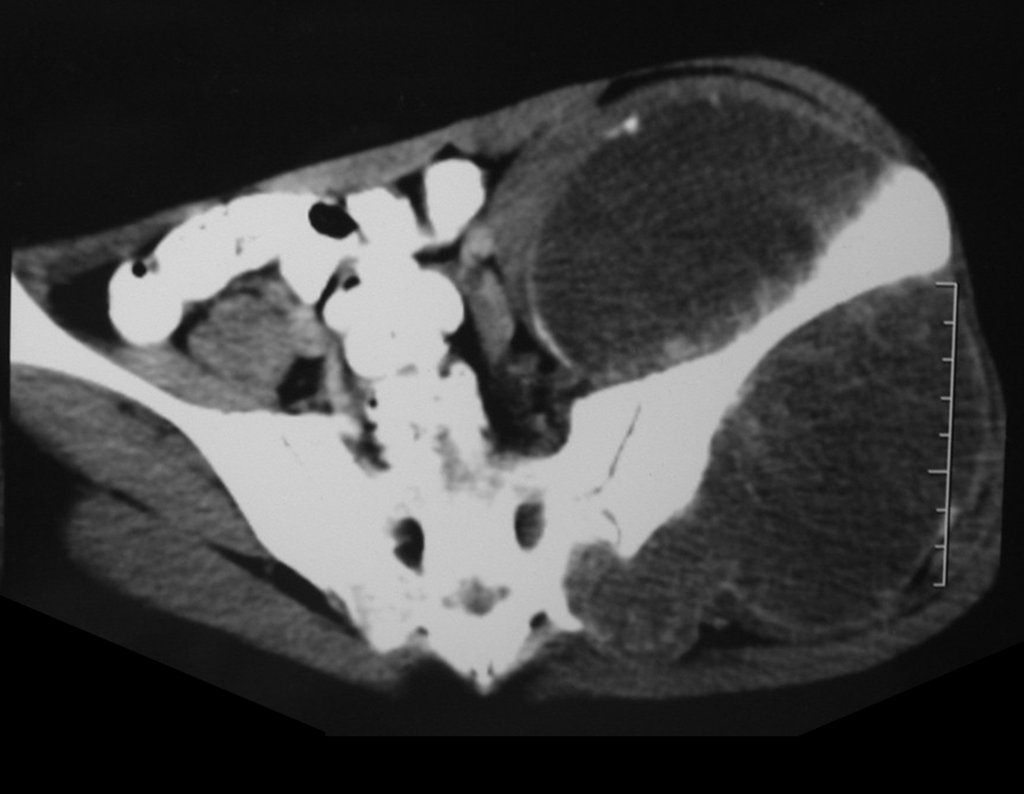
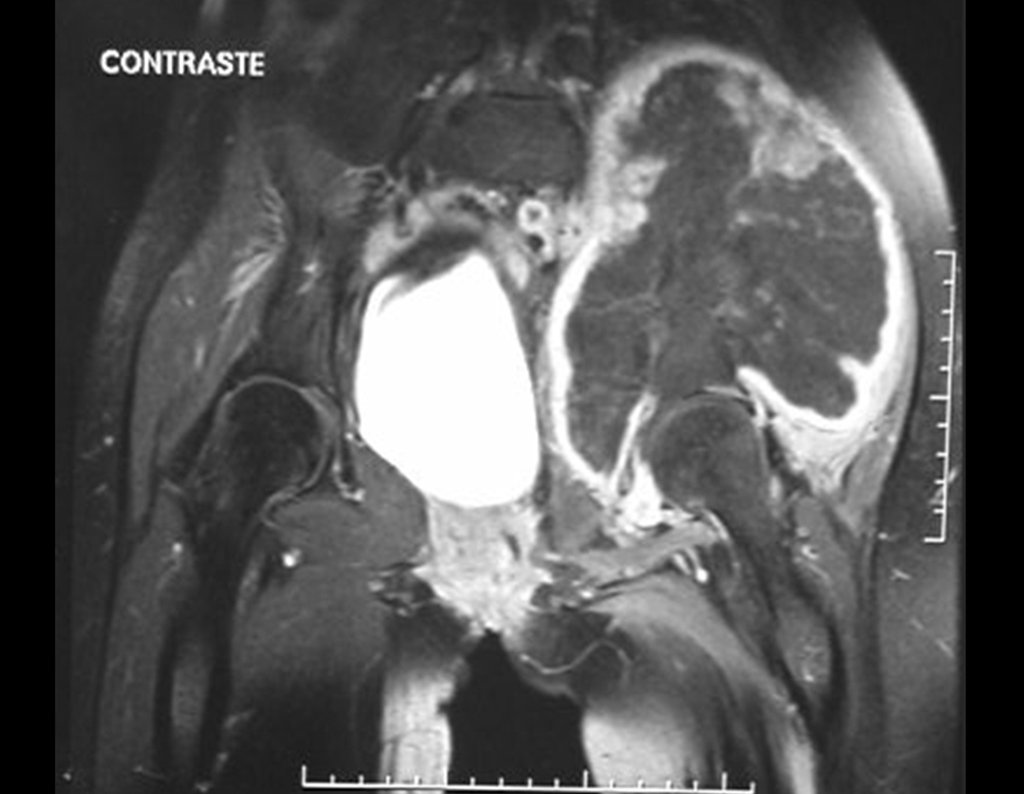
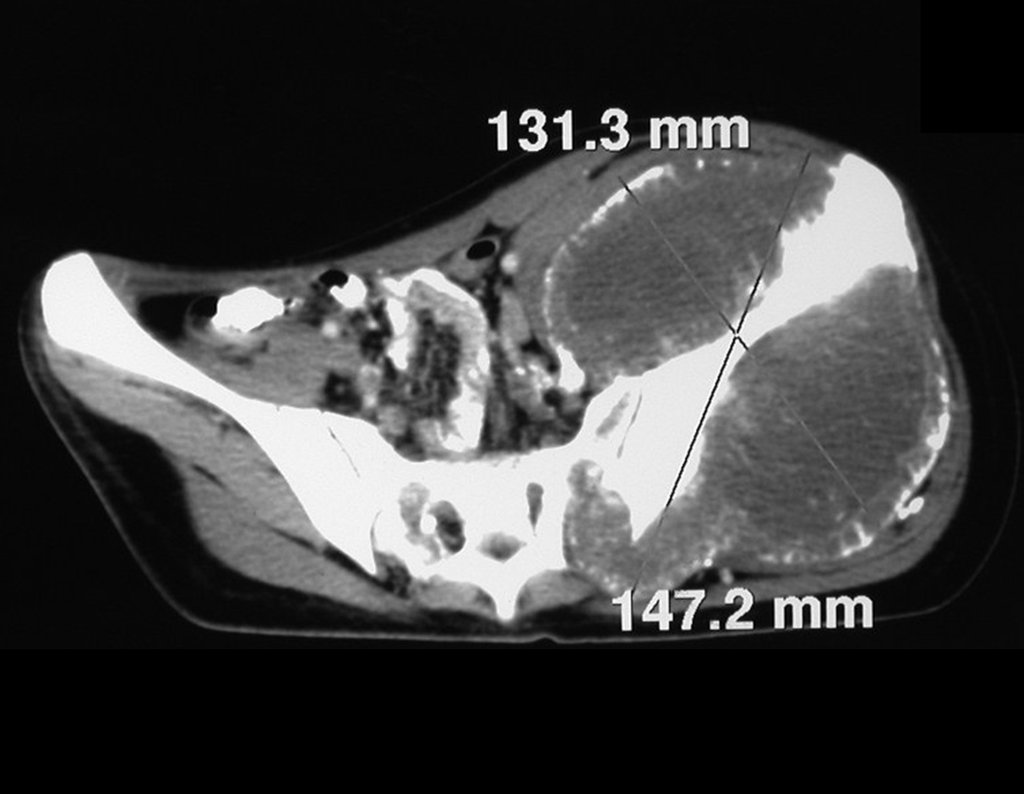
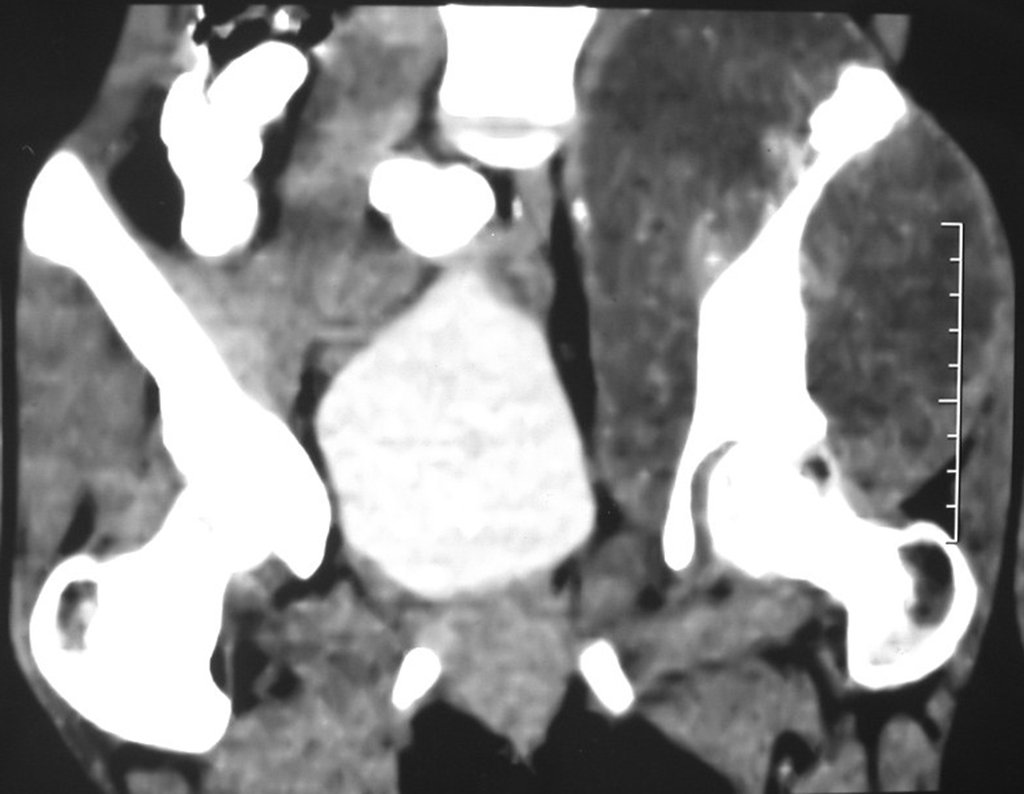
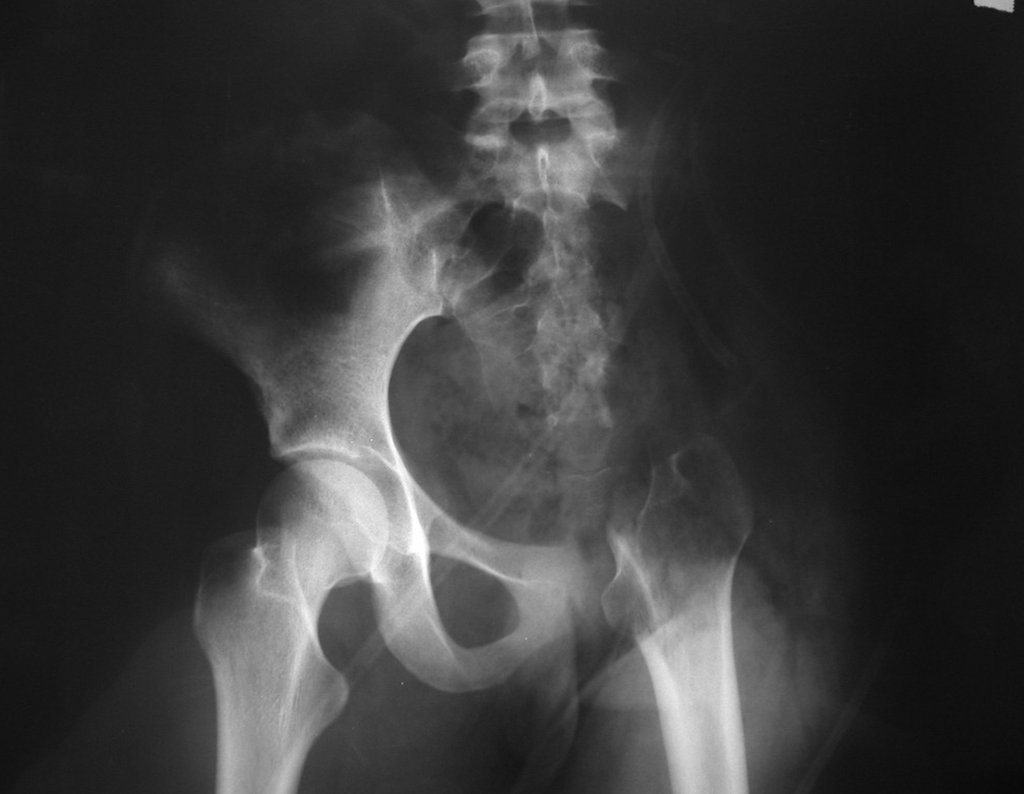
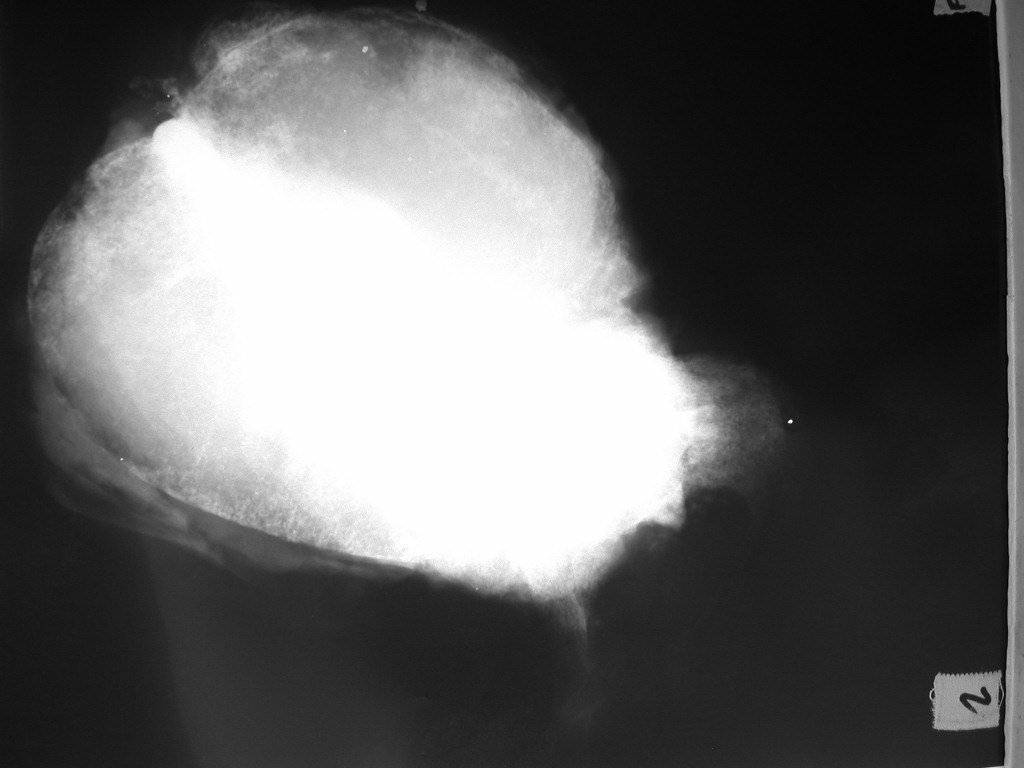
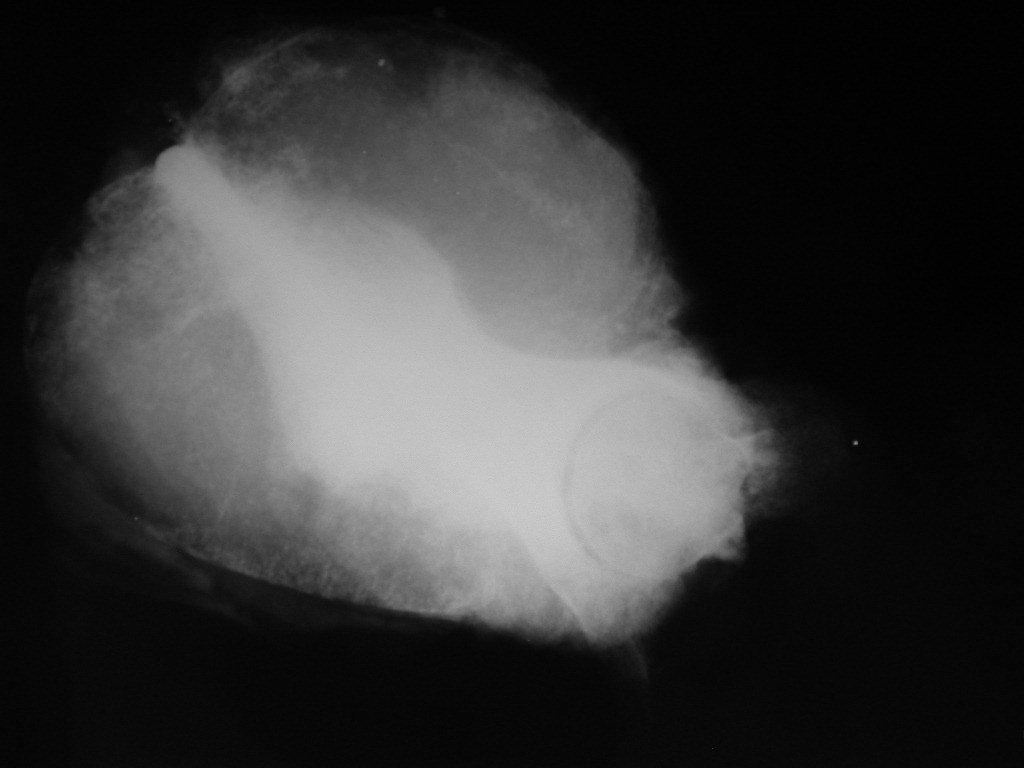
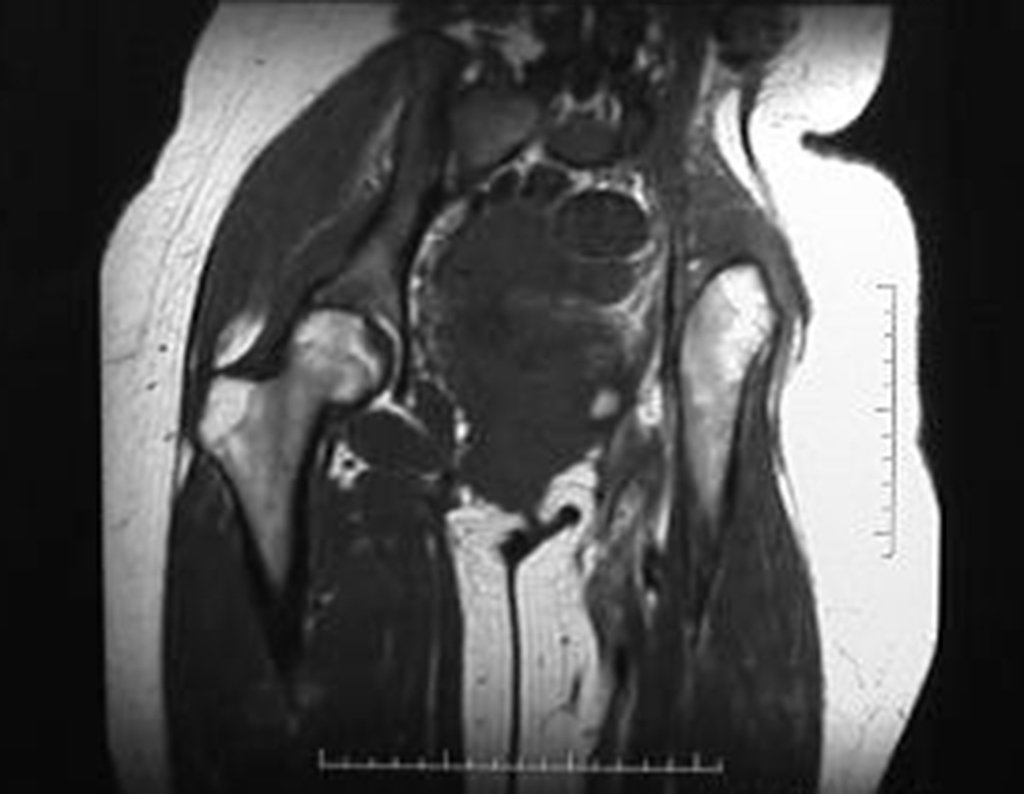
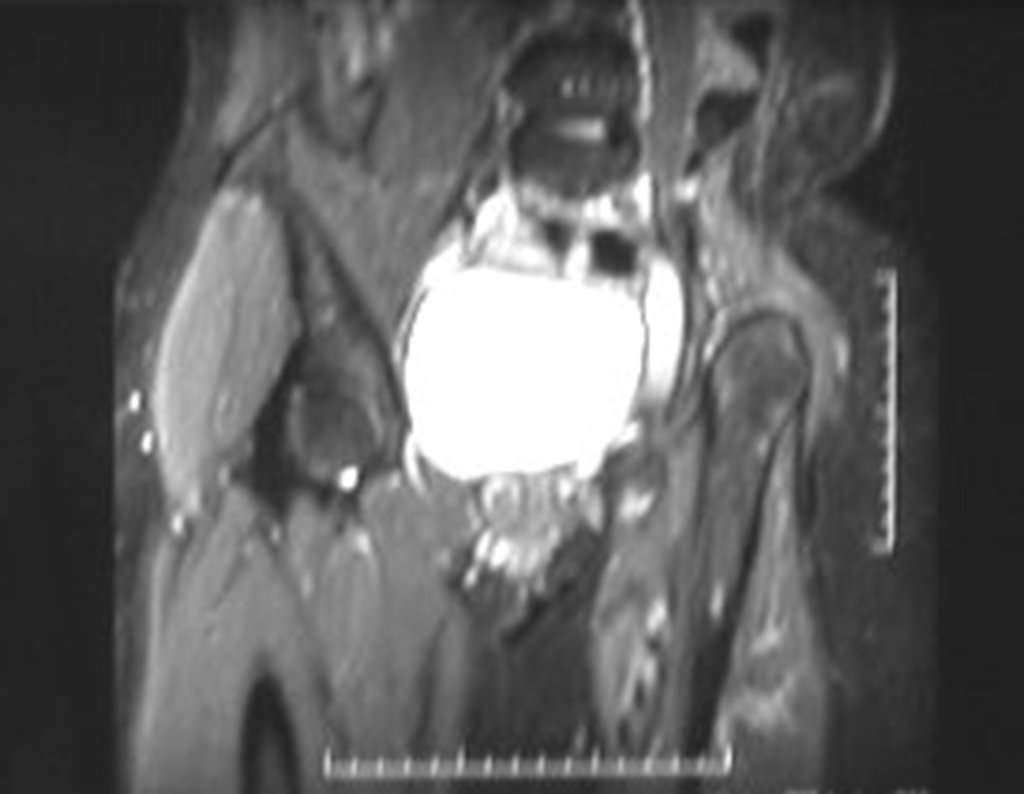
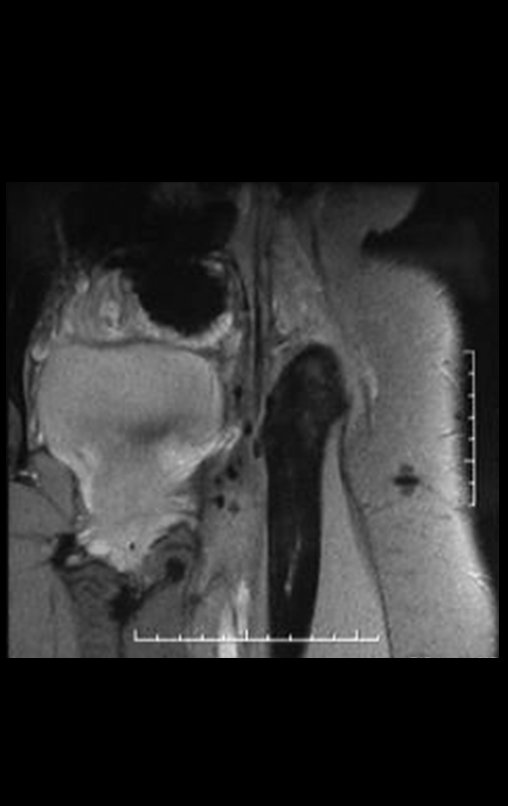
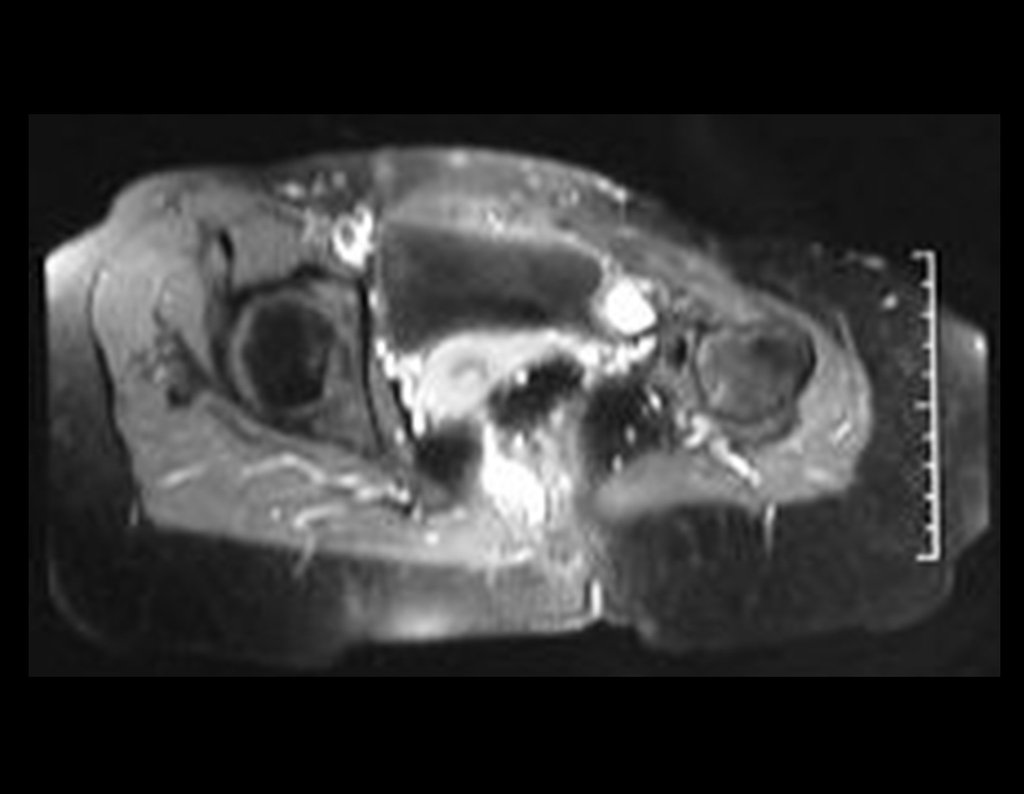
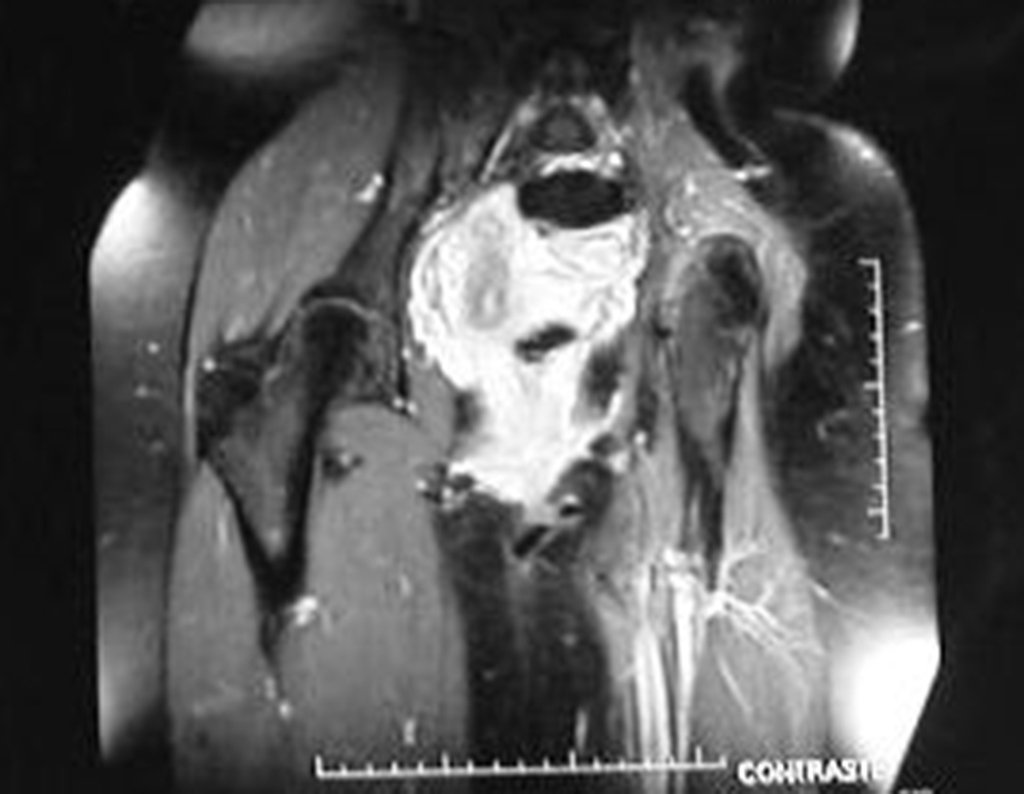
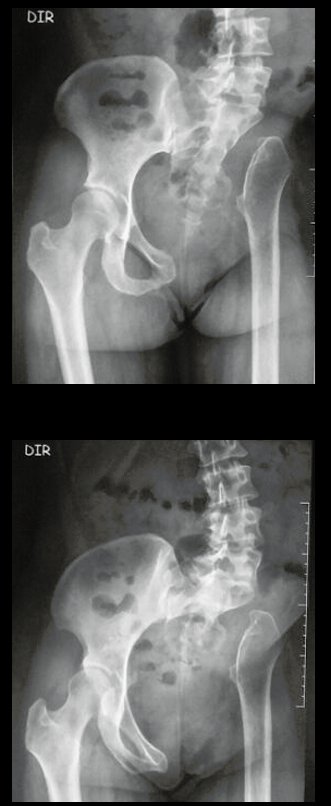
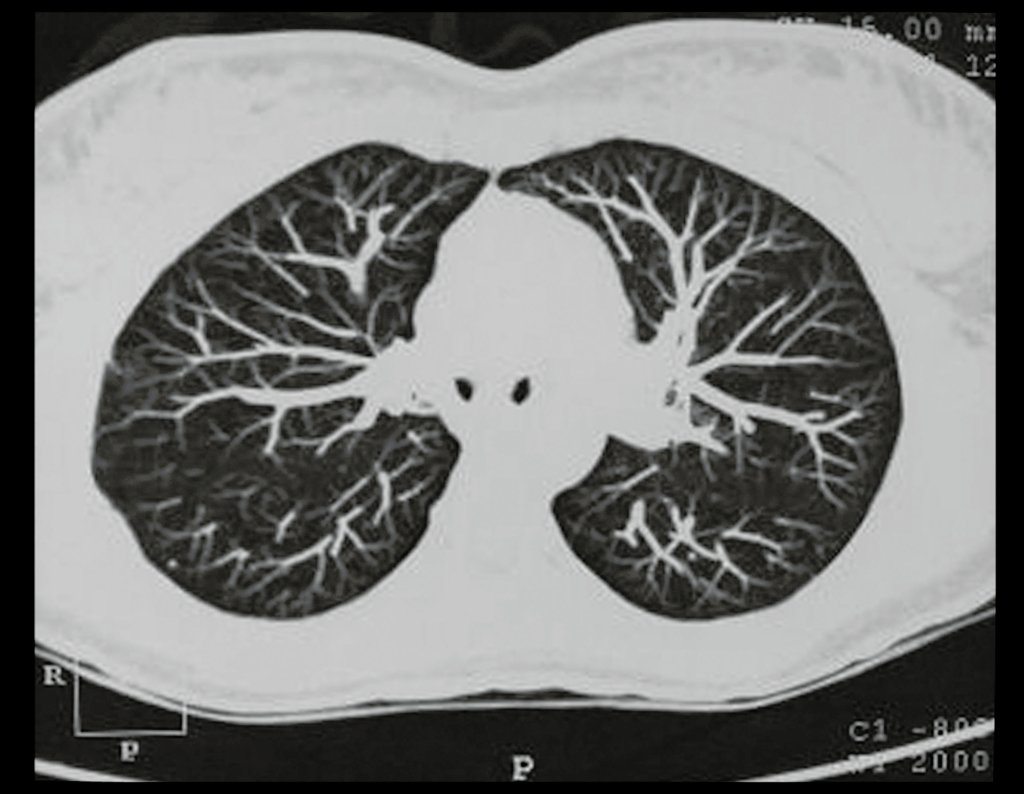
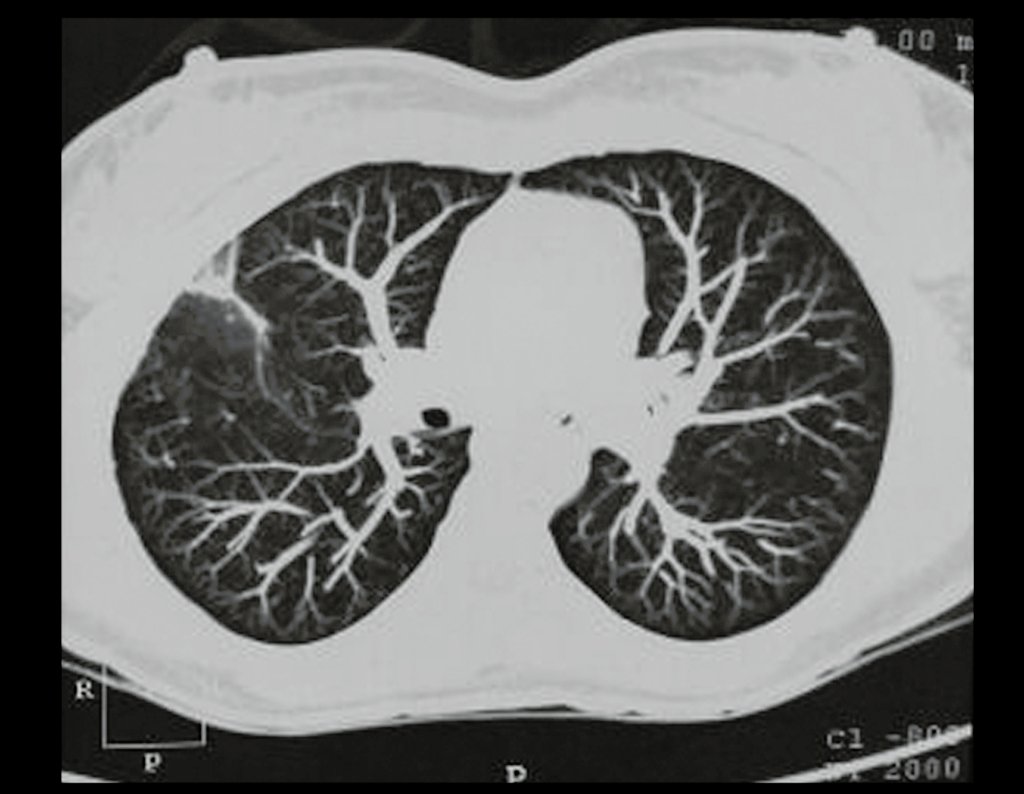
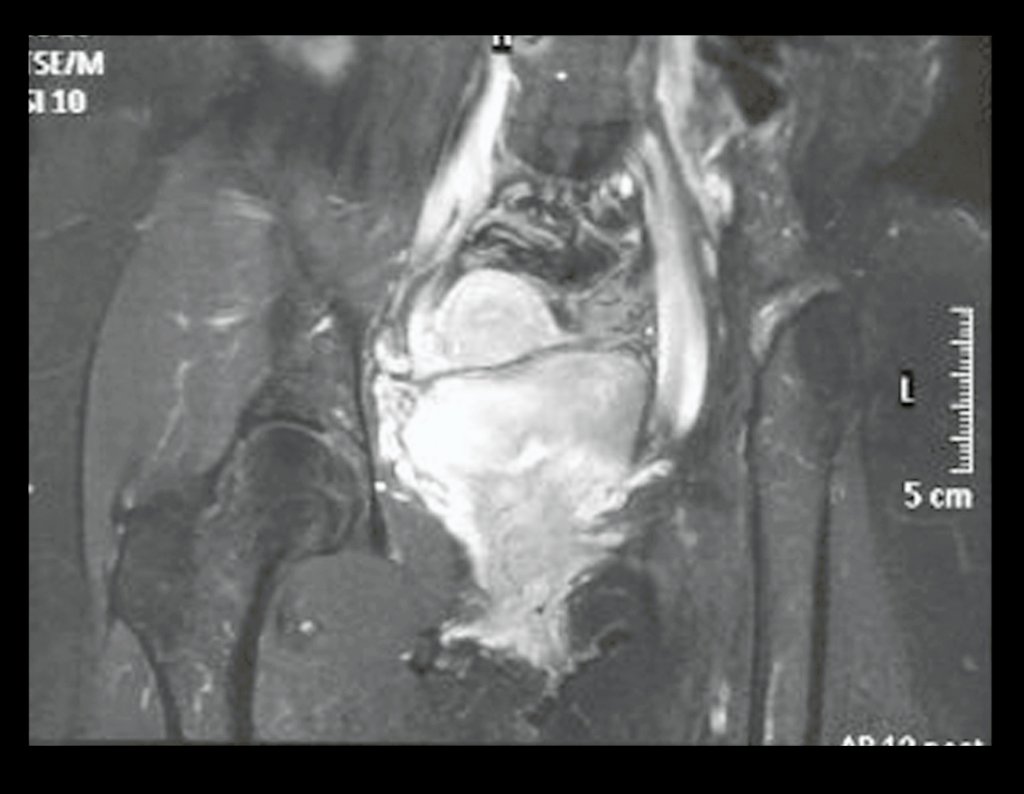
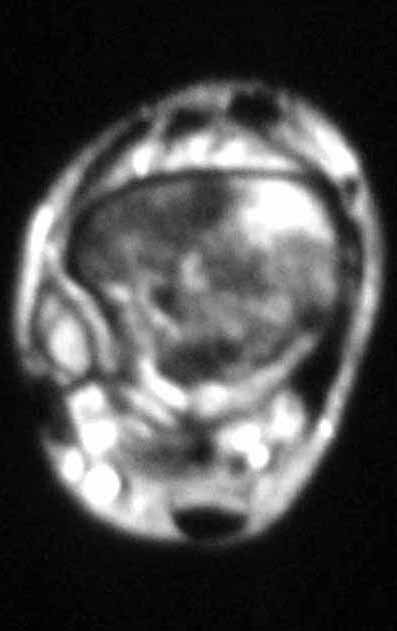
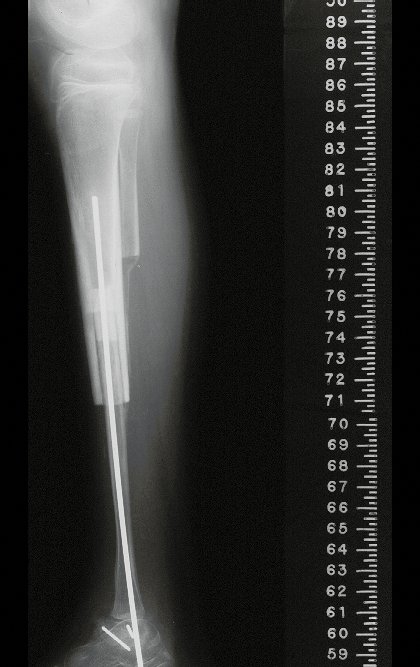
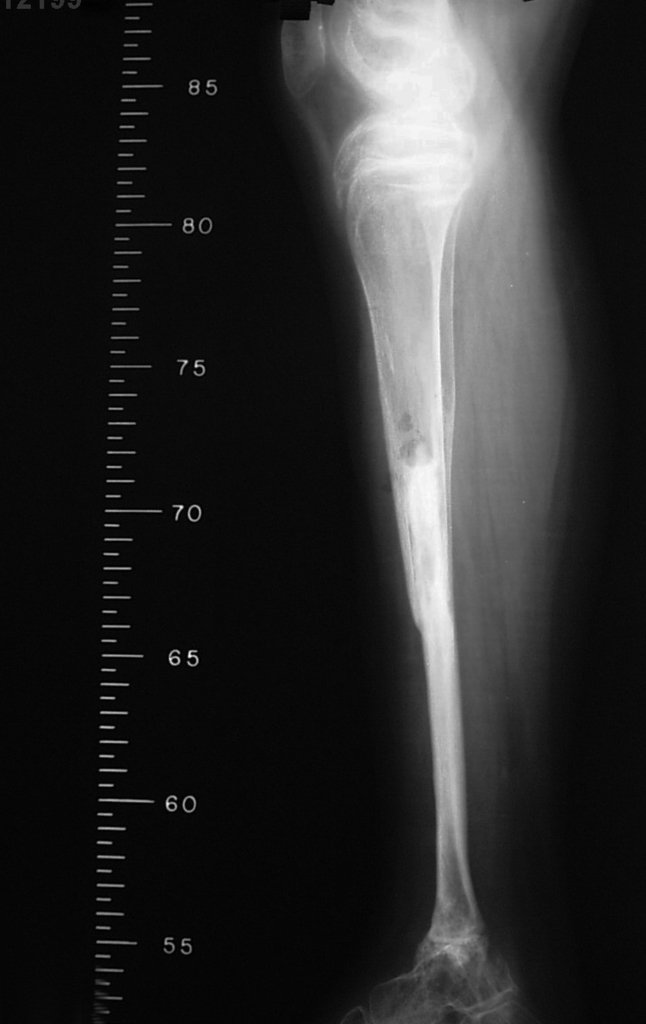
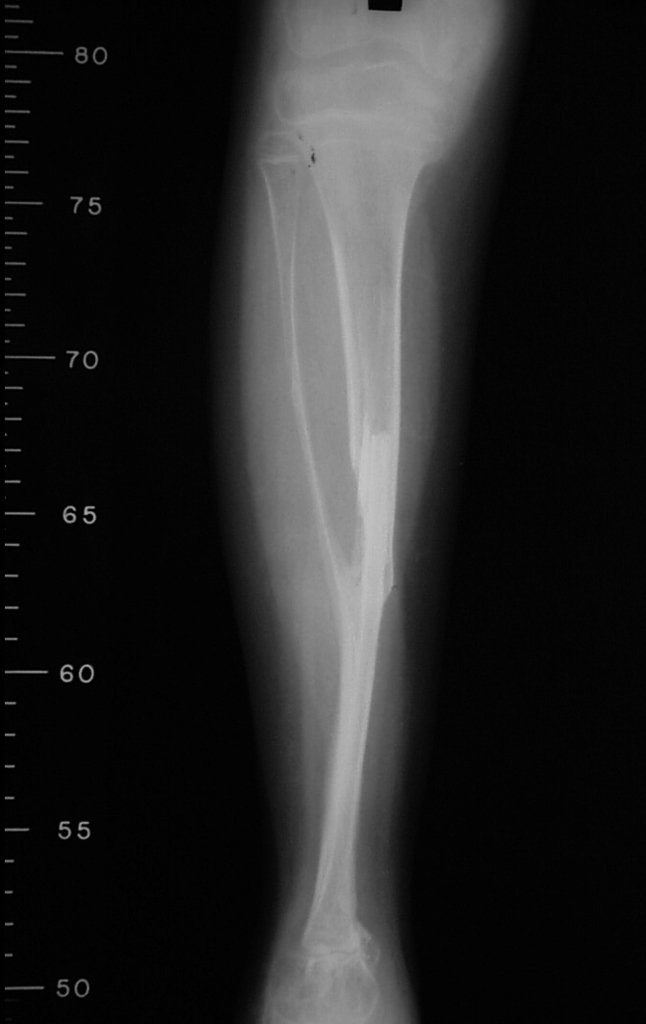
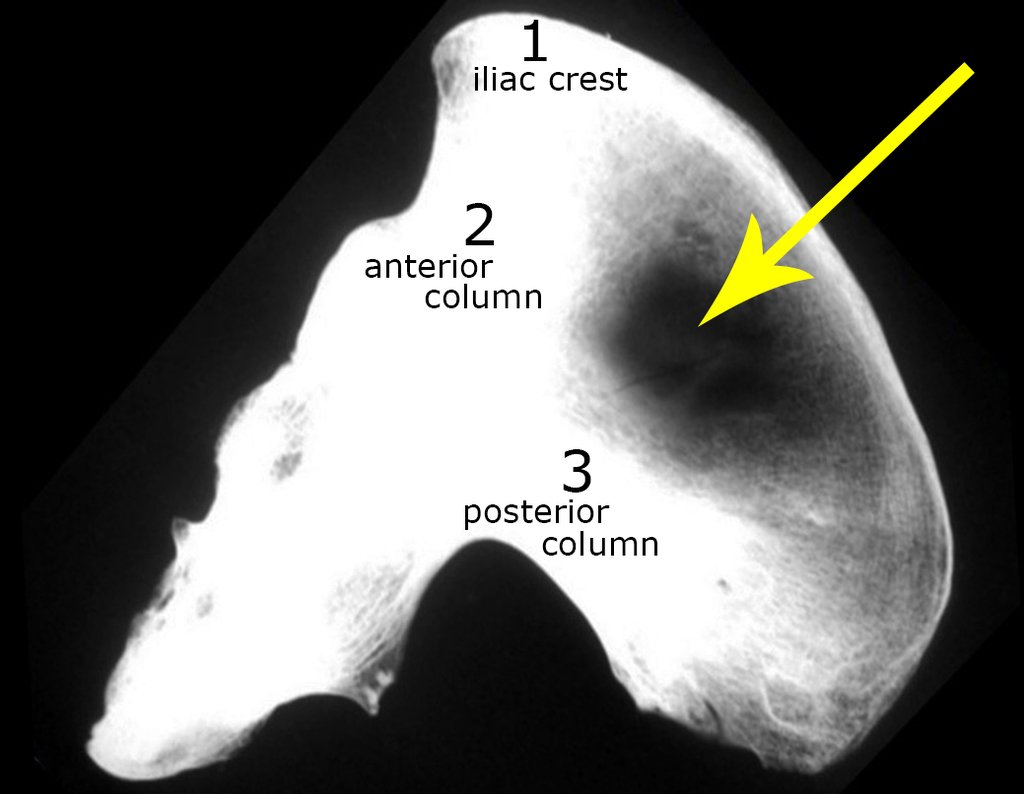
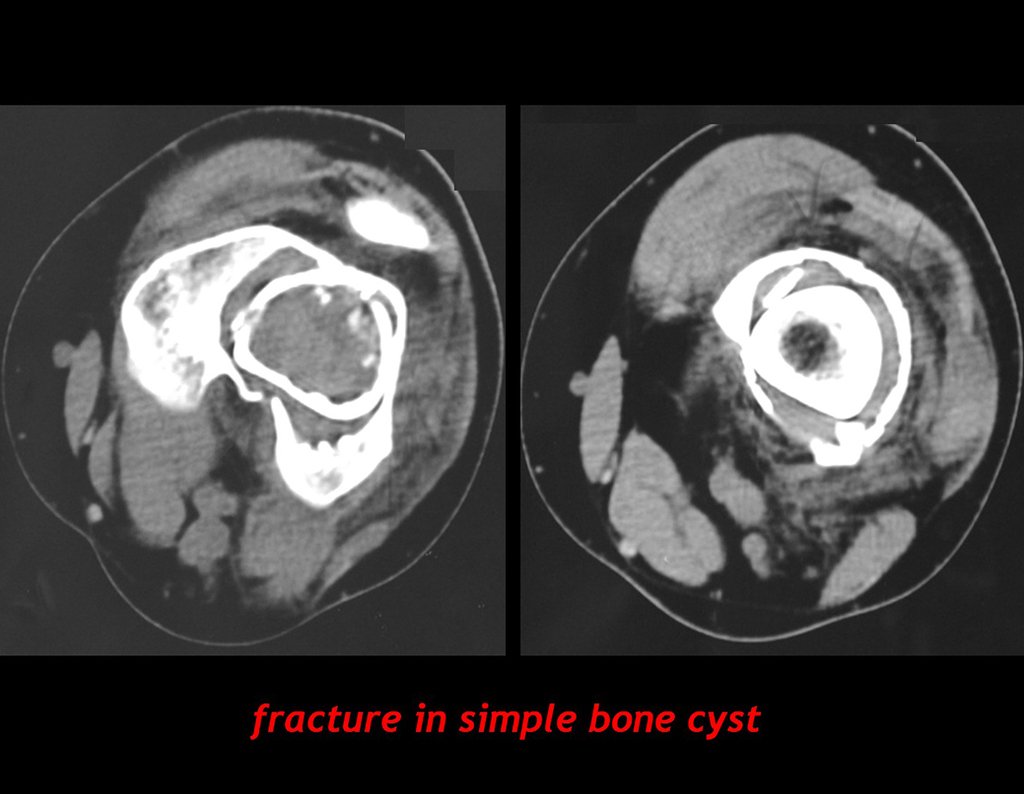
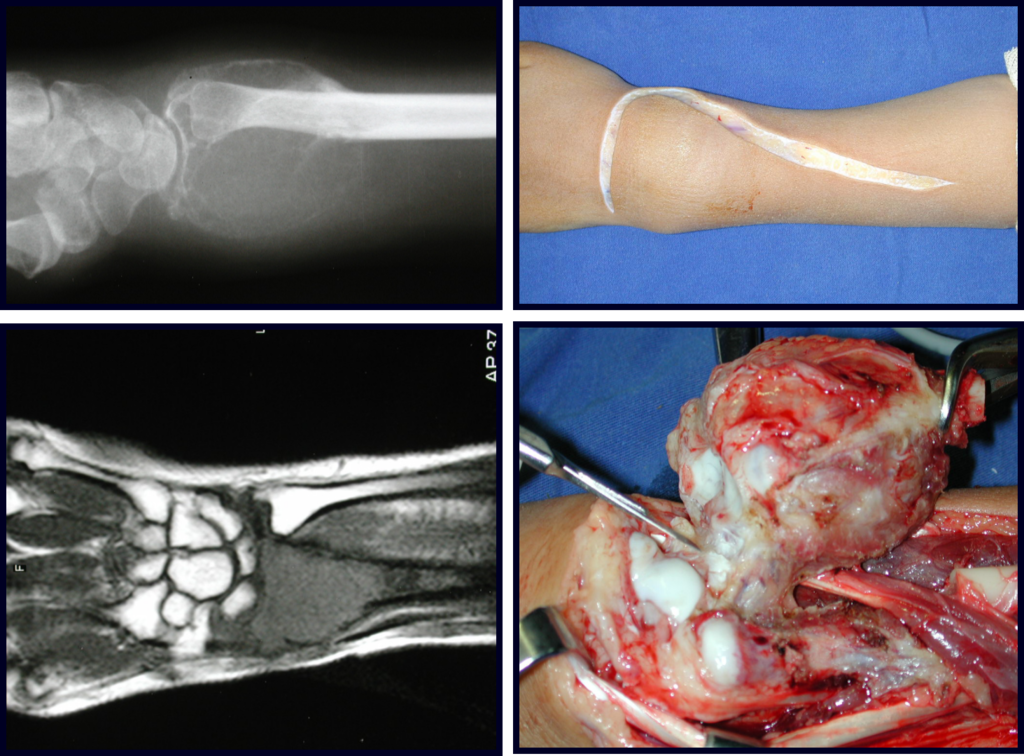
El estudio de resonancia magnética muestra lesión de rarefacción ósea, con áreas de necrosis, erosión, insuflación y fractura e infracción de la cortical, con deformidad y hundimiento de la superficie articular (figuras 25 à 36).
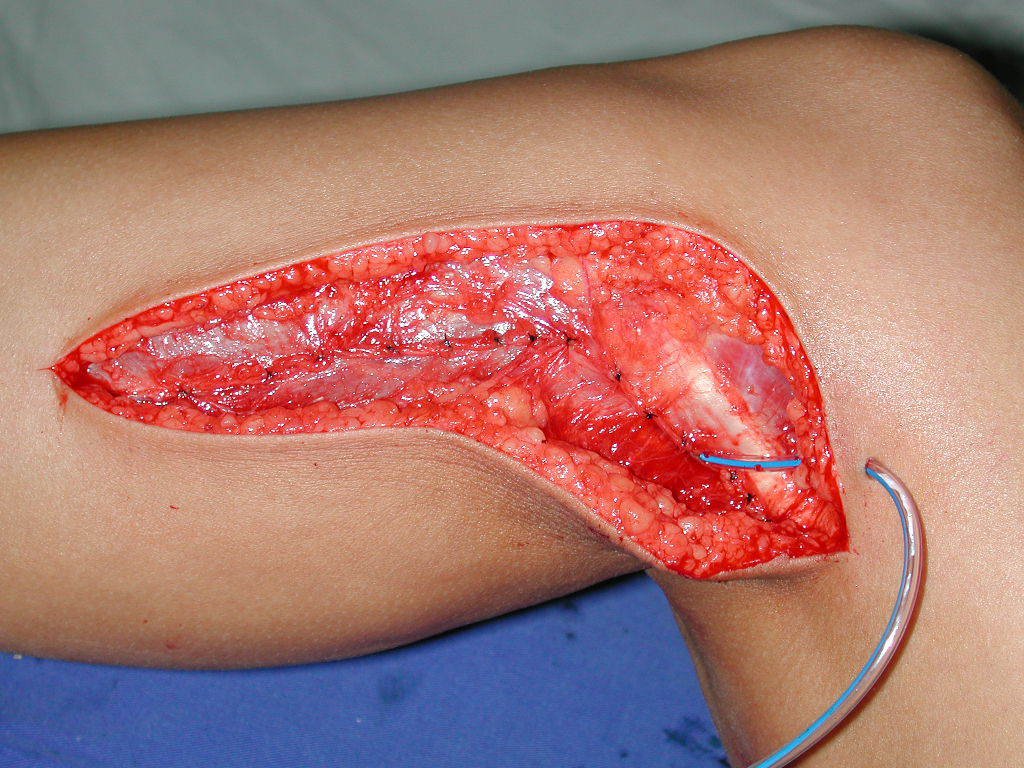
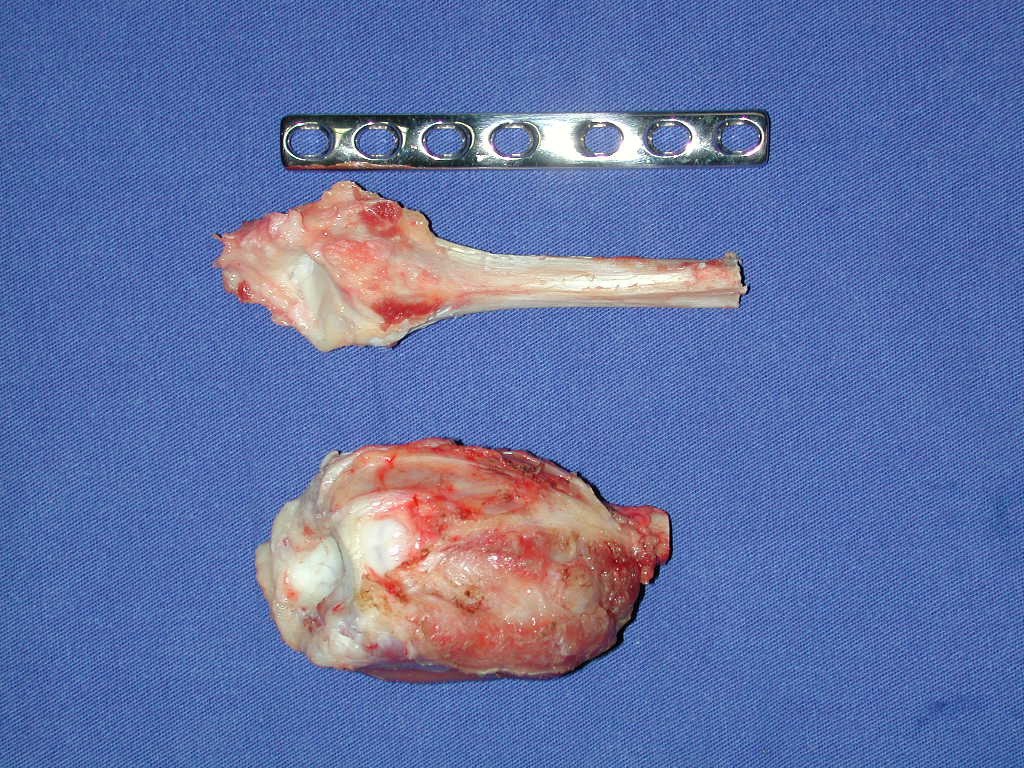
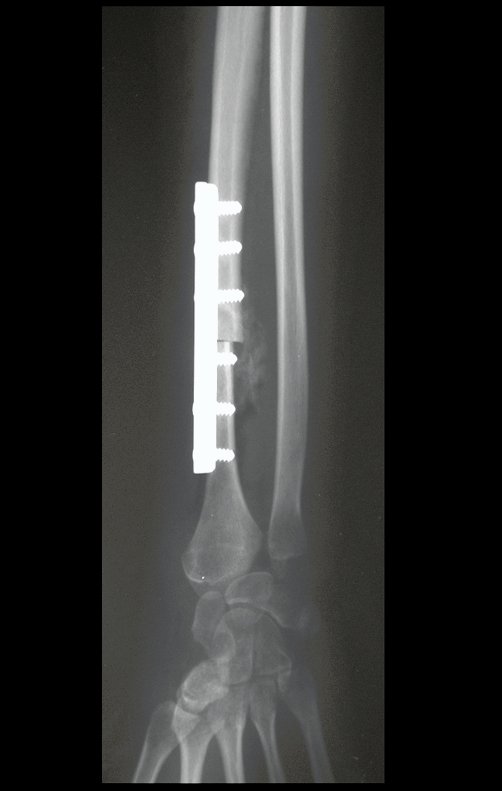
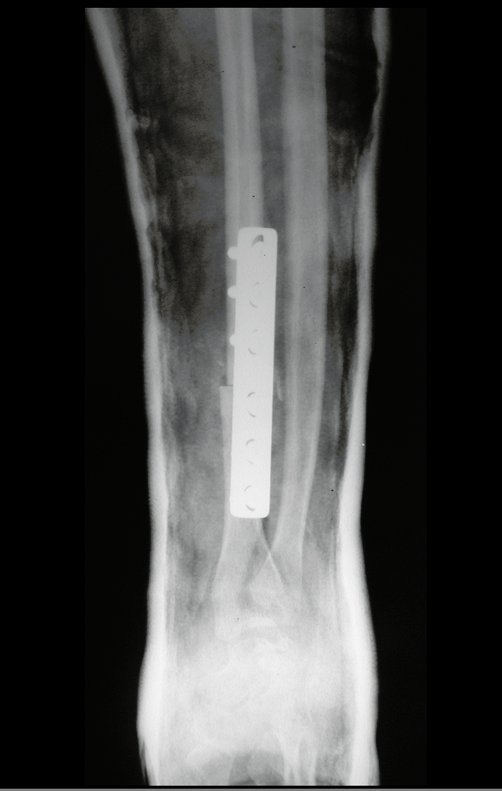
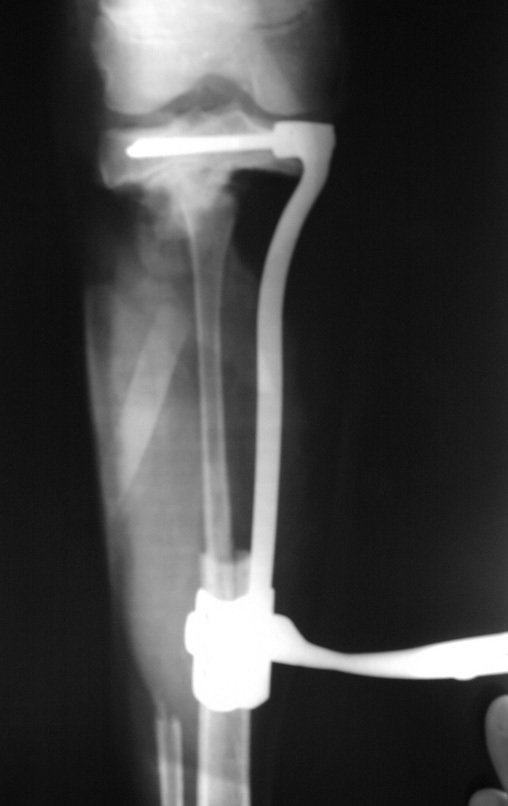
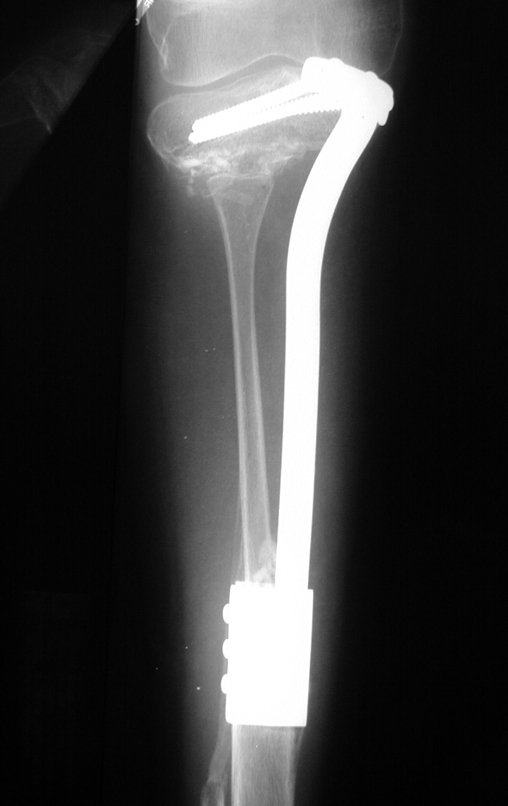
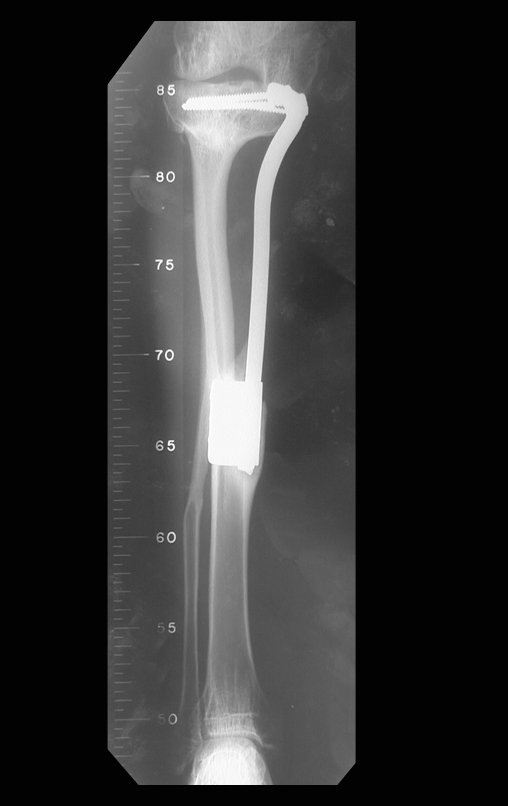
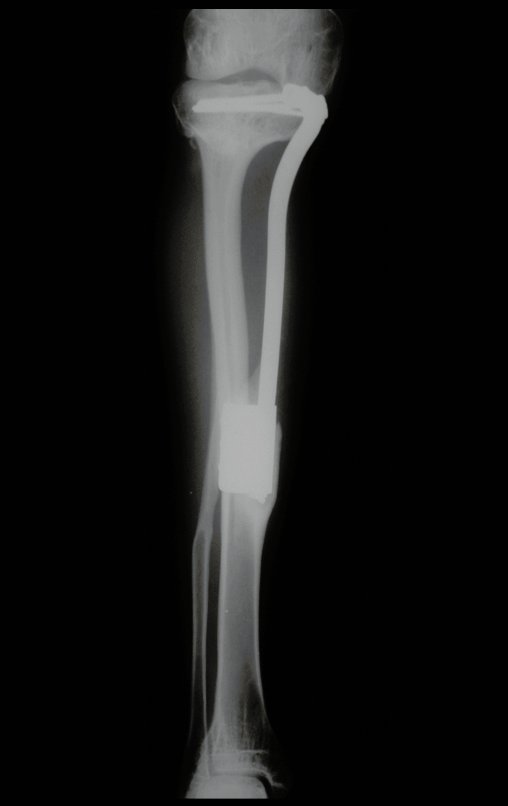
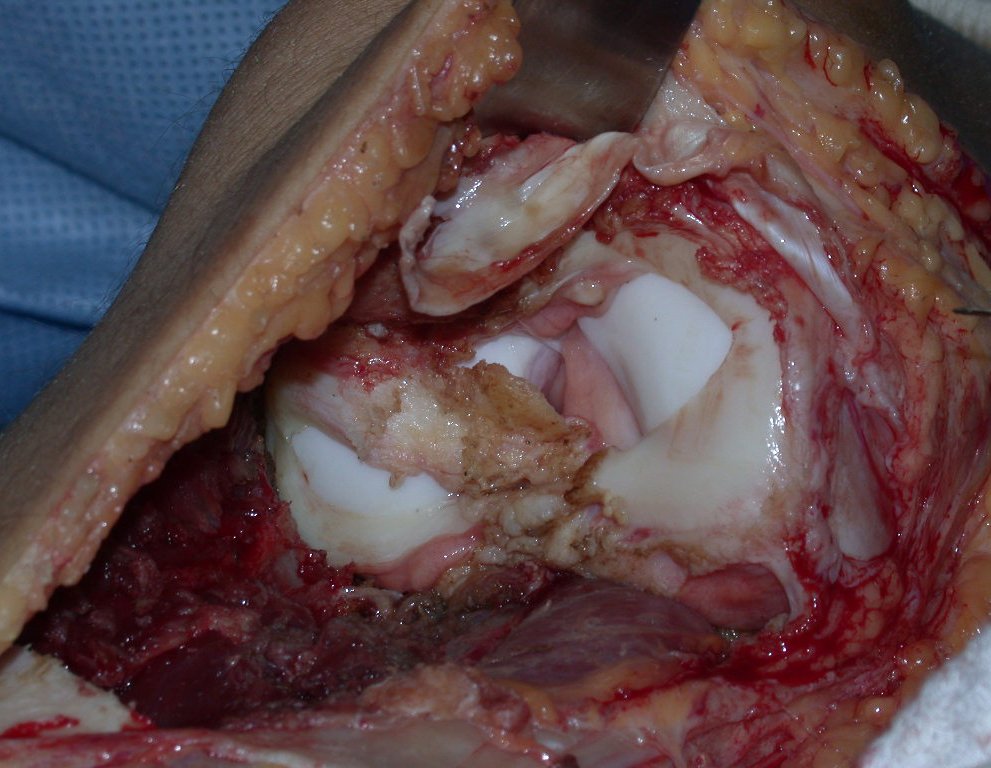
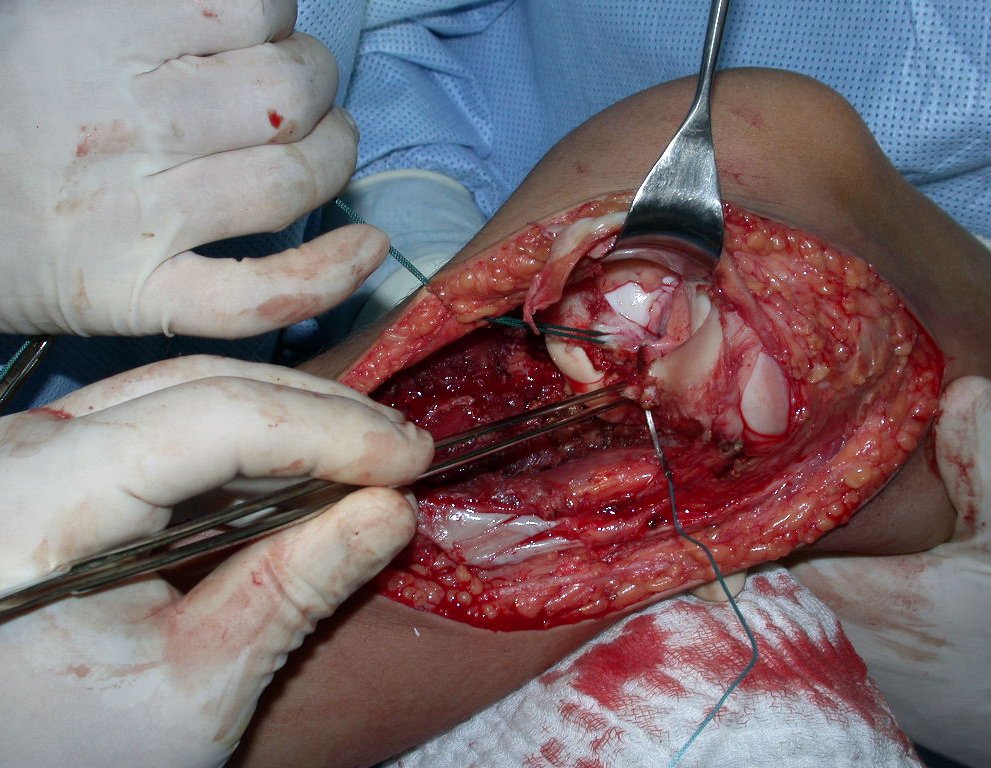
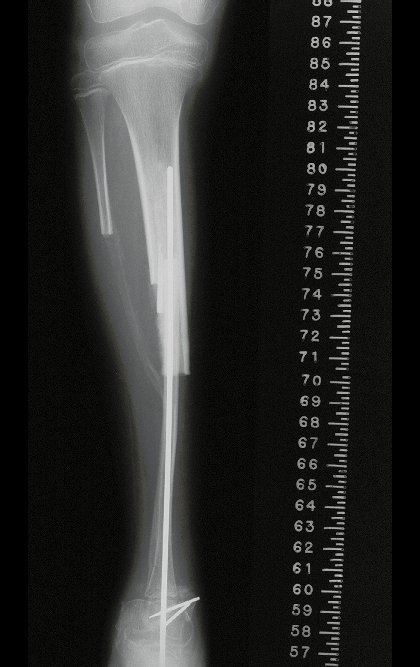
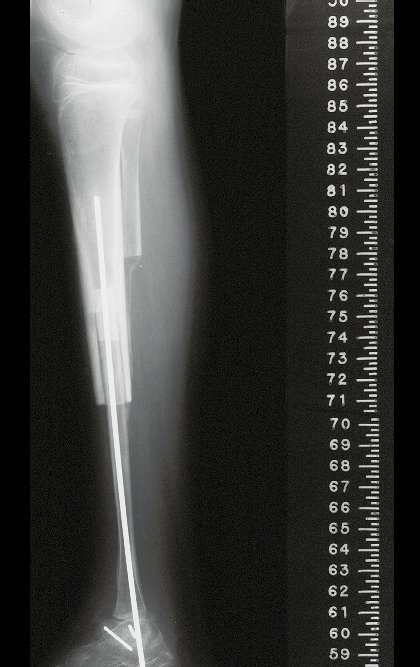
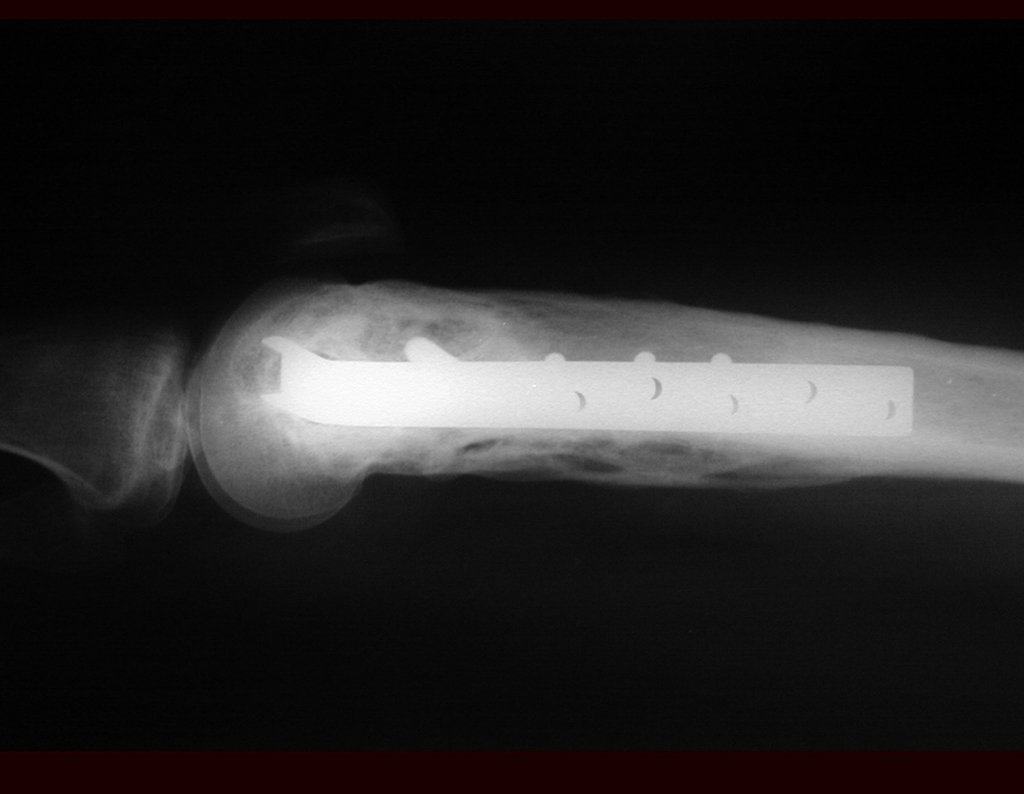
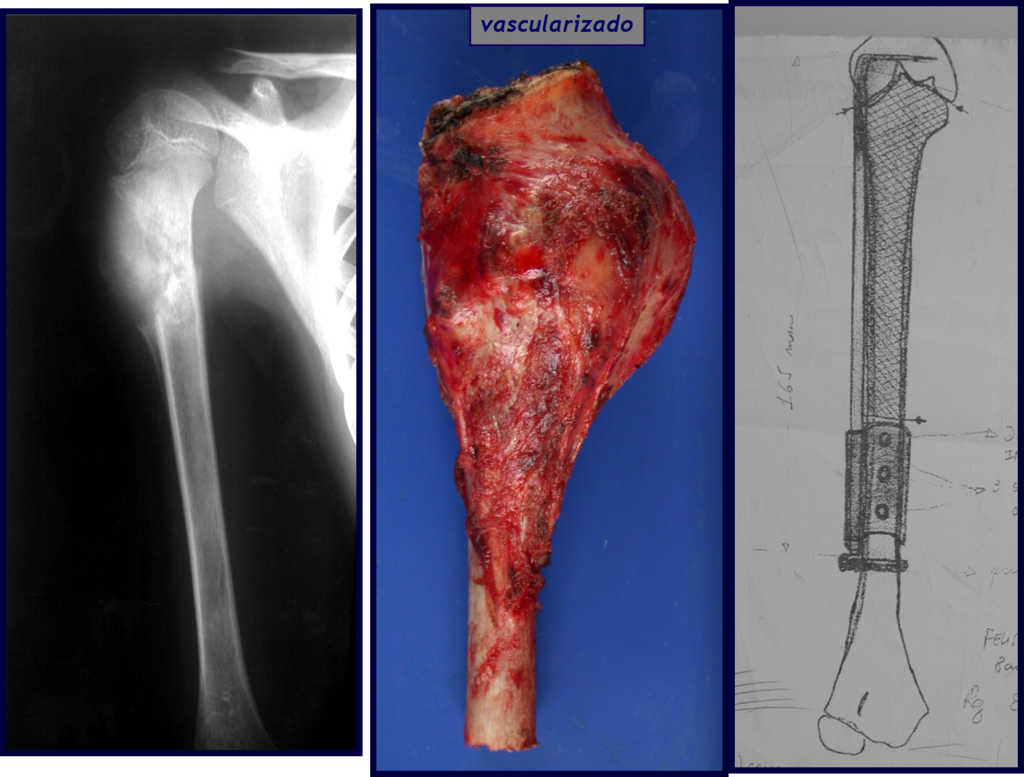
Con este estudio, confirmamos la agresividad local del tumor y la gran destrucción de la extremidad distal del radio izquierdo, con fractura por infracción, deformidad articular y hundimiento del radio. En esta situación el tratamiento intralesional esta contraindicado, debido a las altas posibilidades de recidiva local, además de perdida de la función. Oncológicamente esta indicada la resección segmentaria del radio y reconstrucción de la muñeca. La artrodesis puede ser una alternativa, mas preferimos preservar la función y la anatomía de la muñeca, siempre que sea posible. En este caso optamos por reconstruir con injerto autólogo no vascularizado, obtenido del segmento proximal del peroné ipsilateral, que imita mejor al radio.
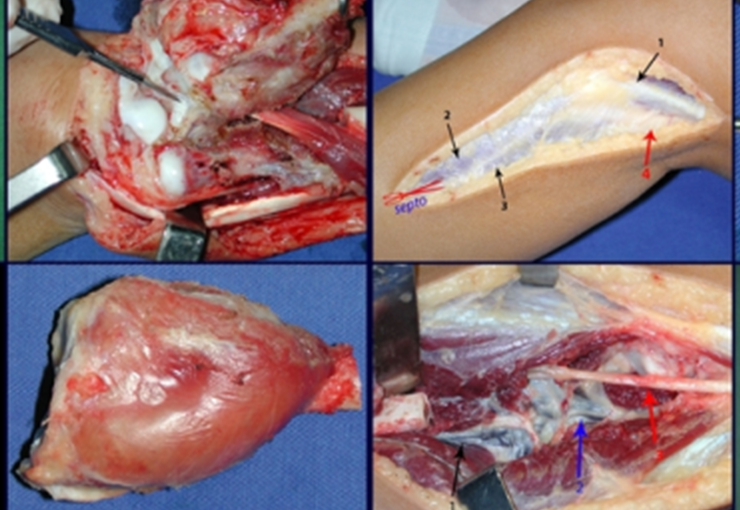
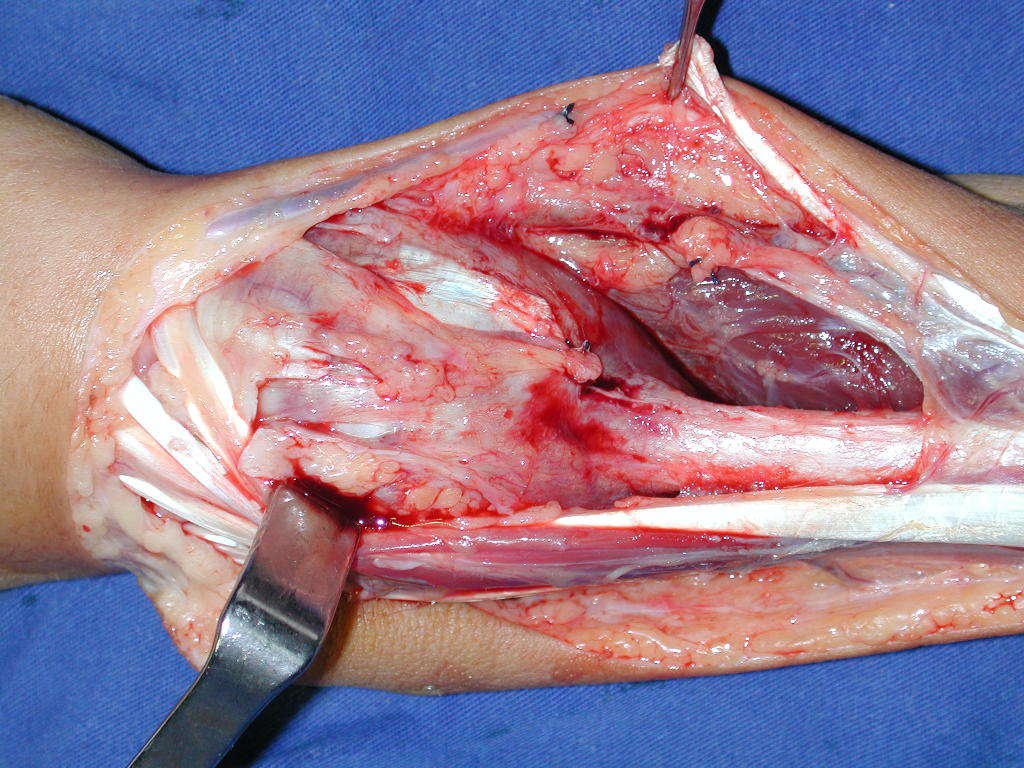
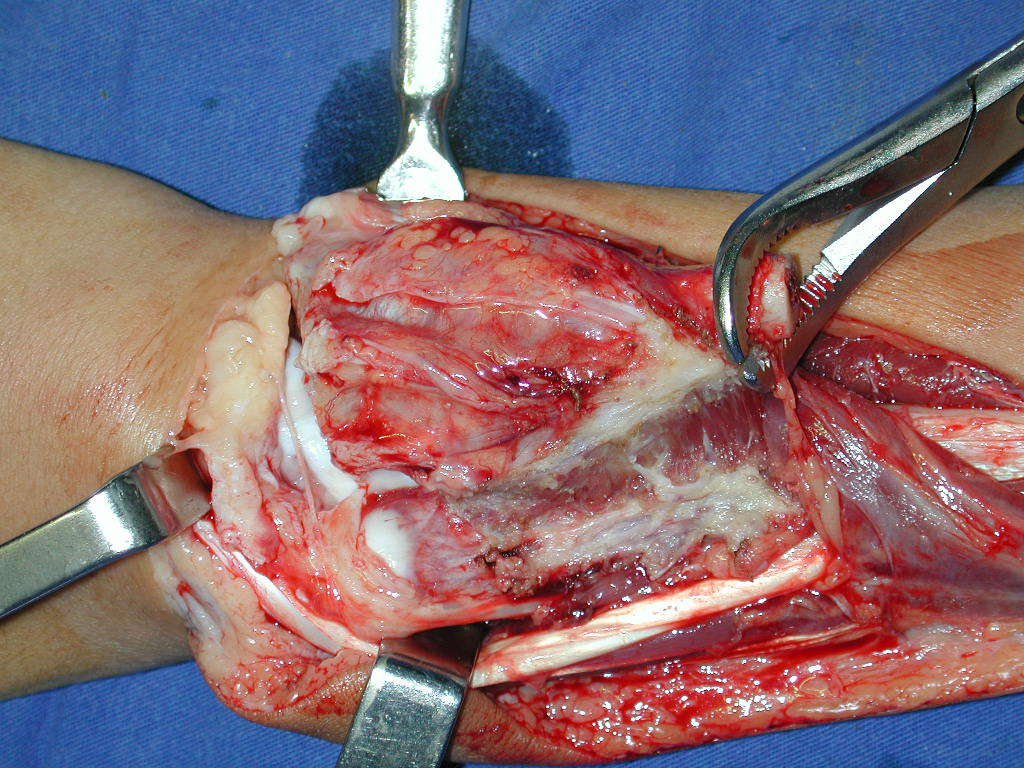
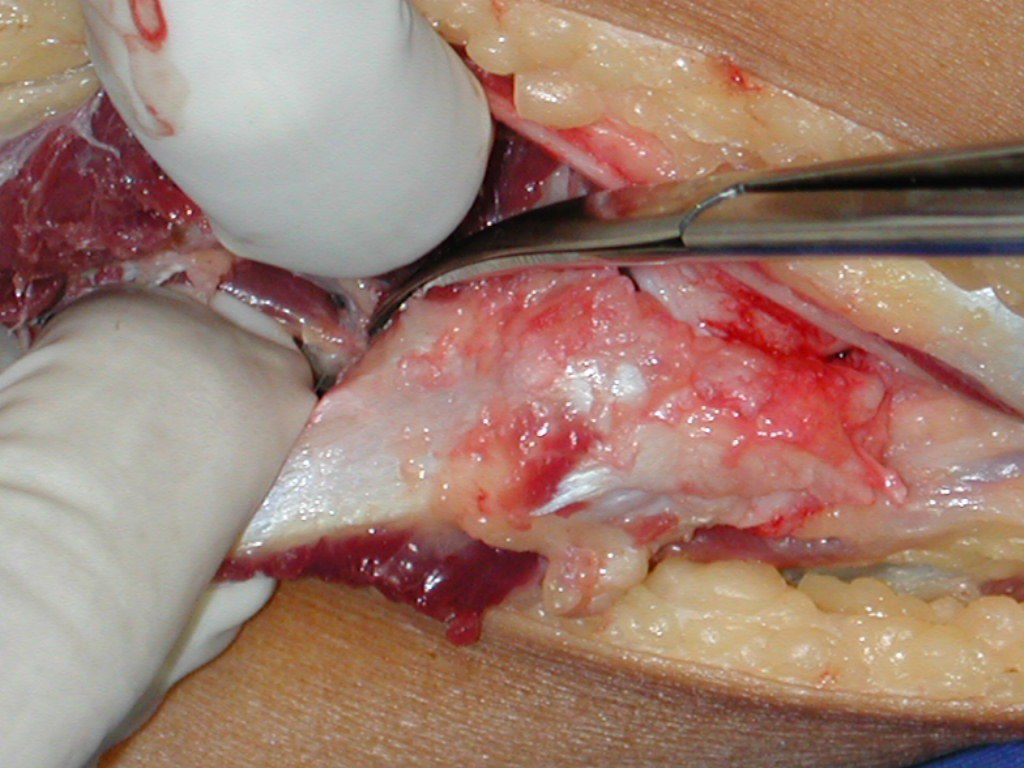
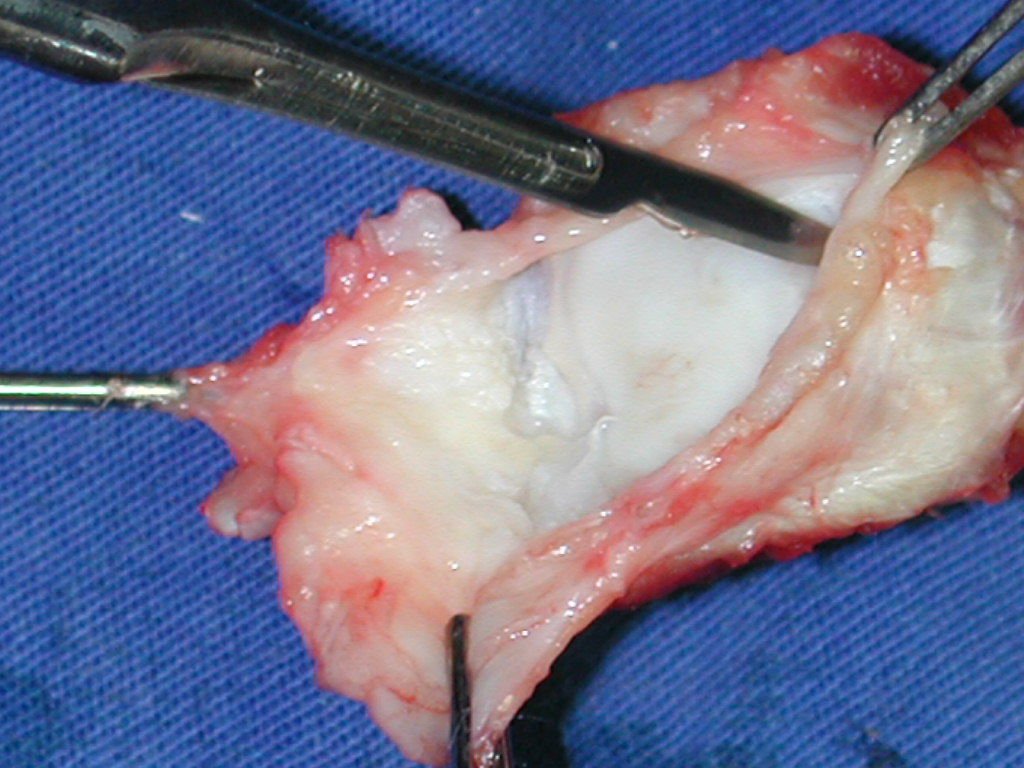
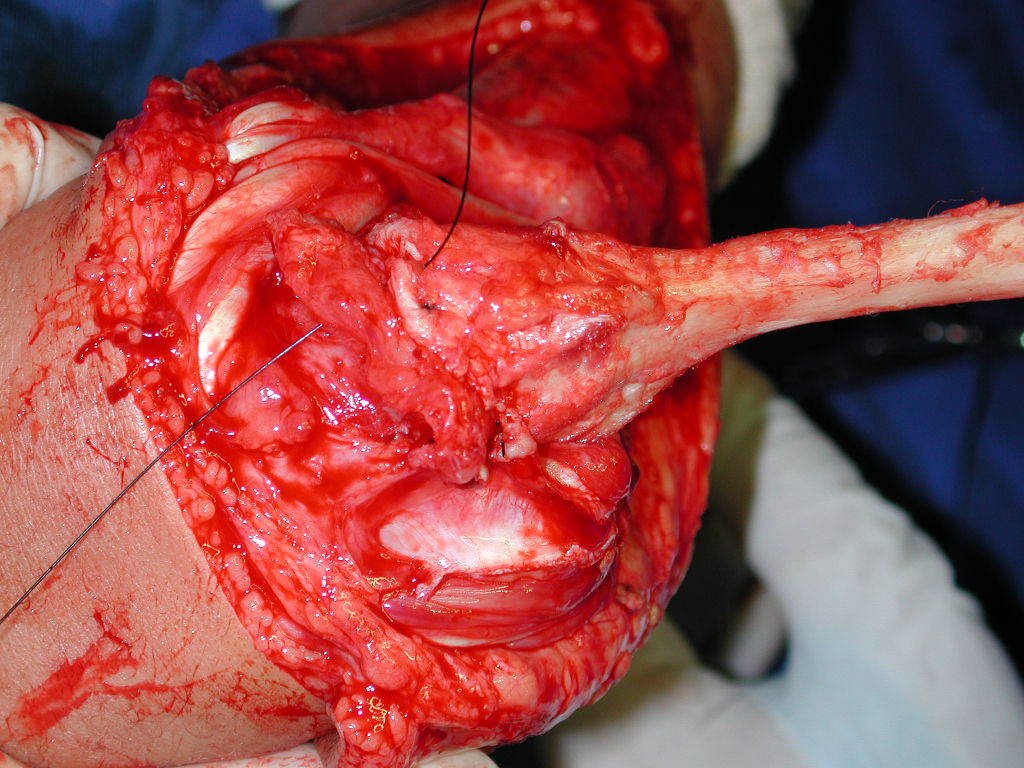
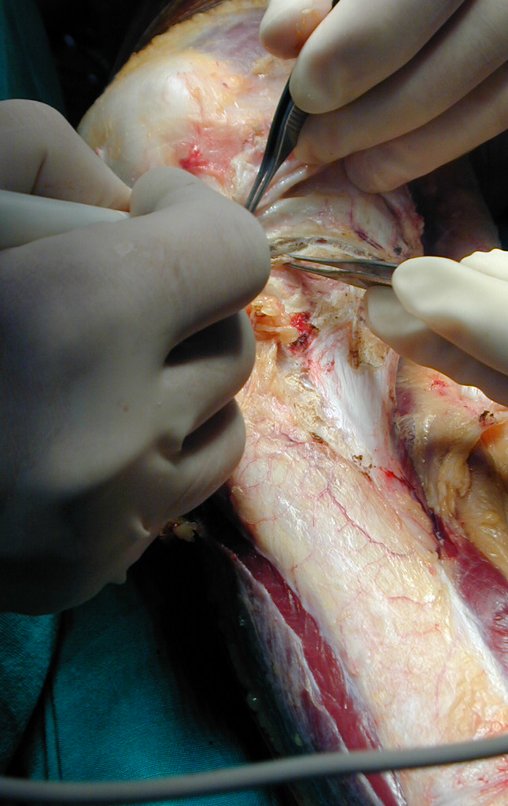
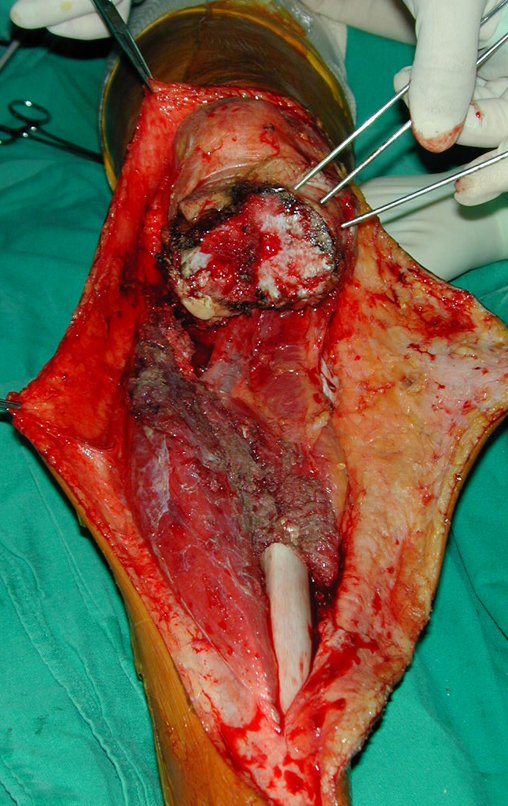
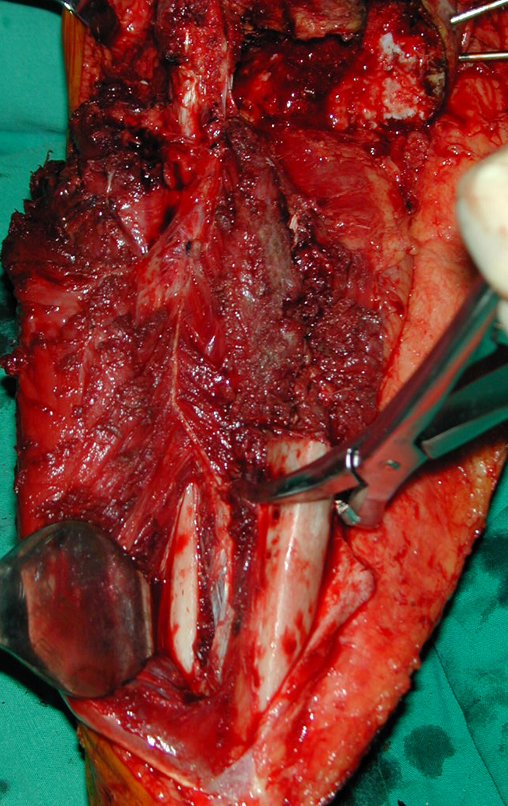
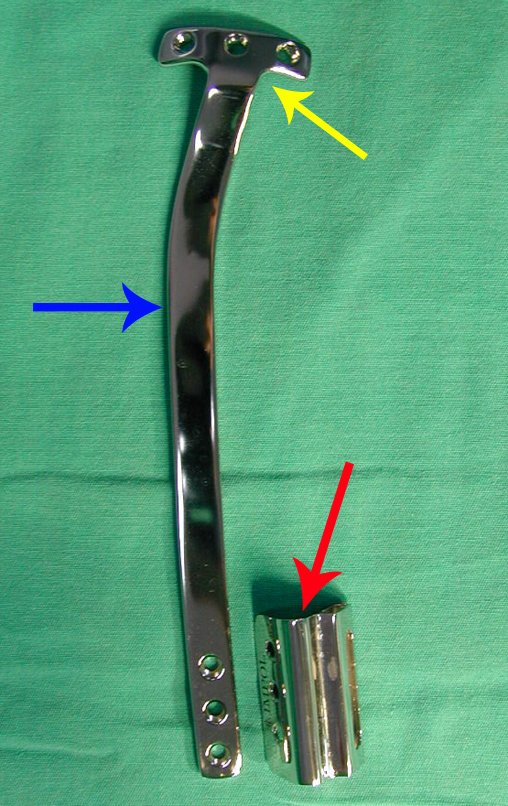
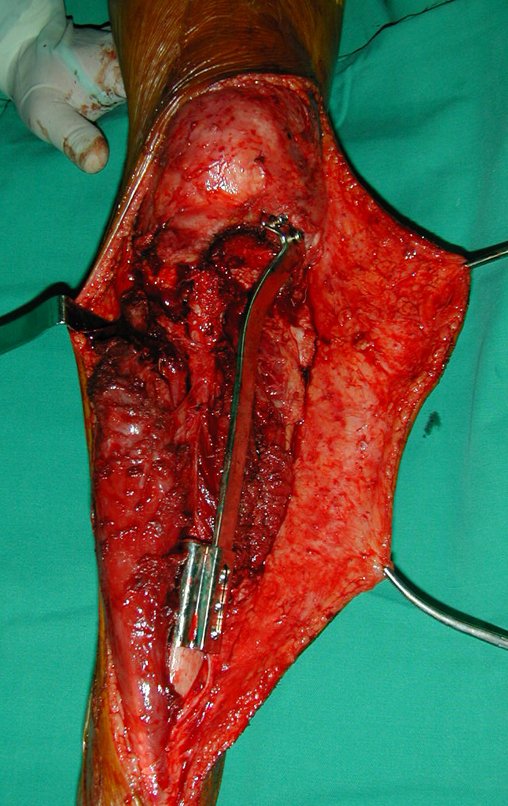
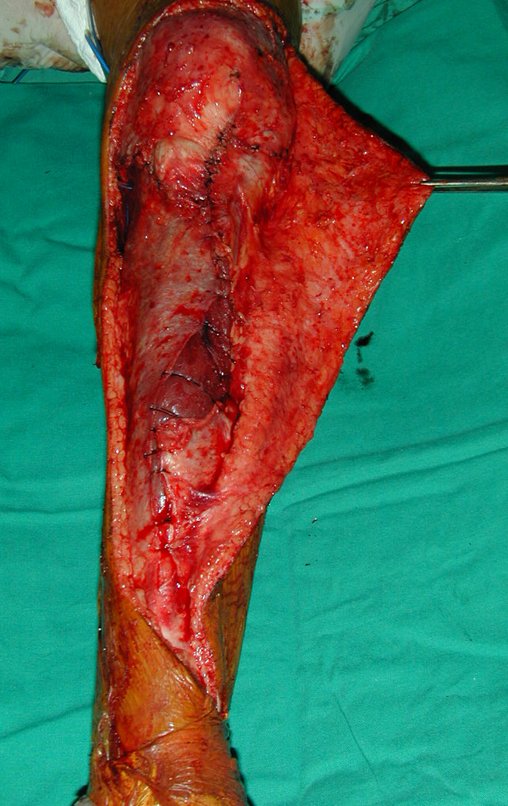
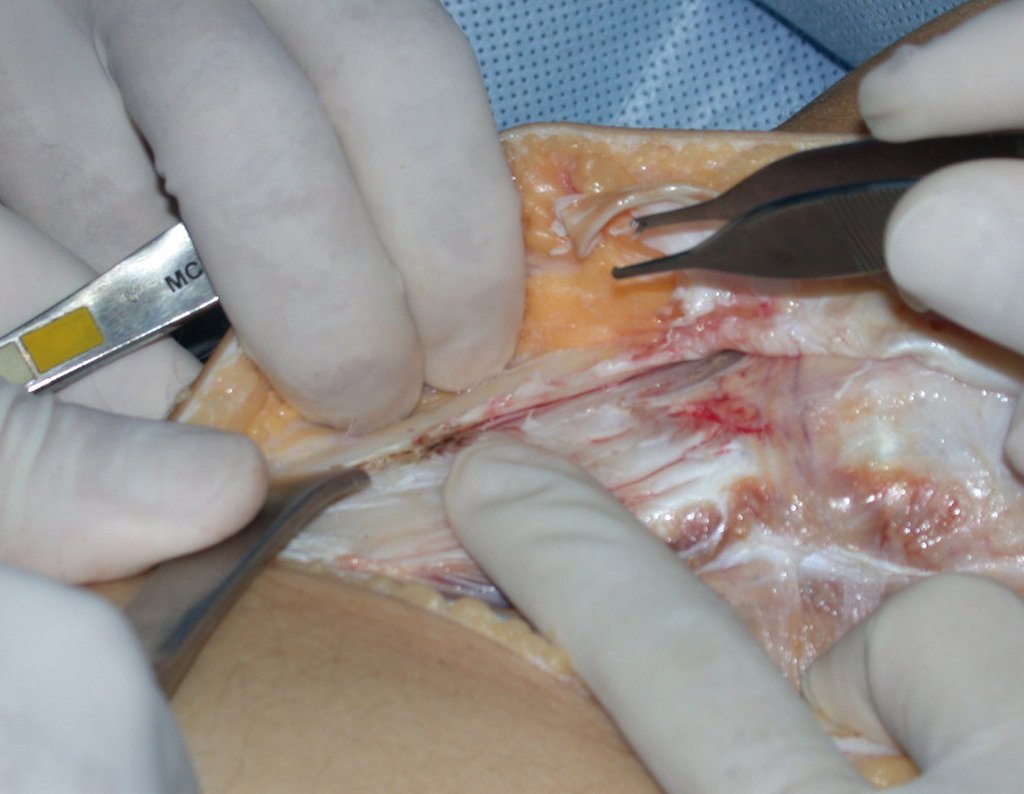
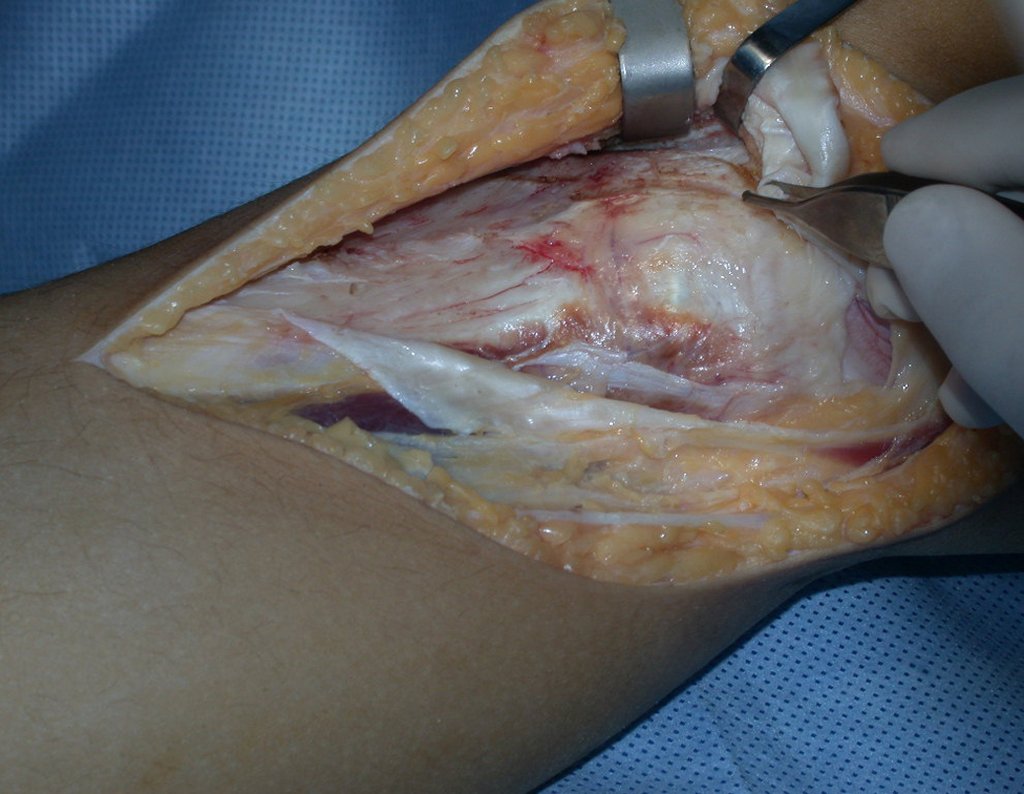
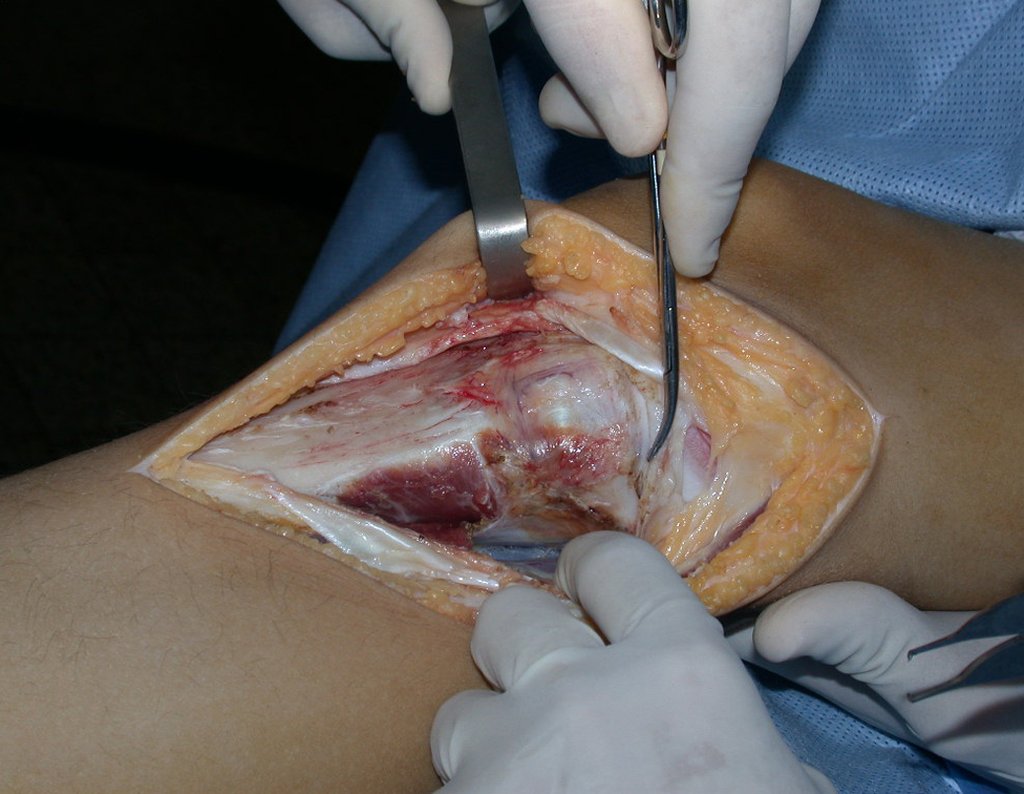
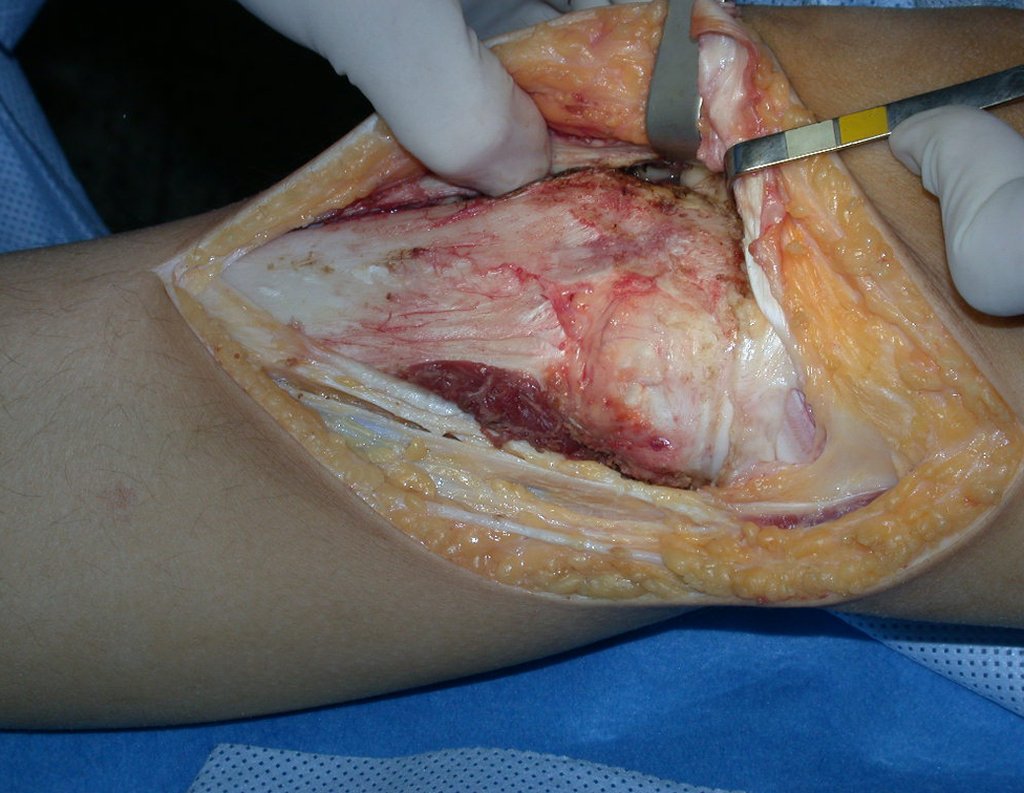
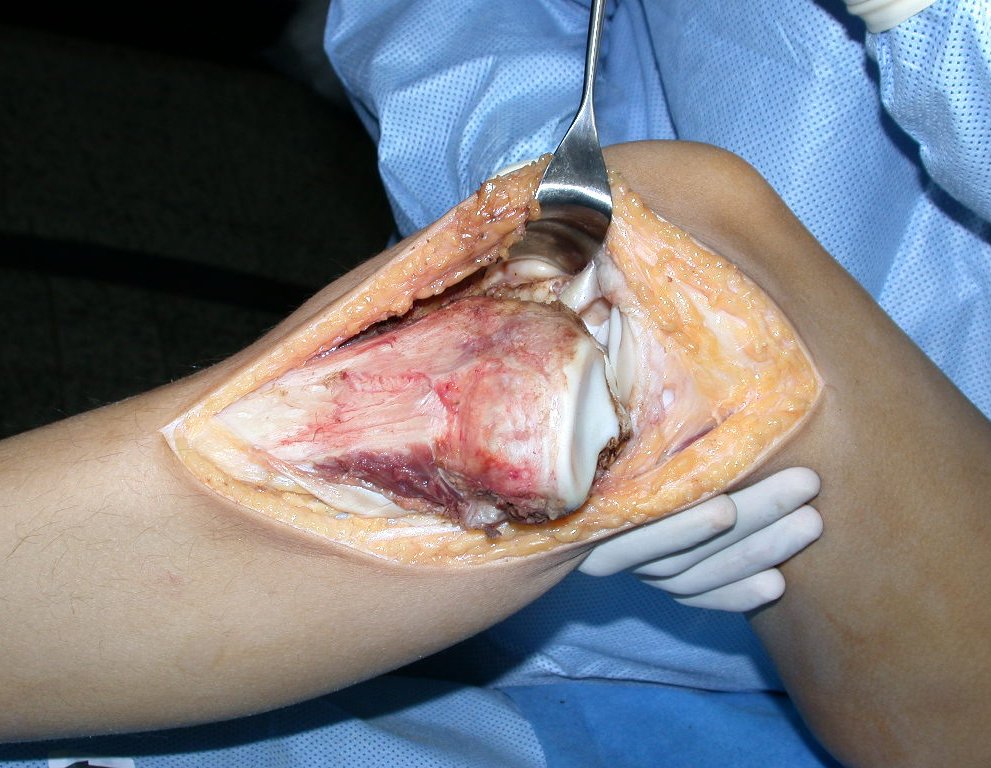
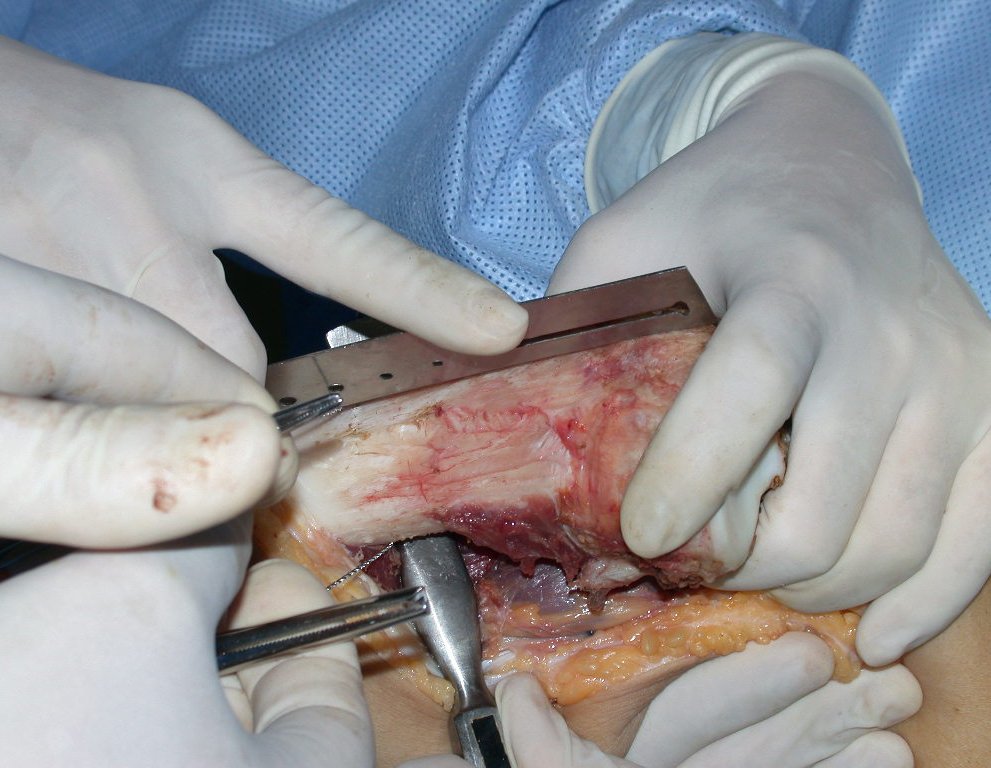
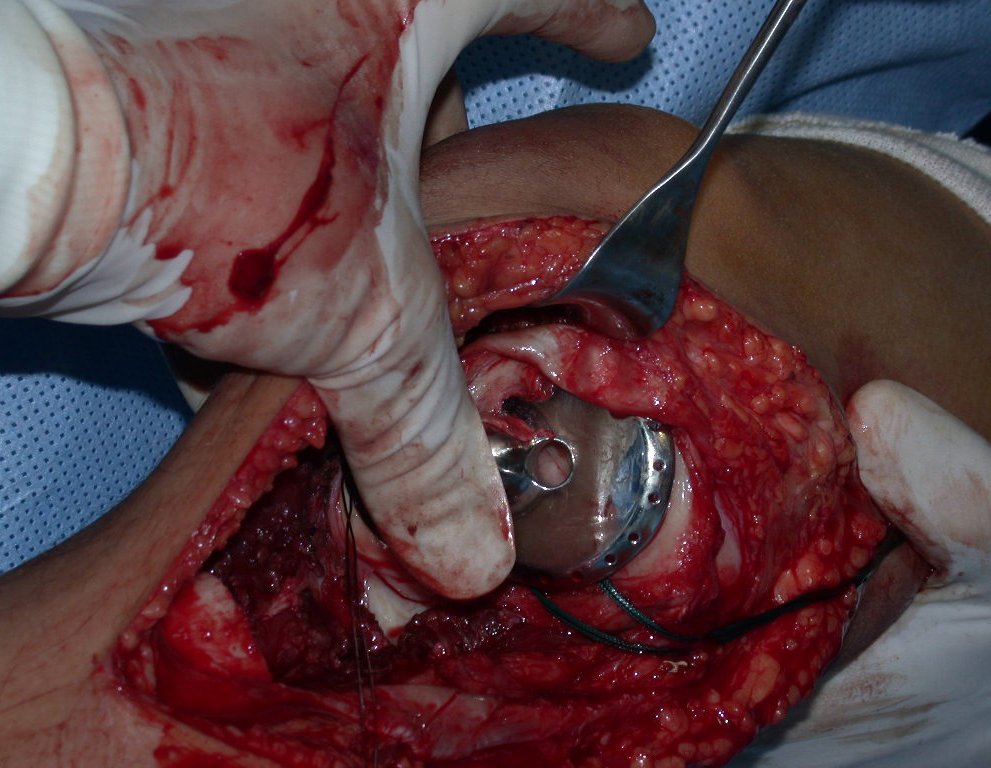
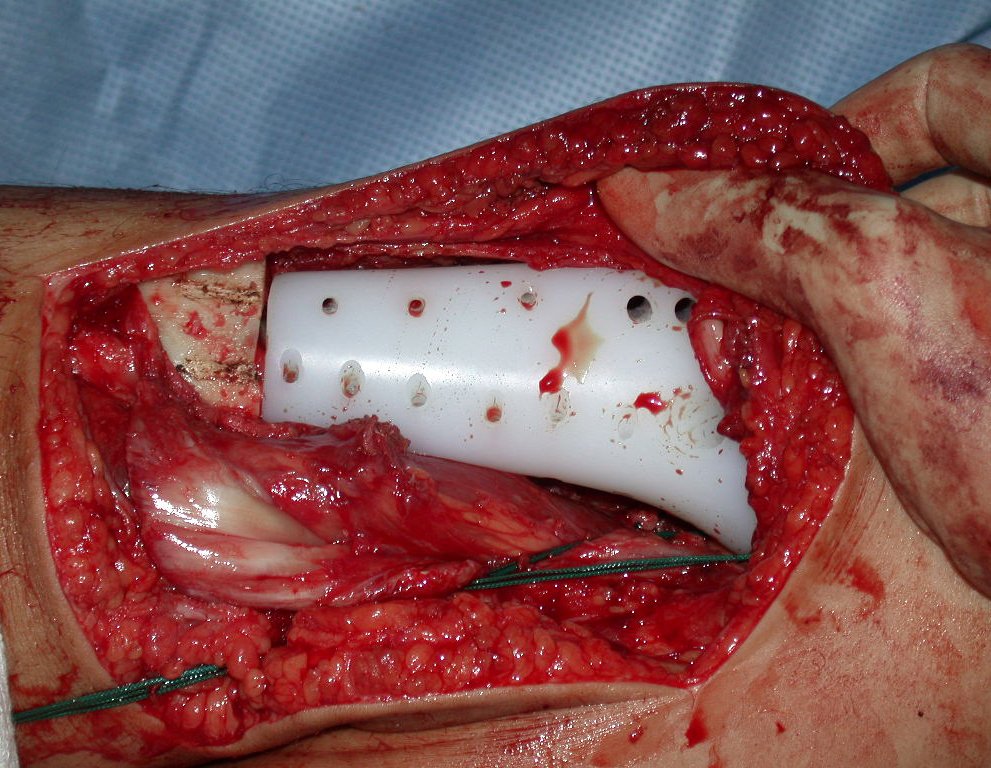
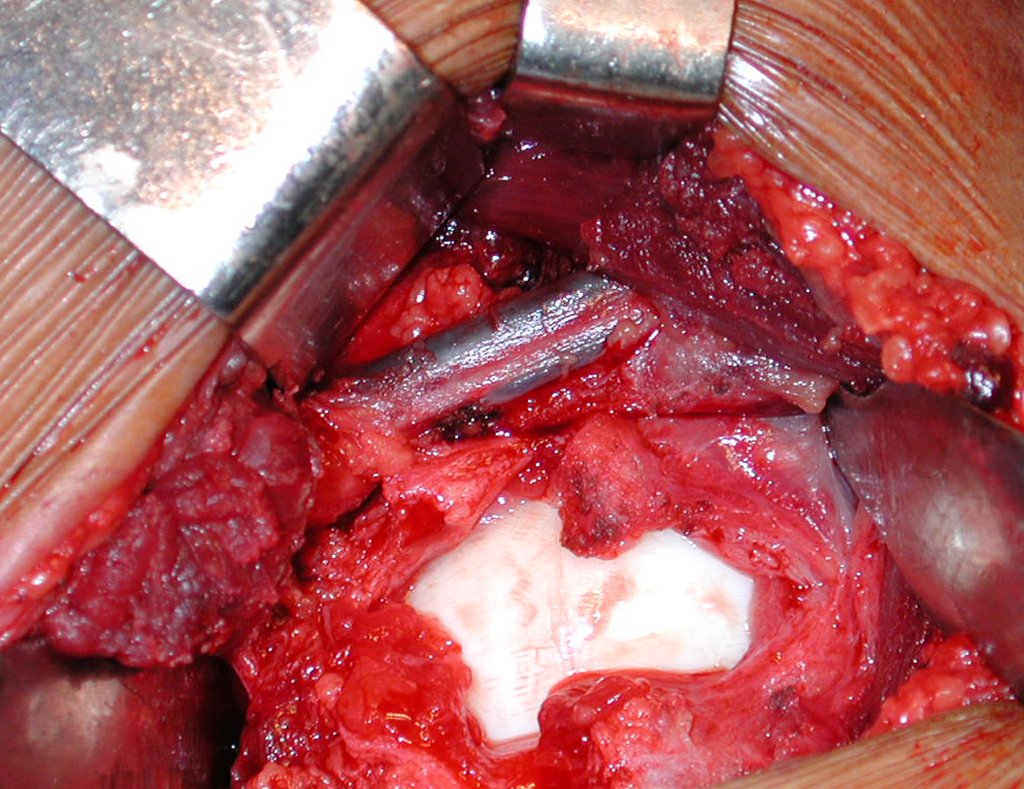
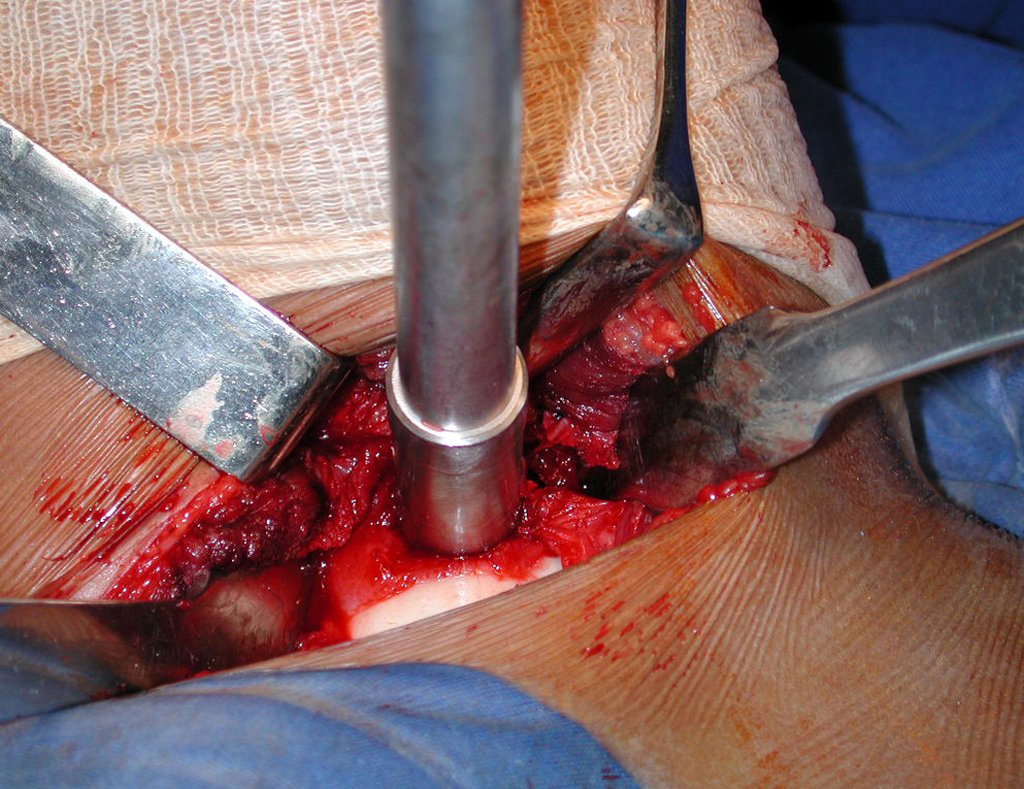
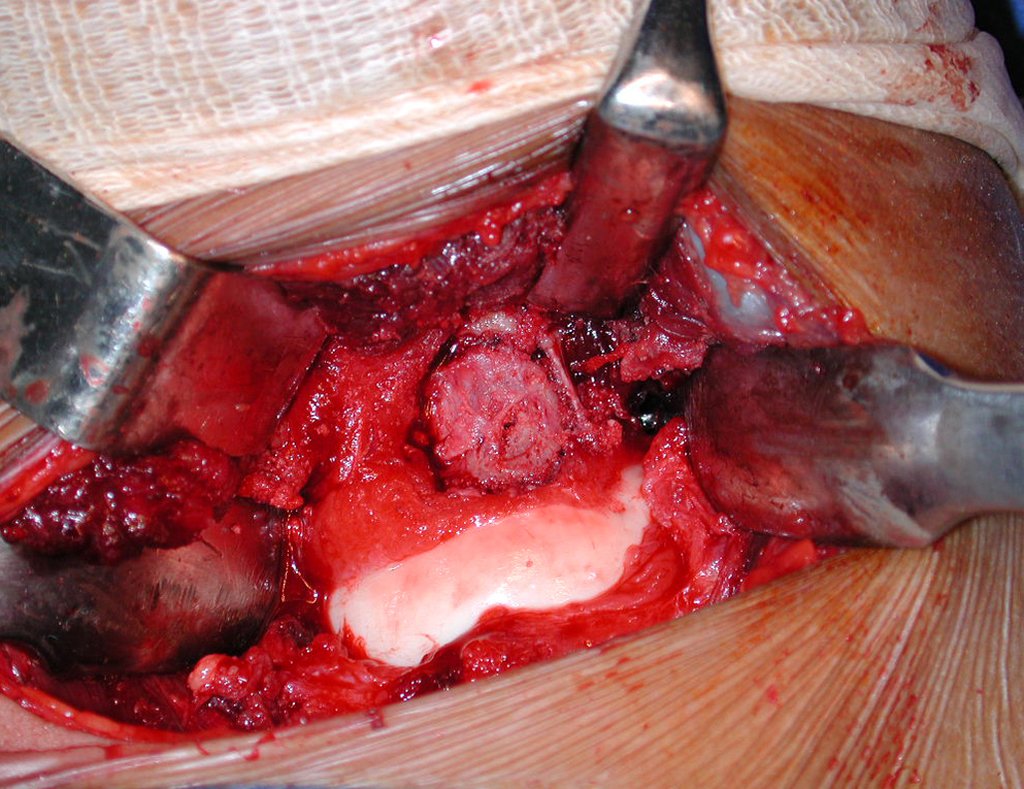
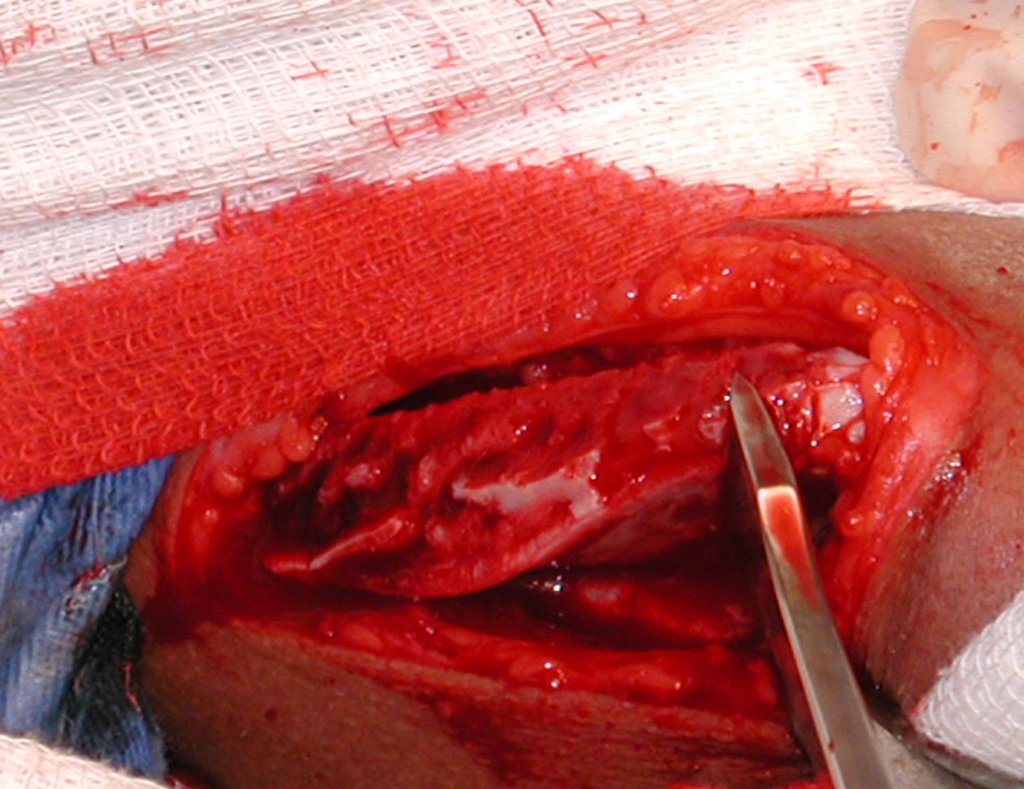
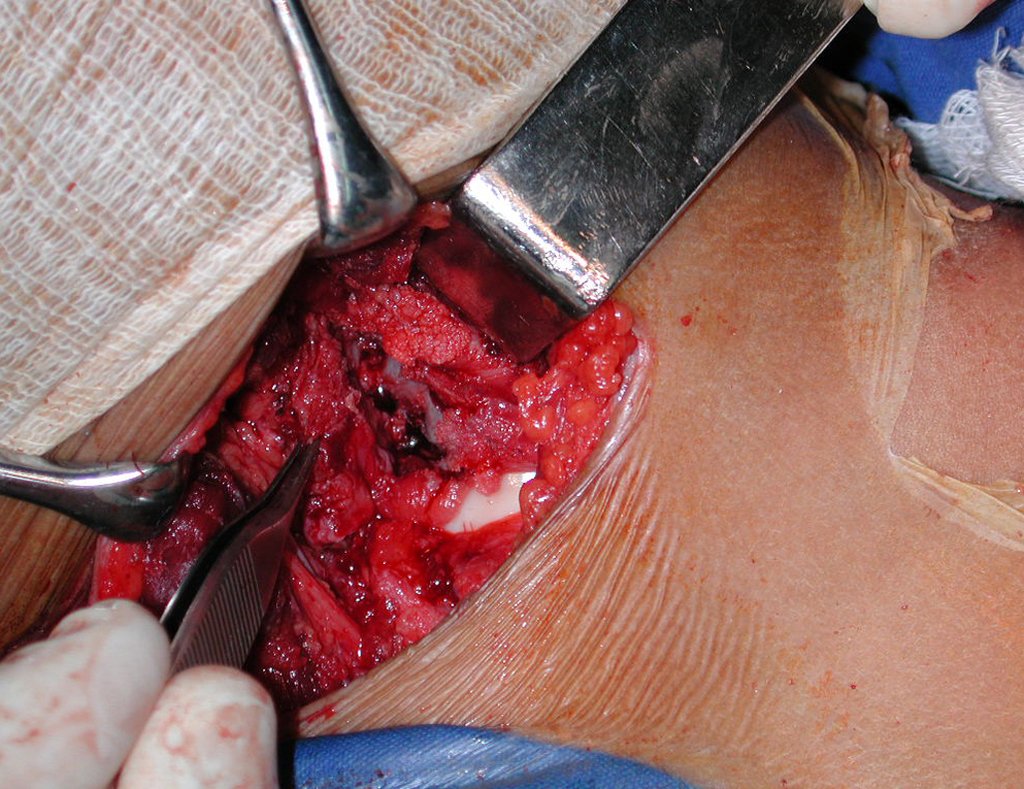
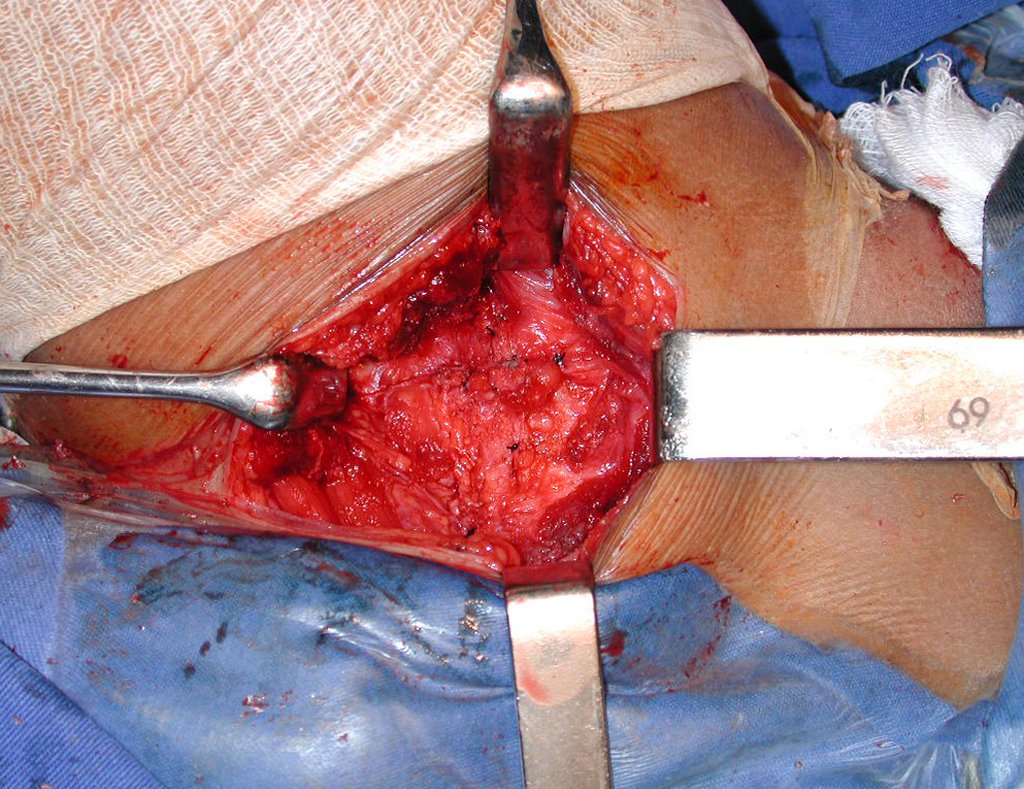
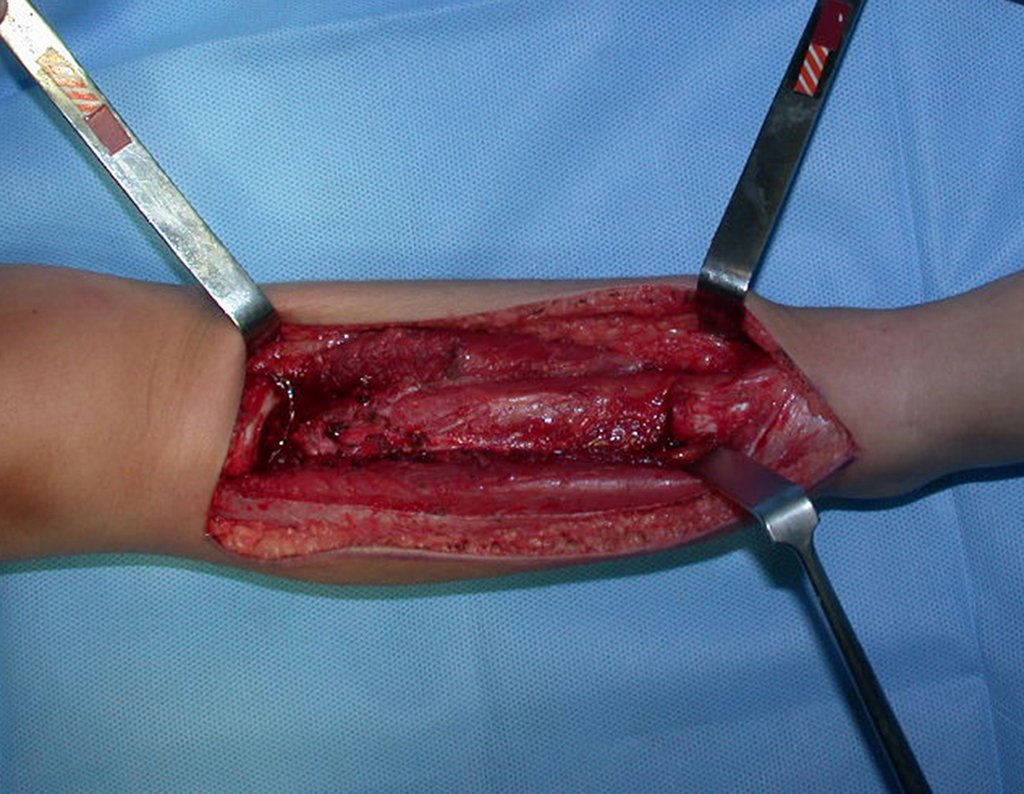
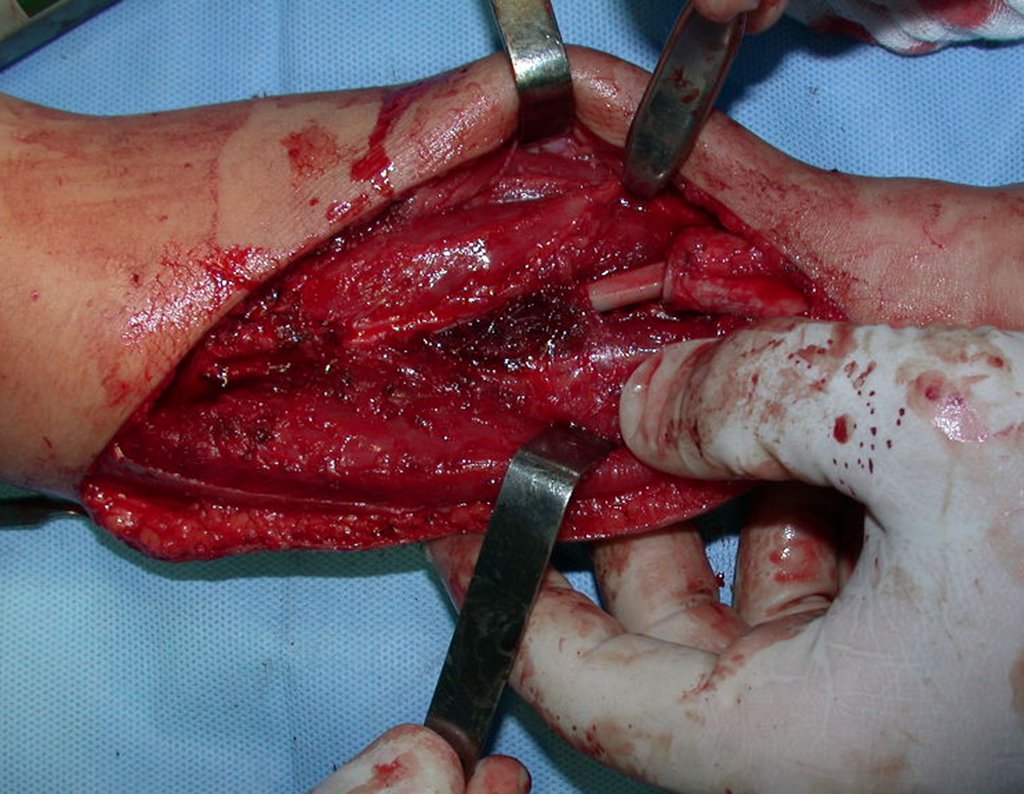
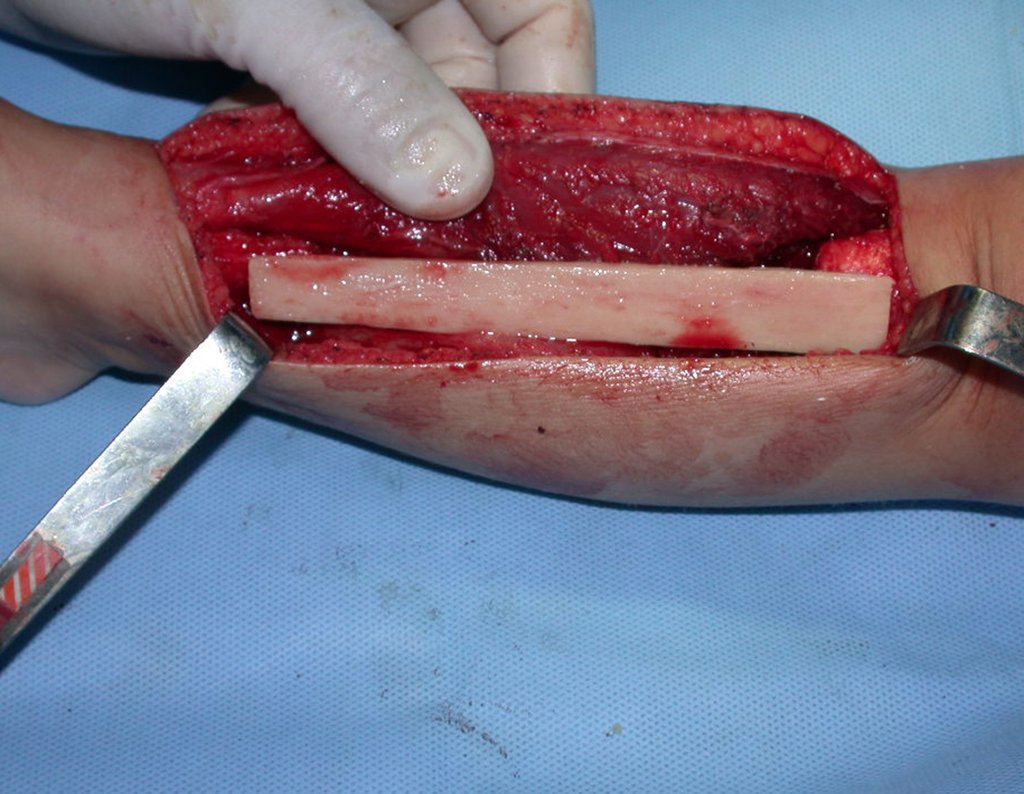
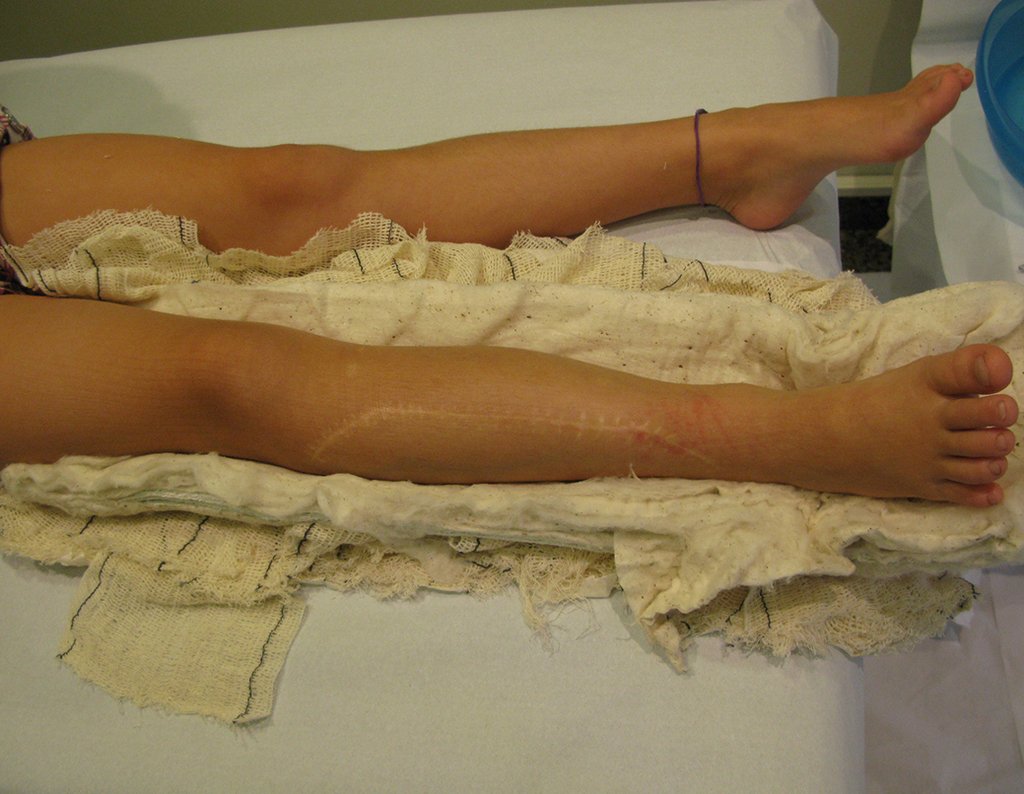
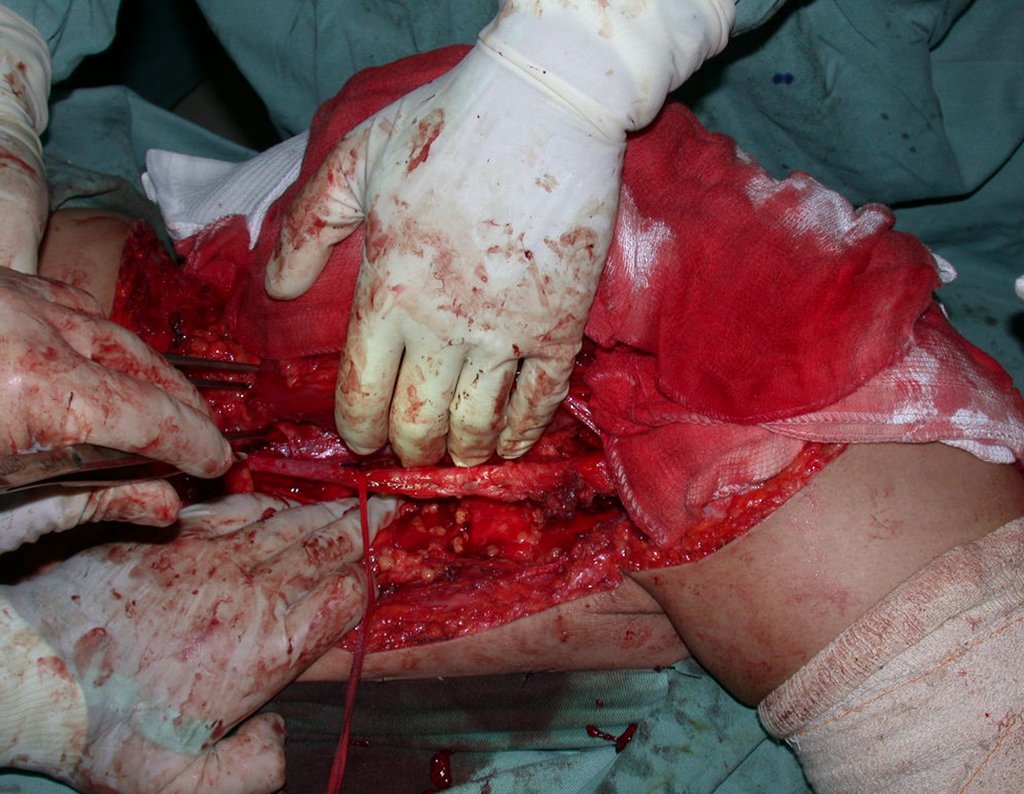
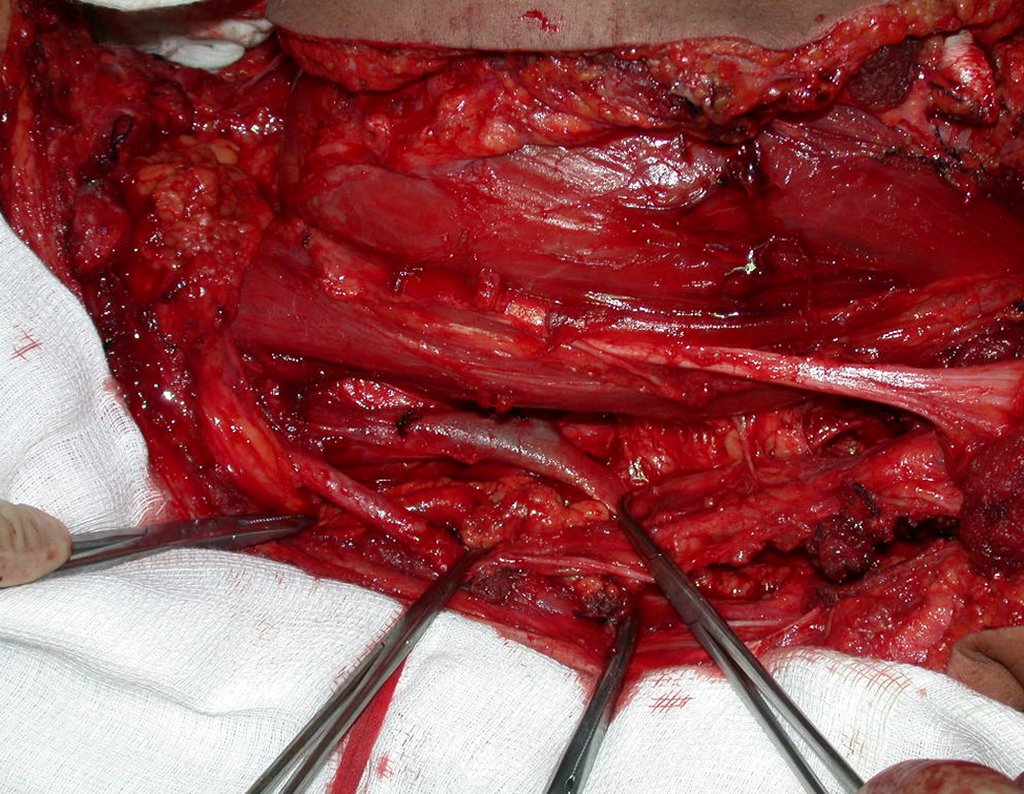
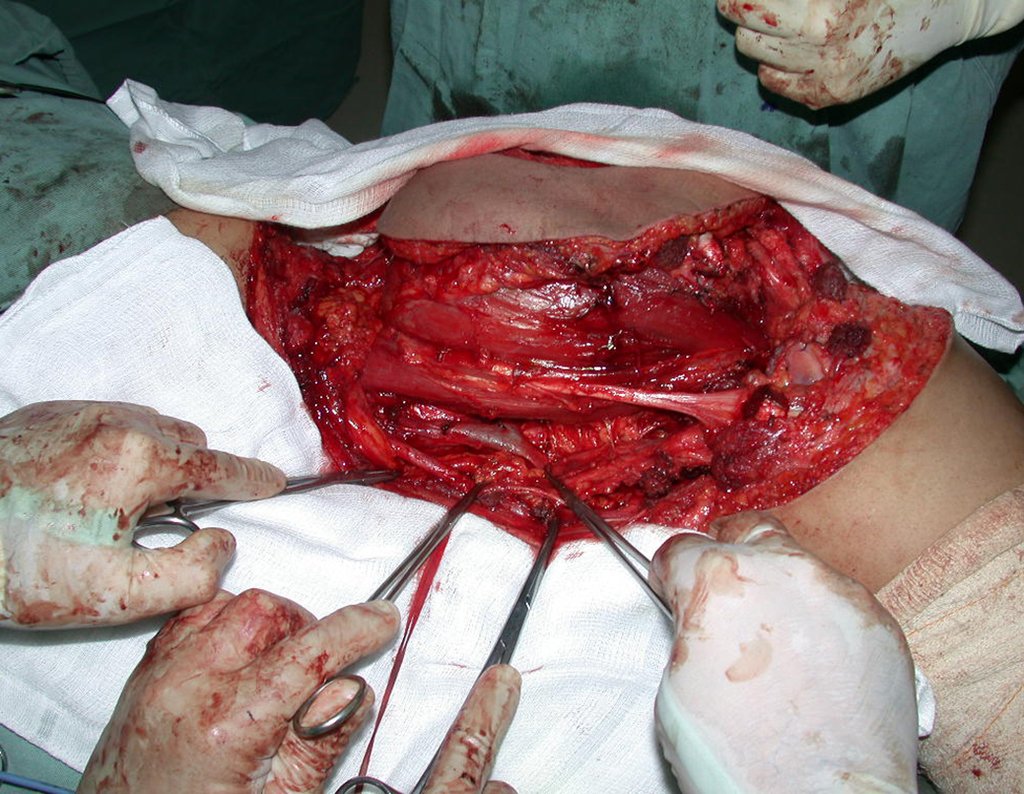
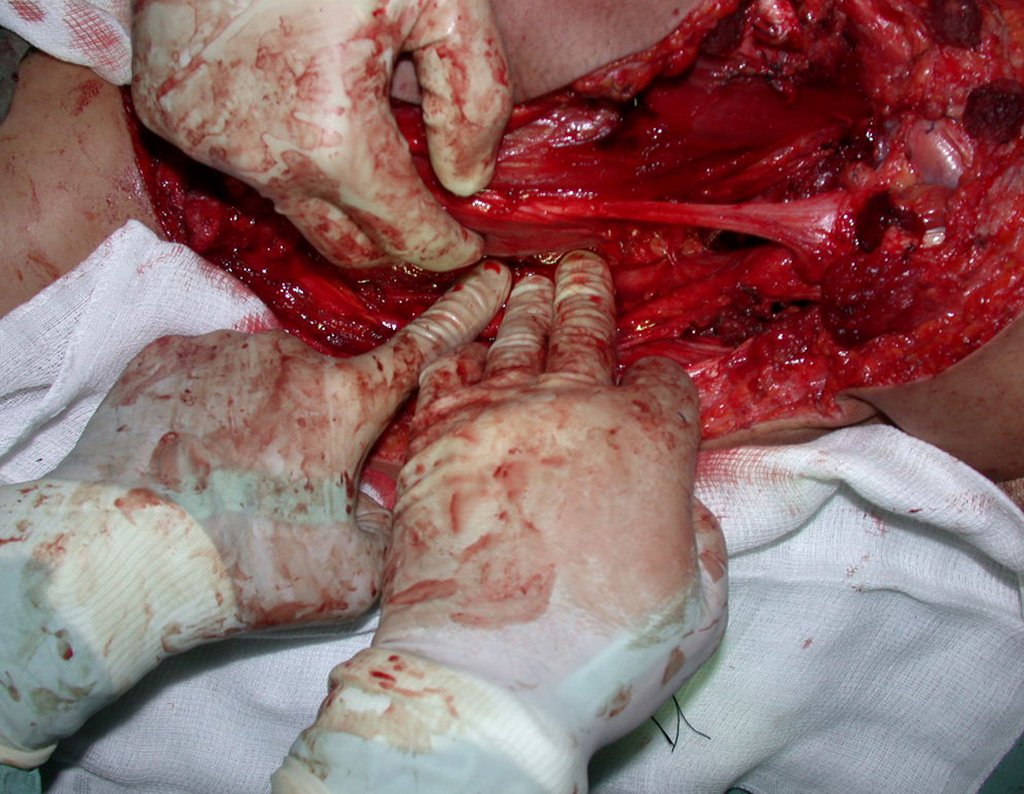
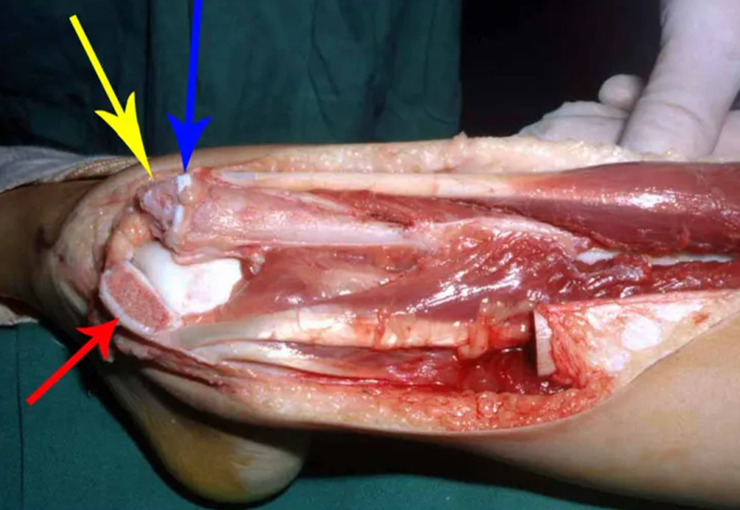
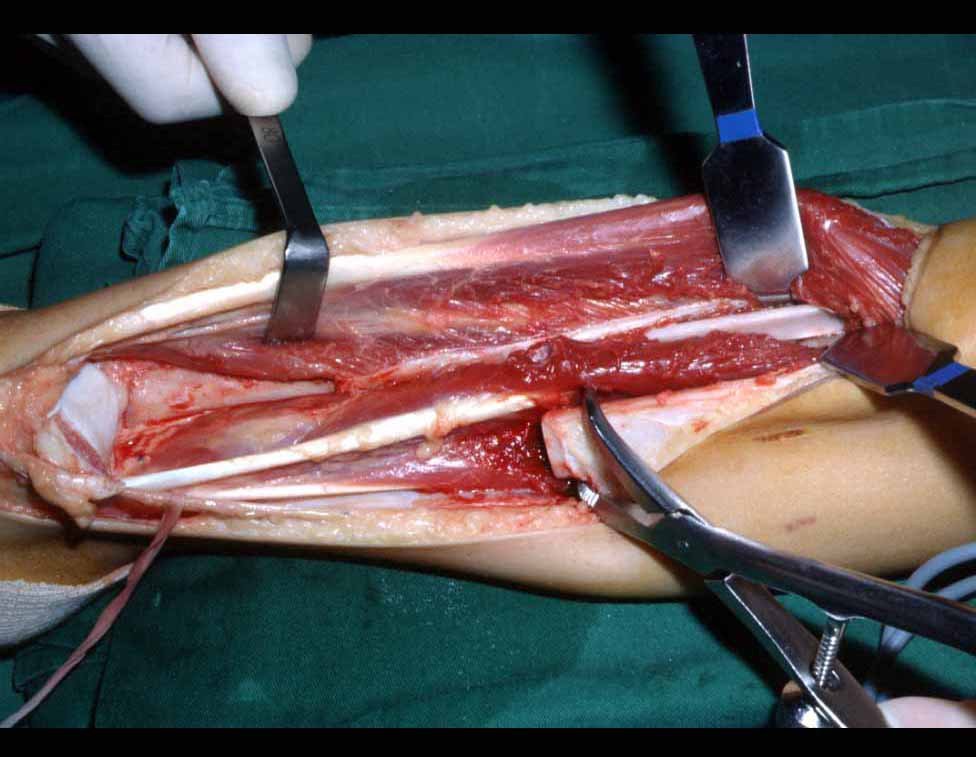
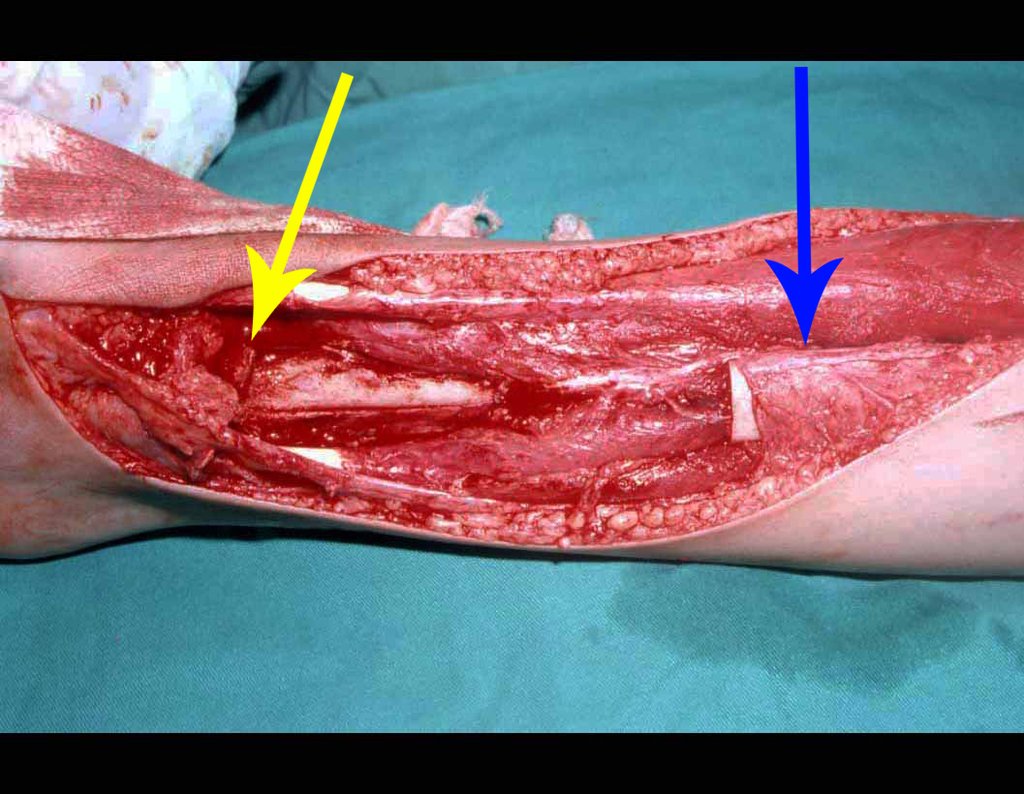
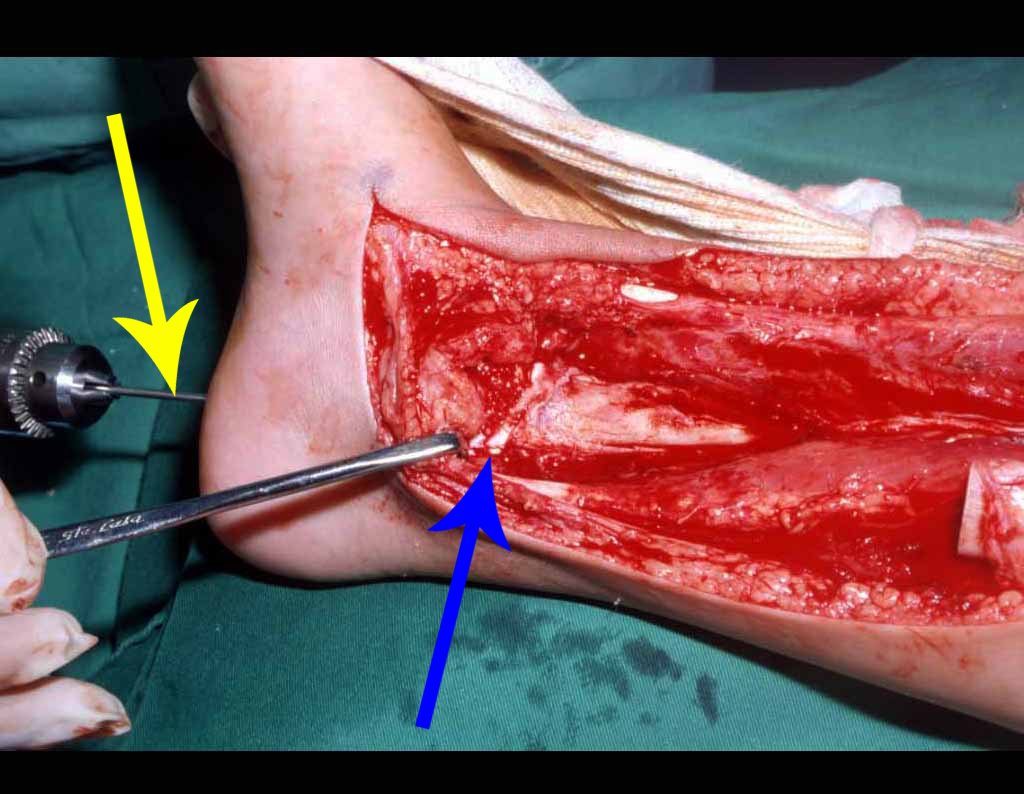
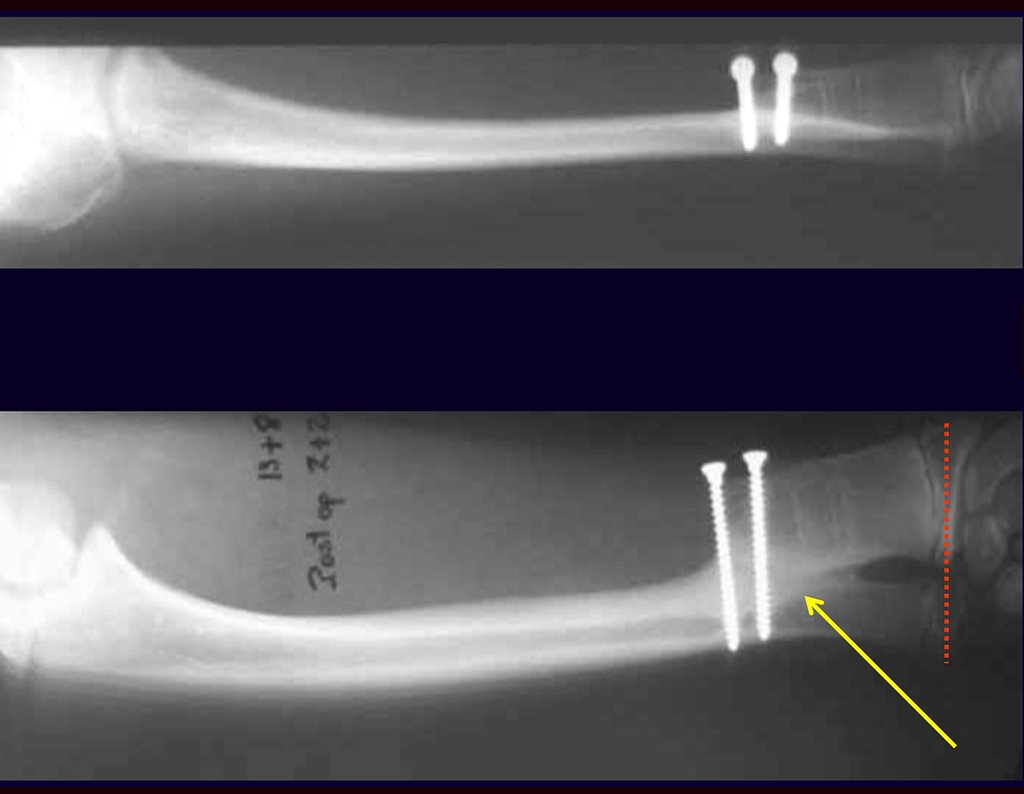
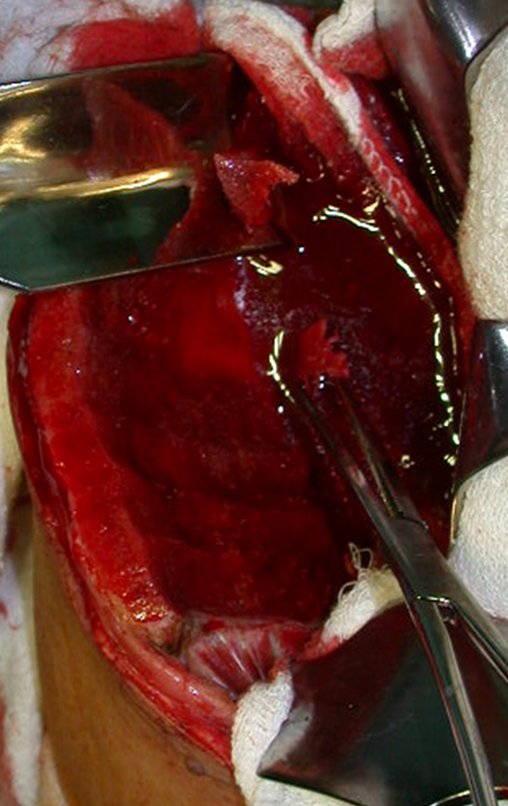
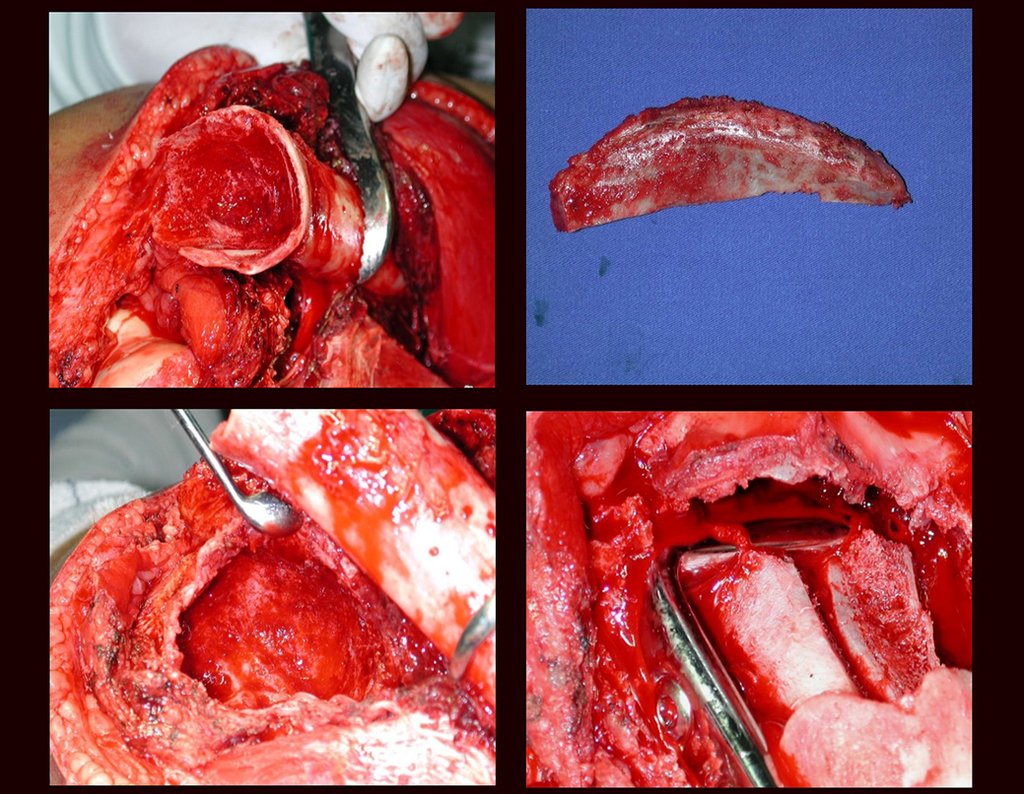
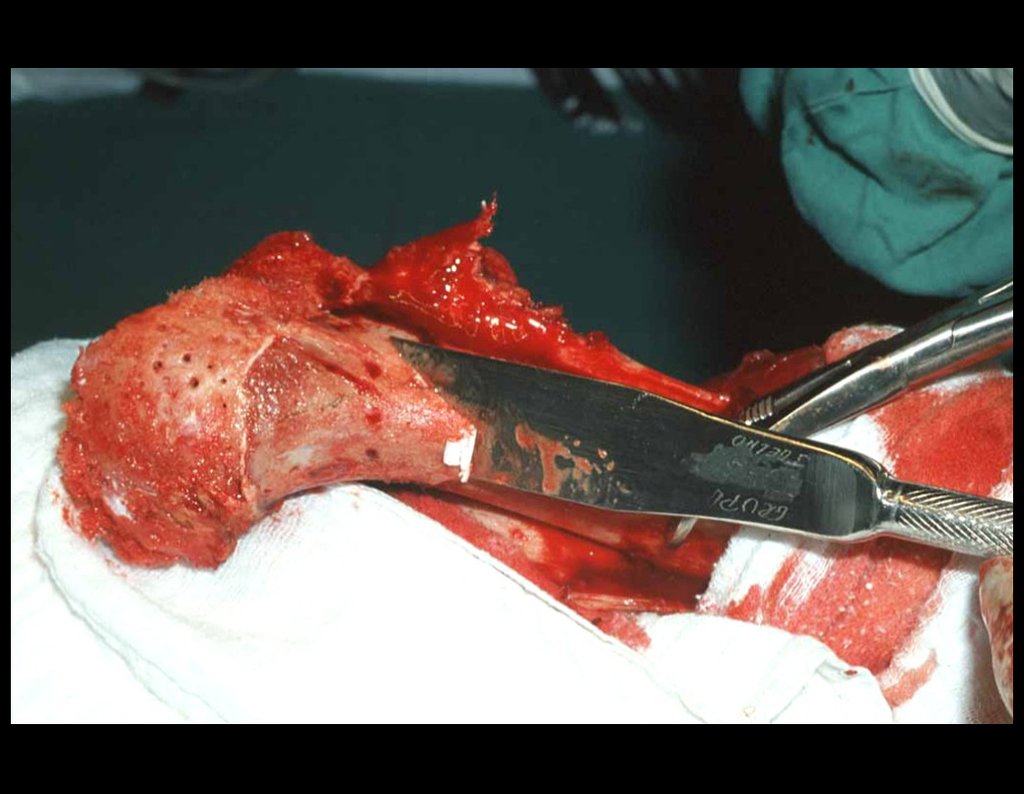
La cirugía es realizada en decúbito dorsal horizontal, preferiblemente sin uso de vaciamiento del miembro. Los detalles de la resección los mostramos en las figuras 38 a 57.
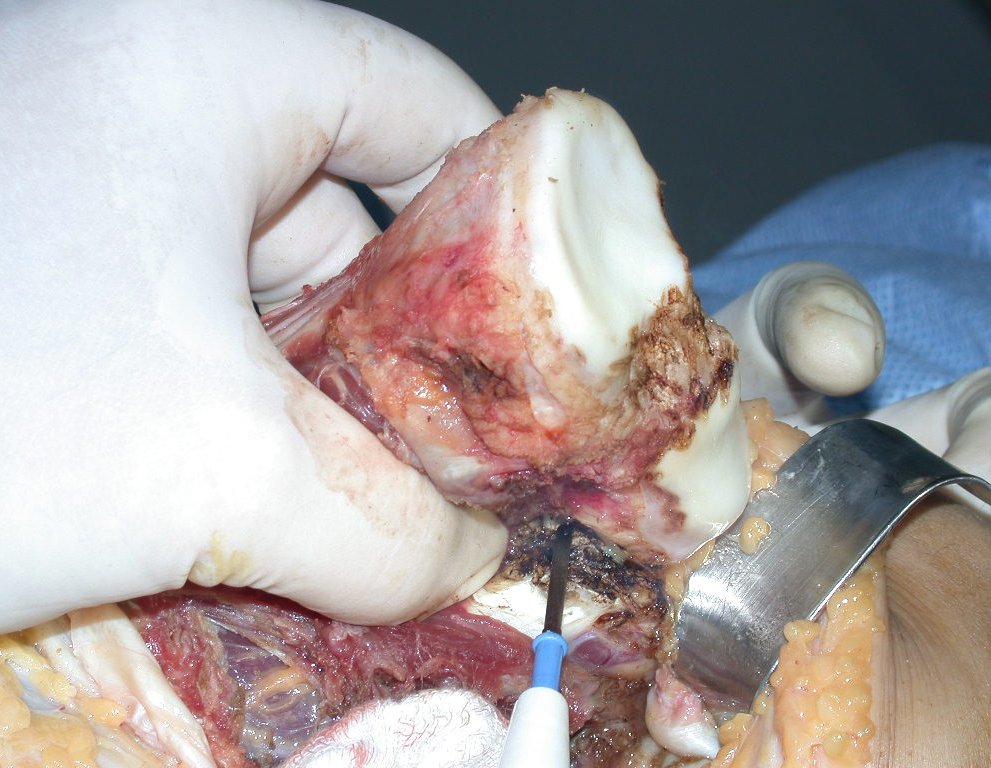
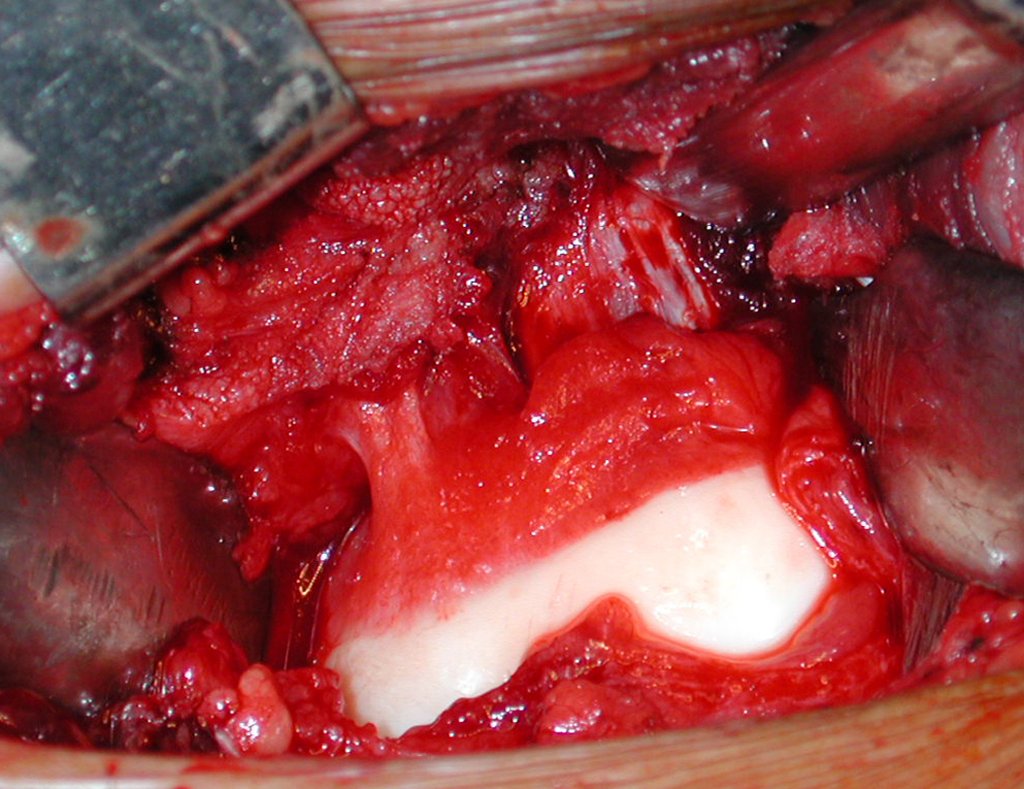
Después de la resección del segmento distal del radio y la revisión cuidadosa de la hemostasia, colocamos compresas humedecidas con suero fisiológico en lecho quirúrgico y enfajamos con faja crepe.
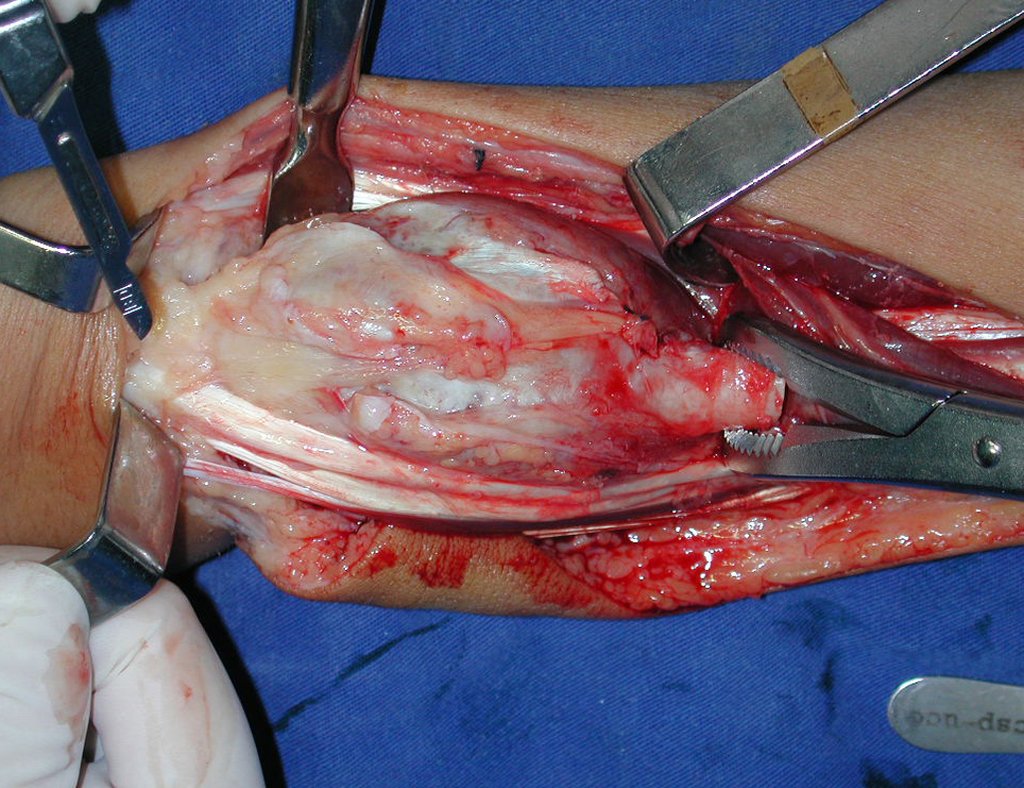
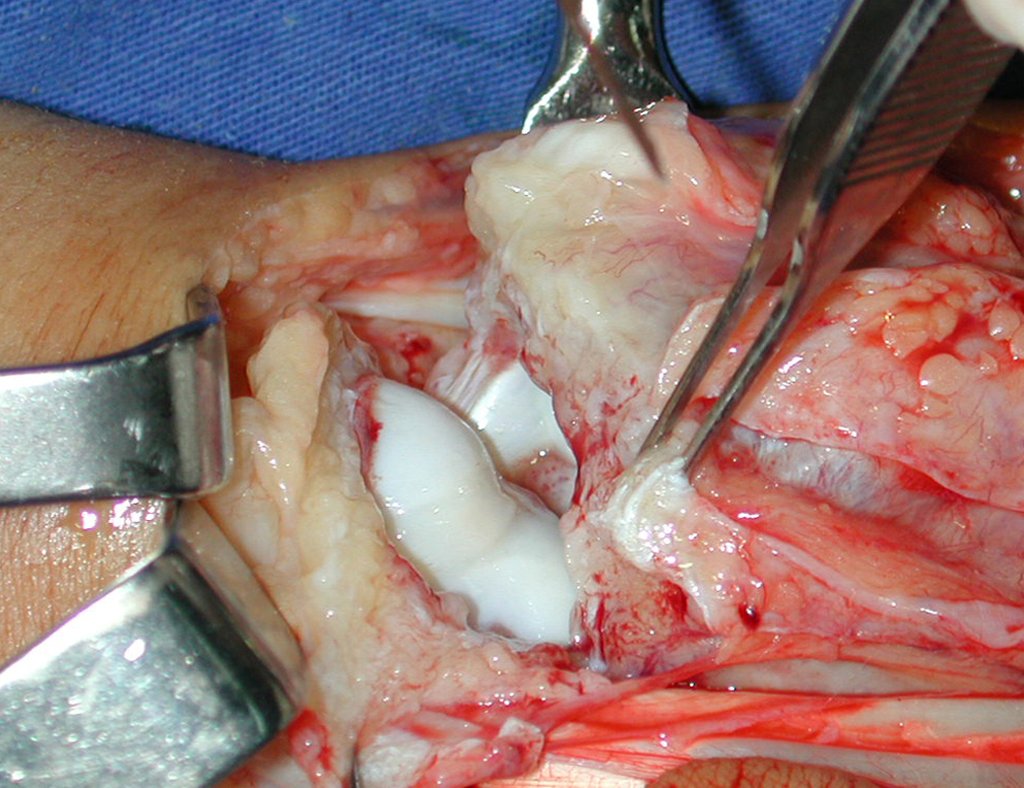
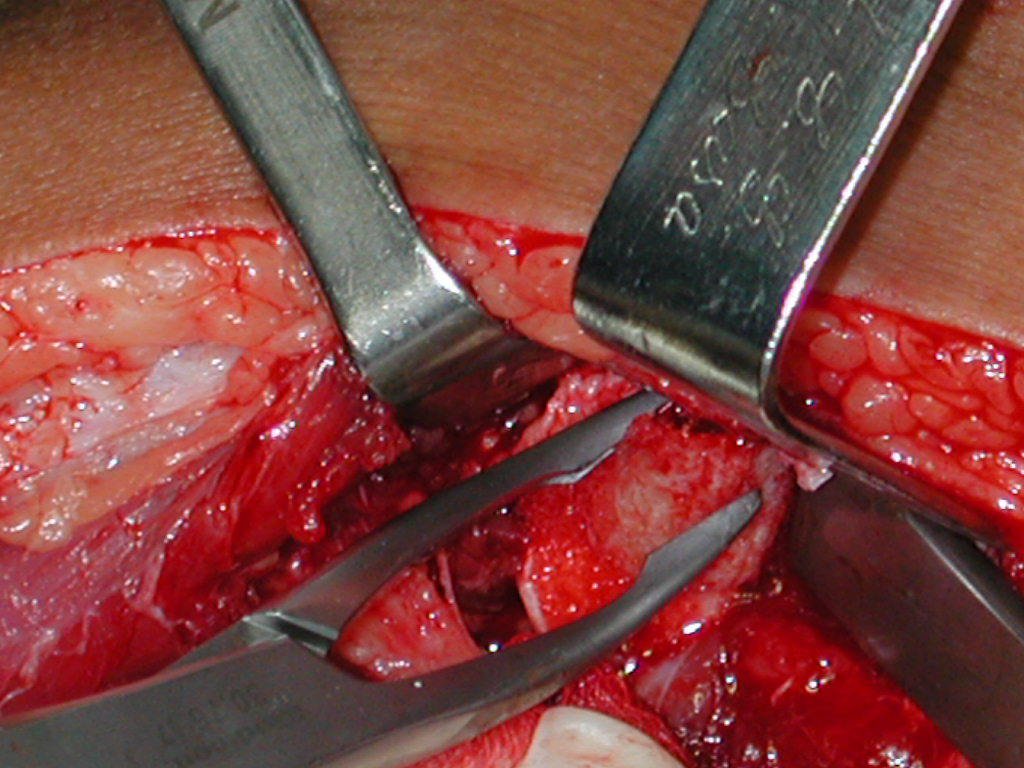
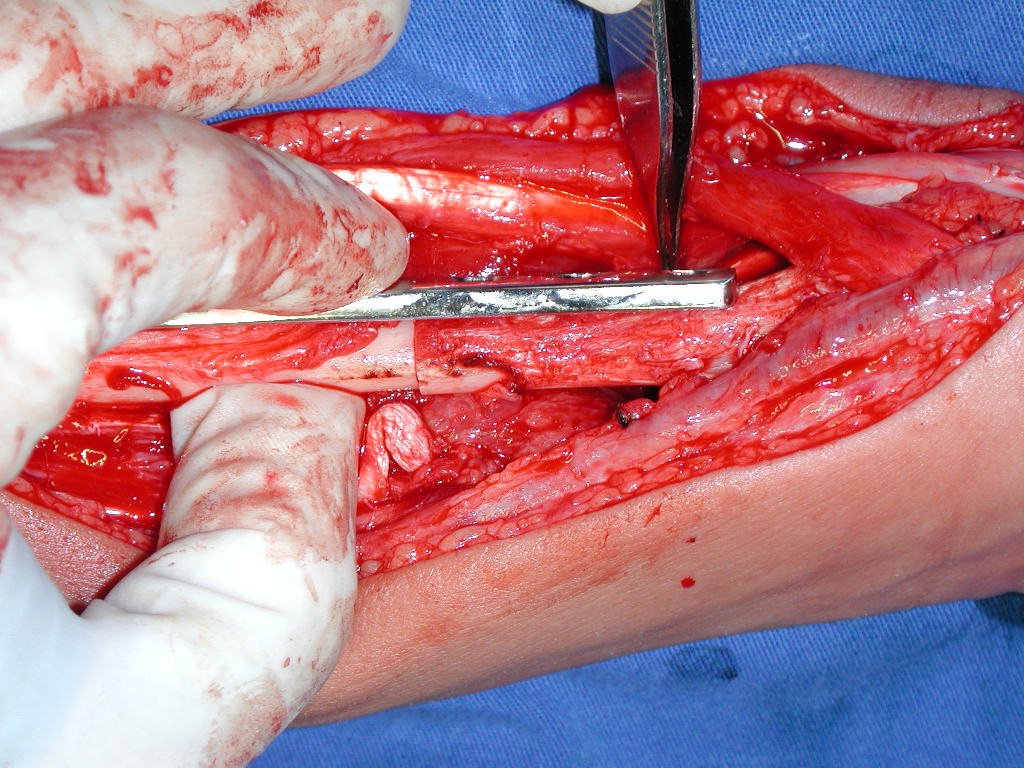
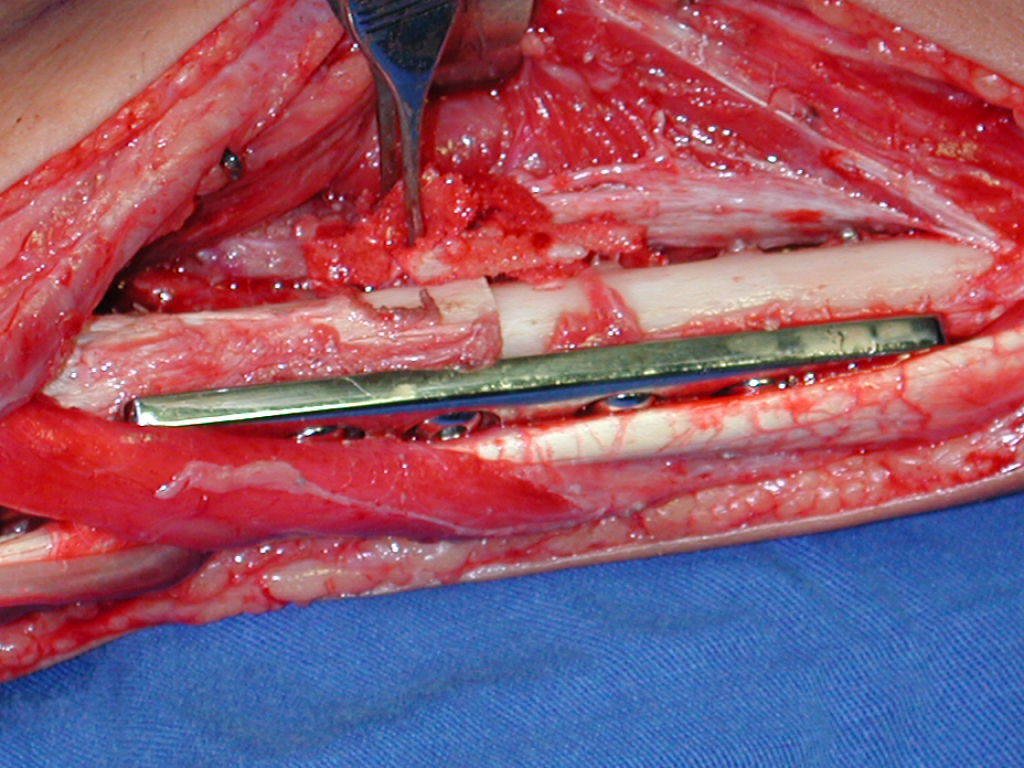
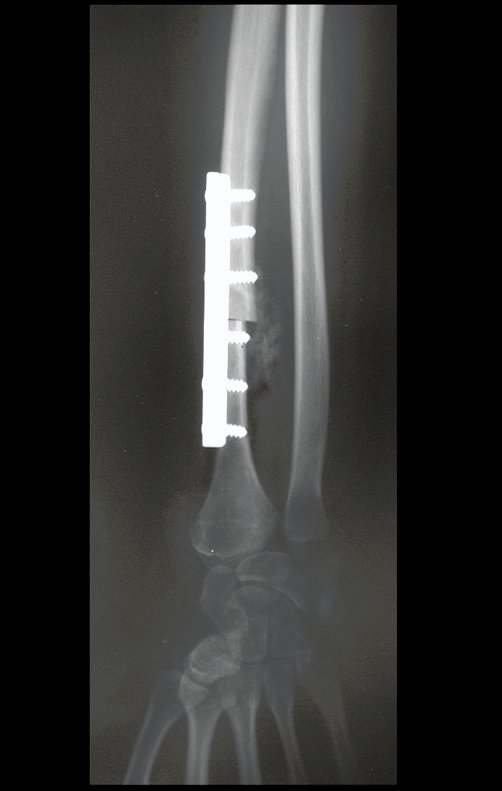
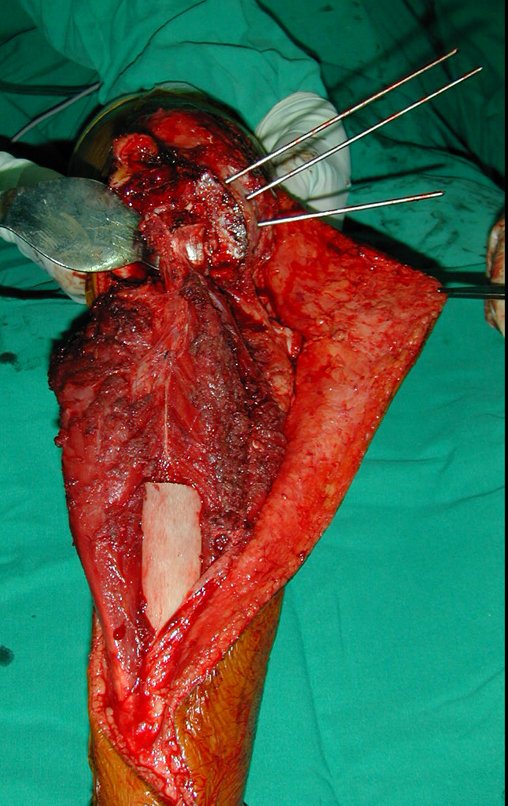
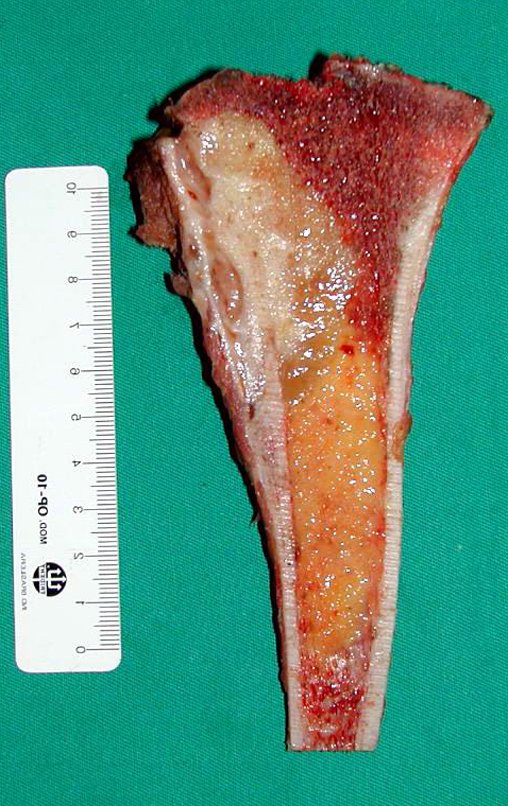
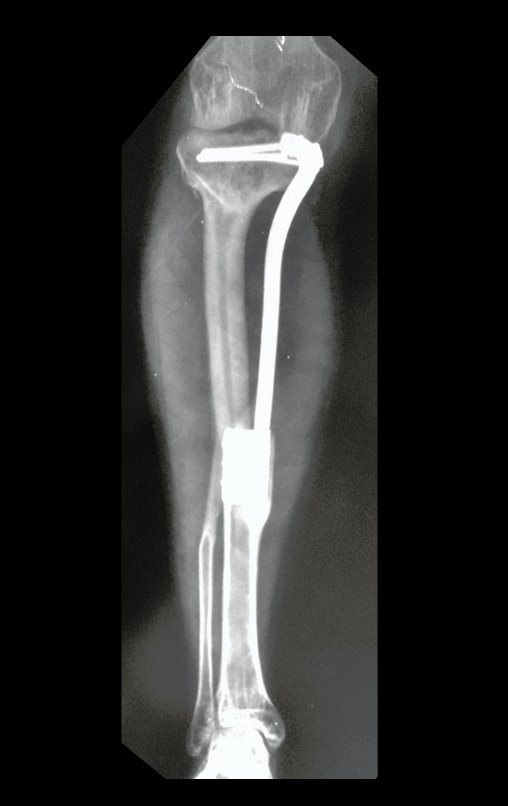
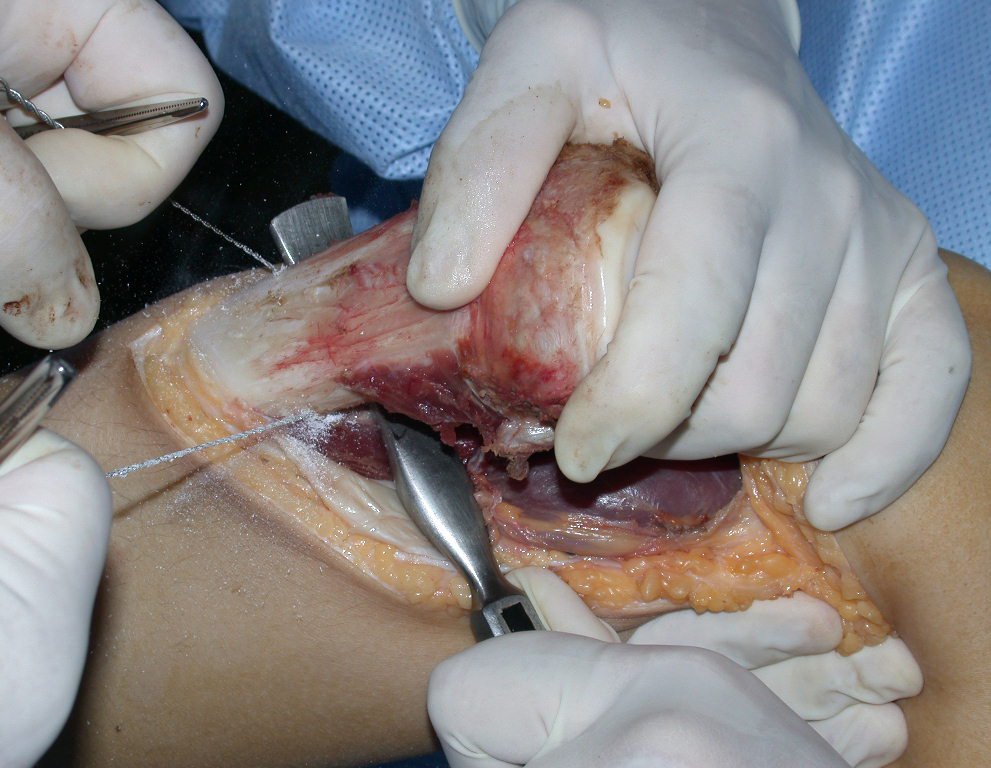
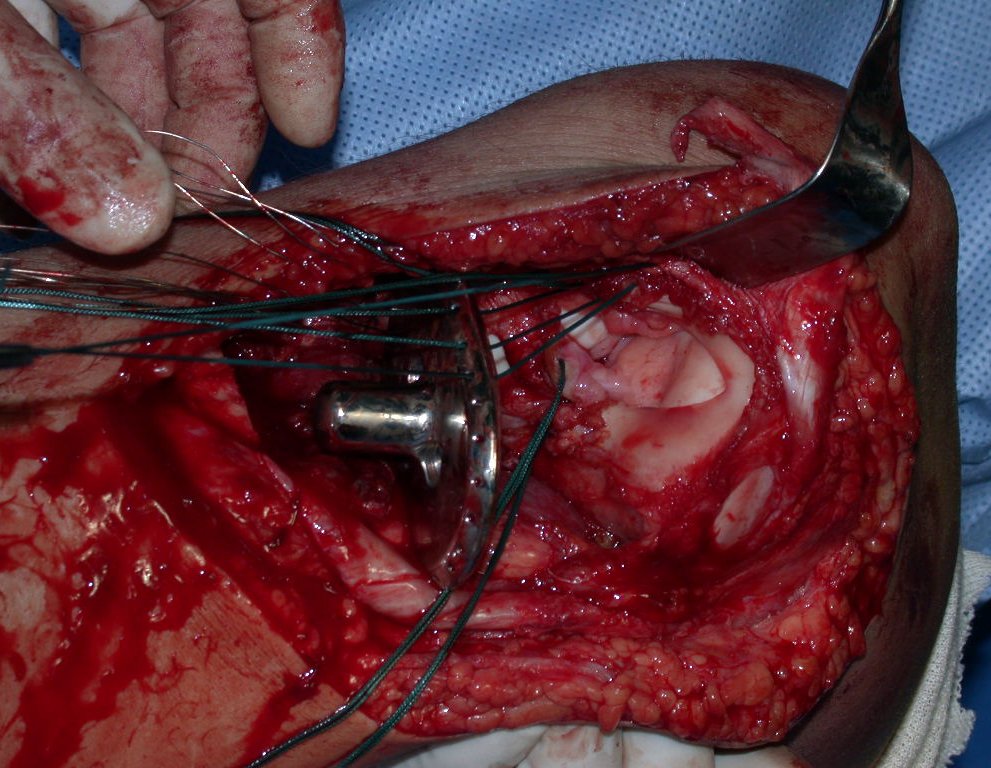
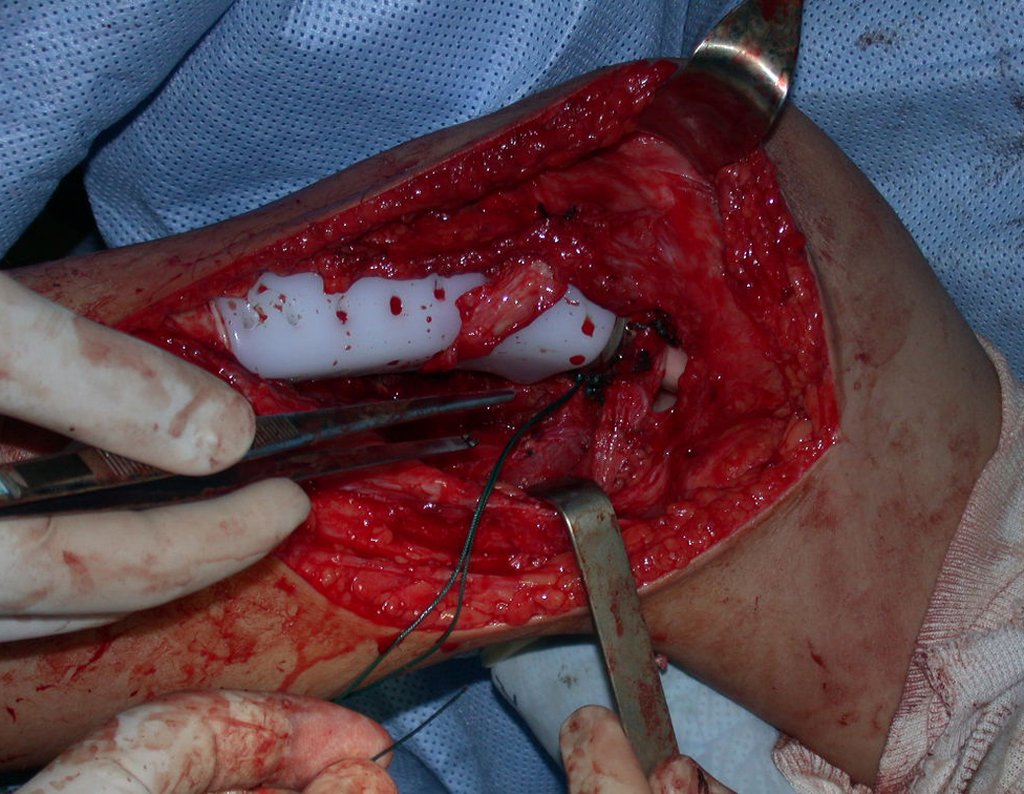
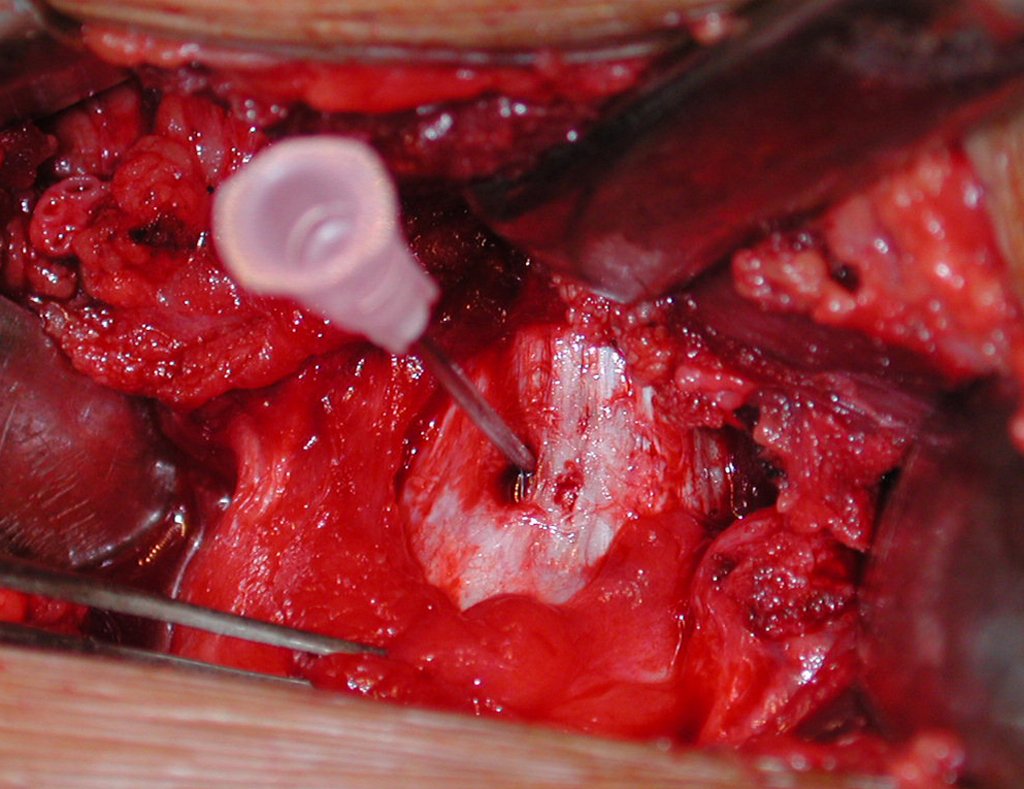
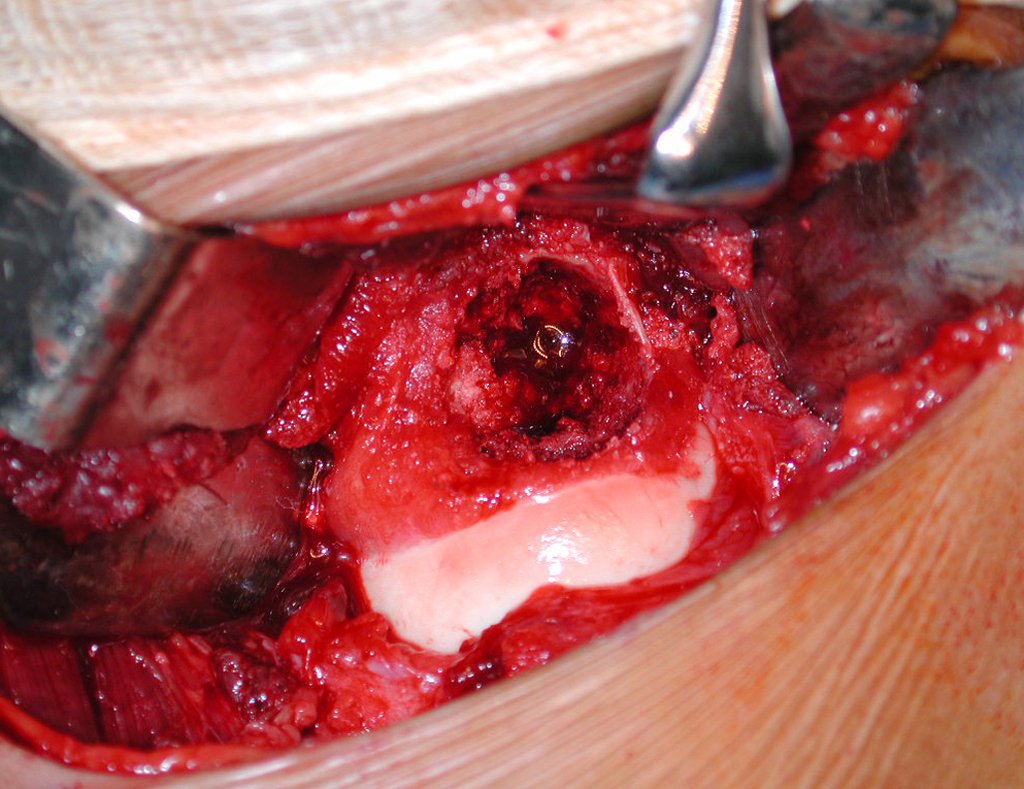
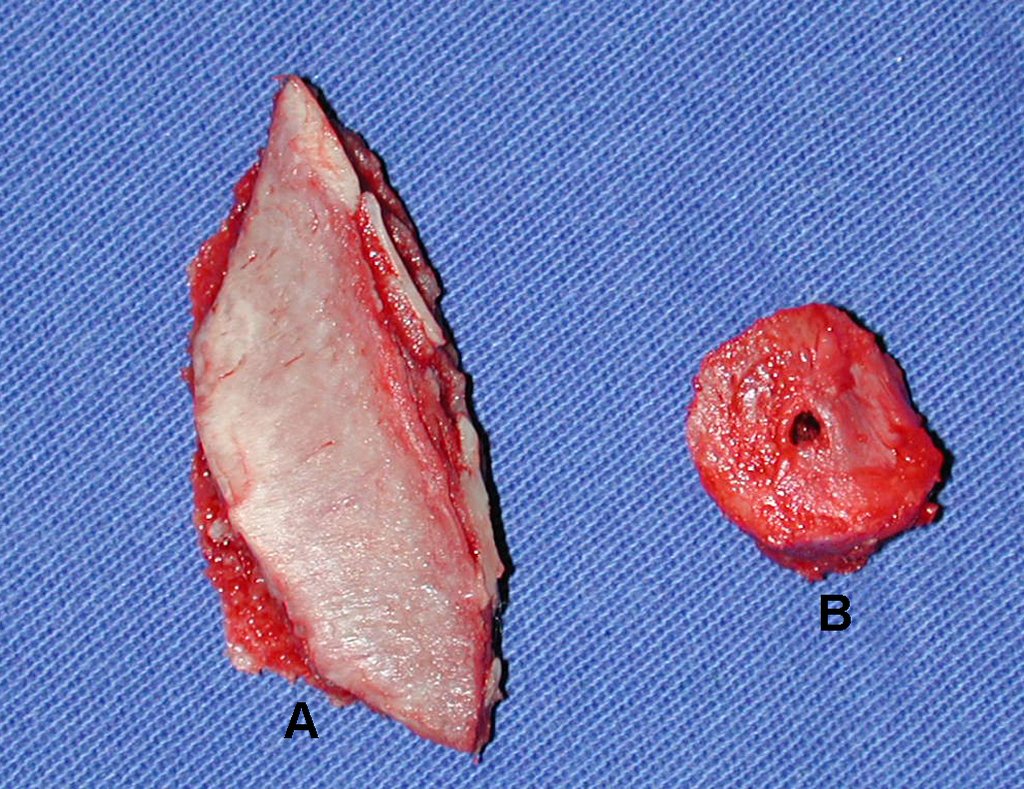
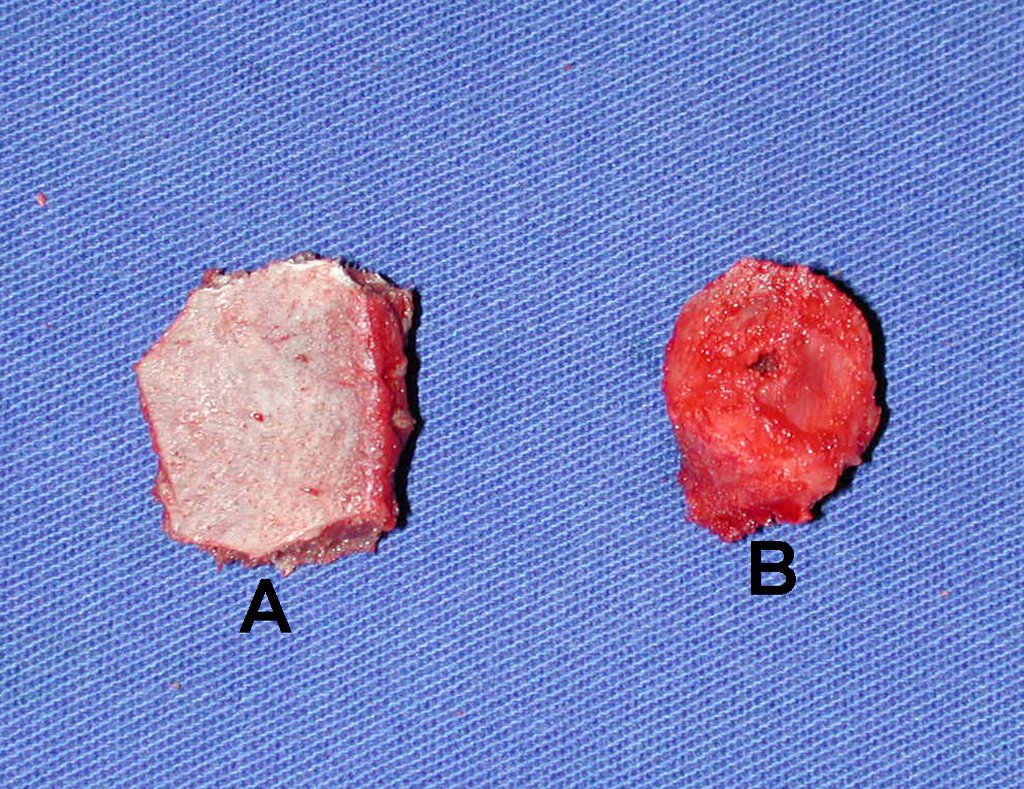
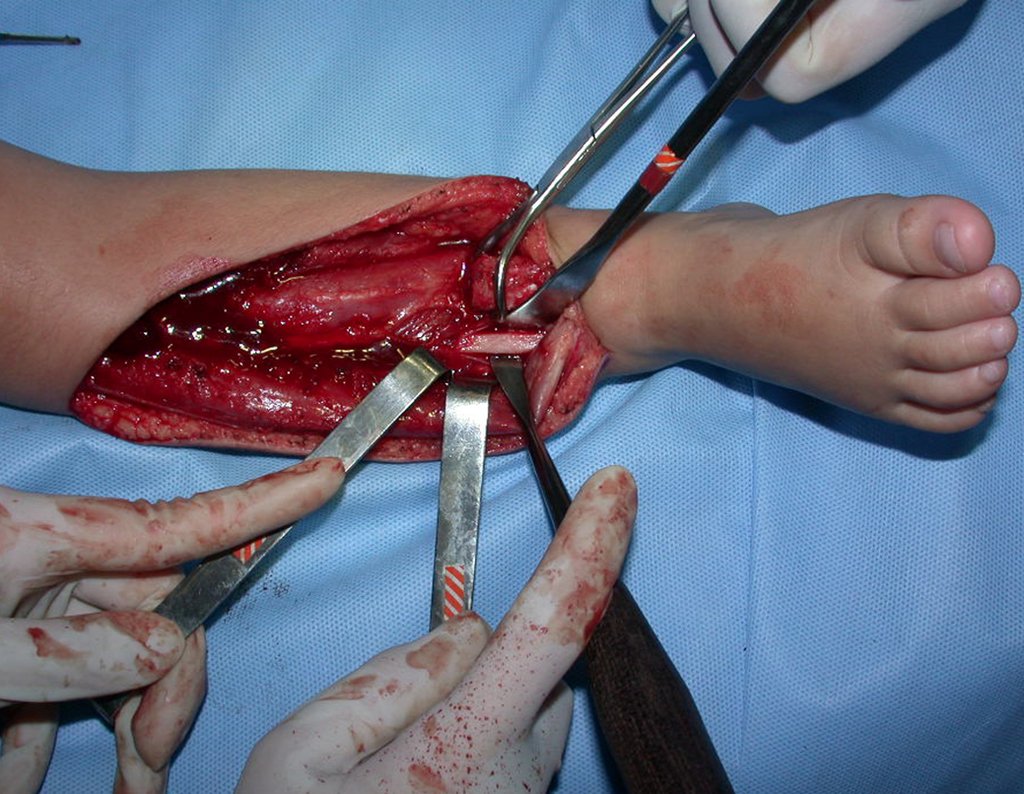
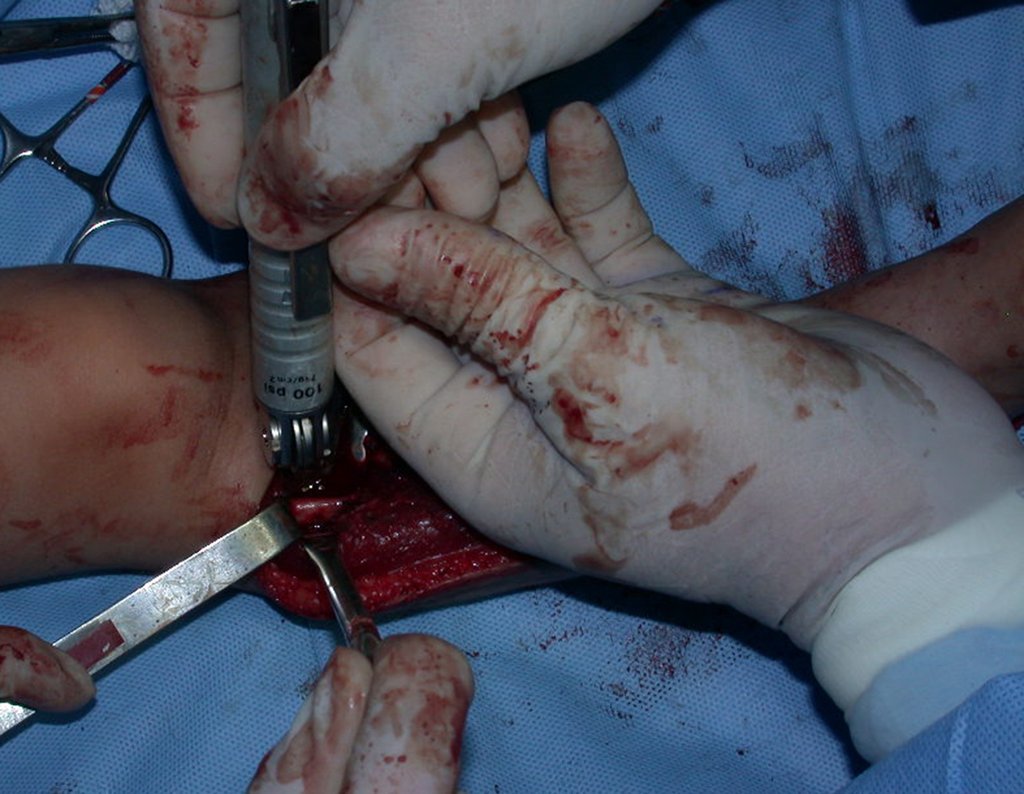
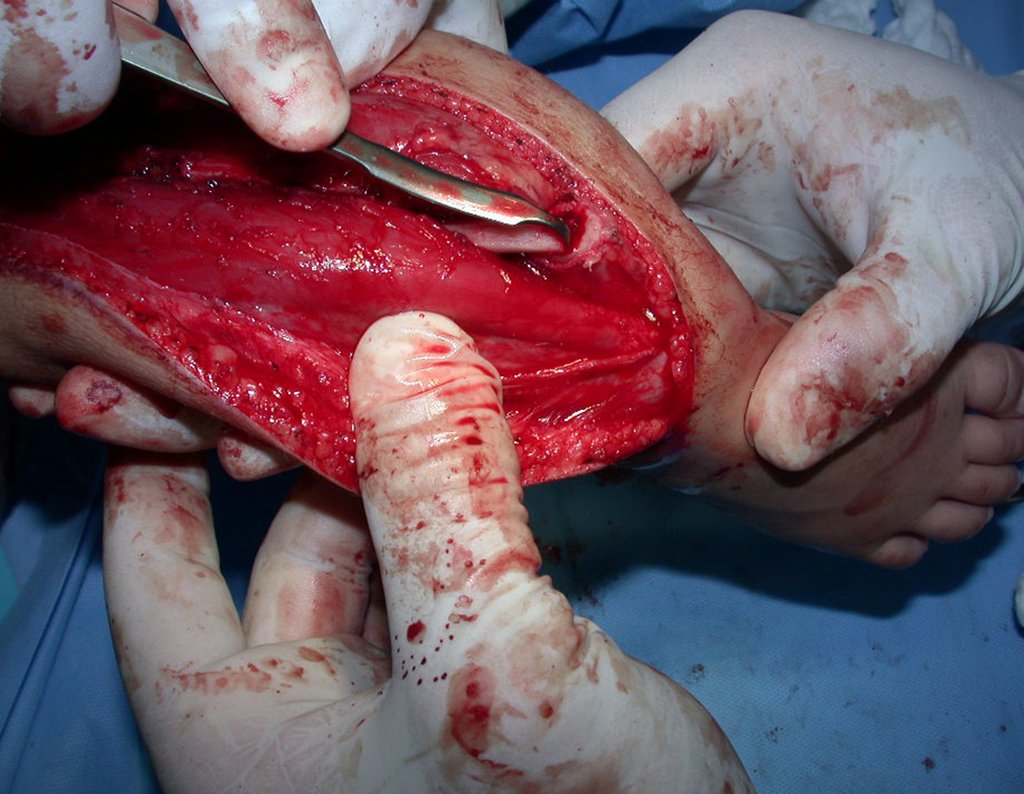
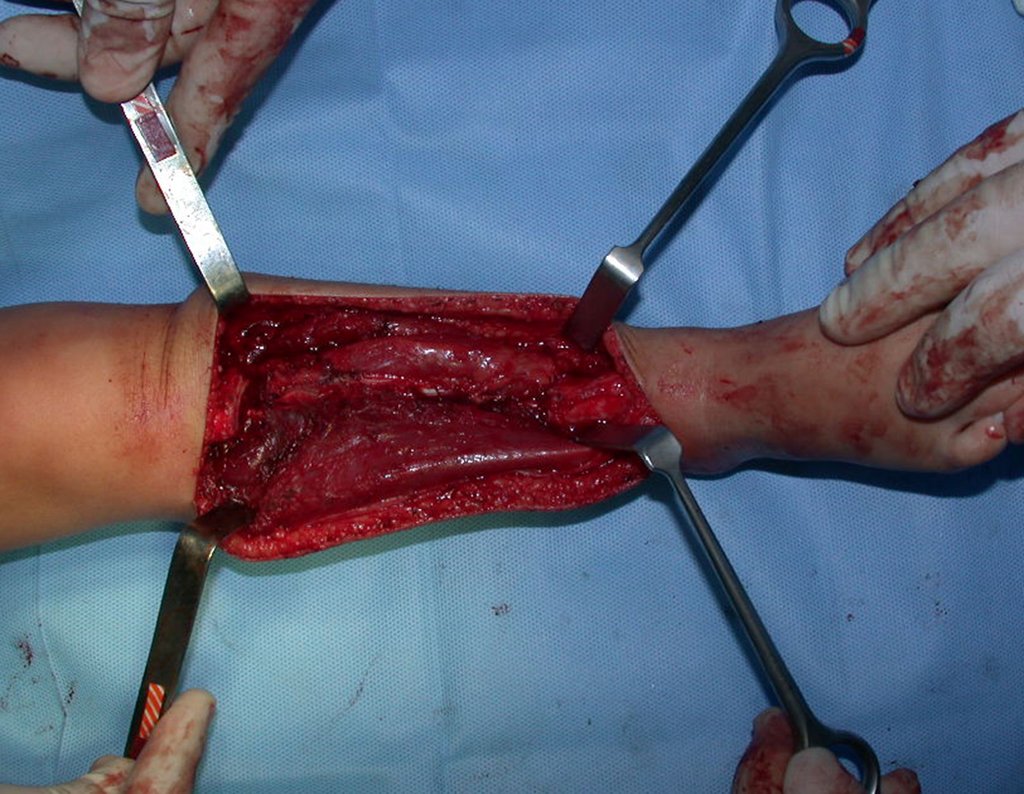
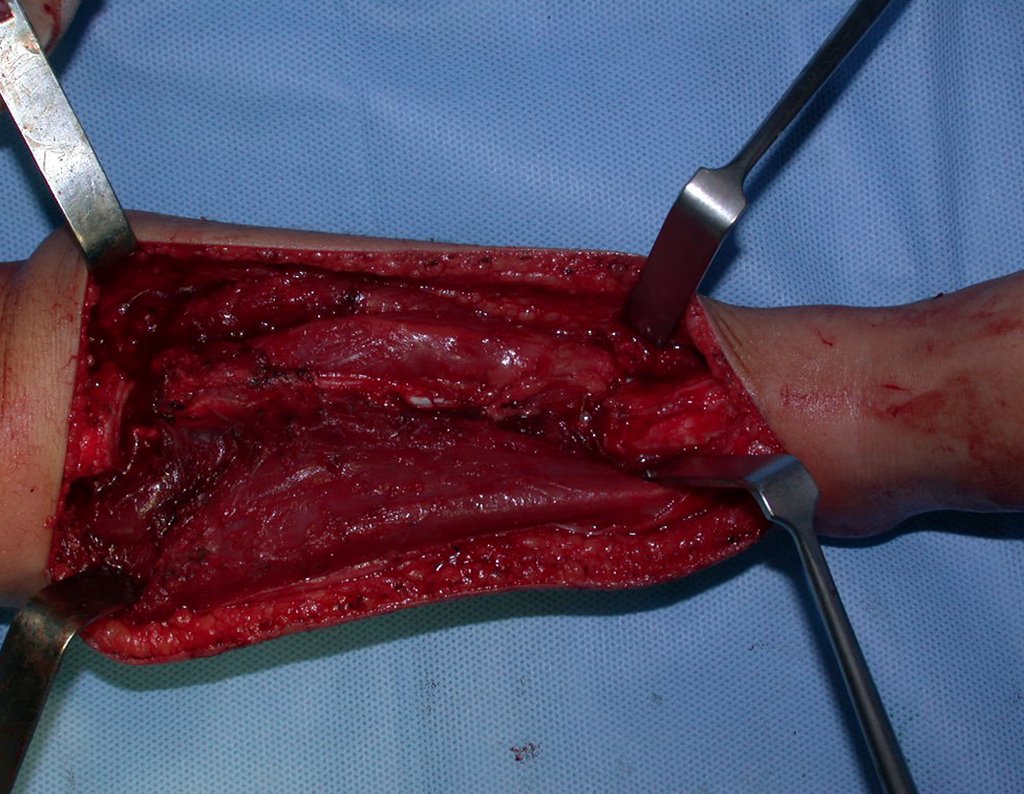
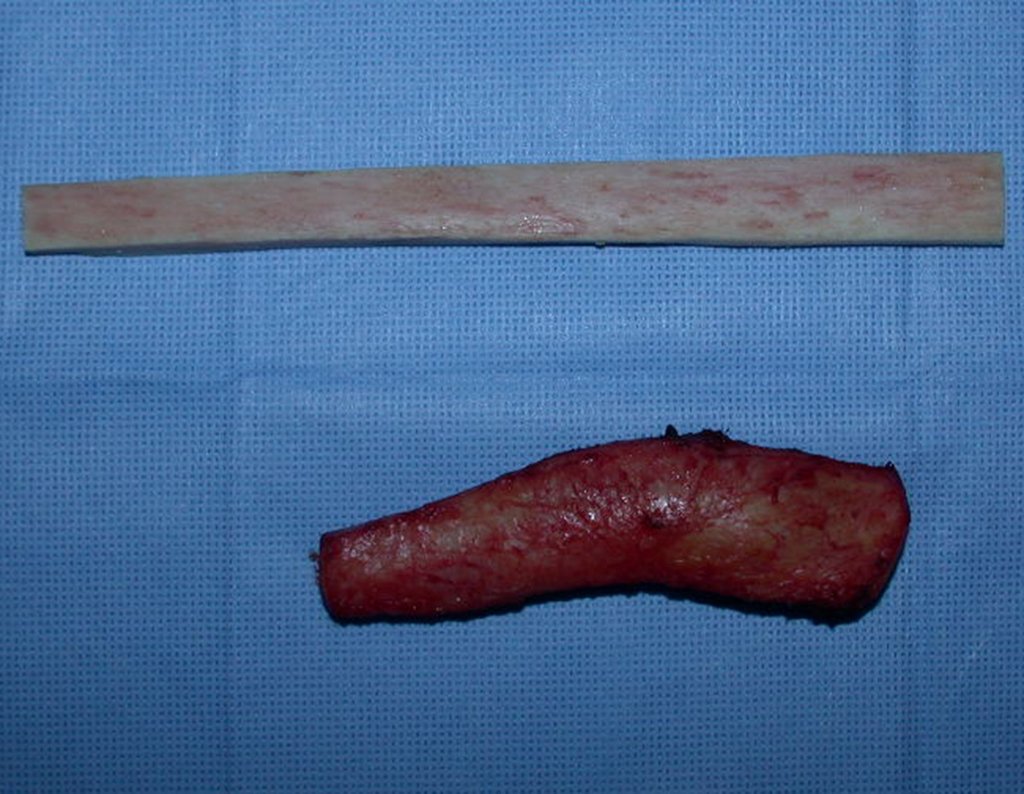
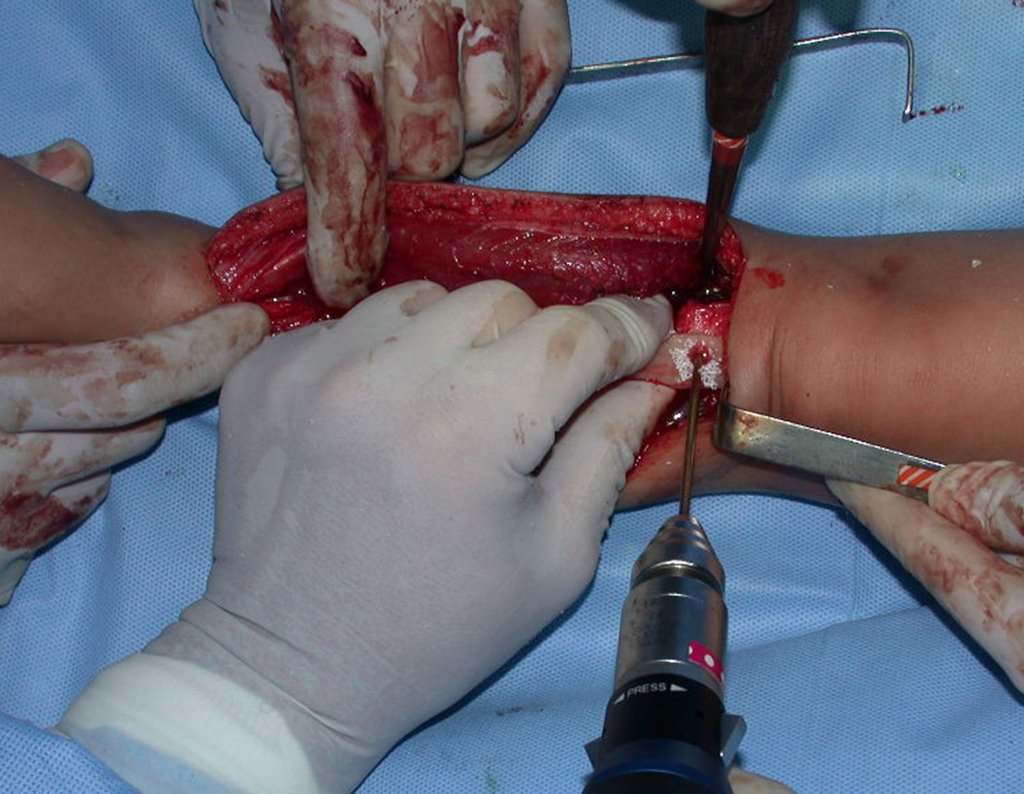
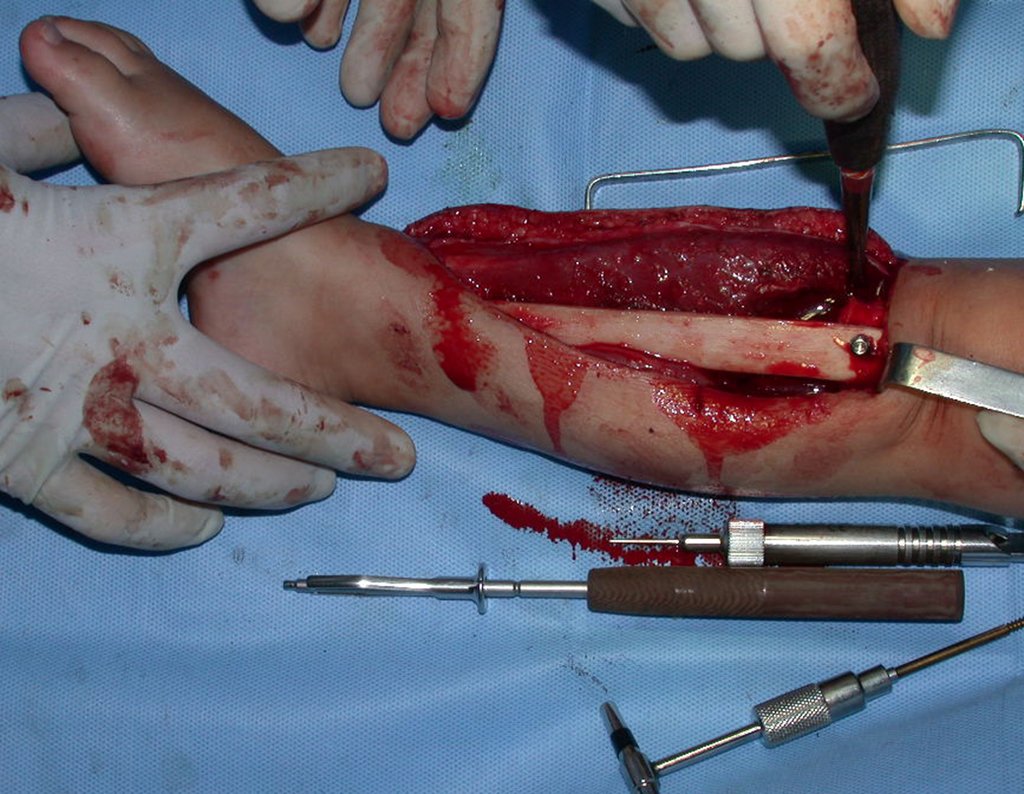
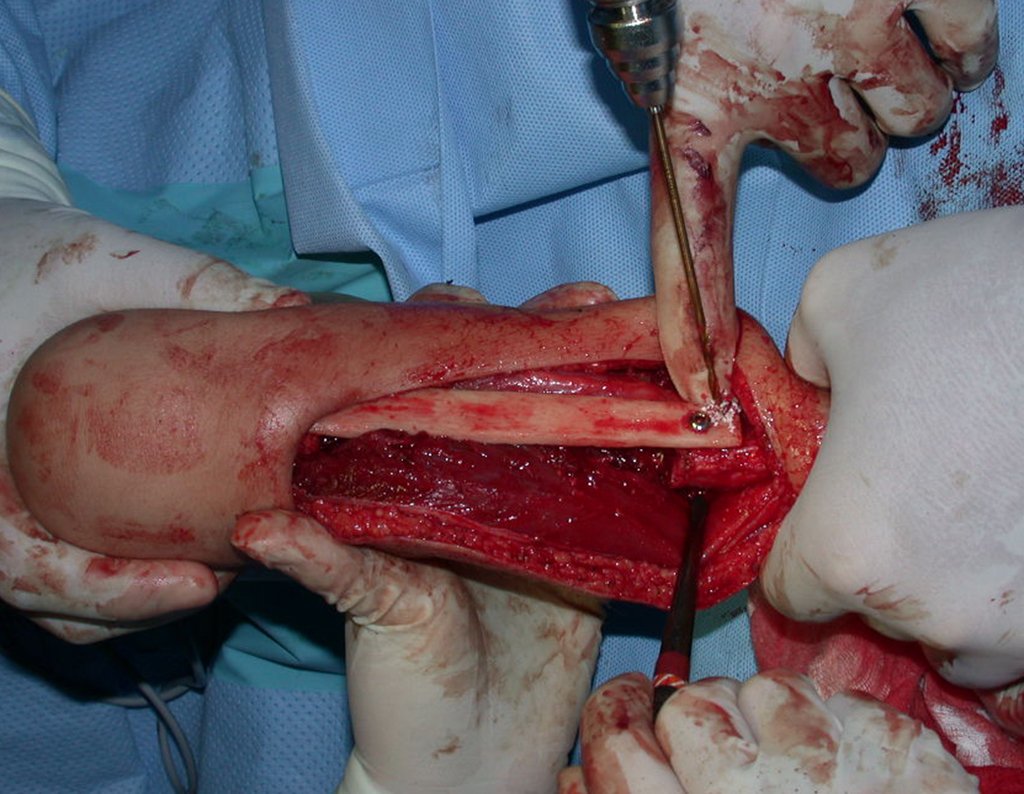
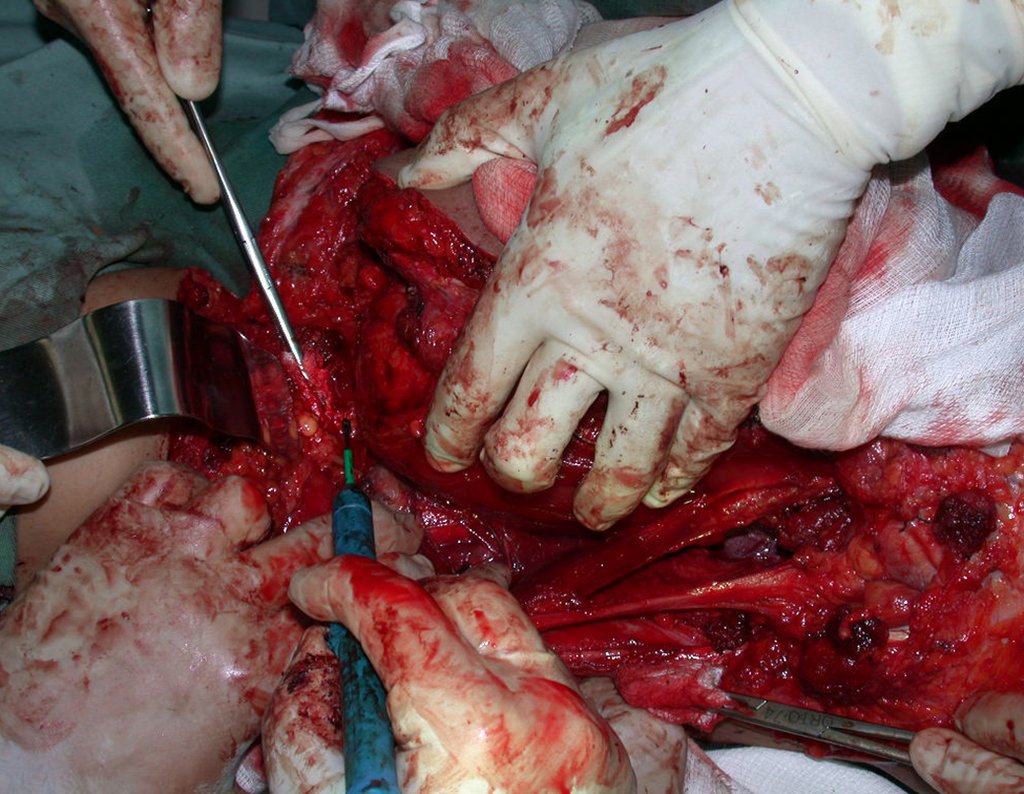
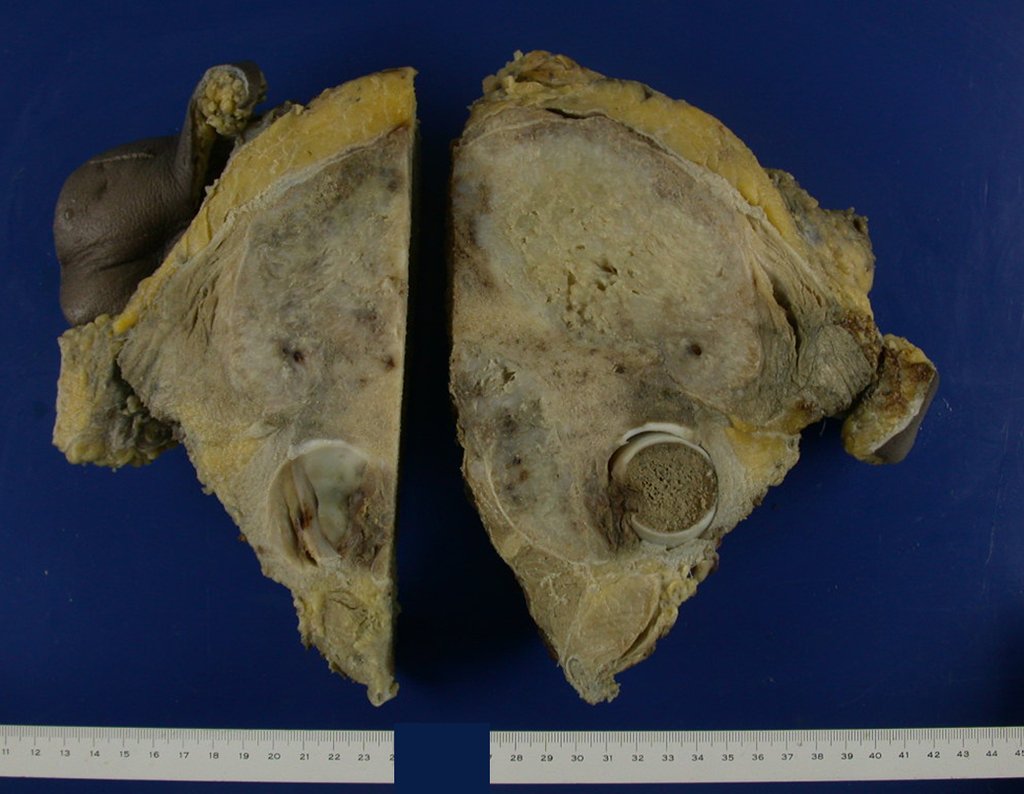
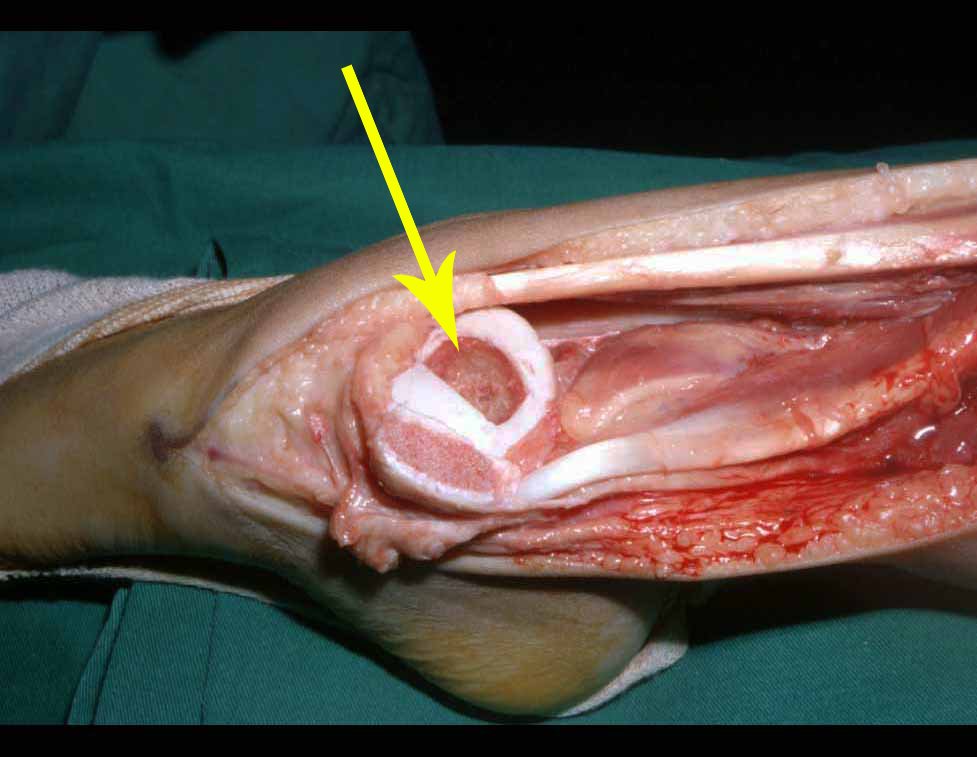
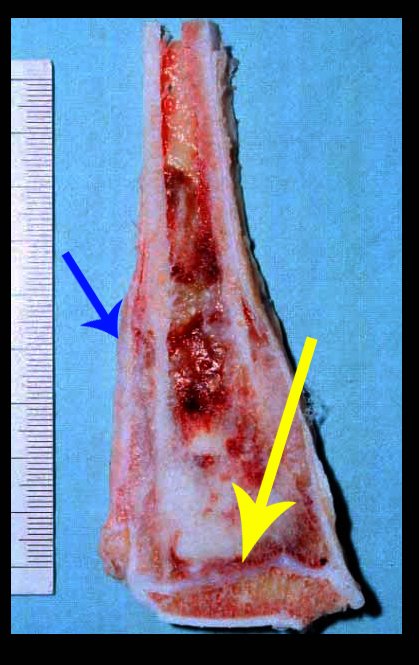
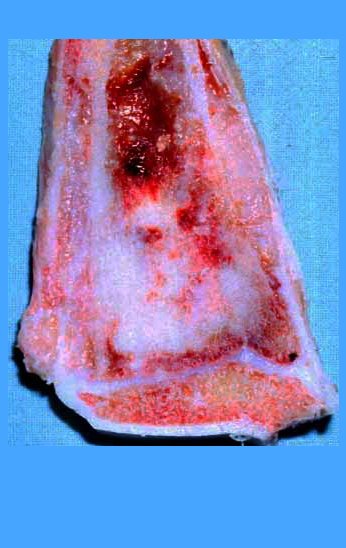
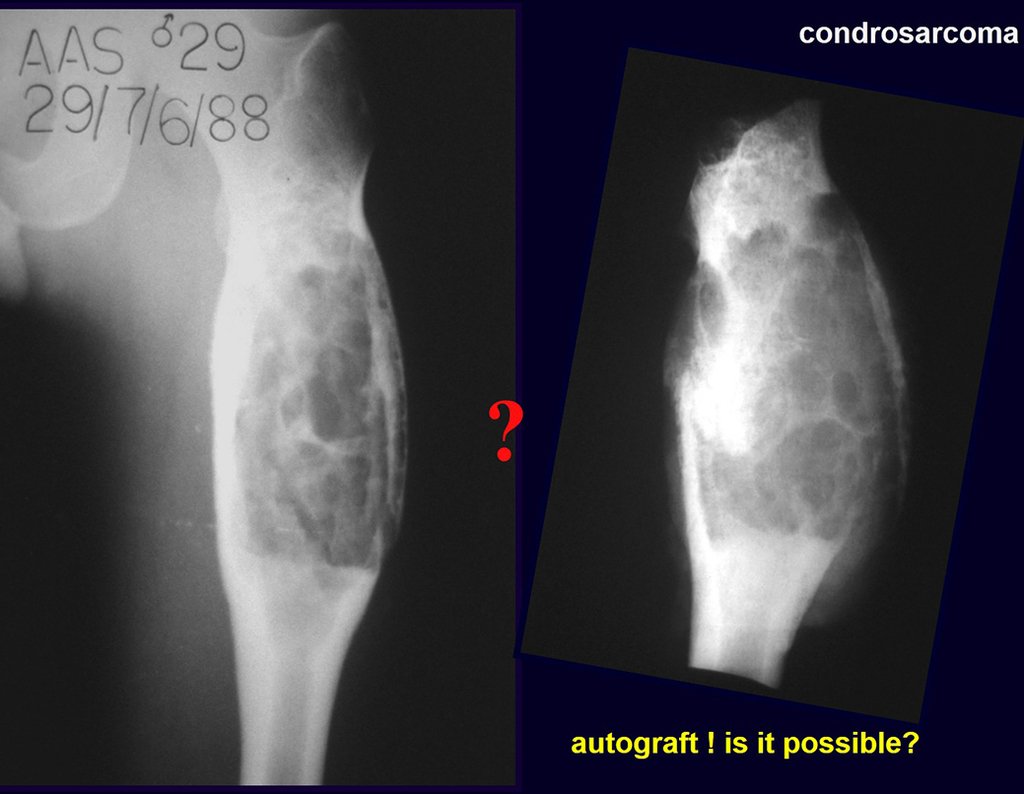
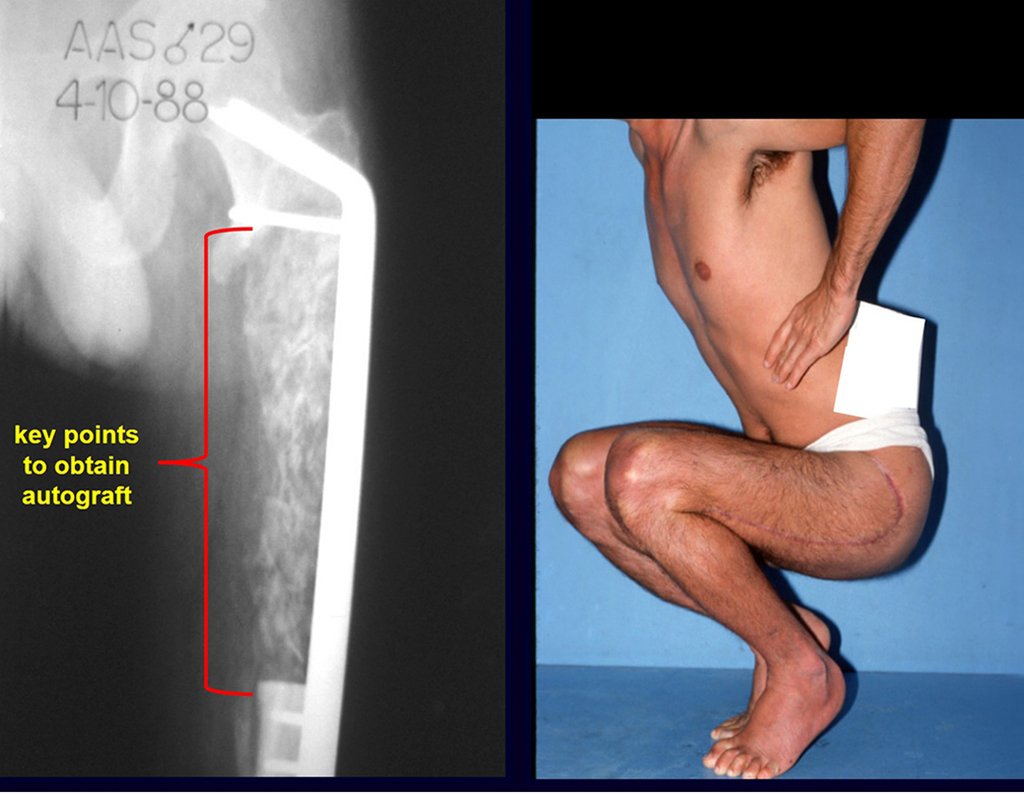
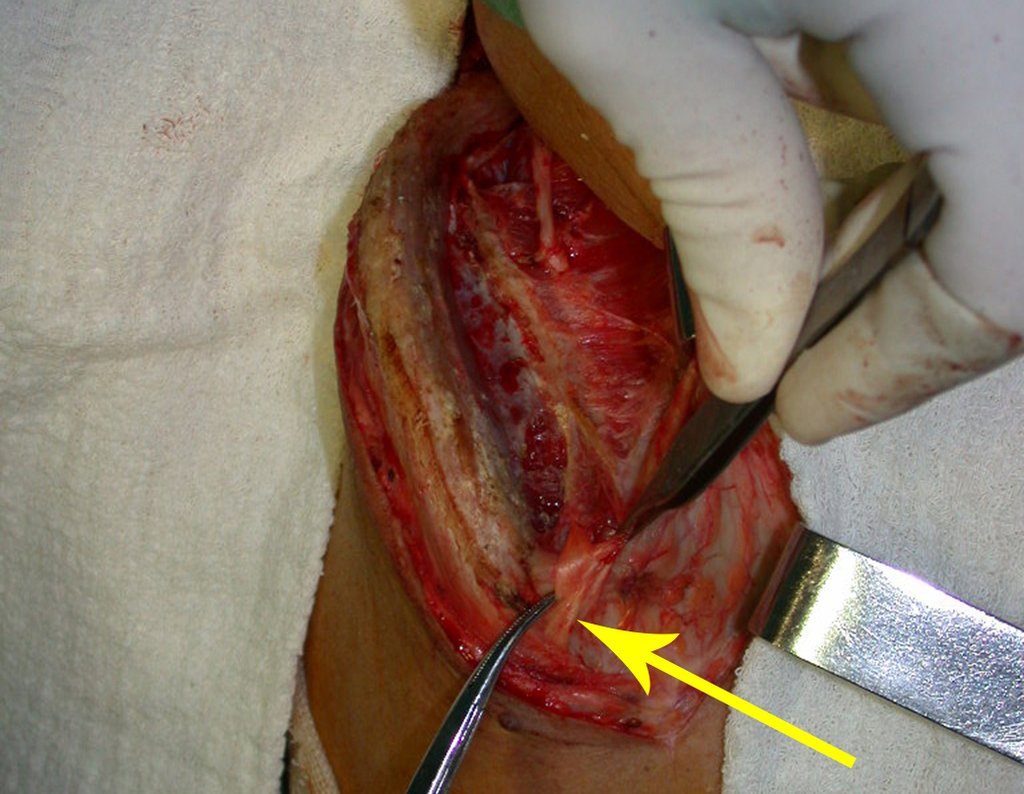
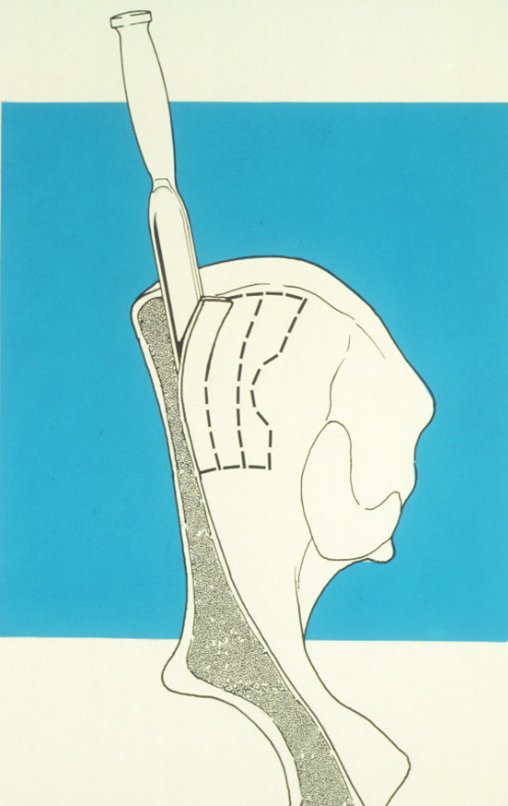
Pasamos para la segunda etapa: la obtención del injerto autólogo no vascularizado, obtenido del segmento proximal del peroné ipsilateral. Es preferible utilizar un injerto obtenido del mismo lado, pues la cara lateral del peroné y la tuberosidad de inserción del ligamento colateral lateral imitan mejor la cara dorsal del radio del mismo lado. De esta forma la pieza del peroné sustituirá a la estiloide radial.
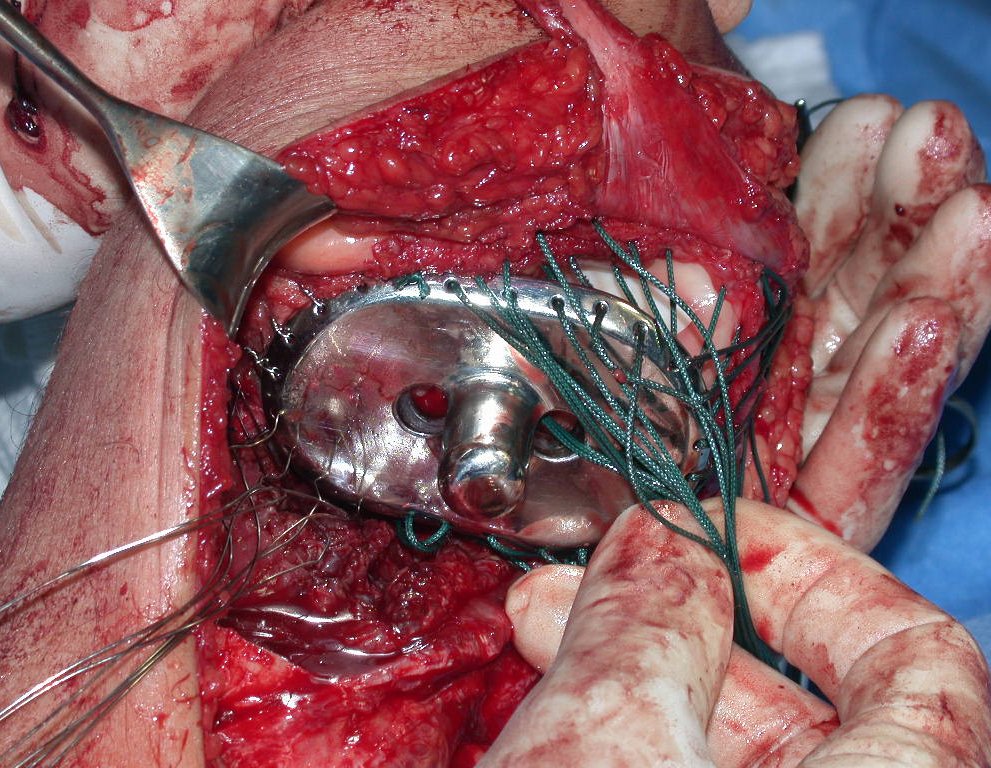
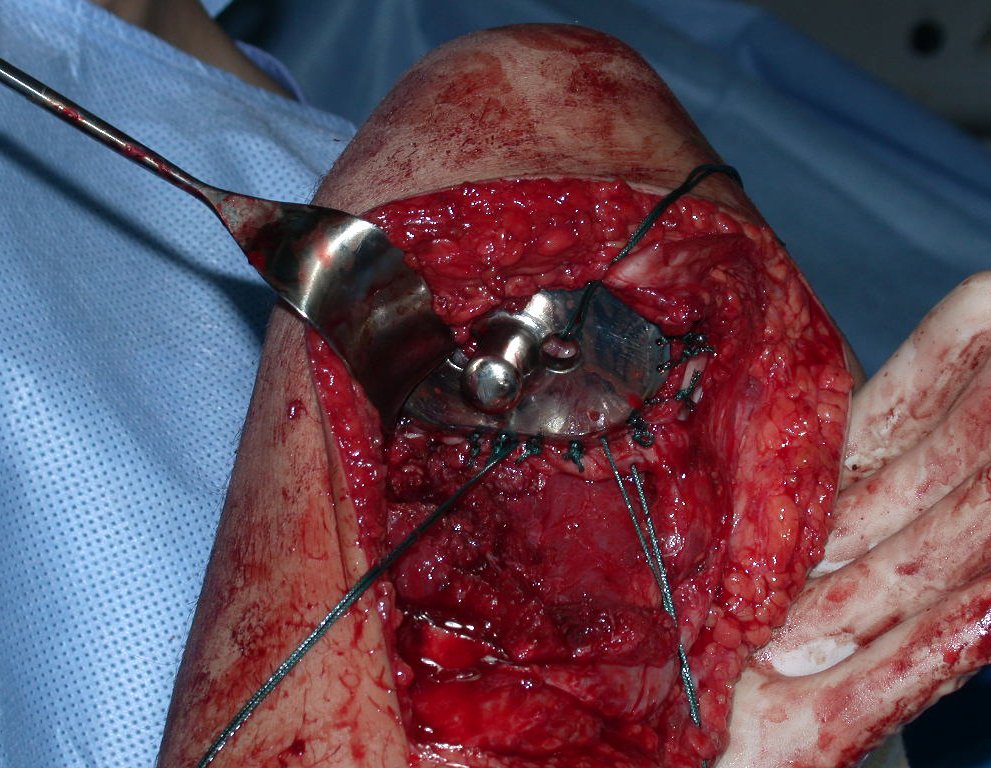
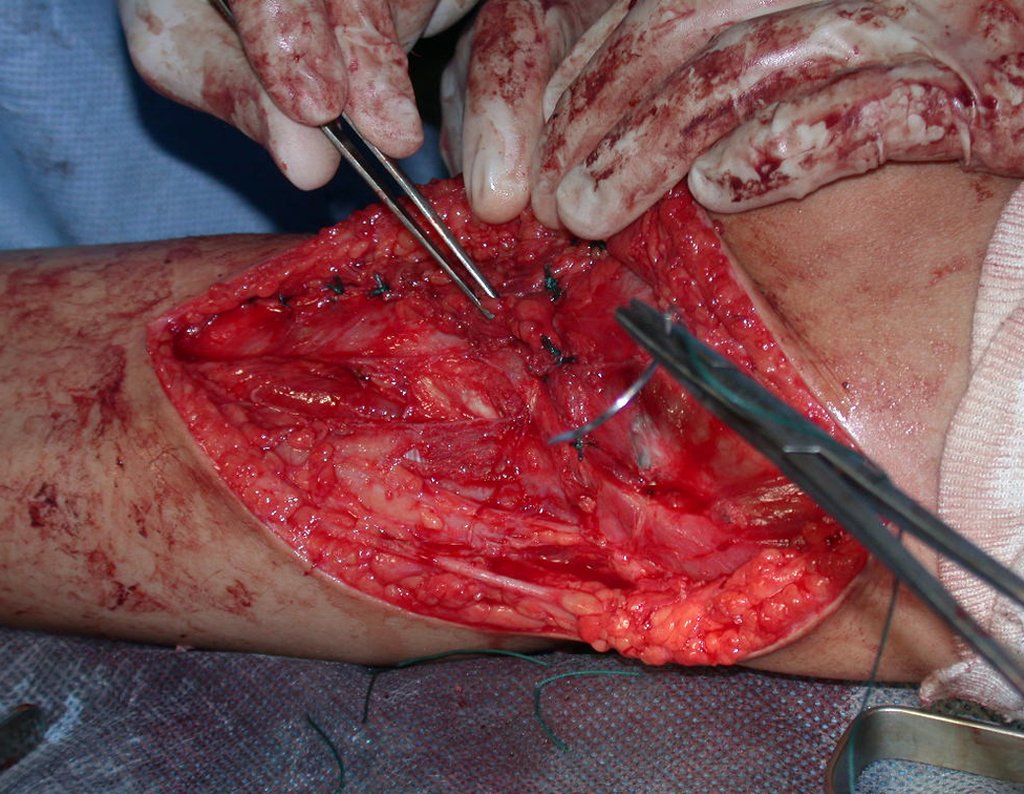
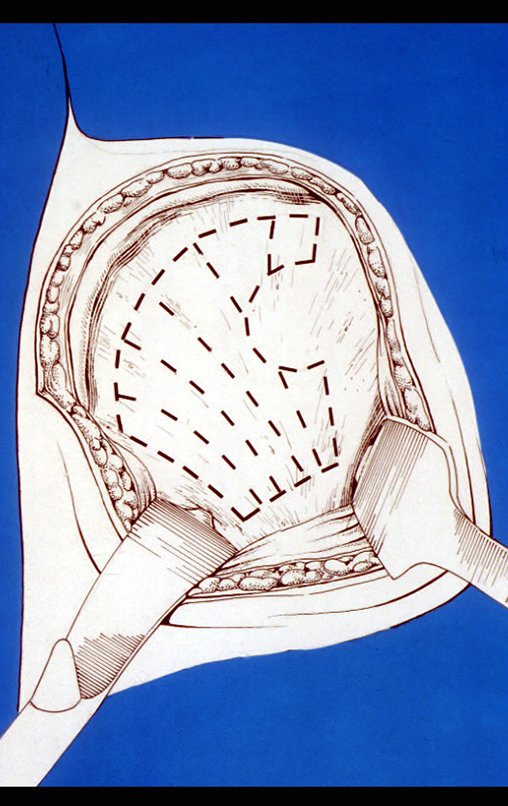
Es importante obtener este injerto con capsula articular de la articulación tibio-peroneal proximal en toda la circunferencia de la epífisis peroneal.
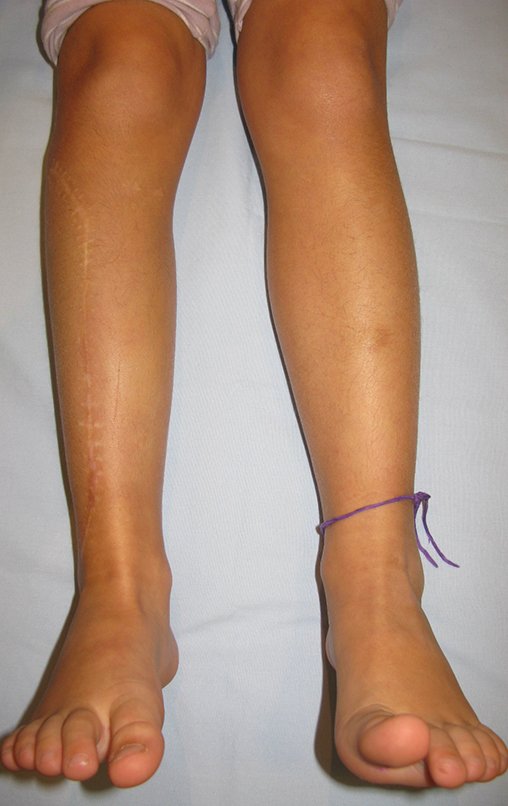
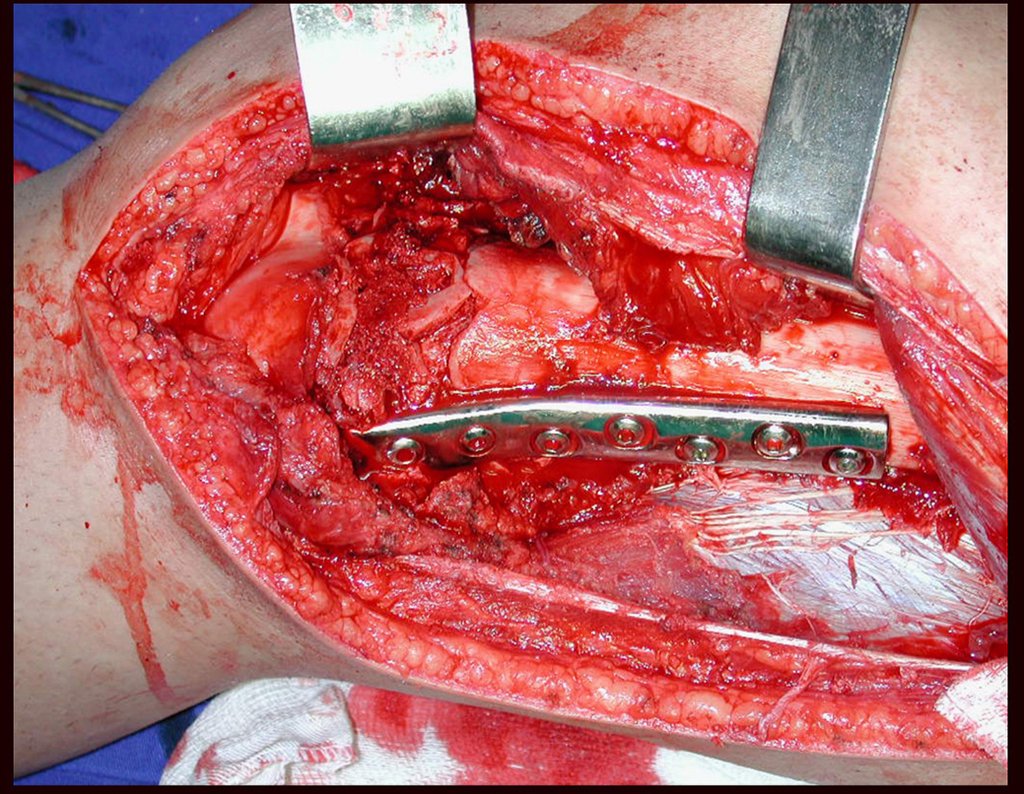
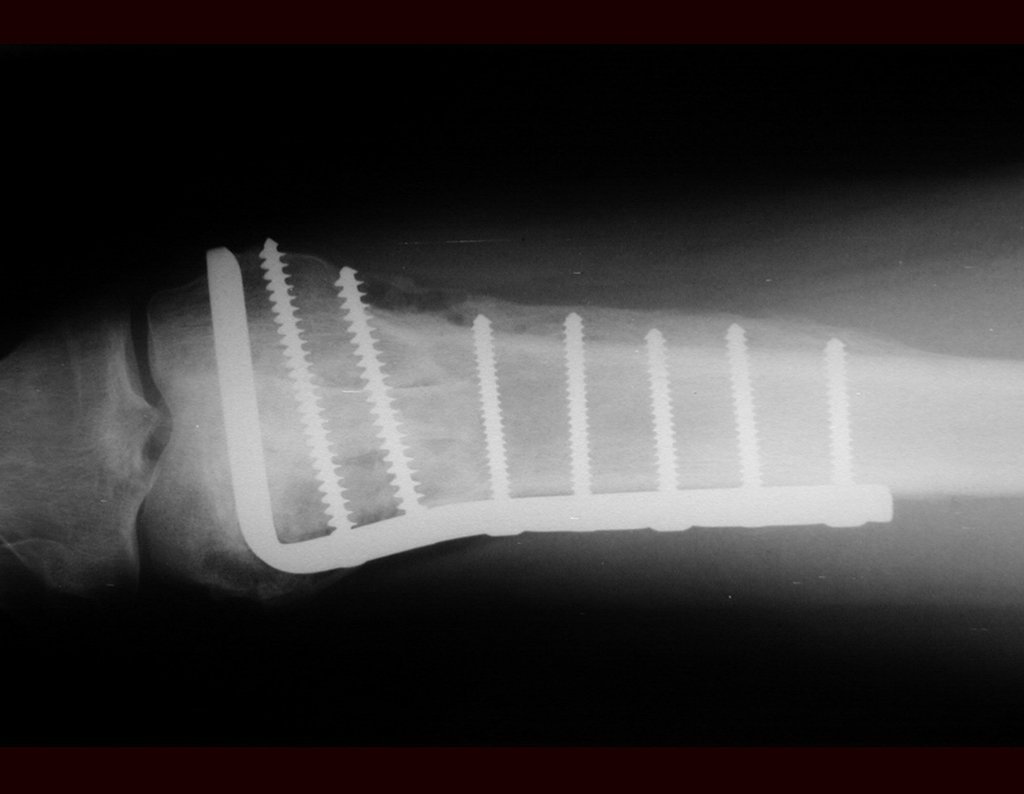
De esta manera tendremos tejidos blandos para la reconstrucción circunferencial de la nueva articulación peroneo-carpal. A continuación detallamos la obtención del injerto del peroné (Figuras 58 à 75).


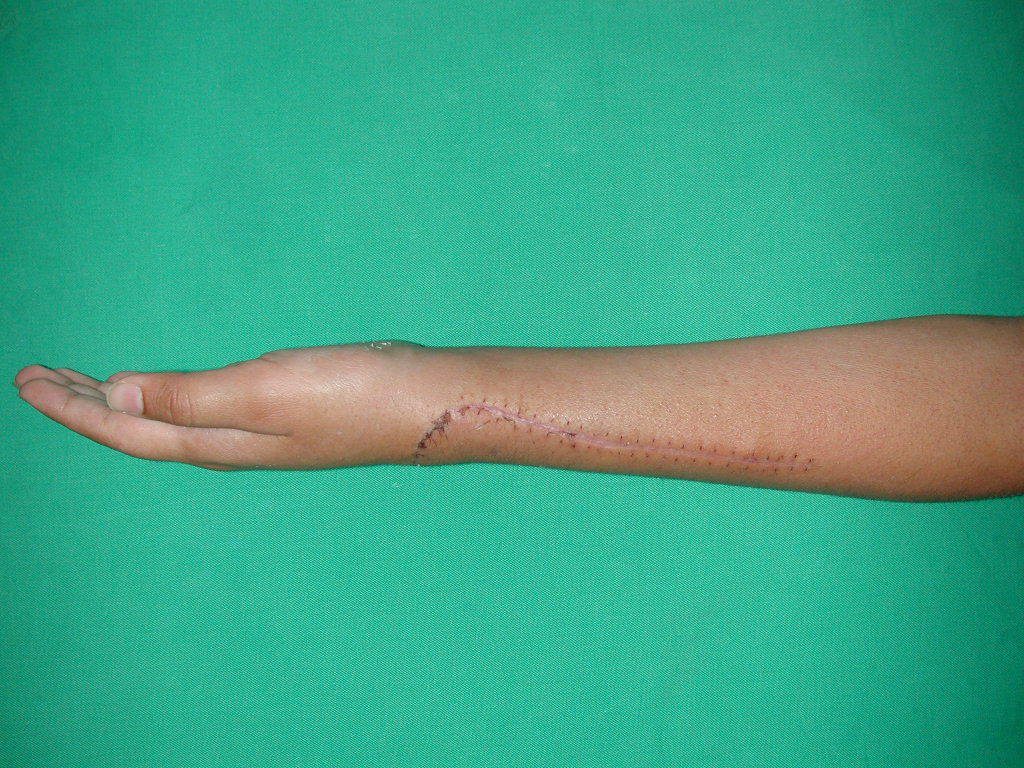
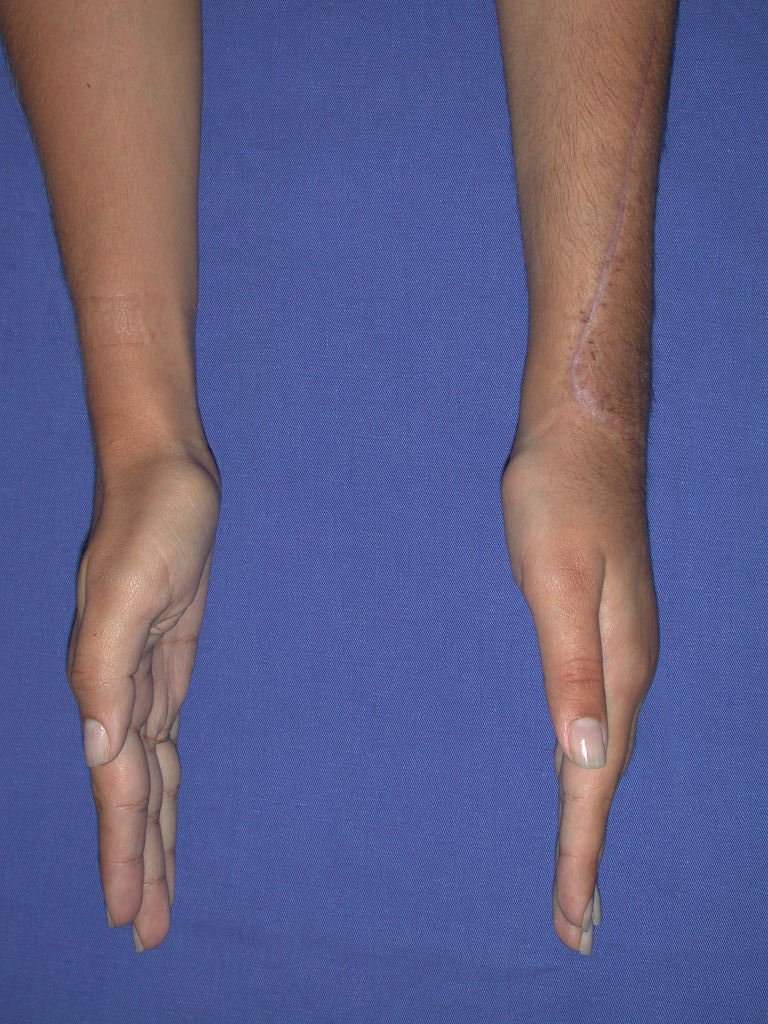
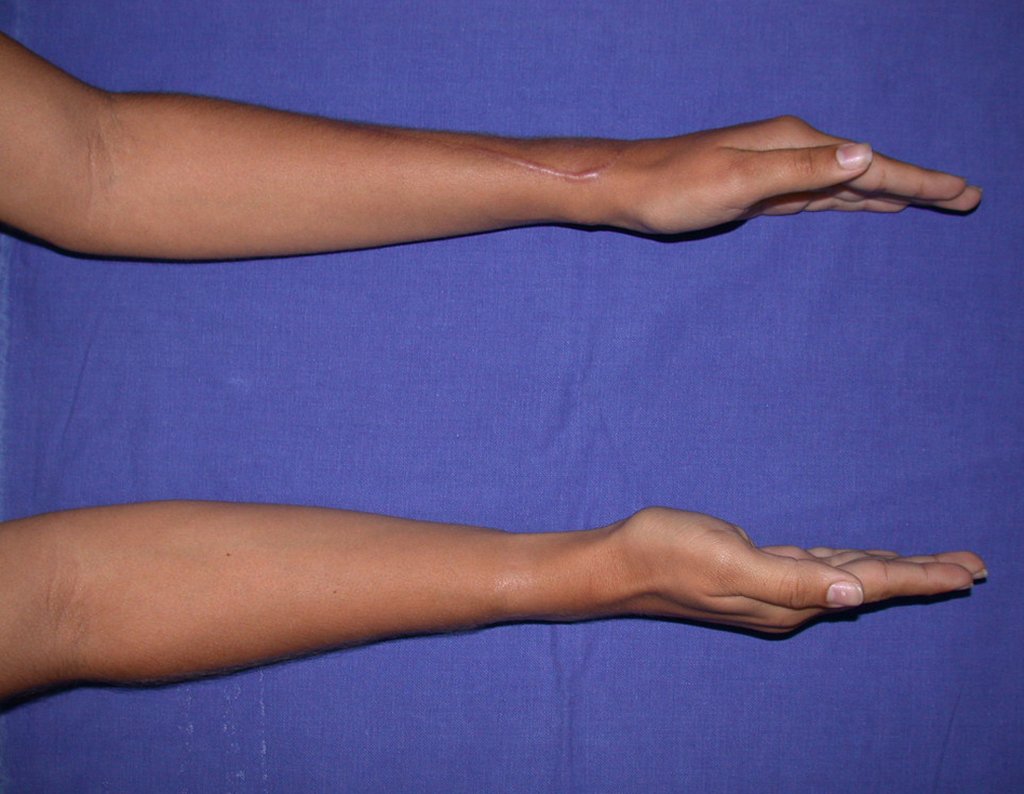
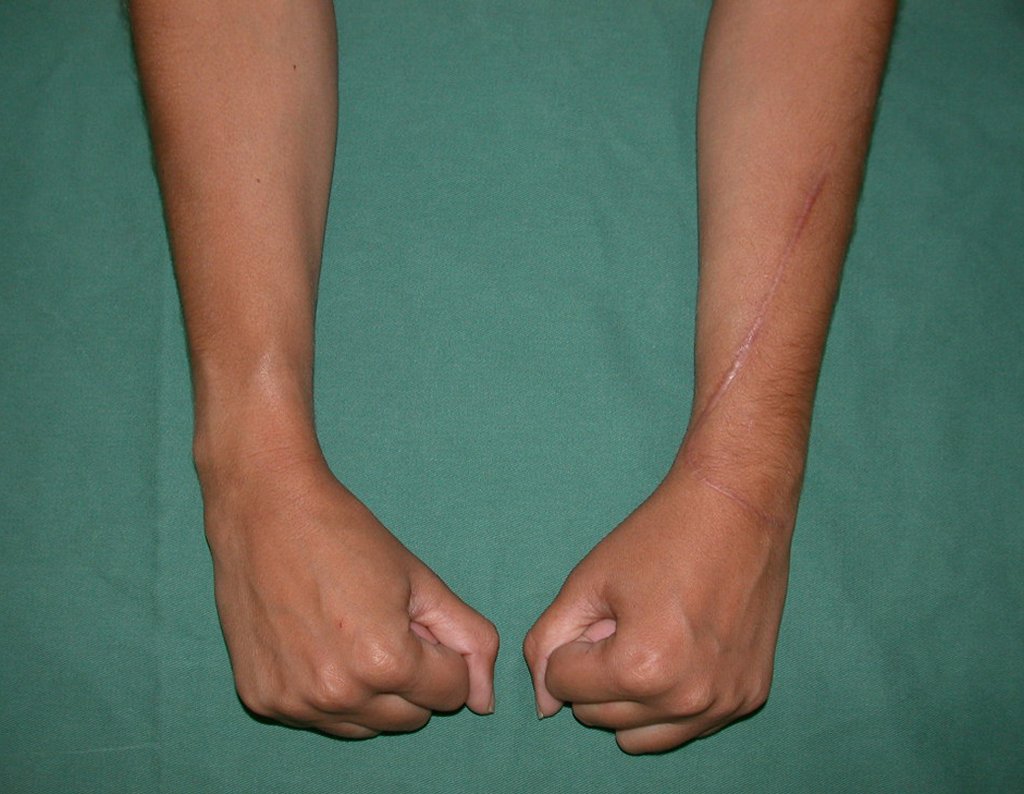
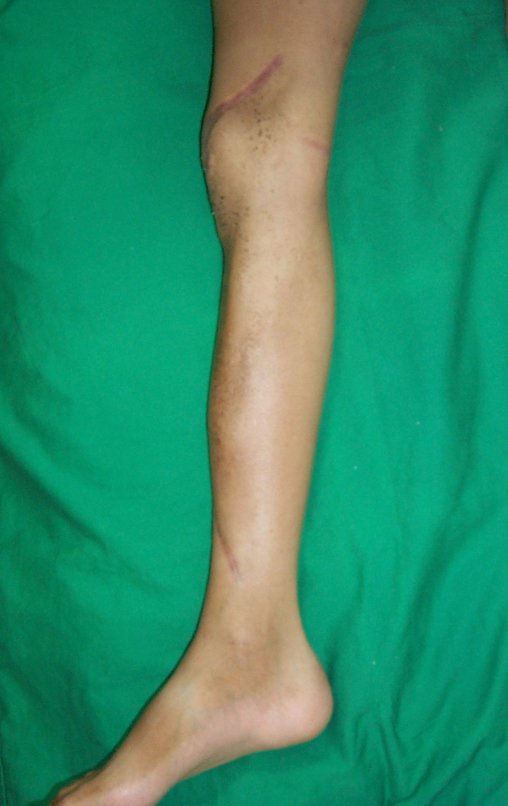
Vídeo 1: Supinação e pronação ativa e simétrica dos punhos, seis meses após a cirurgia. Boa função.
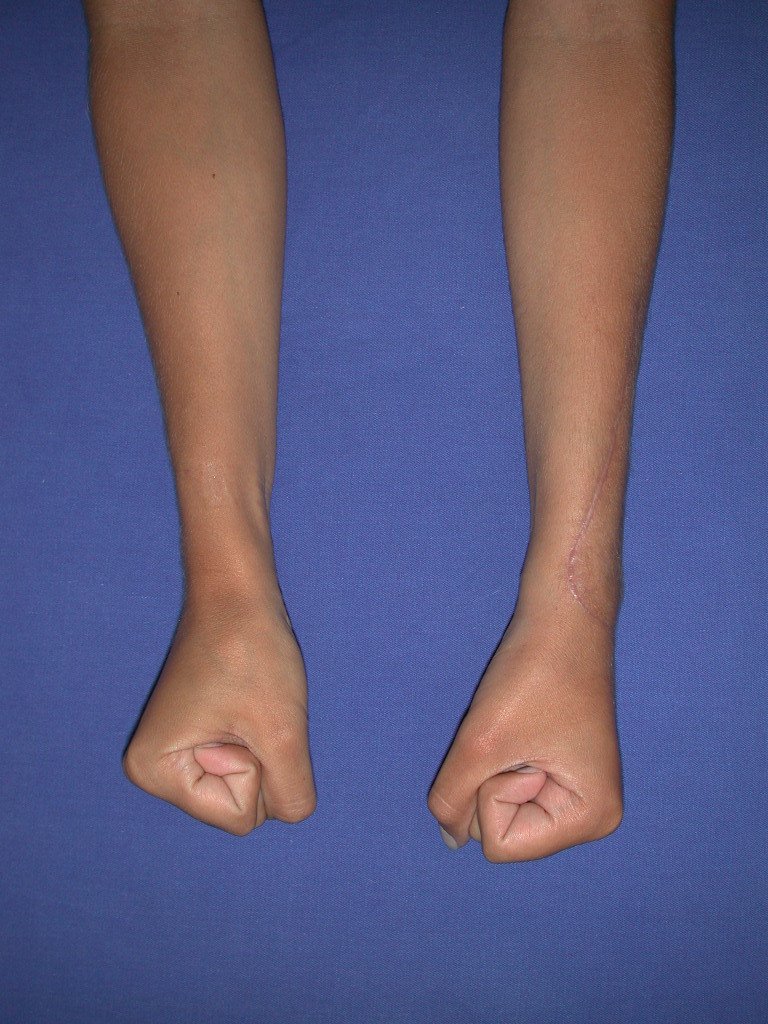
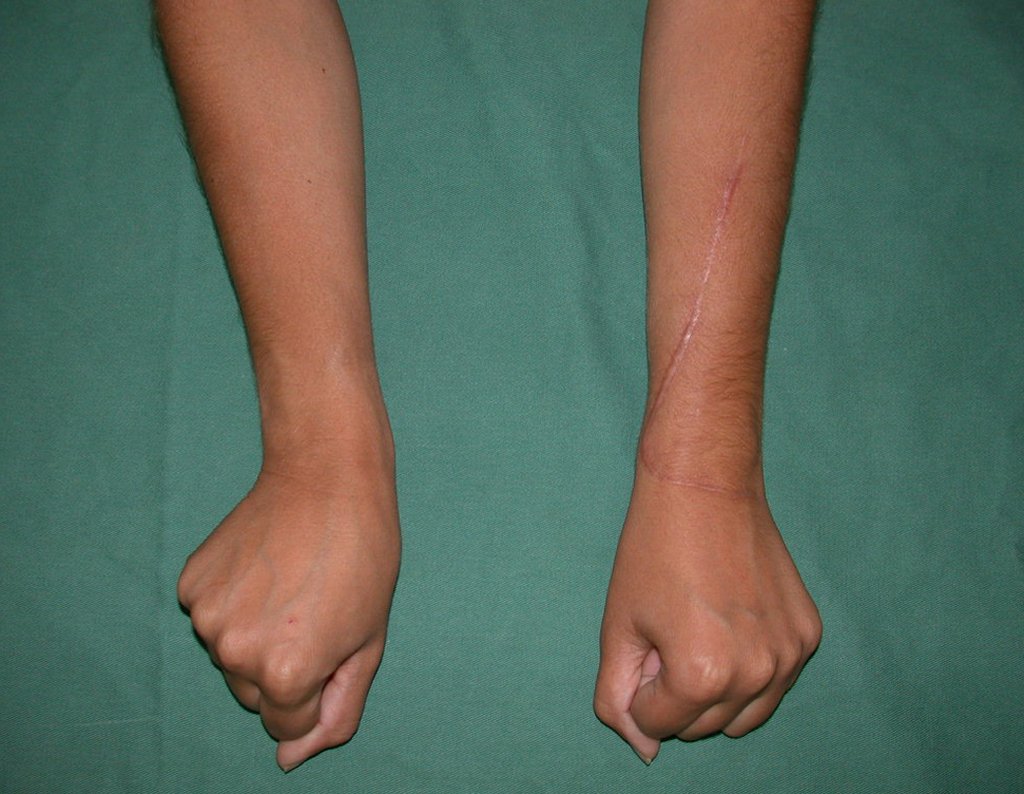
Vídeo 2: Flexão e extensão ativa e simétrica dos dedos, após seis meses. Boa função.
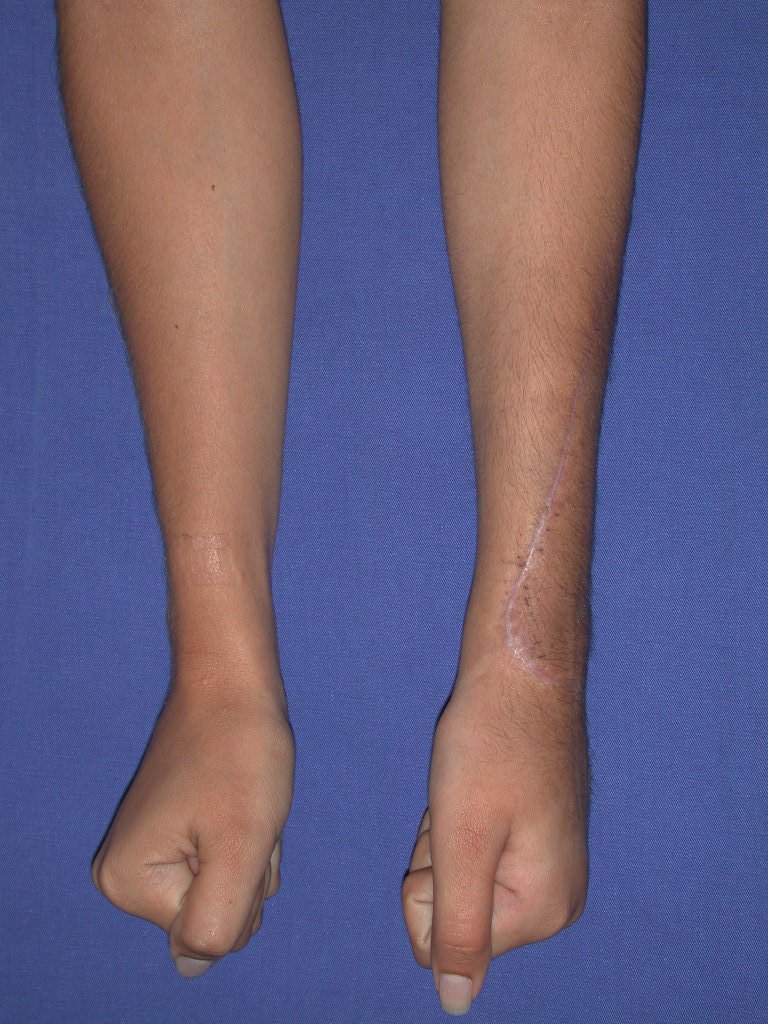
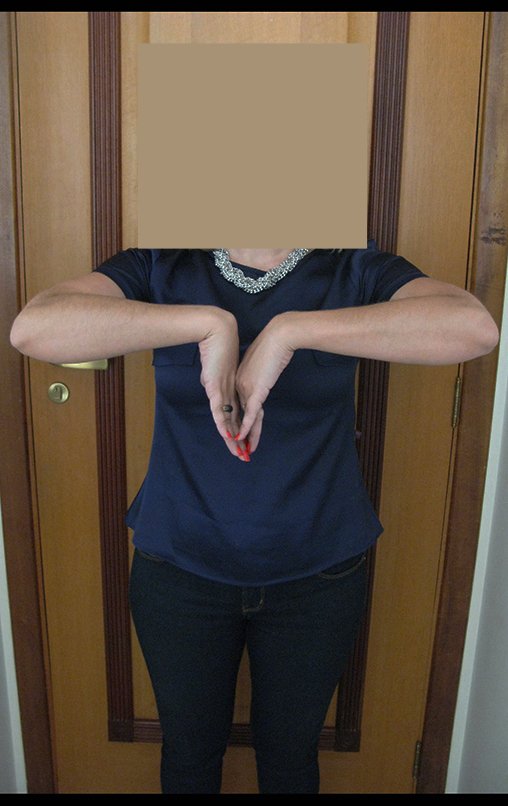
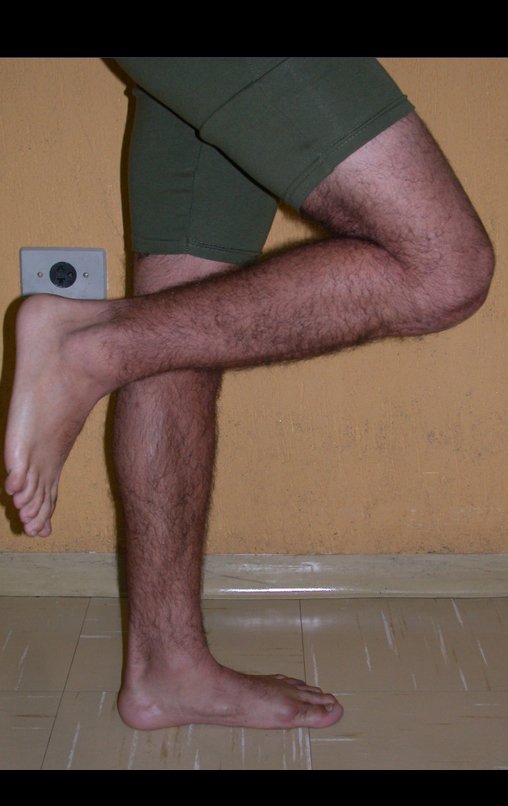
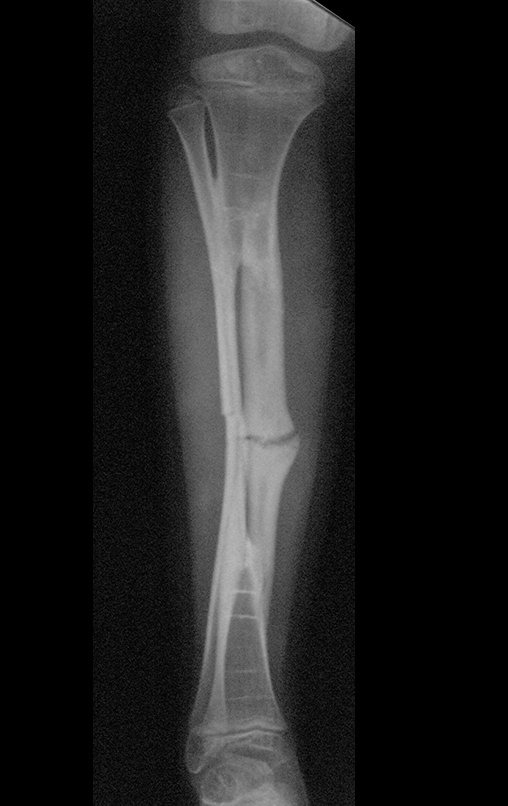
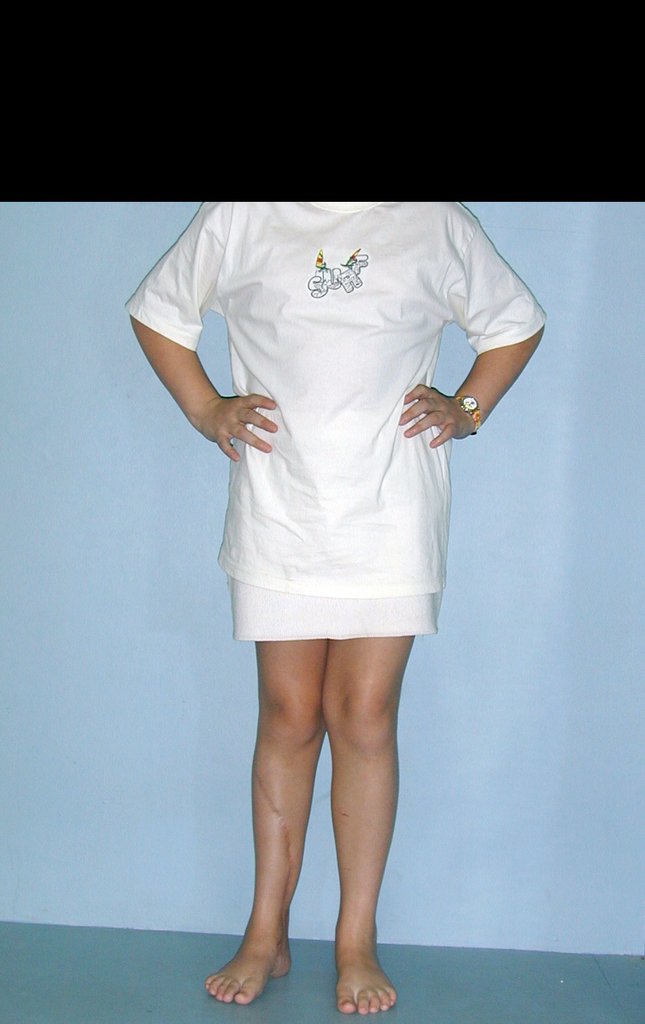
Vídeo 3: Pronação e supinação simétrica, após quinze anos da cirurgia.
Vídeo 4: Flexão e extensão em 29 de setembro de 2015, após quinze anos de pós-operatório.
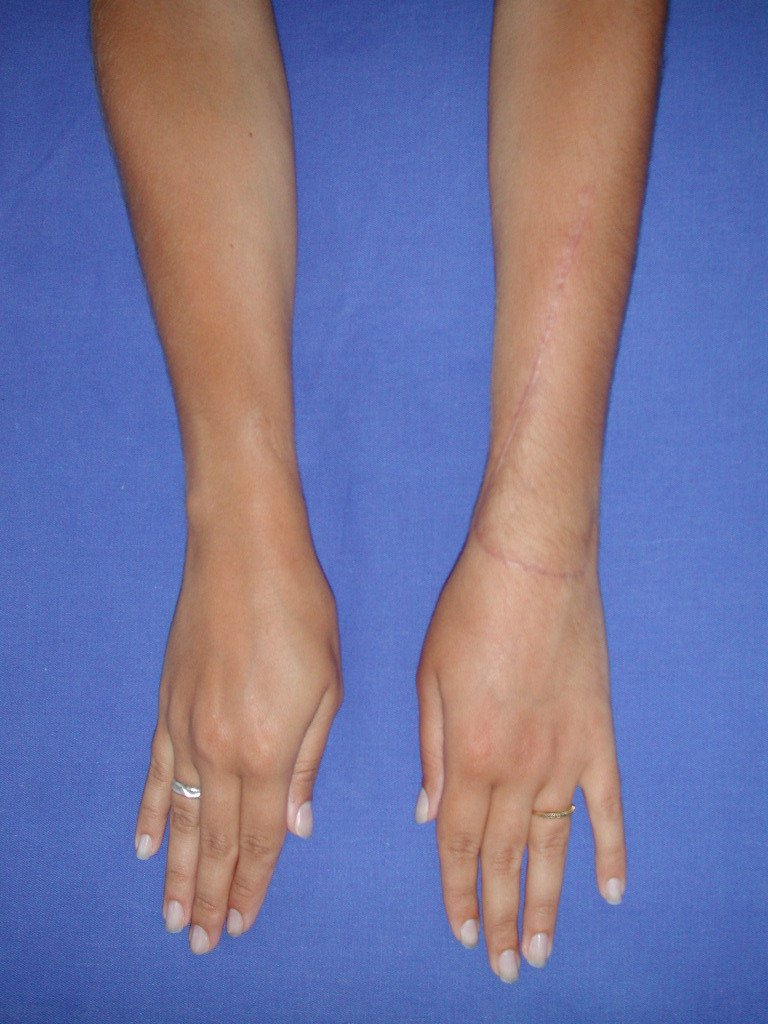
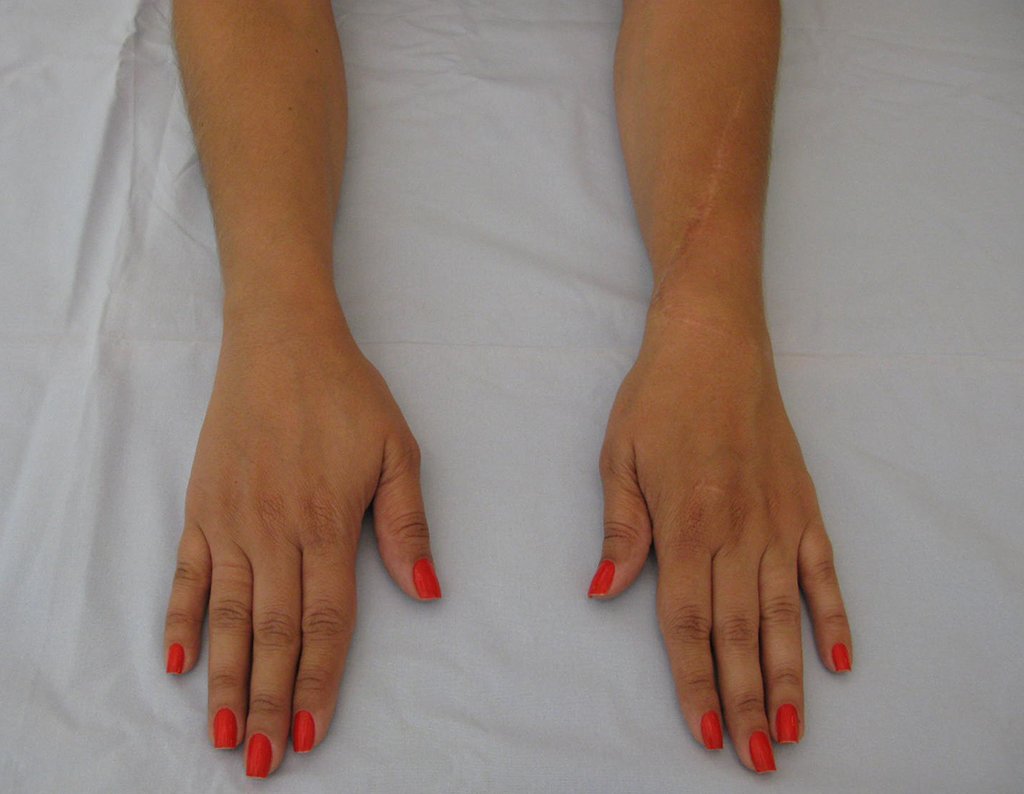
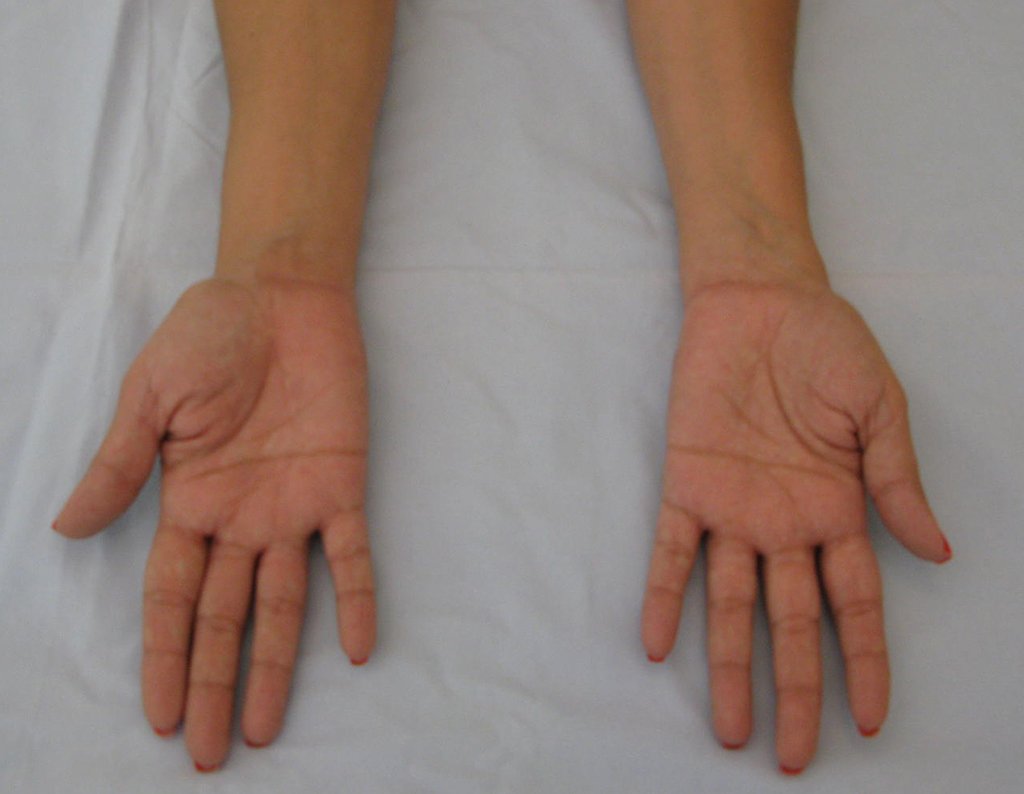
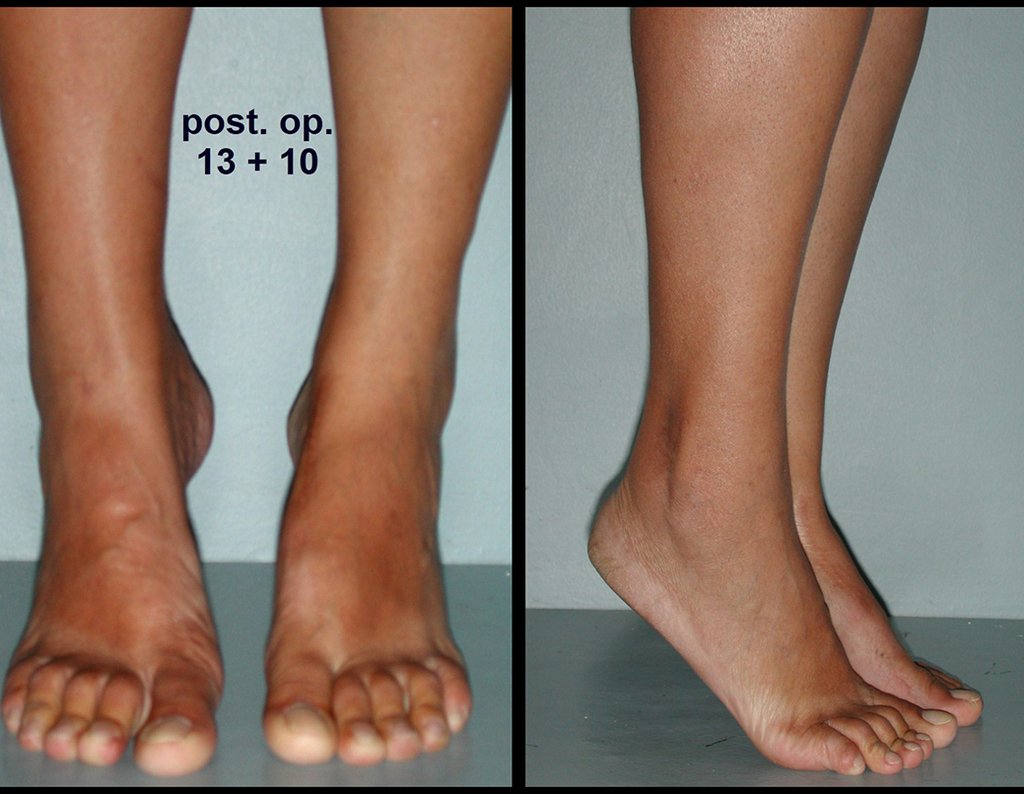
Vídeo 5: Atitude indiferente e espontânea dos punhos. Boa simetria e função em 29/15/2015. Pós-operatório de quinze anos.
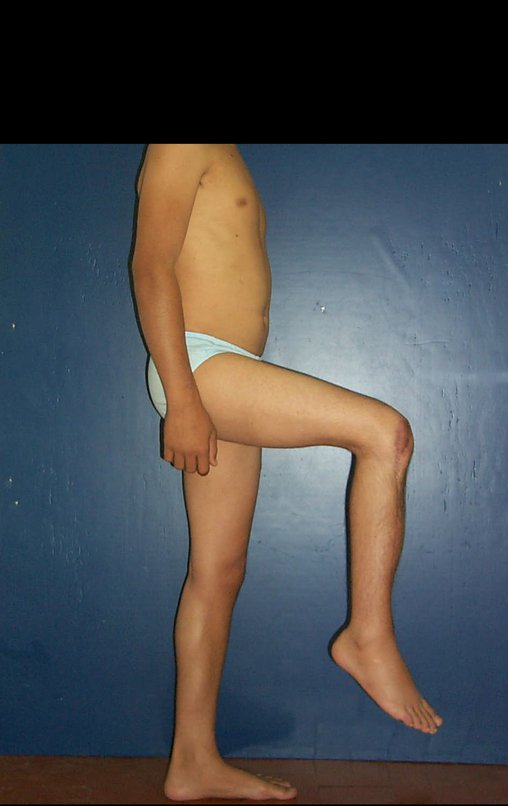
Vídeo 6: Boa força muscular e estabilidade do punho esquerdo, levantando significativo peso após 19 anos de cirurgia, em 22 de agosto de 2019.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com