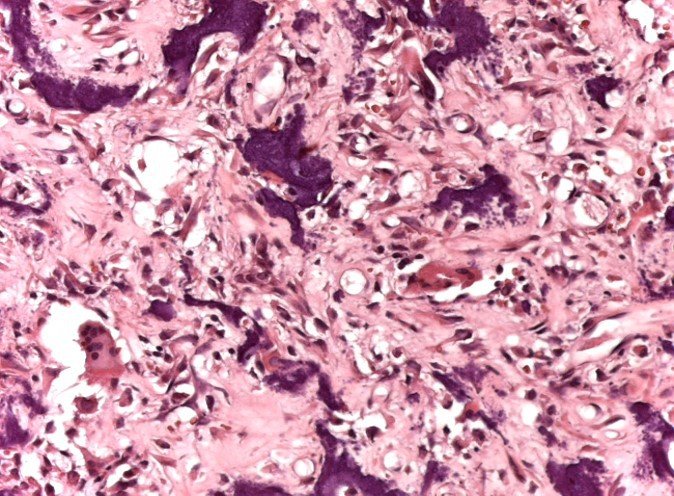
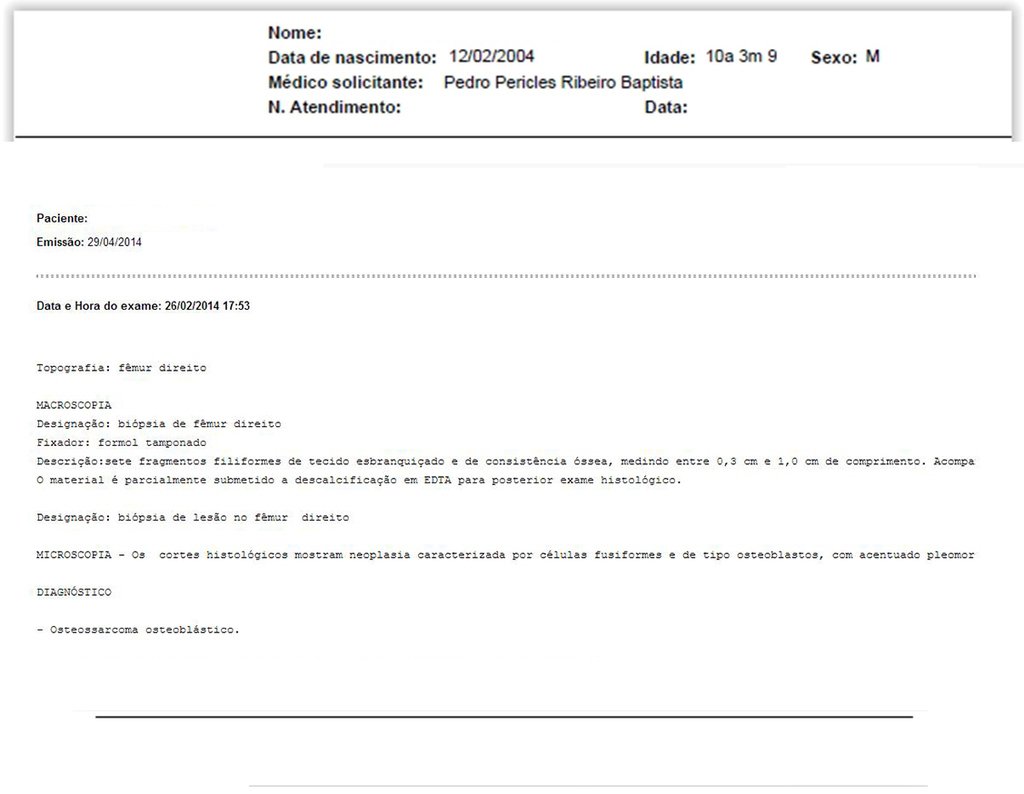
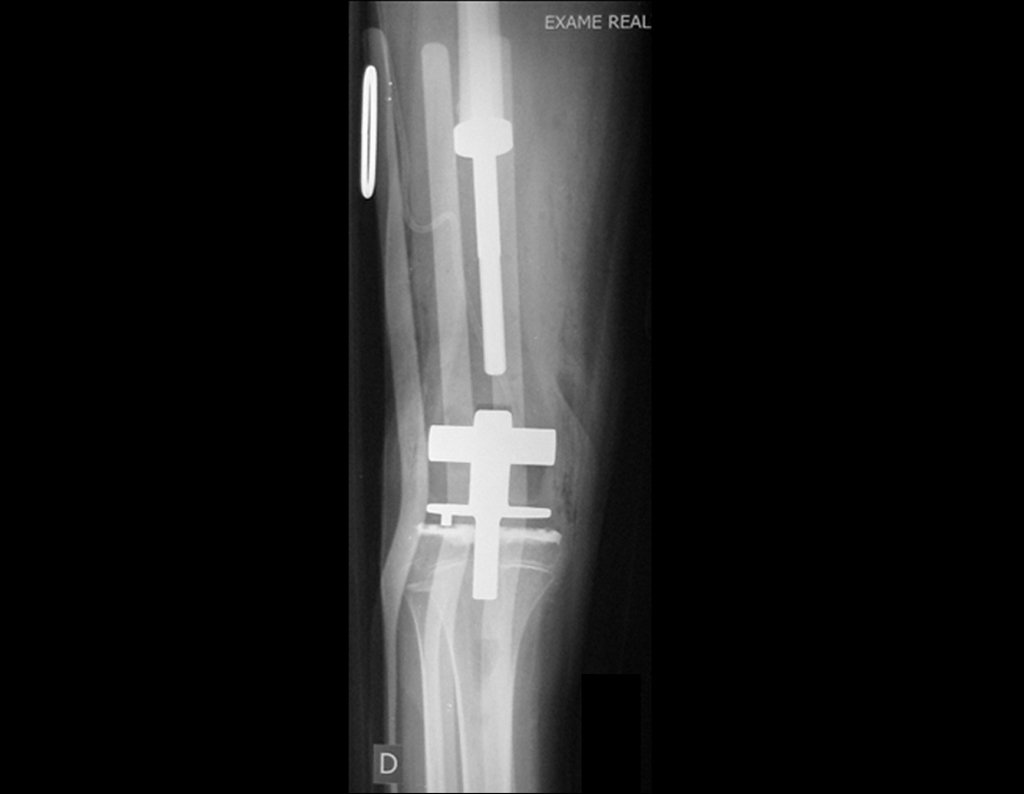
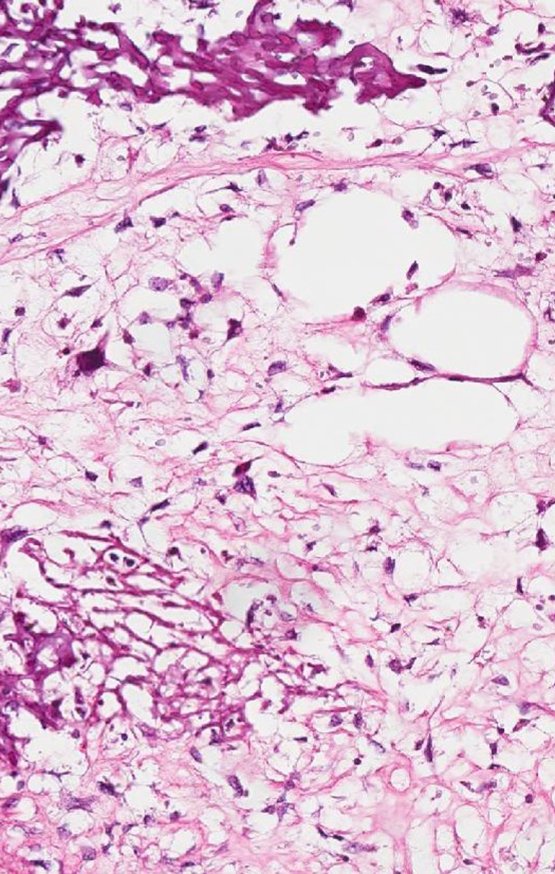
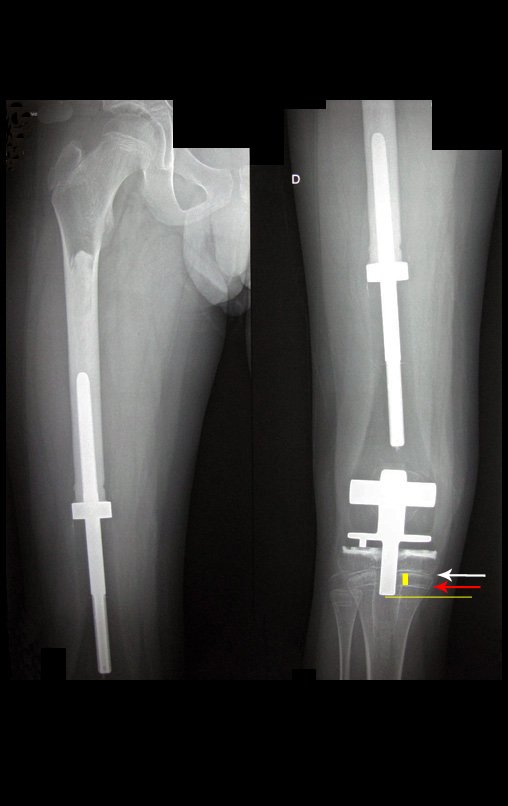
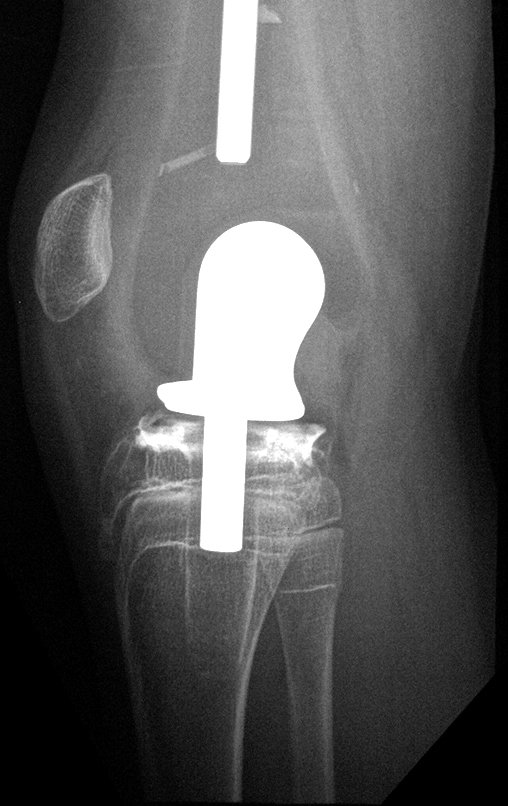
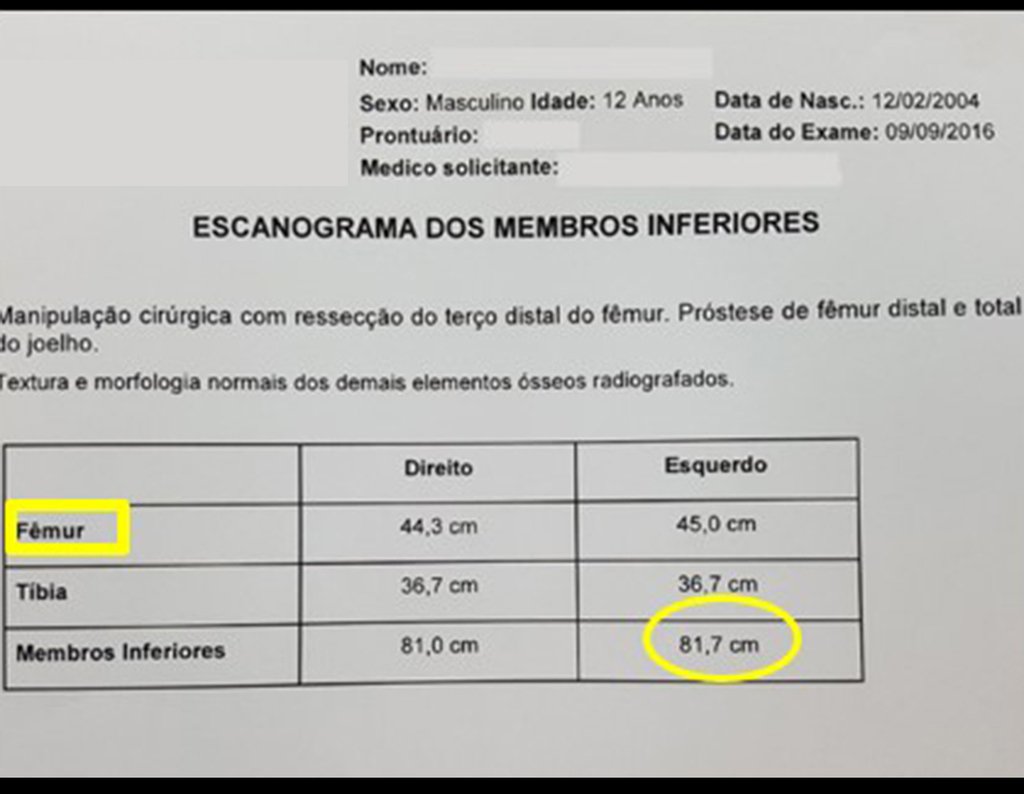
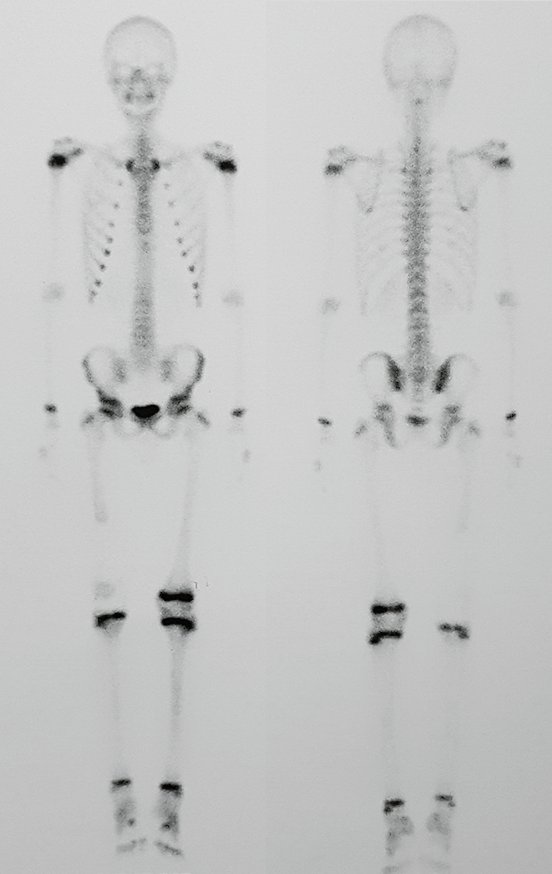
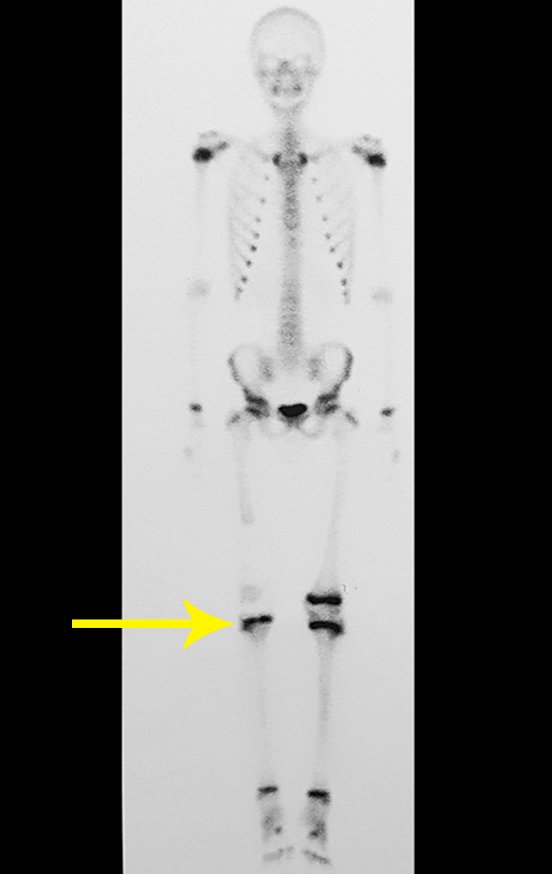
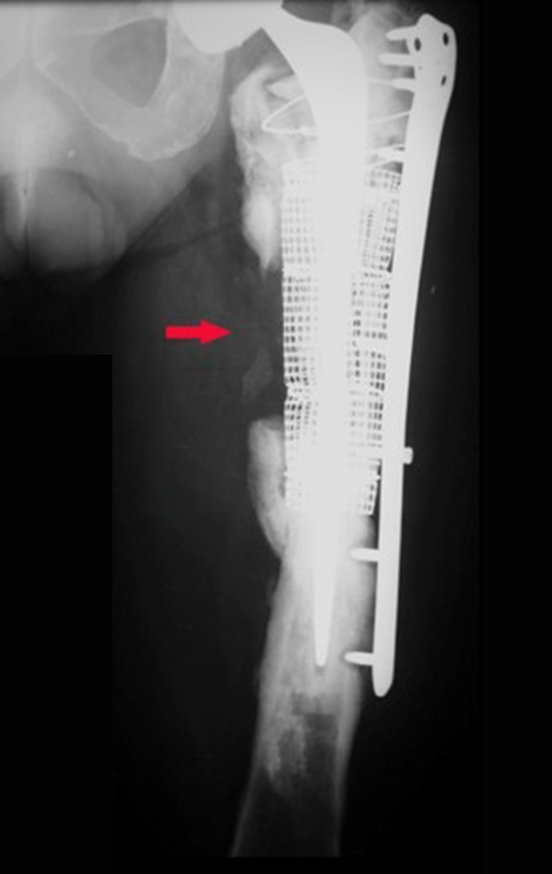
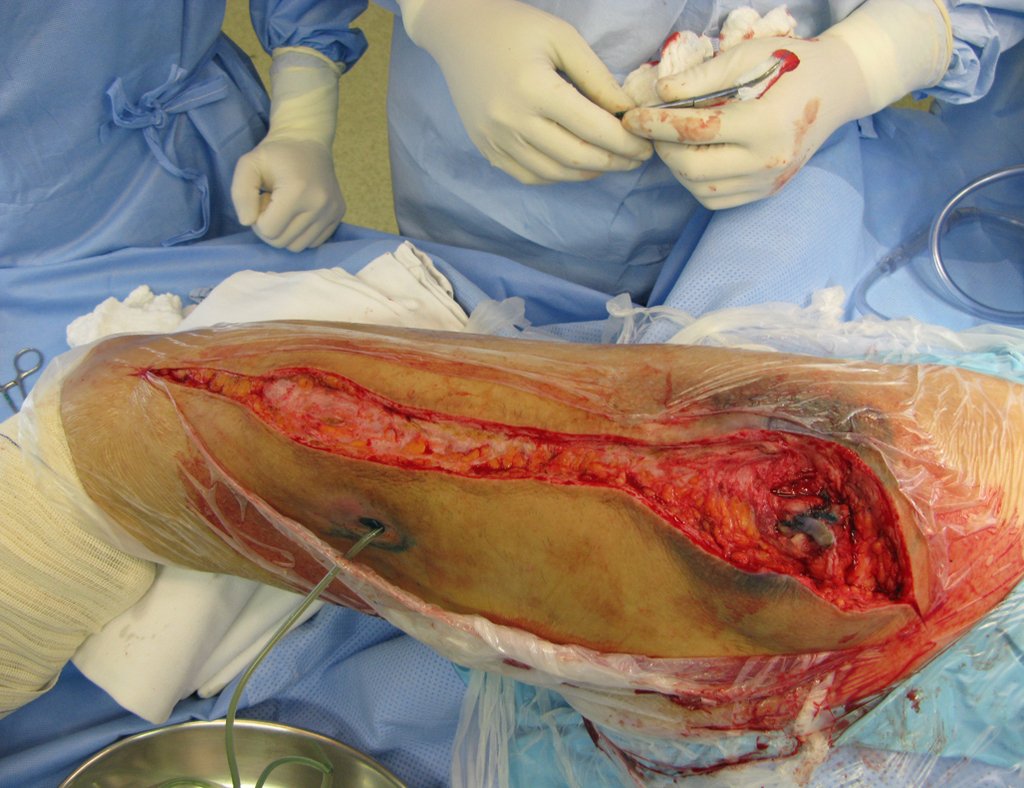
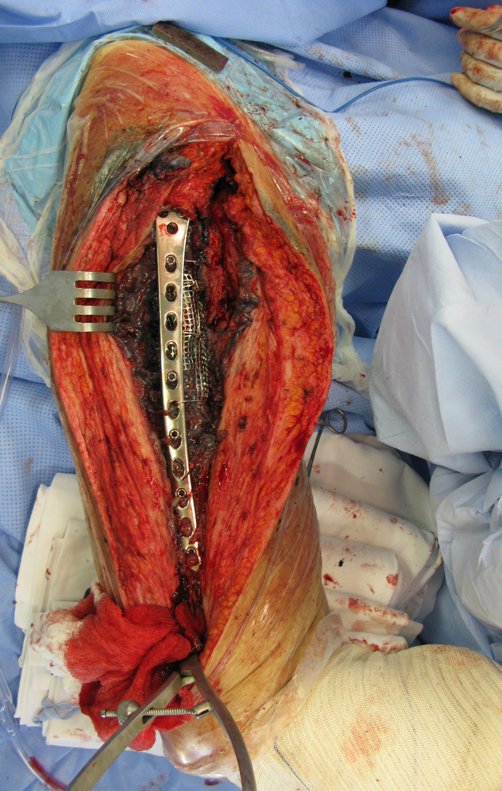
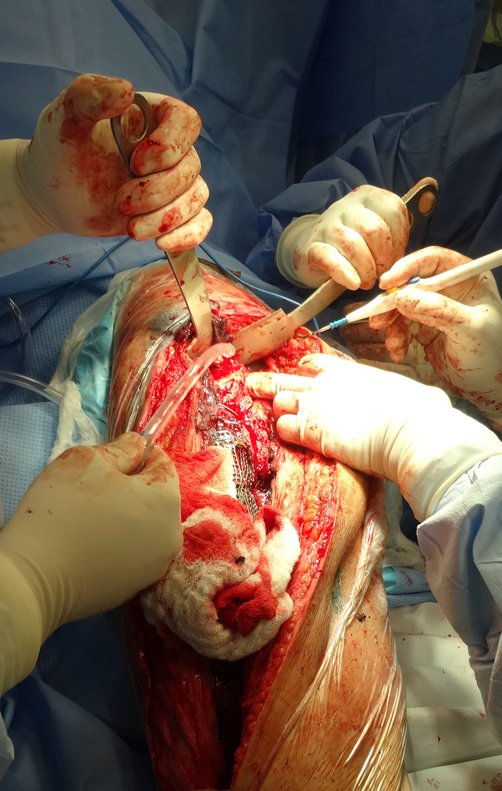
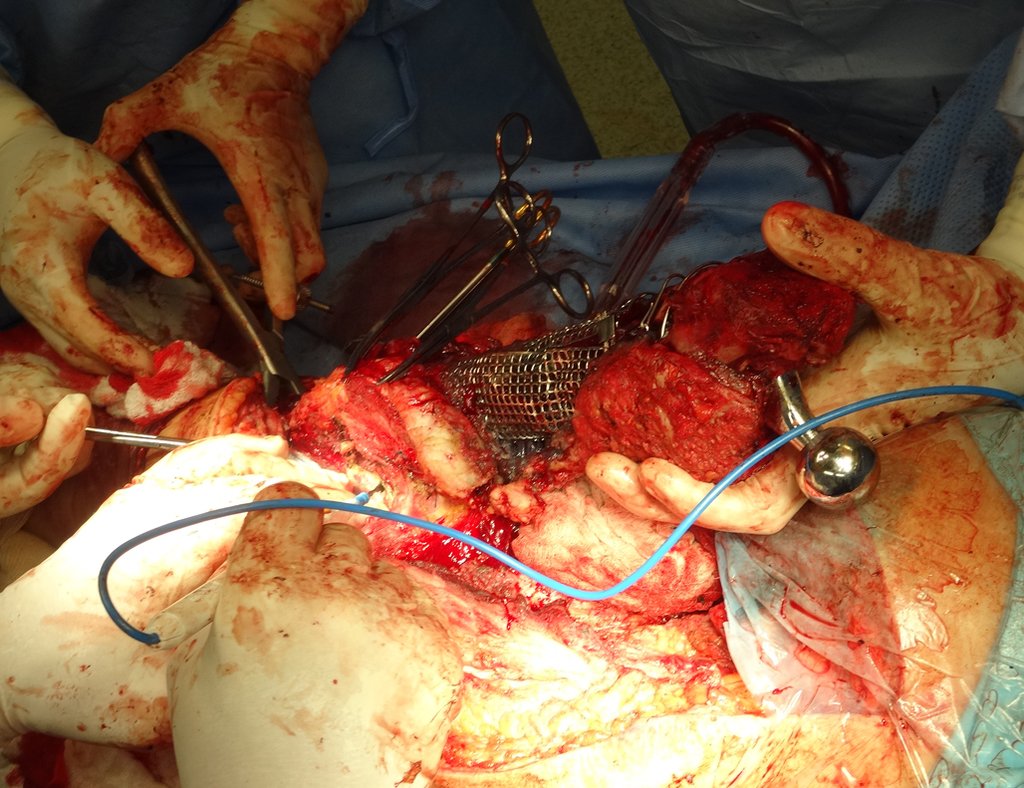
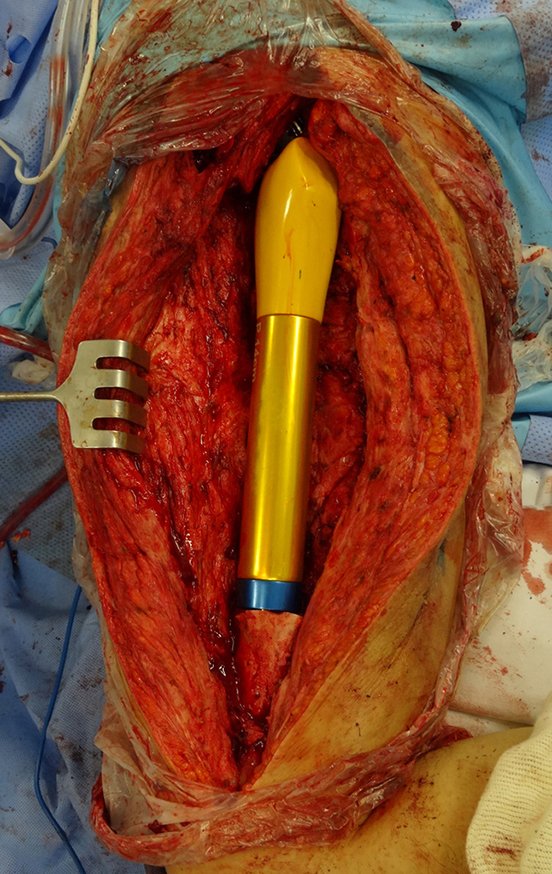
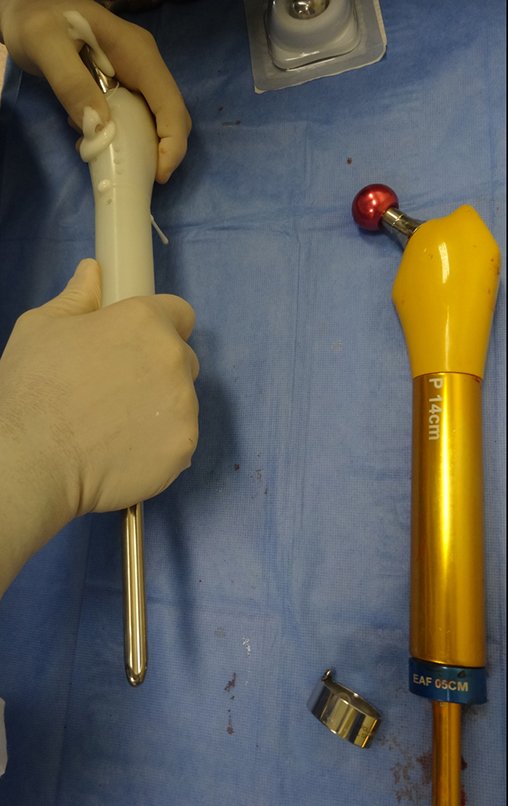
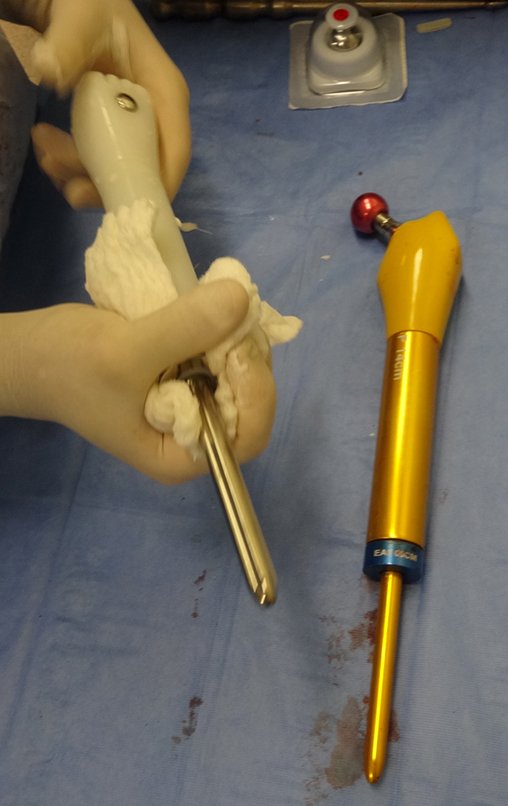
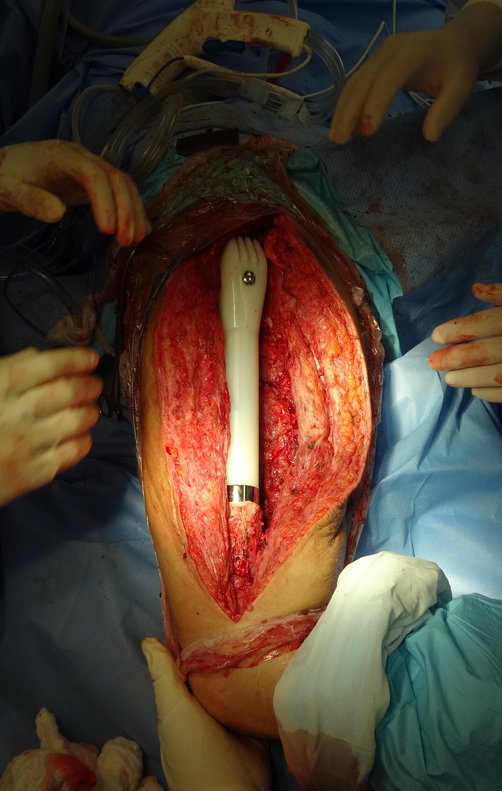
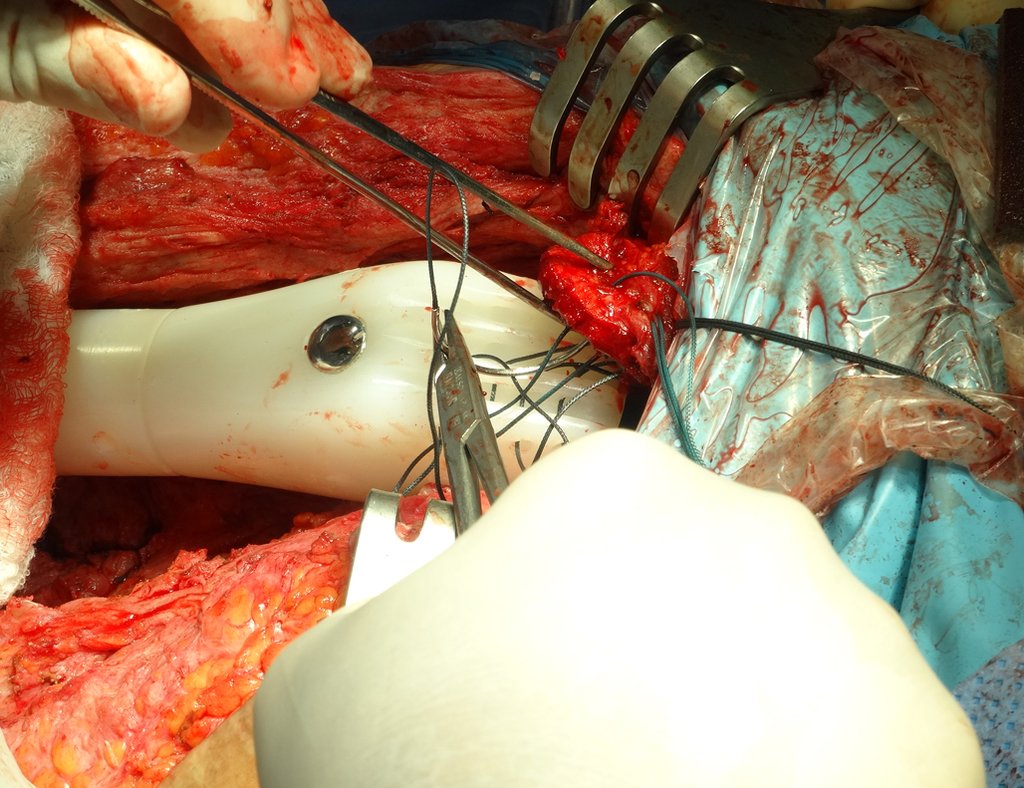
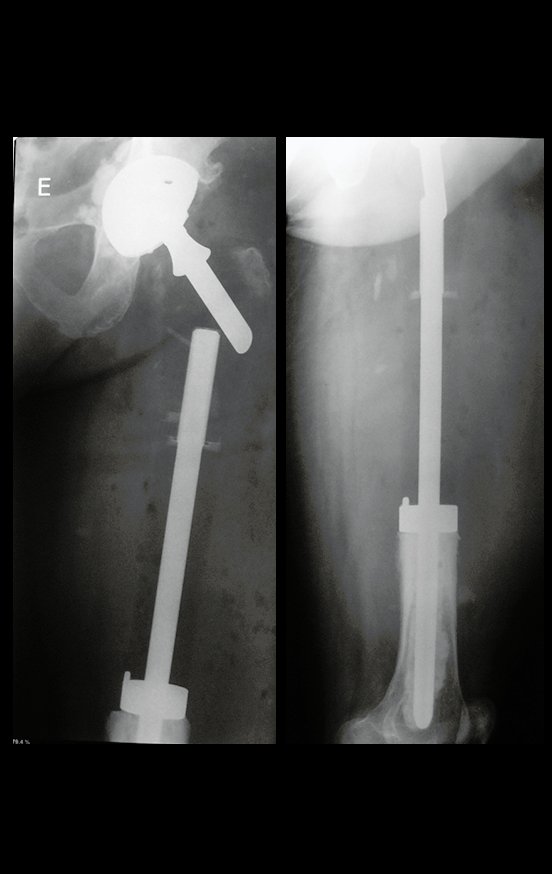
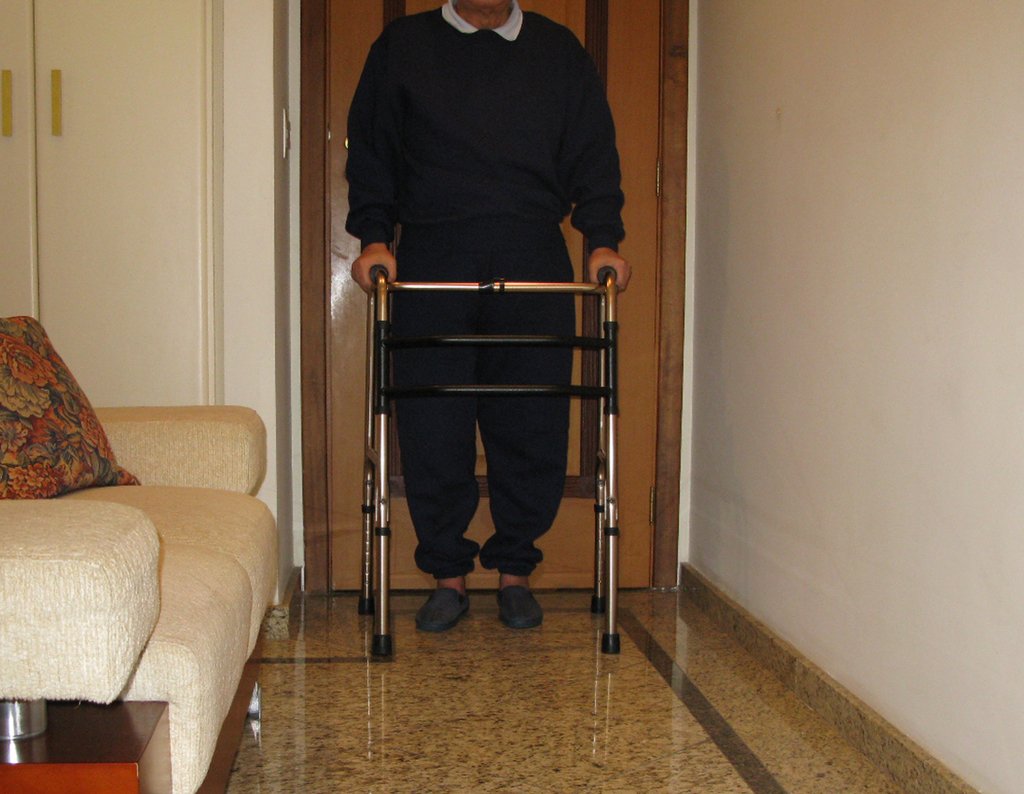
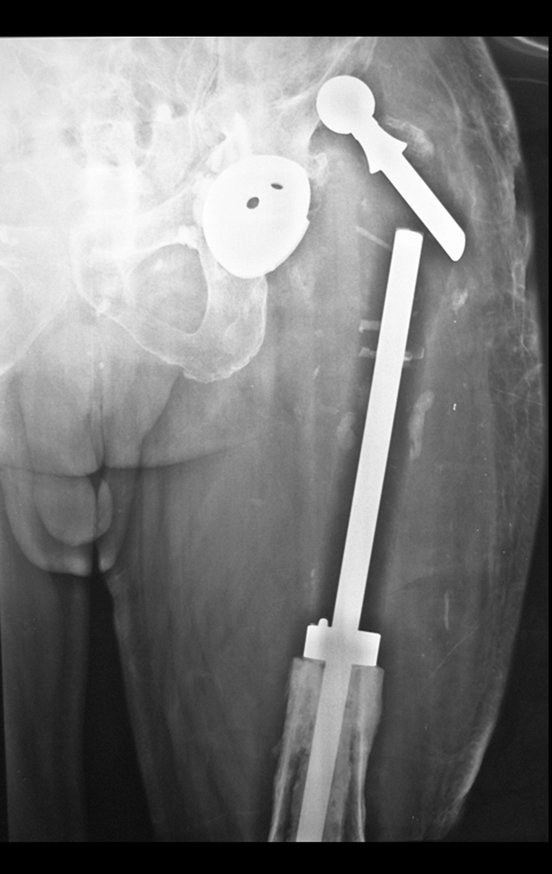
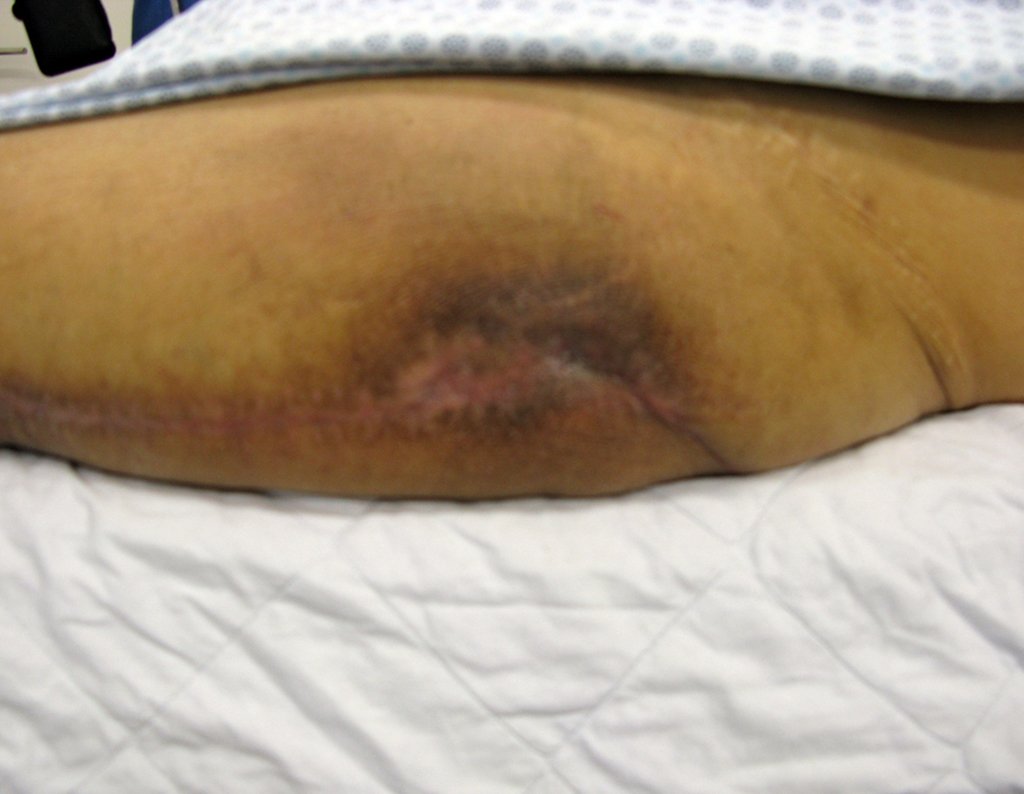
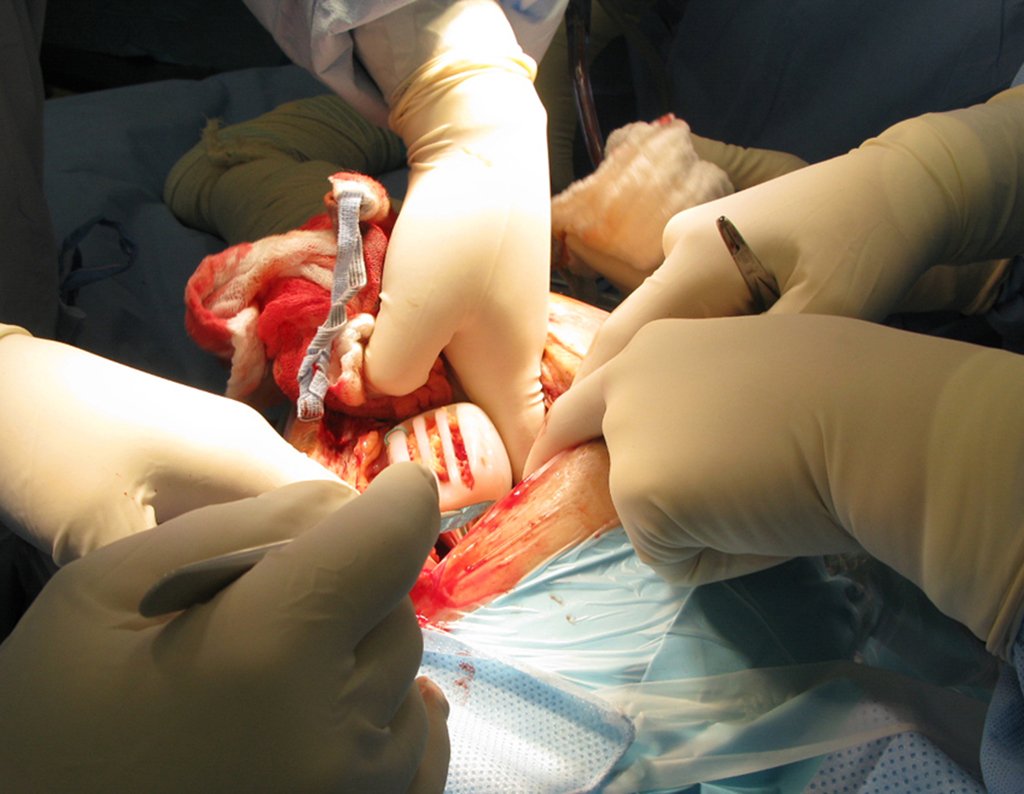
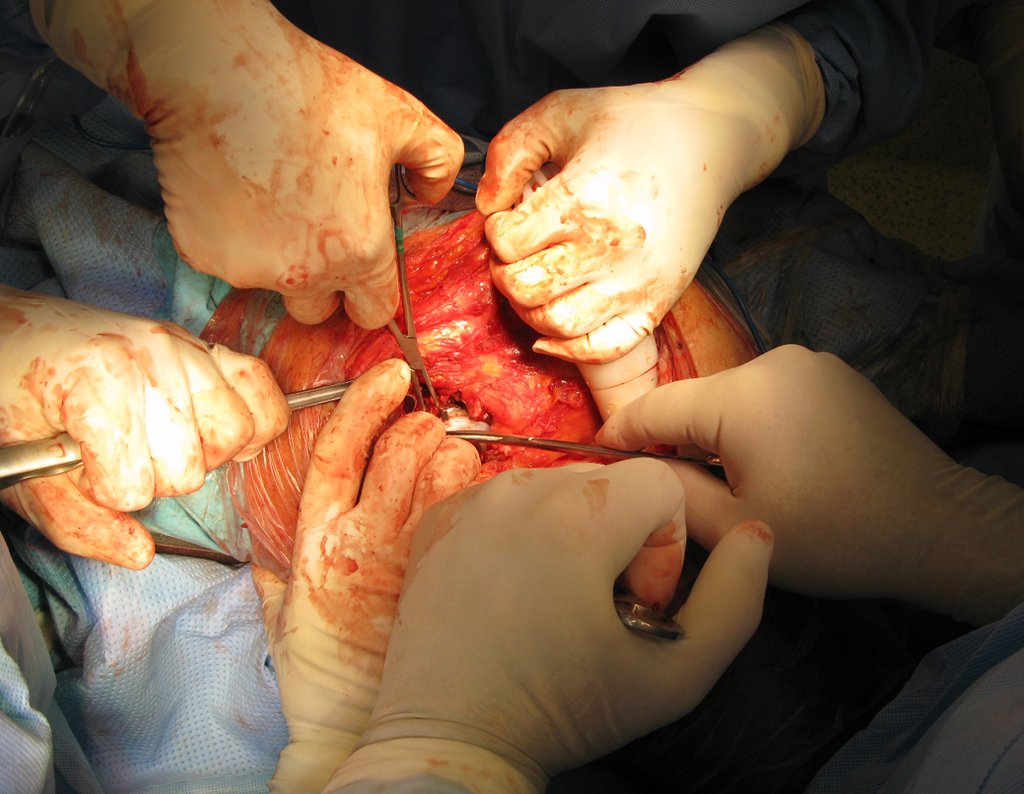
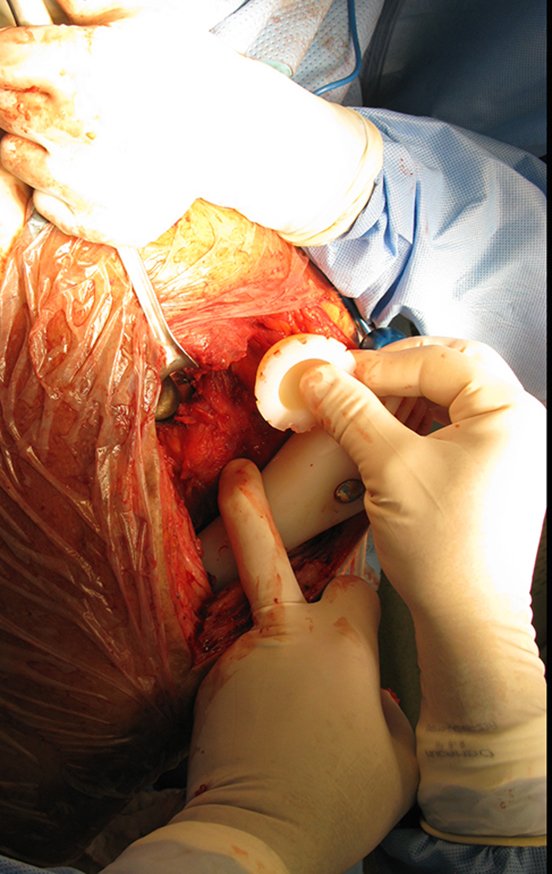
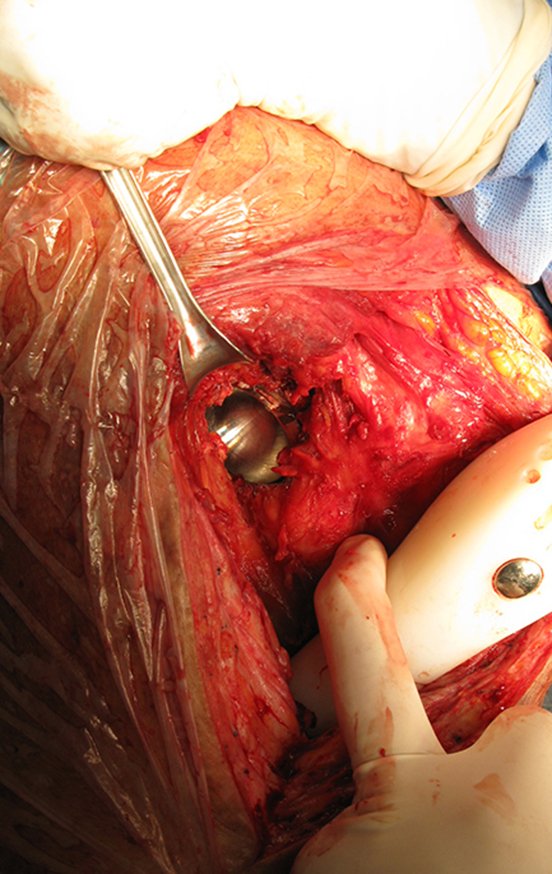
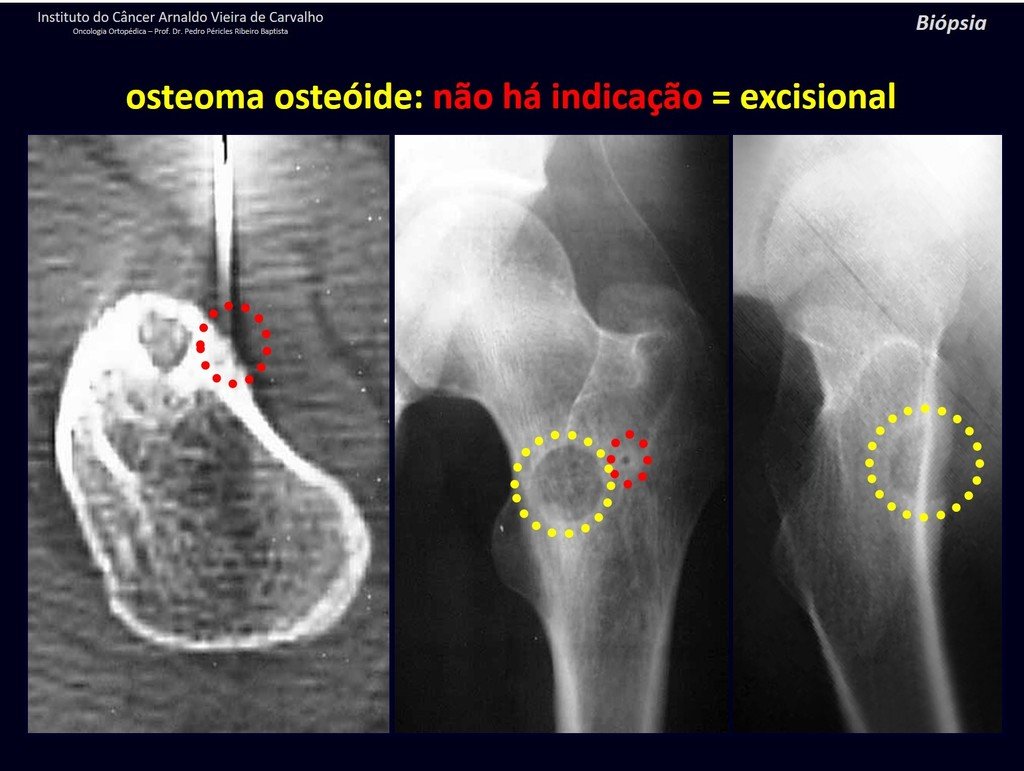
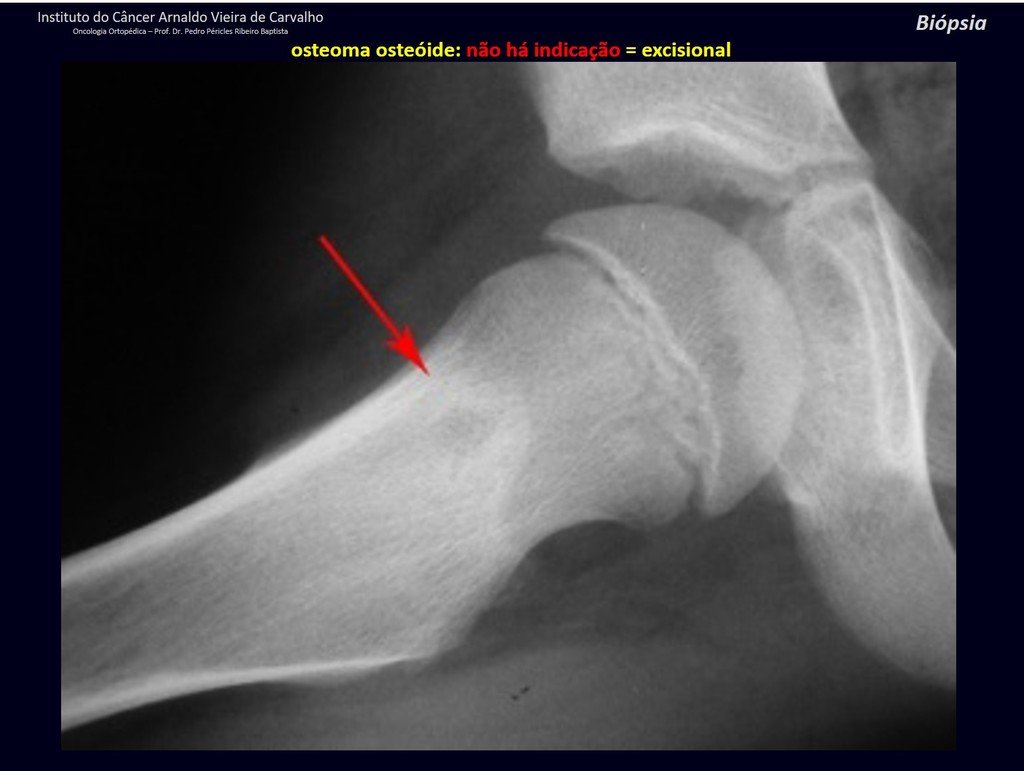
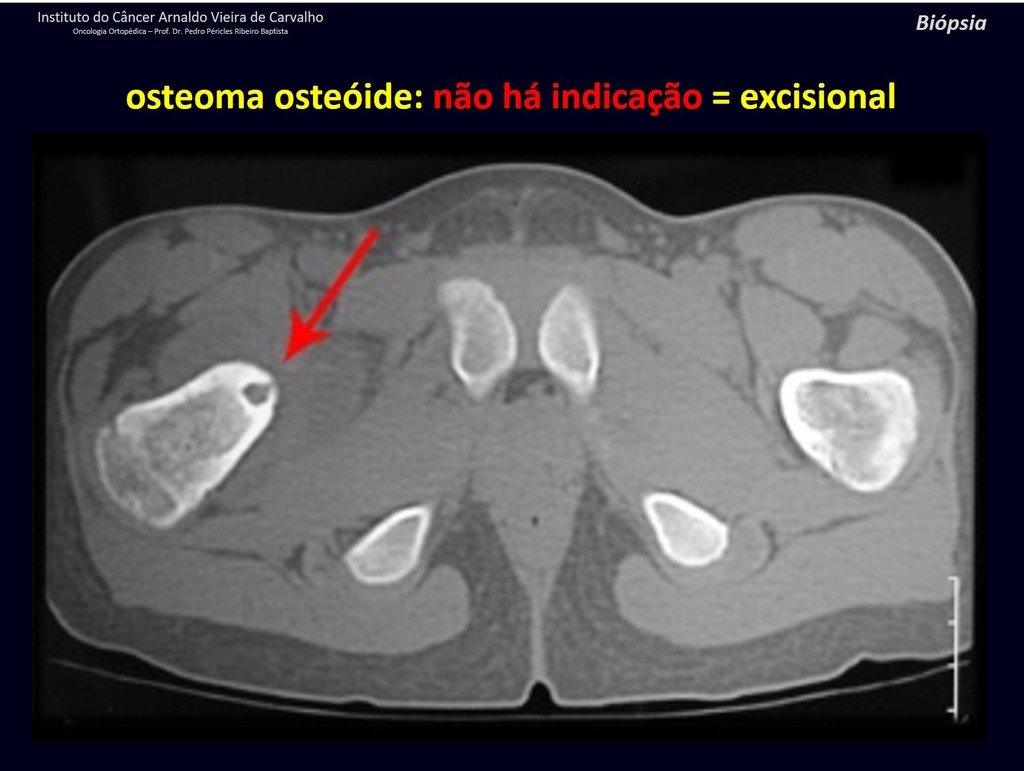
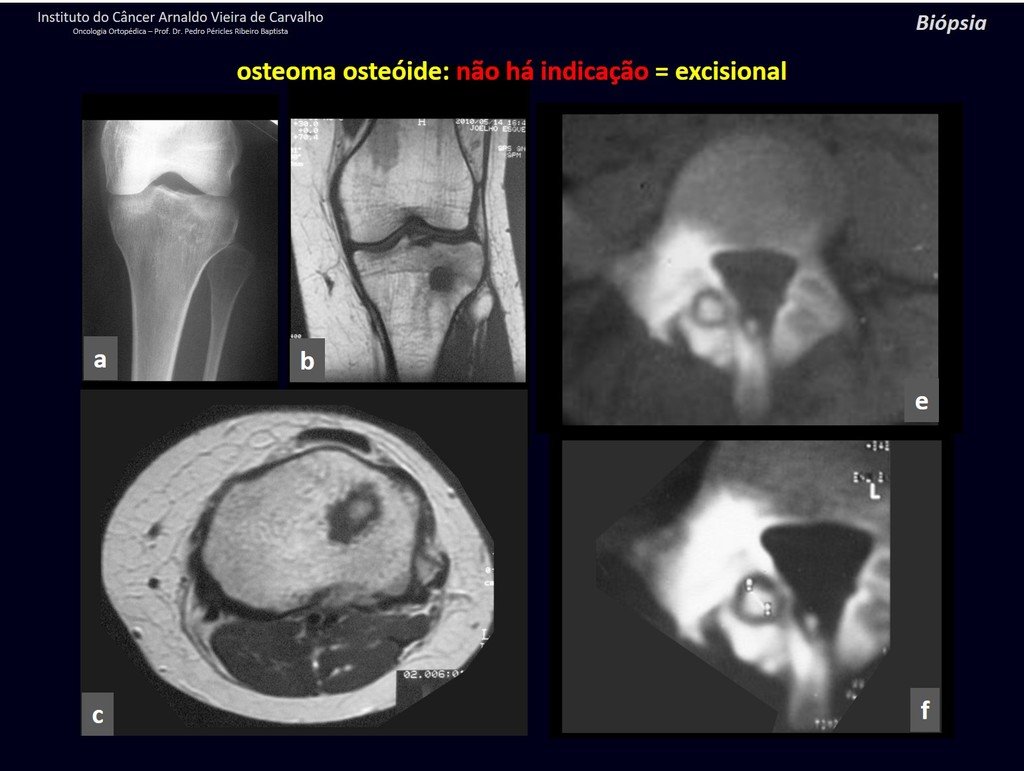
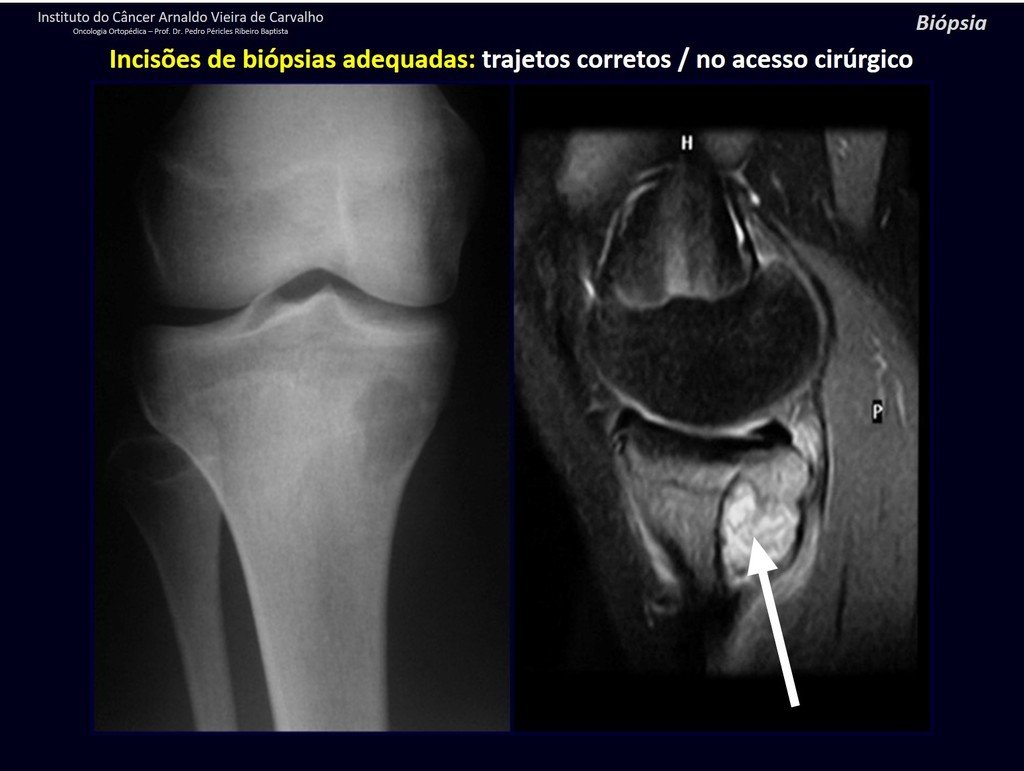
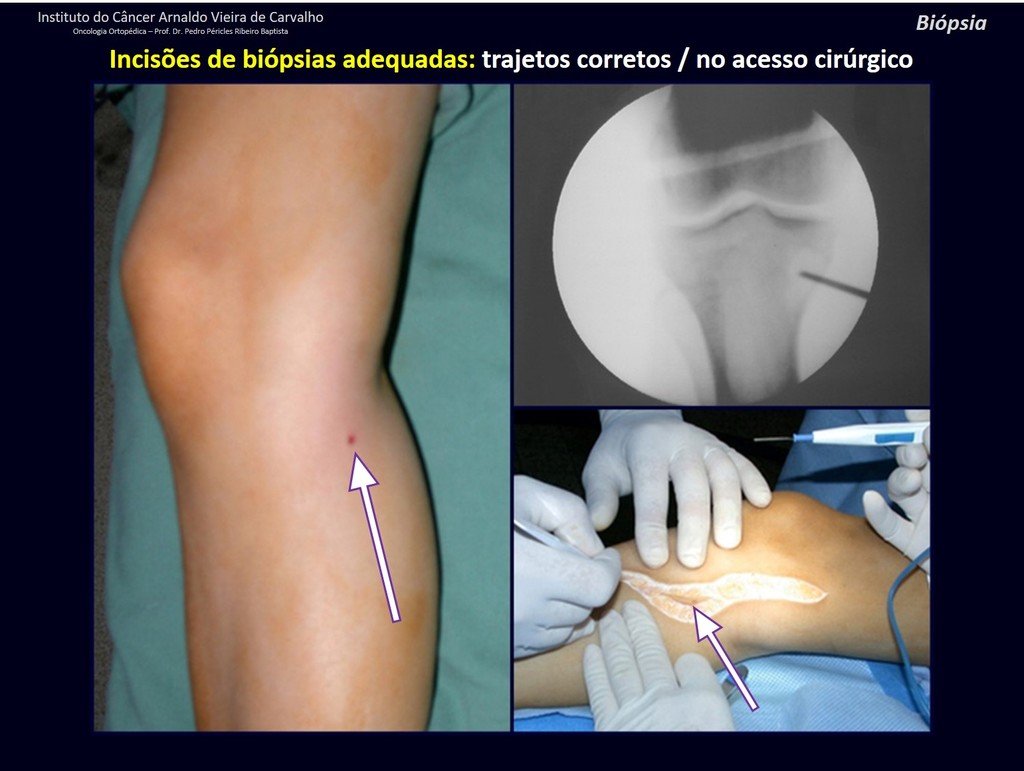
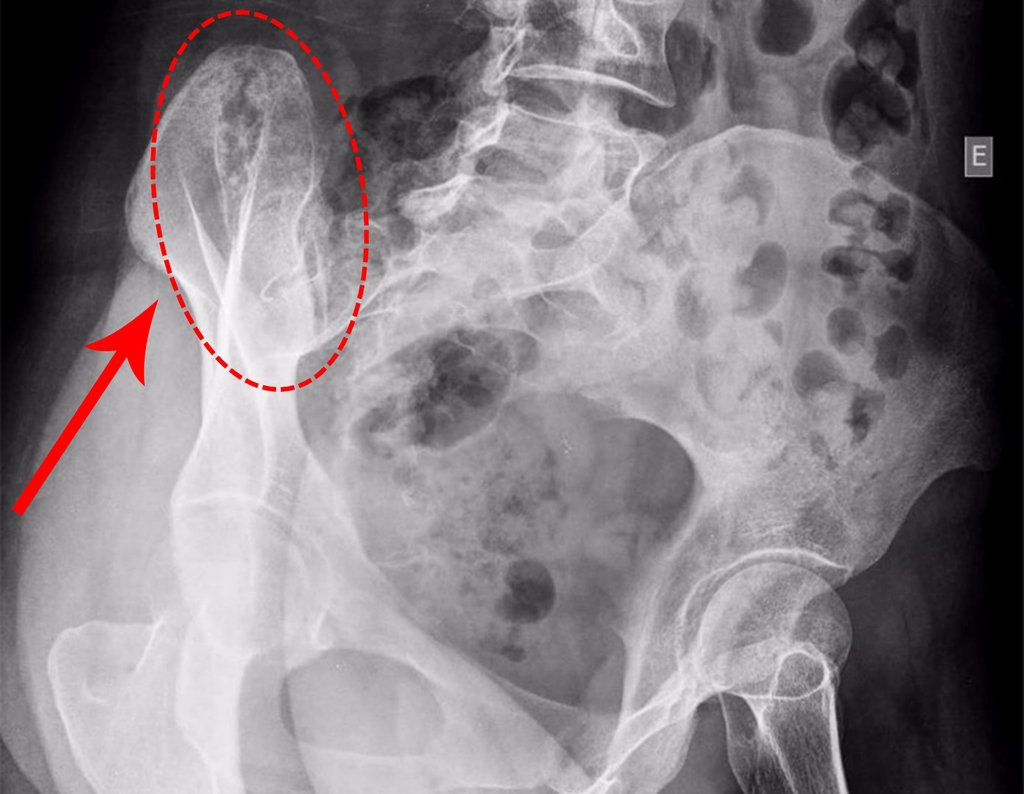
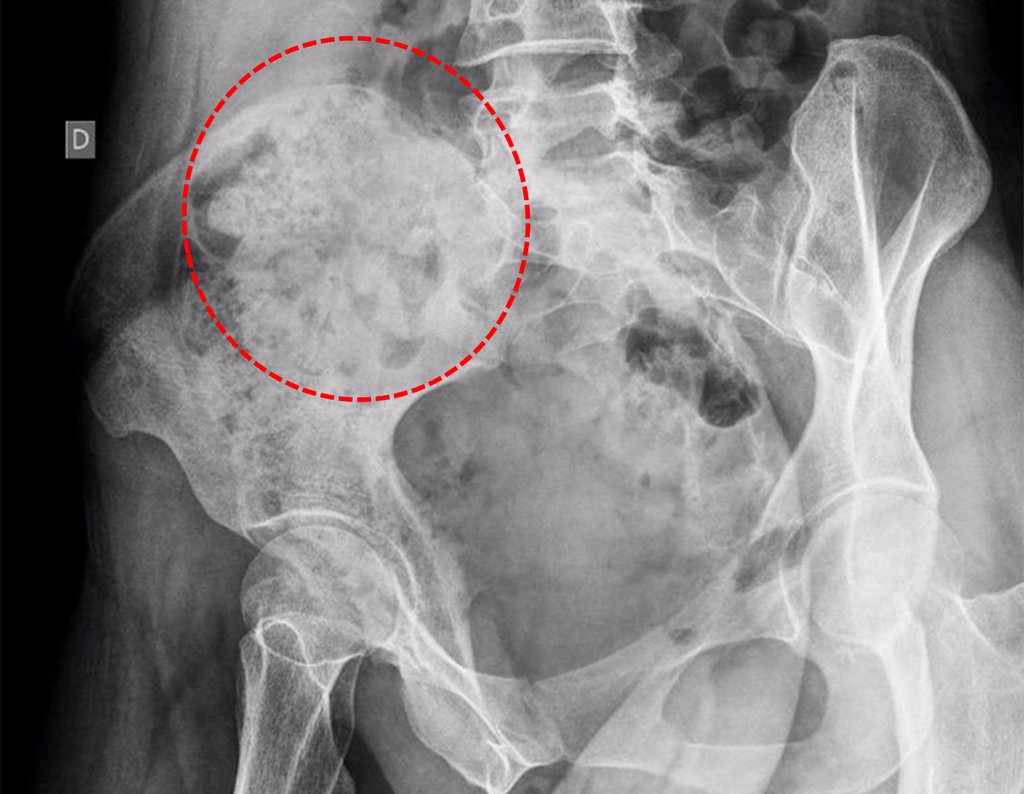
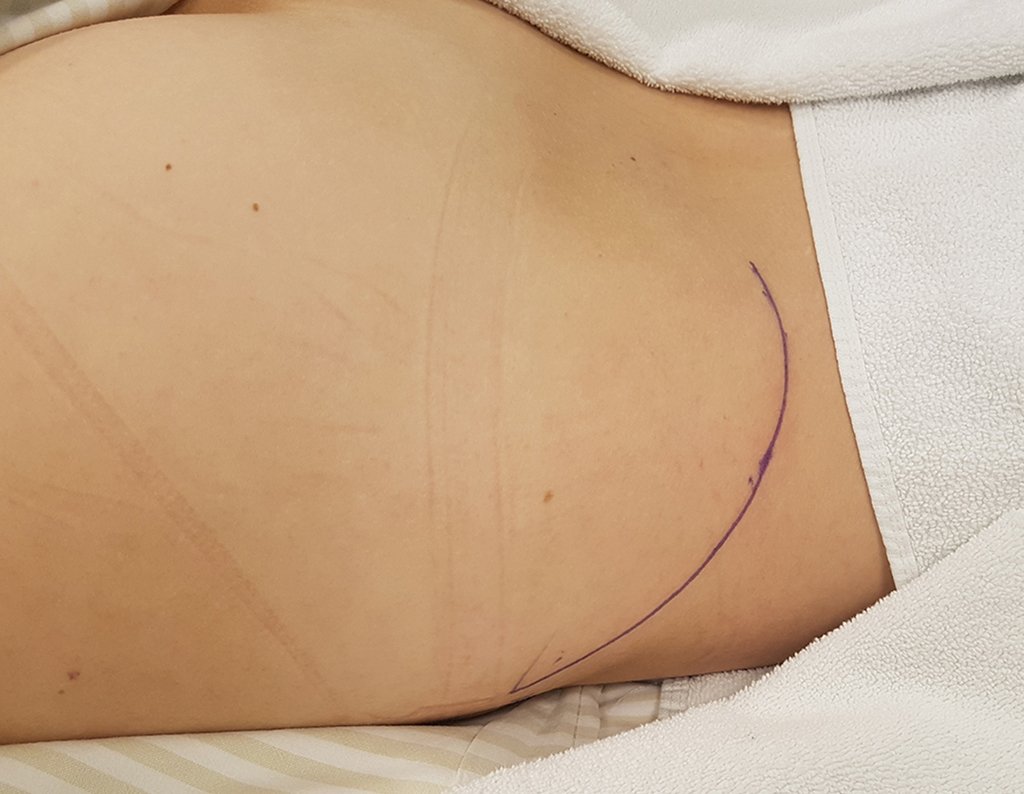
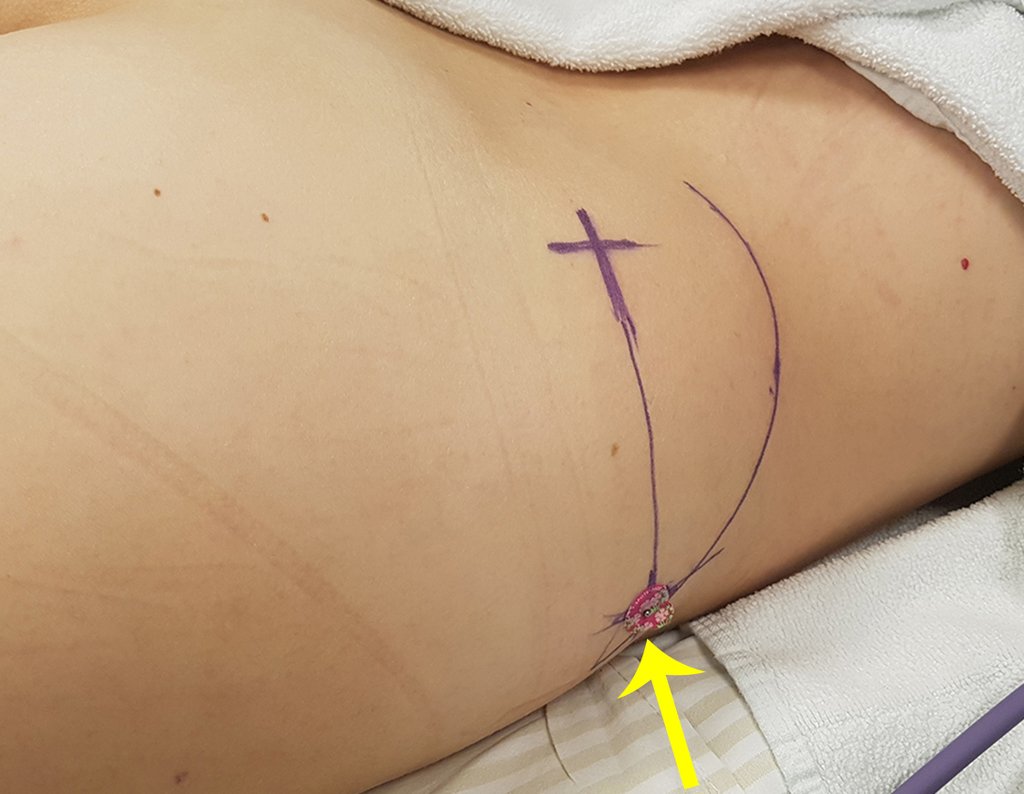
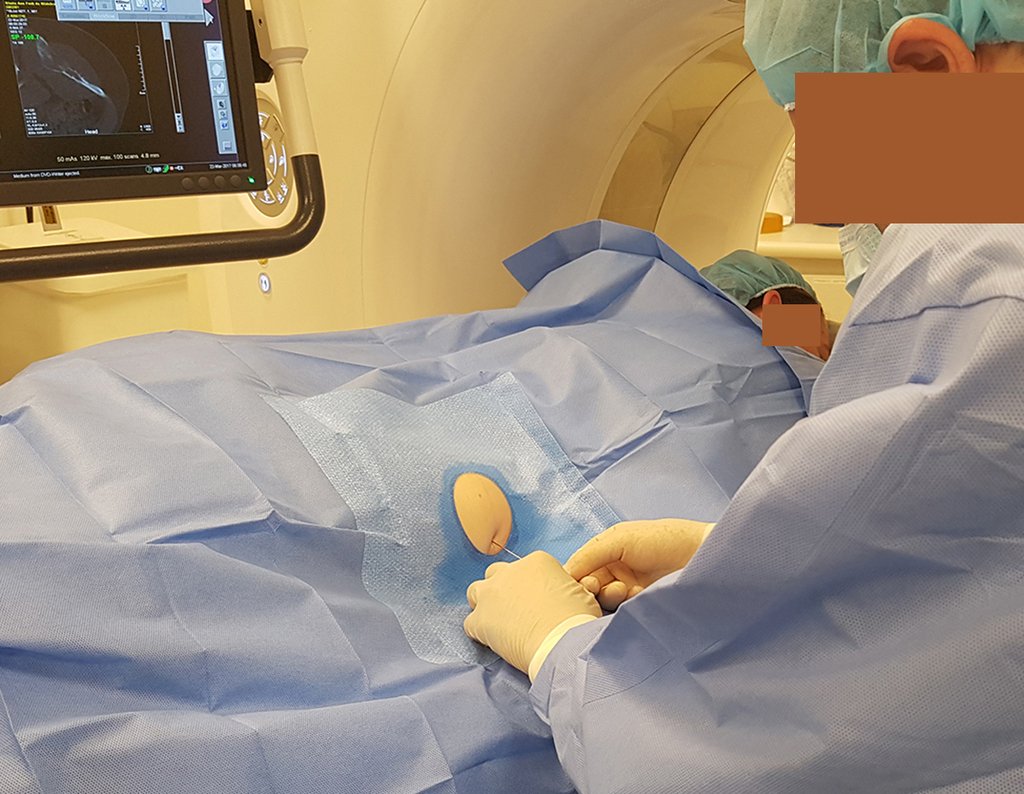
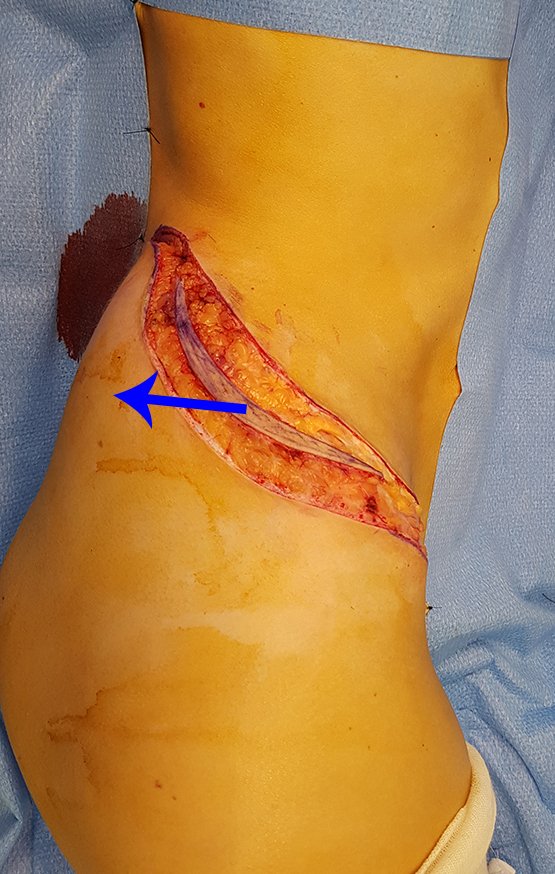
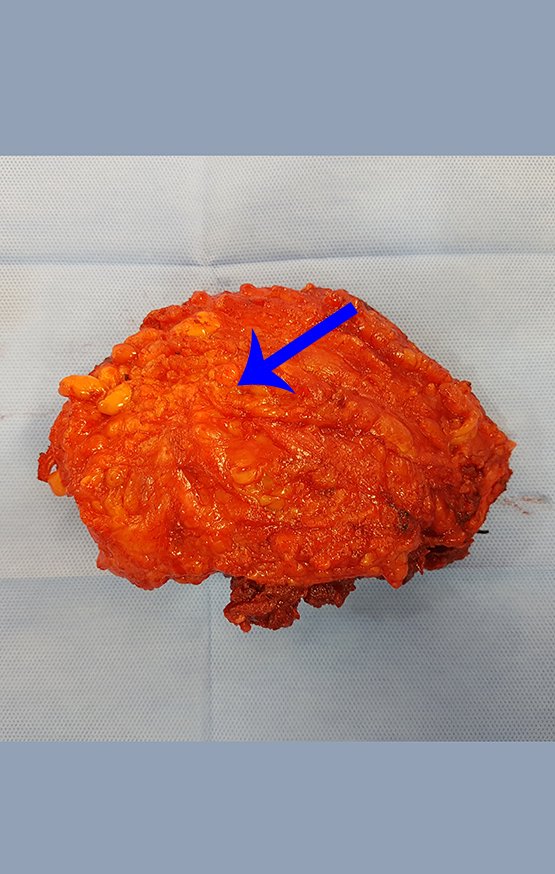
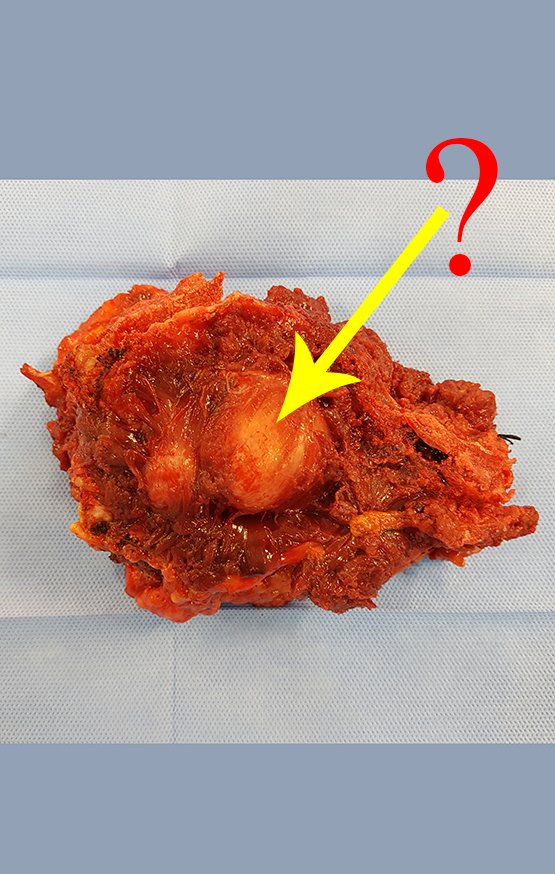
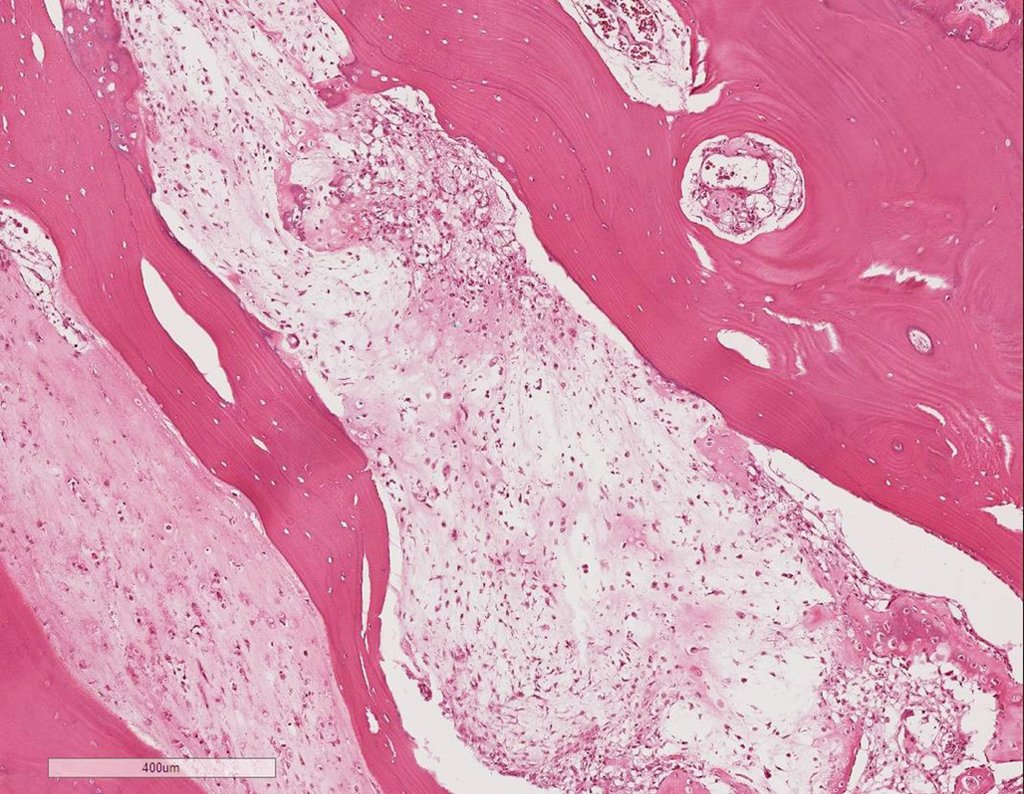
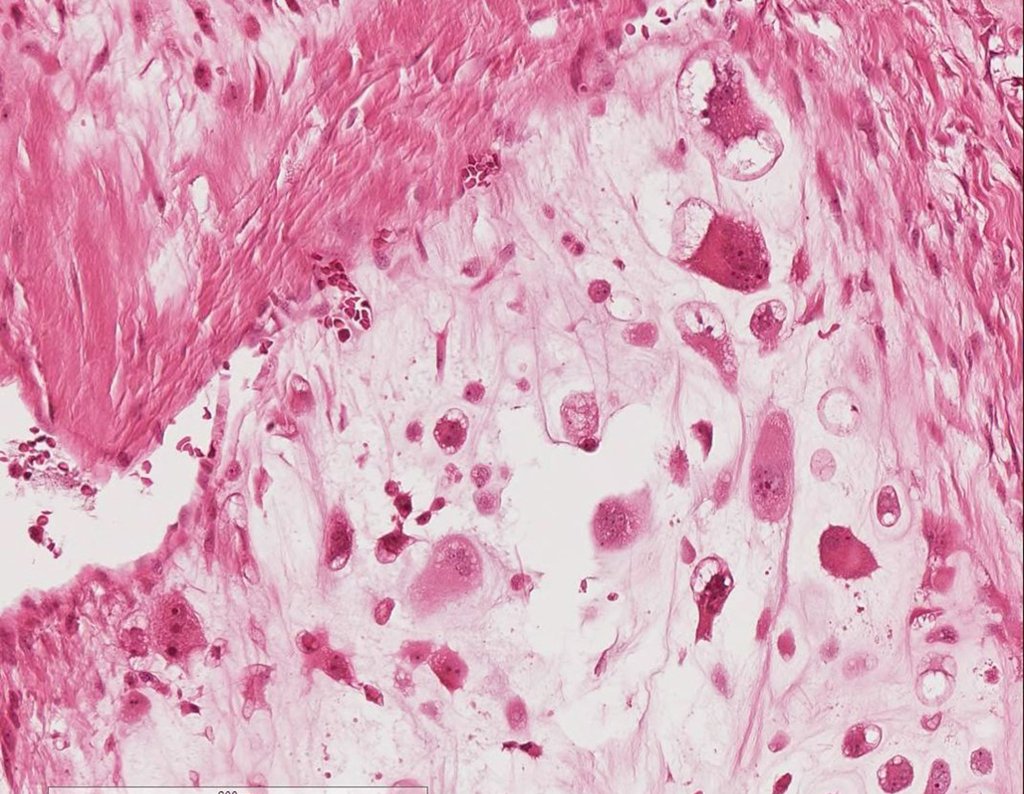
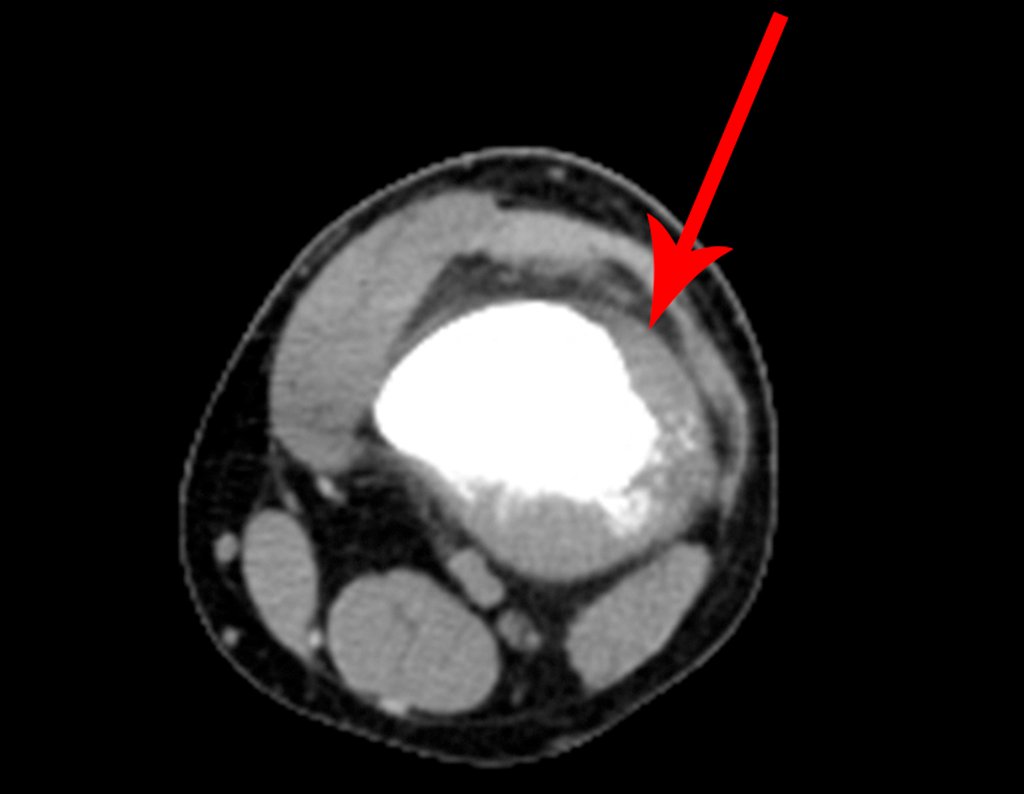
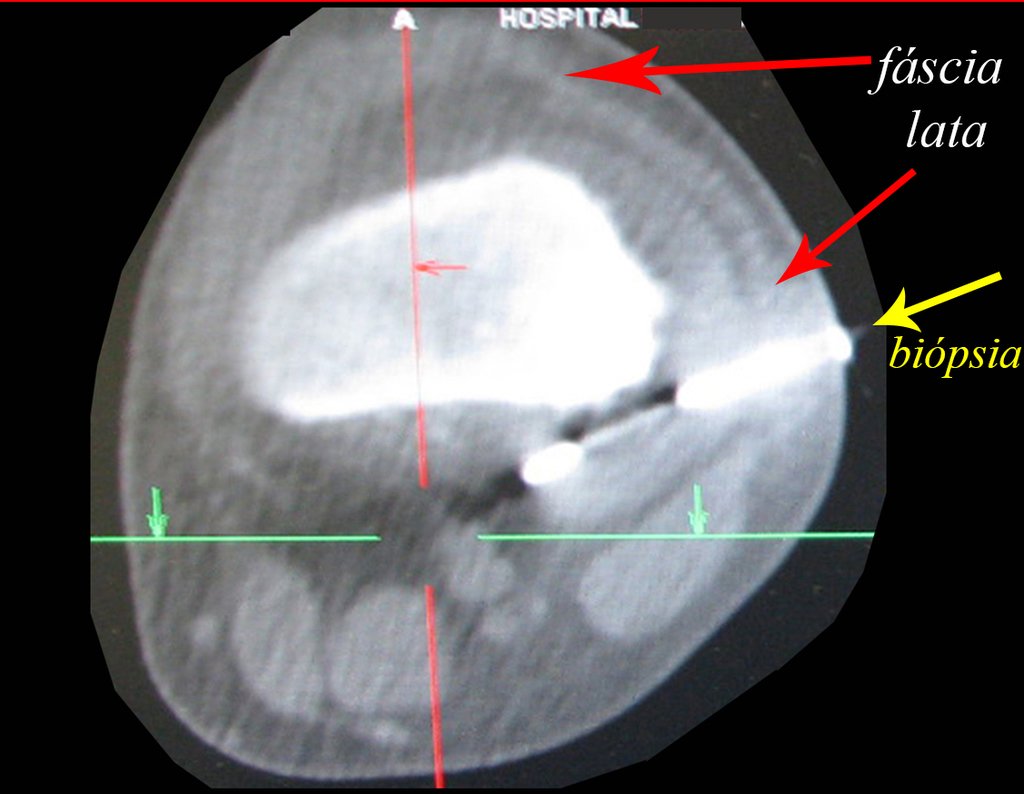
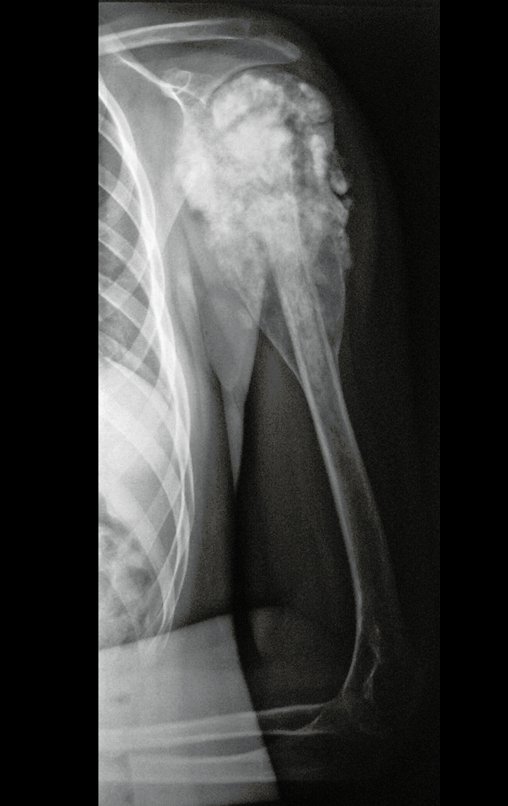
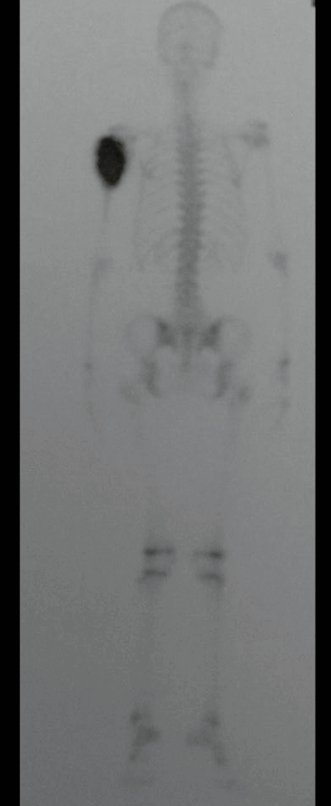
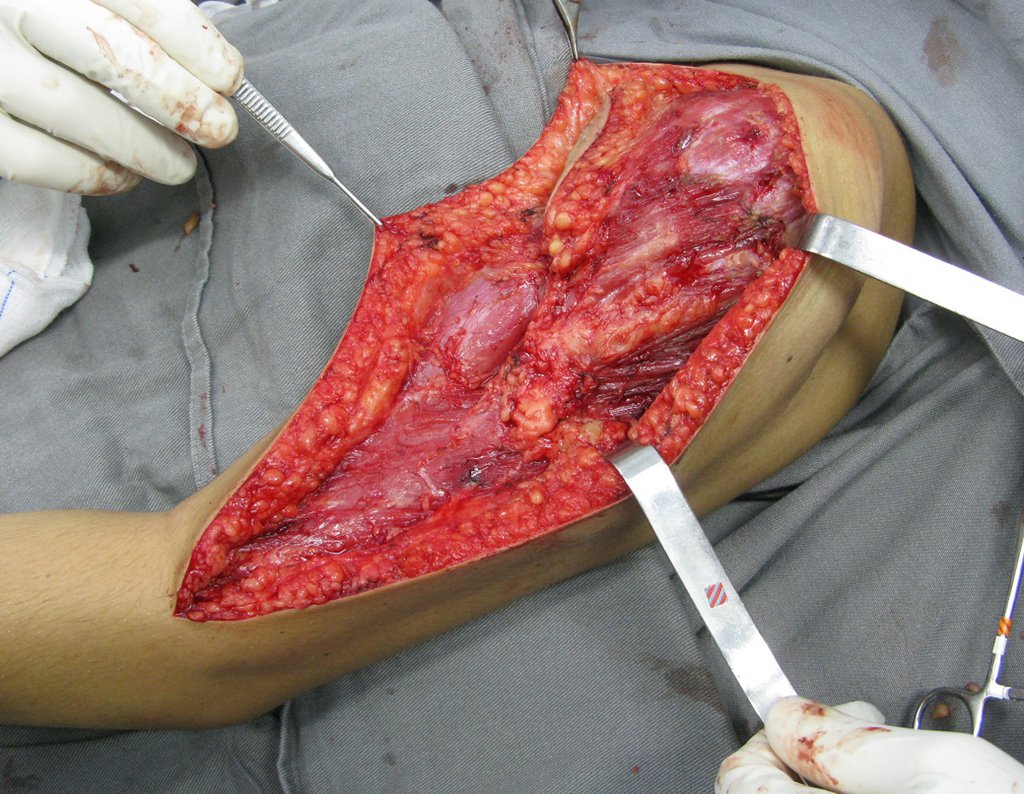
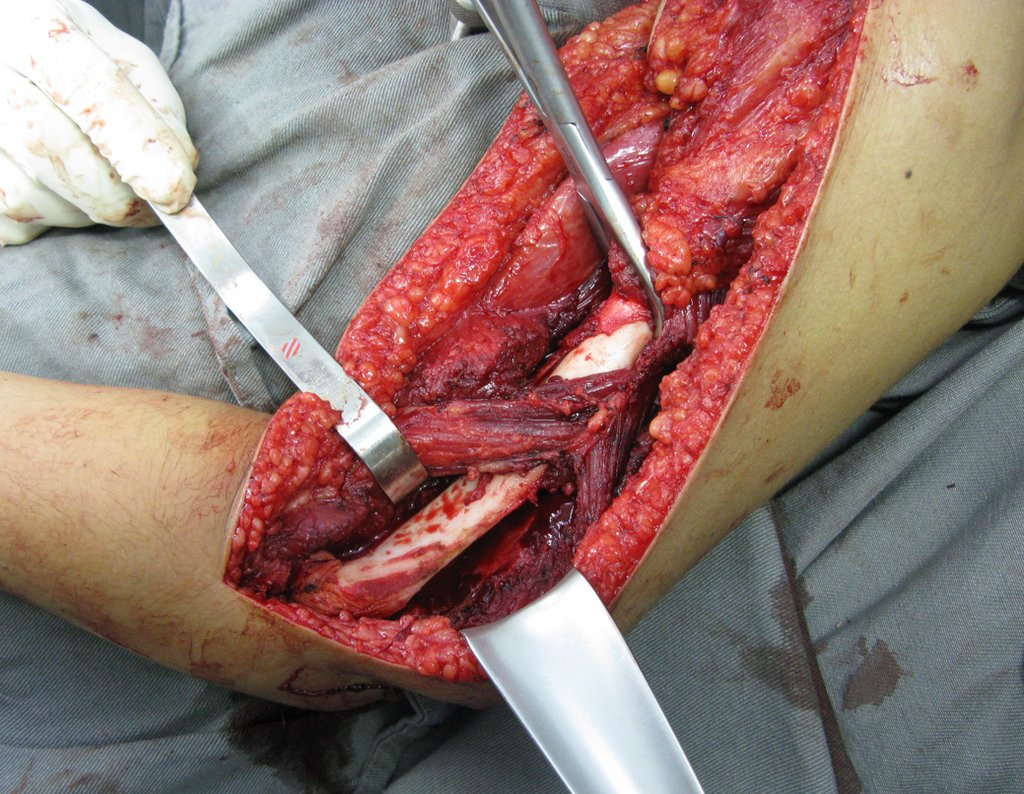
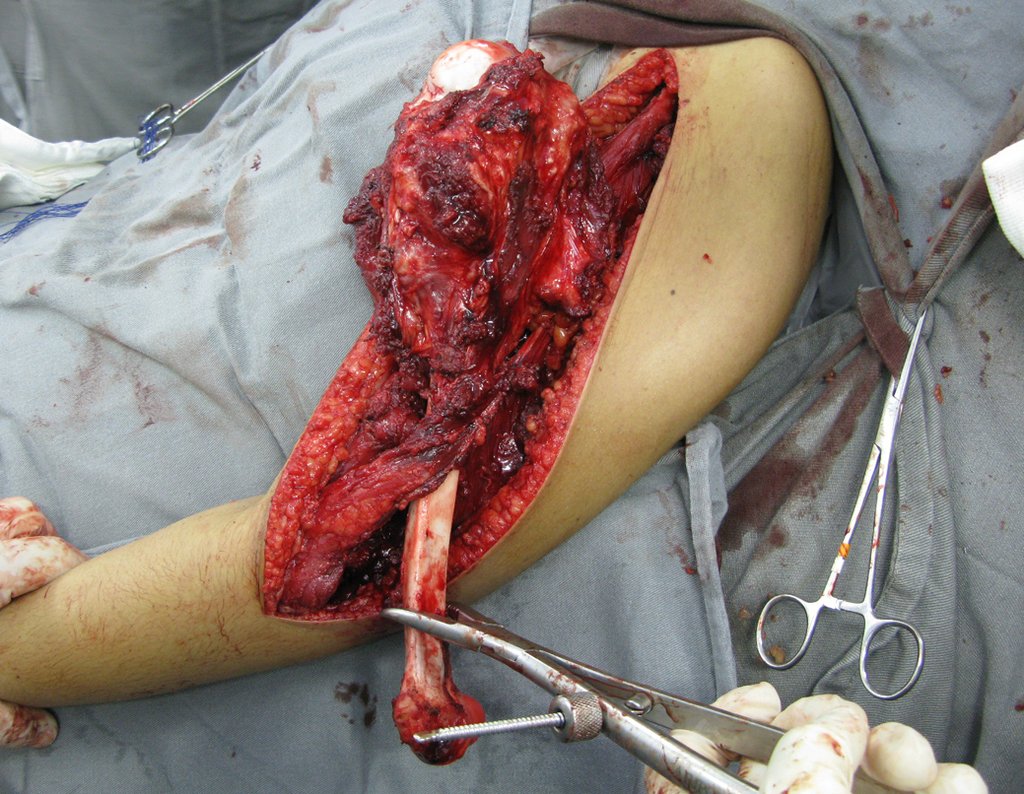
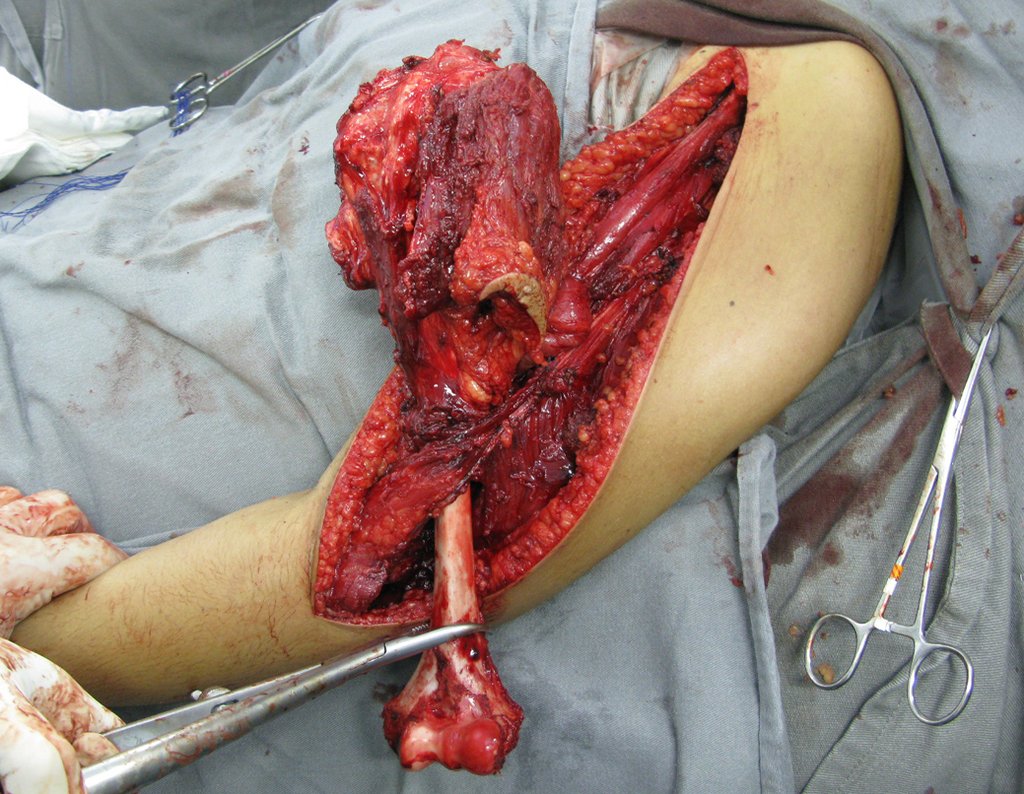
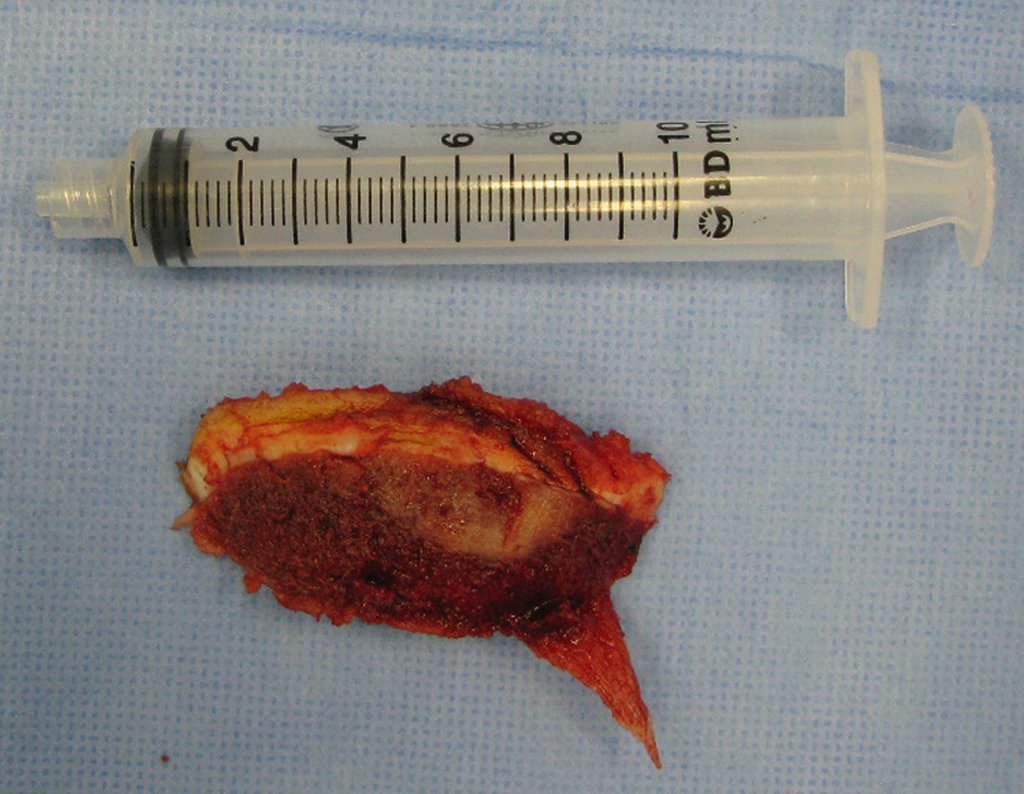
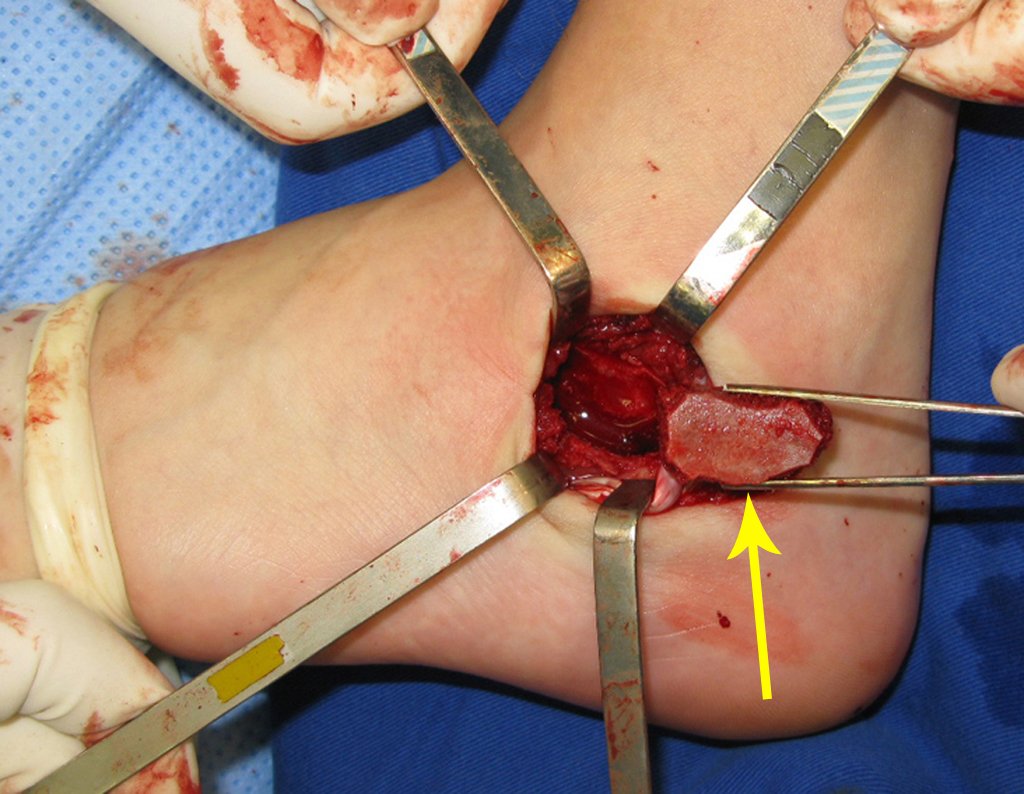
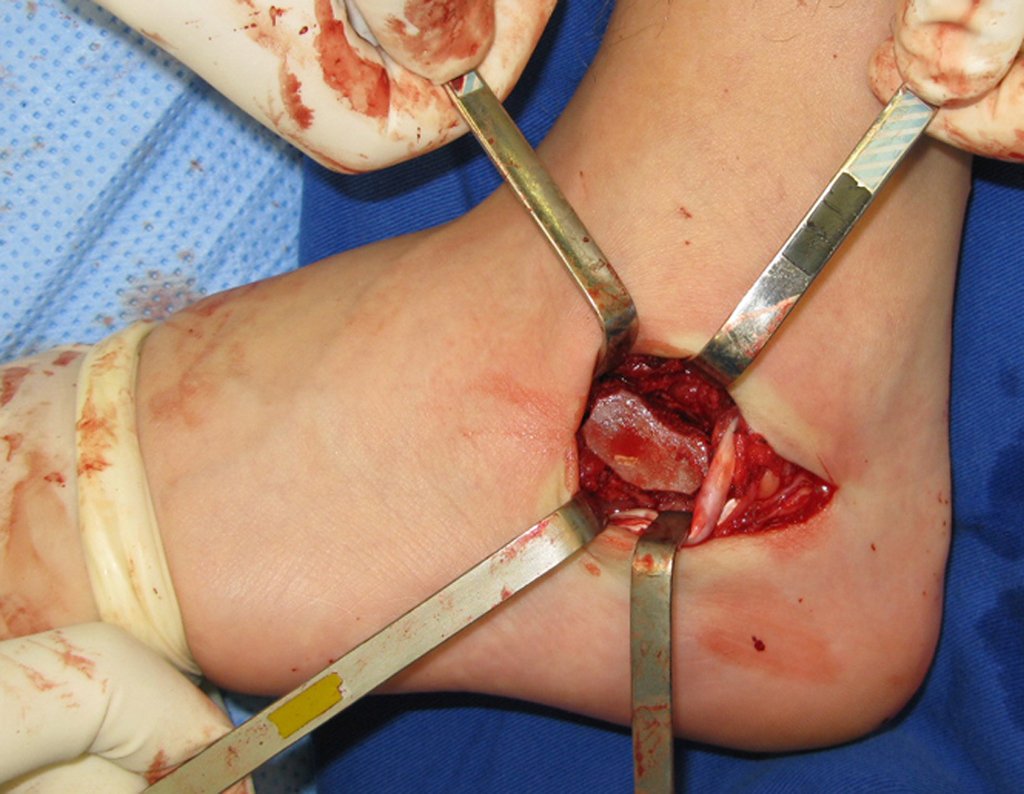
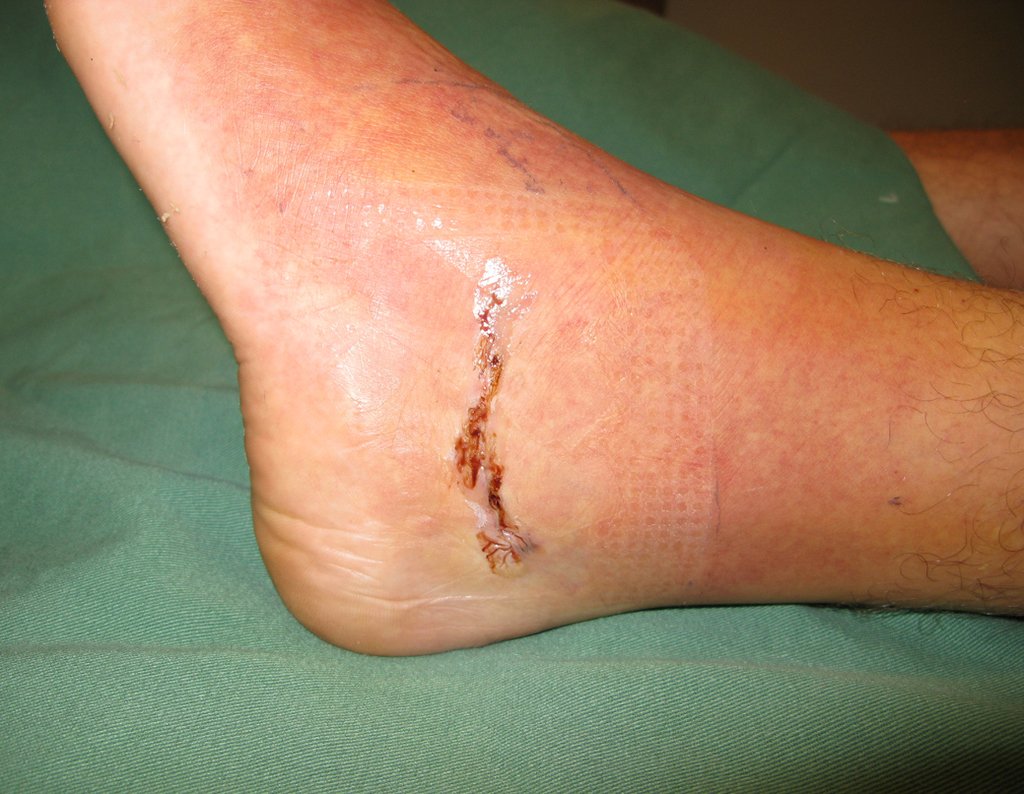
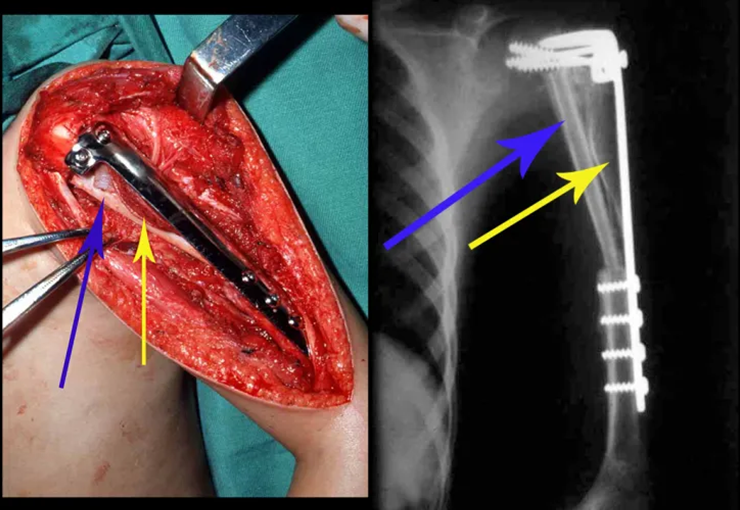
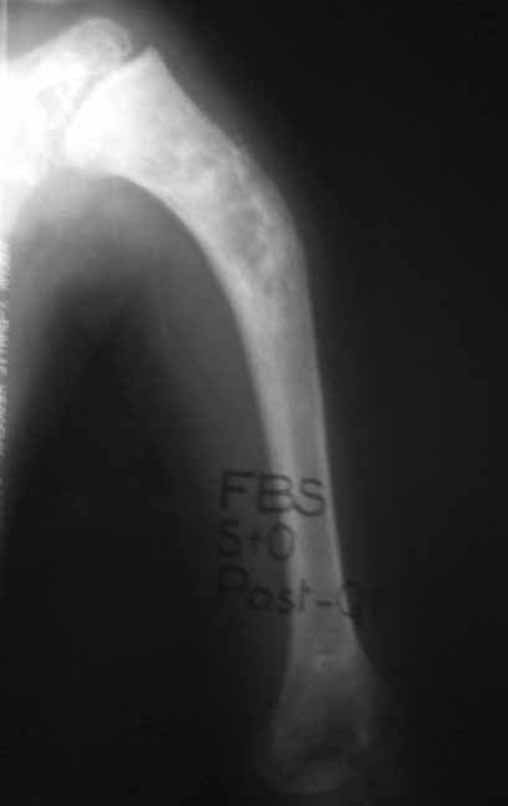
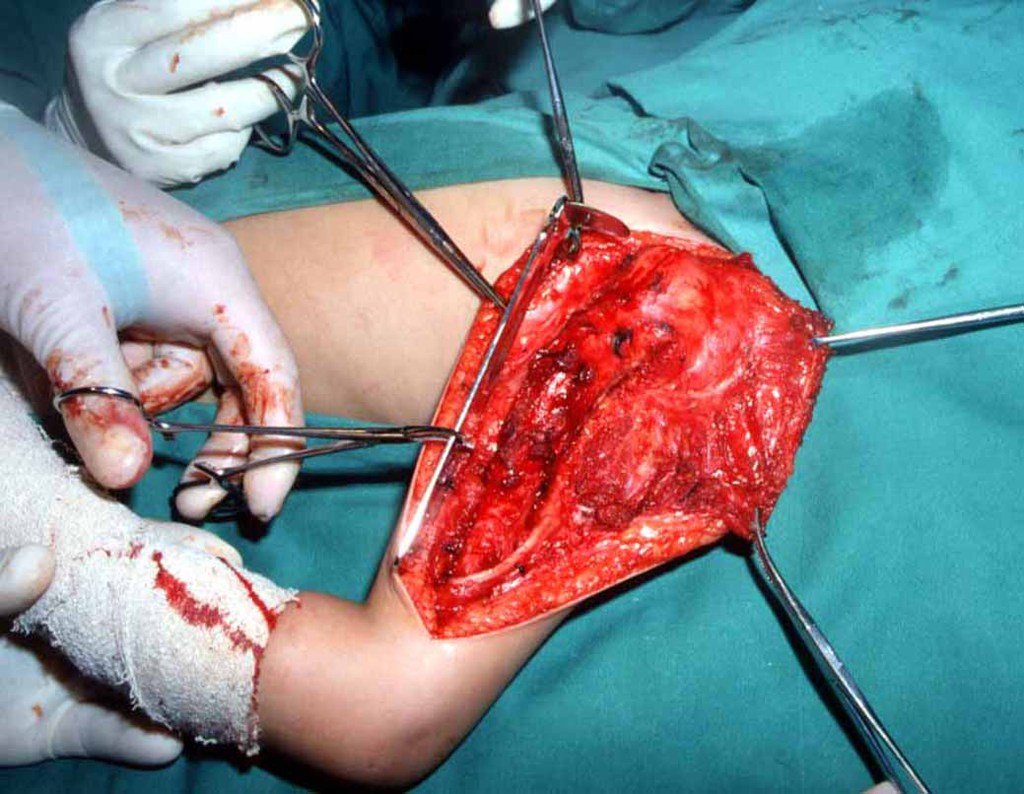
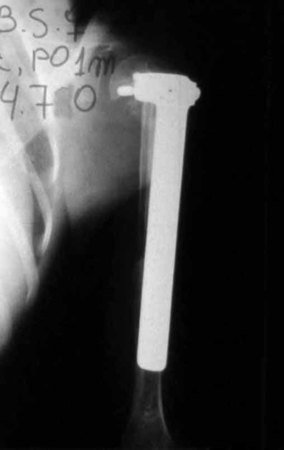
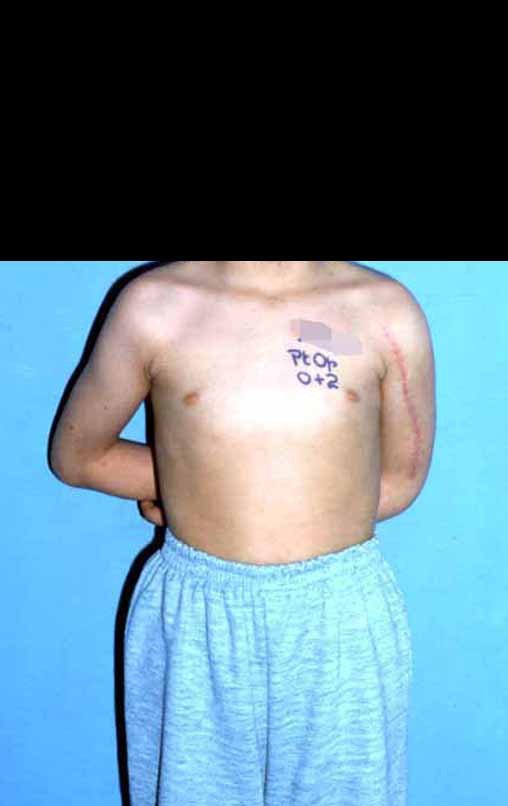
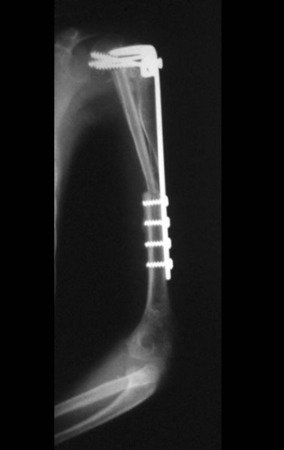
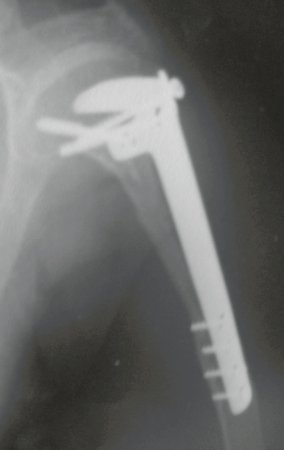
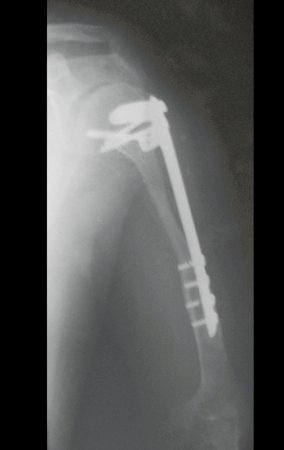
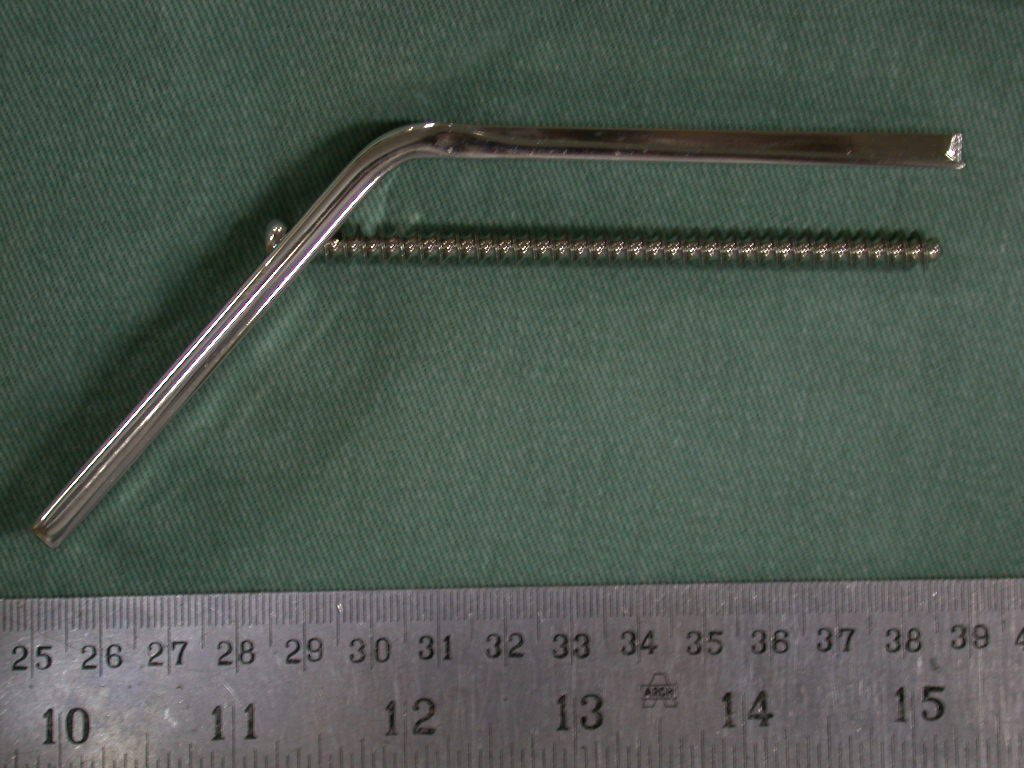
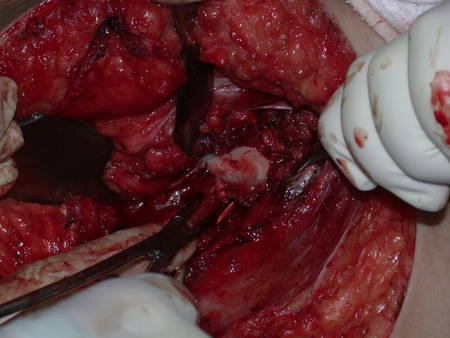
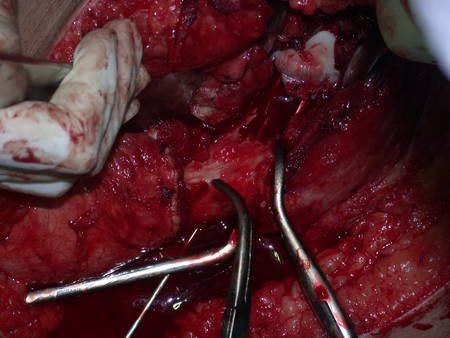
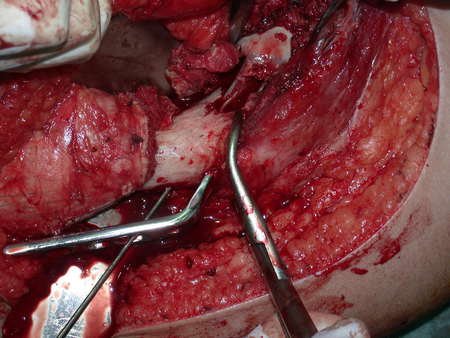
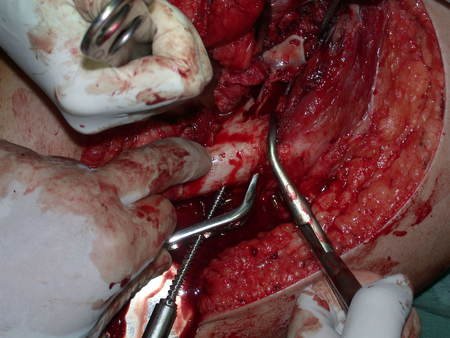
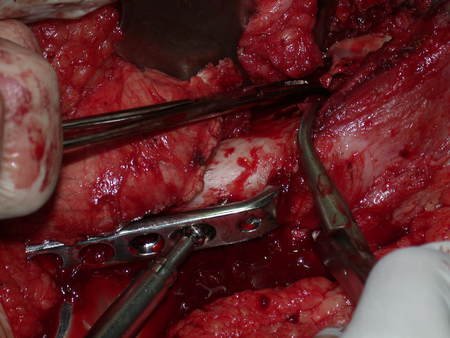
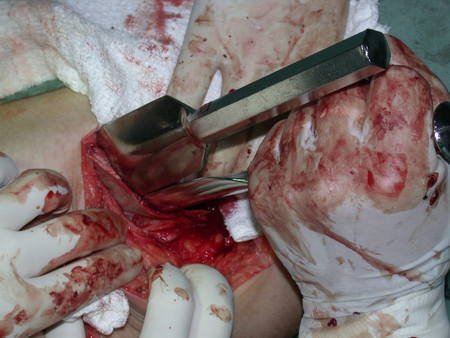
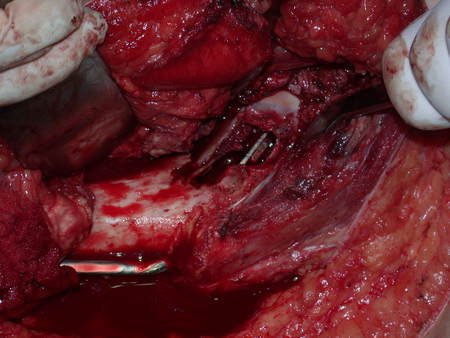
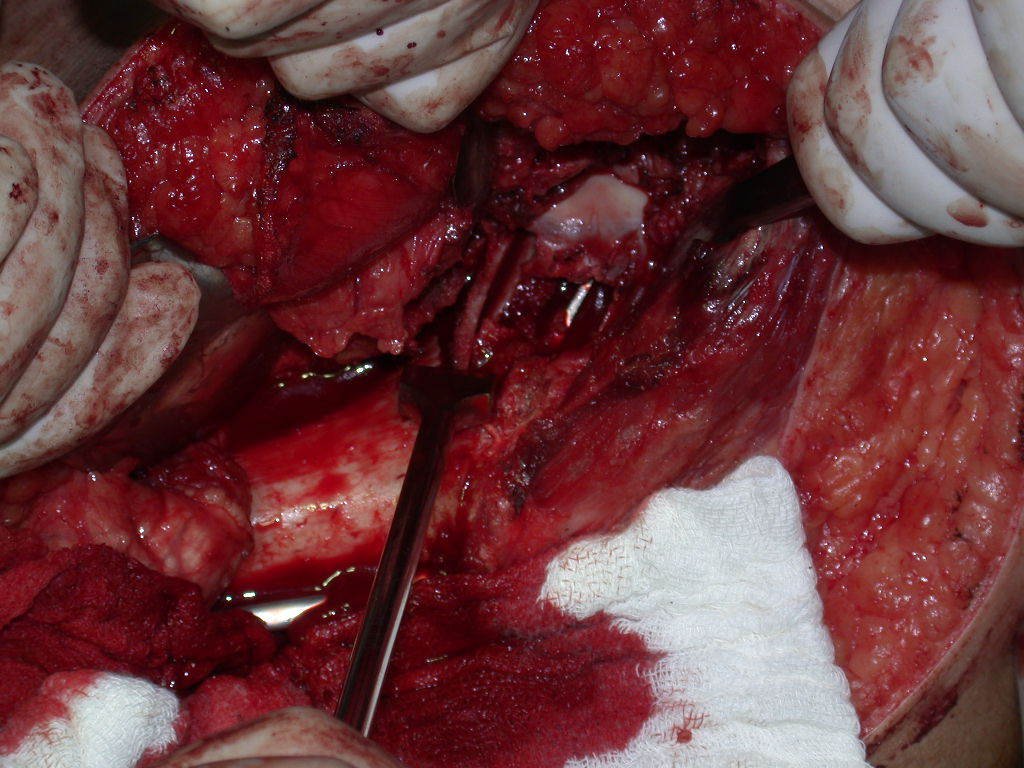
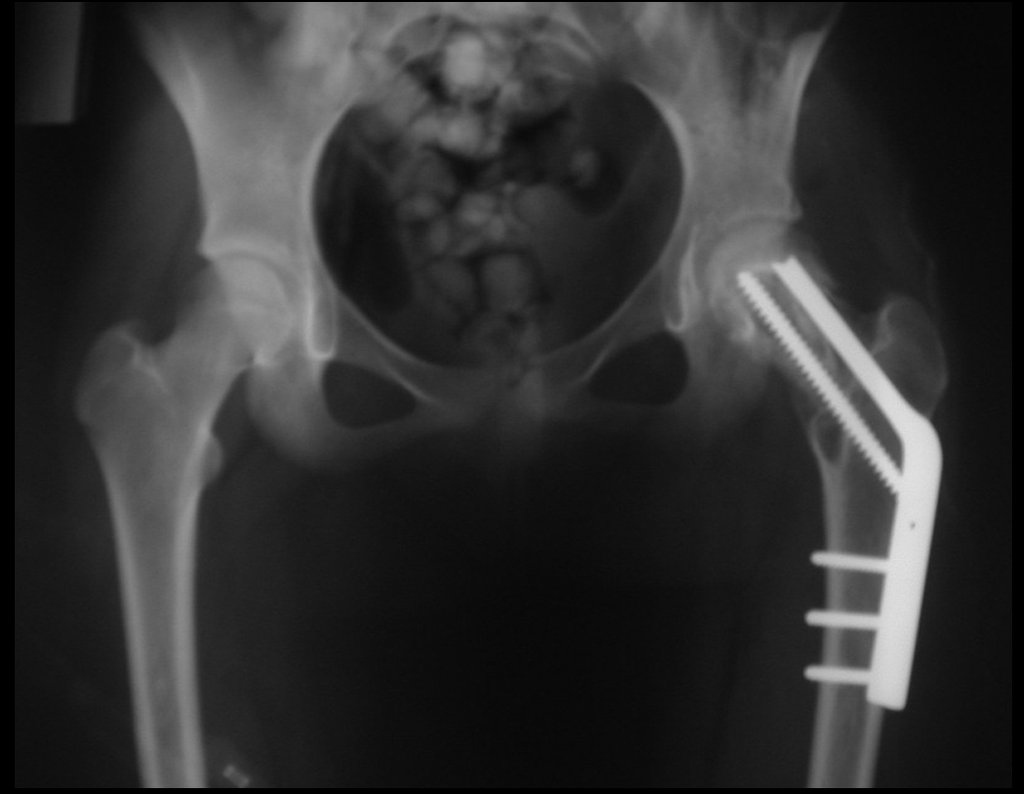
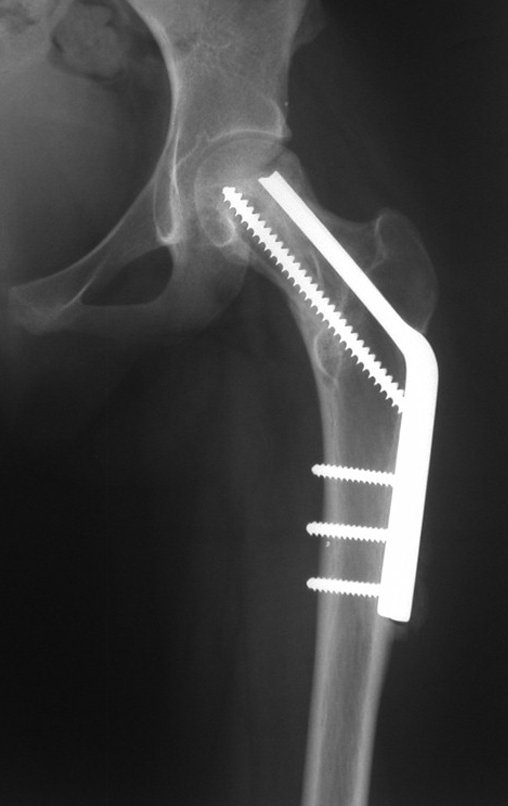
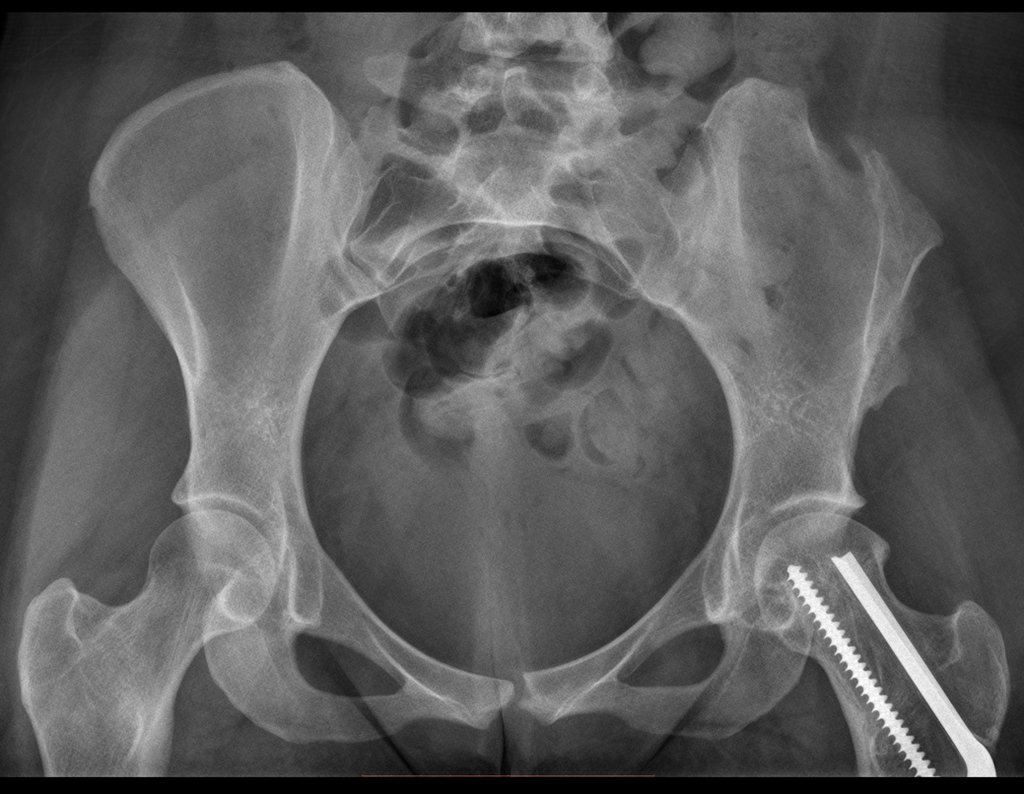
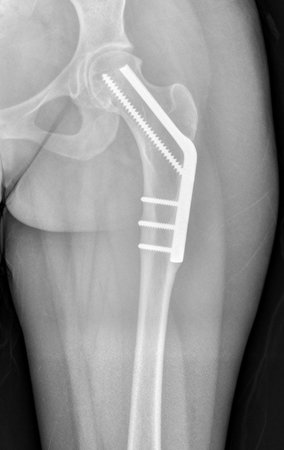
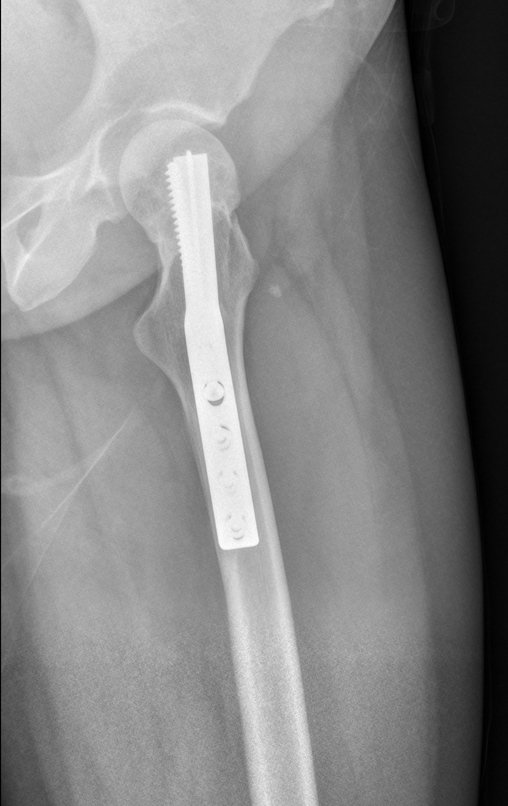
Radioterapia – Técnica de resección de metástasis ósea de un tumor renal en fémur – Reconstrucción con endoprótesis de polietileno
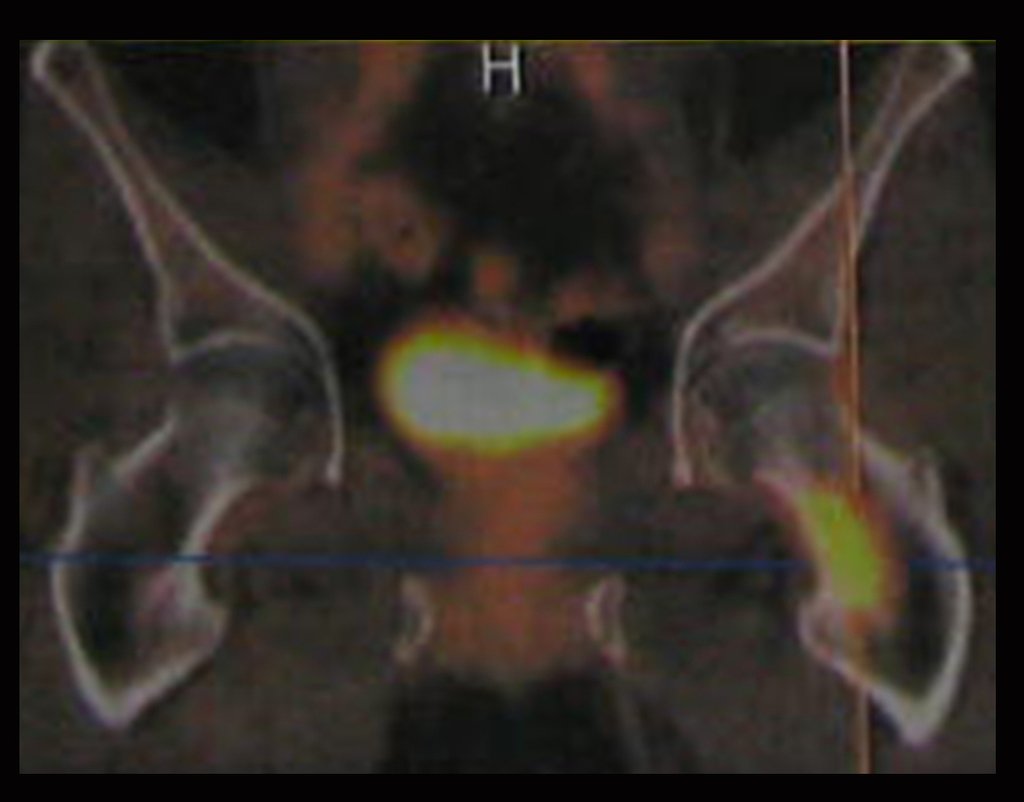
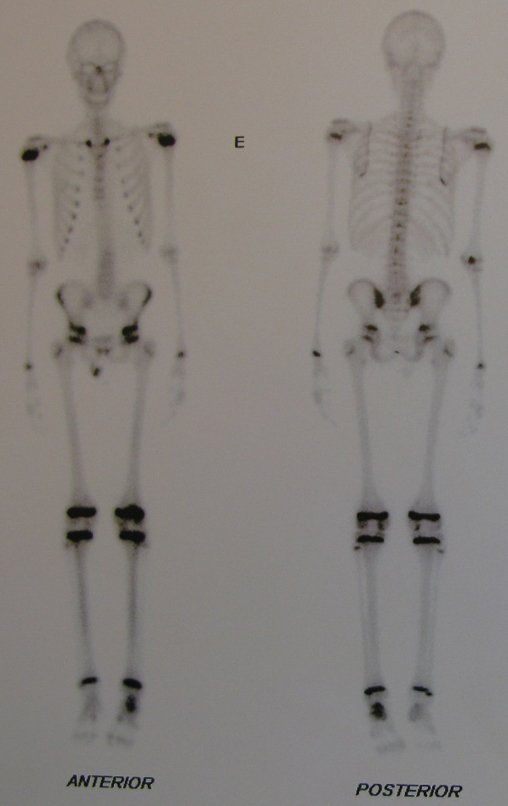
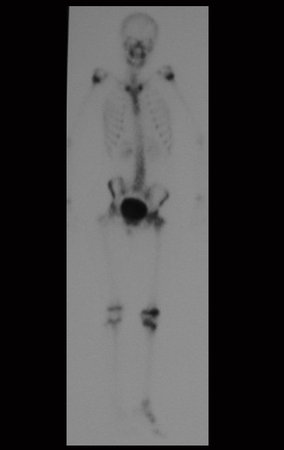
El 23/02/2015, luego de la evaluación clínica y las imágenes disponibles, solicitamos un examen Pet-Ct, para completar los estudios de imagen y estadificación de la lesión.
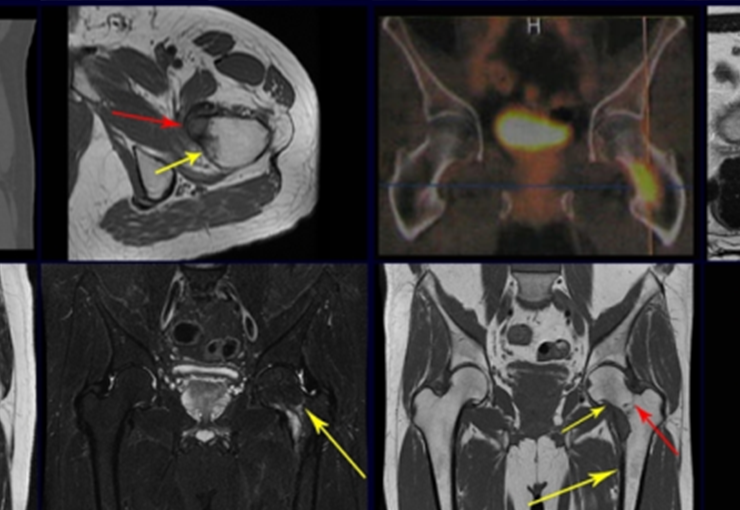
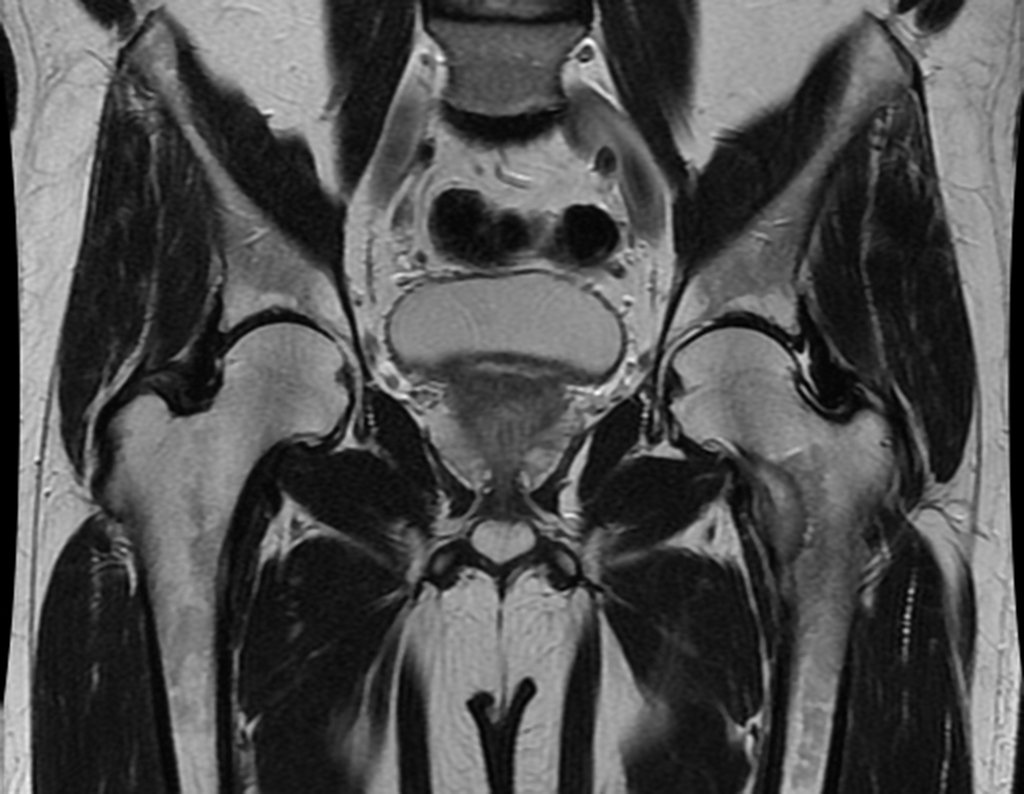
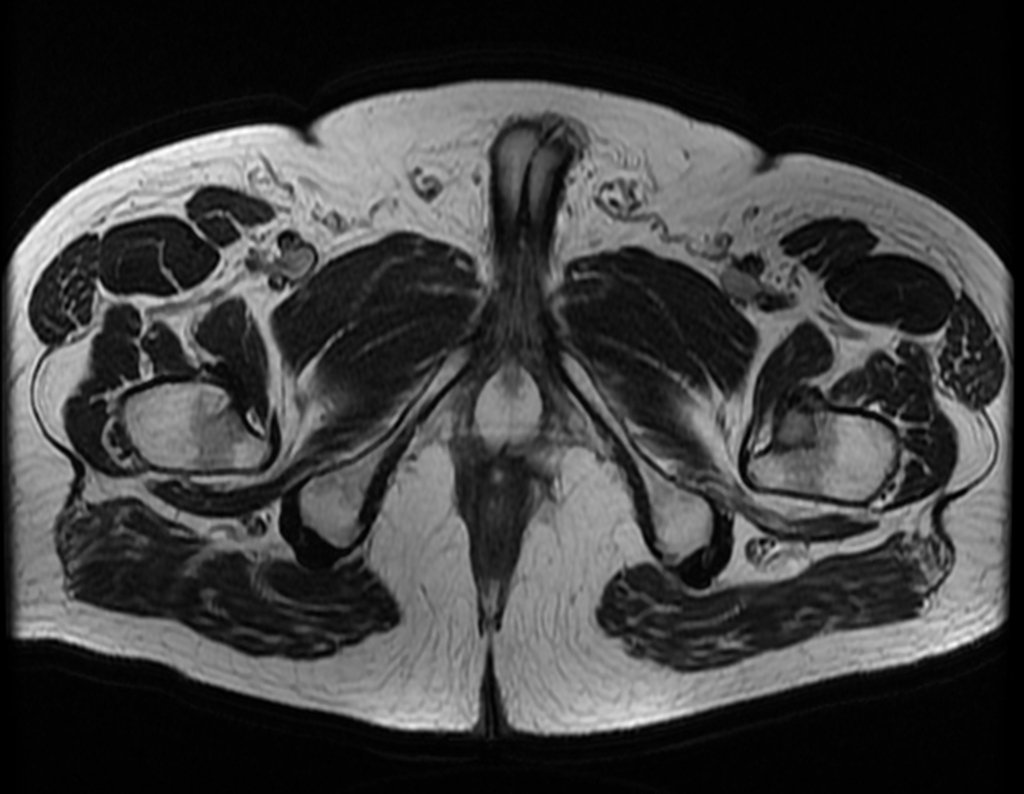
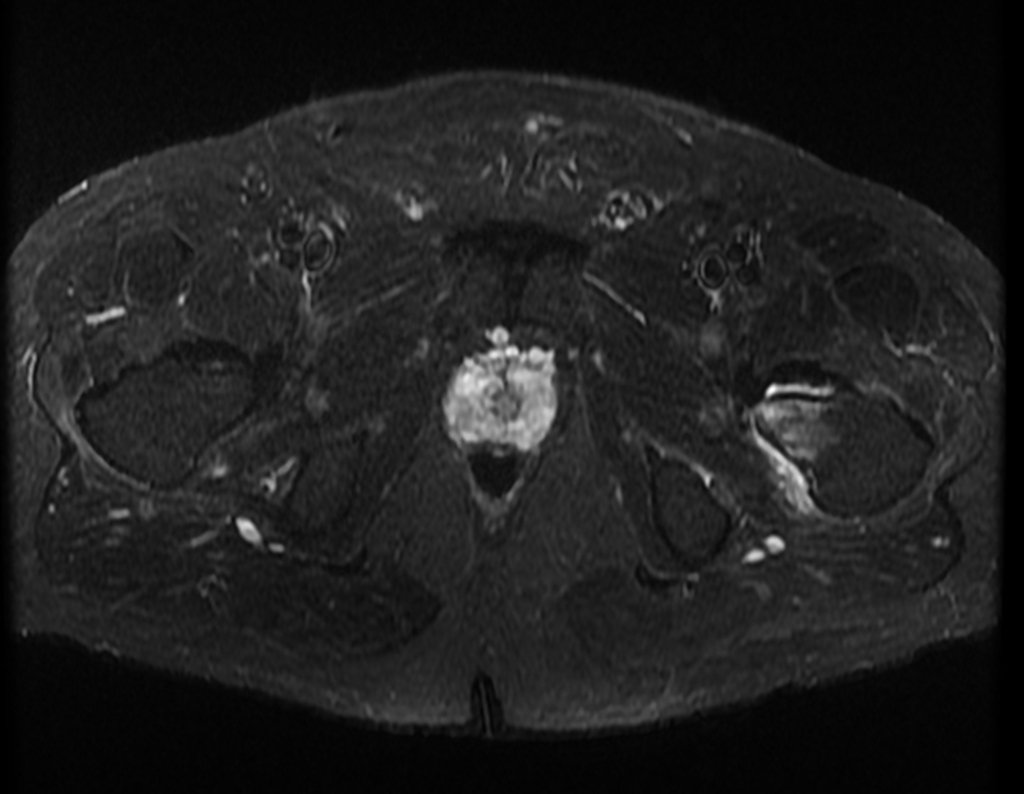
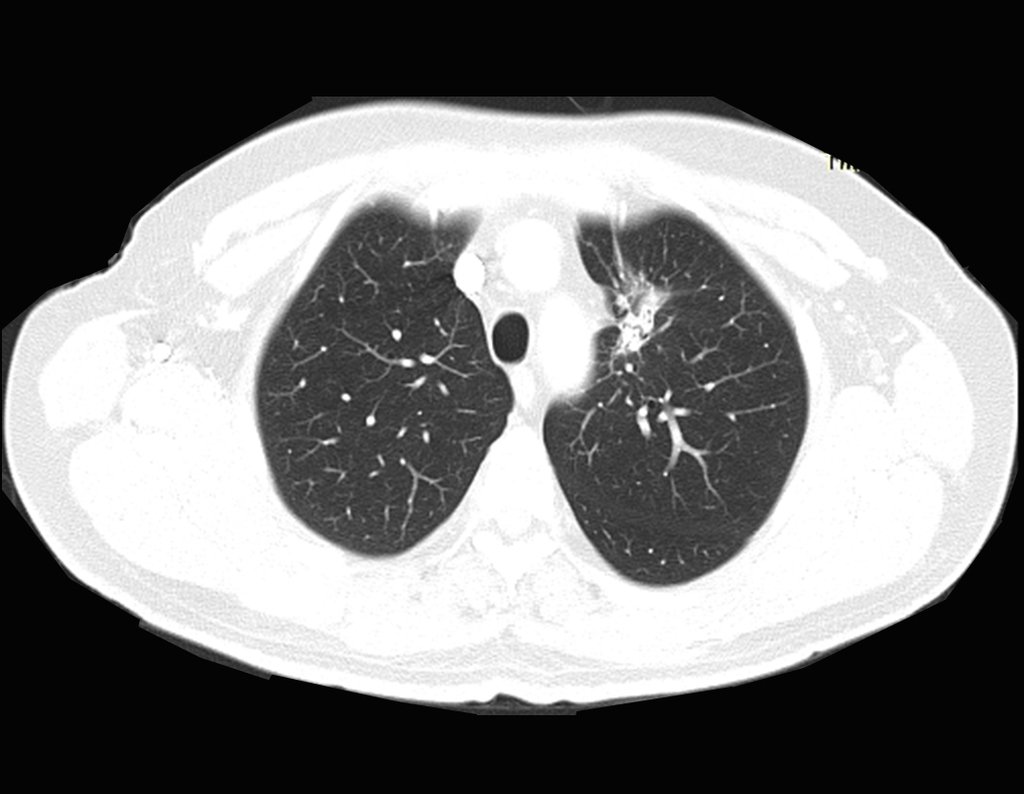
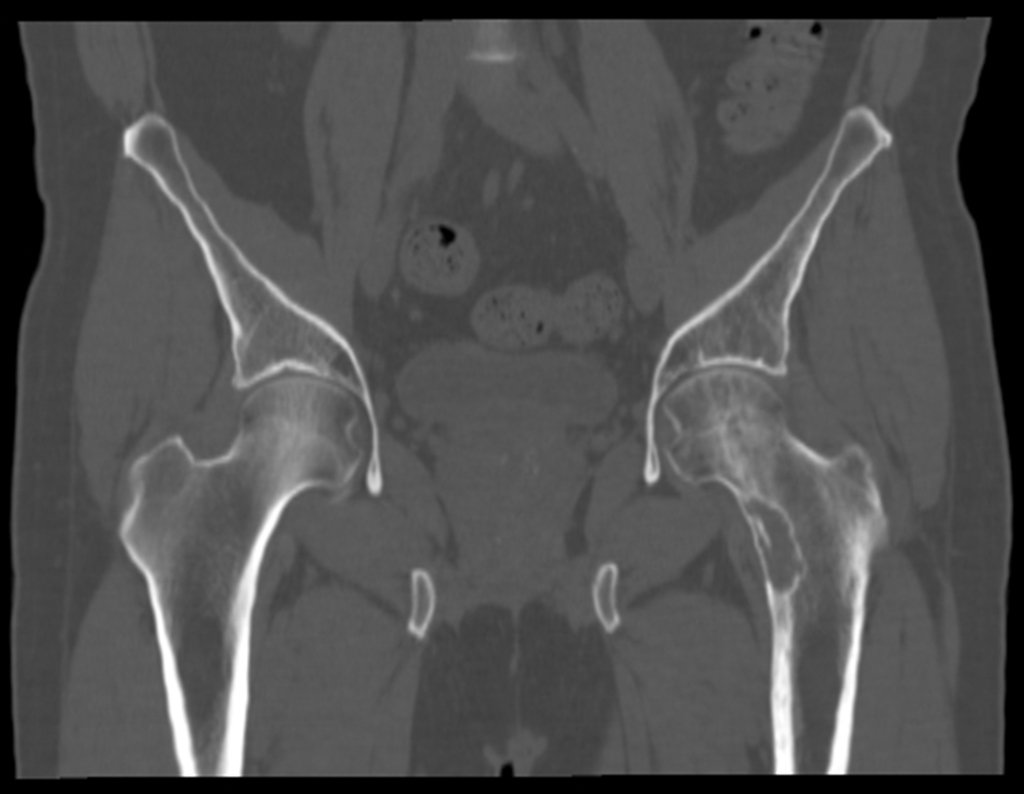
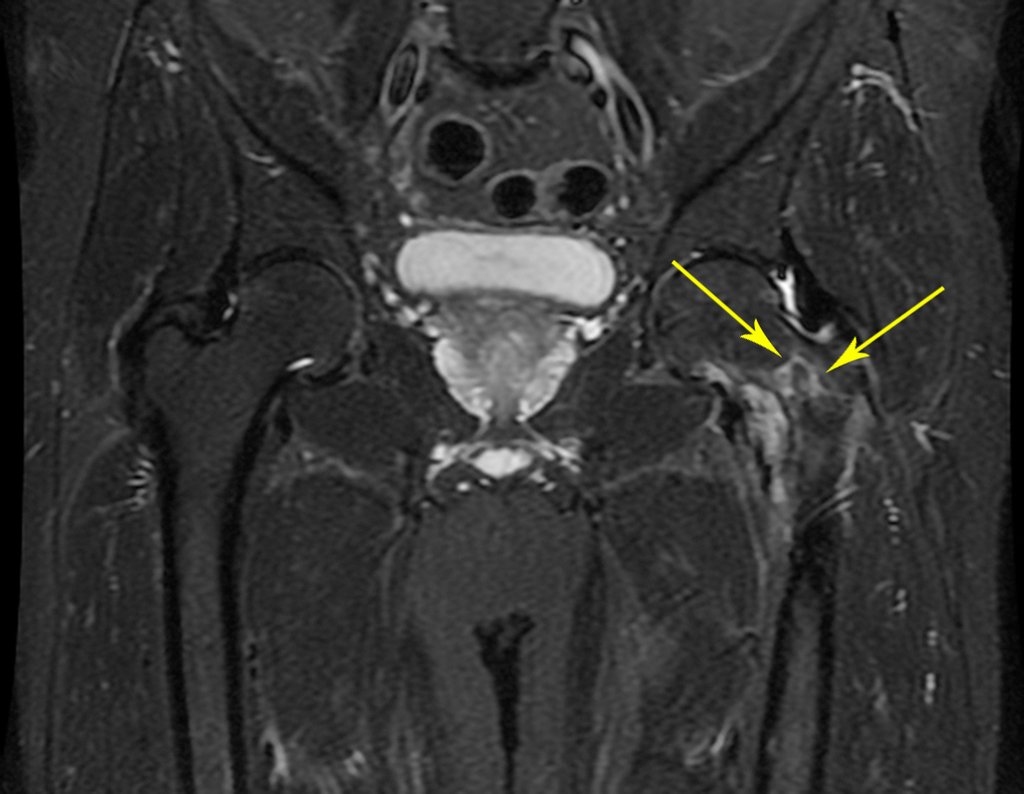
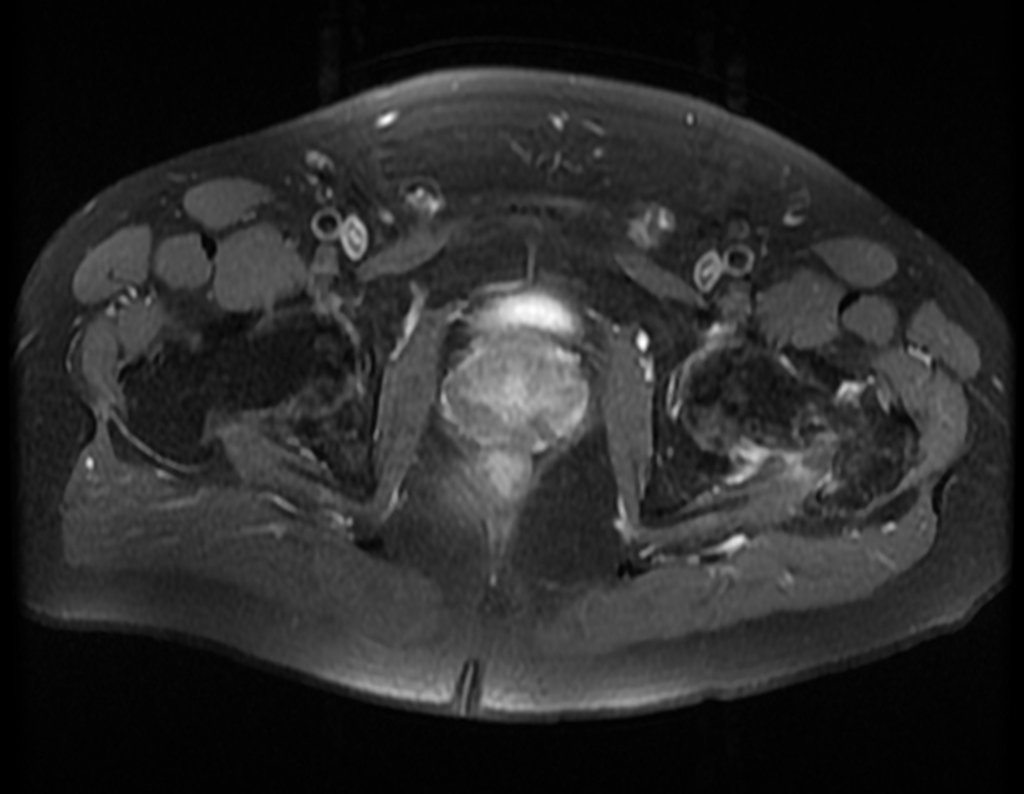
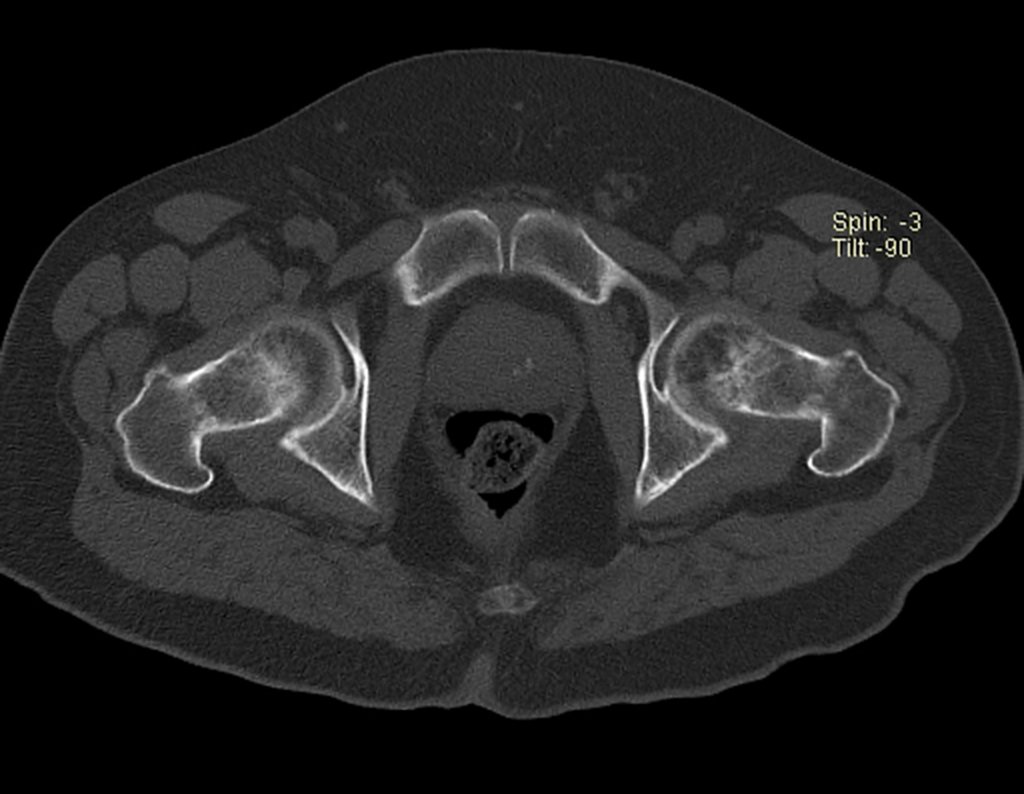
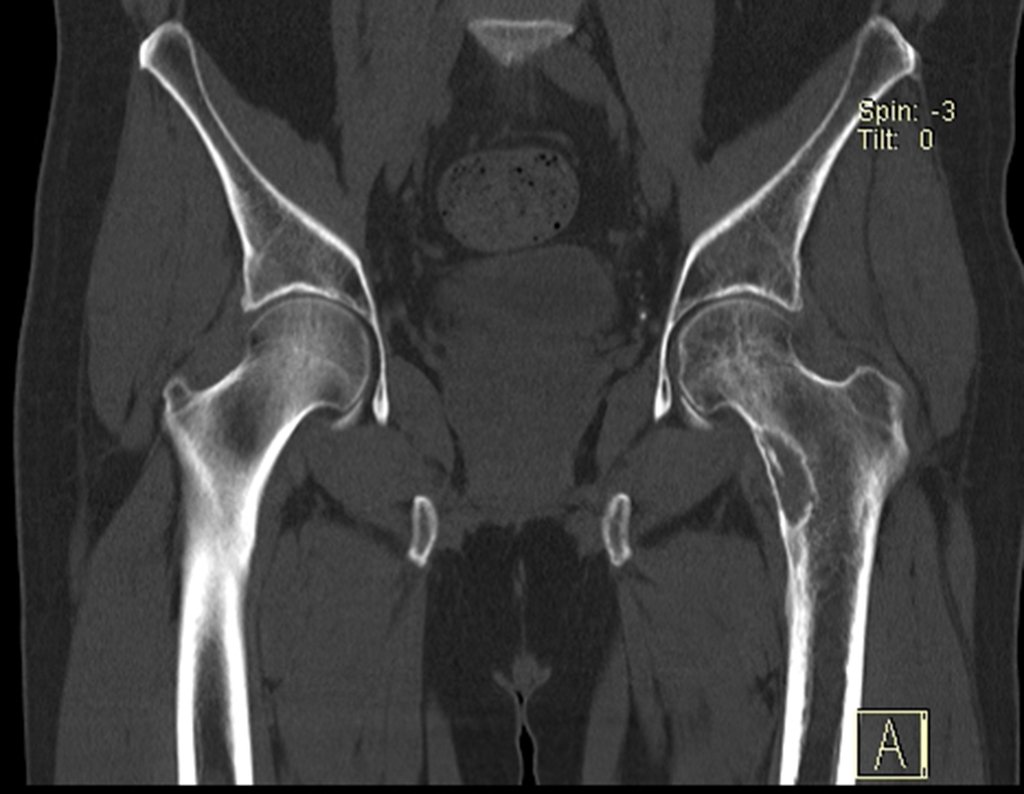
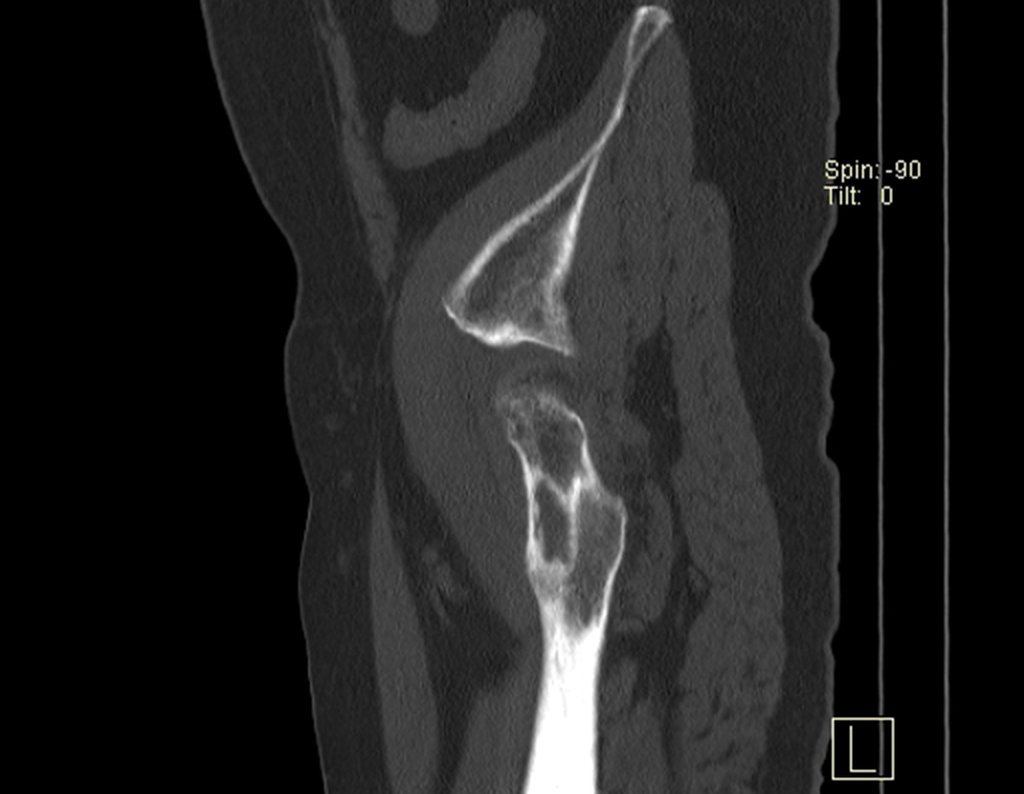
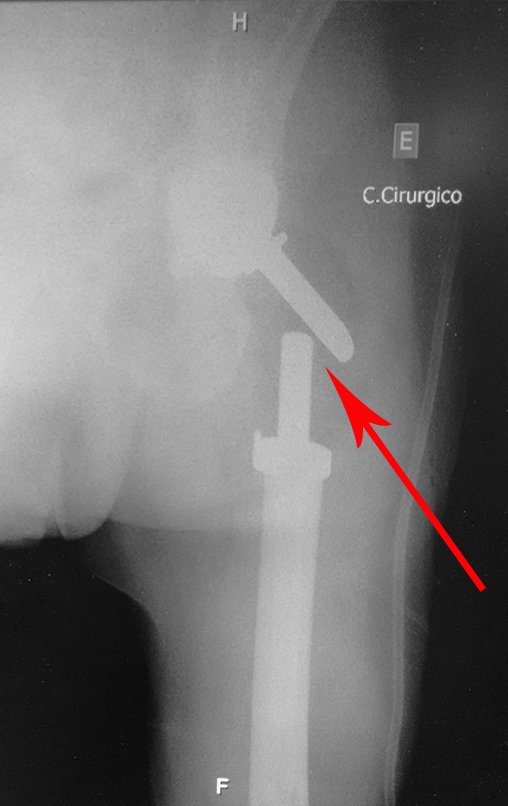
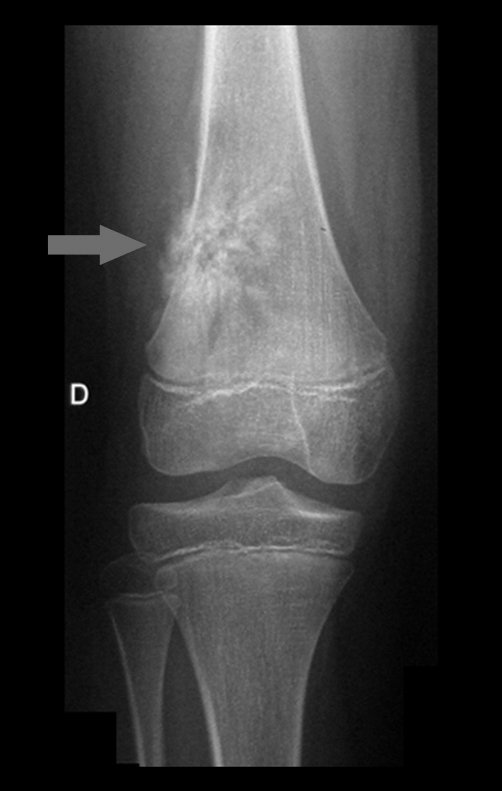
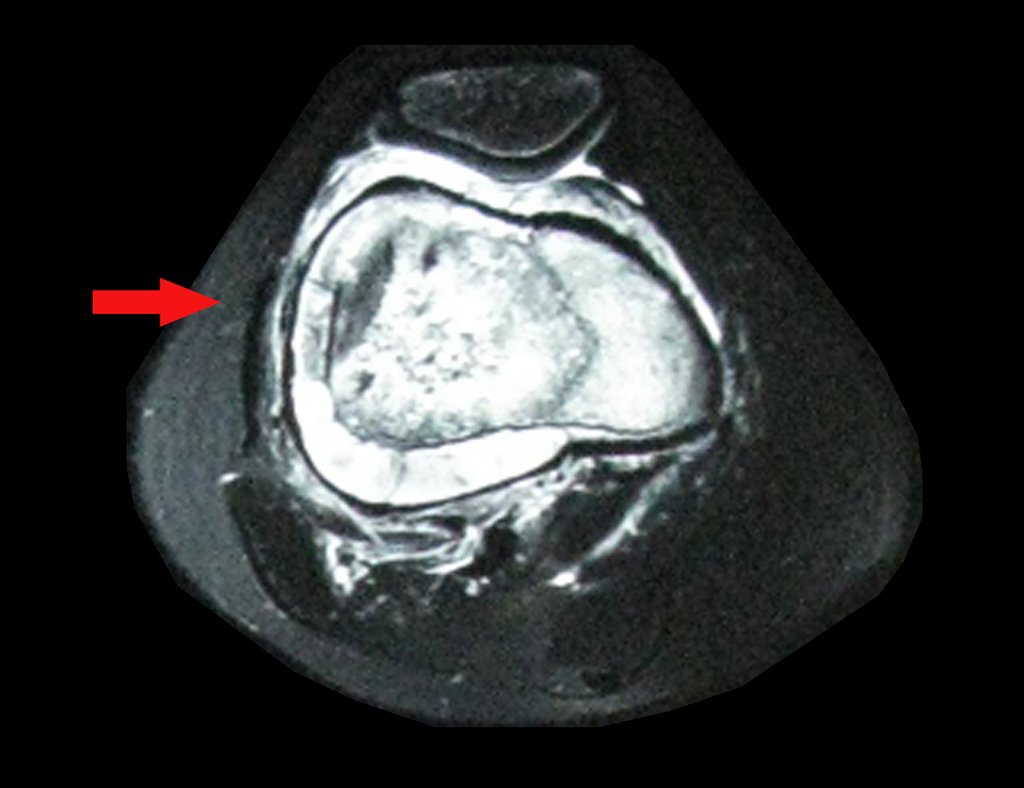
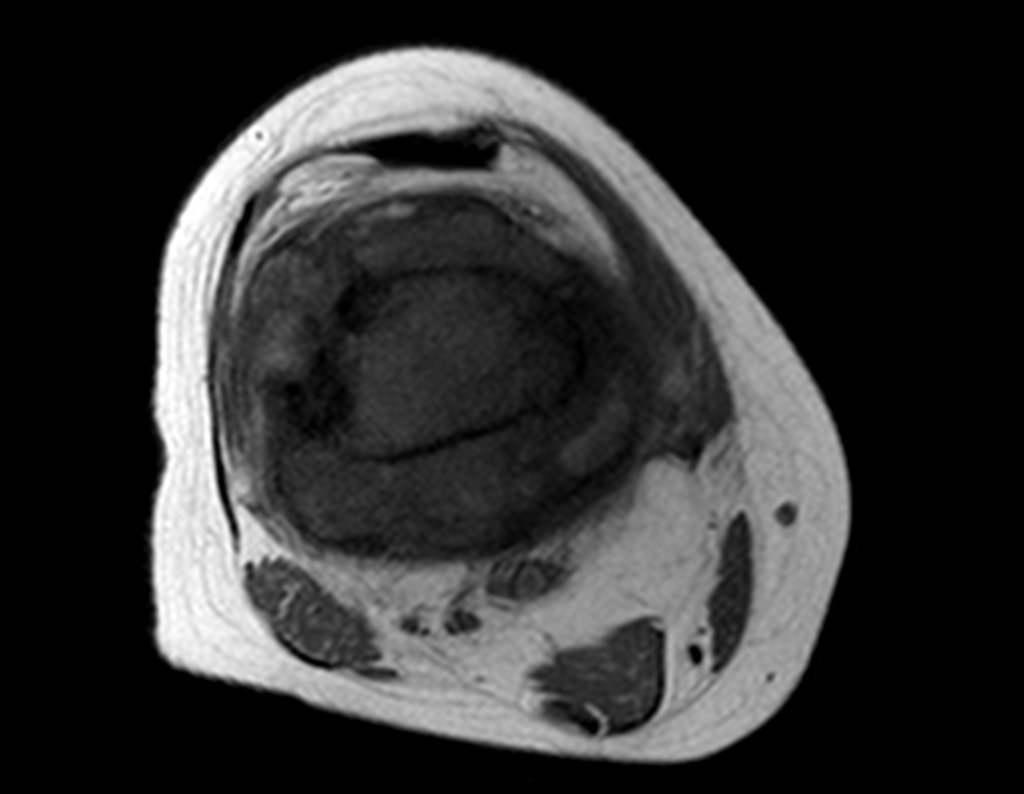
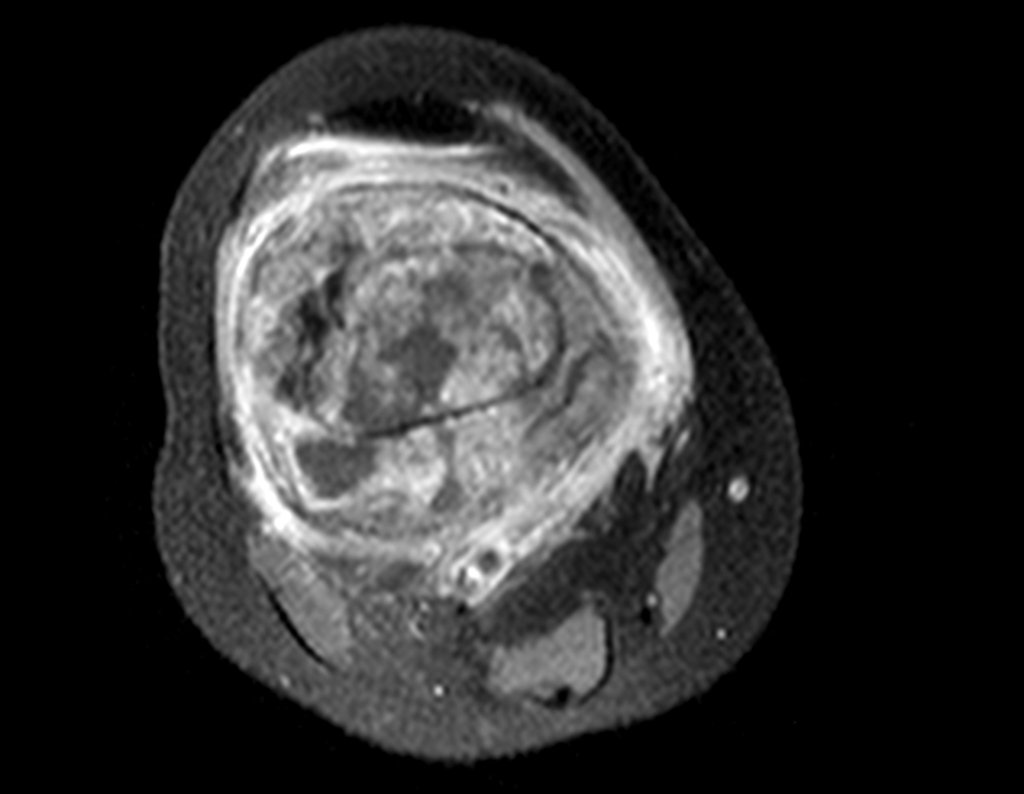
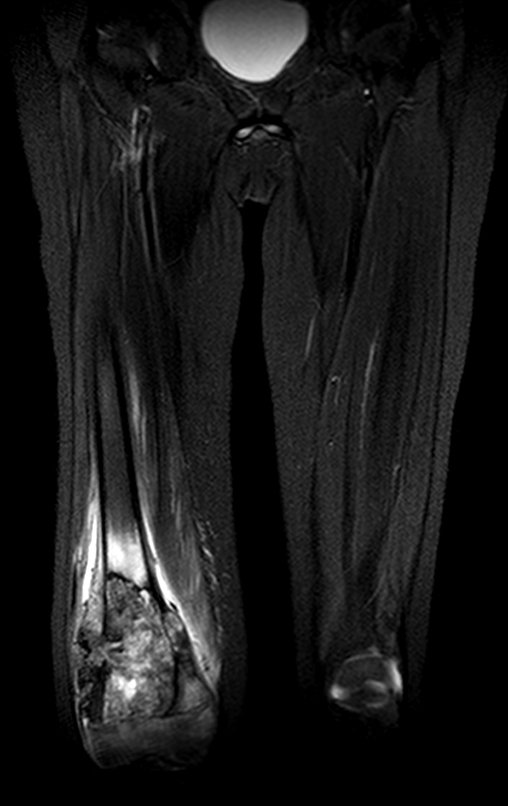
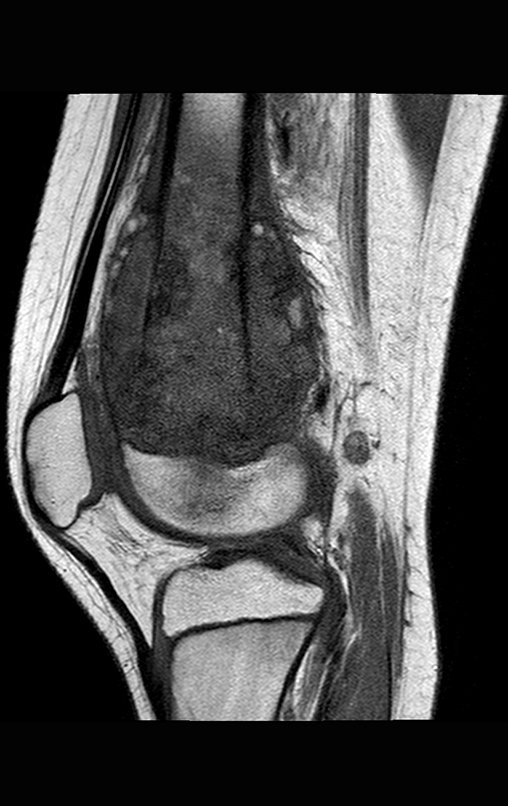
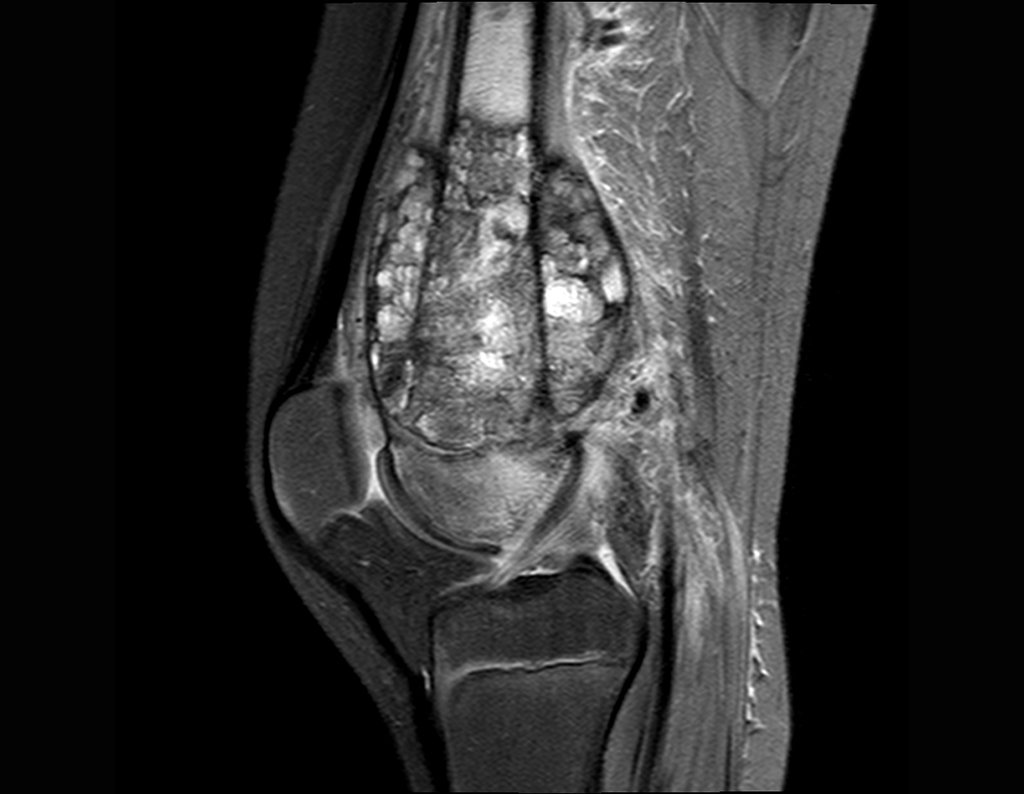
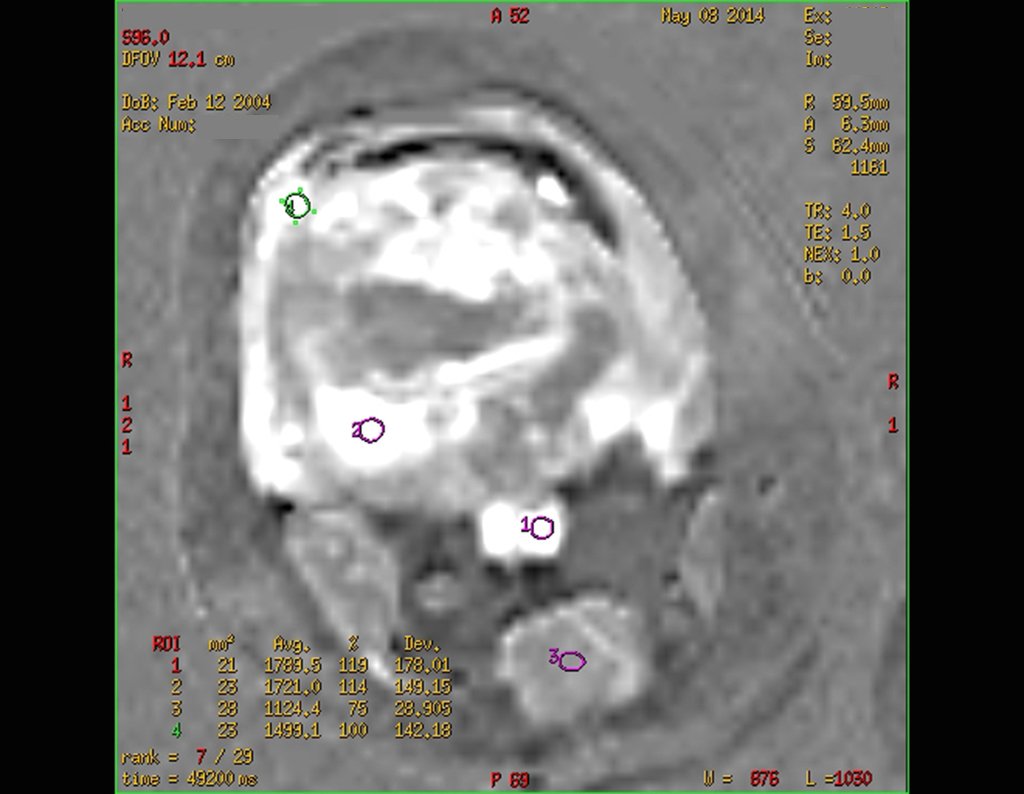
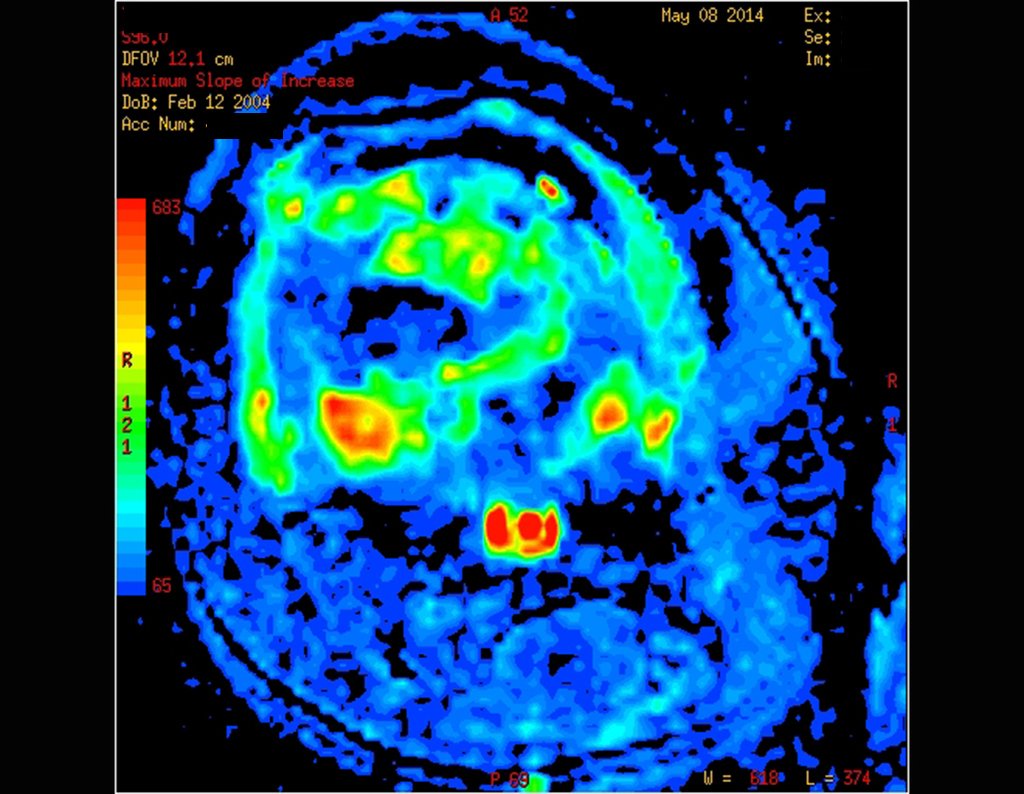
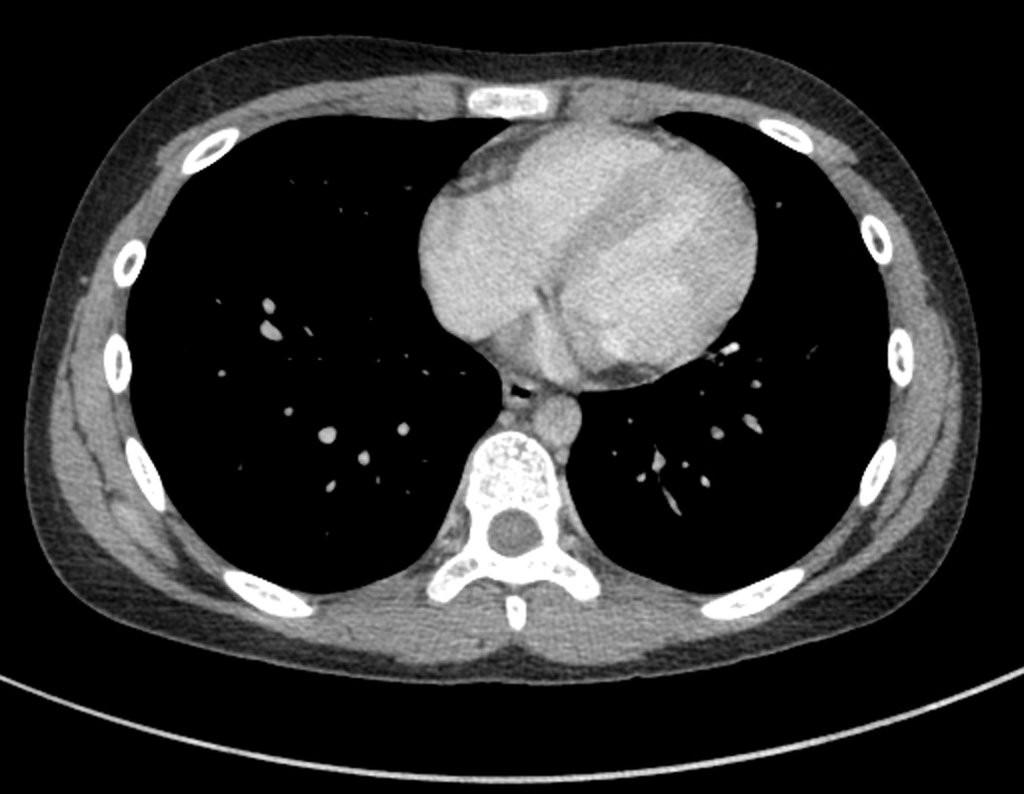
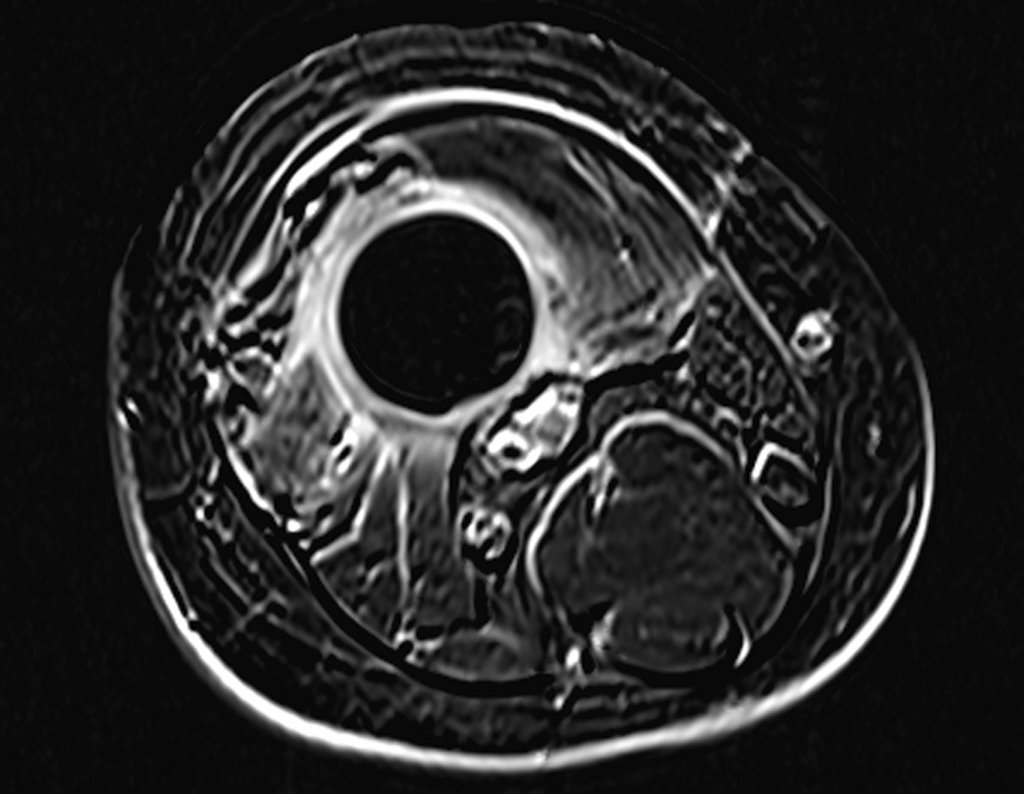
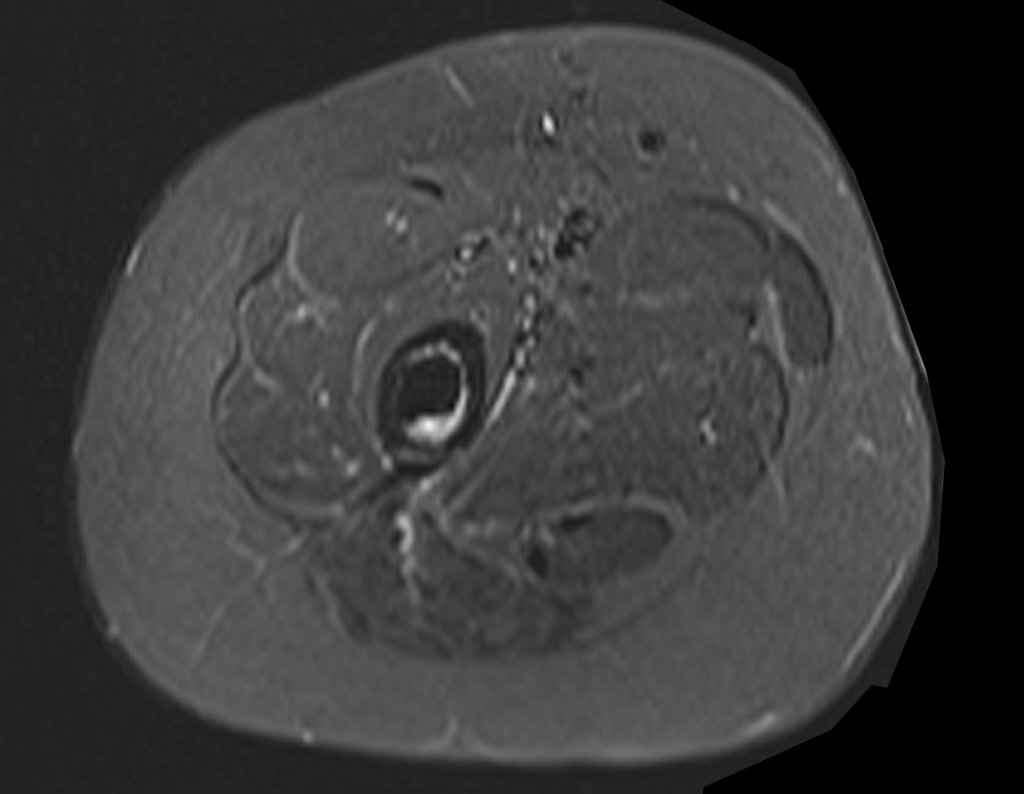
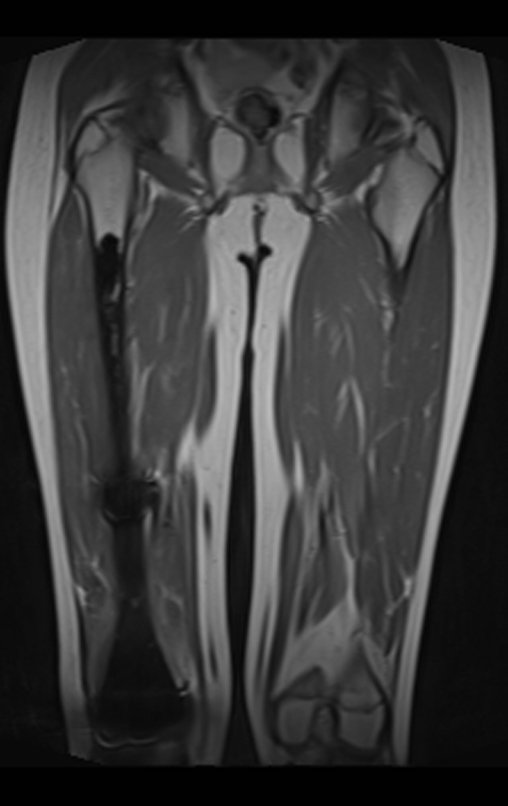
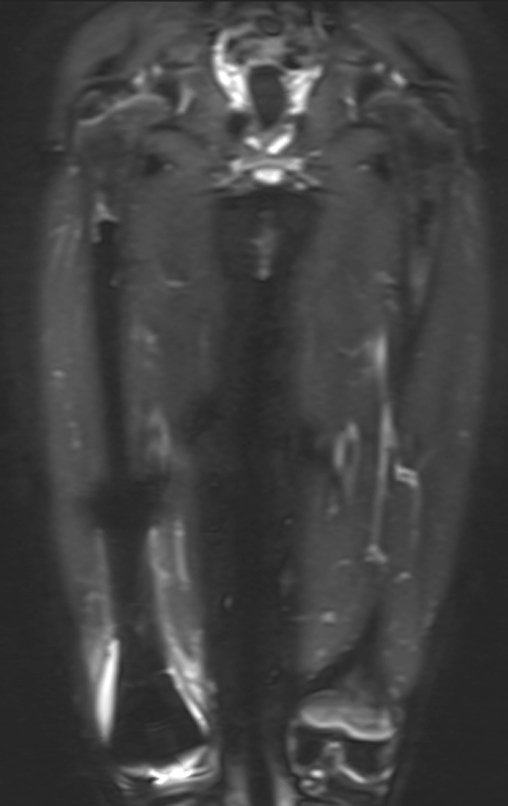
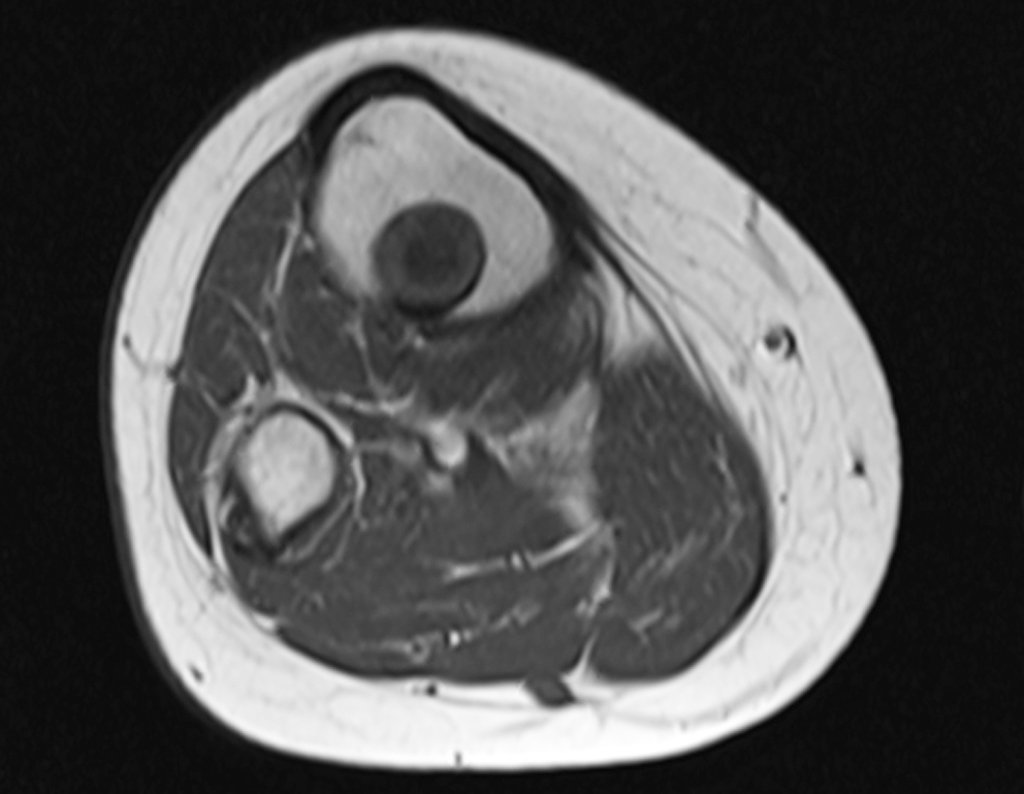
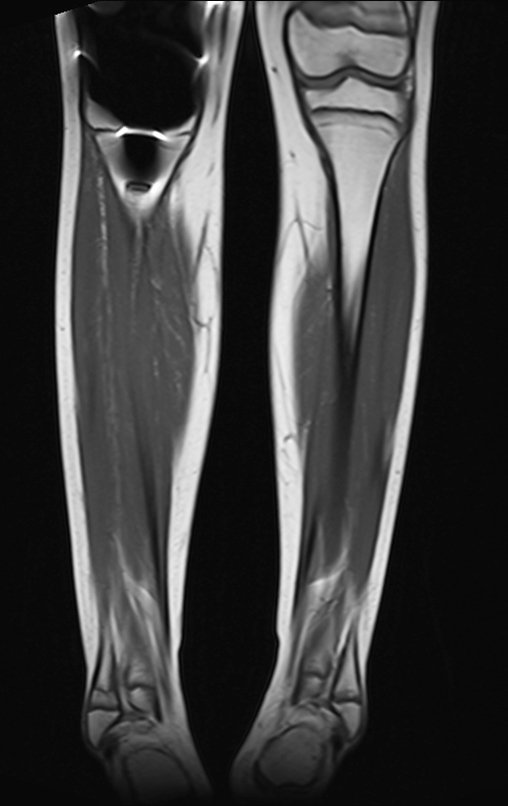
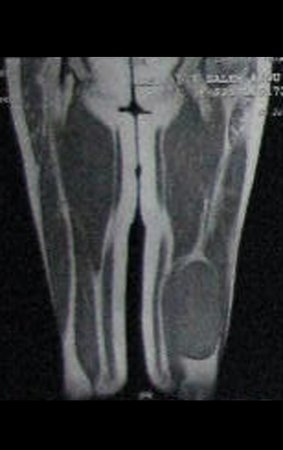
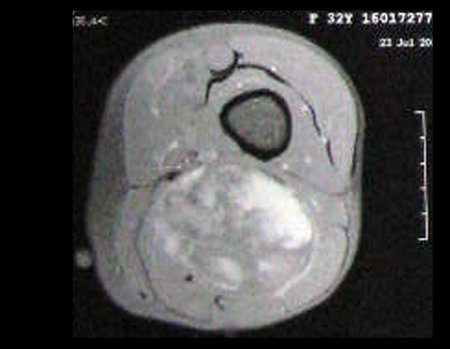
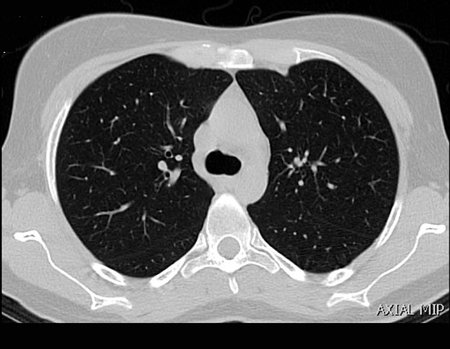
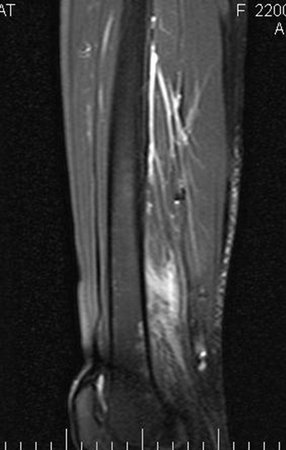
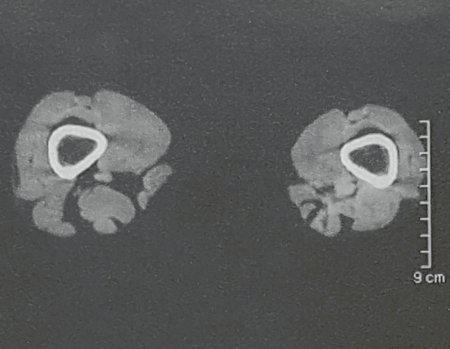
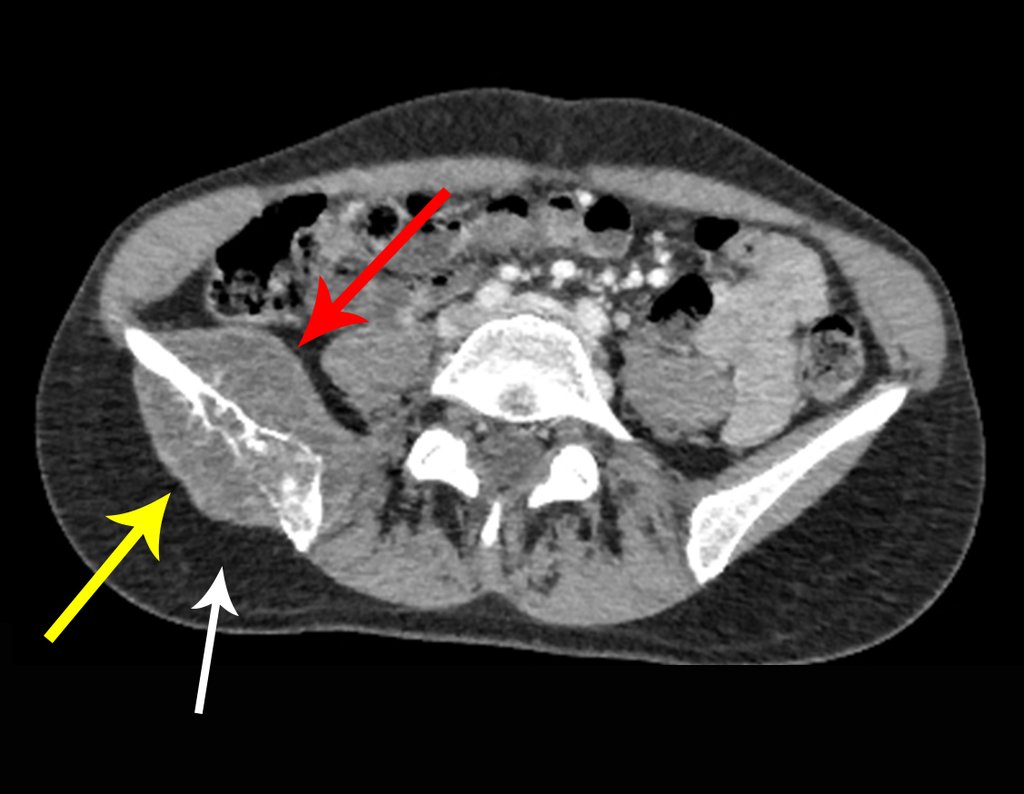
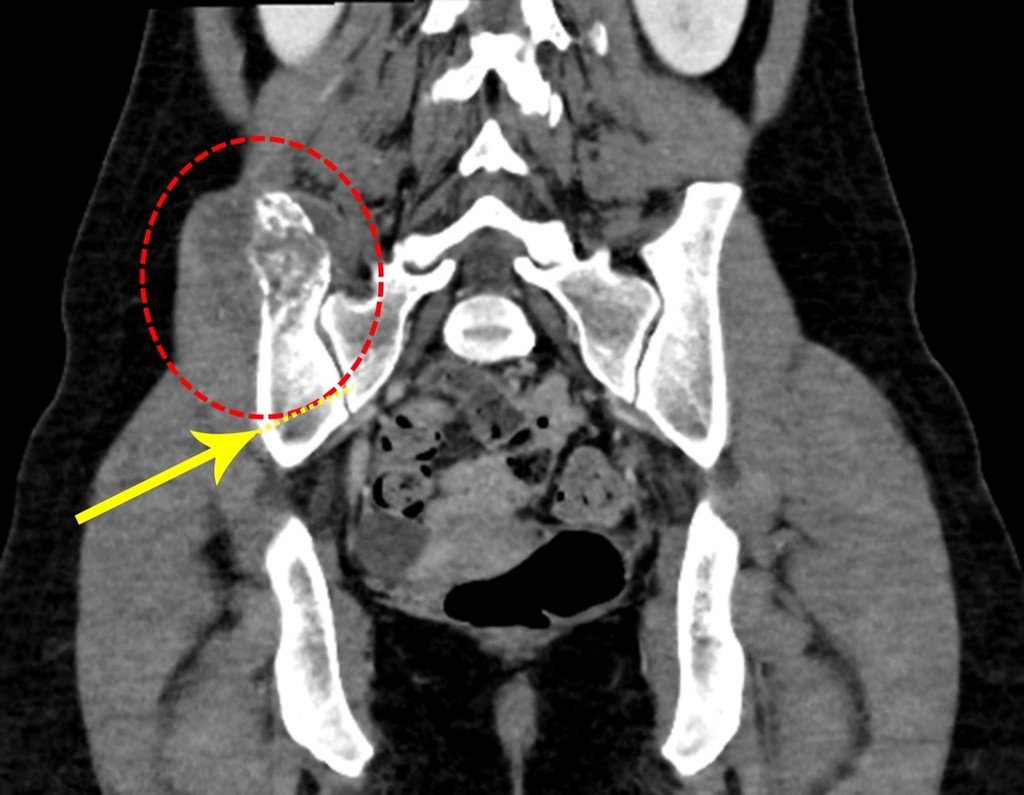
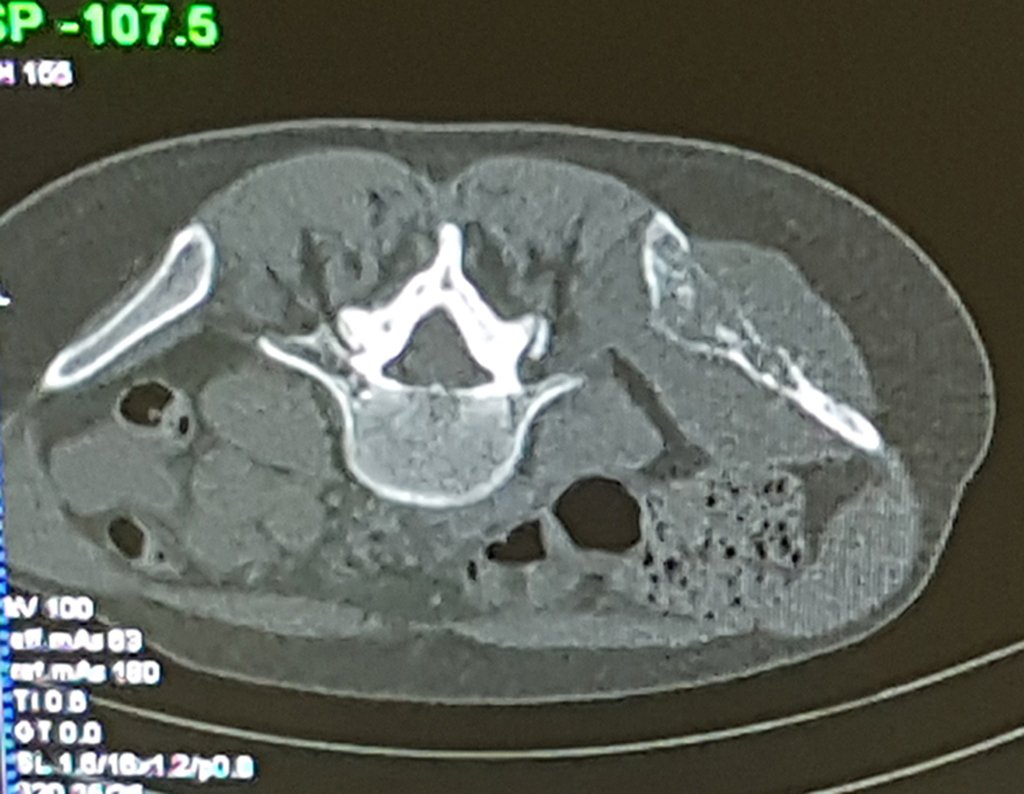
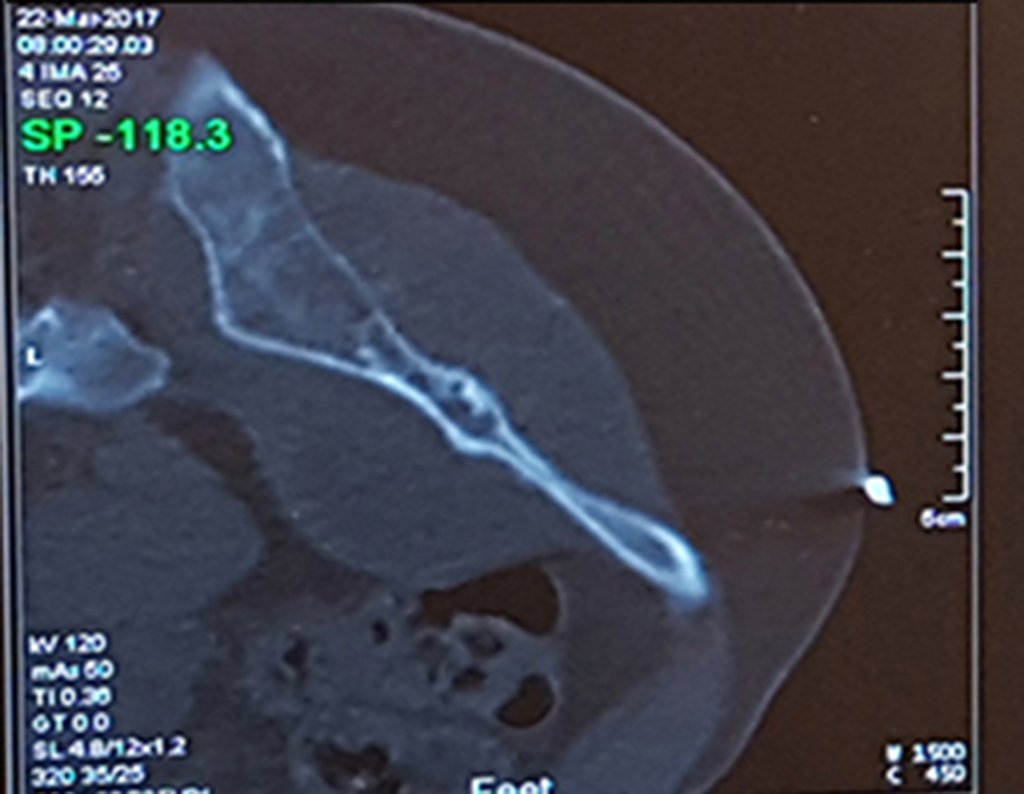
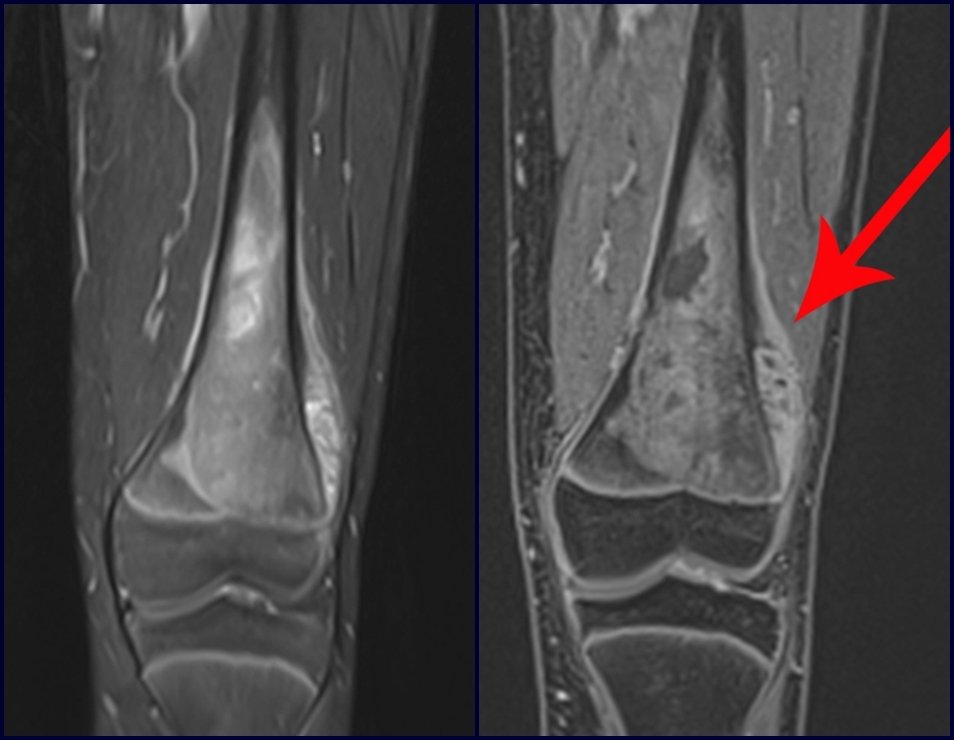
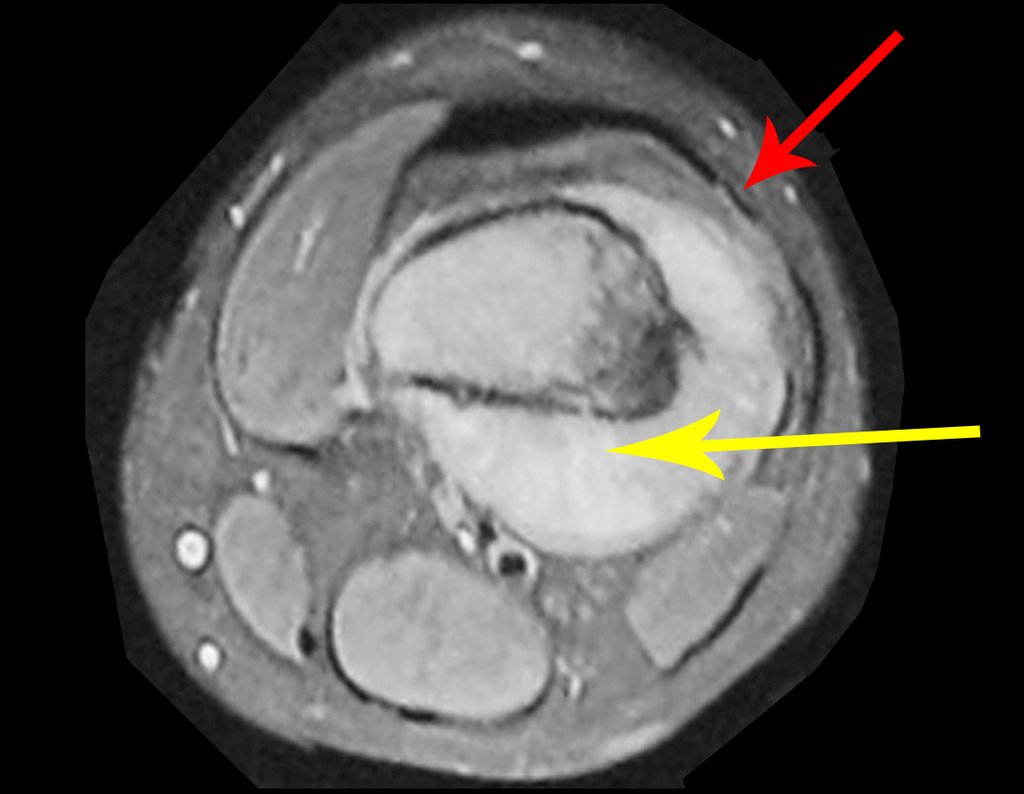
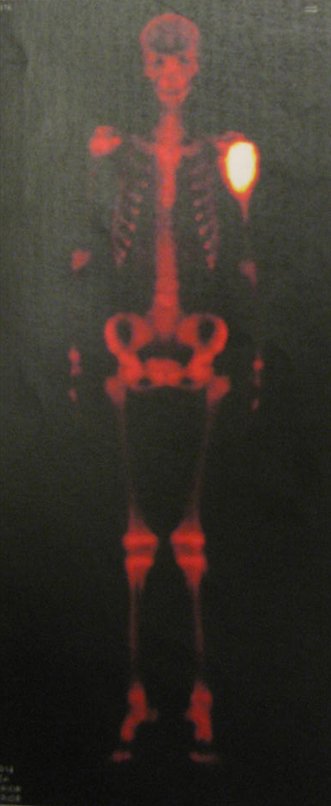
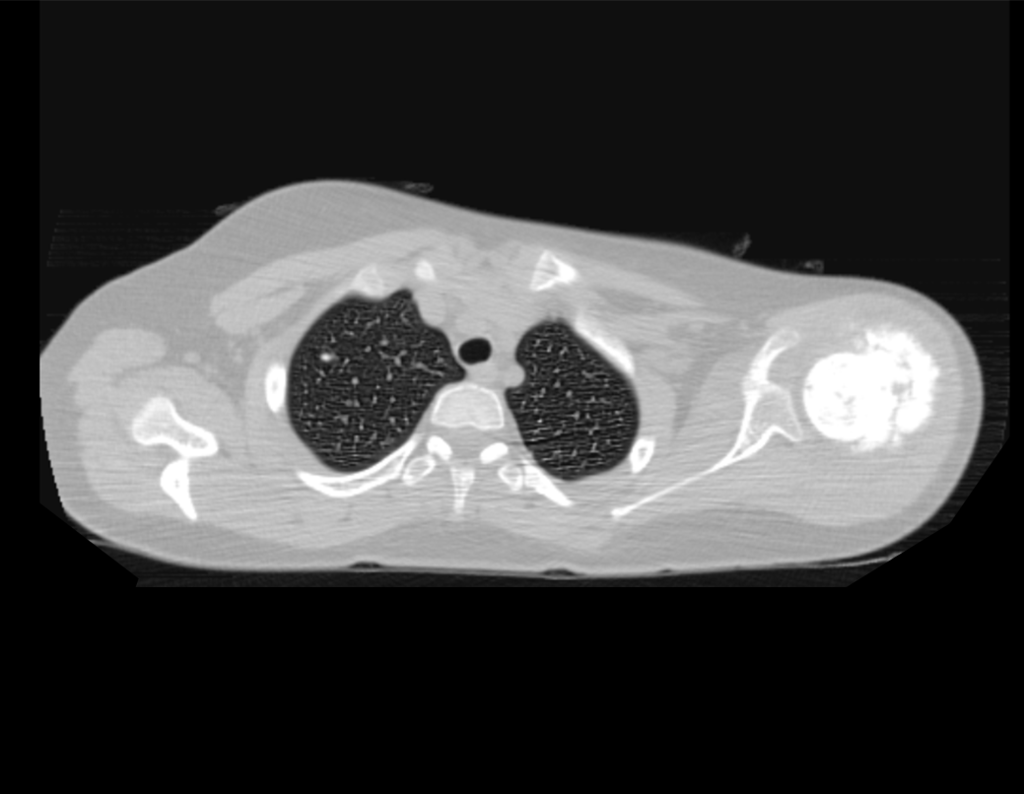
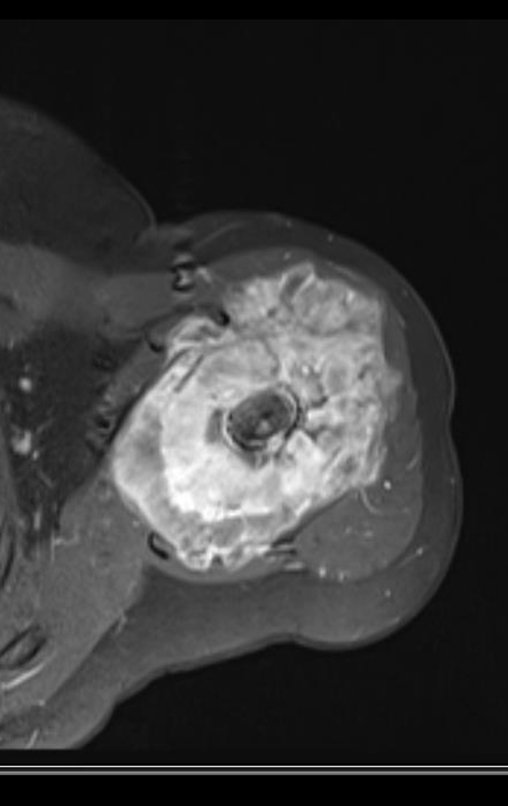
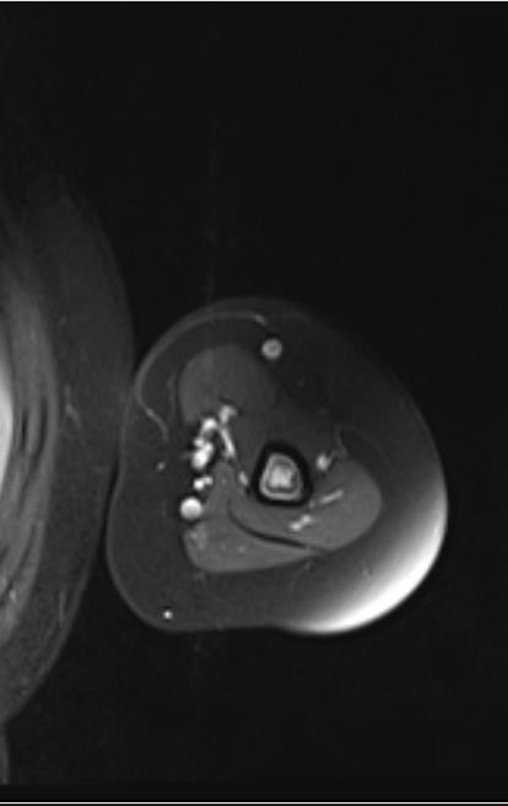
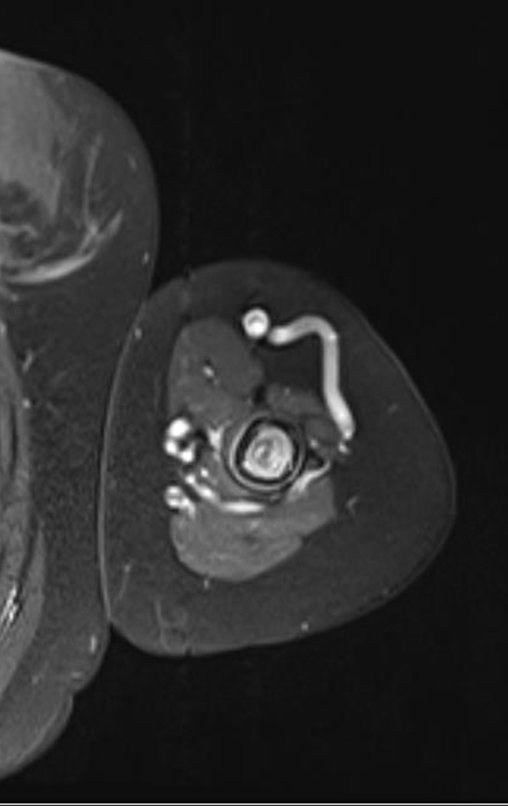
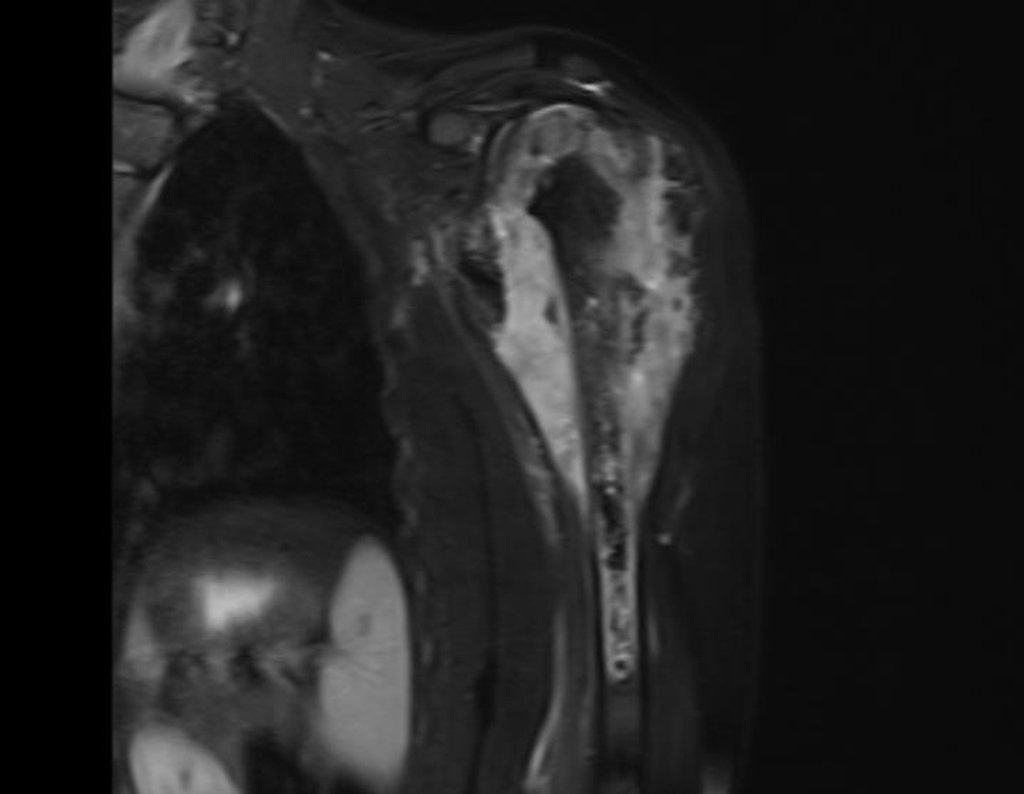
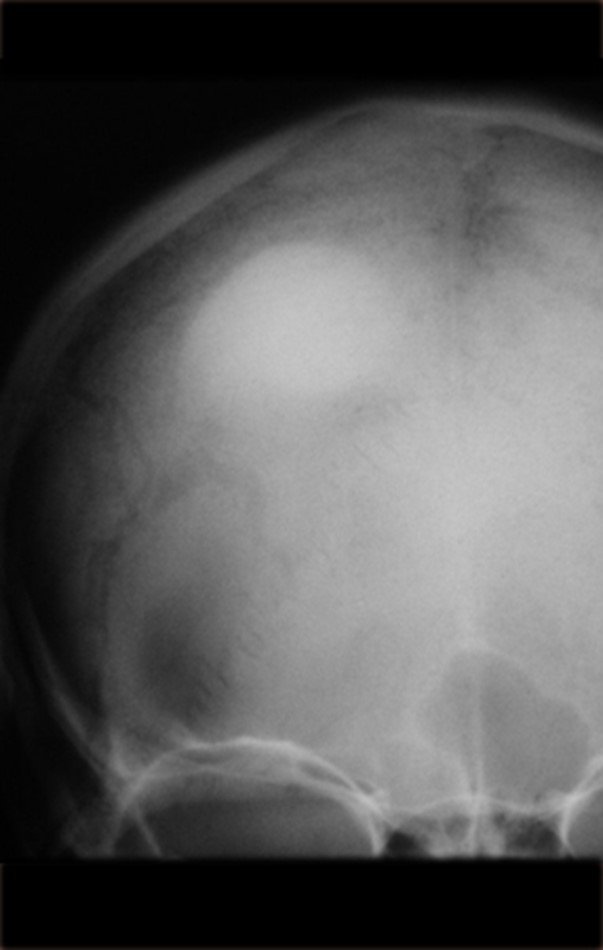
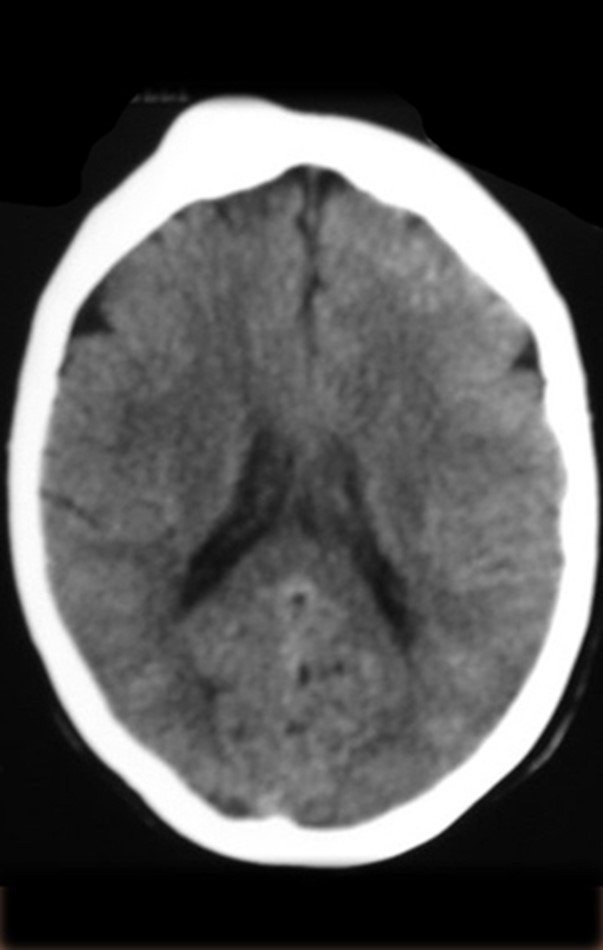
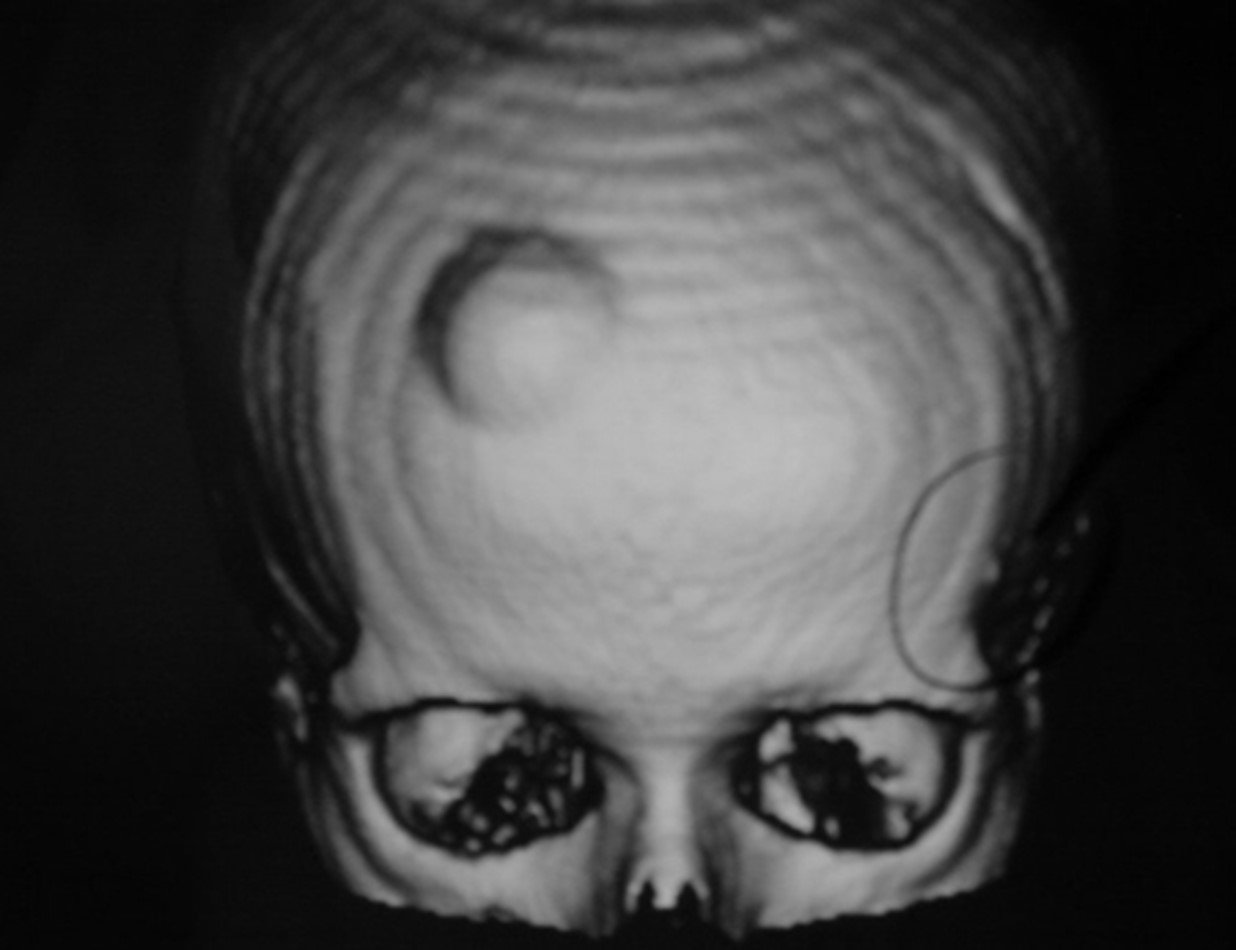
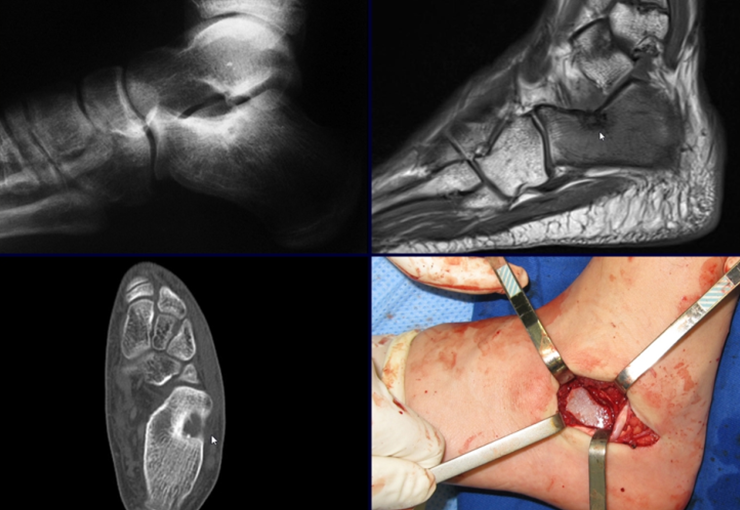
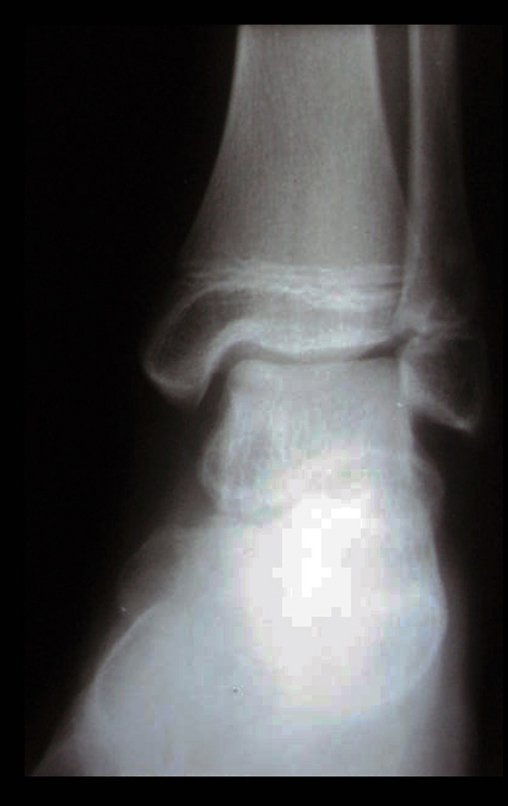
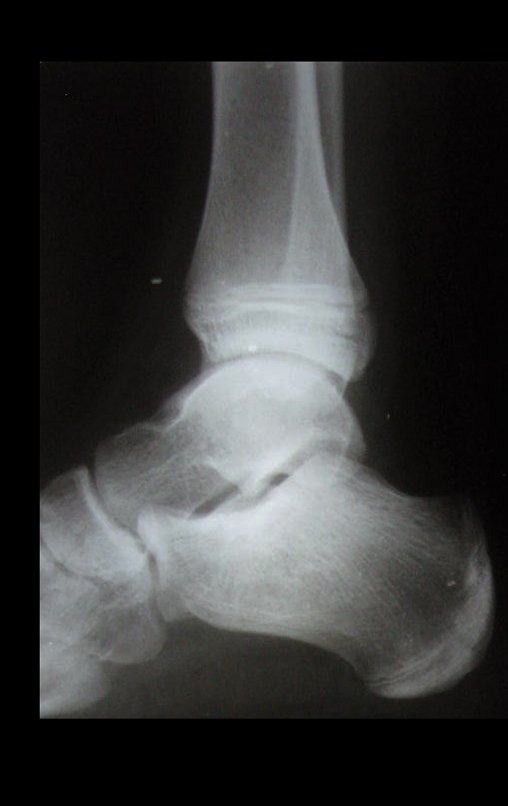
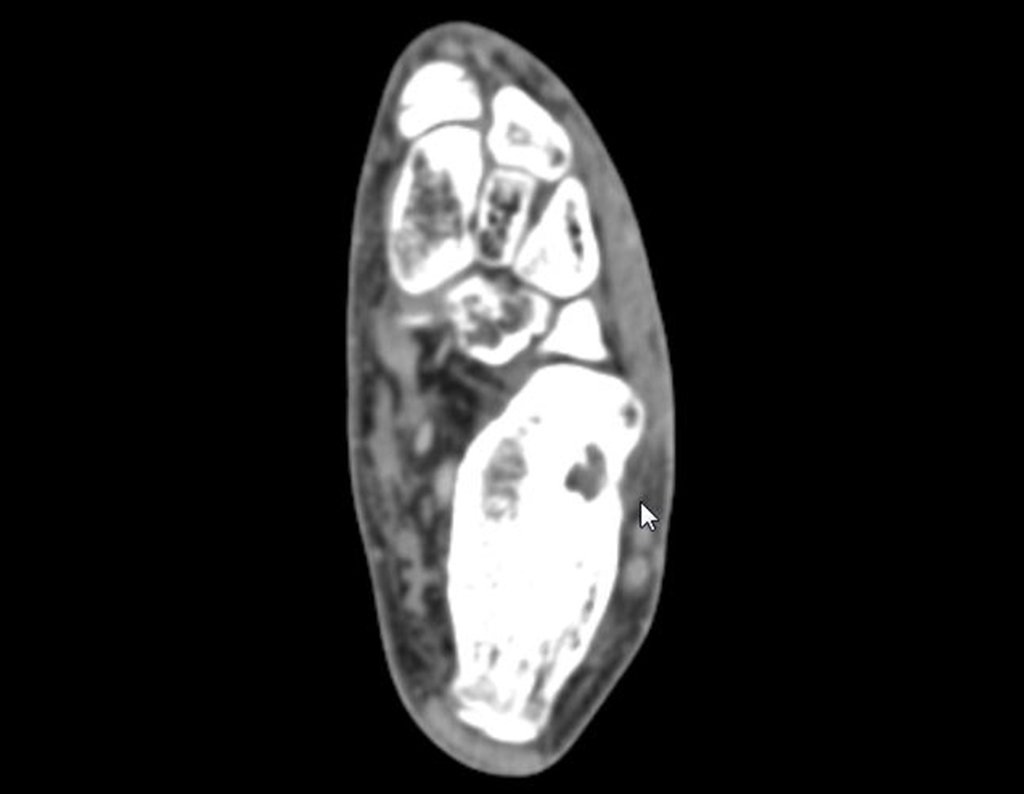
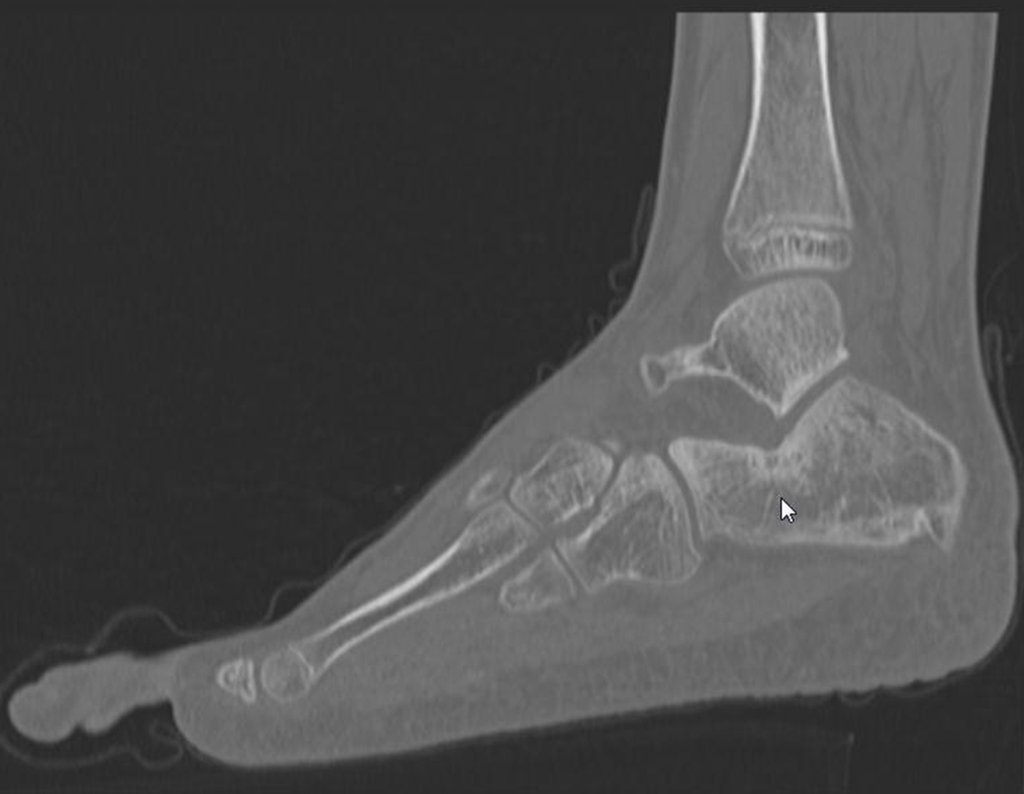
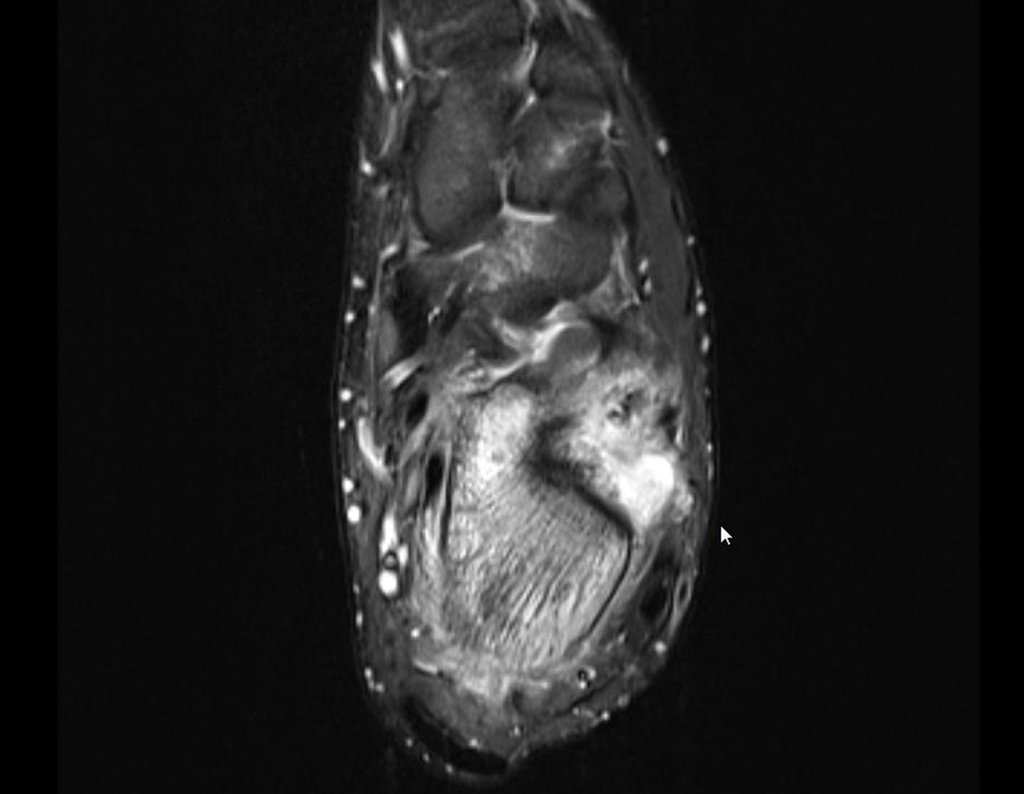
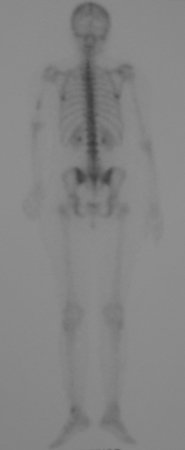
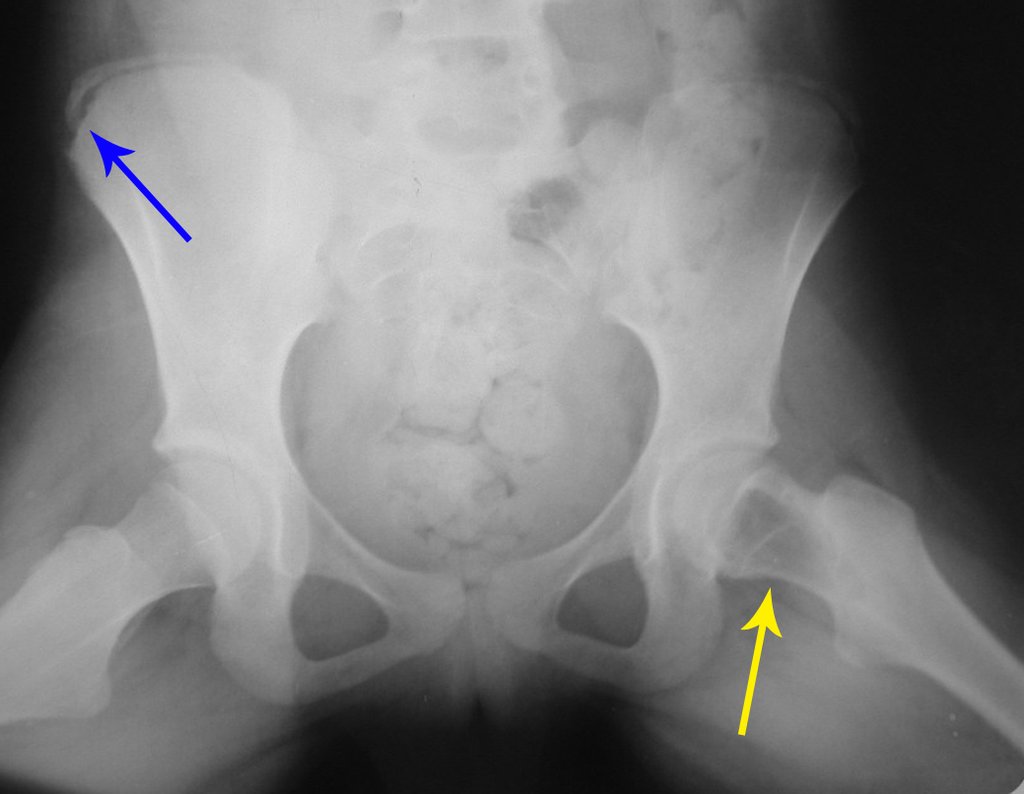
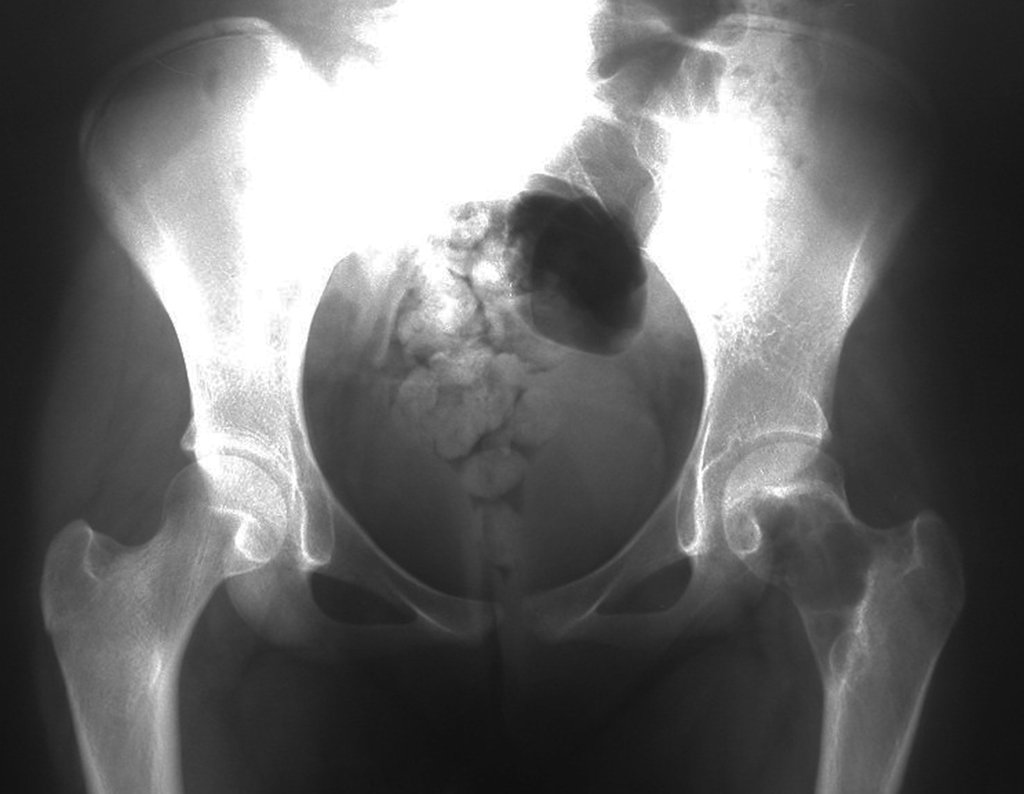
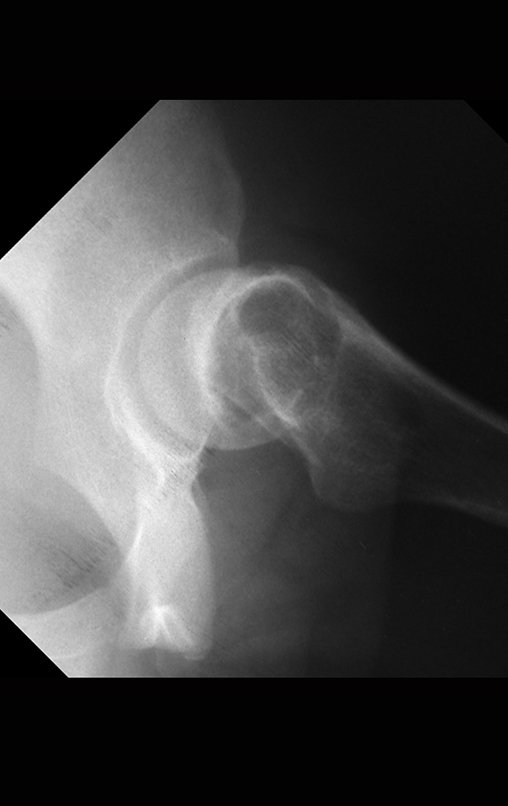
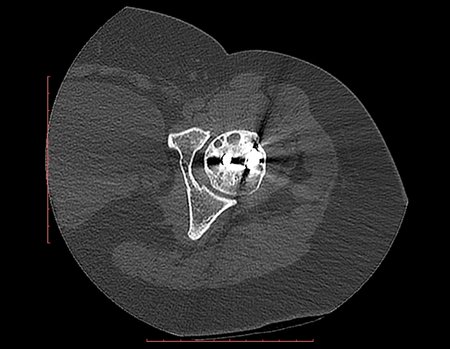
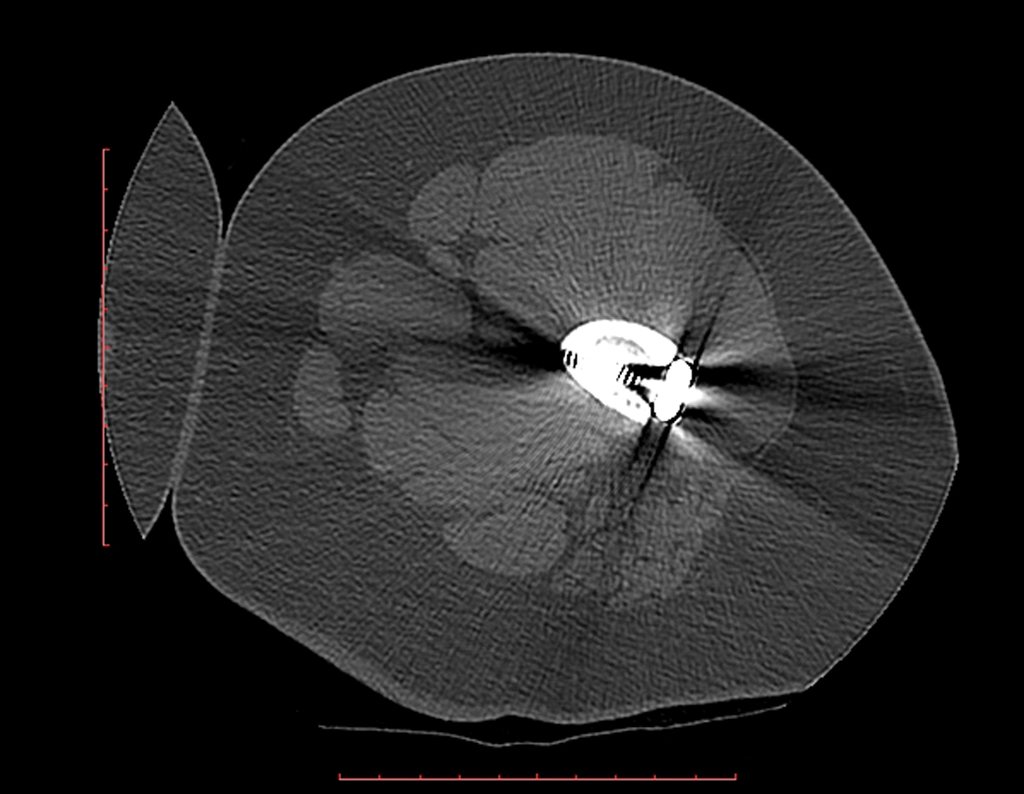
Este examen mostró lesiones hipermetabólicas: pulmón izquierdo, SUV=13,2 (probable proceso primario) y lesión en cuello femoral izquierdo, SUV=10,7 (probable proceso secundario), figuras 16 a 21.
La planificación del tratamiento de radioterapia realizada fue:
1- Técnica: Radioterapia Estereotáxica Extra Craneal (SBRT)
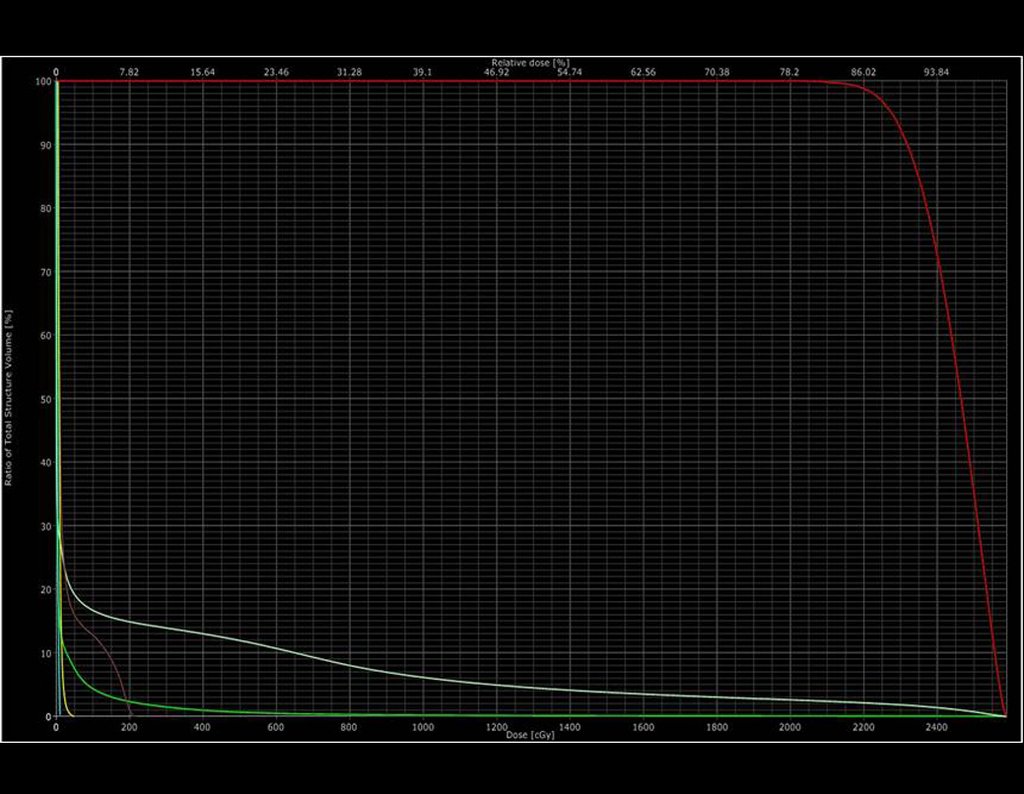
2- Dosis recetada: 2000 cGy en una sola fracción
3- Energía: 15MV
4- Técnica: 3D
5- Dosis máxima en PTV: 2362 cGy
6- Dosis mínima: 1808 cGy
7- Dosis mediana: 2195 cGy
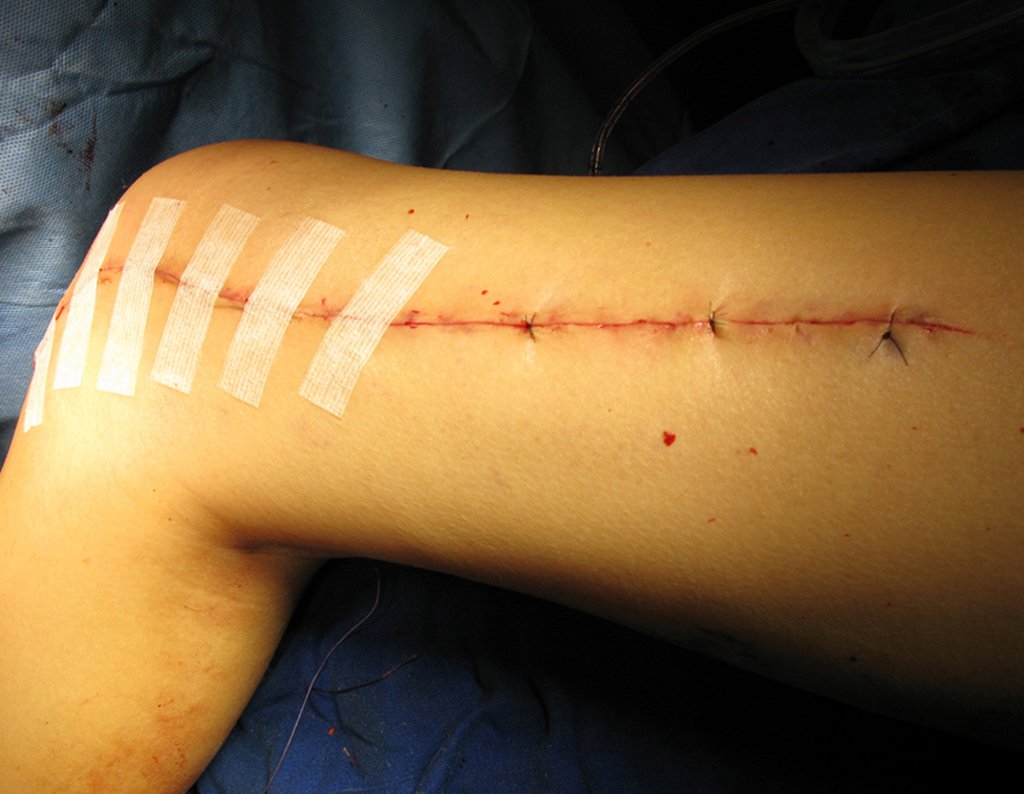
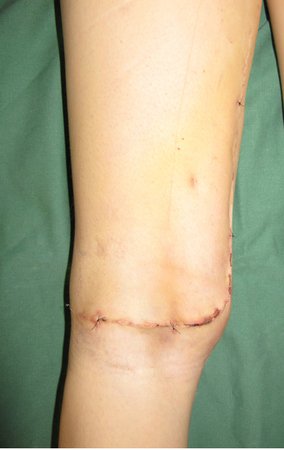
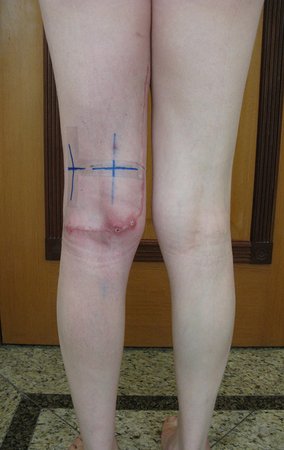
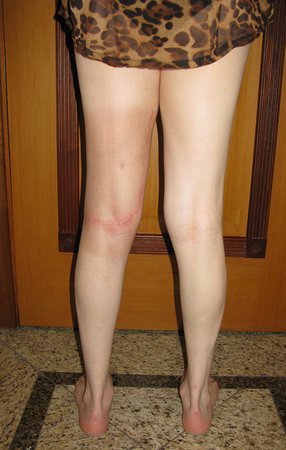
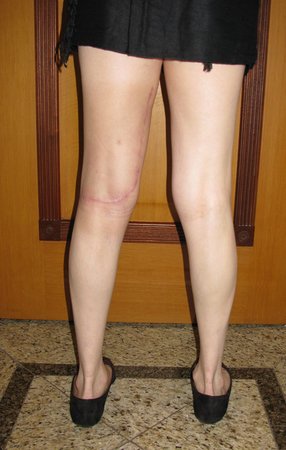
Las figuras 26 c a 26 j documentan el tratamiento adyuvante instituido.
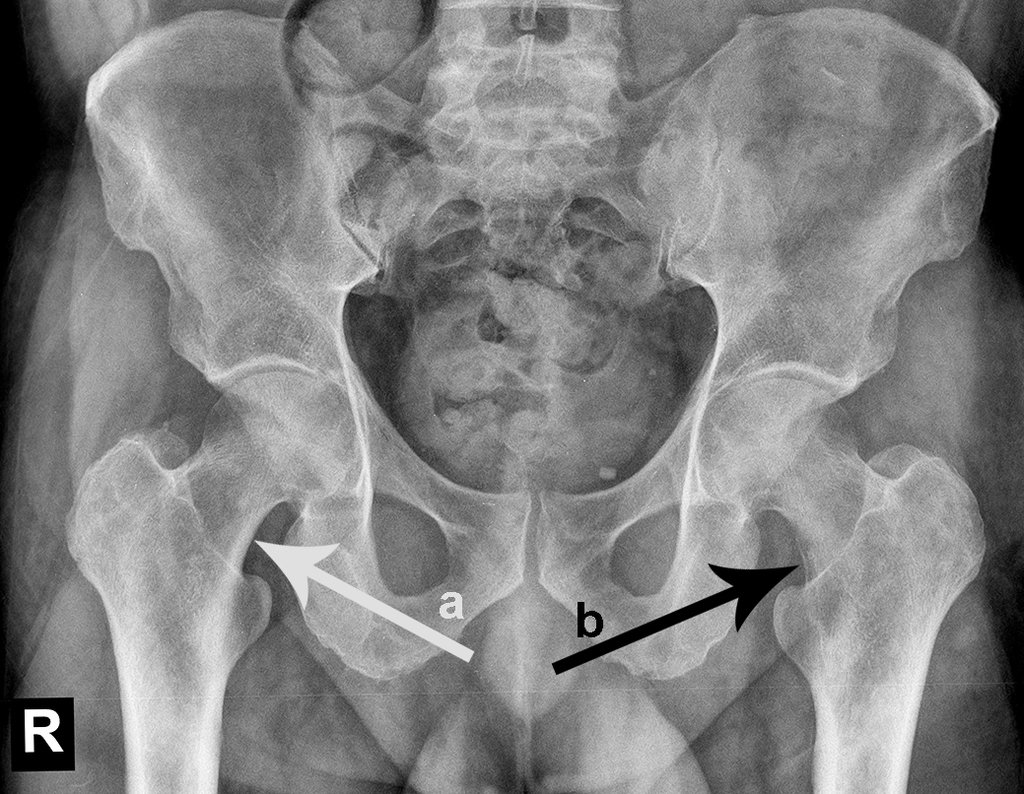
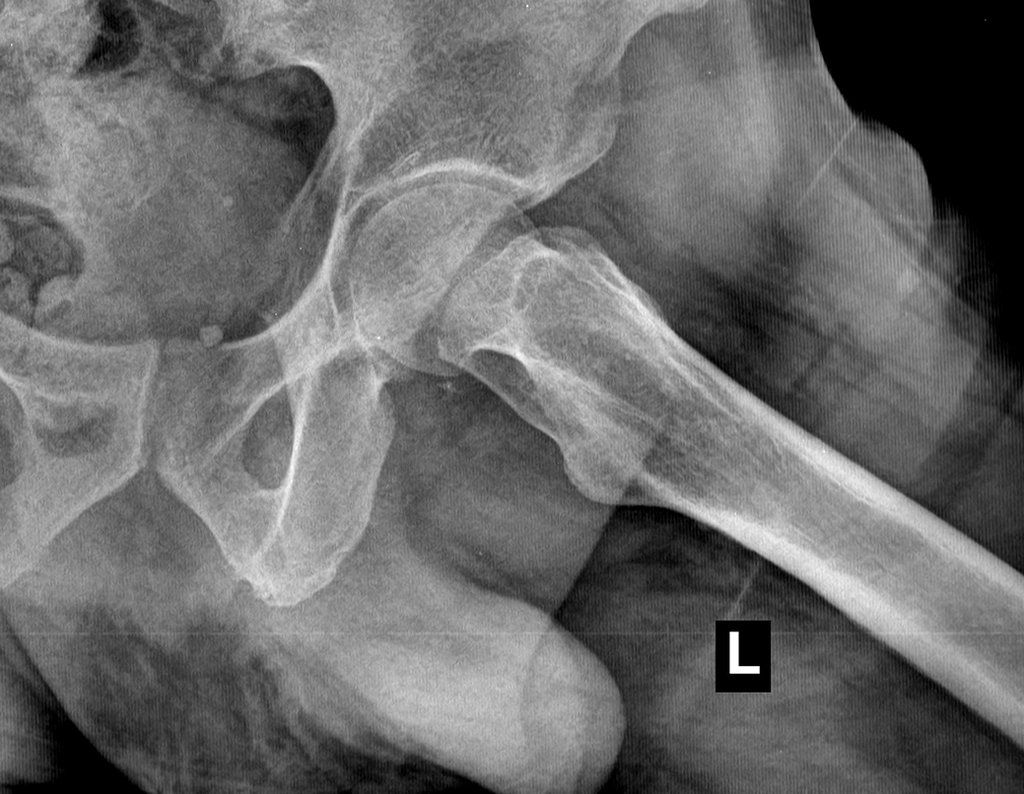
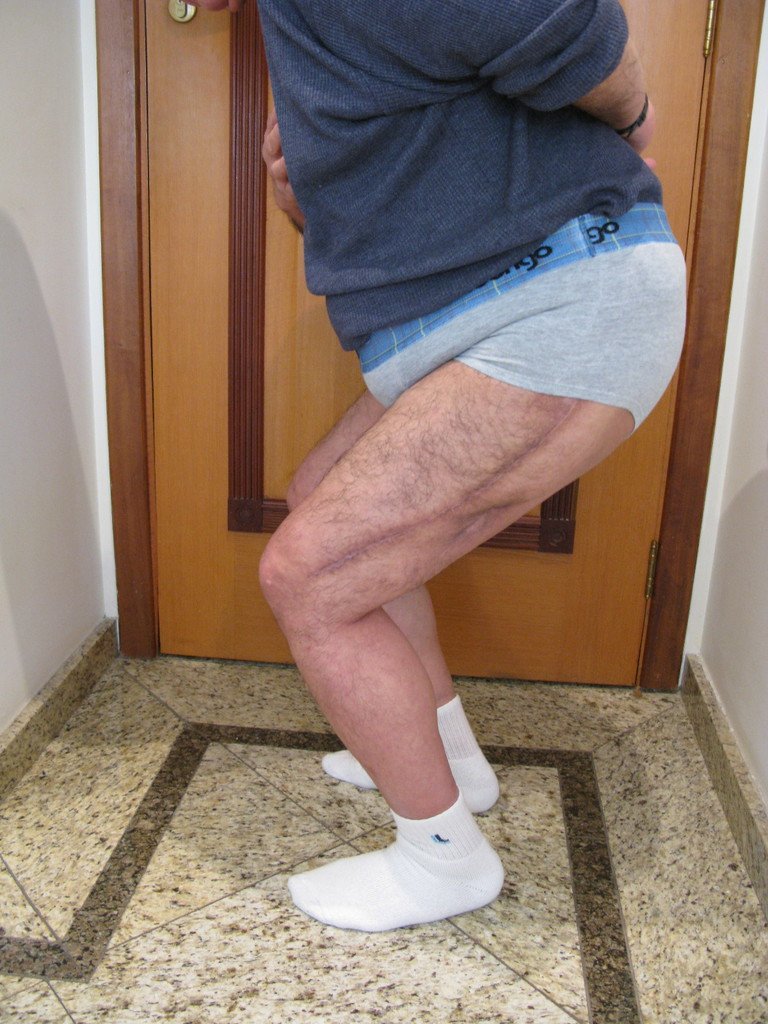
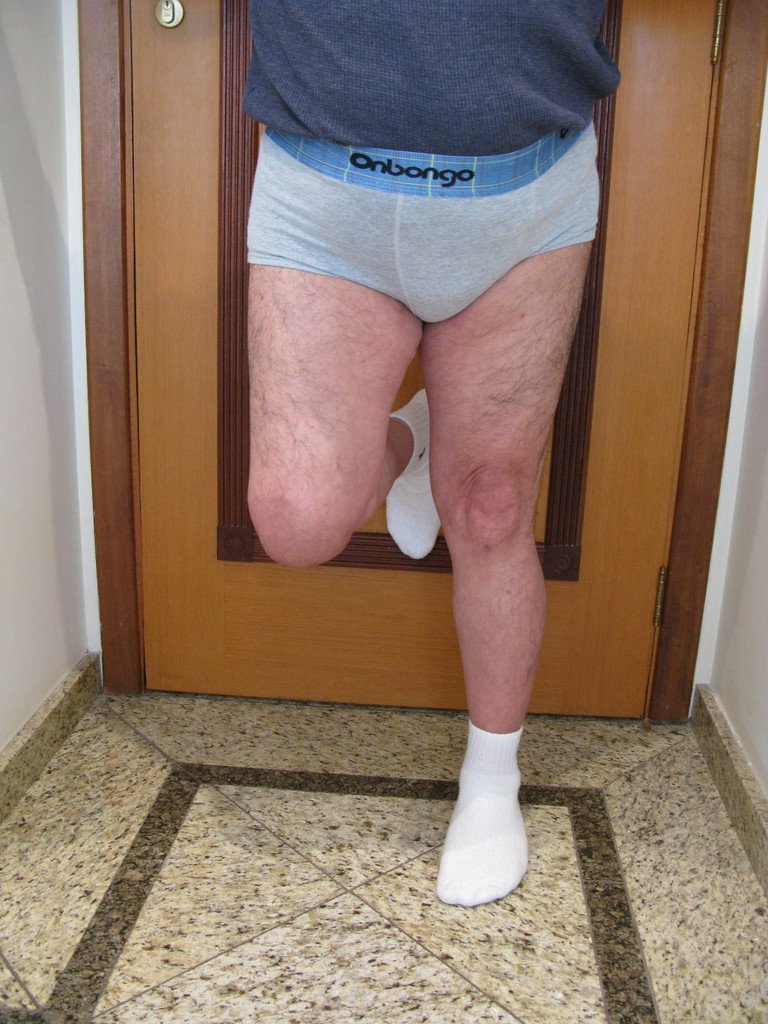
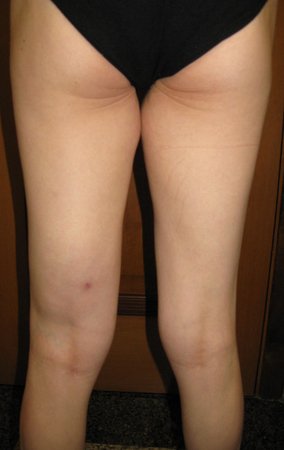
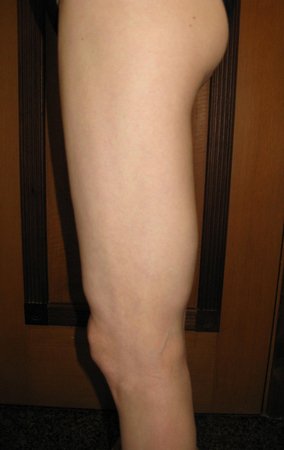
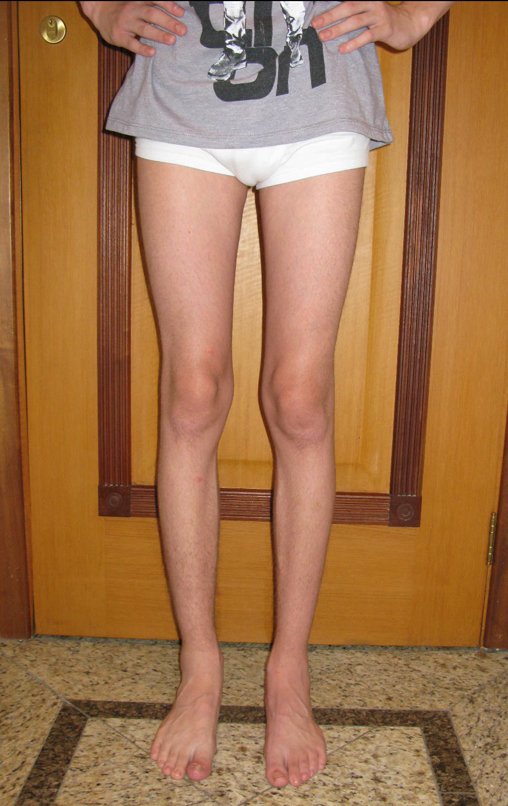
En la evaluación ortopédica en este momento el paciente no presentó síntomas significativos.
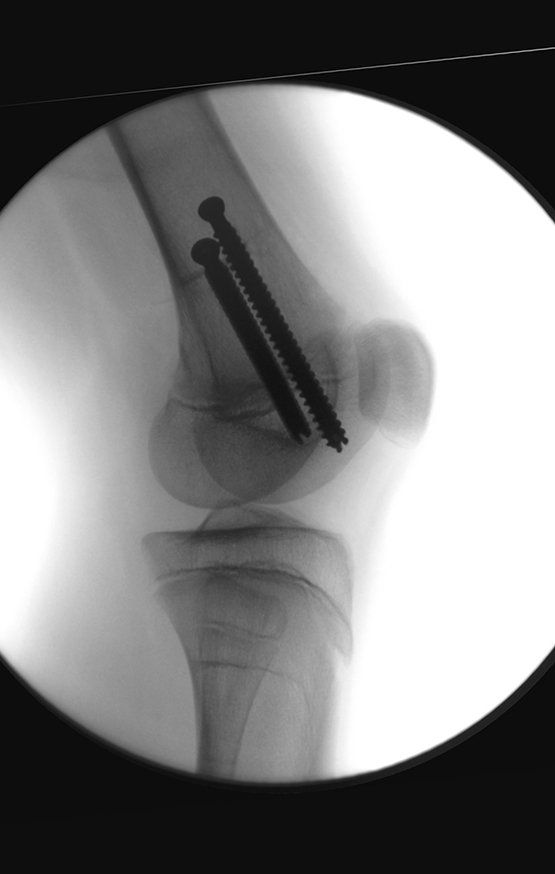
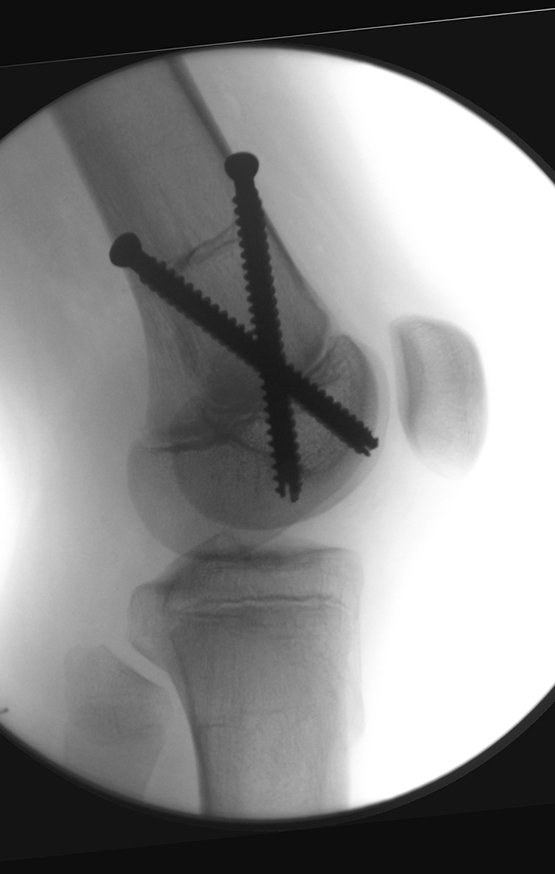
Se consideró el corto período de tratamiento con radioablación y quimioterapia, así como el riesgo de fractura.
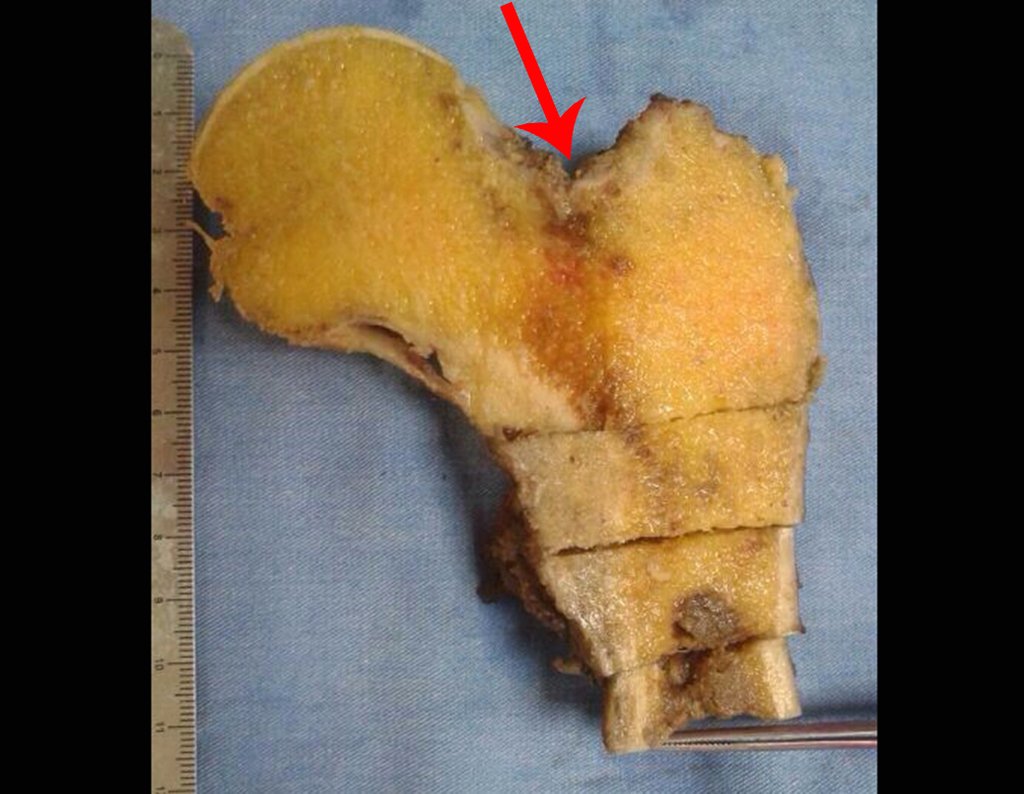
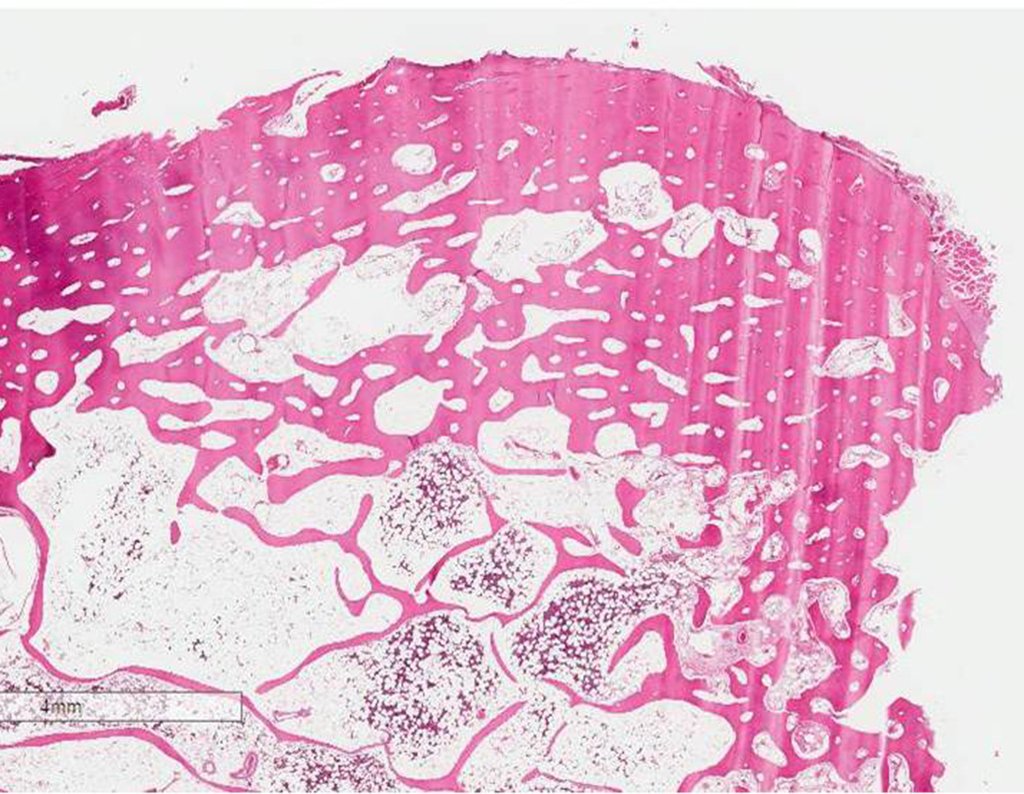
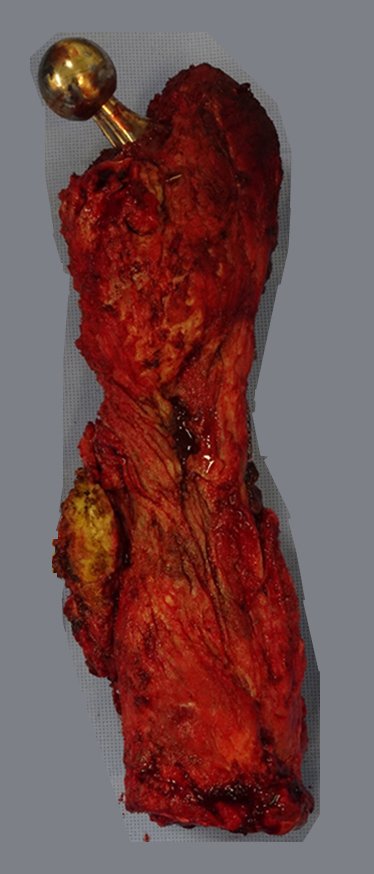
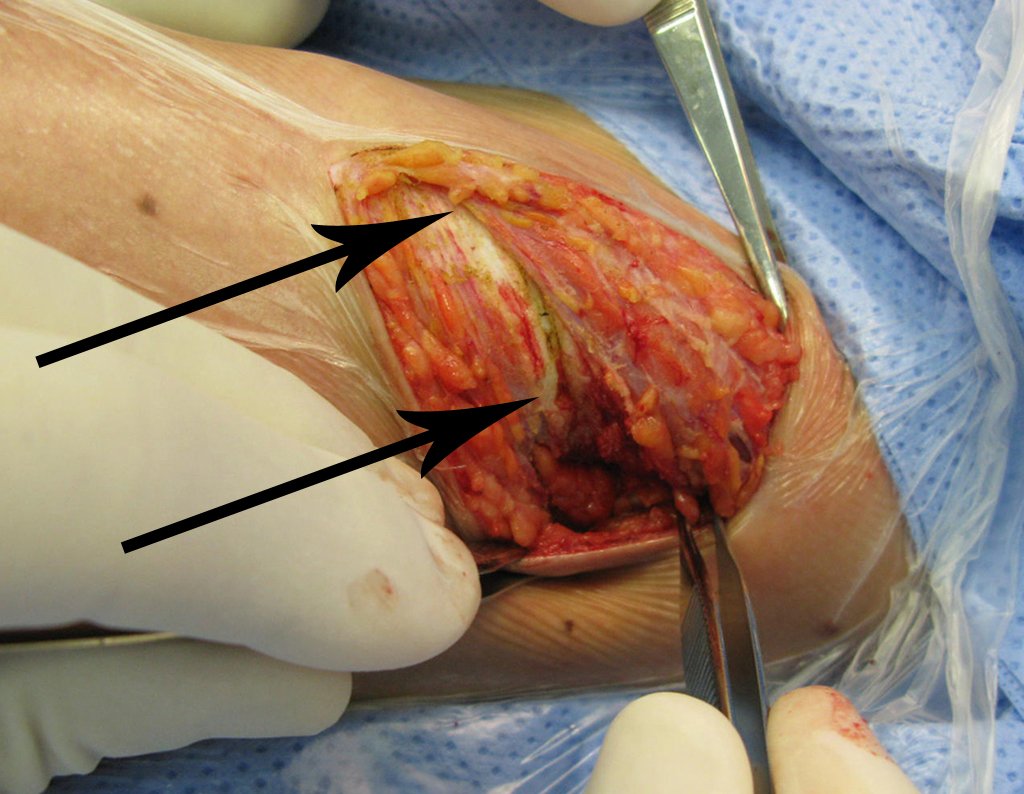
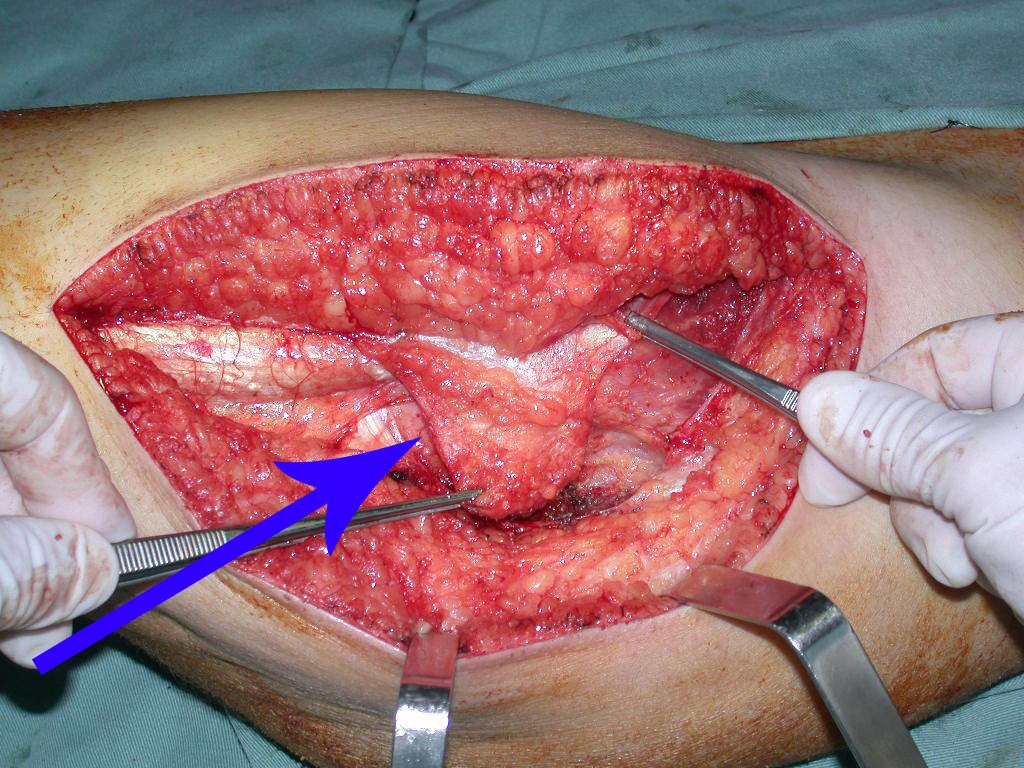
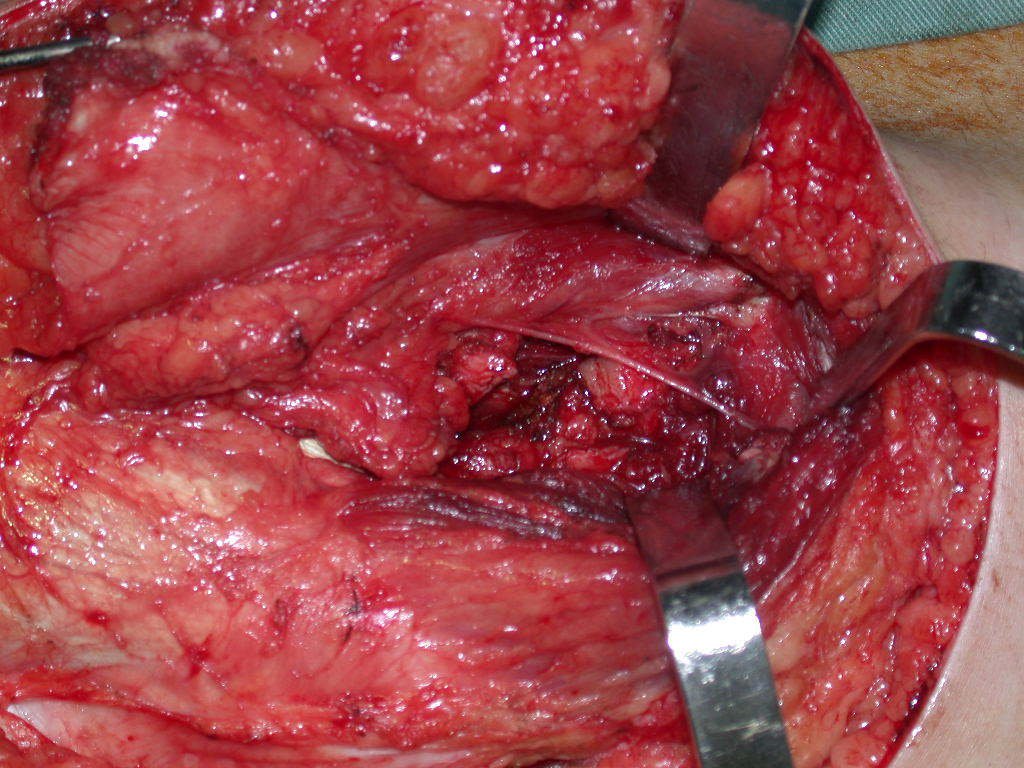
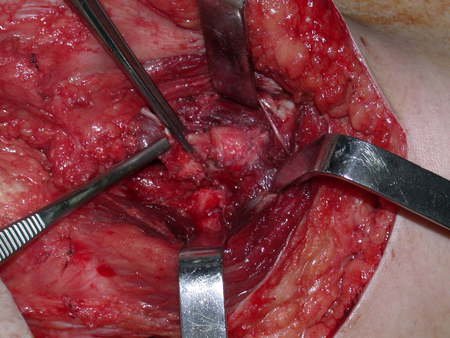
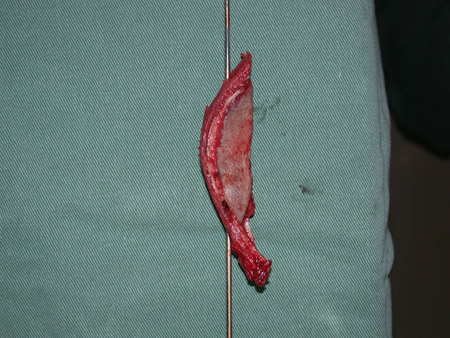
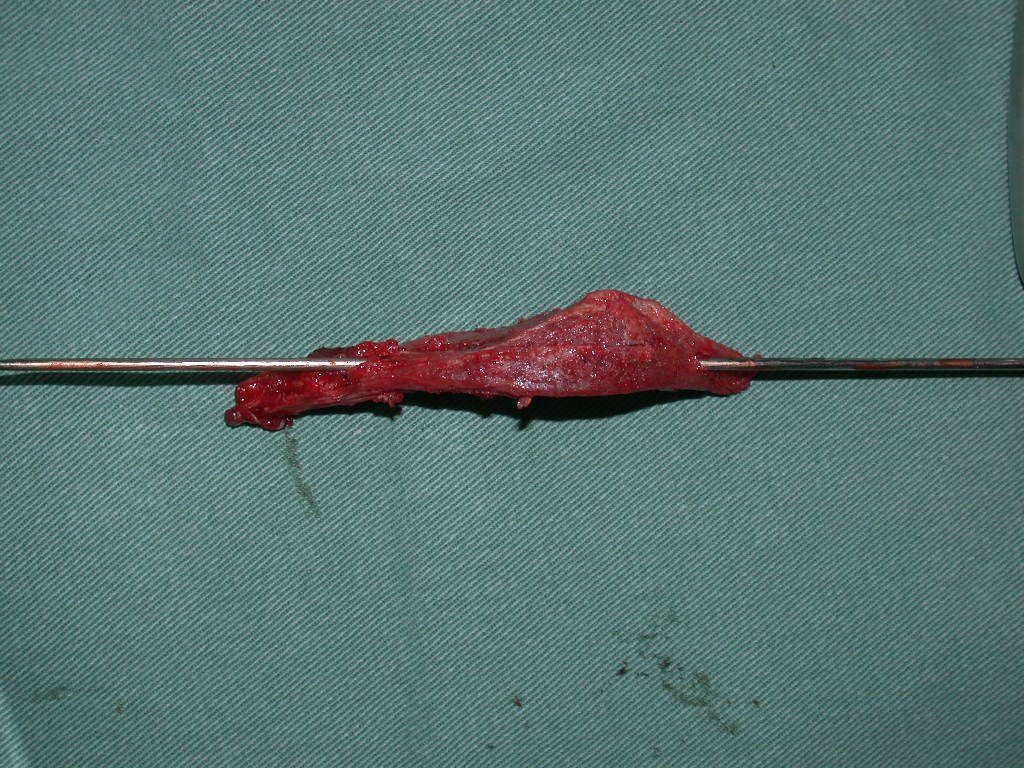
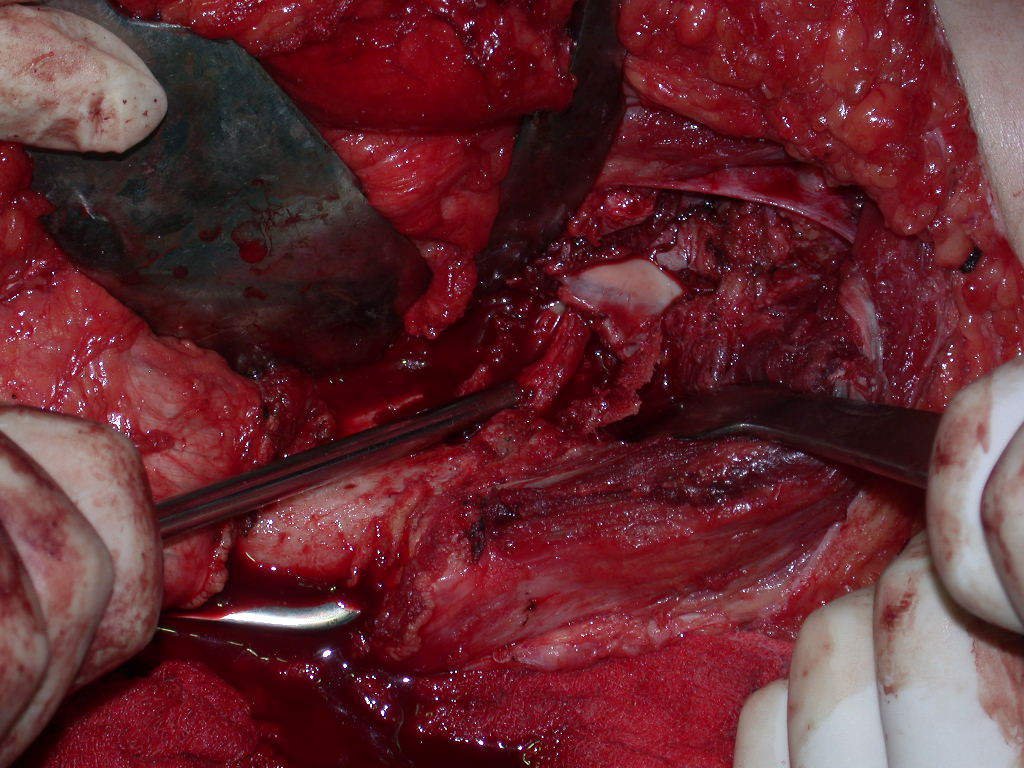
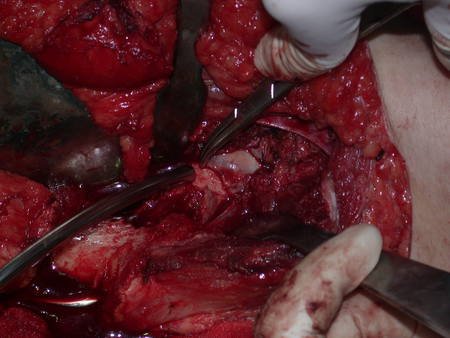
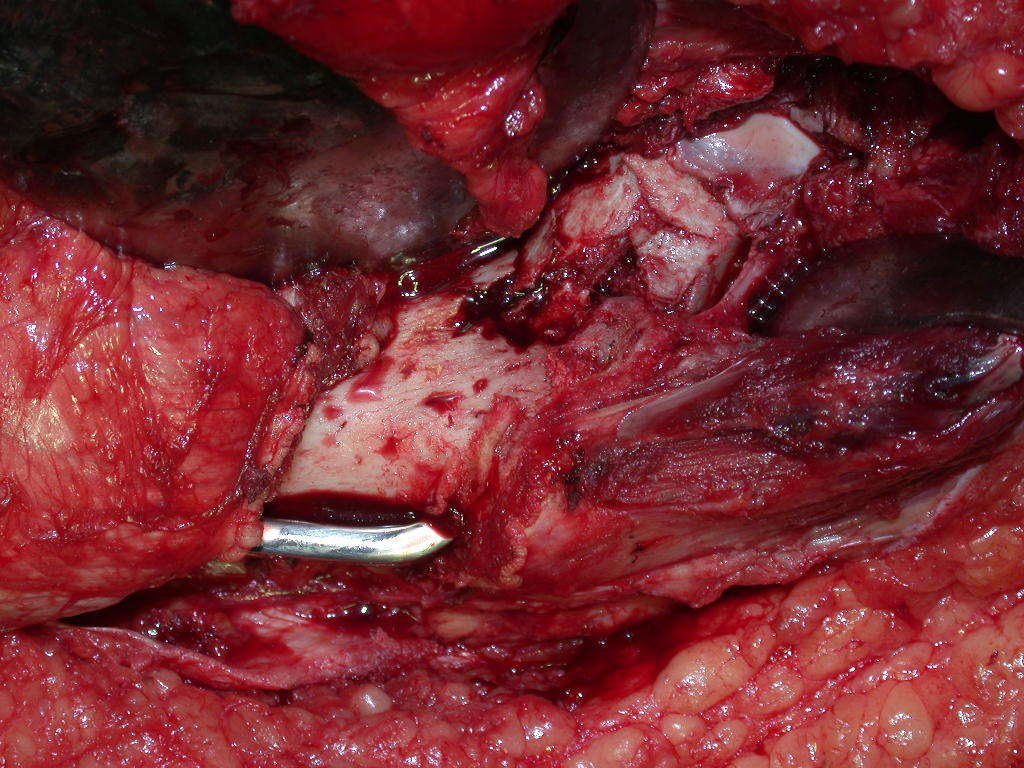
La irrigación medular del cuello femoral en adultos es retrógrada, desde la metáfisis hasta la epífisis. La principal irrigación de la epífisis es a través de la arteria circunfleja posterior, que puede haber sido la vía de diseminación metastásica e incluso puede estar comprometida. Para colmo, el cuello femoral tiene un periostio muy débil, con poca capacidad de regeneración ósea, lo que es la causa de muchos fallos en la consolidación ósea cuando se producen fracturas en esta región.
Junto con el paciente y su familia decidimos esperar, tratando de darle más tiempo y oportunidad a la reparación ósea. Optamos por reevaluar en julio, con nuevas pruebas de imagen, prestando atención a los síntomas.
Posponer la cirugía es una decisión difícil. La expectativa y la ansiedad son compartidas y experimentadas por todos.
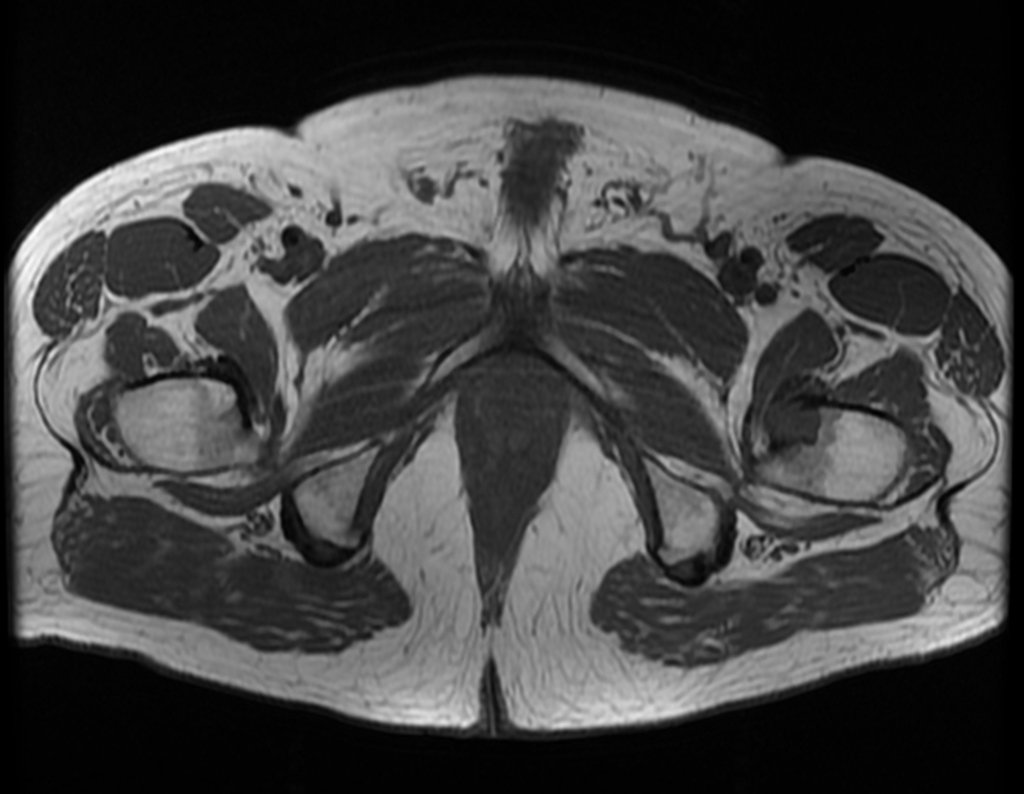
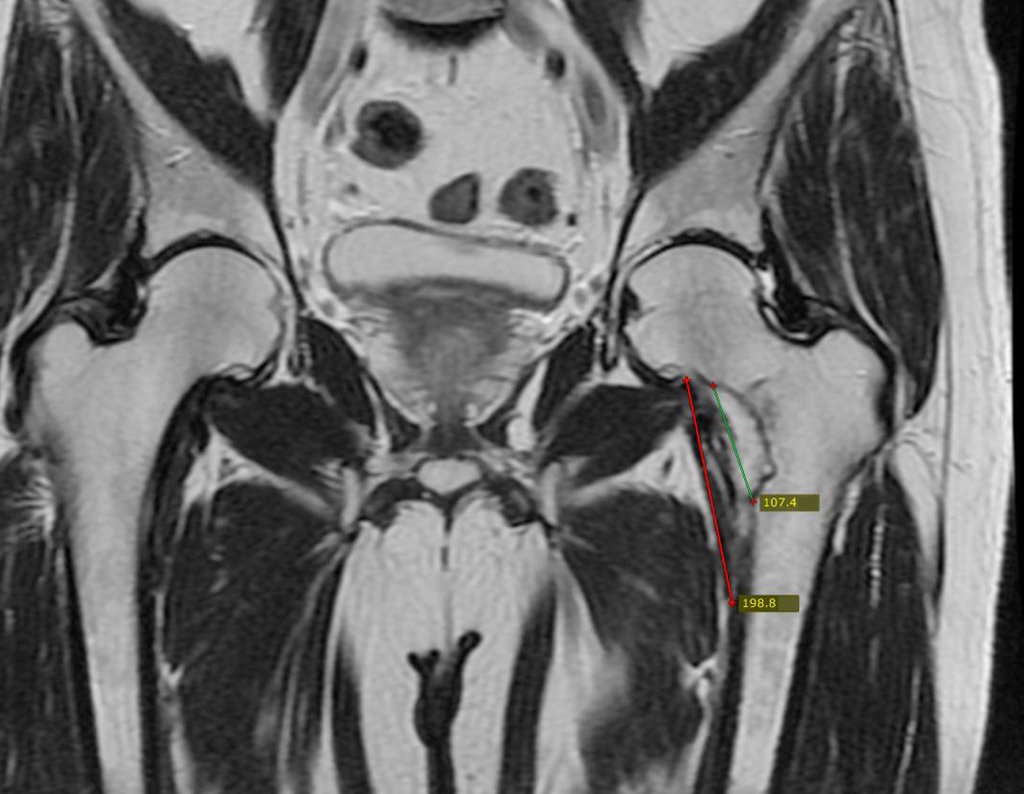
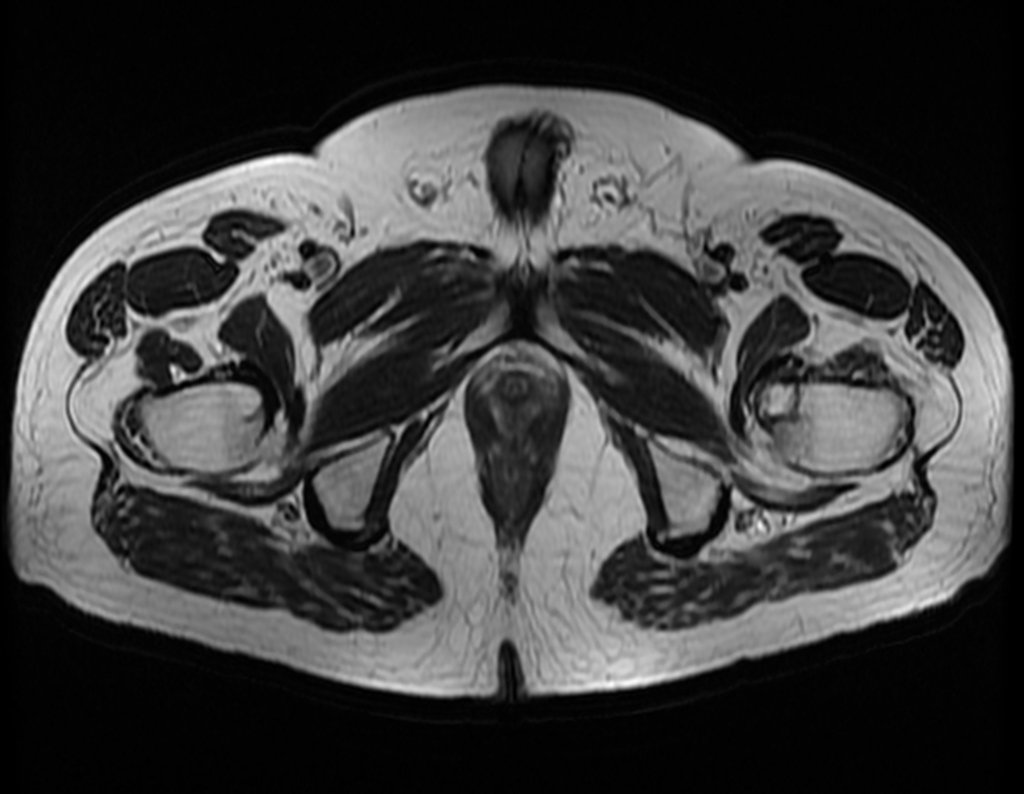
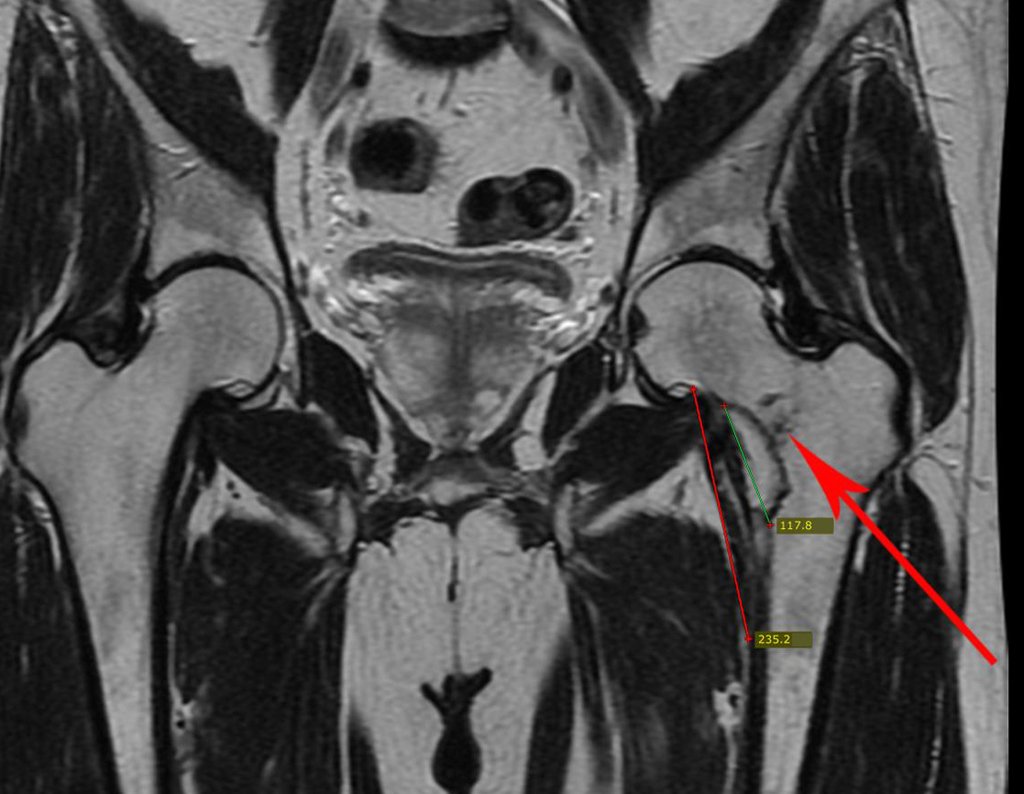
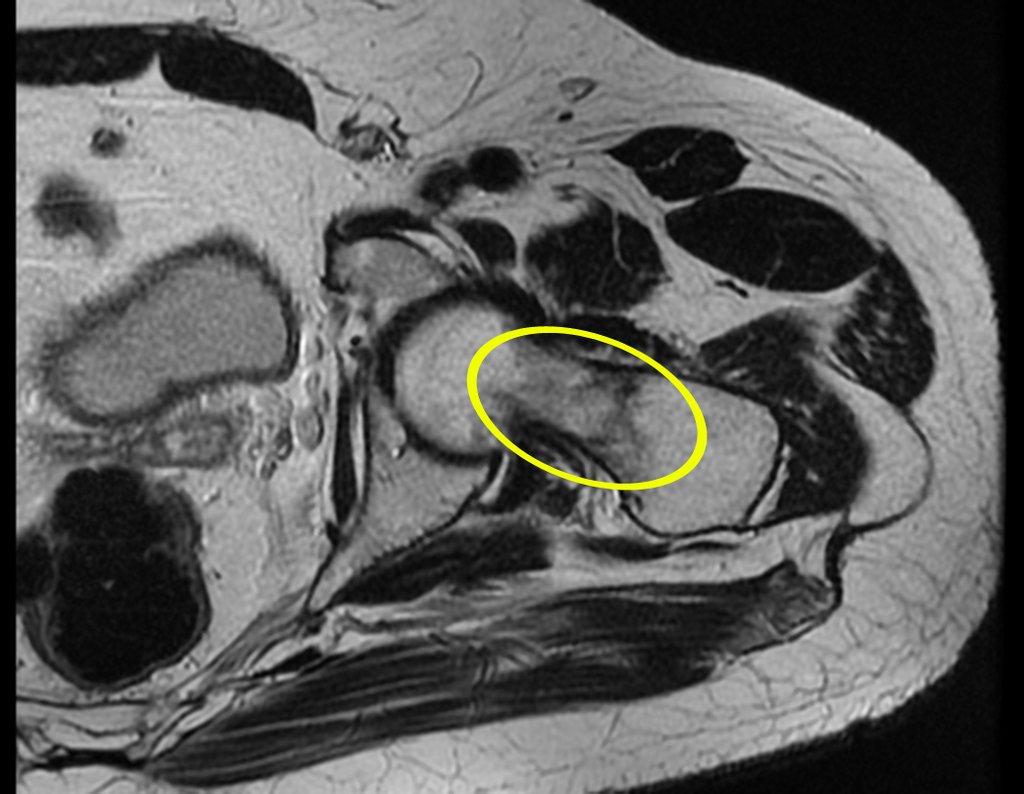
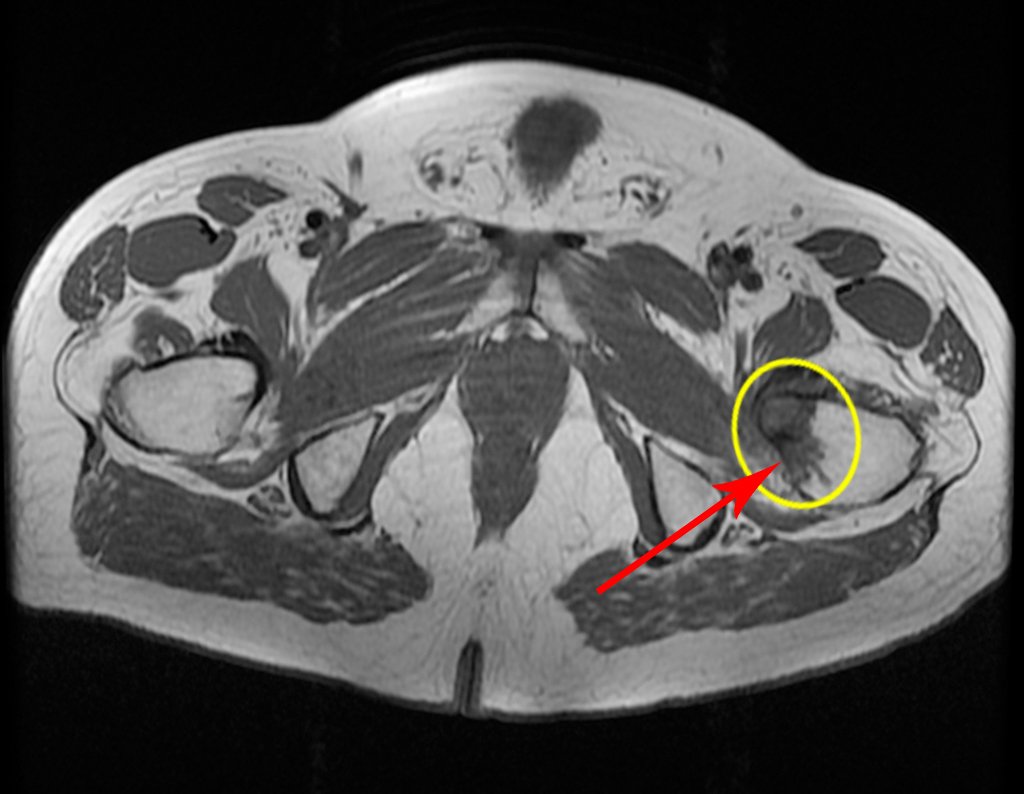
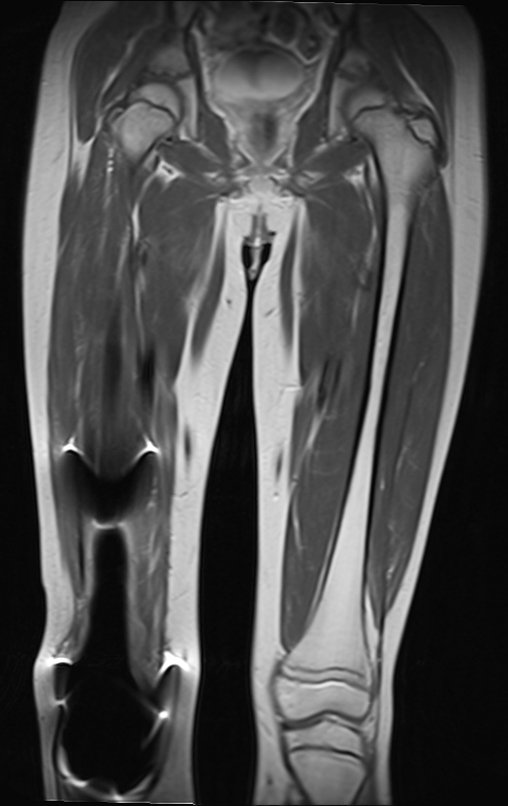
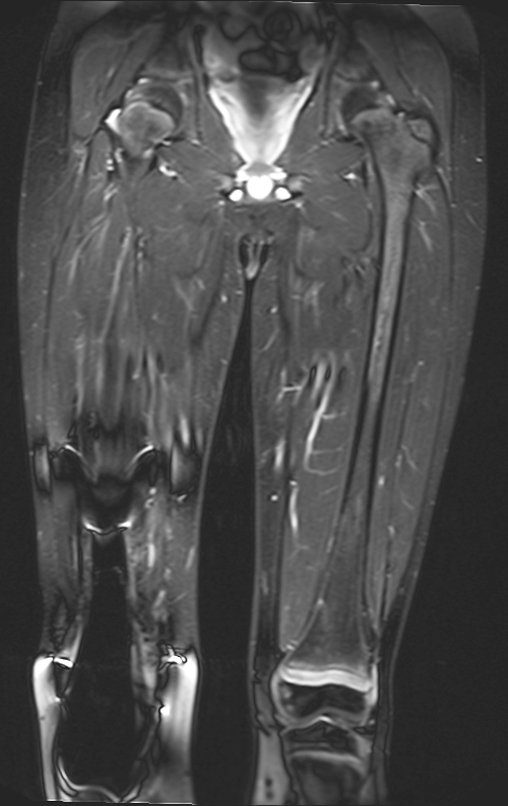
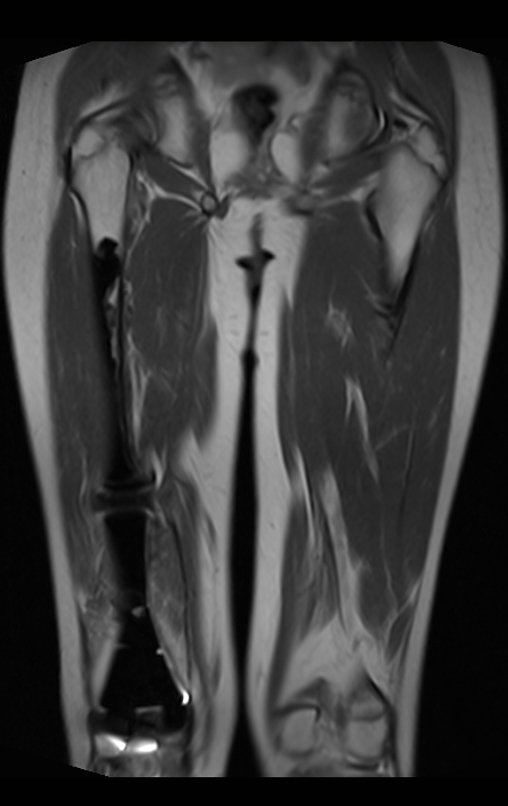
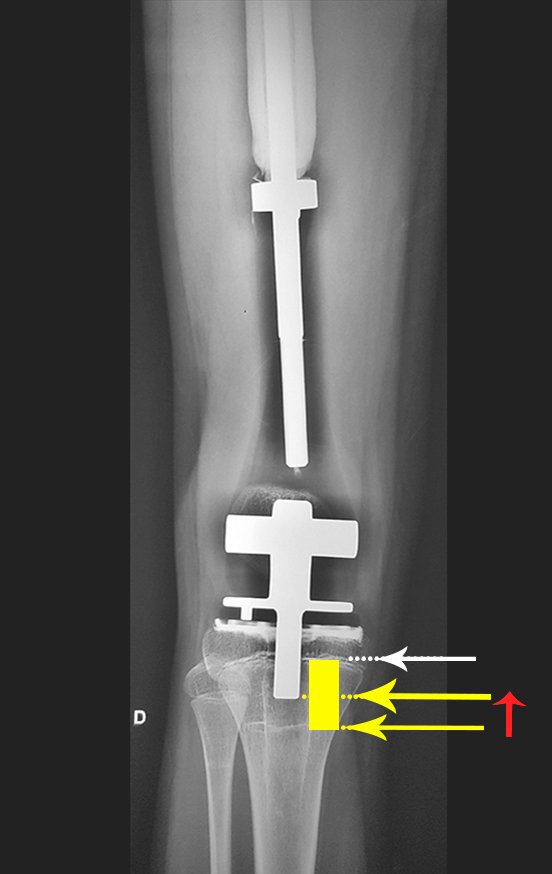
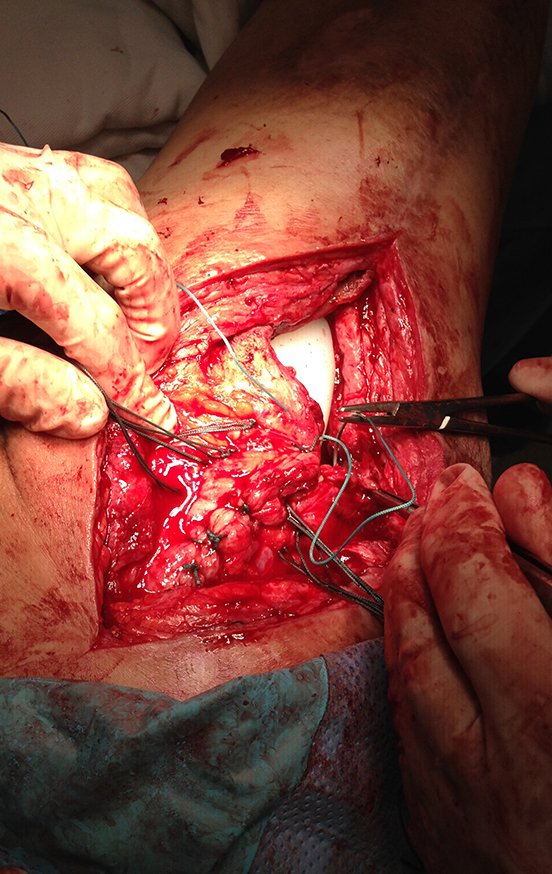
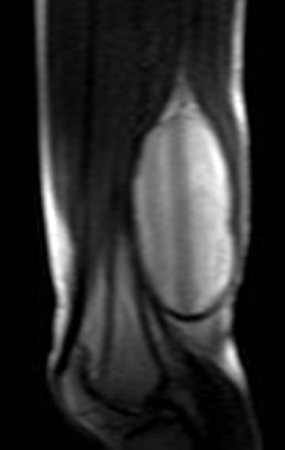
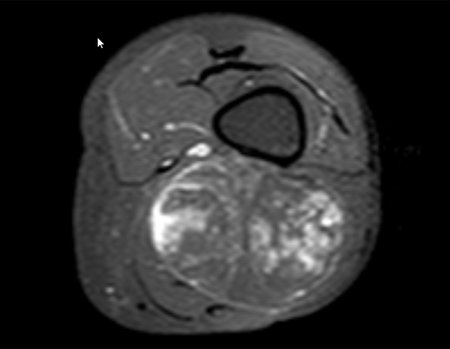
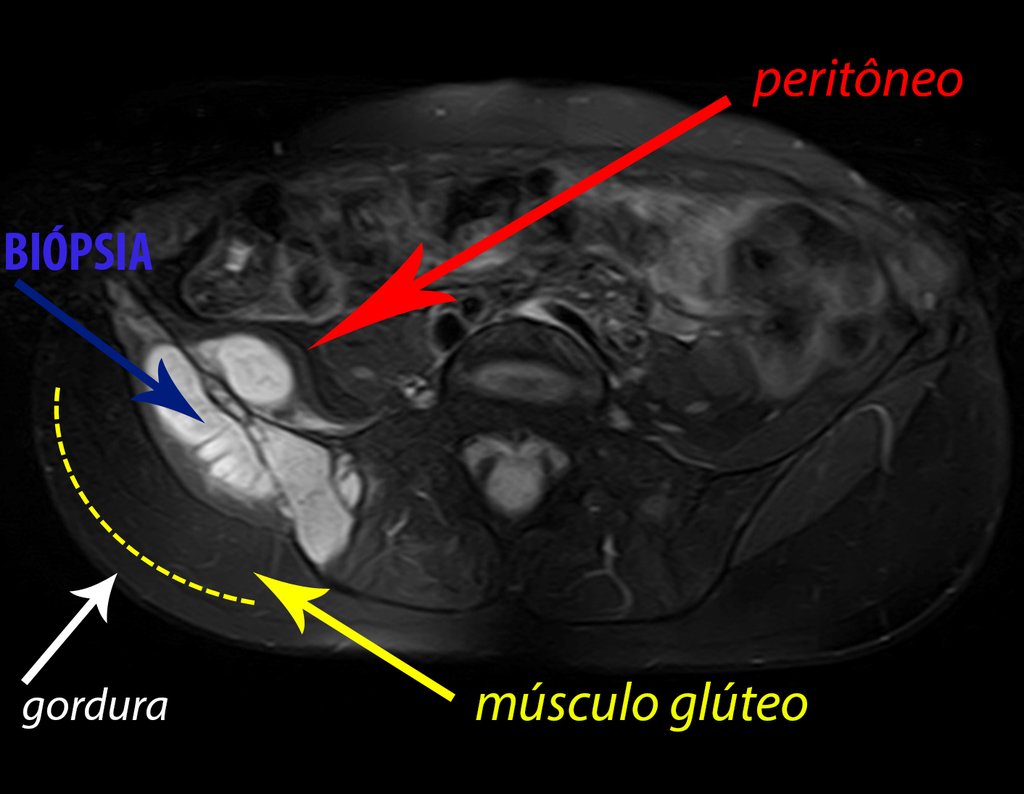
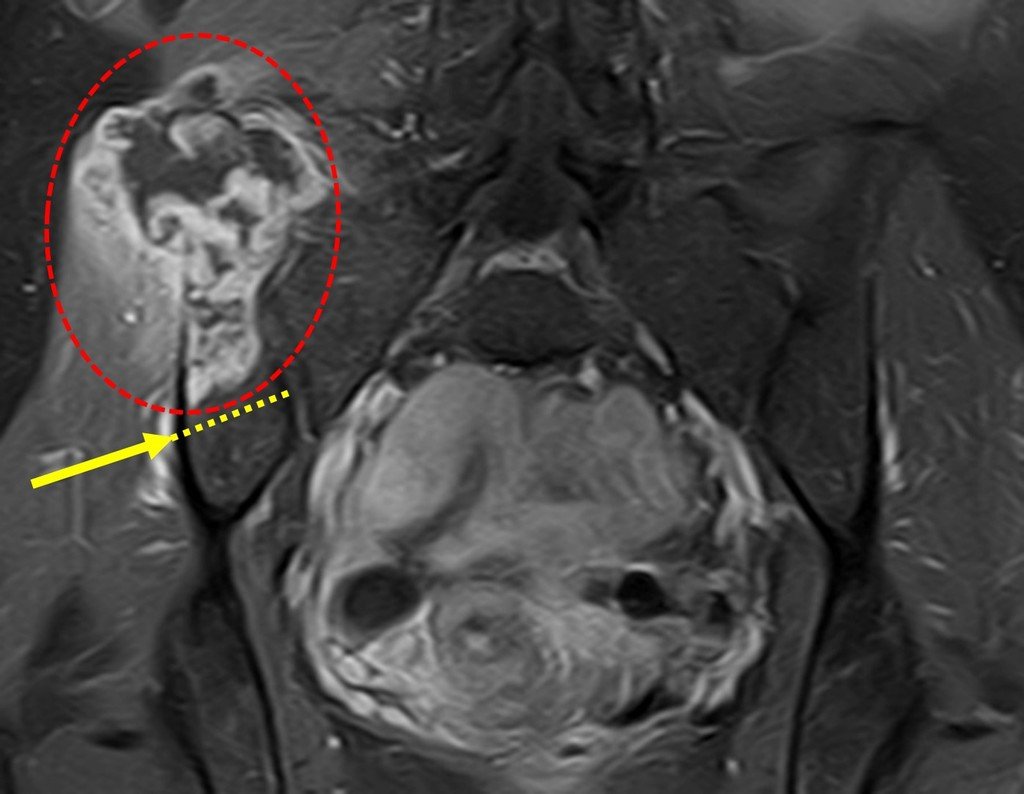
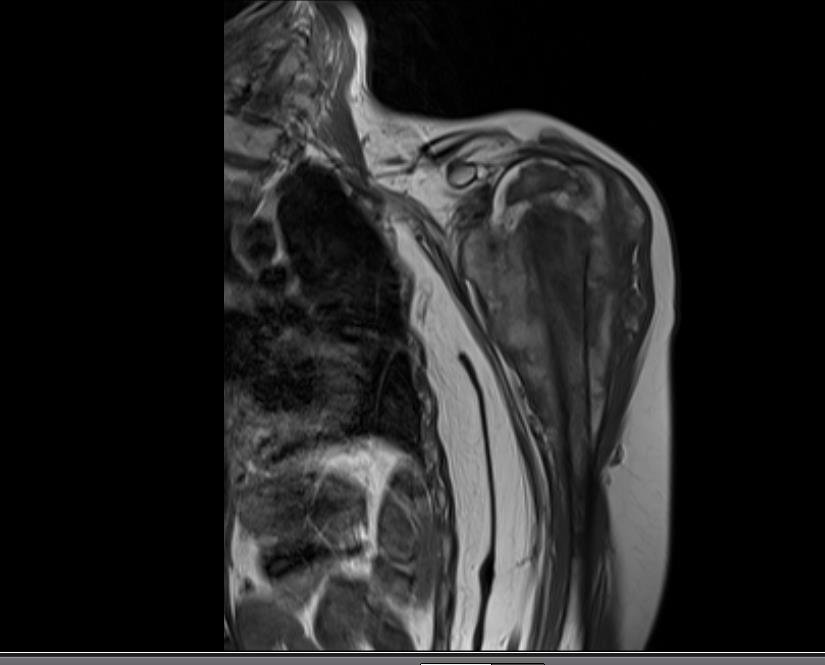
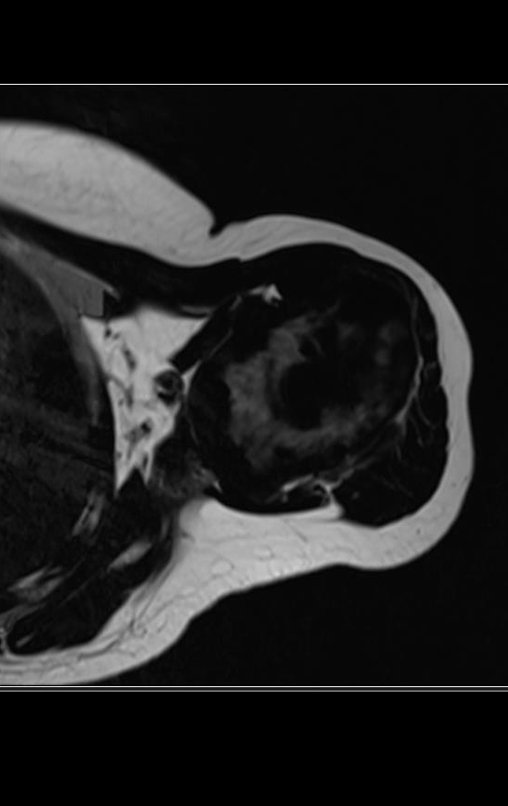
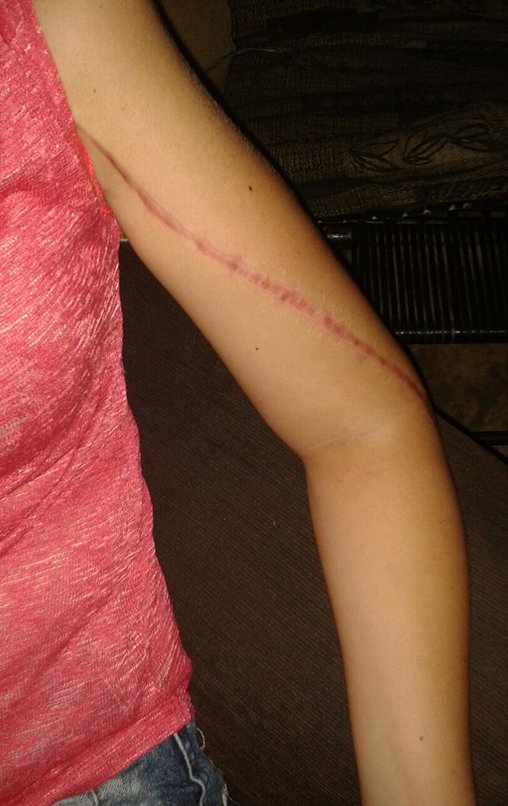
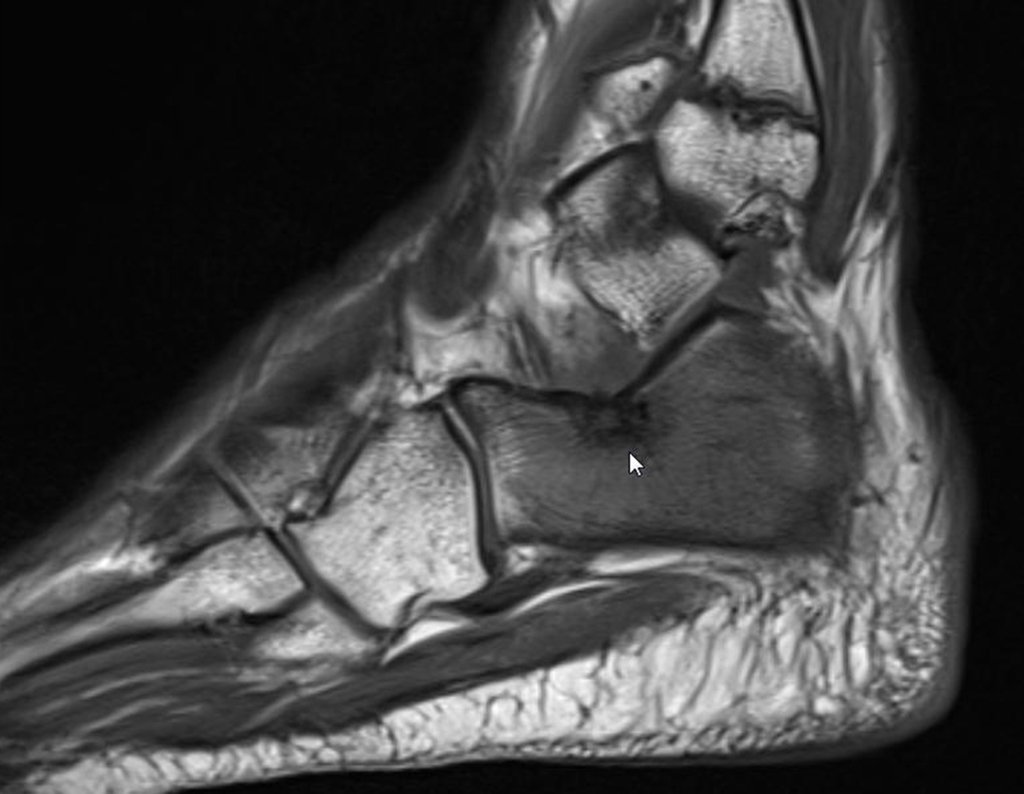
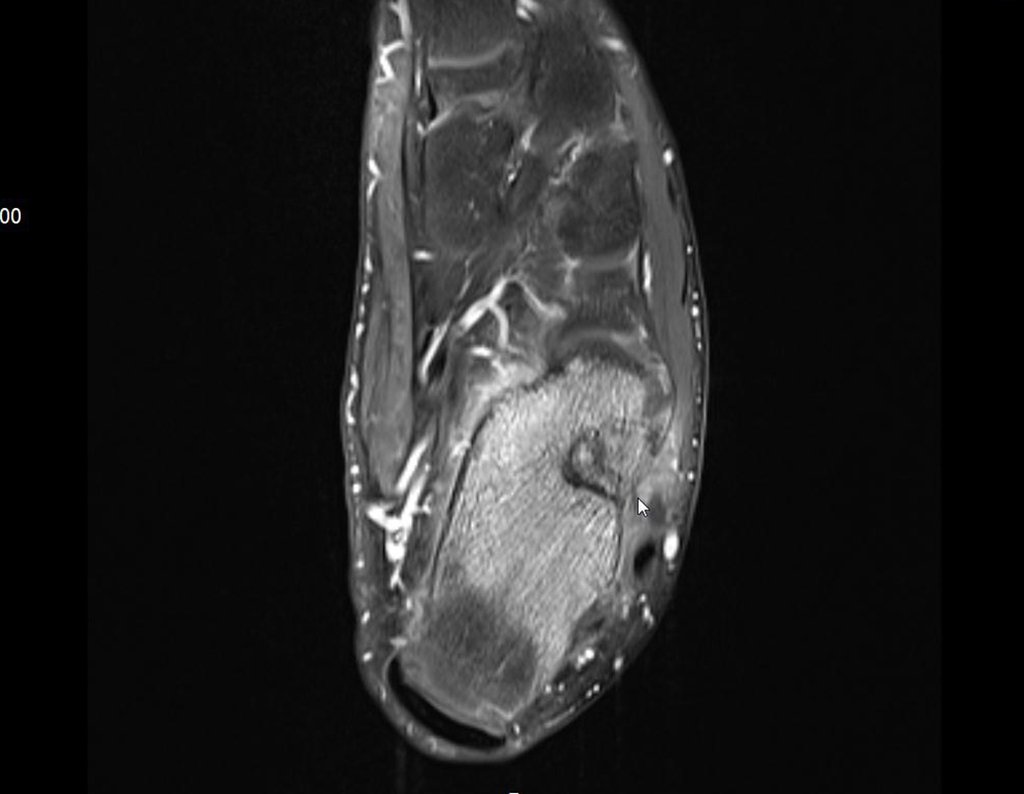
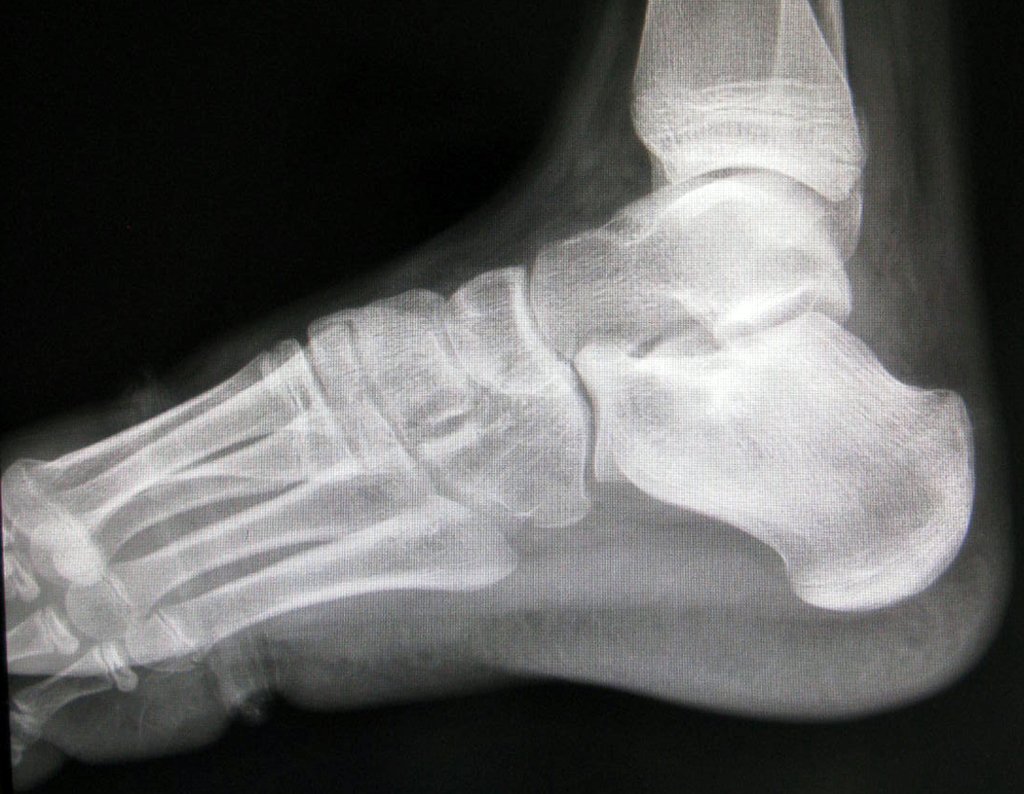
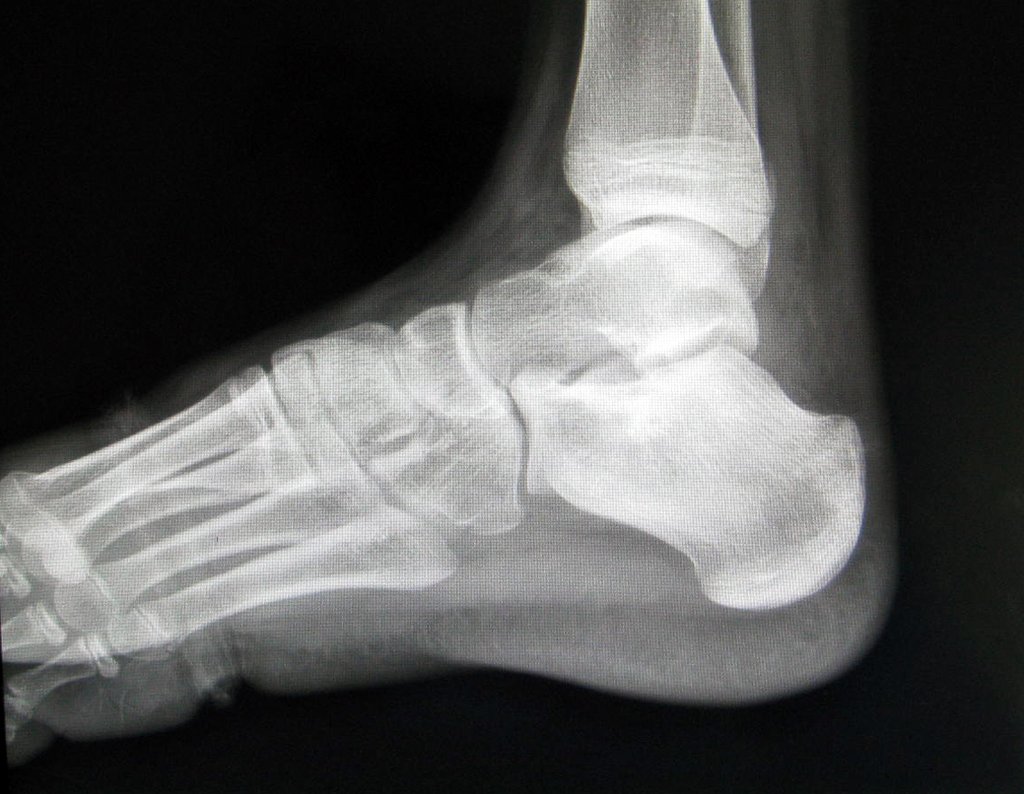
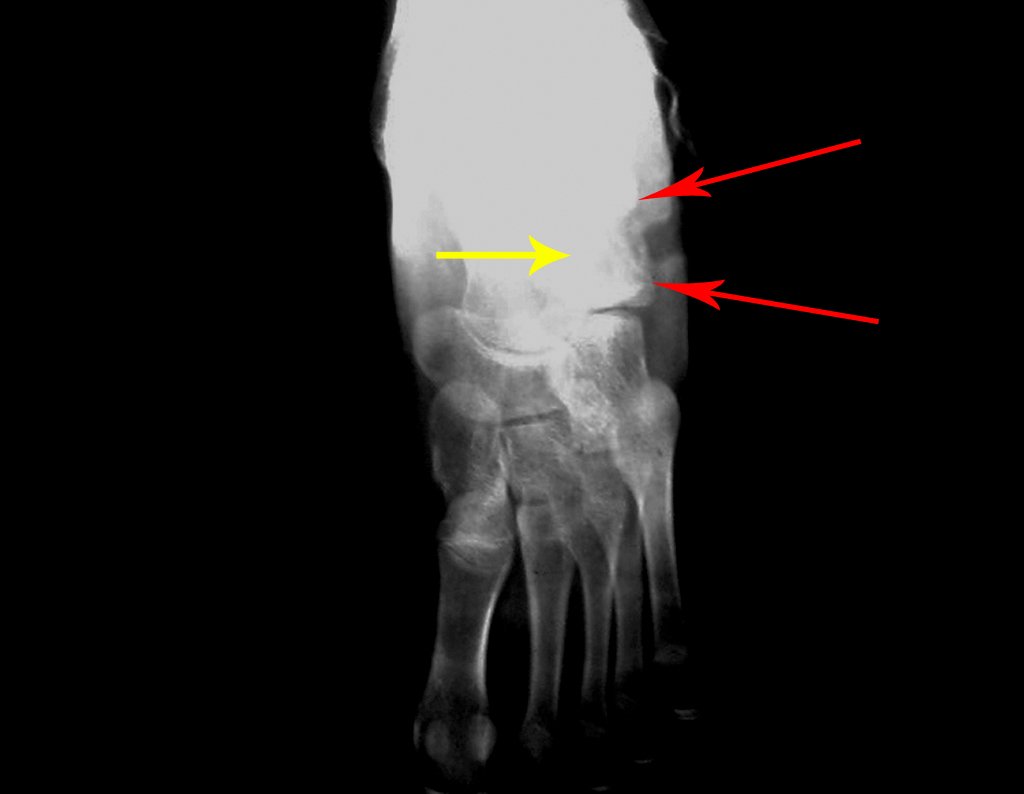
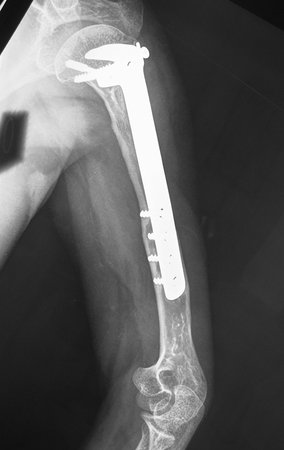
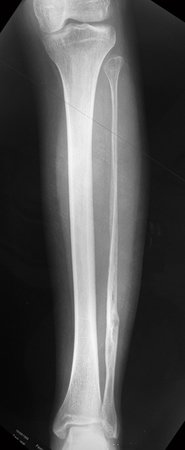
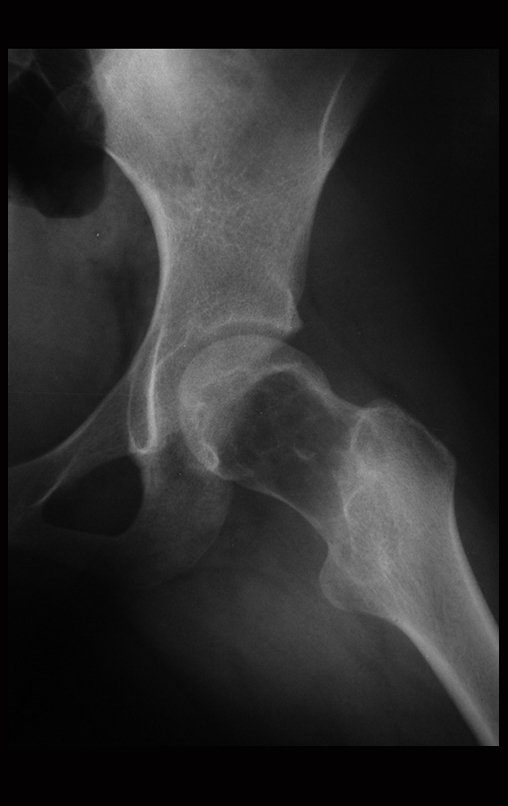
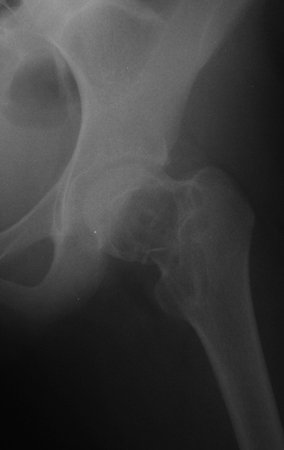
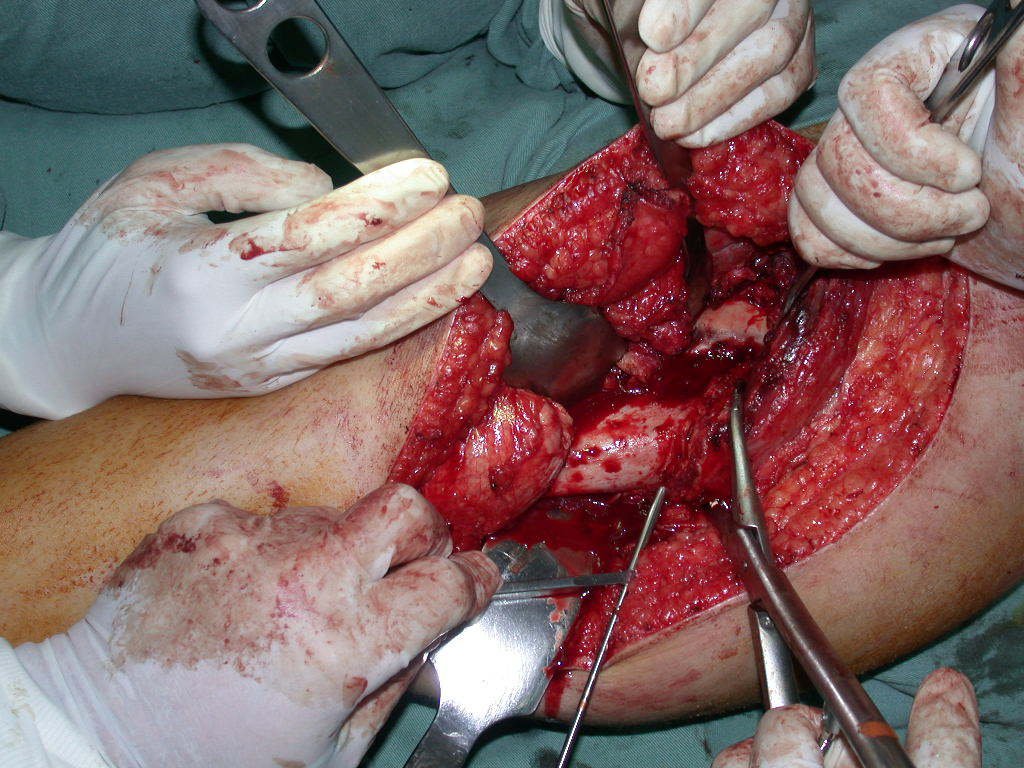
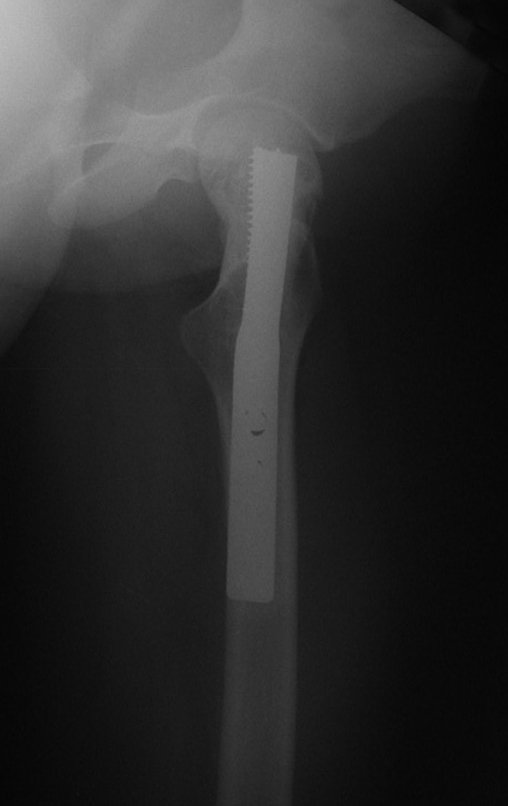
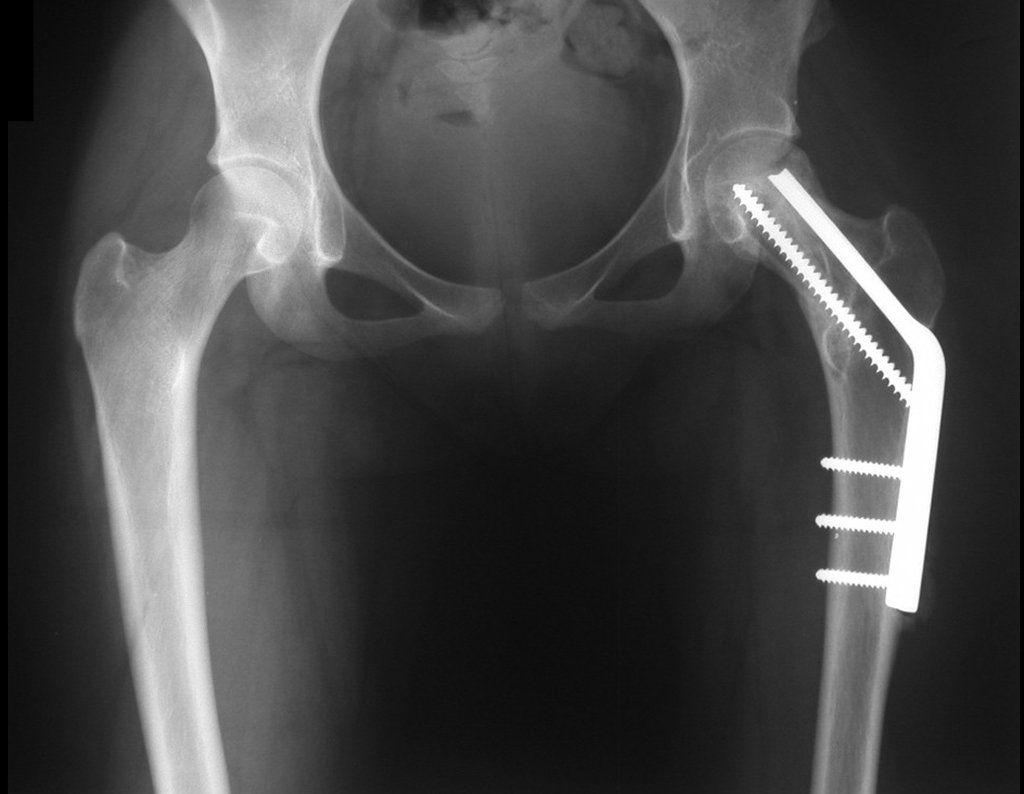
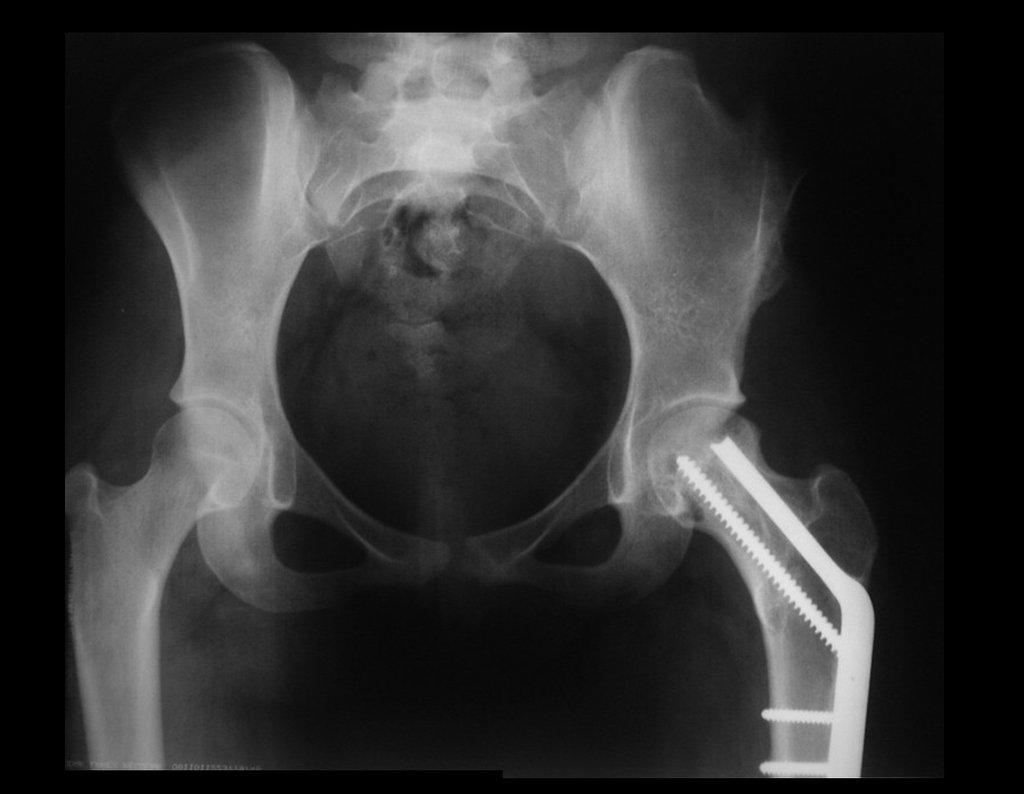
El paciente regresa el 22 de julio de 2015 quejándose de dolor al pasar de sentado a pararse, dolor al rotar la cadera y cojera. Los exámenes de imagen, provenientes de la resonancia magnética del 18 de julio de 2015, se analizan en las figuras 39 a 59.
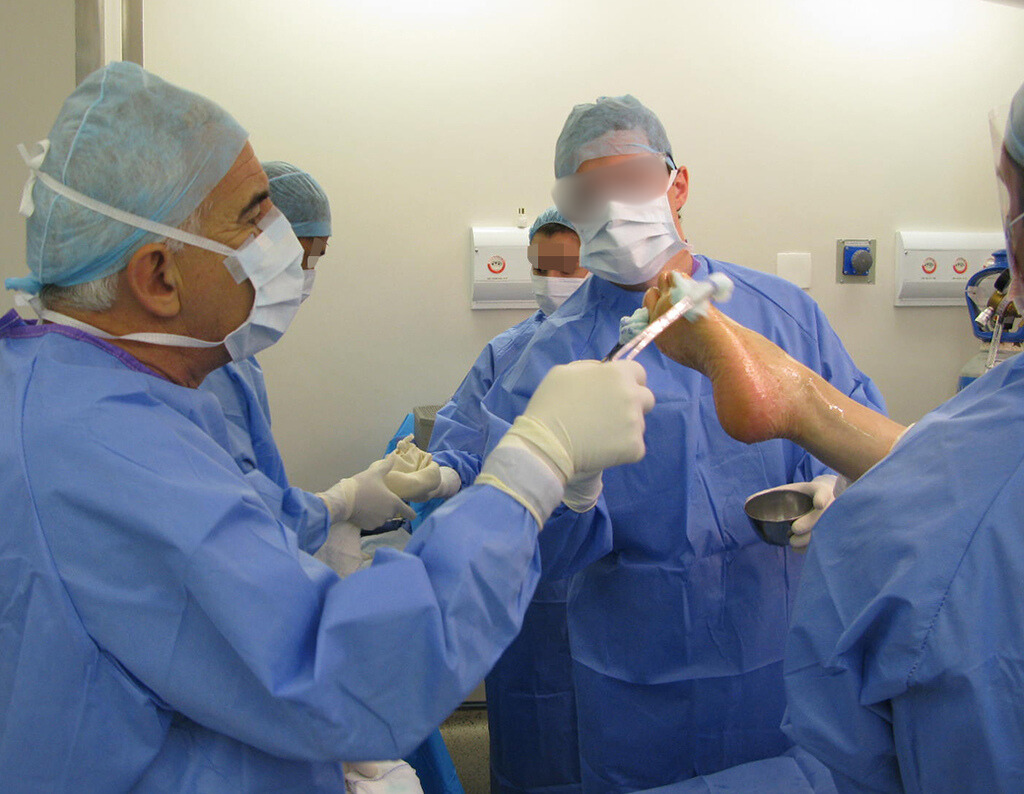
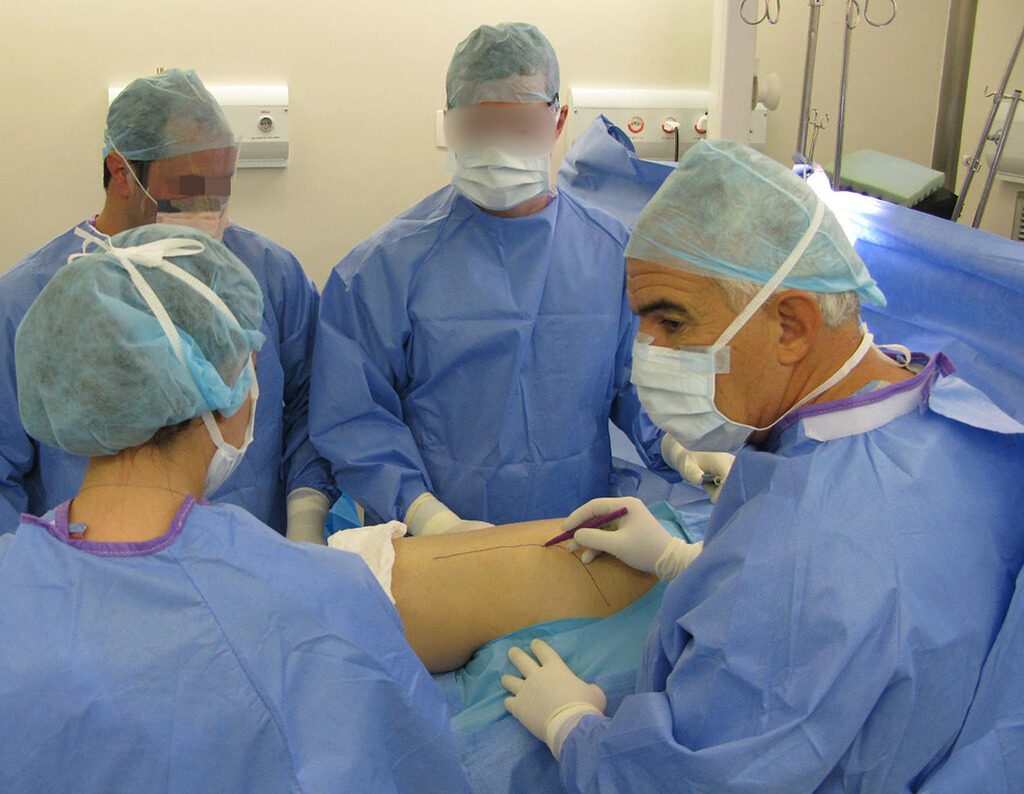
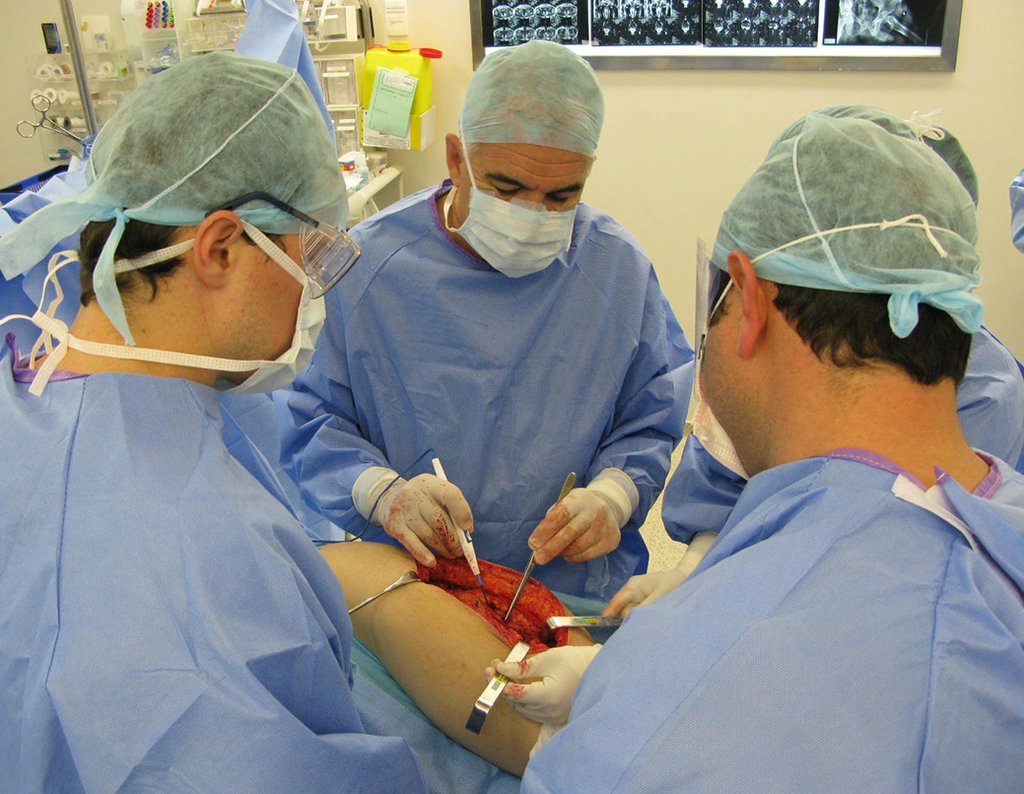
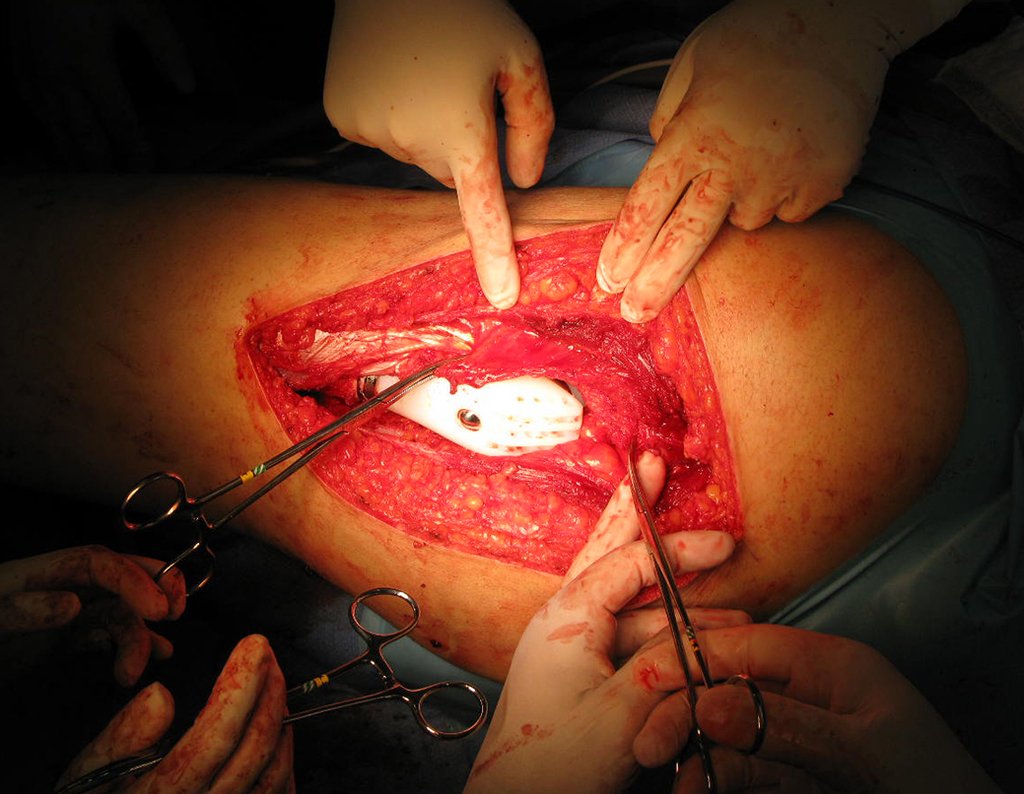
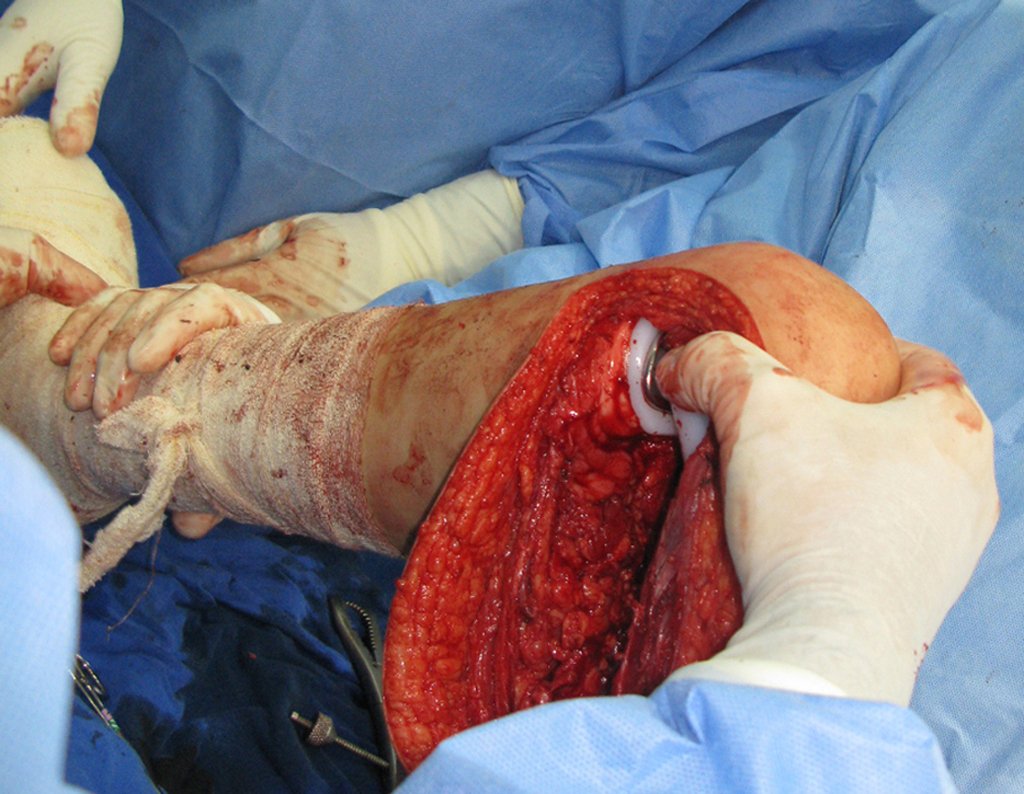
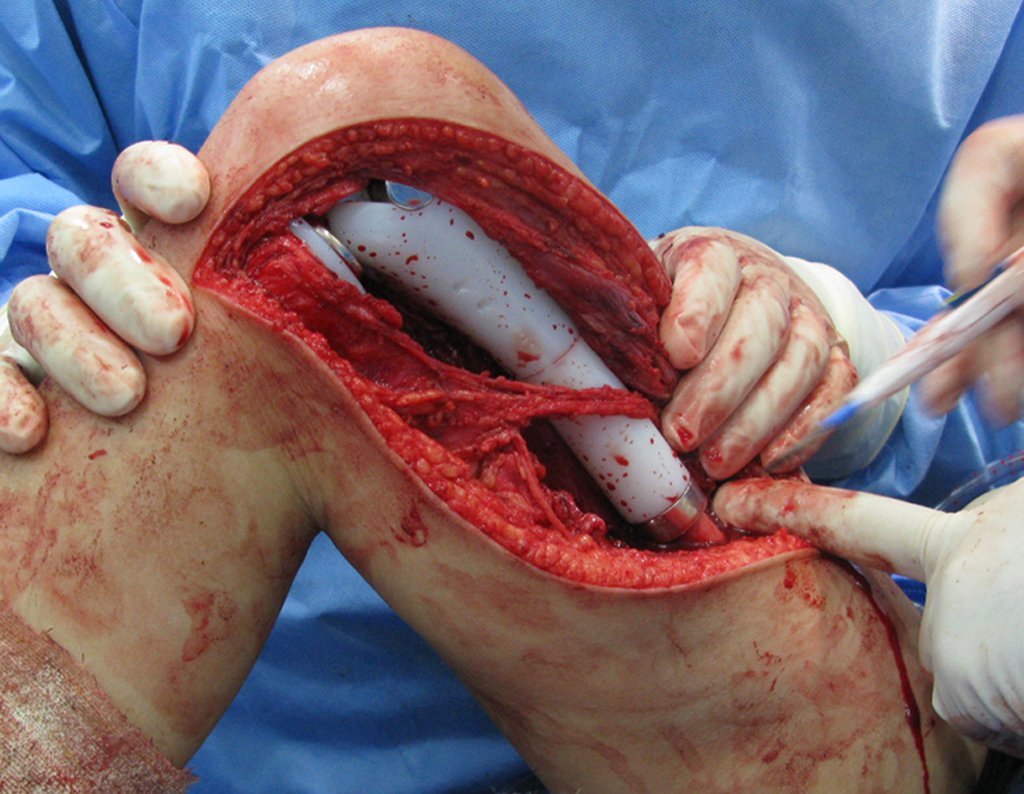
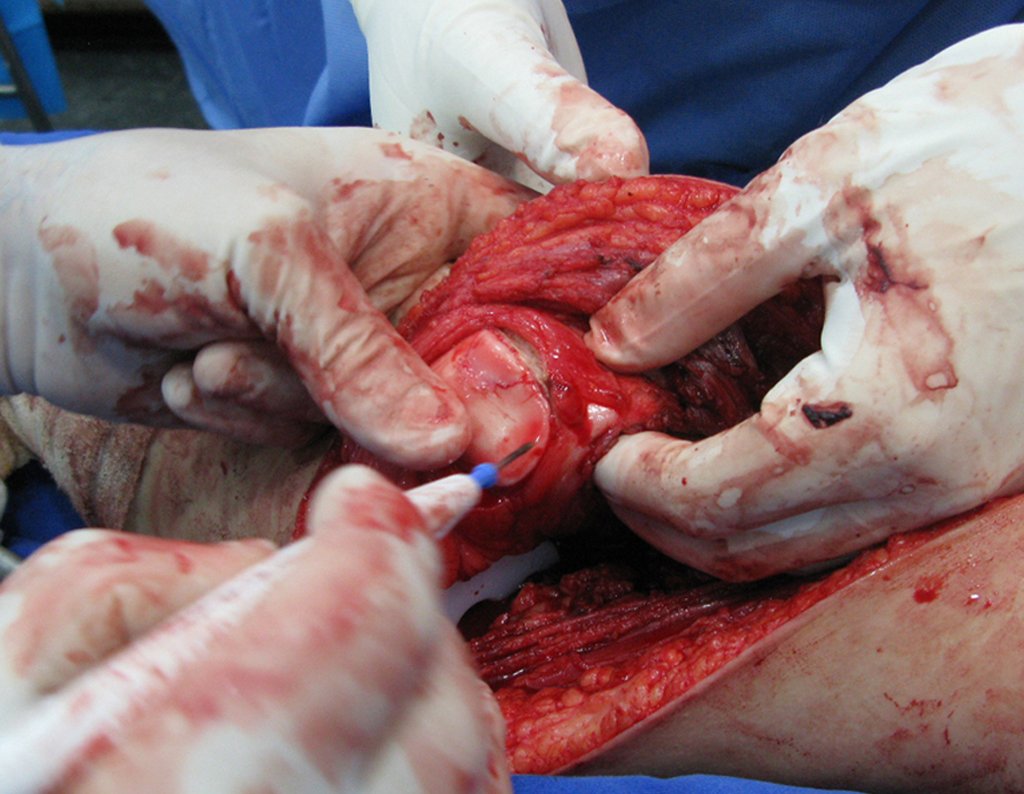
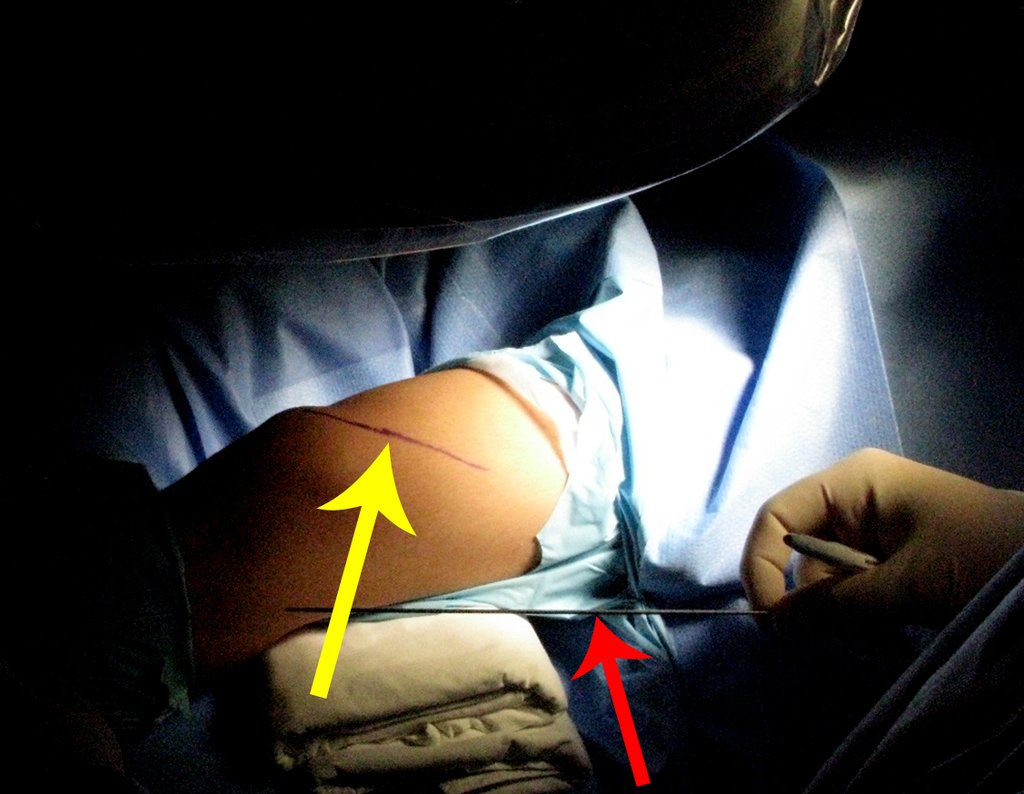
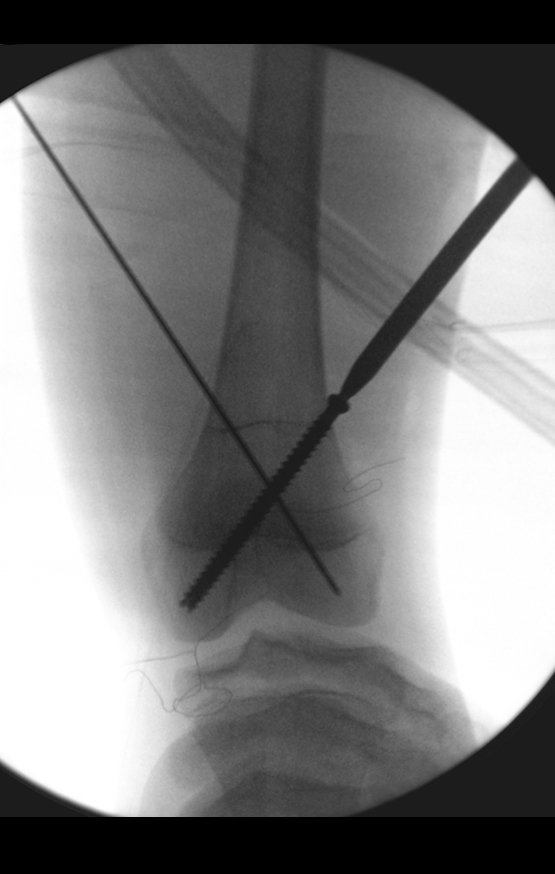
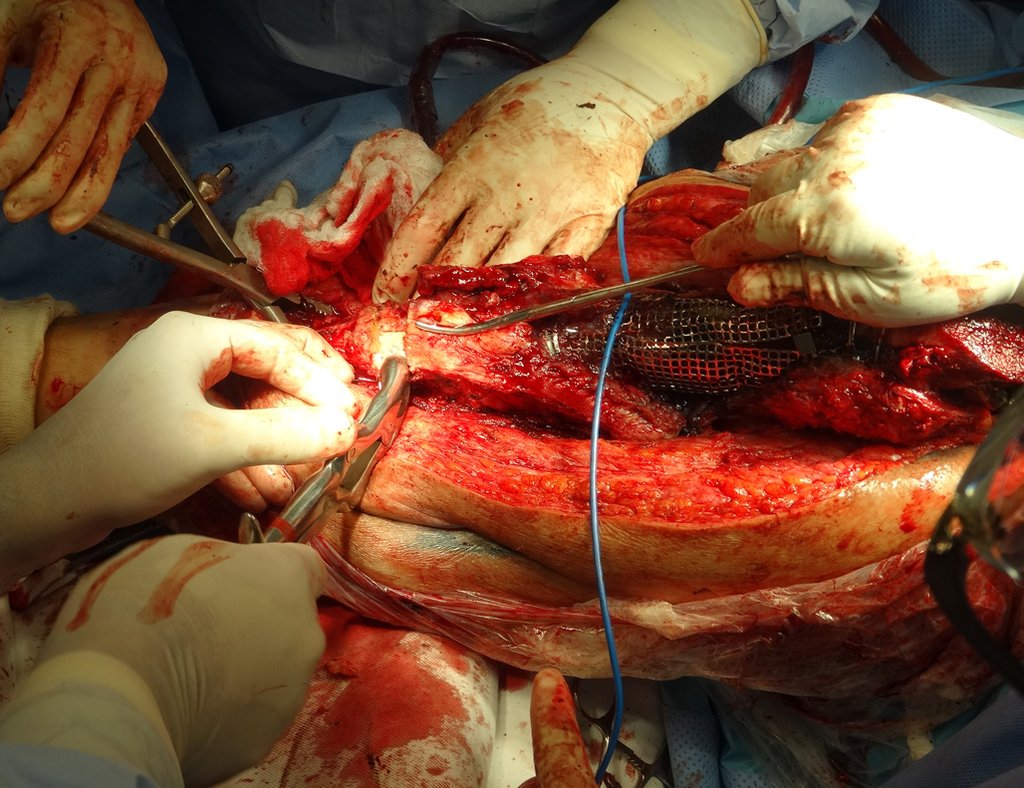
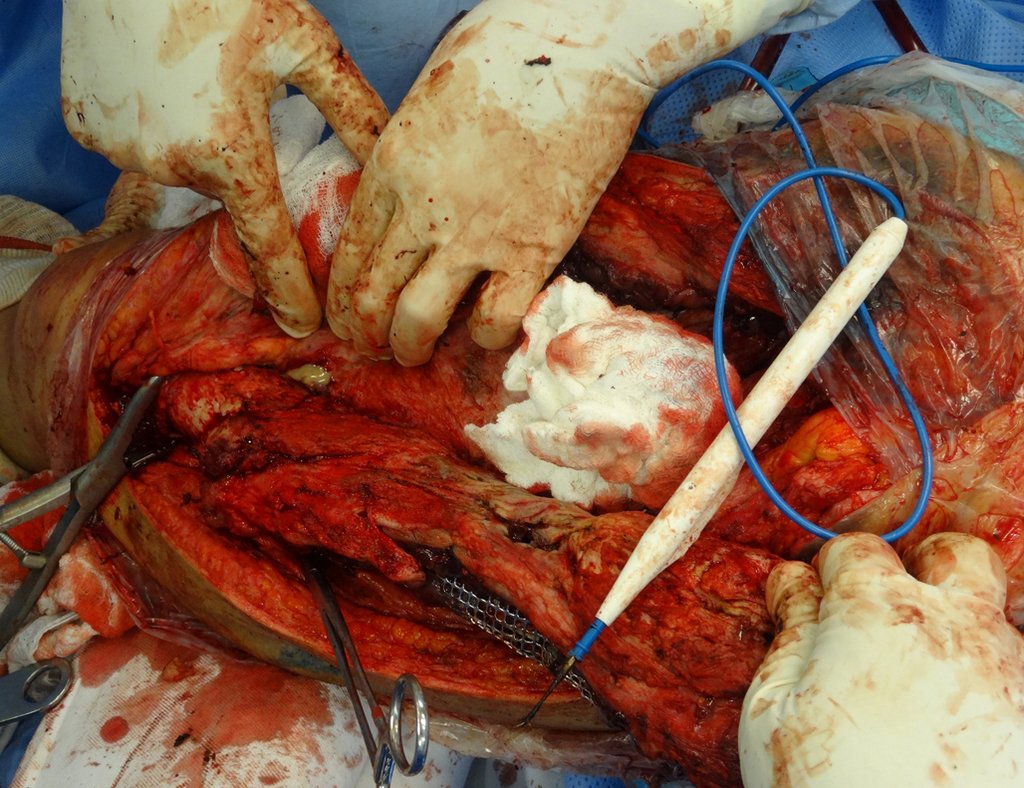
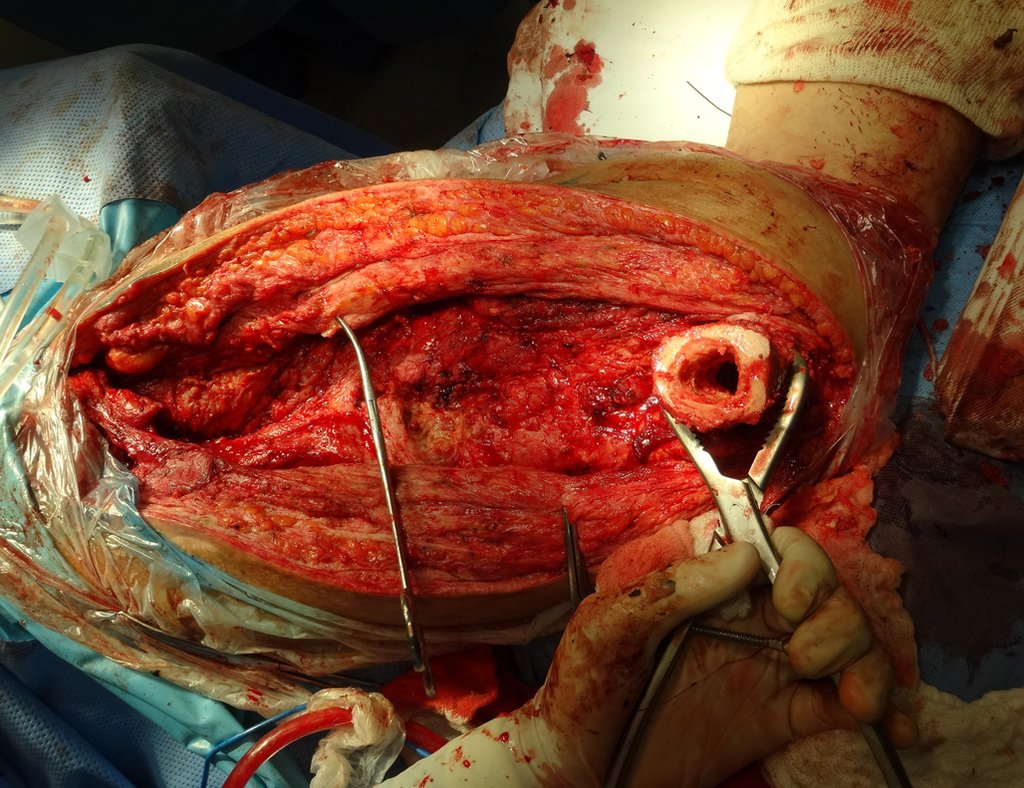
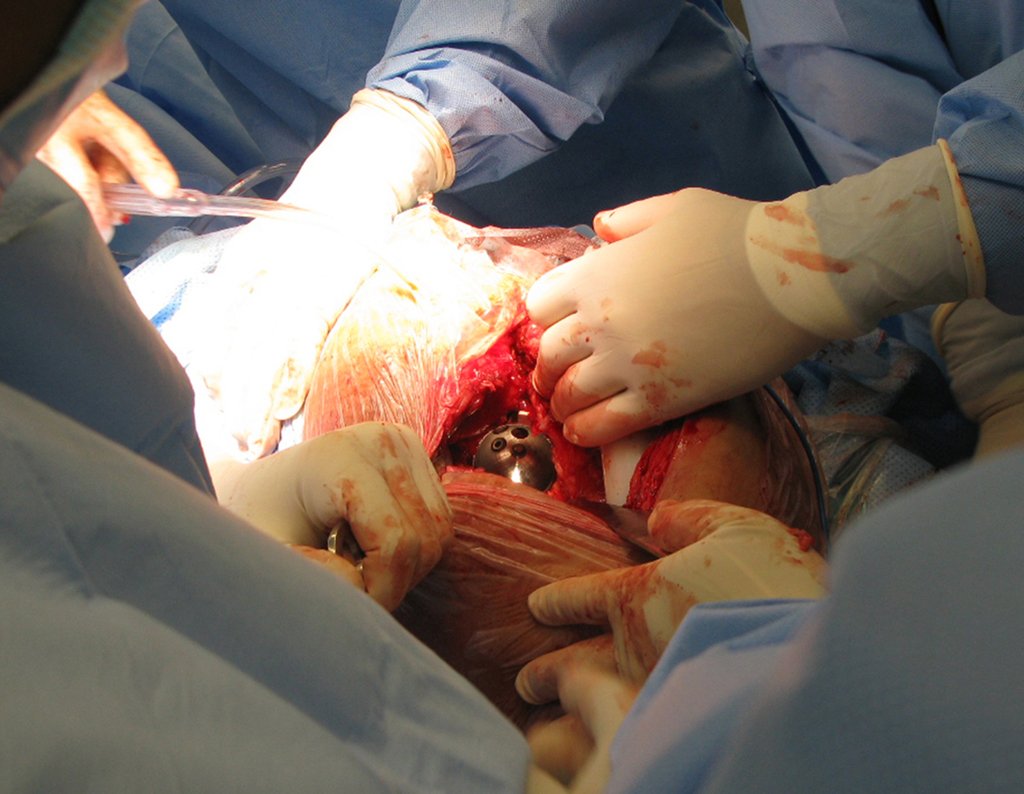
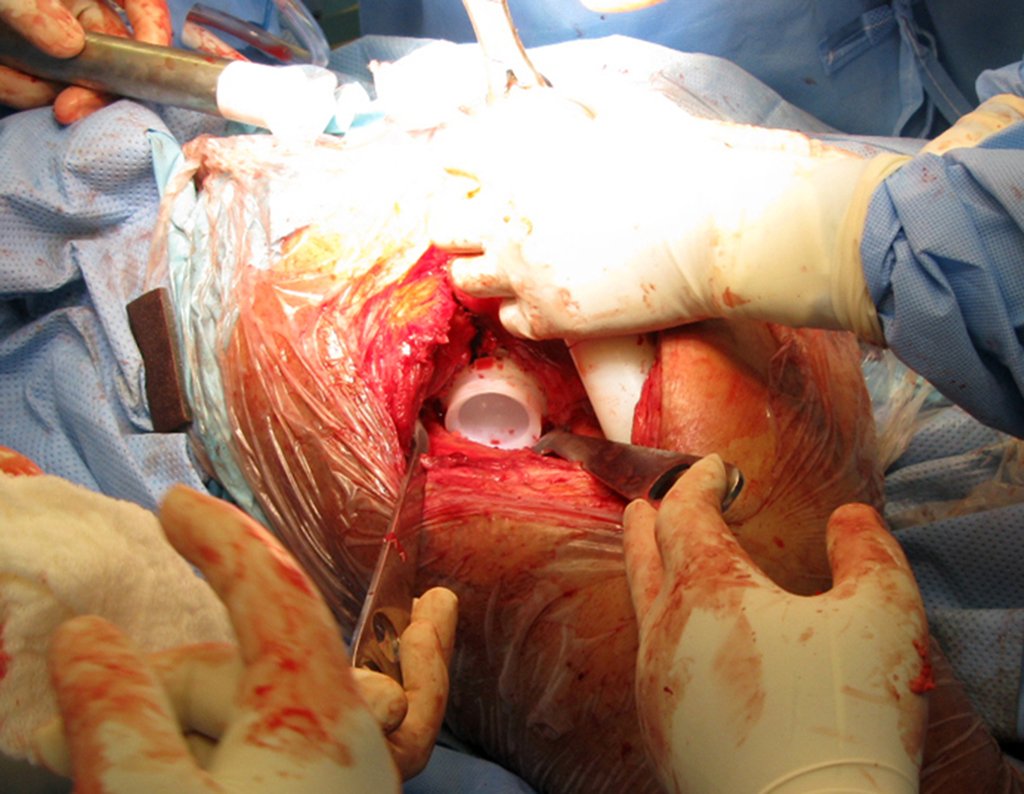
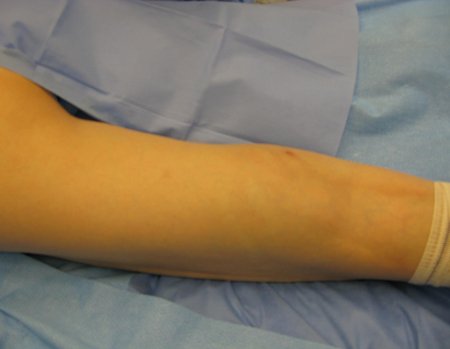
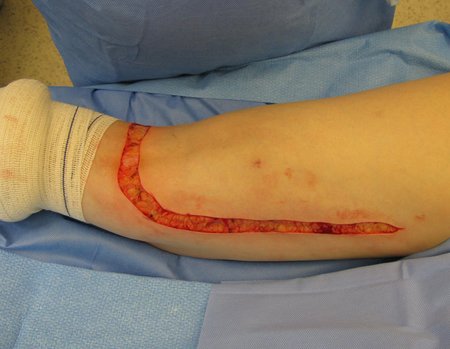
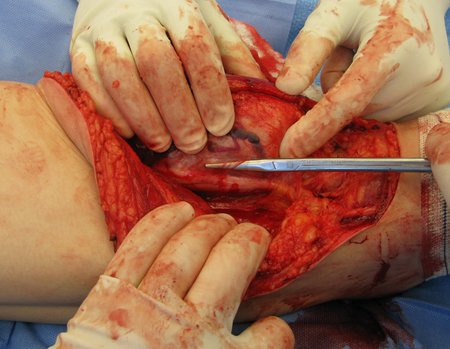
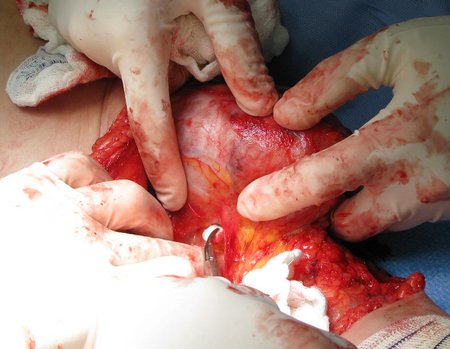
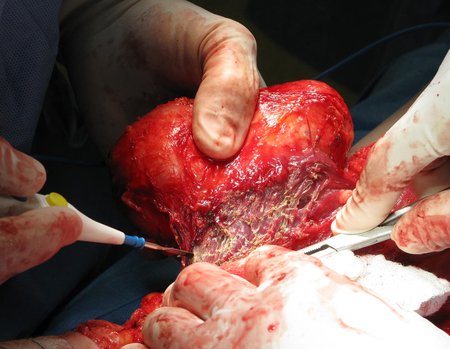
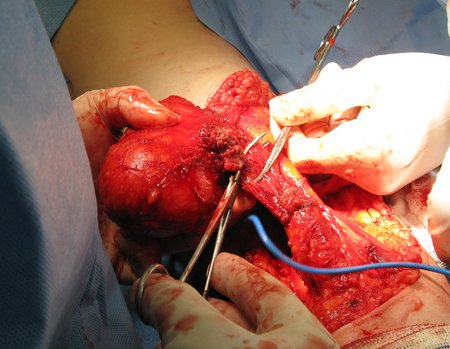
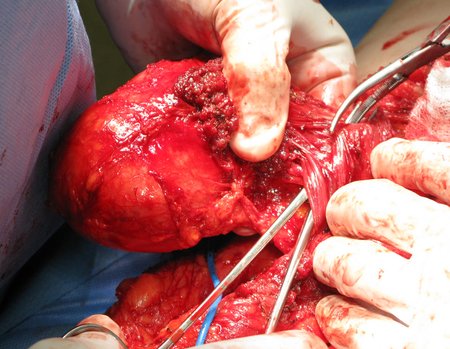
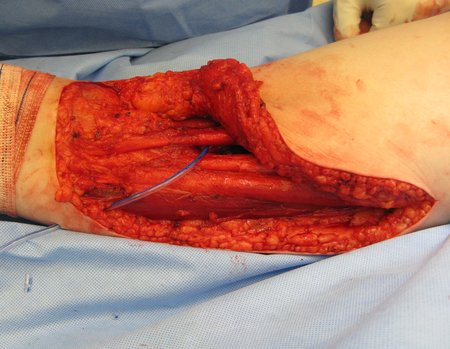
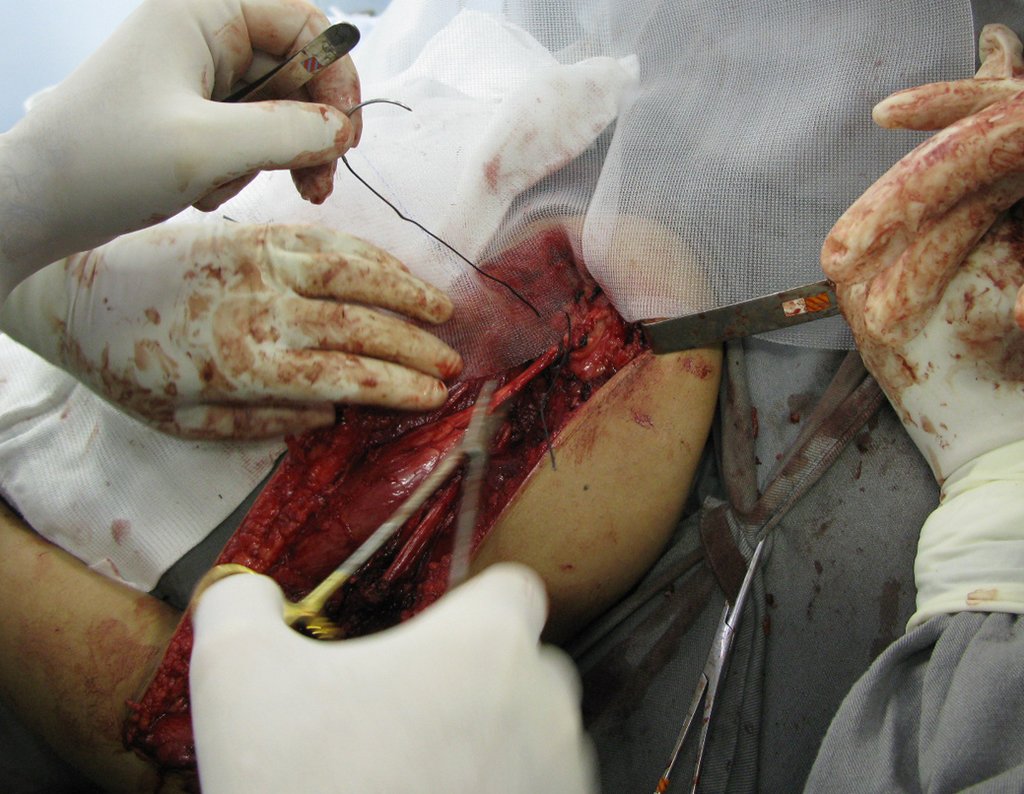
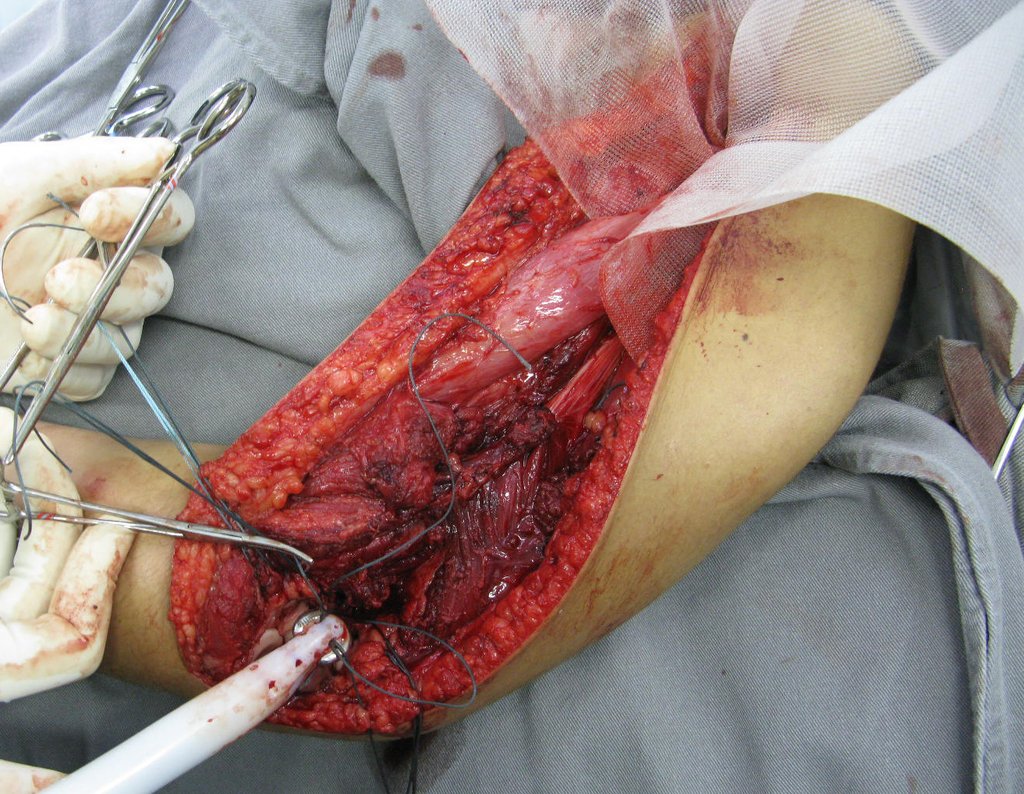
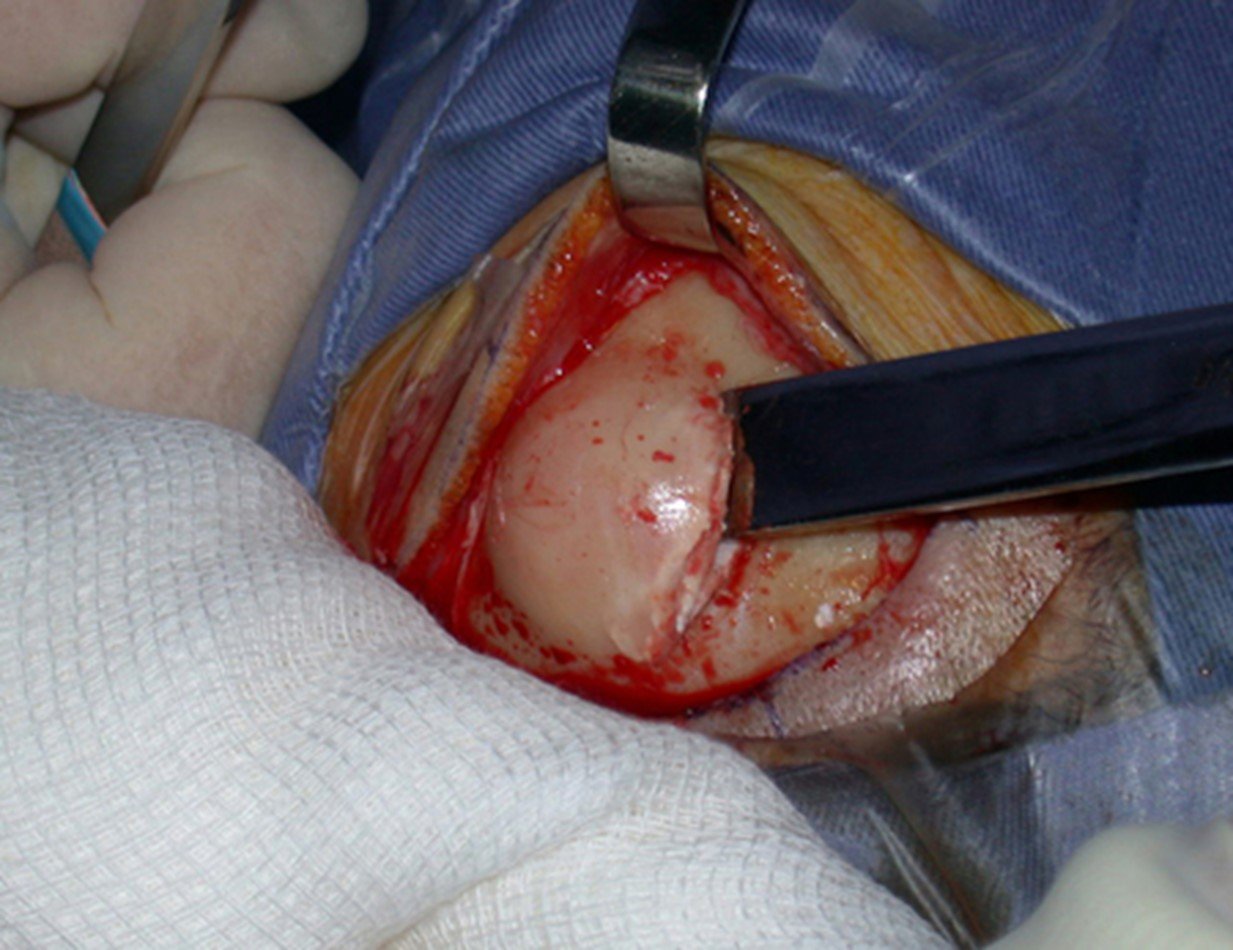
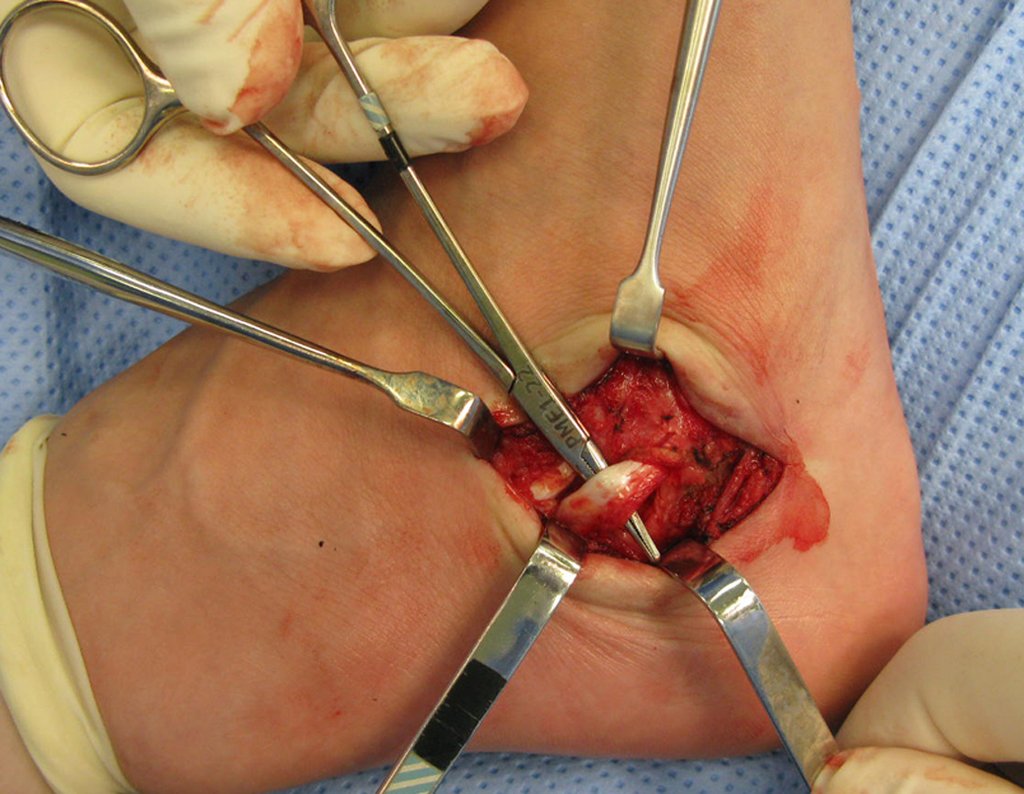
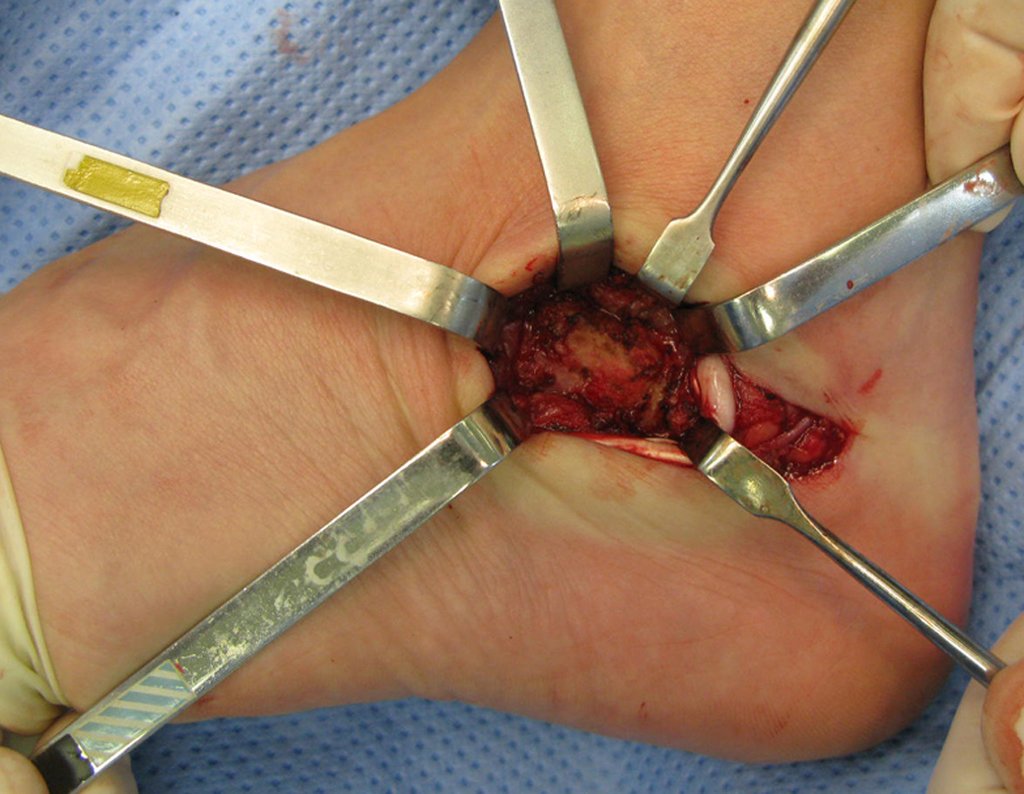
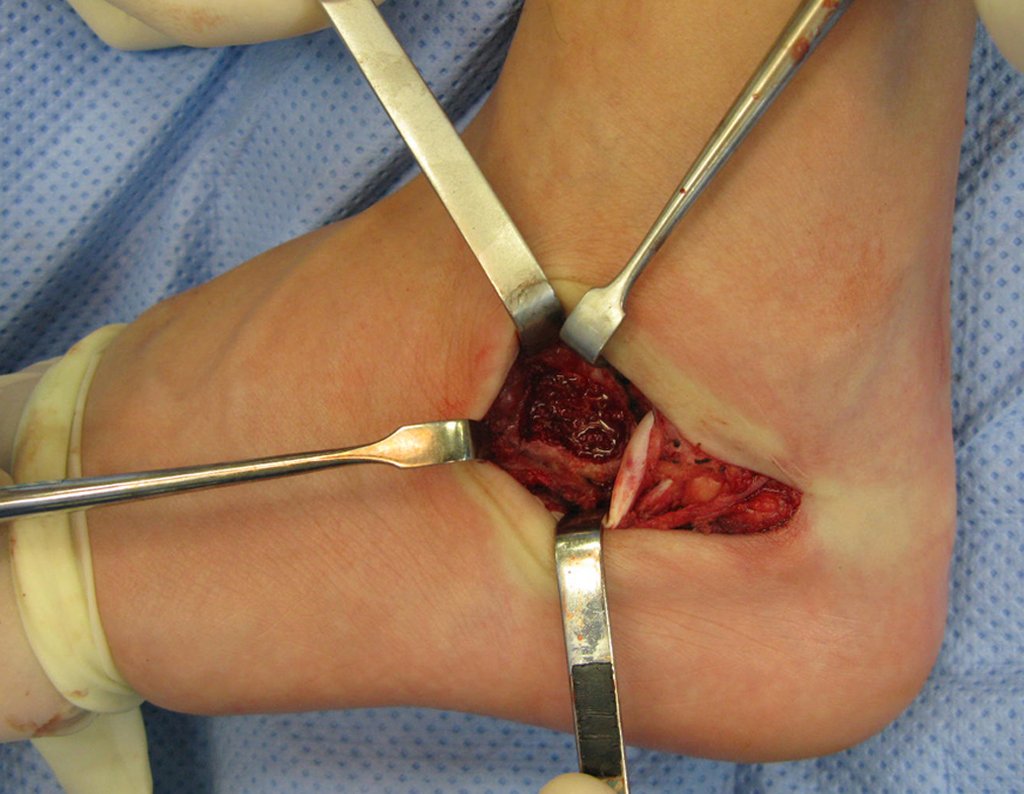
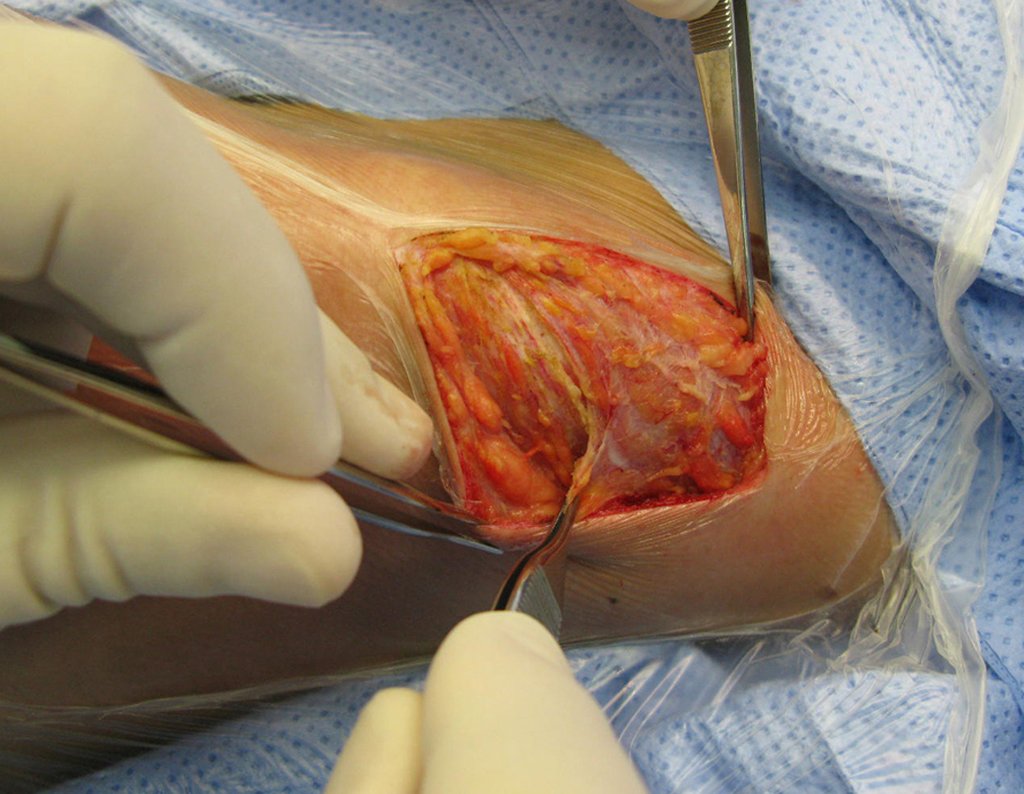
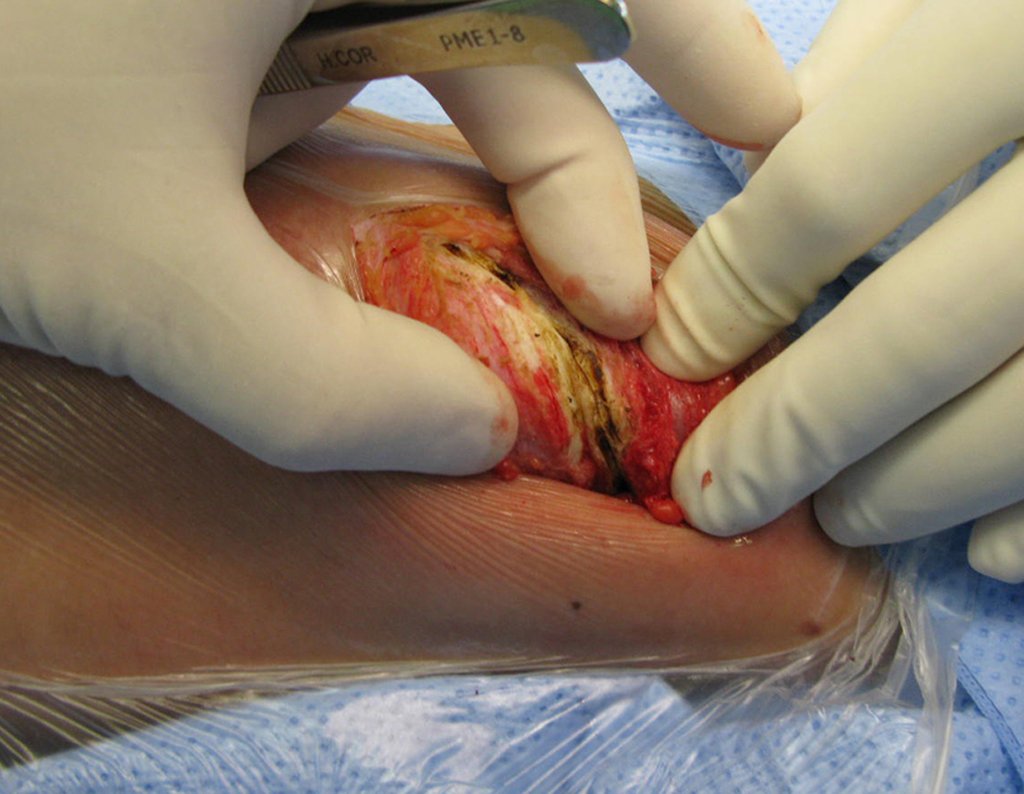
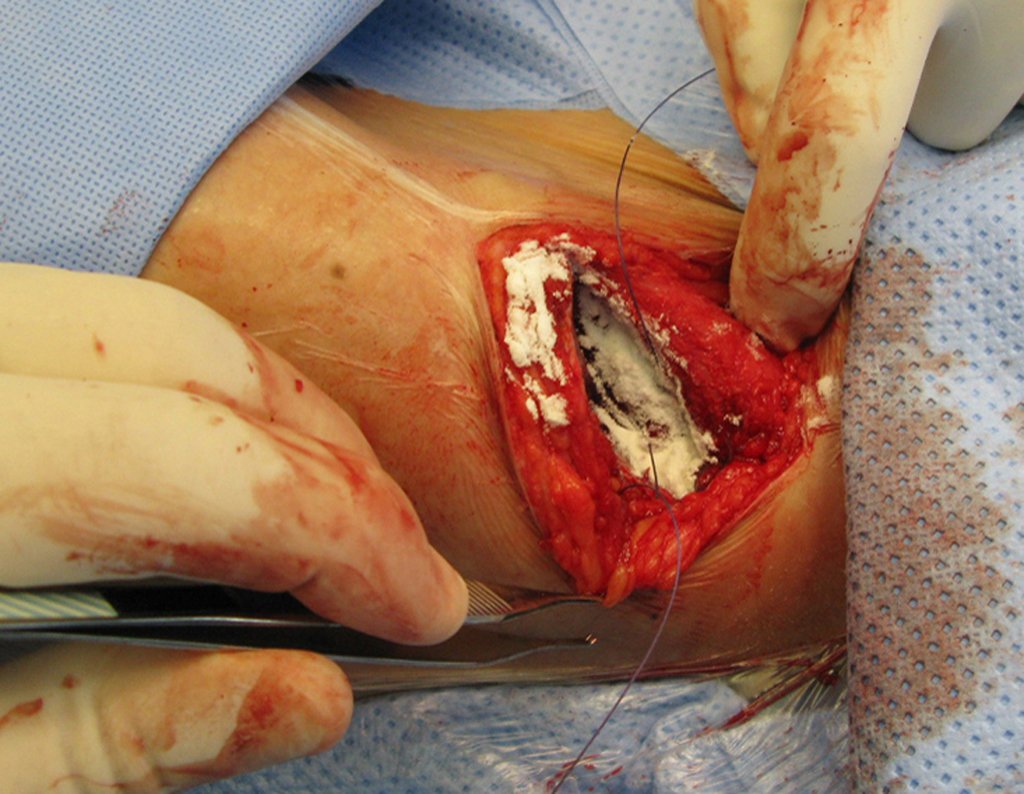
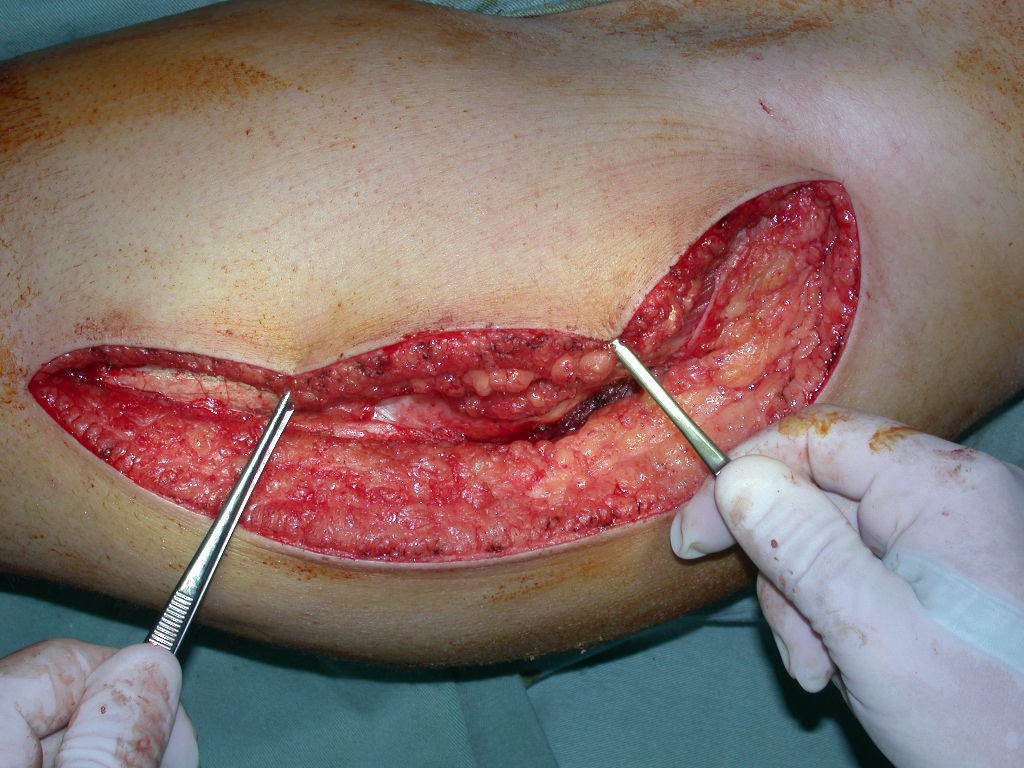
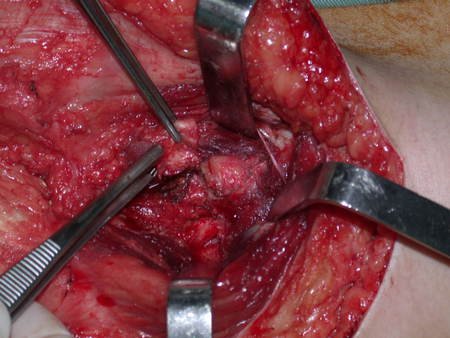
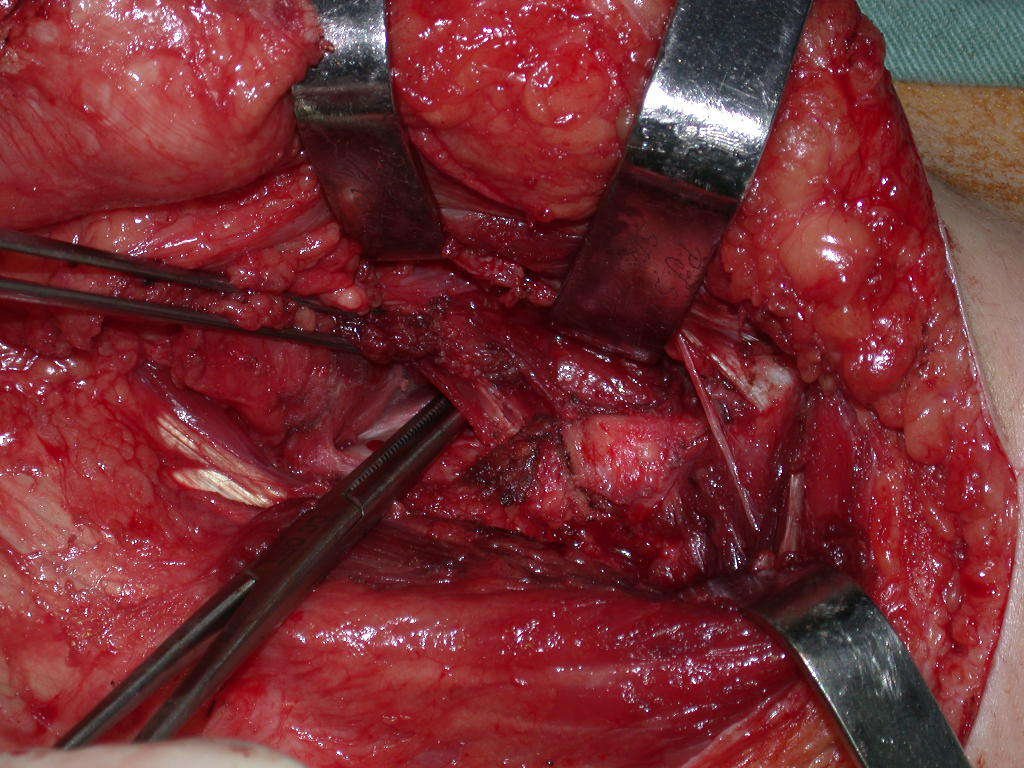
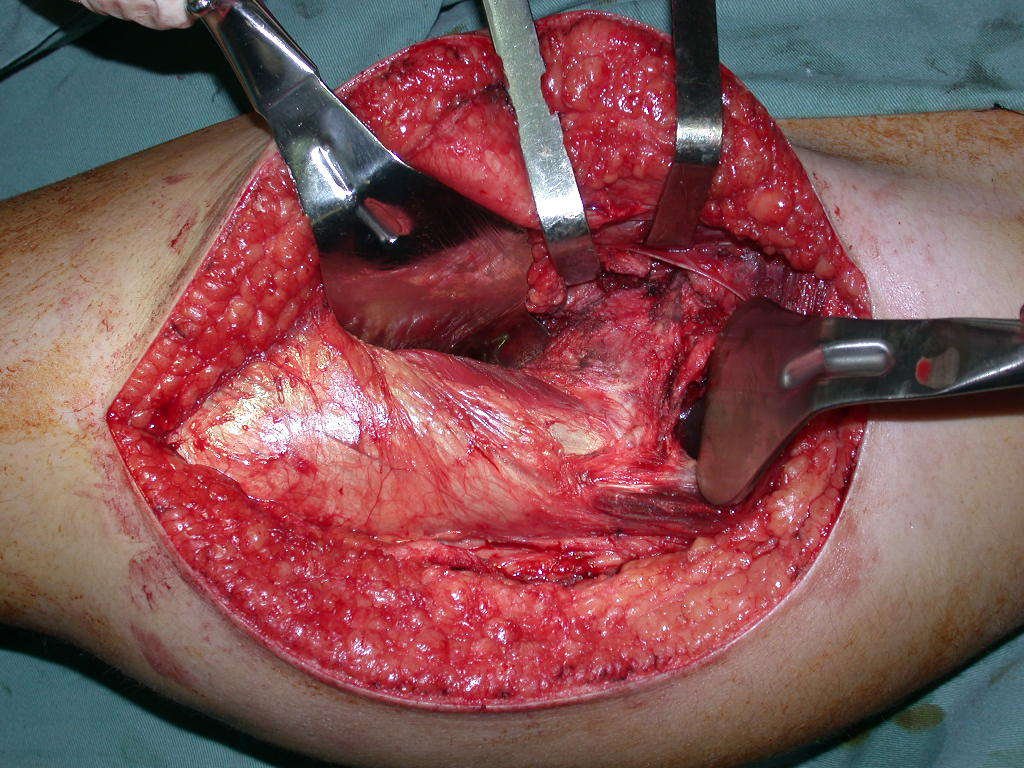
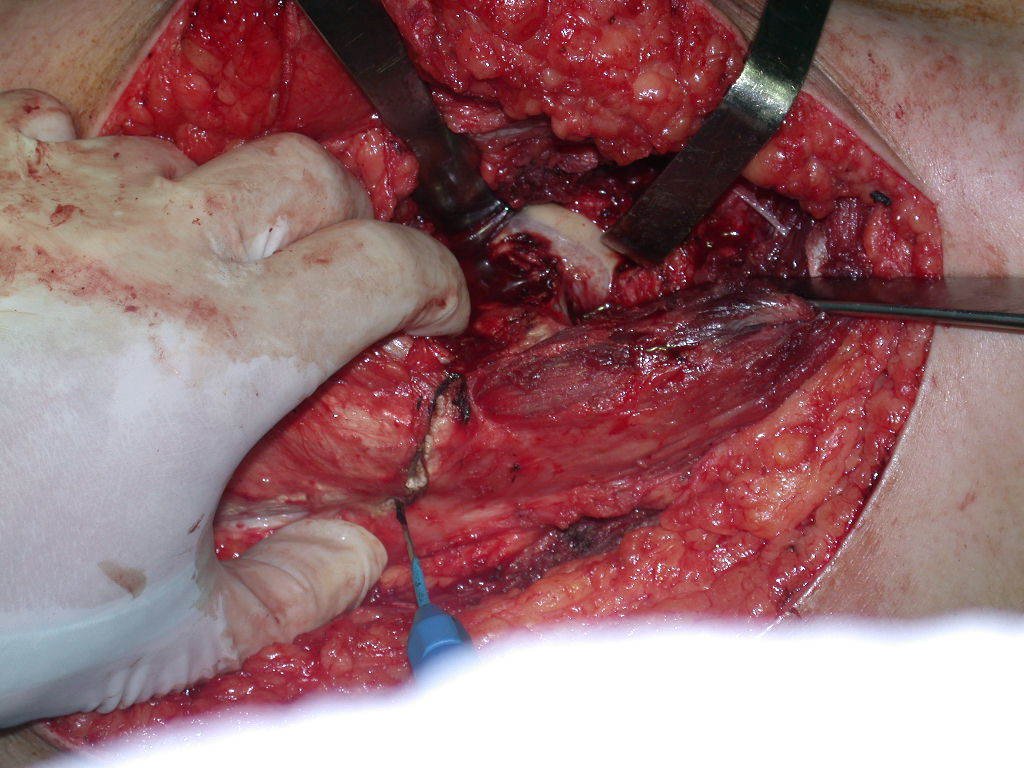
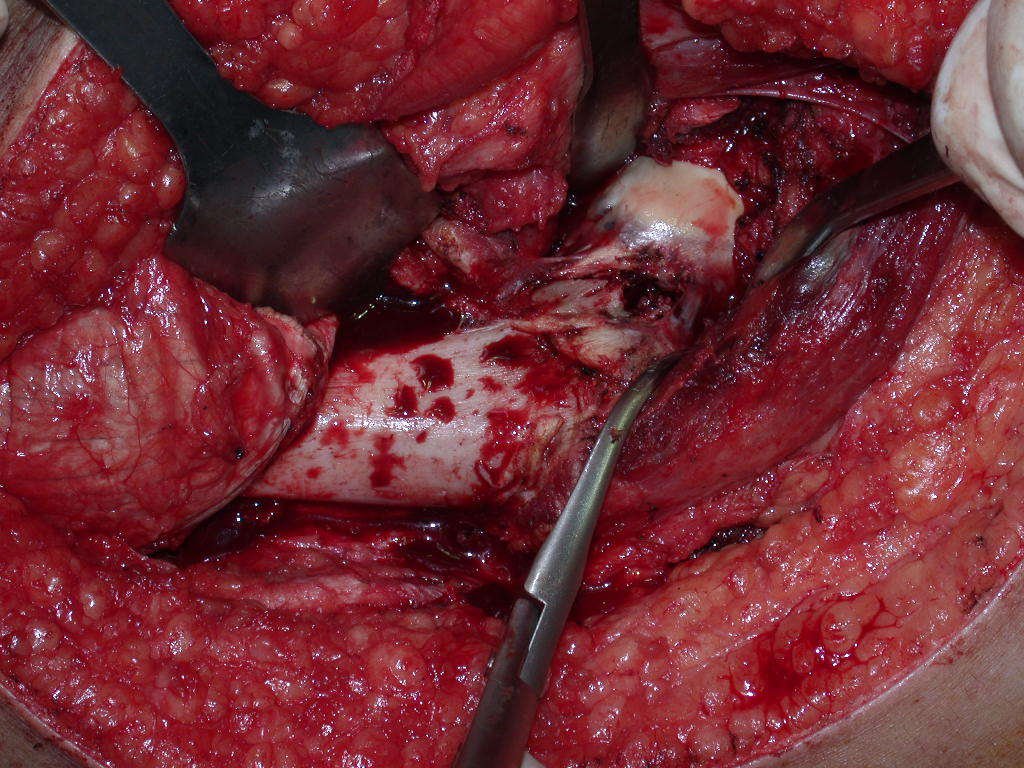
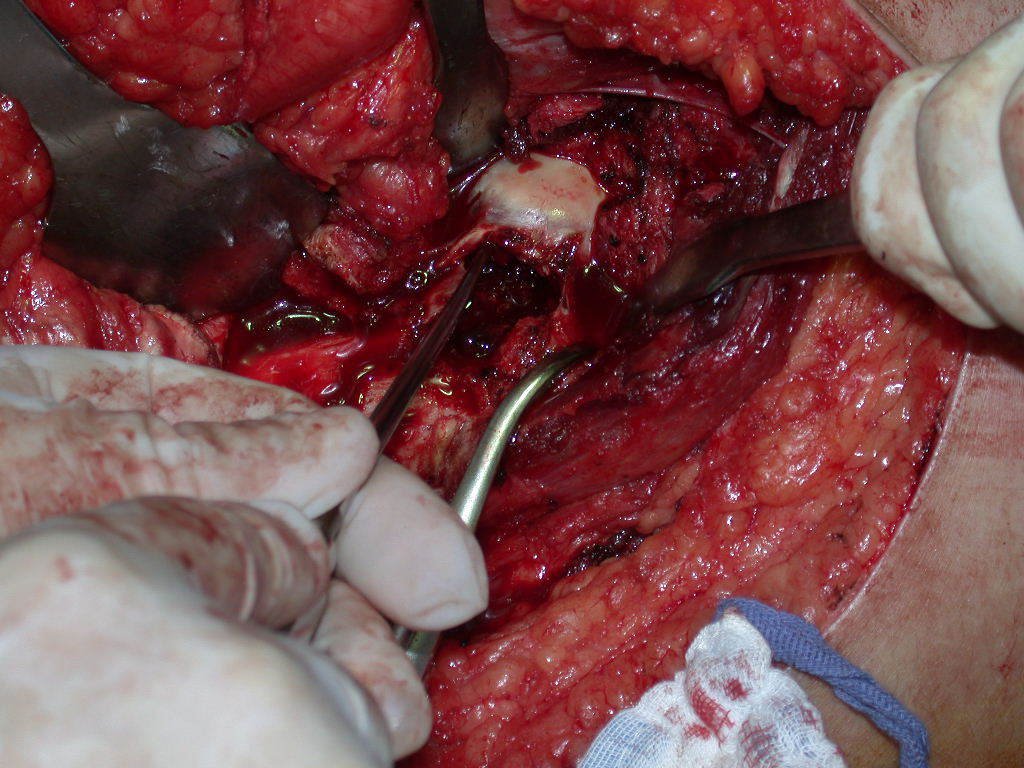
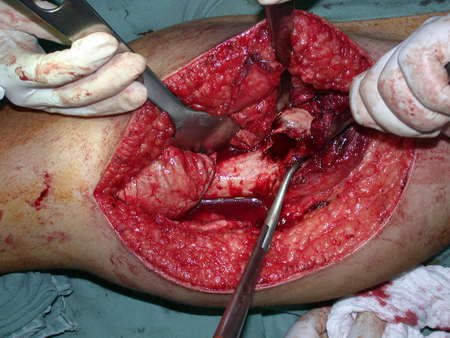
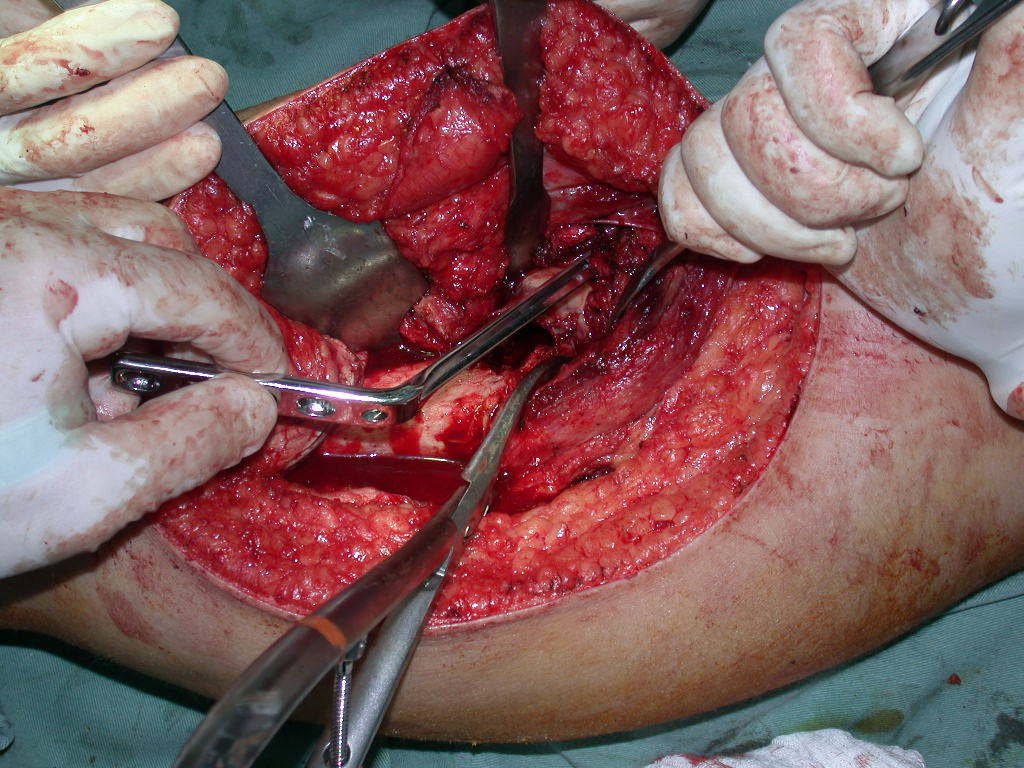
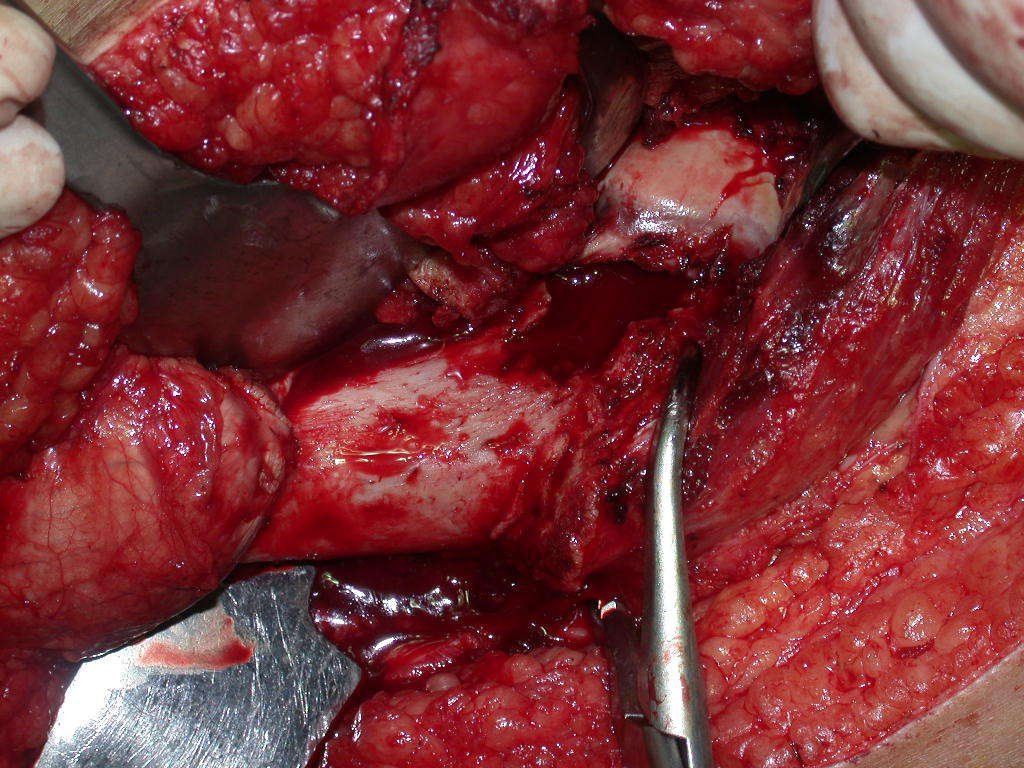
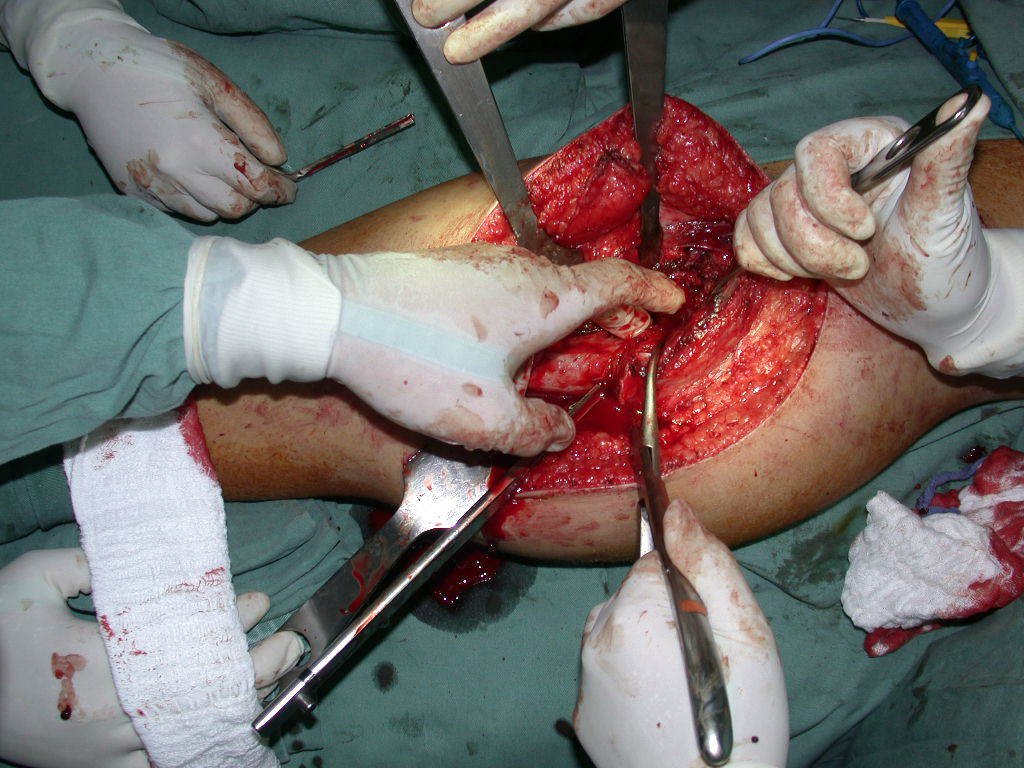
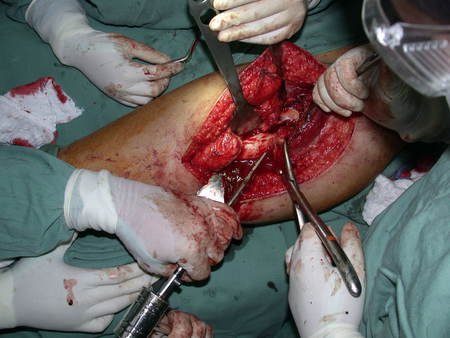
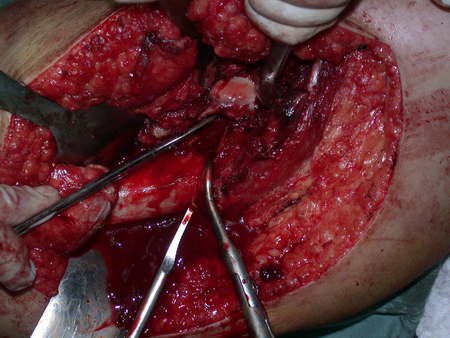
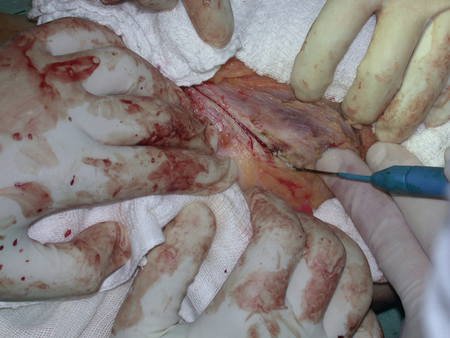
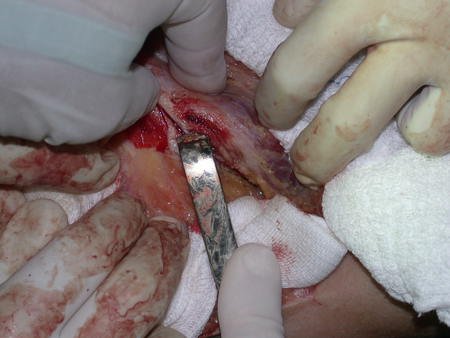
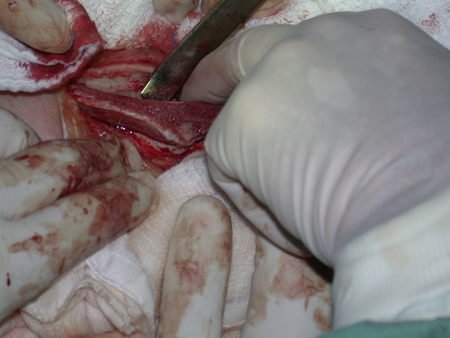
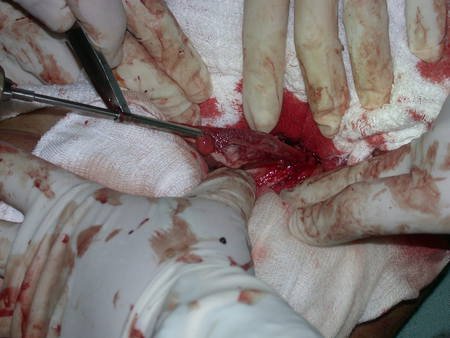
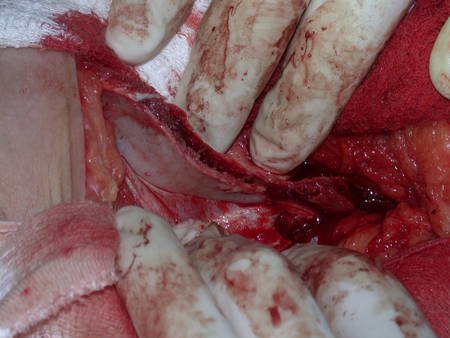
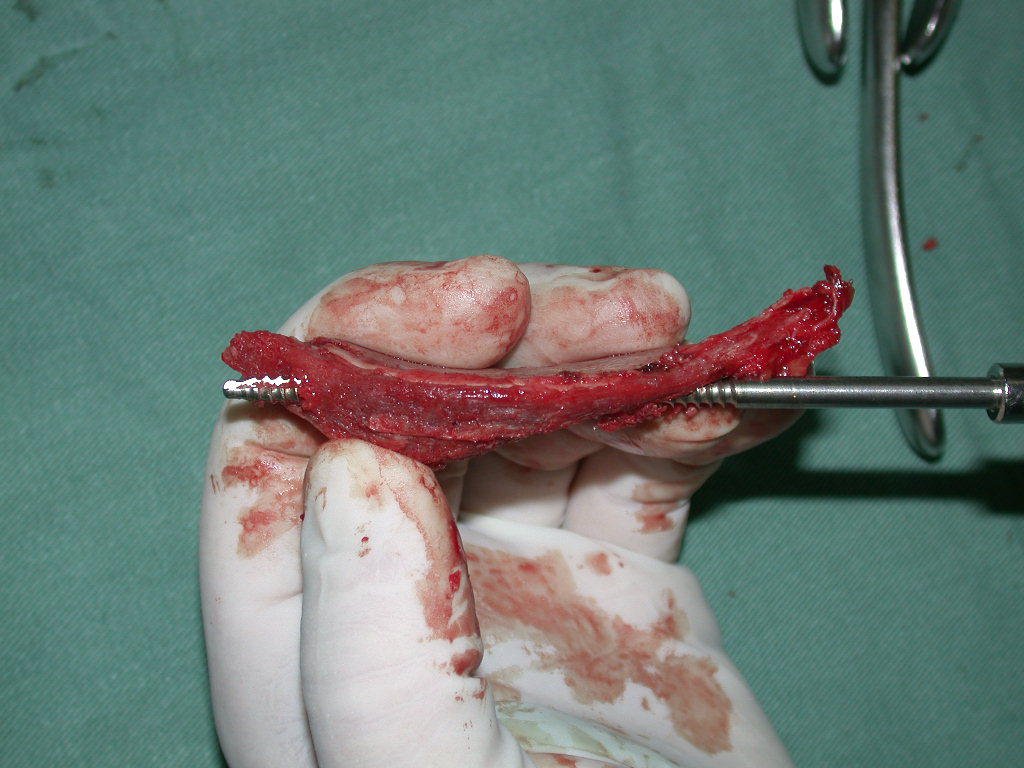
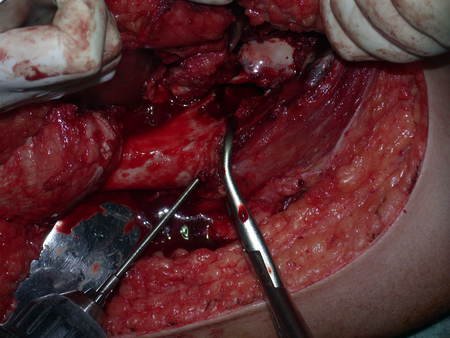
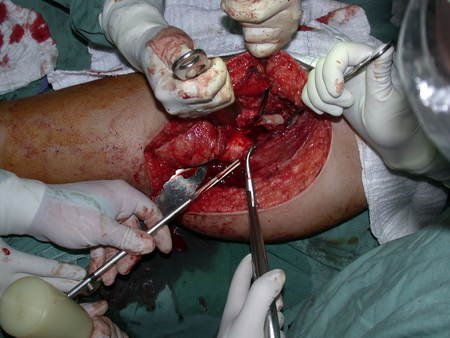
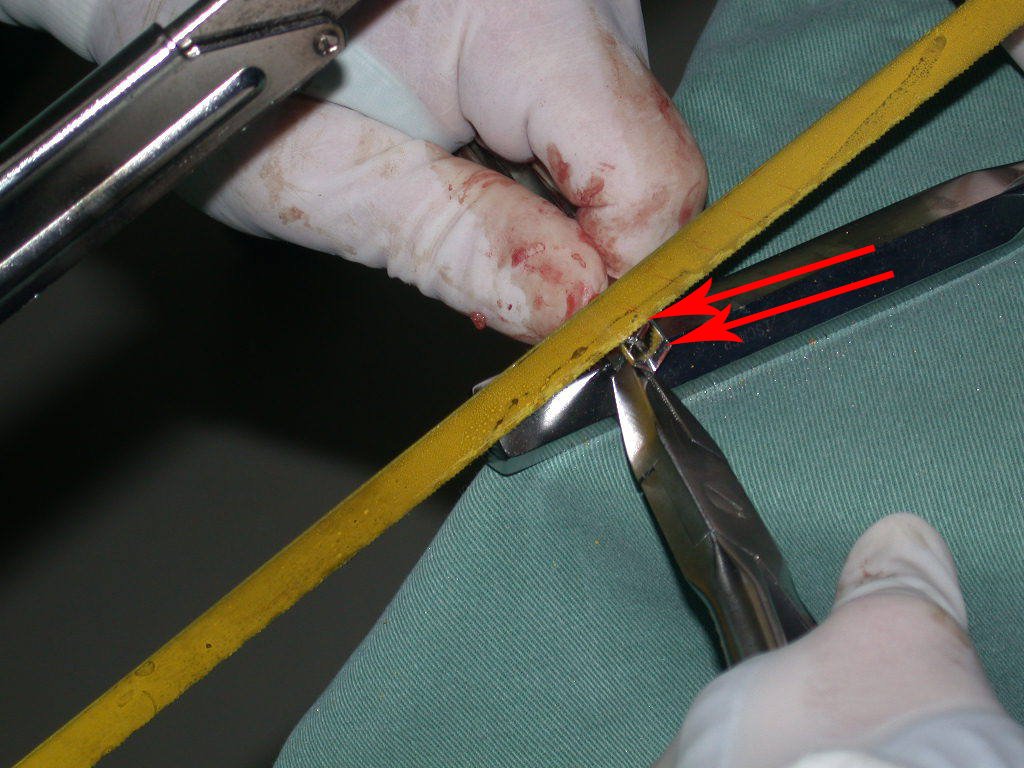
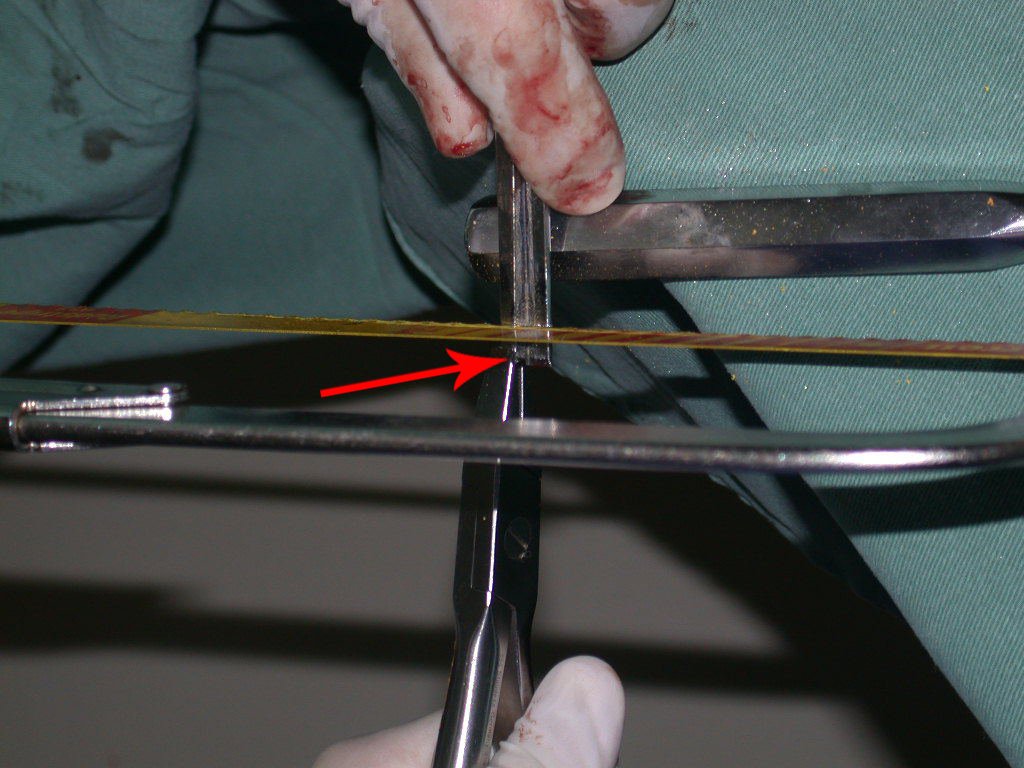
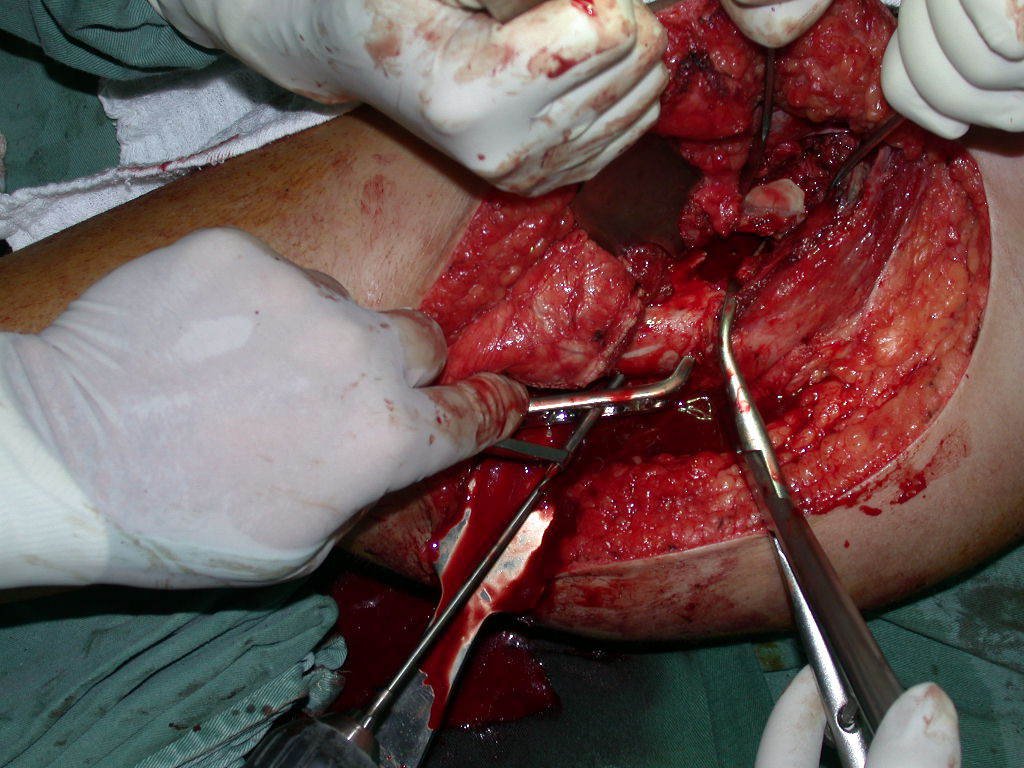
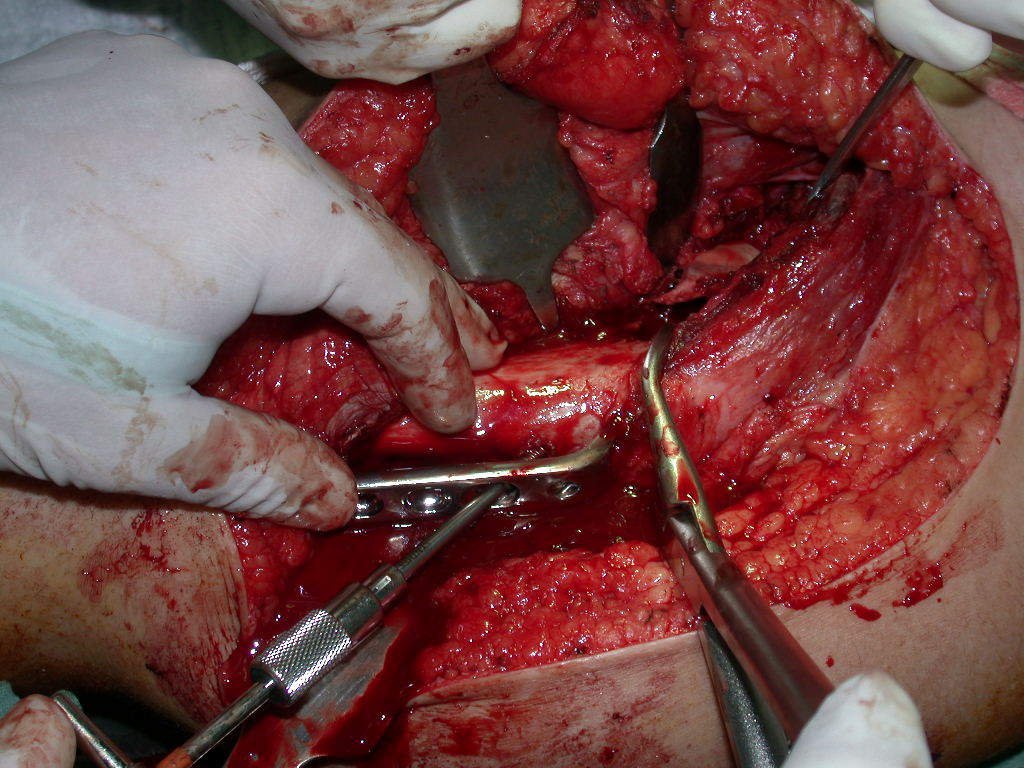
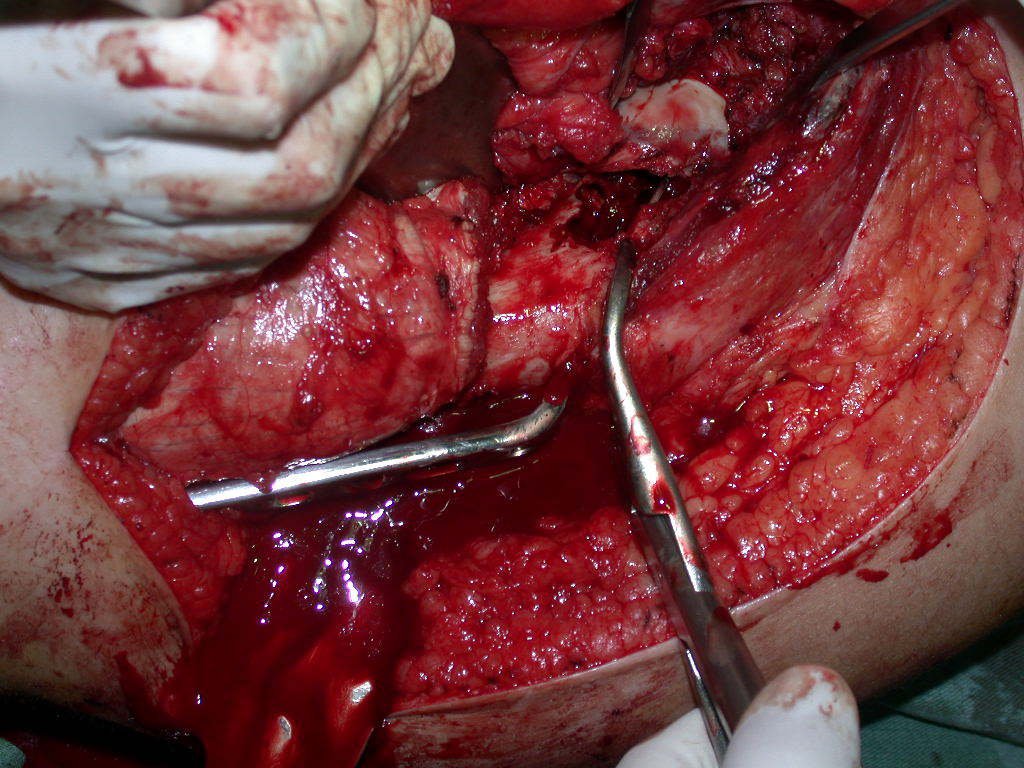
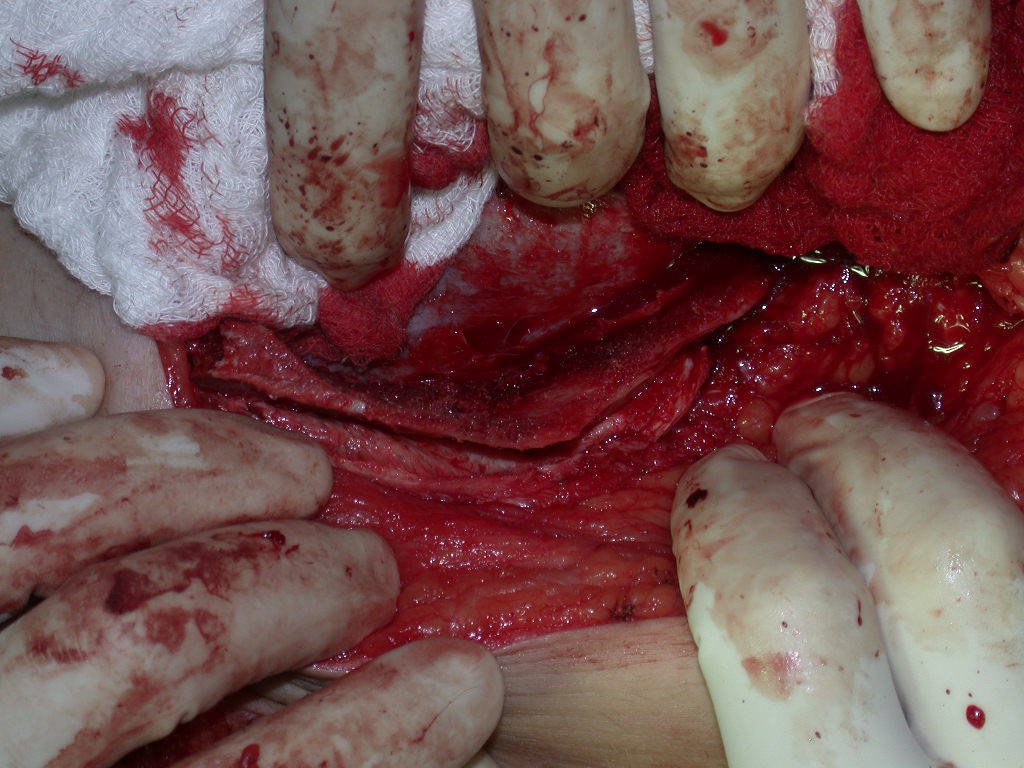
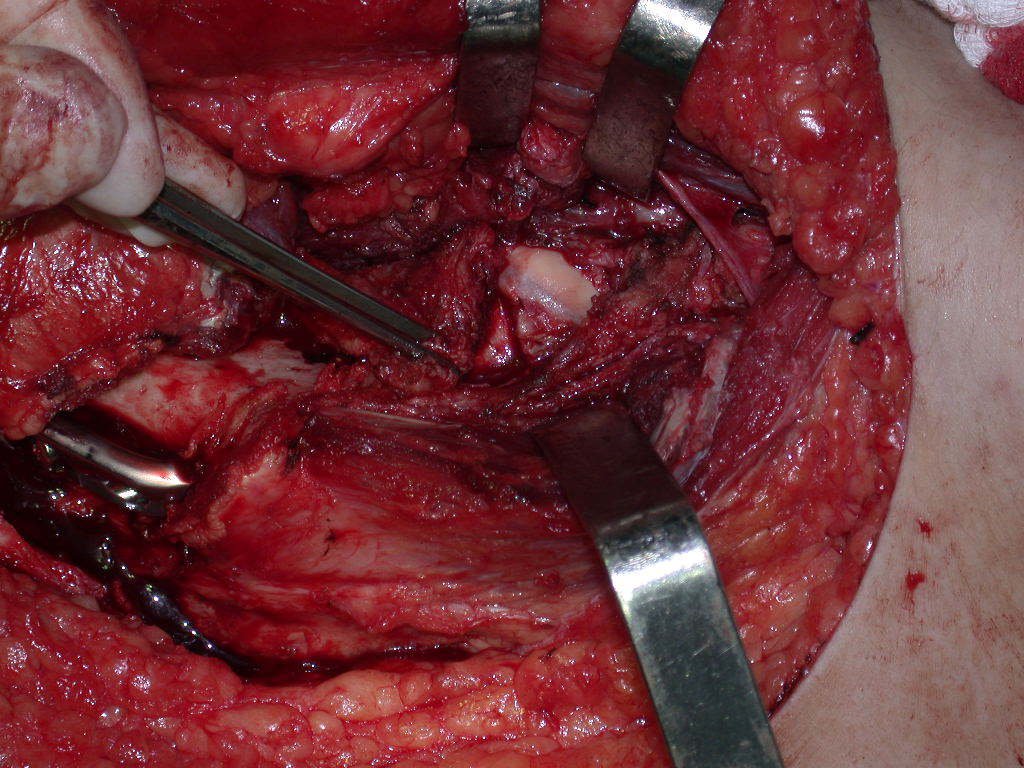
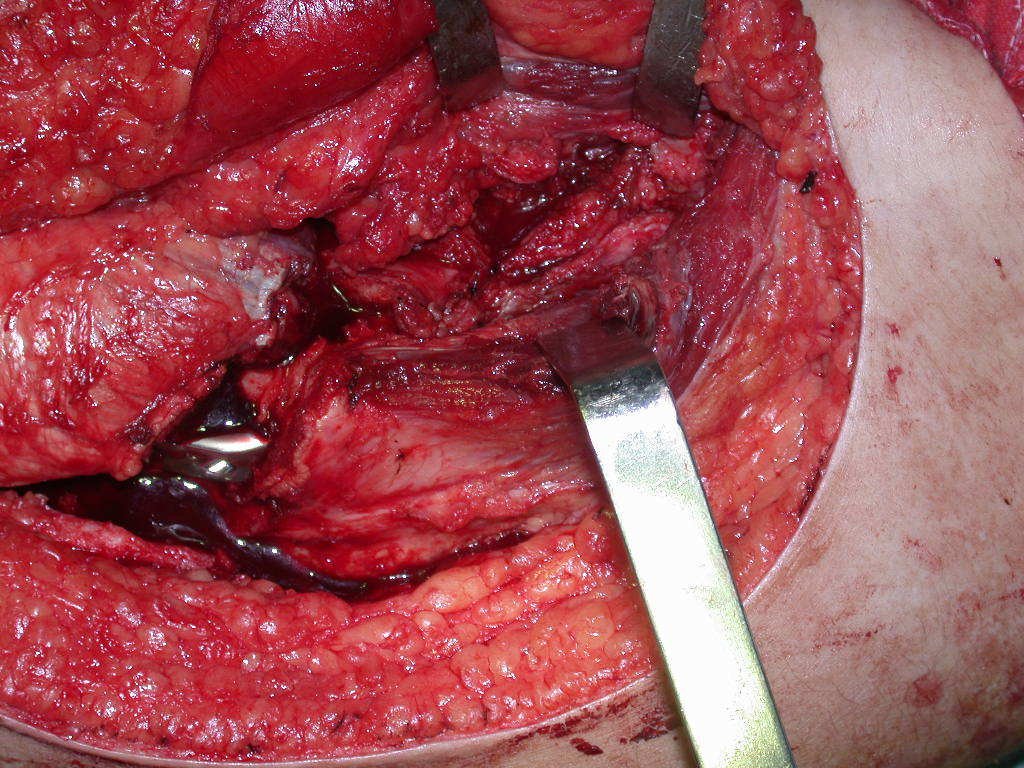
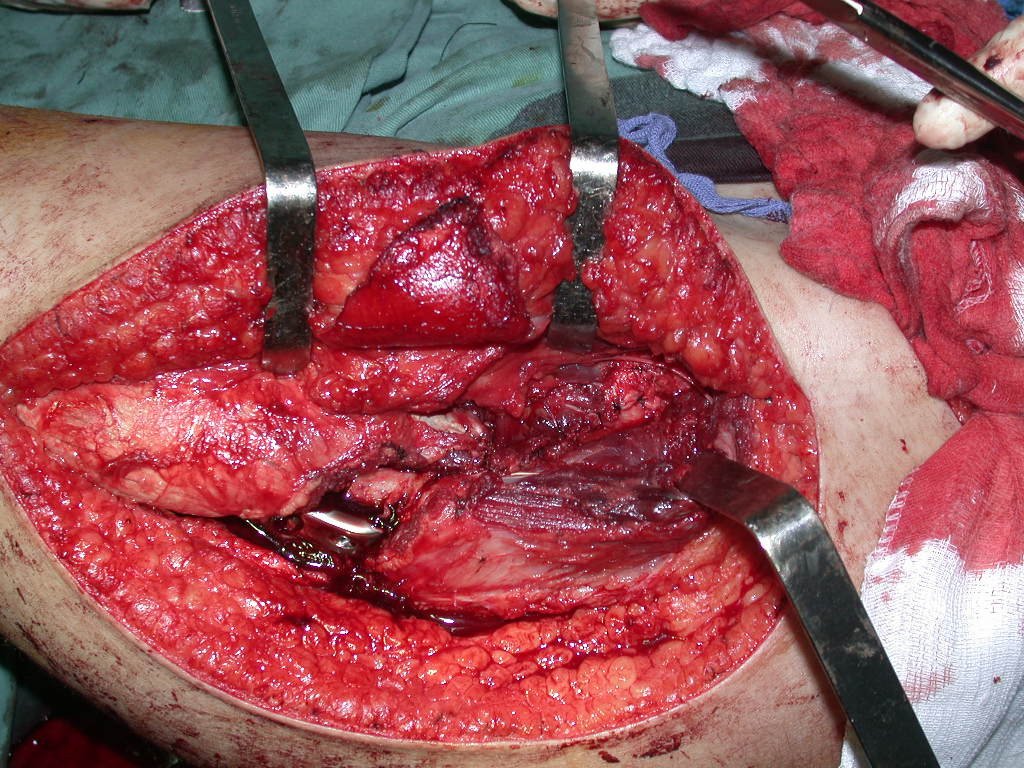
La cirugía debe realizarse con precaución, profundizando la incisión poco a poco , para lograr la hemostasia por capas . Una anestesia adecuada no debe inducir hipotensión , ya que es la única forma en que el cirujano puede observar adecuadamente los capilares seccionados y asegurarse de que está realizando una operación sin pérdida de sangre, ni en ese momento ni en un momento posterior.
En las cirugías oncológicas, el cirujano no puede tener mano “pesada”. El paciente ya está debilitado por la enfermedad, por la quimioterapia, posiblemente ya haya recibido transfusiones y se debe evitar la necesidad de reposición de sangre. El garroteo no debe utilizarse excepto en cirugías de amputación.
Durante la anestesia el paciente no puede sentir dolor. No basta con estar sedado, ya que si hay dolor aumenta la presión, dificultando la hemostasia con electrocauterio.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com