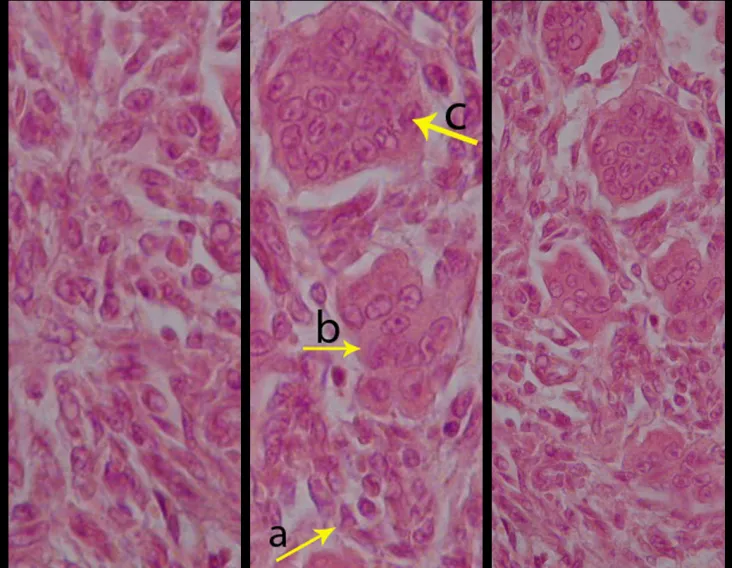
El tumor de células gigantes es una neoplasia de naturaleza mesenquimal, caracterizada por la proliferación de células gigantes multinucleadas (gigantócitos) que se asemejan a los osteoclastos, en medio de un estroma de células mononucleadas (fig. 1a). También se conoce como osteoclastoma y tumor giganto-celular, siendo común el uso de las siglas TCG o TGC. Fue descrito por primera vez por Sir Astley Cooper en 1818. Posteriormente, Paget (1853) lo denominó “tumor marrón o mieloide”. Nelaton (1860) describió sus características clínicas e histológicas, resaltando su agresividad local y dándole el nombre de “tumor a mieloplaxias”. Gross (1879) insistió en su benignidad y destacó las dificultades en el diagnóstico diferencial con “la variante aneurismática del sarcoma medular”. Con el advenimiento de la radiología, se mejoró el diagnóstico diferencial de esta lesión y Bloodgood (1923) propuso la denominación de “tumor benigno de células gigantes.
Tumor de células gigantes
En las últimas décadas, se ha discutido mucho sobre la naturaleza del tumor giganto-celular. Para Geschikter y Copeland (1949) y Willis (1949), el tumor giganto-celular sería una neoplasia de osteoclastos en medio de estroma mesenquimal, dada la similitud entre el gigantócito y el osteoclasto normal.
Jaffe et al. (1940) describieron su origen como derivado de las células del estroma. Sherman (1965) afirmó que el hueso desaparecía en el lugar de crecimiento del tumor y los gigantócitos resultarían de la fusión de las células mesenquimales del estroma, teniendo en cuenta la similitud entre la microscopía óptica de los núcleos del estroma y de las células gigantes. Los trabajos de histoquímica y cultivo de tejidos realizados por Schajowicz (1961) no demostraron diferencias significativas entre los gigantócitos tumorales y los osteoclastos normales. Por otro lado, estudios utilizando microscopía electrónica confirmaron que las células gigantes son sincitios constituidos por células del estroma. Así, las células mesenquimales indiferenciadas de la médula ósea darían origen al estroma tumoral, cuyas células, a su vez, al diferenciarse, formarían conglomerados con las características de los gigantócitos. Las numerosas células gigantes que se asemejan a los osteoclastos, en medio de un estroma de células fusiformes, son los elementos más importantes de este tumor. El aspecto histológico del TGC presenta características comunes a diversas lesiones tumorales y seudotumorales, por lo que es necesaria un análisis conjunto con las características clínicas y de imagen para confirmar el diagnóstico.
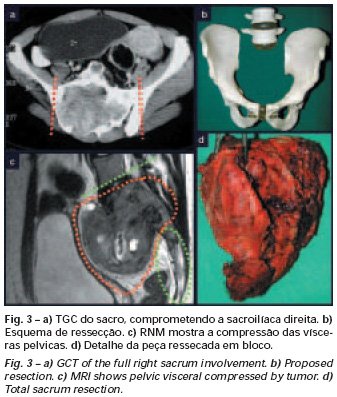
Empleamos la eletrotermia como adyuvante local, utilizando para ello el bisturí eléctrico. Esta técnica de eletrotermia es eficaz, ya que con la punta curva del bisturí podemos alcanzar áreas de acceso más difícil. La eletrotermia, además de la cauterización, también complementa el curetaje, ya que las células tumorales remanentes en las pequeñas “cavidades” de la pared ósea son destruidas y se desprenden, facilitando su eliminación. La eletrotermia debe preceder al fresado, evitando una posible diseminación de las células debido a la rotación del Lentodrill. En la región de la rodilla, frecuentemente indicamos el curetaje endocavitario seguido de eletrotermia y fresado con Lentodrill. Esto se debe a que la resección segmentaria de esta región implicaría artrodesis o sustitución por endoprótesis o injerto homólogo osteoarticular.
El metilmetacrilato permite visualizar fácilmente posibles recidivas, es de fácil aplicación y permite la carga precoz; sin embargo, no es una solución biológica y pueden ocurrir fracturas en la región.
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com