Lesiones óseas pseudotumorales
El grupo de enfermedades conocidas como lesiones óseas pseudotumorales corresponde al conjunto de cambios óseos que imitan, desde el punto de vista radiológico, las lesiones tumorales.
Lesiones óseas pseudotumorales
Las lesiones que forman parte de este grupo son:
- Quiste óseo simple
- Quiste óseo aneurismático
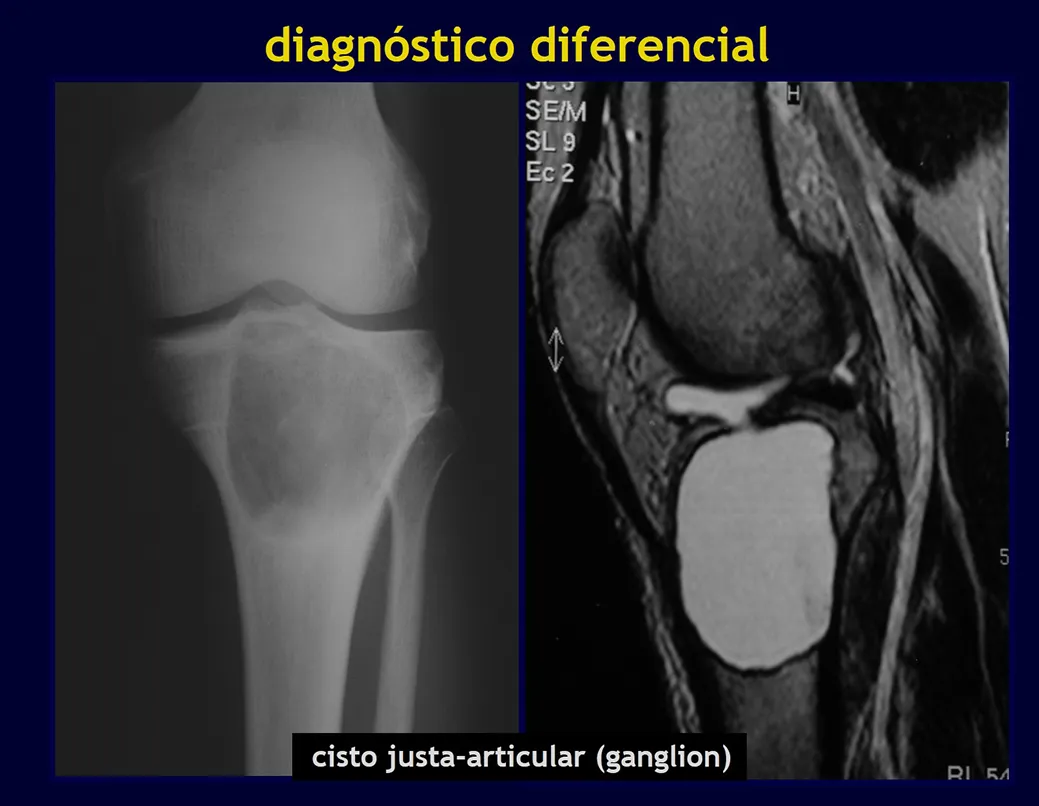
- Quiste óseo yuxtacortical (ganglio intraóseo)
- Defecto fibroso metafisario ( fibroma no osificante )
- Granuloma eosinofílico
- Displasia fibrosa / osteofibrodisplasia
- Miositis osificante
- Tumor marrón del hiperparatiroidismo
- Quiste epidermoide intraóseo
- Granuloma reparativo de células gigantes
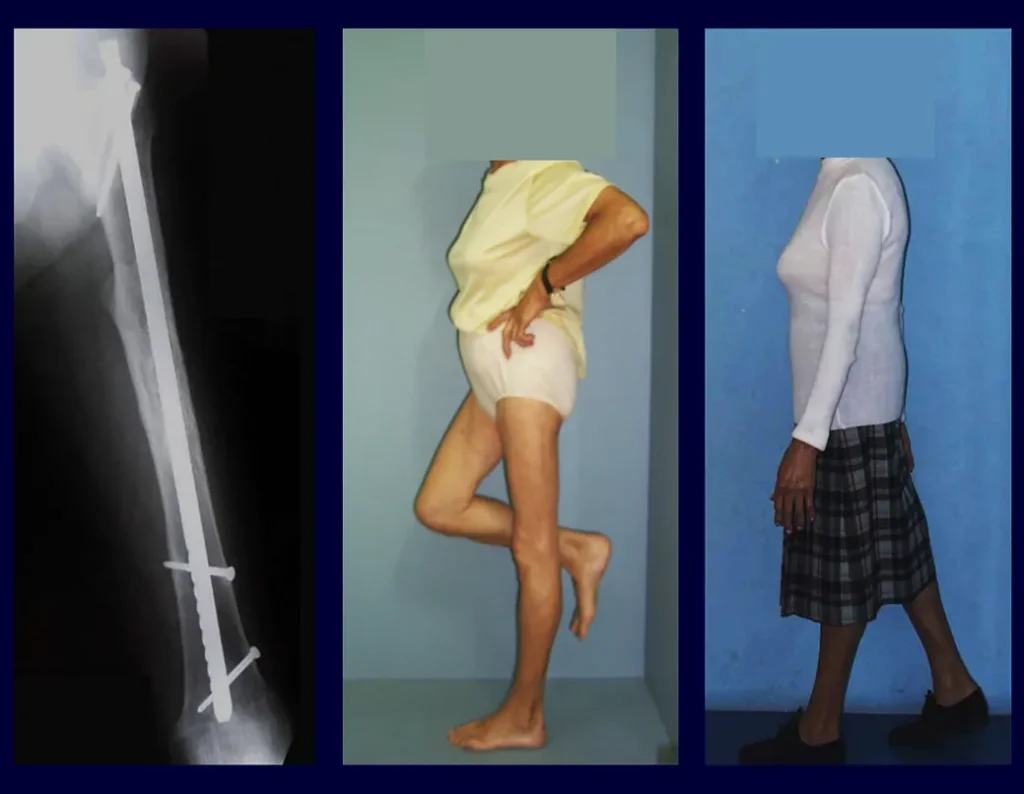
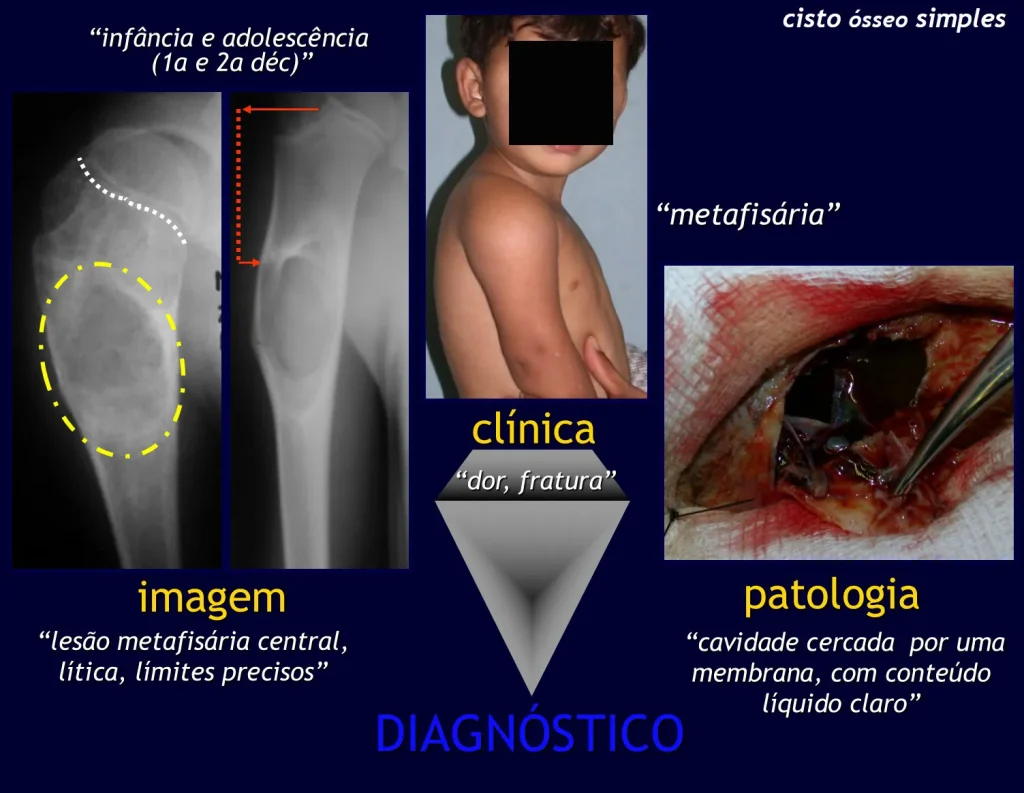
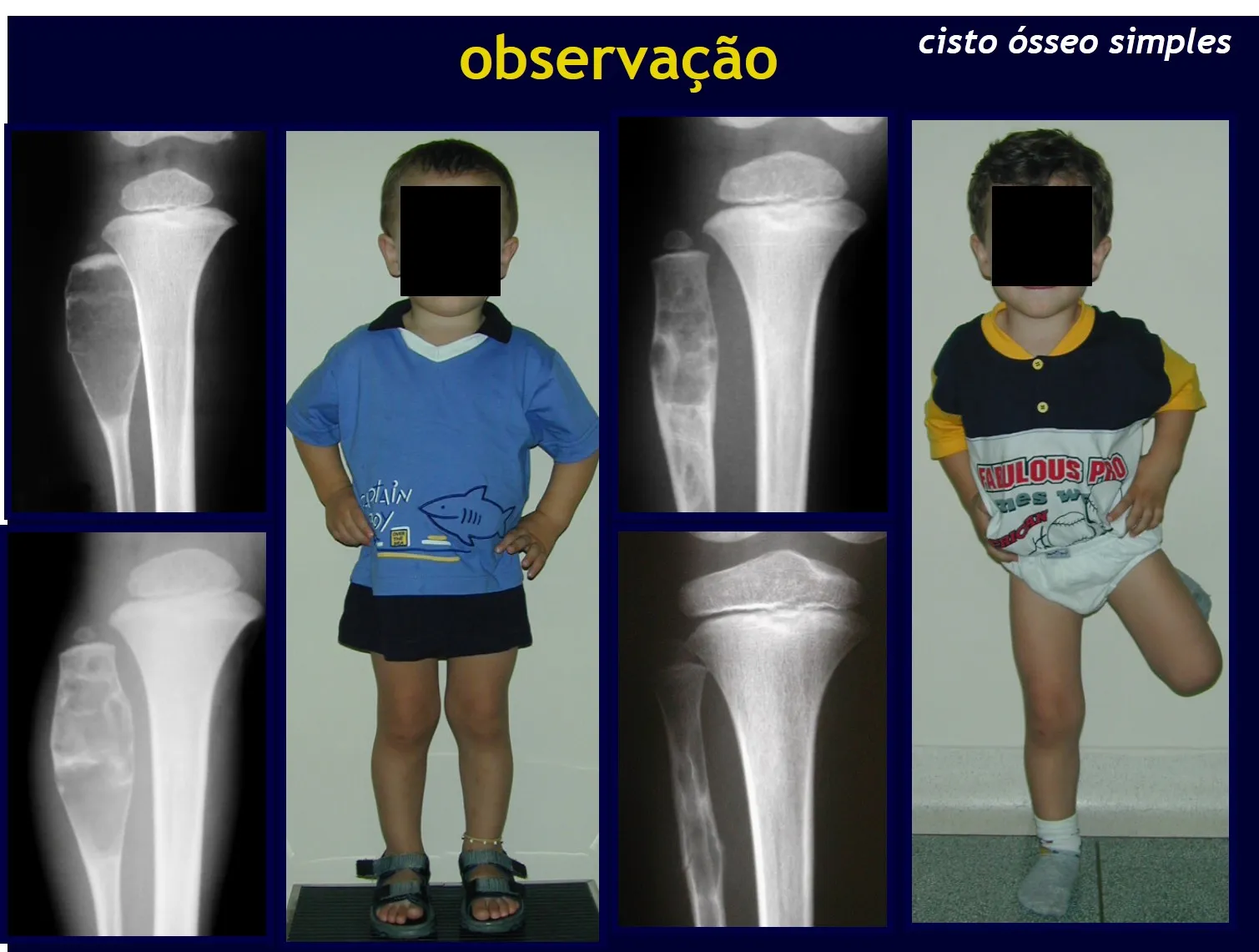
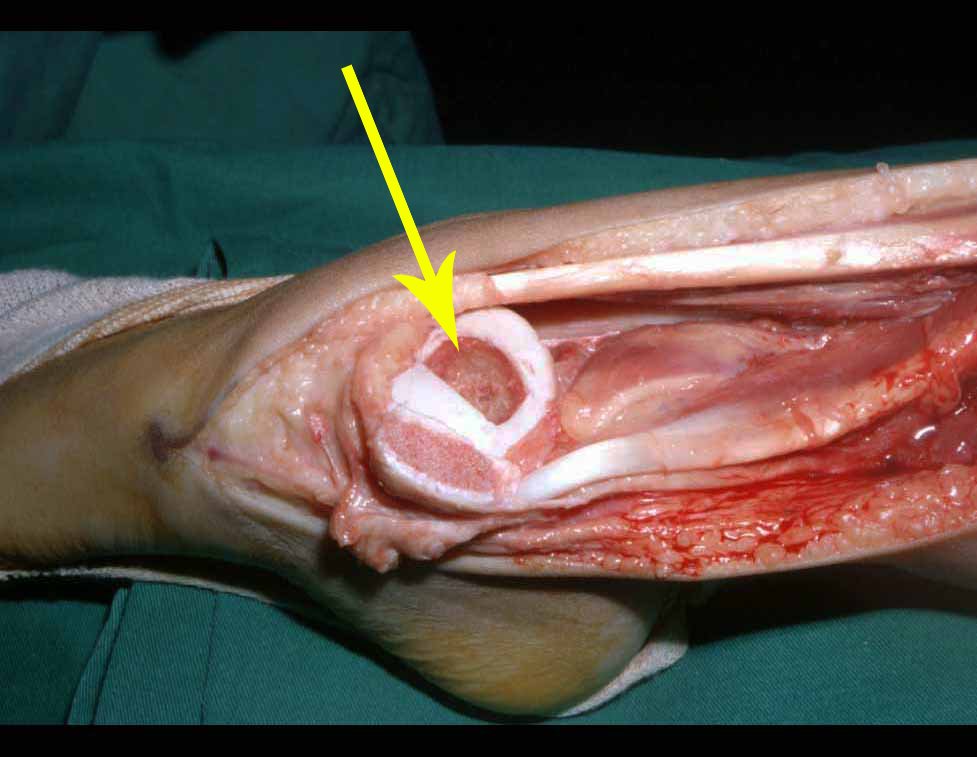
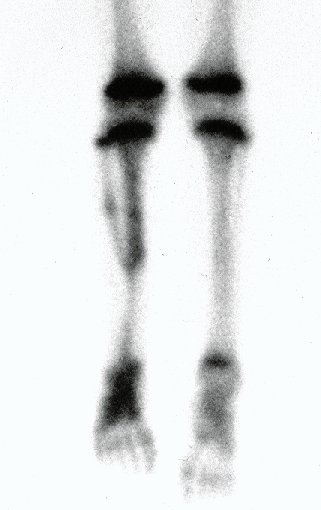
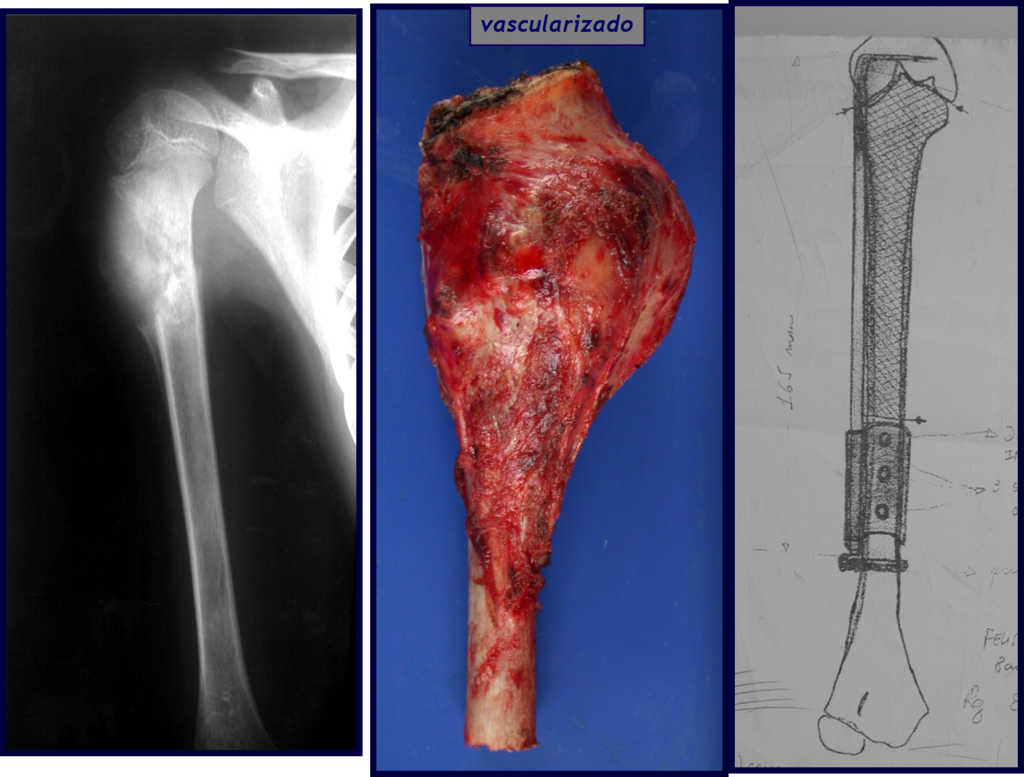
Quiste óseo simple
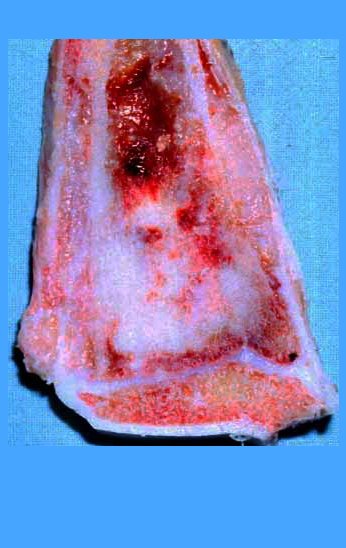
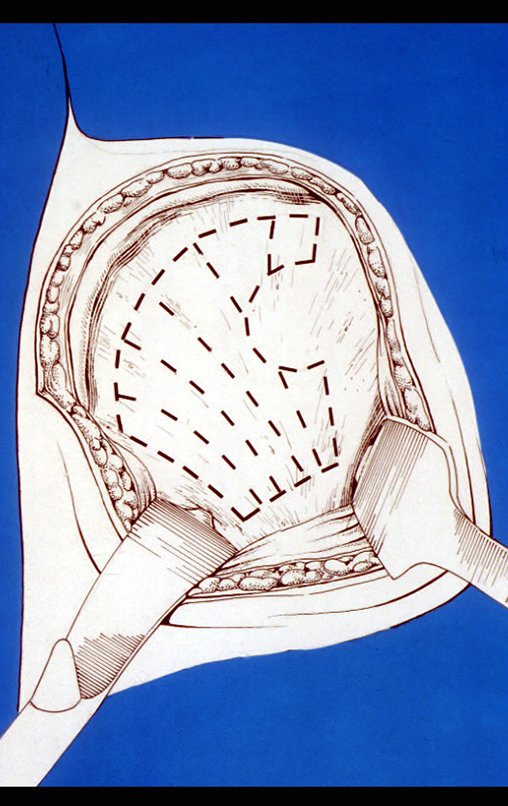
El Quiste Óseo Simple es una cavidad, inicialmente unicameral, llena de líquido claro rodeado por una membrana, con tejido conectivo vascularizado mostrando células gigantes osteoclásticas, pudiendo existir algunas zonas de hemorragia o fisuras con contenido rico en colesterol.
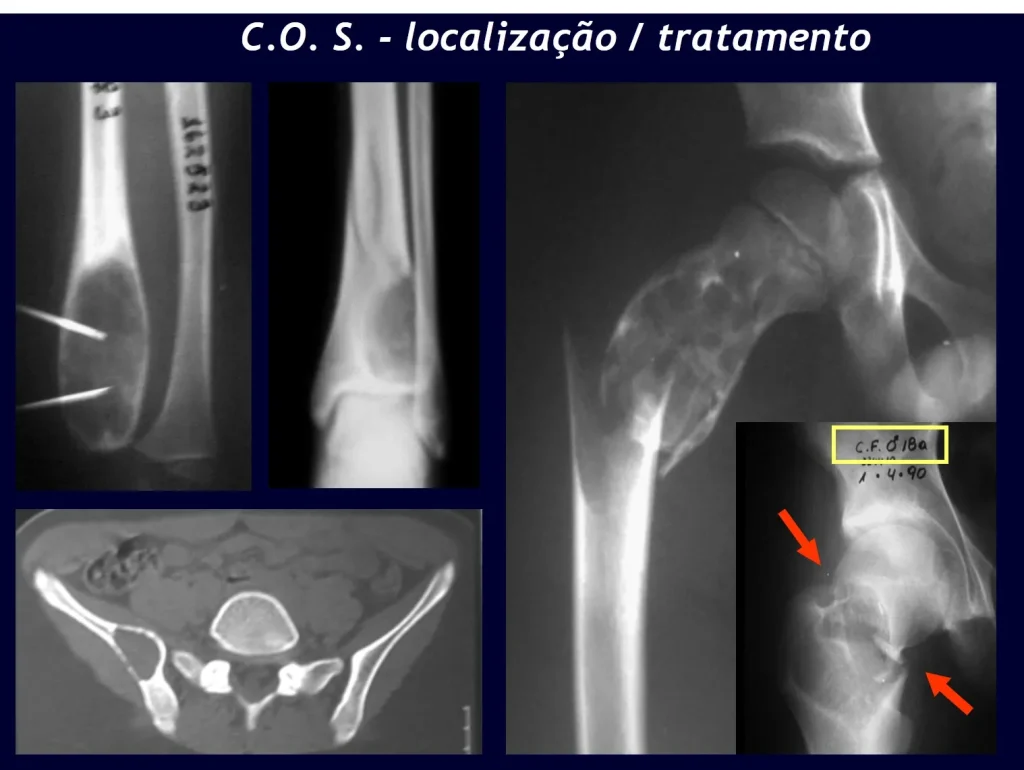
Ocurre entre los 5 y 15 años de edad, con ligero predominio en el sexo masculino. Afecta con mayor frecuencia la región metafisaria proximal del húmero y el fémur.
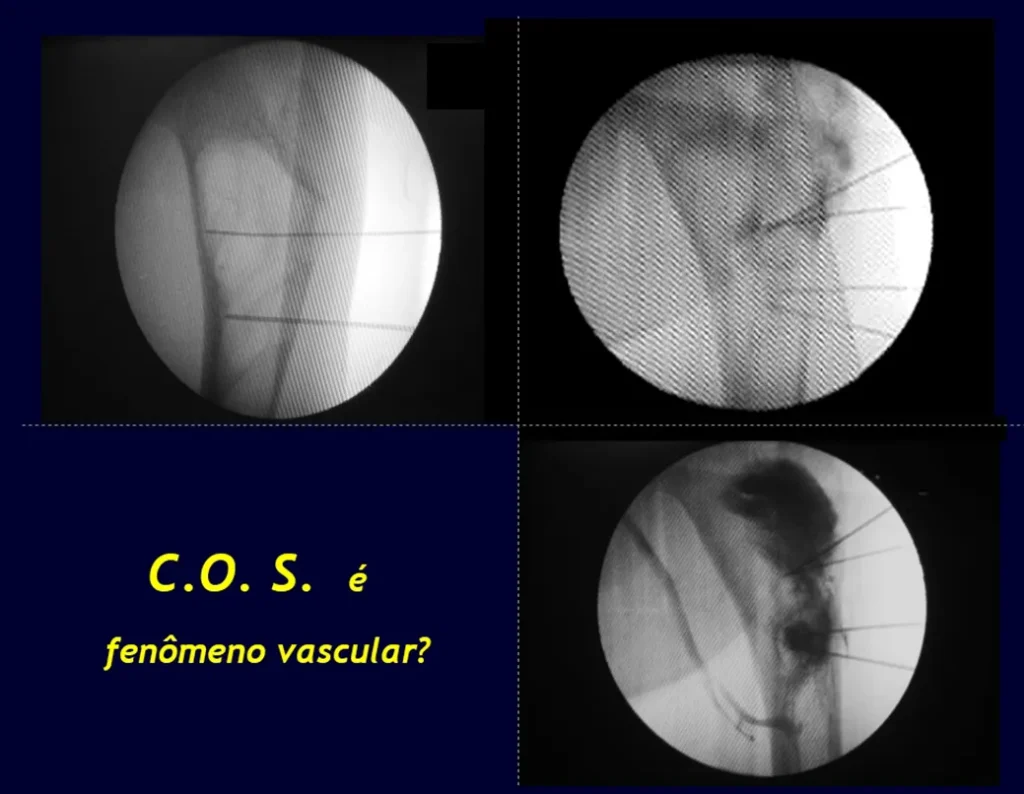
Aunque aún se desconoce su etiología, hemos observado contraste en el interior de los vasos cuando infiltramos la cavidad, lo que hace suponer que se trata de un fenómeno vascular.
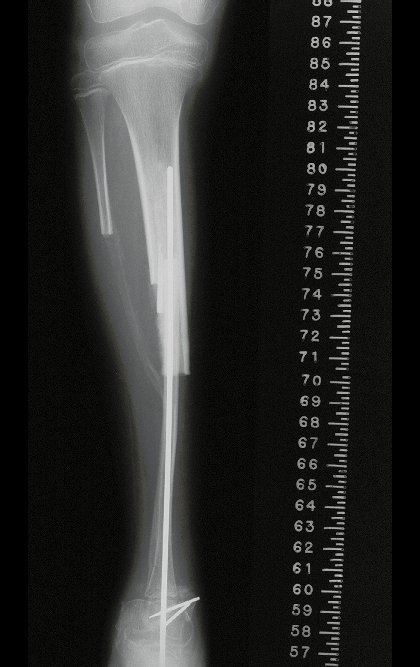
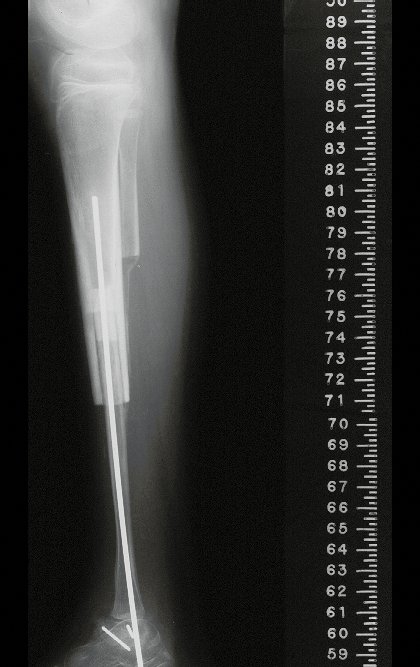
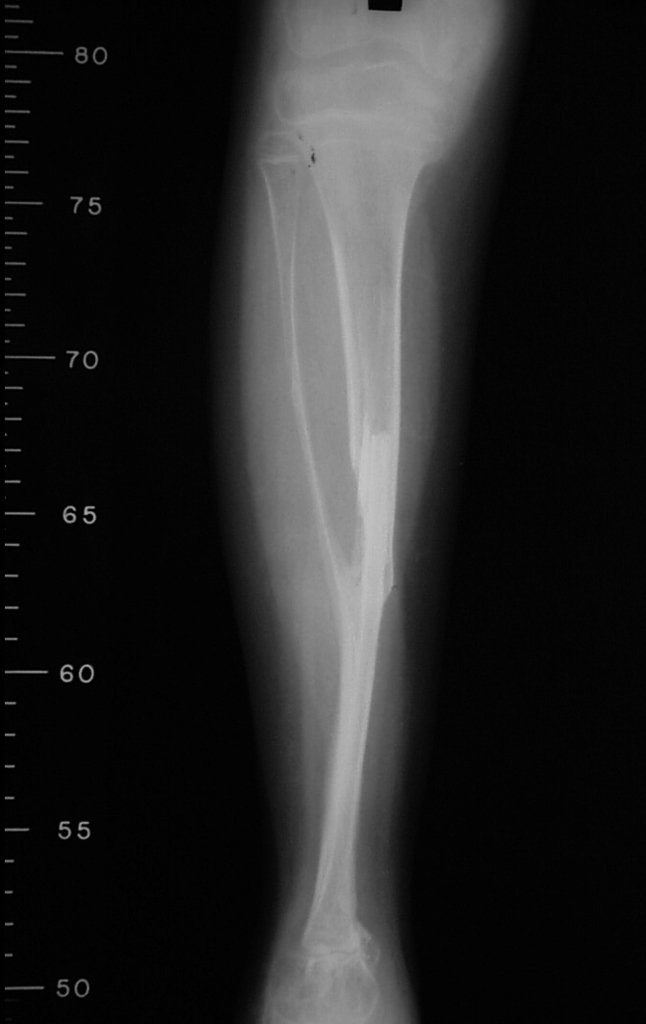
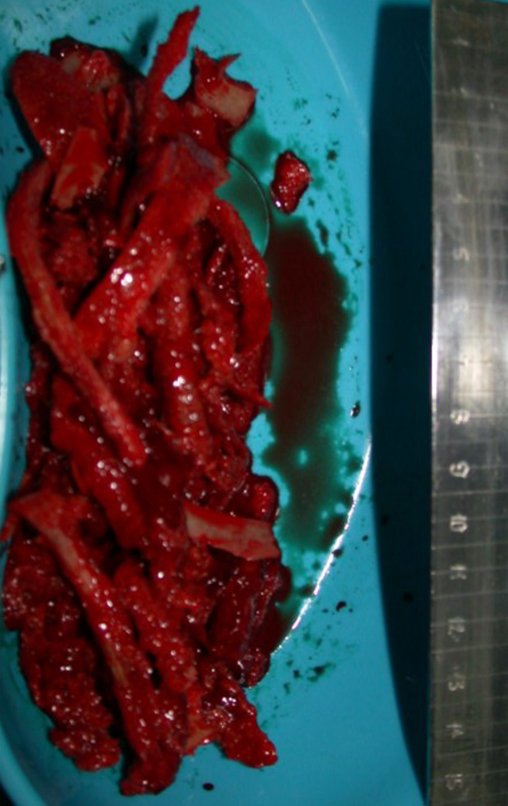
La fractura suele ser la primera manifestación del quiste, que muchas veces ha evolucionado de forma asintomática.
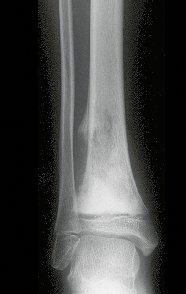
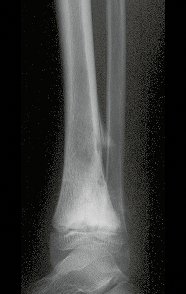
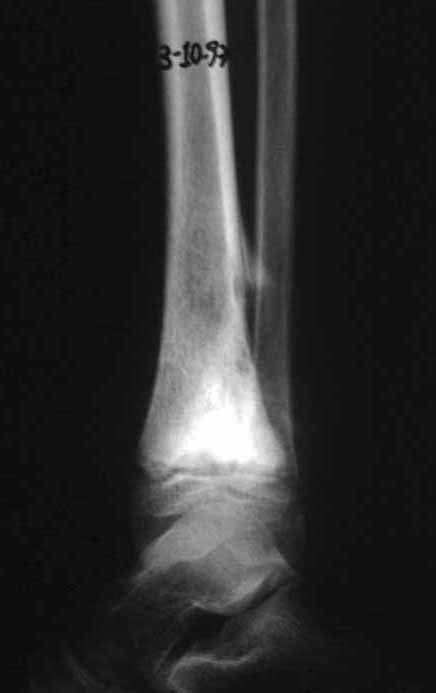
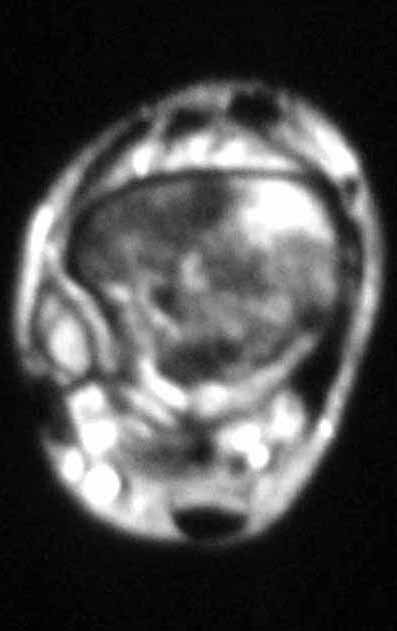
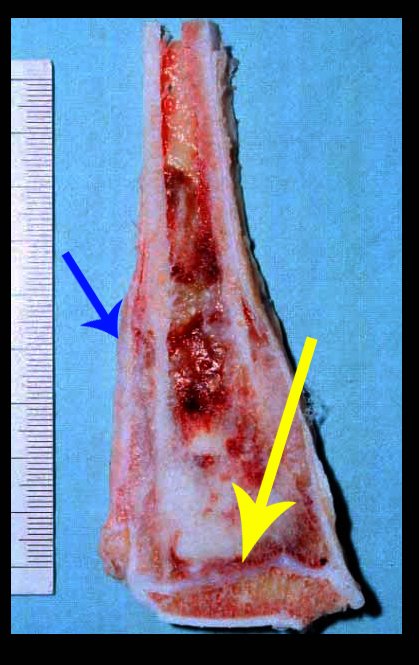
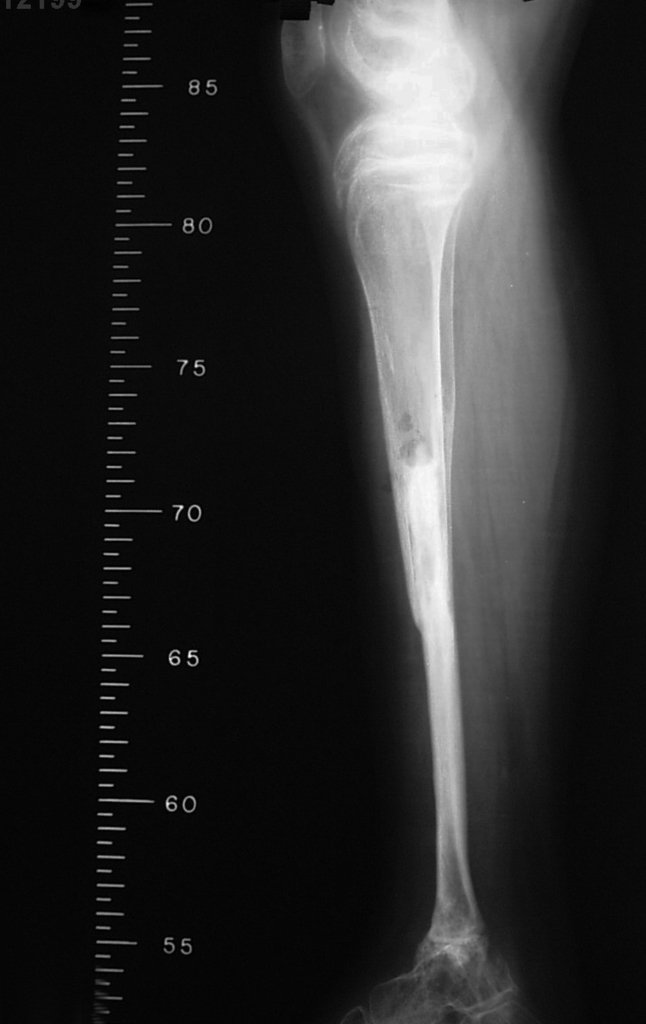
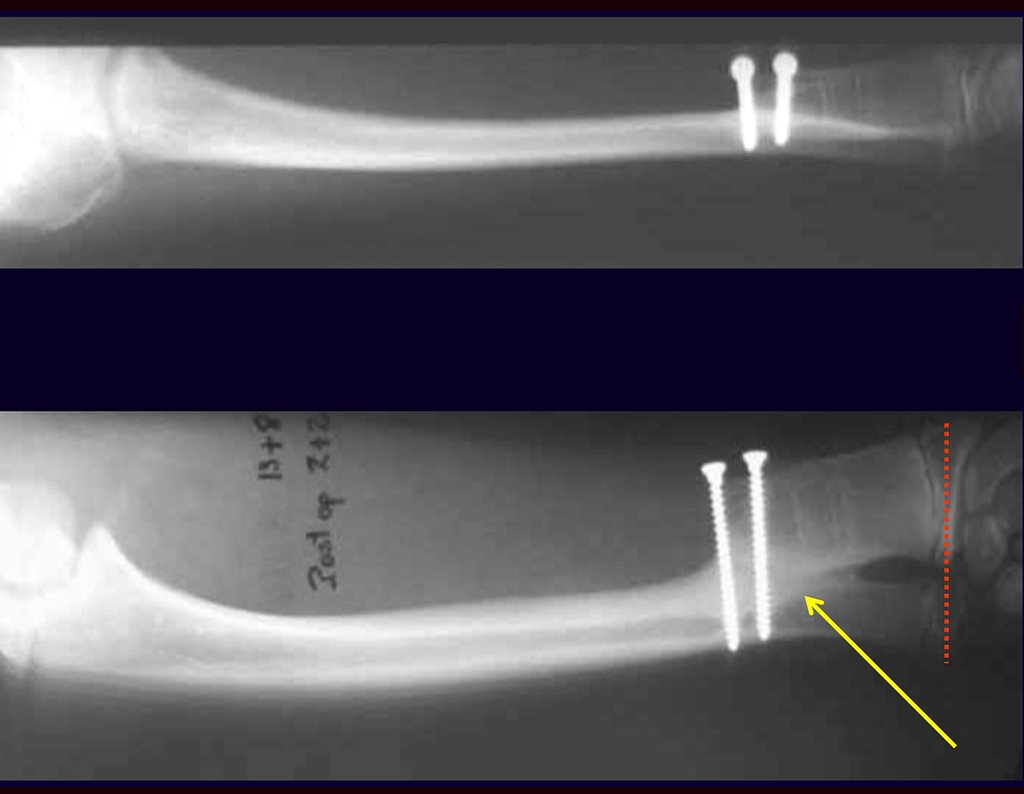
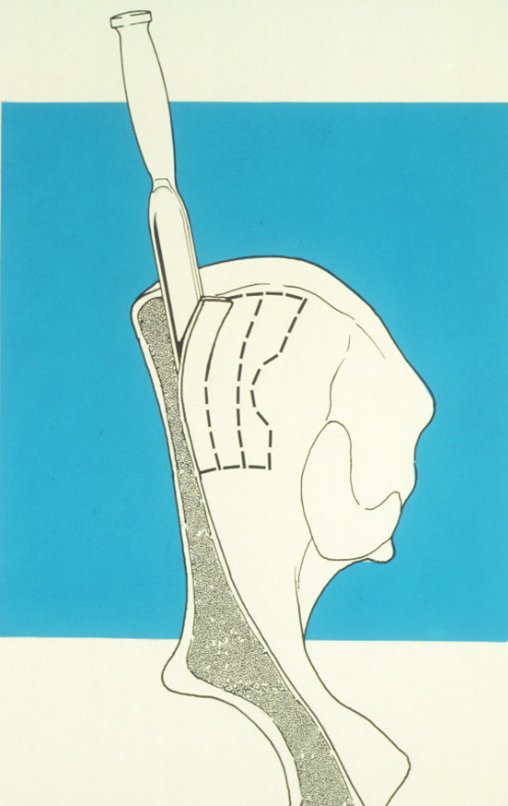
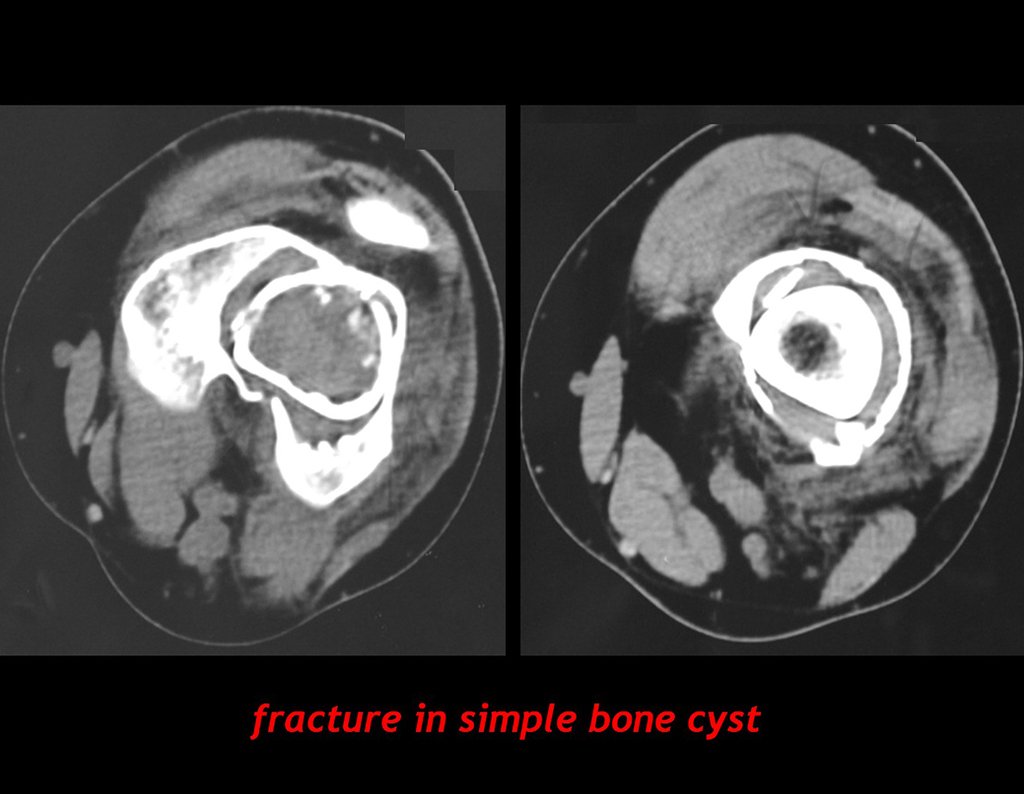
Aparece como una lesión radiotransparente en la región metafisaria de los huesos largos, de ubicación central, que no excede el ancho de la línea epifisaria. Con el crecimiento, el quiste óseo simple se aleja de la placa de crecimiento, ocupando una posición metadiafisaria, y puede erosionar y fracturar la corteza.
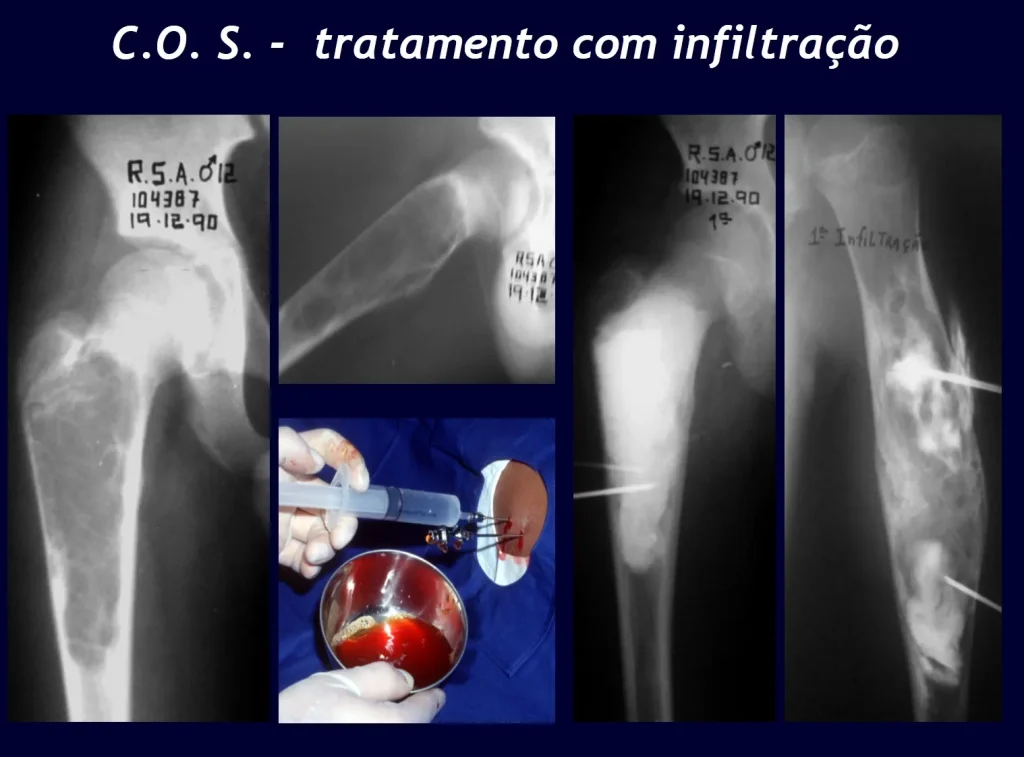
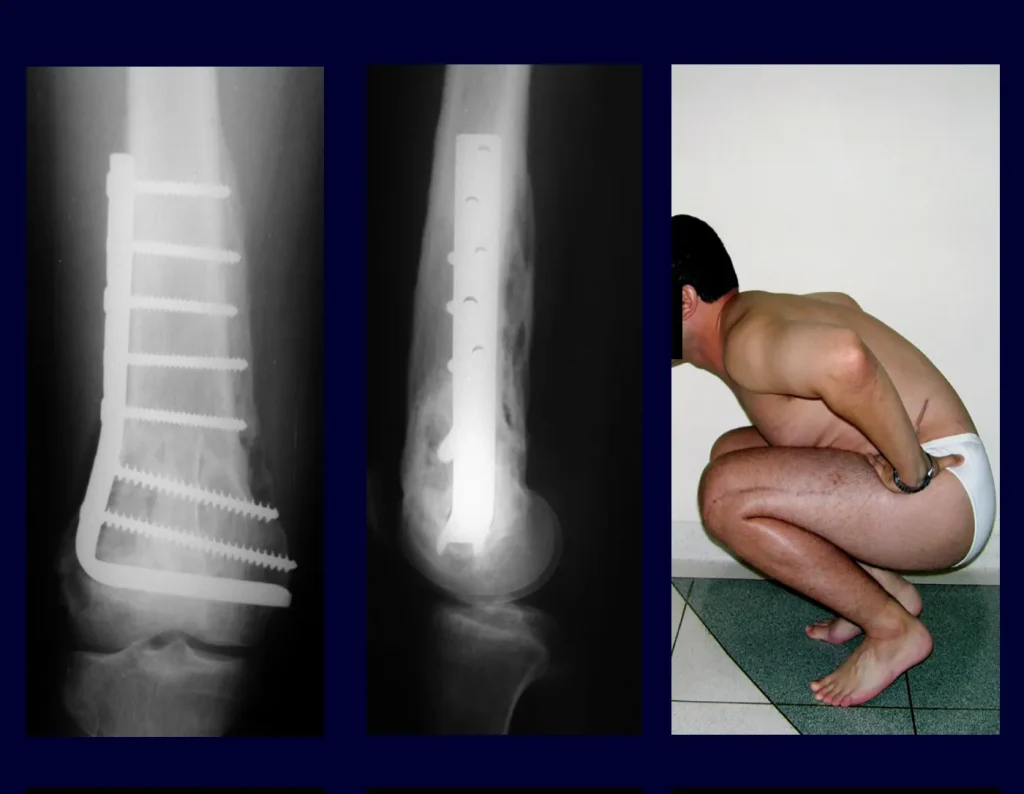
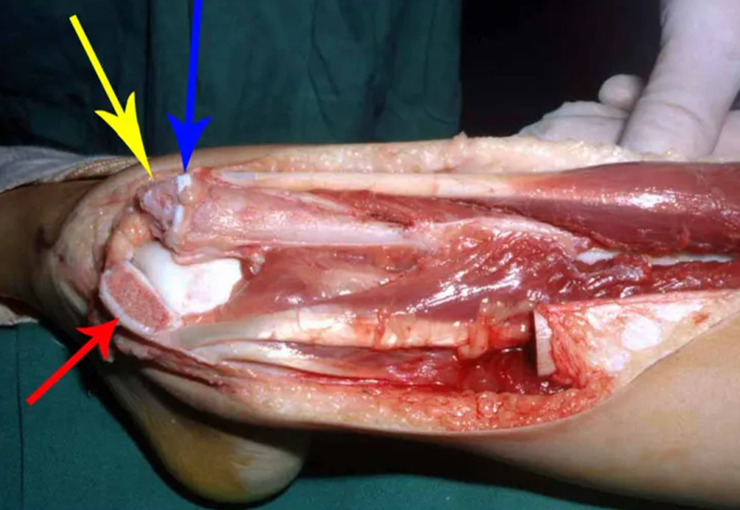
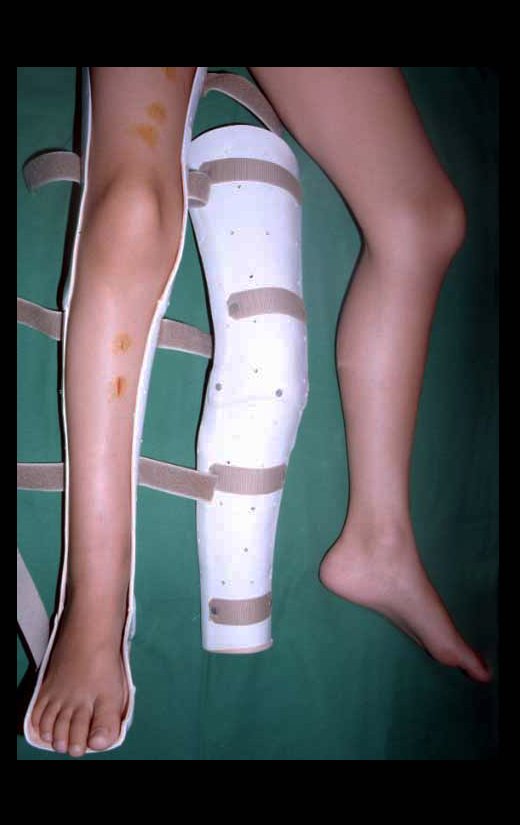
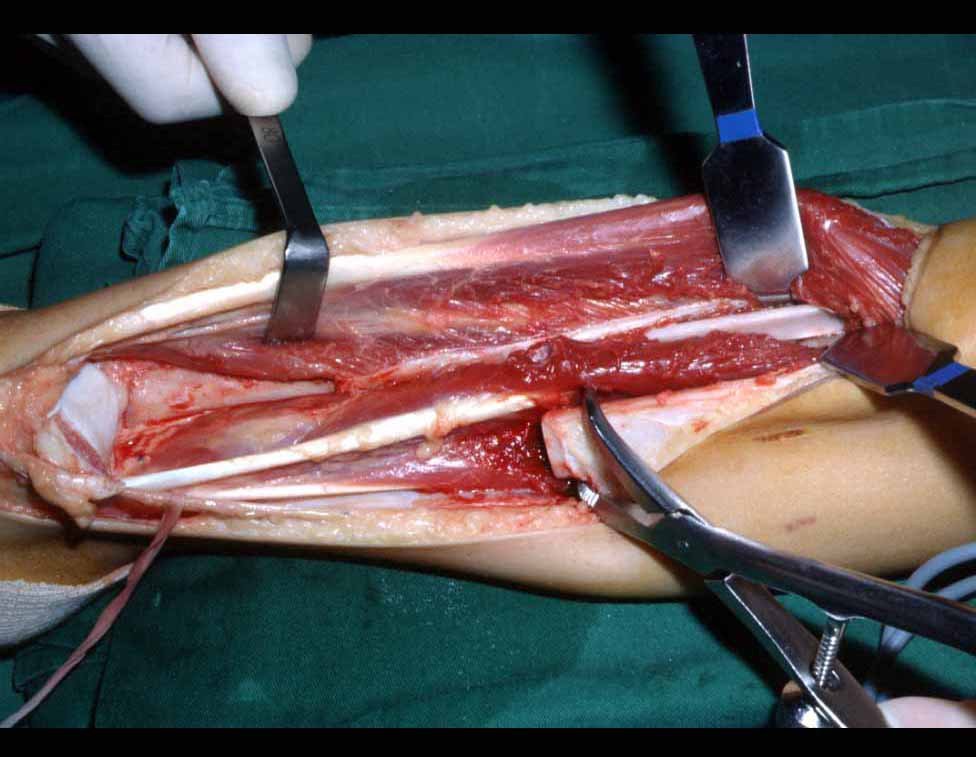
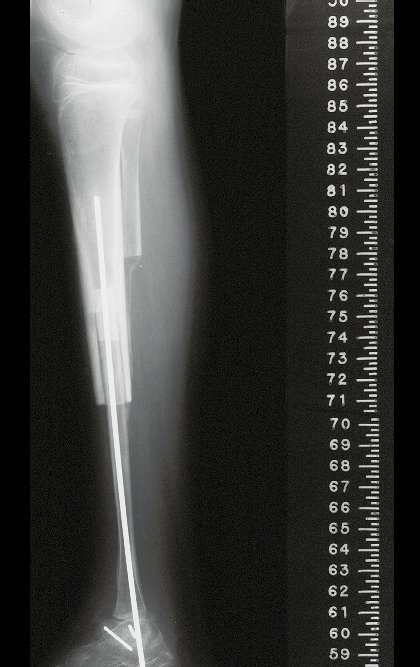
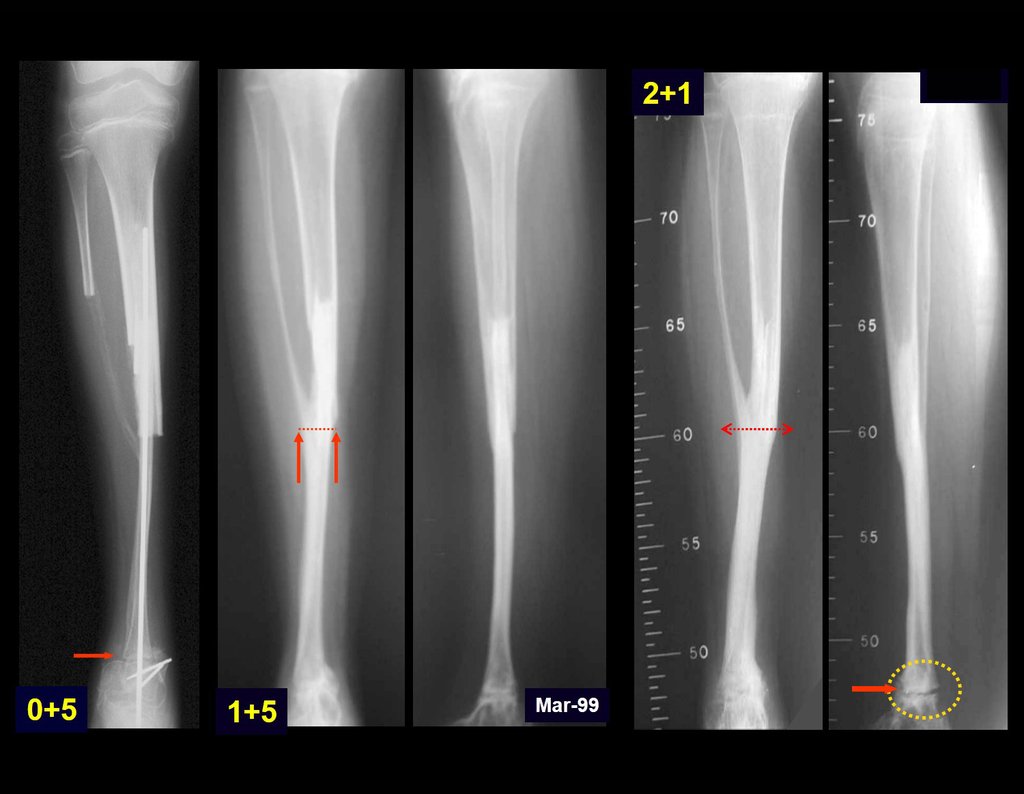
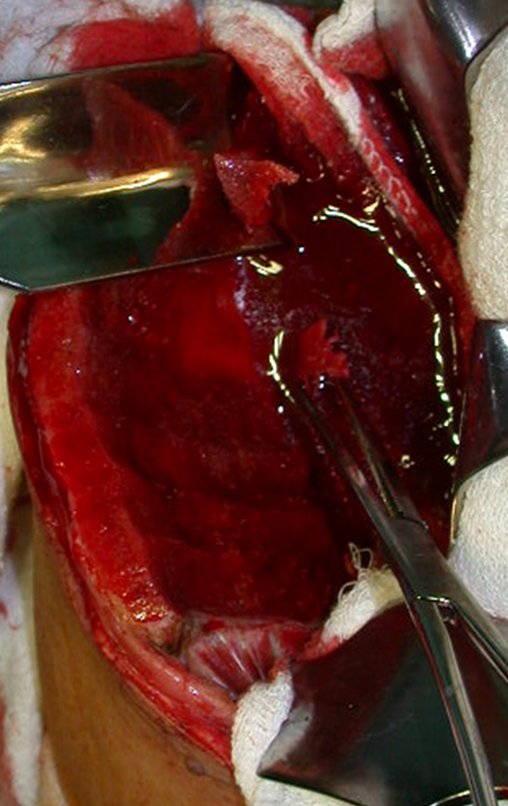
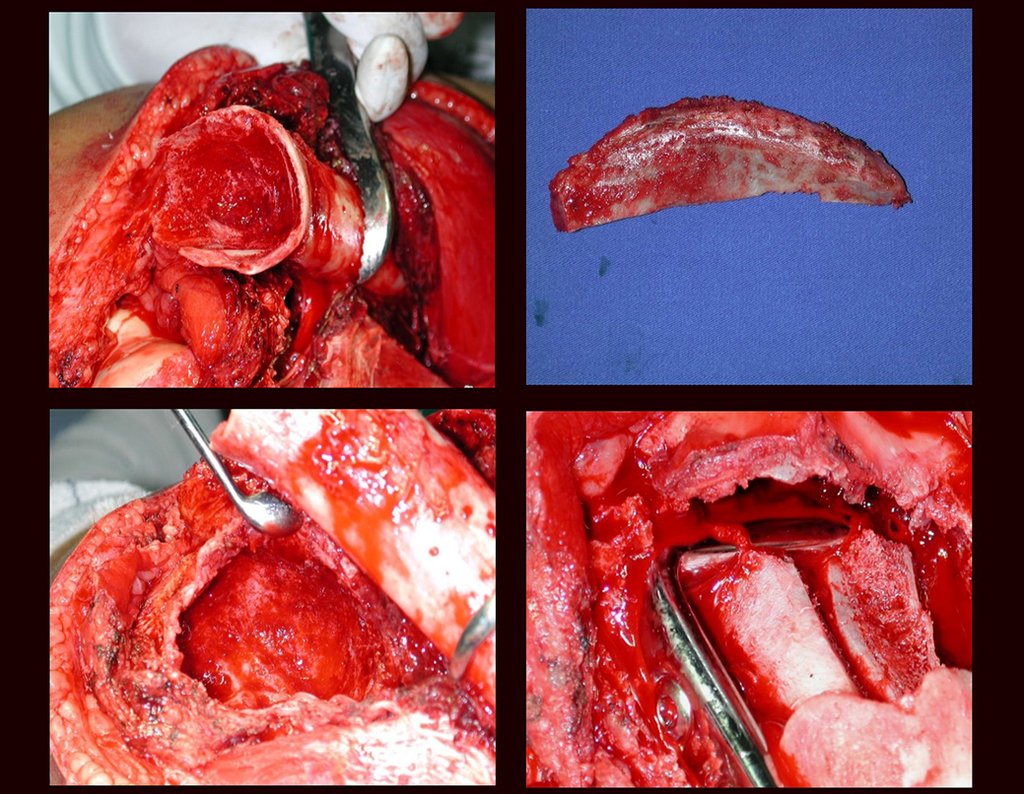
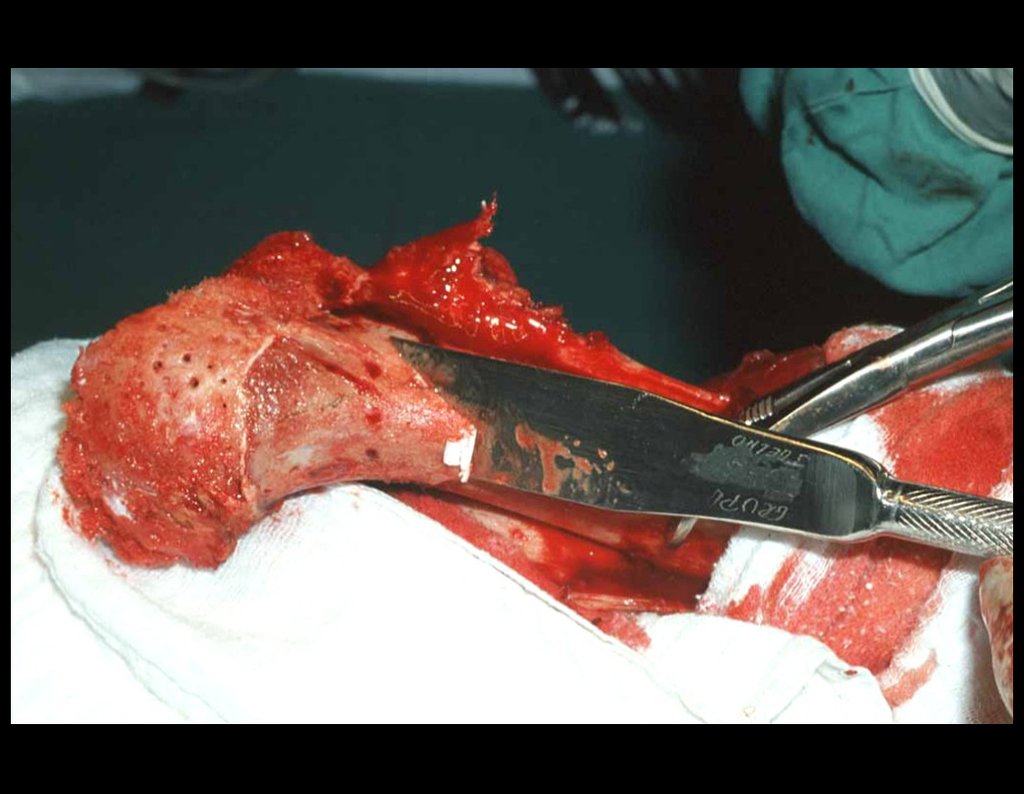
Su tratamiento es generalmente no quirúrgico y clásicamente se realiza con una serie de tres inyecciones de corticosteroides, a intervalos de cuatro semanas. En huesos de carga, particularmente en la región del cuello femoral, debemos considerar la posibilidad de tratamiento quirúrgico, con curetaje e injerto óseo.
Definición:
Cavidad unicameral llena de líquido claro o sanguinolento y limitada por una membrana de espesor variable, con tejido conectivo vascularizado que muestra células gigantes osteoclásticas y algunas zonas con hemorragia reciente o antigua o fisuras con contenido rico en colesterol (OMS)
Incidencia:
En el tratamiento de los tumores musculoesqueléticos observamos predominio de casos en el grupo de edad entre 5 y 15 años, con ligero predominio de casos en el sexo masculino, y la mayoría afecta la región metafisaria proximal del húmero y fémur. La gran mayoría son remitidos debido a un episodio de fractura provocado por un traumatismo en el sitio de la lesión o como hallazgo radiológico durante una eventual radiografía tomada por algún traumatismo sufrido por el paciente.
Etiología:
Aunque su reconocimiento desde el punto de vista radiológico es sencillo, su etiología aún es desconocida.
Evaluación clínica:
La mayoría de los pacientes se presentan asintomáticamente y las fracturas suelen ser el motivo de su primera consulta con un ortopedista. Algunos pacientes refieren episodios esporádicos de dolor o limitación funcional antes de que se diagnostique la presencia de un quiste óseo.
Características radiográficas:
El Quiste Óseo Simple se presenta como una lesión radiolúcida en la región metafisaria de los huesos largos, de localización central, principalmente en la región proximal del húmero y fémur y cercana a la línea epifisaria. Son lesiones bien definidas, con bordes escleróticos, que rara vez traspasan los límites de la corteza o los límites del hueso, expandiéndose, adelgazando la corteza, pero casi nunca rompiéndola. En algunos casos se puede observar el signo del “fragmento caído”, que representa fragmentos de la pared cortical sueltos dentro del quiste.
Tratamiento:
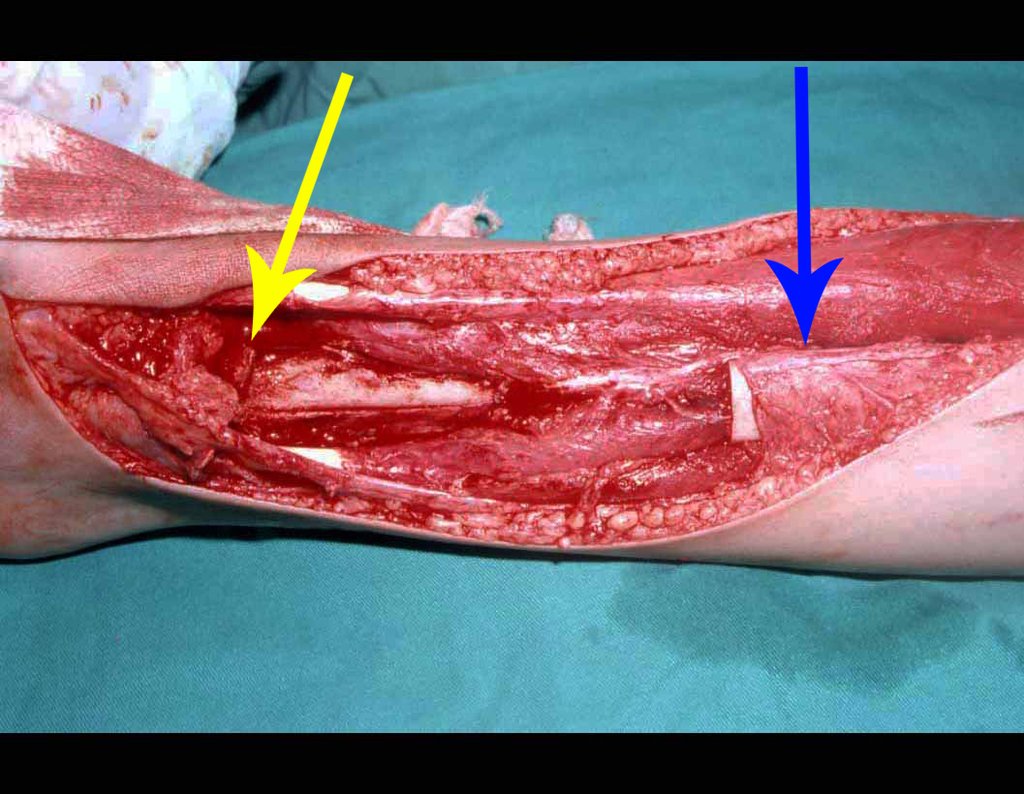
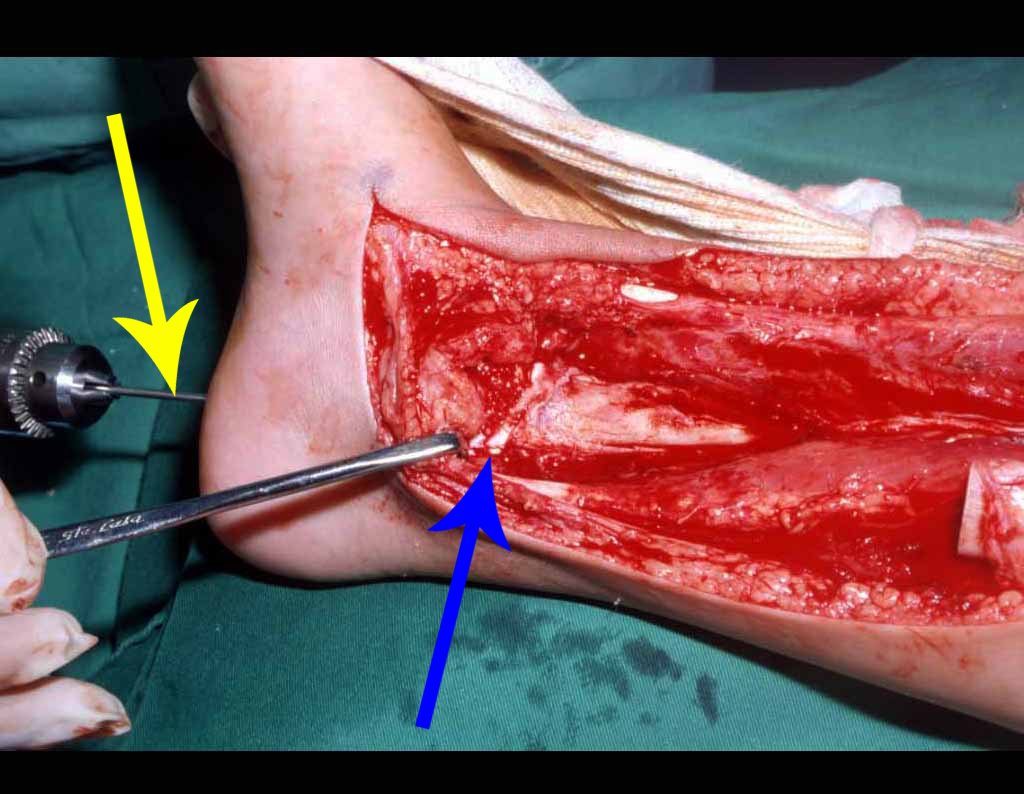
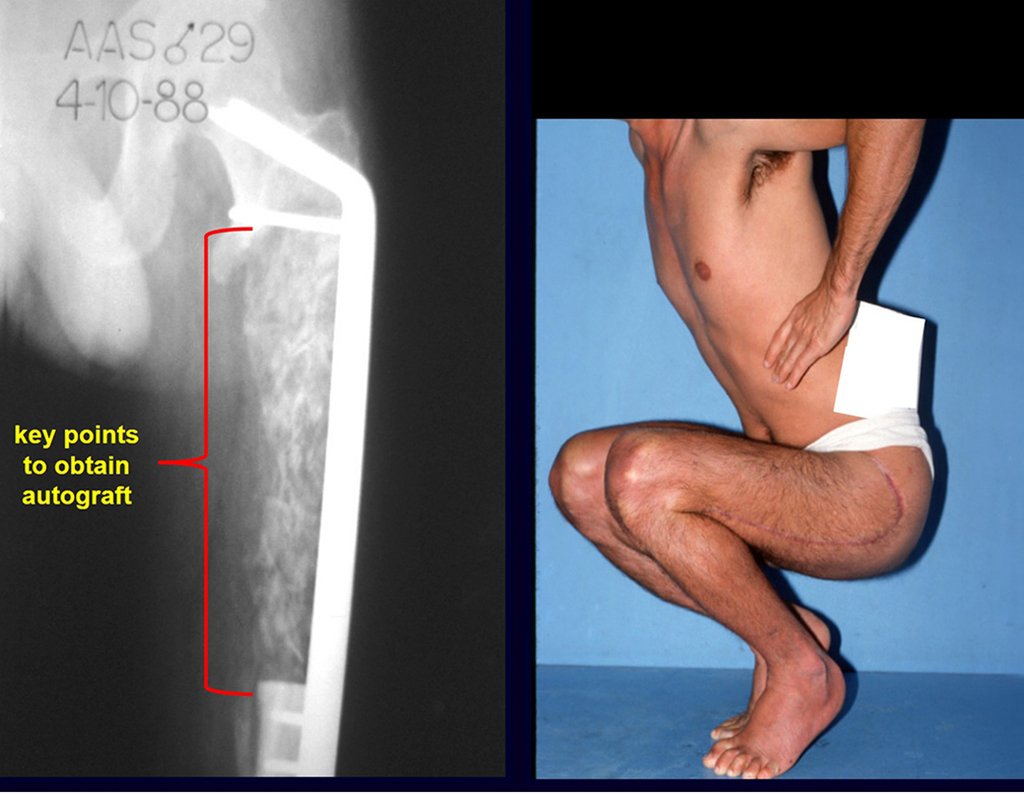
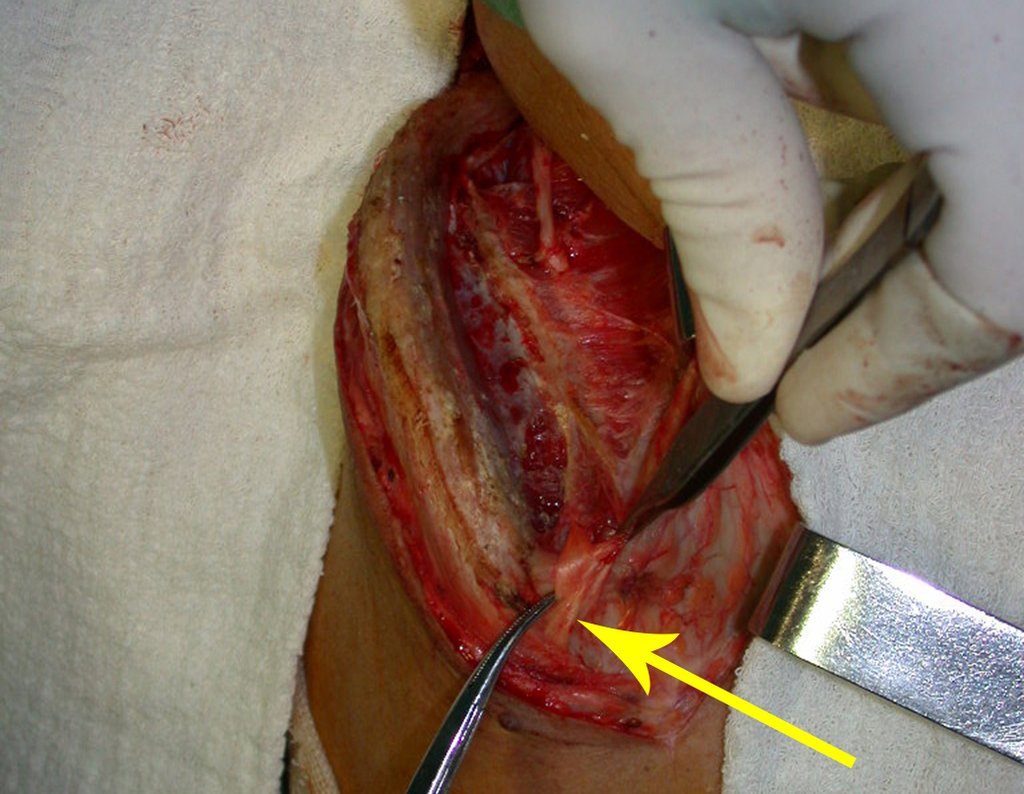
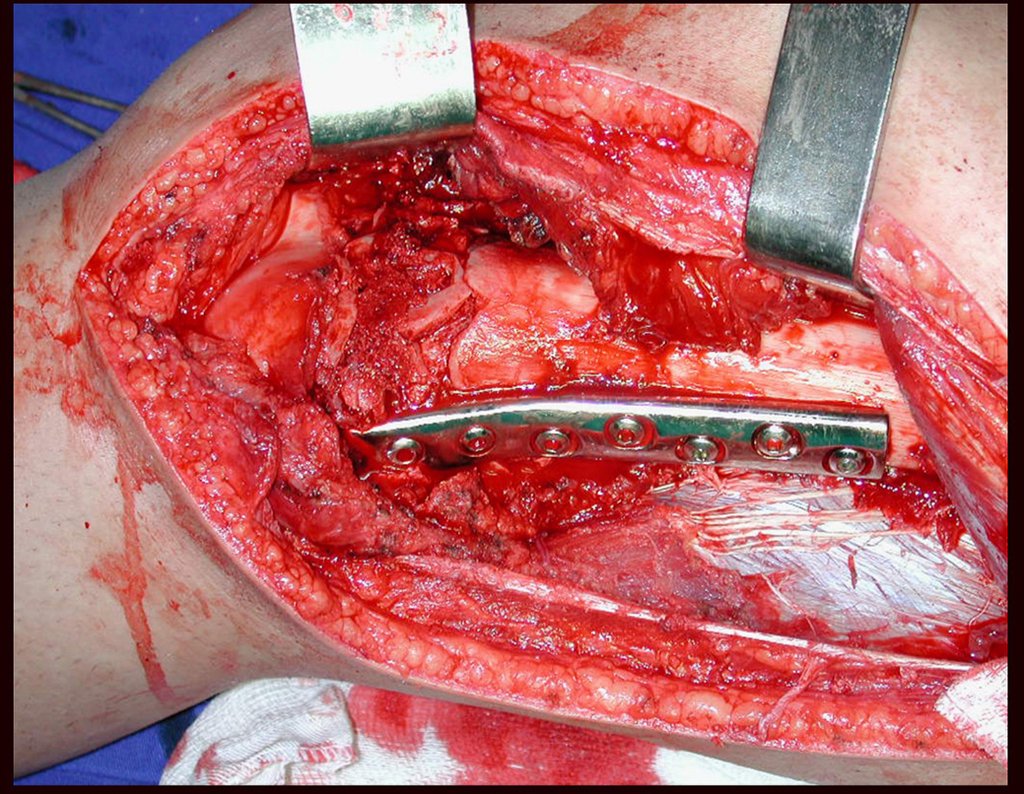
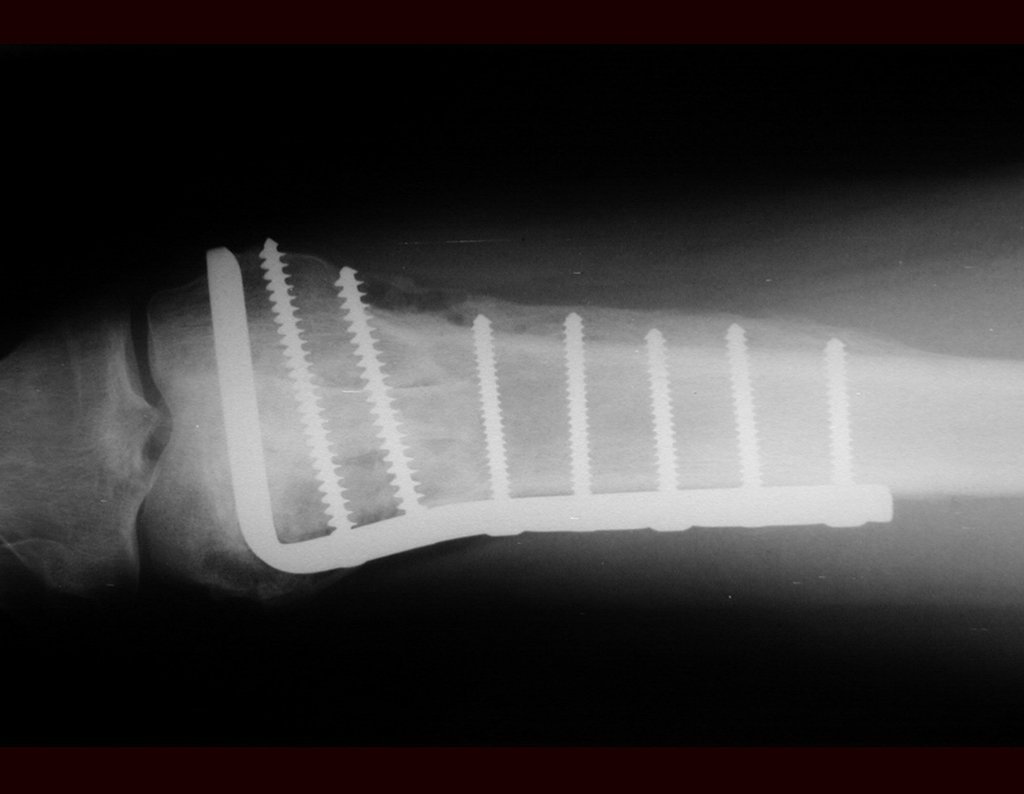
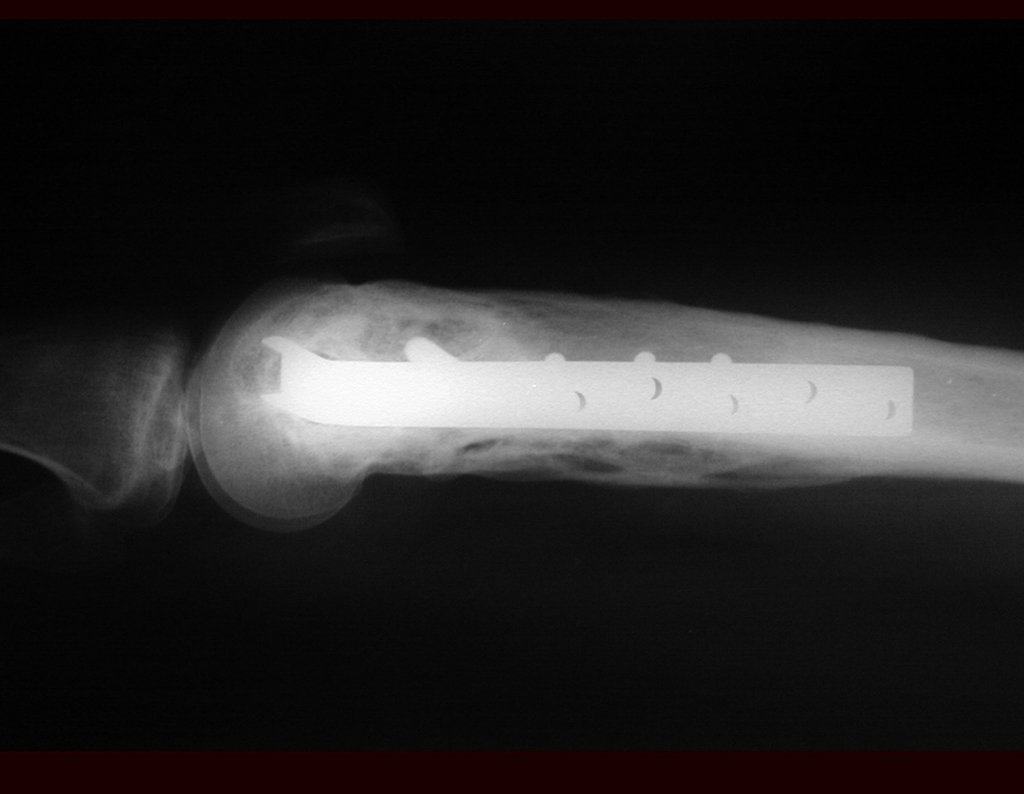
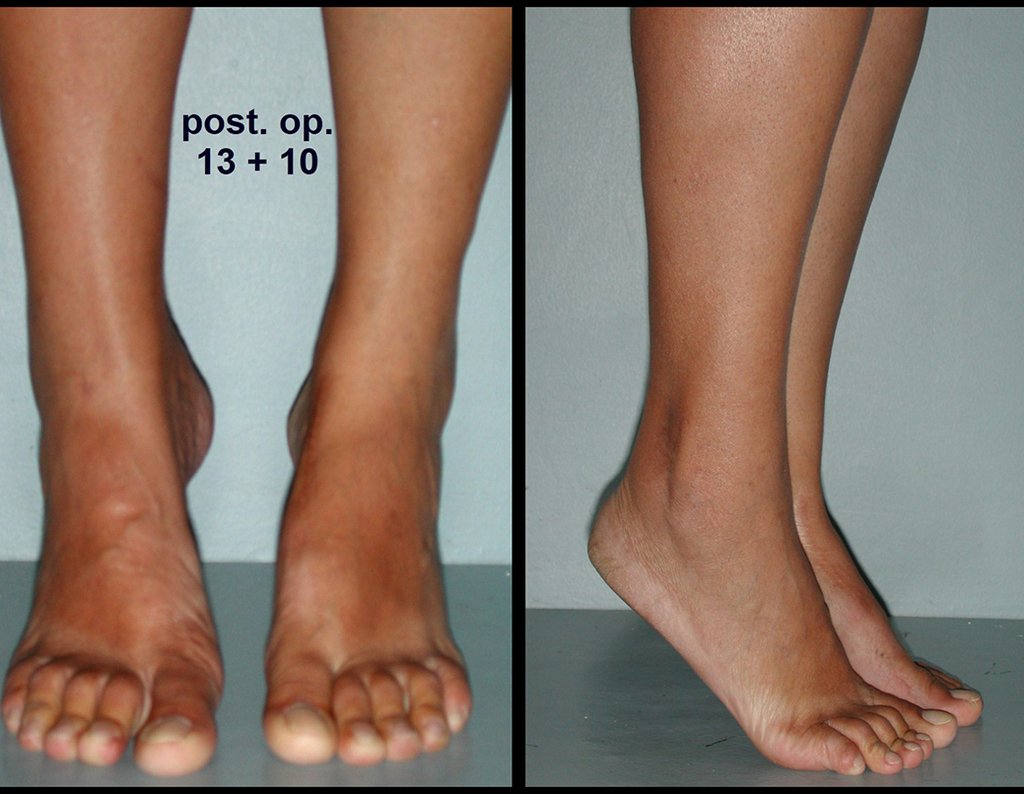
El tratamiento de COS depende de su localización y tamaño, en la gran mayoría de los casos puede ser conservador y no quirúrgico. En general, el tratamiento del miembro superior es menos quirúrgico y más conservador, mientras que el tratamiento del miembro inferior tiende a ser más quirúrgico, en un intento de evitar una fractura. El tratamiento clásico consiste en infiltraciones con corticoides (depomedrol), observando si se forma o no contenido óseo en su interior. Si hay una fractura inminente en un hueso de carga, debemos considerar seriamente la posibilidad de realizar un tratamiento intralesional rellenando la cavidad ya sea con un injerto autólogo u homólogo.
1- Haz clic para ver más : http://bit.ly/cisto_ósseo_simples
2- Reconstrucción del cuello femoral con fractura por quiste óseo
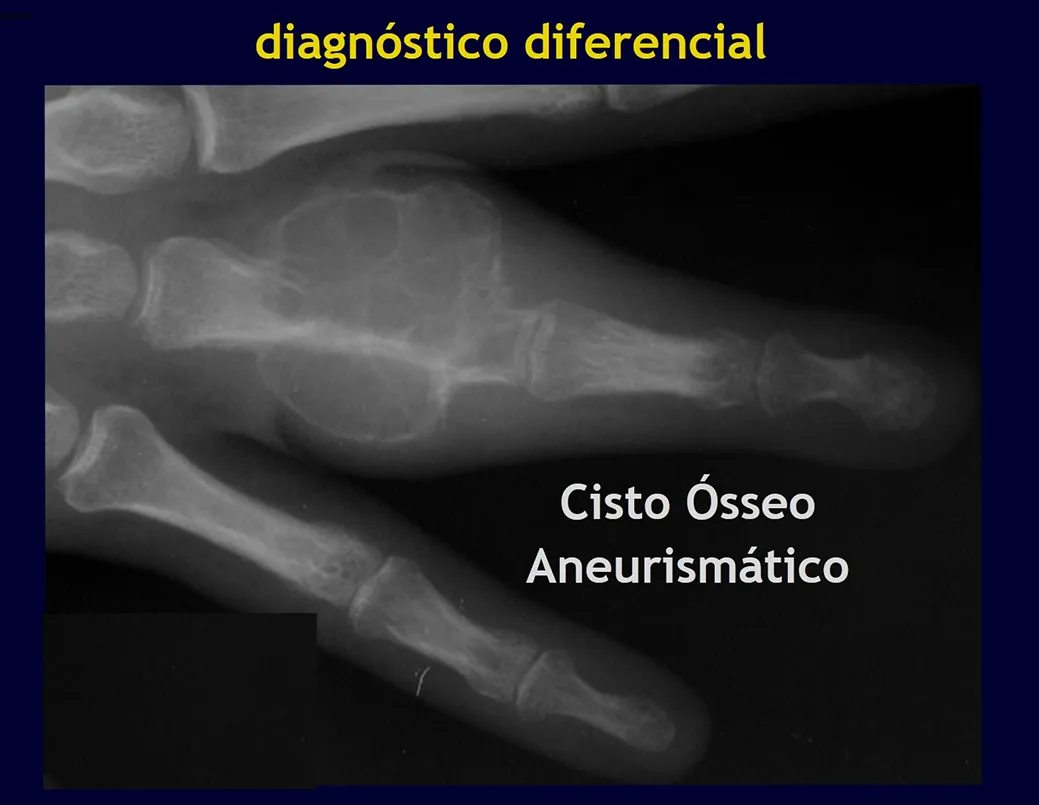
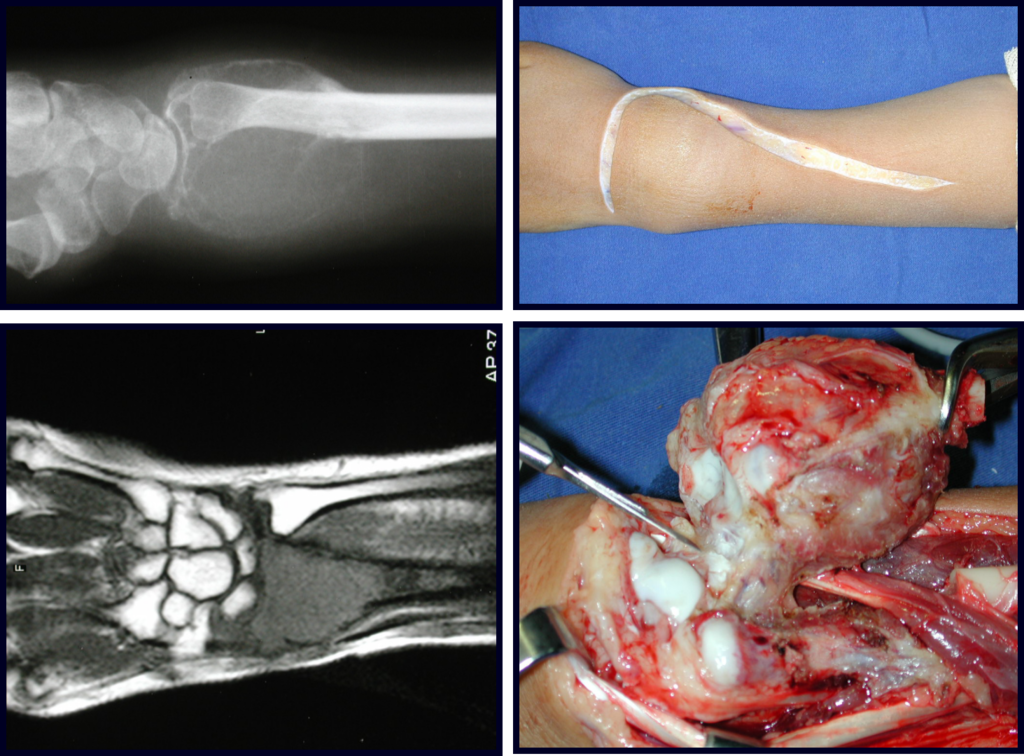
Quiste óseo aneurismático
Definición:
Lesión osteolítica expansiva, llena de sangre, entre espacios de tamaño variable separados por tabiques de tejido conectivo que contienen trabéculas de hueso o tejido osteoide y células gigantes osteoclásticas.
Incidencia:
Los quistes óseos aneurismáticos son más frecuentes en las tres primeras décadas de la vida, produciéndose su máxima incidencia alrededor de los 10 a 15 años de edad, con un ligero predominio en mujeres que en hombres.
Etiología:
El origen y la etiología aún se desconocen.
Evaluación clínica:
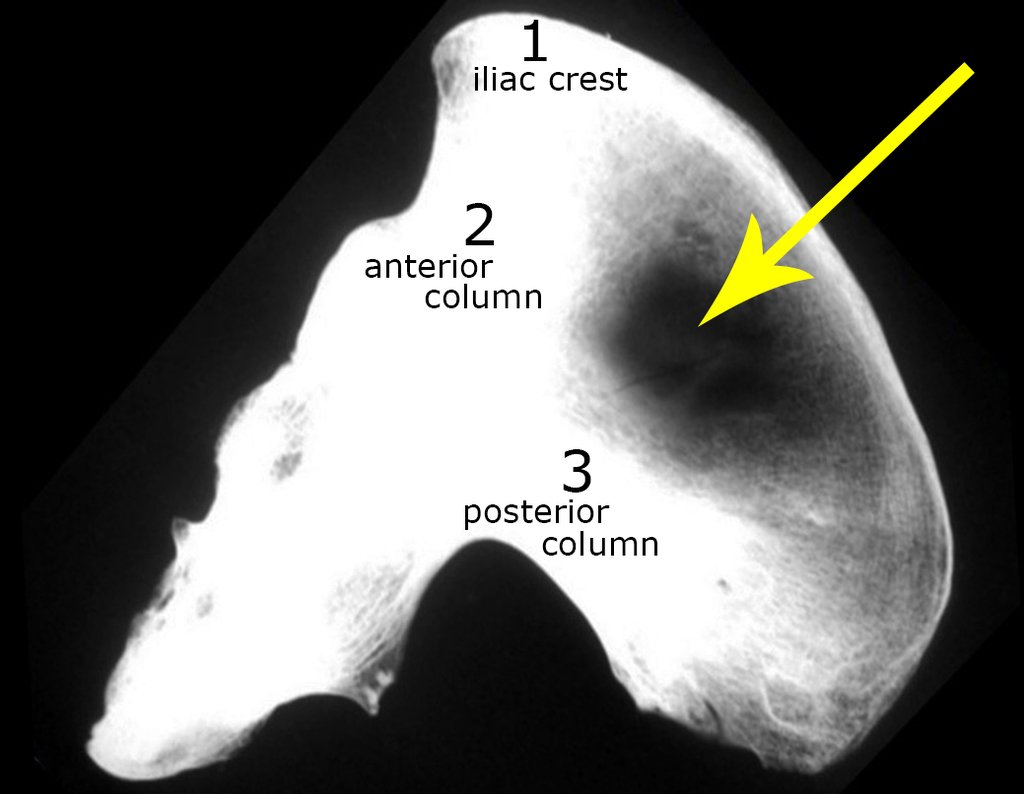
Los pacientes normalmente presentan dolor leve en el sitio de la lesión y a menudo se observan signos inflamatorios como aumento de volumen y calor en el sitio. Cuando hay compromiso en la columna, puede haber síntomas neurológicos de compresión de la médula espinal o de la raíz nerviosa. La evolución es muy variable con un aumento lento y progresivo de volumen o en algunos casos rápidamente expansivo. Afecta frecuentemente a los miembros inferiores y a las vértebras, incluido el sacro y la pelvis, principalmente en la rama iliopúbica.
Características radiográficas:
Presenta una lesión insuflativa y radiotransparente principalmente en la región metafisaria o diafisaria de los huesos largos, con presencia de septos dispersos por todo su contenido, con adelgazamiento y expansión de la corteza, que puede ser excéntrica o central.
Tratamiento:
El tratamiento de elección ha sido el legrado intralesional y el relleno con injerto autólogo. Muchas veces, puede o no ser posible asociar el tratamiento adyuvante intralesional con la aplicación de fenol, electrocauterización o uso de crioterapia. En raras ocasiones y en algunos casos específicos, es posible resecar el hueso comprometido sin comprometer la función, como en los casos de afectación de la costilla, el peroné y los huesos metacarpianos y metatarsianos. La recurrencia es muy rara.
1- Haz clic aquí para ver más : http://bit.ly/cisto_aneurismático
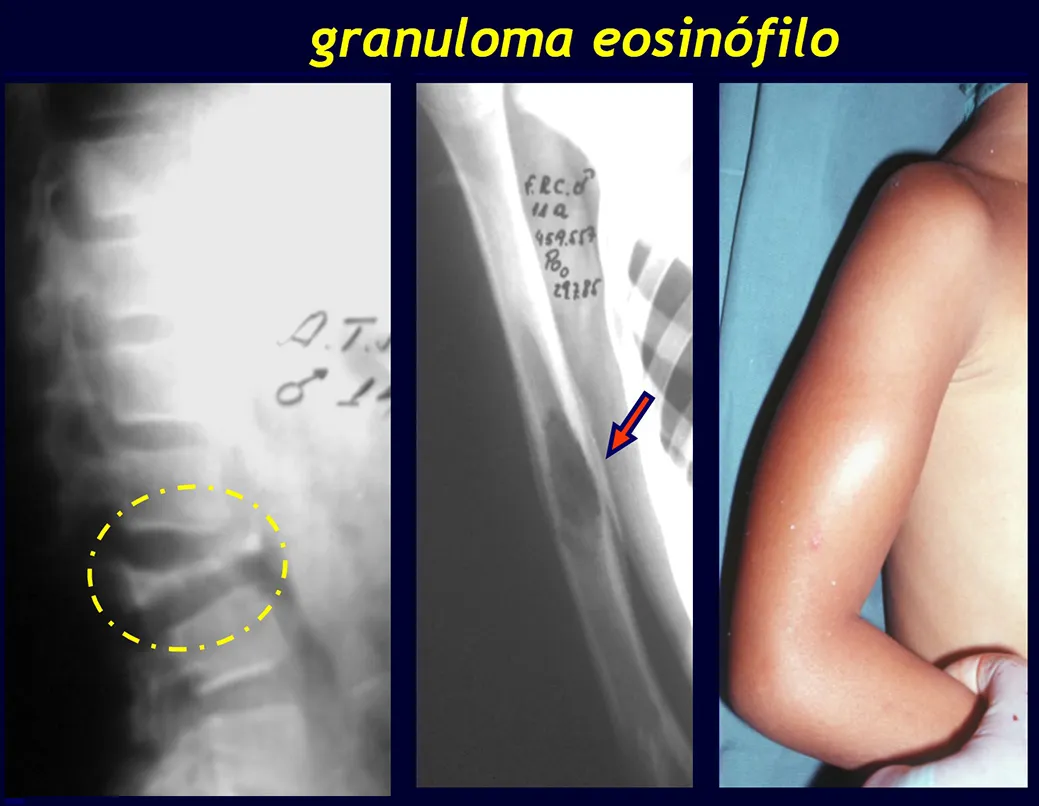
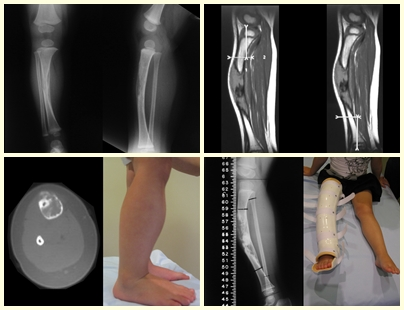
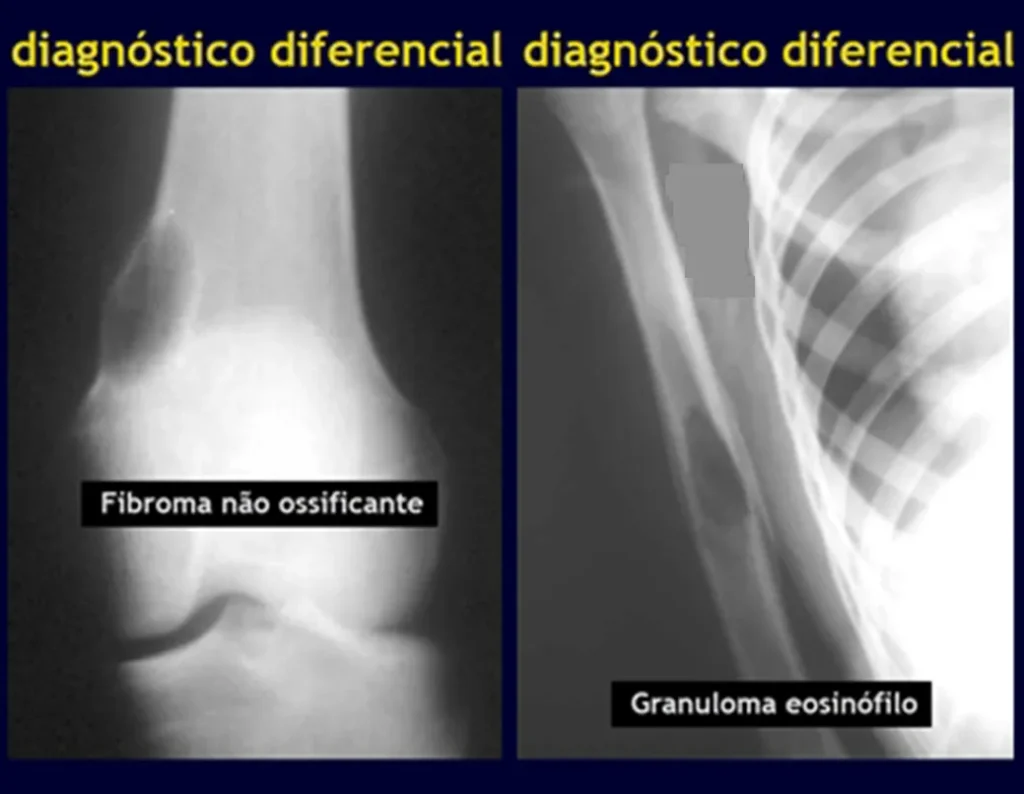
Granuloma eosinofílico
(Histiocitosis X, Granuloma de células de Langerhans, Reticuloendoteliosis)
El Granuloma Eosinofílico es una lesión pseudotumoral, también de etiología desconocida, caracterizada por una intensa proliferación de elementos reticulohistiocíticos con un número variable de eosinófilos, neutrófilos, linfocitos, células plasmáticas y células gigantes multinucleadas. Presenta frecuentes zonas de necrosis, así como la presencia de numerosas células grasas.
Entre las reticuloendoteliosis, el granuloma eosinofílico se presenta como una lesión única que afecta preferentemente las regiones diafisarias y metafisarias de los huesos largos. Estas lesiones únicas pueden resolverse espontáneamente con el tiempo, desde meses hasta años. Rara vez son incapacitantes o causan fracturas patológicas.
La reticuloendoteliosis en su forma múltiple caracteriza la enfermedad de Hand-Schuller-Christian, que presenta múltiples lesiones en el casquete y afecta frecuentemente a otros tejidos, presentándose diabetes insípida (por afectación de la glándula parapituitaria), exoftalmos y lesiones en el hígado y el bazo.
En la forma más grave, Letterer-Siwe, los hallazgos clínicos frecuentes son fiebre, otitis media, antecedentes frecuentes de infecciones bacterianas y, en algunos casos, observamos anemia, hepatoesplenomegalia, hemorragia sin causa aparente, linfadenopatía y lesiones óseas diseminadas. La evolución suele ser fatal debido a una afectación sistémica grave.
El aspecto radiológico del granuloma eosinofílico en sí es el de una lesión radiolúcida, de forma redondeada u ovoide, con bordes delimitados y bien definidos, en la región diafisaria de los huesos largos y, en ocasiones, en la región metafisaria, provocando erosión cortical y reacción perióstica. . piel de cebolla”, imitando la reacción perióstica del sarcoma de Ewing, pero en el granuloma eosinofílico es del tipo laminar grueso.
Cuando afecta a la columna, provoca el colapso de las vértebras “Calvé vertebrae” , pero rara vez conduce a un deterioro neurológico.
En lesiones únicas el tratamiento es curetaje e injerto óseo cuando sea necesario.
Definición: Lesión no neoplásica de etiología desconocida, caracterizada por una intensa proliferación de elementos reticulohistiocíticos con un número variable de eosinófilos, neutrófilos, linfocitos, células plasmáticas y células gigantes multinucleadas. Frecuentes áreas de necrosis, así como presencia de células grasas, especialmente en lesiones antiguas y múltiples.
Incidencia: La reticuloendoteliosis presenta varias formas de afectación, pero se divide principalmente en tres formas básicas: Granuloma eosinofílico (75%), Hand-Schuller-Christian (15%) y Letterer-Siwe (10%).
Granuloma eosinofílico: 5 a 20 años
Hand-Schuller-Christian: 3 a 5 años
Letterer-Siwe: 1 a 3 años
Etiología: La reticuloendoteliosis no tiene una etiología conocida, sin embargo algunos autores la relacionan con una probable causa viral o inmunológica, debido a la presencia de un fenómeno inflamatorio con formación de un proceso granulomatoso hiperplásico, muchas veces similar a procesos neoplásicos.
Manifestaciones Clínicas: La historia natural de la evolución de esta enfermedad dependerá de una de las tres formas en que se presente.
– Granuloma eosinofílico: la mayoría de las veces se presenta como una lesión única, afectando preferentemente a la región diafisaria y metafisaria de los huesos largos, y más raramente también vemos casos con afectación múltiple, que puede ser simultánea o consecutiva, comenzando en la adolescencia y arrastrando. hasta la edad adulta joven. Las lesiones únicas suelen acabar resolviendo espontáneamente con el tiempo, que va de meses a años, y rara vez son incapacitantes o conducen a una fractura patológica.
– Hand-Schuller-Christian: normalmente cursa con múltiples lesiones, que son más difíciles de tratar y evolucionan de forma más incapacitante que el Granuloma Eosinofílico. Frecuentemente presentan afectación secundaria de otros tejidos, progresando frecuentemente a Diabetes insípida (afectación de la glándula parapituitaria), exoftalmos por afectación orbitaria y afectación del hígado y del bazo.
– Letterer-Siwe: los hallazgos clínicos más frecuentes son fiebre, otitis media y antecedentes frecuentes de infecciones bacterianas, y en algunos casos hay anemia, hepatoesplenomegalia, sangrado sin causa aparente, linfadenopatías y lesiones óseas diseminadas. La evolución suele ser fatal debido a la afectación sistémica.
Aspectos radiográficos: Las lesiones tienen un aspecto radiotransparente, con forma redondeada y ovoide, con bordes bien definidos y bien definidos, y en muchas ocasiones pueden verse trabéculas en su interior. Con frecuencia afectan la región diafisaria de los huesos largos y con menos frecuencia la región metafisaria, provocando erosión cortical y ligera expansión cortical. Es posible visualizar un pequeño levantamiento perióstico con una reacción de “piel de cebolla” similar a la del Sarcoma de Ewing y la osteomielitis.
Cuando la afectación es en la columna, rara vez deriva en deterioro neurológico, aunque se produce un colapso de la vértebra, presentándose un aplanamiento y conocido como “vértebra plana de Calvé”.
En casos más graves, como el síndrome de Hand-Schüller-Christian y el síndrome de Letterer-Siwe, se observan lesiones radiotransparentes diseminadas en la bóveda craneal.
Tratamiento y Pronóstico : El tratamiento y pronóstico de la enfermedad dependen directamente del grado de afectación y manifestaciones clínicas. En lesiones únicas el tratamiento de elección es el legrado y en defectos grandes el relleno con hueso esponjoso. En algunos casos donde no hay deterioro funcional o estético, se puede realizar la resección del hueso comprometido, como las costillas, la clavícula y la parte superior del peroné. En casos de afectación múltiple y sistémica, parte del tratamiento se realiza con el uso de fármacos quimioterapéuticos y terapia con corticosteroides.
1- Haz clic para ver más: http://bit.ly/granuloma_eosinófilo-por
2- Caso de granuloma eosinófilo poliostótico : http://bit.ly/Granuloma_Eosinófilo_do-Rádio
Defecto fibroso cortical / Fibroma no osificante
El defecto fibroso cortical es una lesión ósea benigna, no neoplásica, de causa desconocida, que se caracteriza por una proliferación fibrosa en una pequeña zona del hueso cortical. El fibroma no osificante es el mismo proceso, con un tamaño mayor.
El defecto fibroso cortical generalmente no presenta ningún síntoma o signo clínico. En la gran mayoría de los casos se diagnostica mediante un examen radiológico realizado por algún motivo. Cuando adquiere las características de un fibroma no osificante, puede manifestarse como un dolor leve, una protrusión perceptible por el paciente o, con menos frecuencia, una fractura.
Suelen encontrarse en la metáfisis de los huesos largos, principalmente en el fémur distal y la tibia proximal.
En las radiografías, el defecto fibroso cortical aparece como una pequeña lesión radiotransparente, de aproximadamente 1 a 2 cm, excéntrica, ya que se localiza en la corteza de las metáfisis de los huesos largos. Al principio son redondeados y con el tiempo se vuelven ovalados, con el mayor diámetro a lo largo del eje longitudinal en relación al hueso afectado. El proceso es superficial y restringido a la corteza, fácilmente determinable mediante tomografía computarizada.
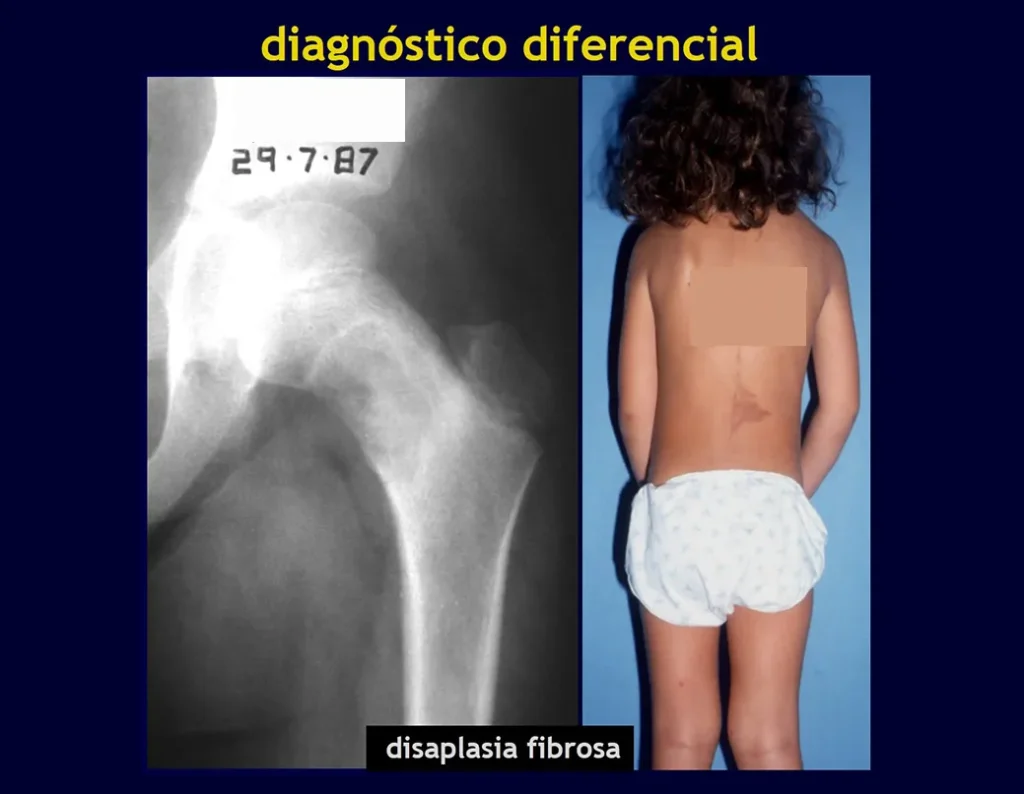
Displasia fibrosa y osteofibrodisplasia
La displasia fibrosa es una lesión pseudotumoral, caracterizada por un fallo en el desarrollo de uno o más huesos, que permanecen con sustitución parcial del hueso por tejido fibroso en medio de haces de osteoides dispuestos irregularmente. Radiográficamente la lesión es radiotransparente, con apariencia de vidrio “esmerilado”.
Puede manifestarse en dos formas clínicas: solitaria (monostótica) y múltiple (poliostótica), pudiendo producirse pigmentación de la piel.
Albright describió el síndrome con “osteítis fibrosa” en múltiples huesos, acompañada de manchas en la piel y pubertad precoz en las mujeres. Pueden estar asociados trastornos endocrinos como hipertiroidismo, diabetes, síndrome de Cushing, además de hipertensión y retraso mental. La asociación de displasia fibrosa poliostótica y mixomas de tejidos blandos se conoce como síndrome de Mazabraud.
La displasia fibrosa monostótica la mayor parte del tiempo no presenta síntomas. Es un defecto congénito del modelado óseo, que se manifiesta con mayor frecuencia en la primera y segunda década de la vida. Deformidad, fractura o hallazgo casual en radiografías son los principales hechos que llevan al paciente a consultar.
El tratamiento, cuando sea necesario, debe ser quirúrgico, ya que no existe tratamiento clínico para ninguna de las formas de displasia fibrosa. La lesión o lesiones generalmente dejan de progresar con el crecimiento y suelen cesar con la pubertad. La intervención quirúrgica estará indicada para correcciones ortopédicas cuando existan deformidades o riesgos de fractura inminente.
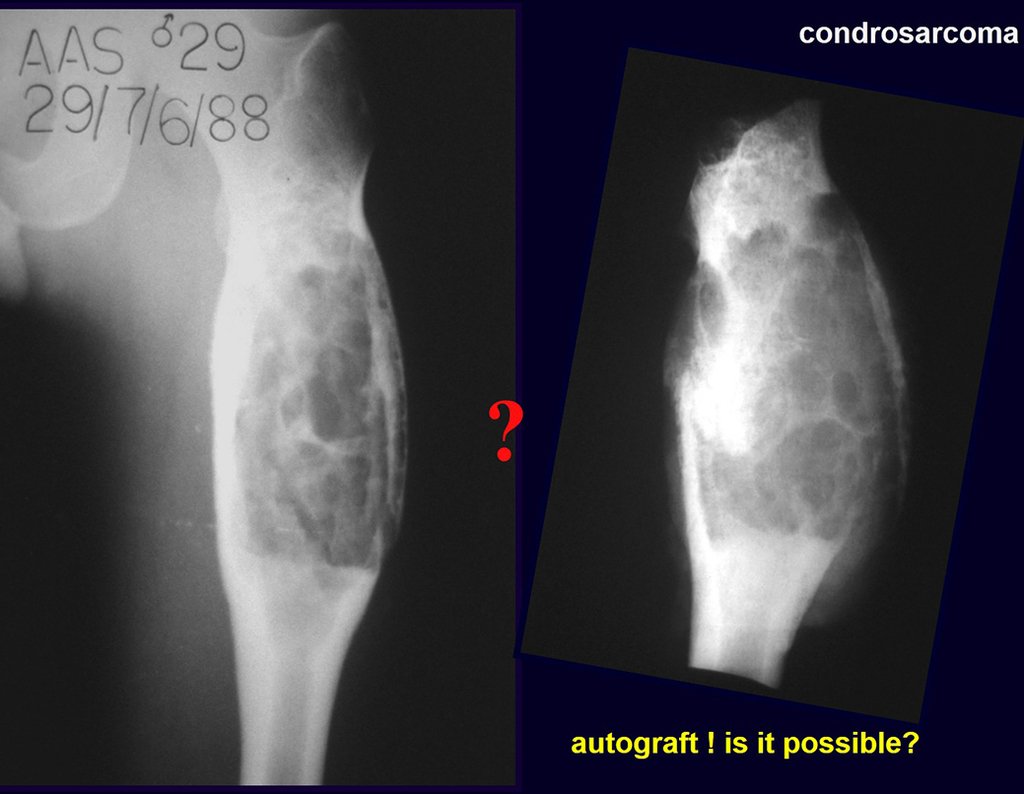
La malignidad de la displasia fibrosa es rara y pueden ocurrir casos de transformación en osteosarcoma y condrosarcoma.
Las lesiones únicas de displasia fibrosa pueden parecerse al fibroma desmoplásico, al condrosarcoma central o al adamantinoma de huesos largos. Cuando el paciente presenta quistes, el diagnóstico diferencial con adamantinoma de huesos largos puede resultar difícil mediante el examen radiográfico.
Histológicamente los principales diagnósticos diferenciales son el fibroma desmoplásico, el adamantinoma de huesos largos y la osteofibrodisplasia.
En la osteofibrodisplasia, el aspecto histológico es muy similar al de la displasia fibrosa. Sólo la localización intracortical en tibia o peroné permitirá el diagnóstico diferencial.
Tumor marrón del hiperparatiroidismo
Es una enfermedad metabólica que, si no se diagnostica precozmente, puede dar lugar a un proceso que simula la apariencia de un tumor, con numerosas lesiones debidas a focos de resorción ósea por hiperparatiroidismo primario. Es una lesión no neoplásica que presenta numerosas células gigantes multinucleadas.
Es causada por un adenoma de paratiroides y tiene un inicio lento e insidioso, predominando en mujeres adultas, presentando diversas manifestaciones clínicas como náuseas, indigestión, pérdida de apetito, cálculos renales recurrentes y fracturas sin causa aparente o por traumatismos leves. eventualmente, cambios psíquicos.
La hipercalcemia acompañada de hipercalciuria, hipofosfatemia, hiperfosfaturia y aumento de la hormona paratiroidea en sangre cierran el diagnóstico de laboratorio. Si no se trata, pueden producirse cambios óseos cada vez más intensos, hasta llegar a la osteítis fibroquística generalizada o la enfermedad ósea de Von Recklinghausen.
Las lesiones iniciales del hiperparatiroidismo ocurren como focos de resorción ósea subperióstica en las falanges de las manos y reabsorción de la “lámina dura” de la implantación dental en los alvéolos.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com