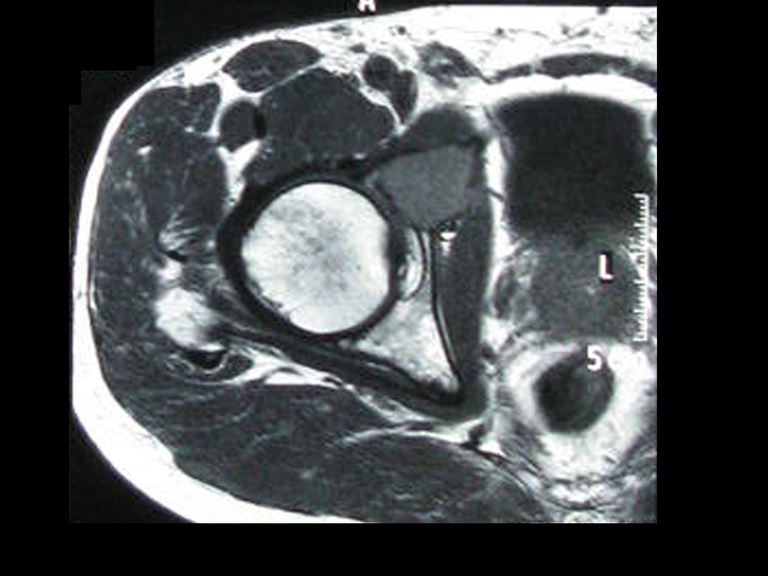
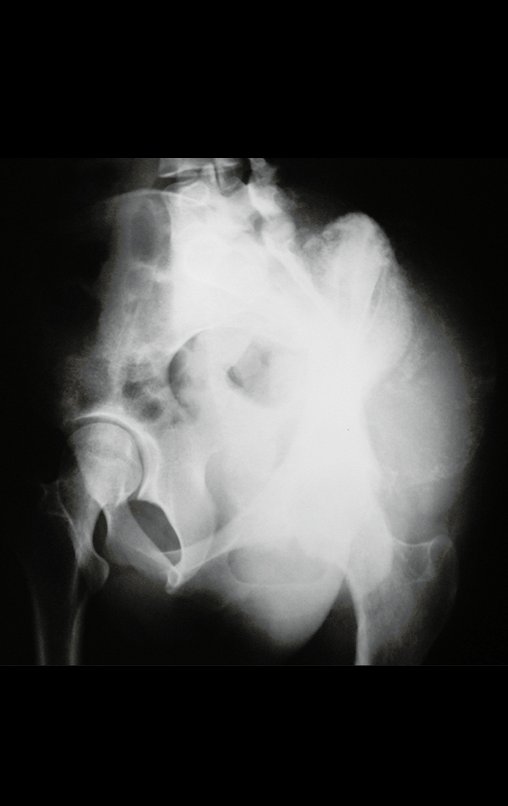
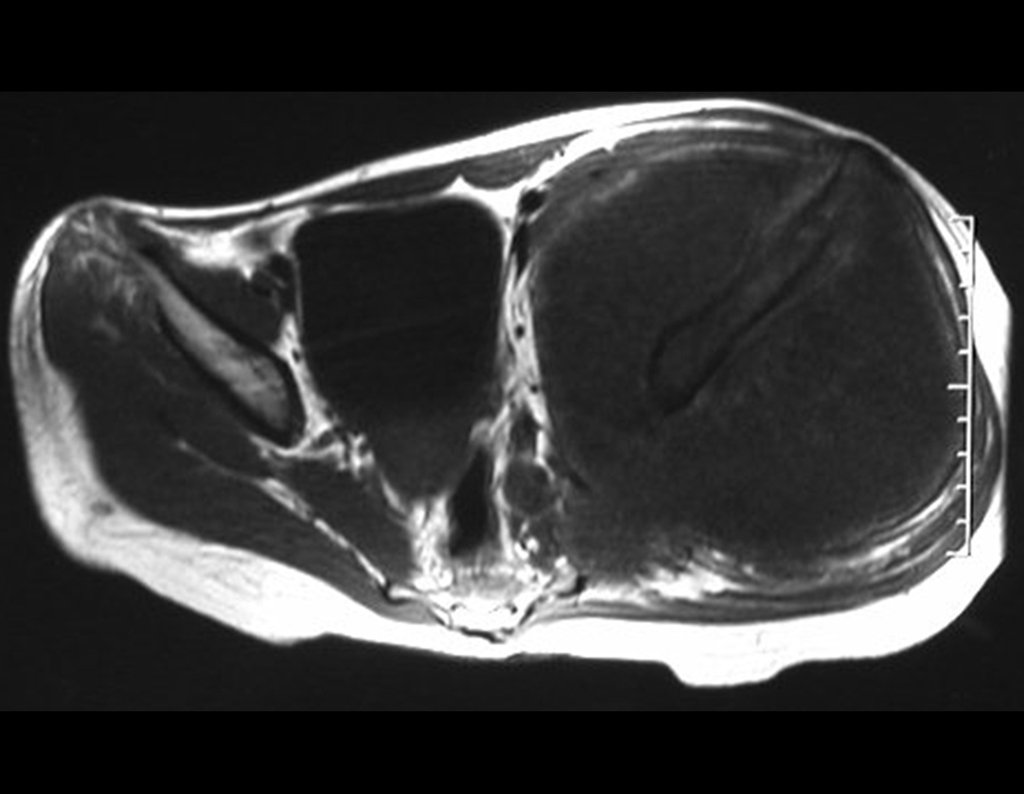
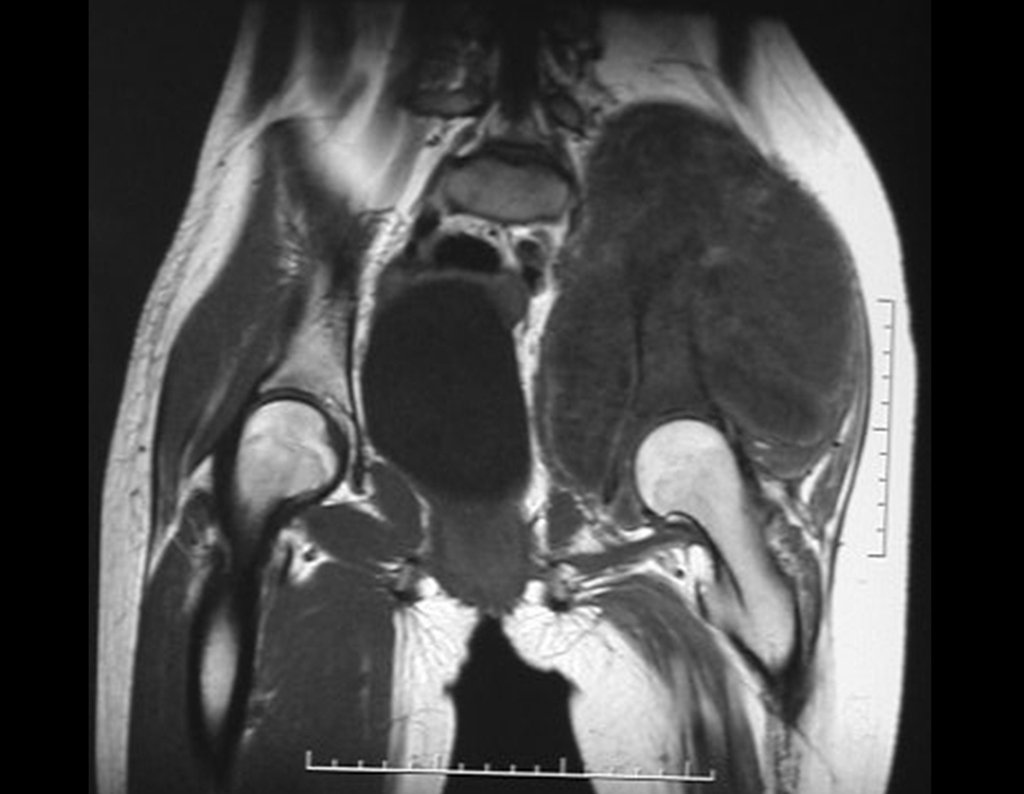
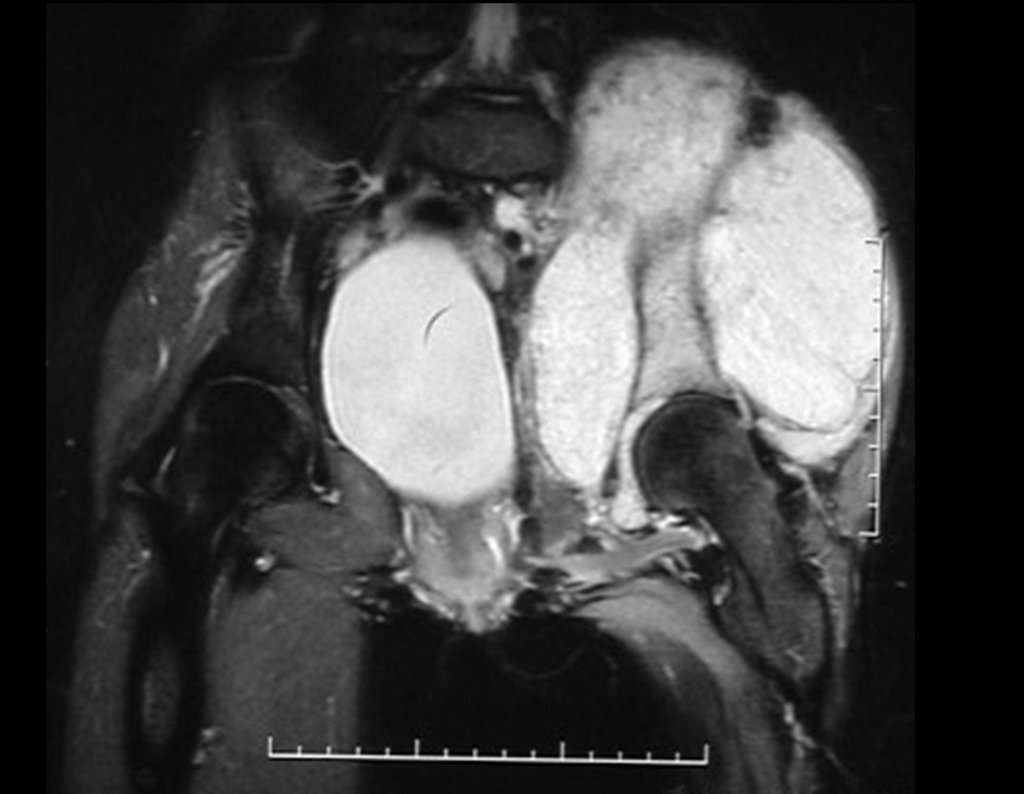
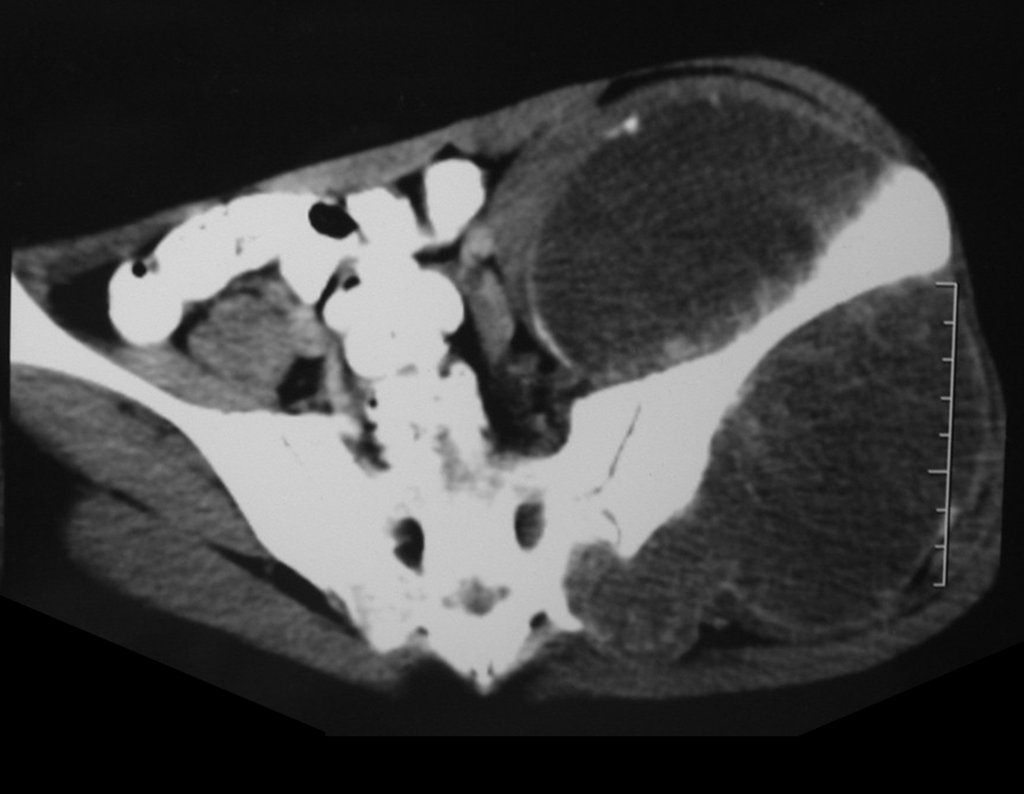
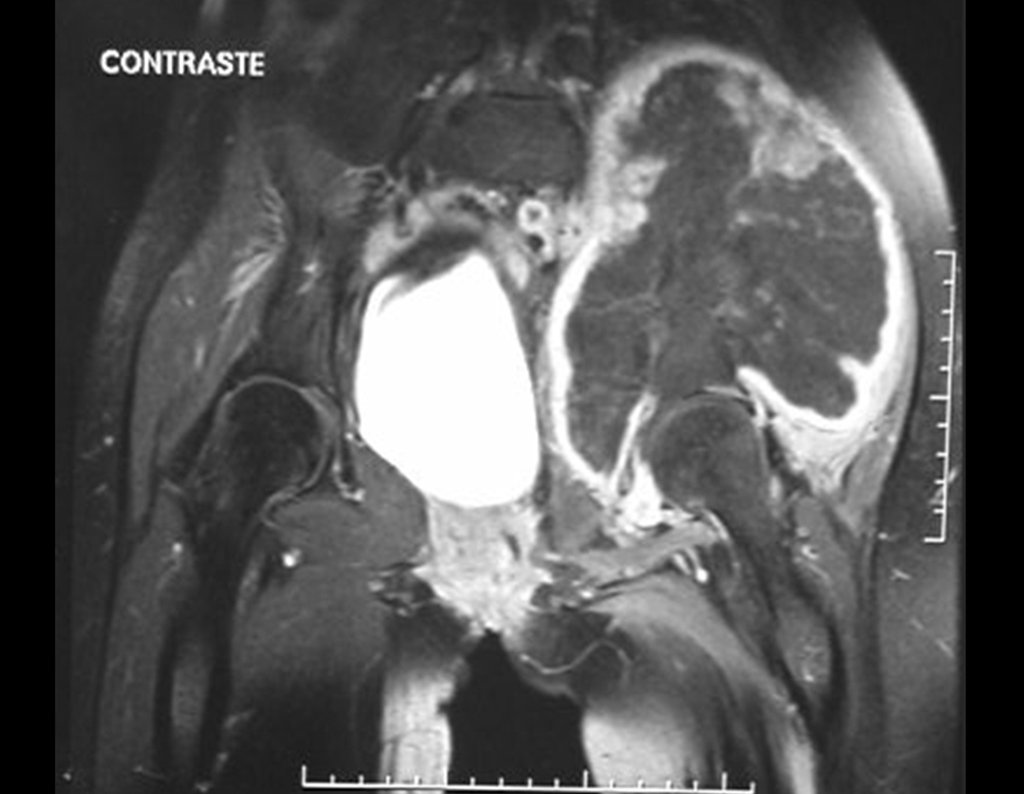
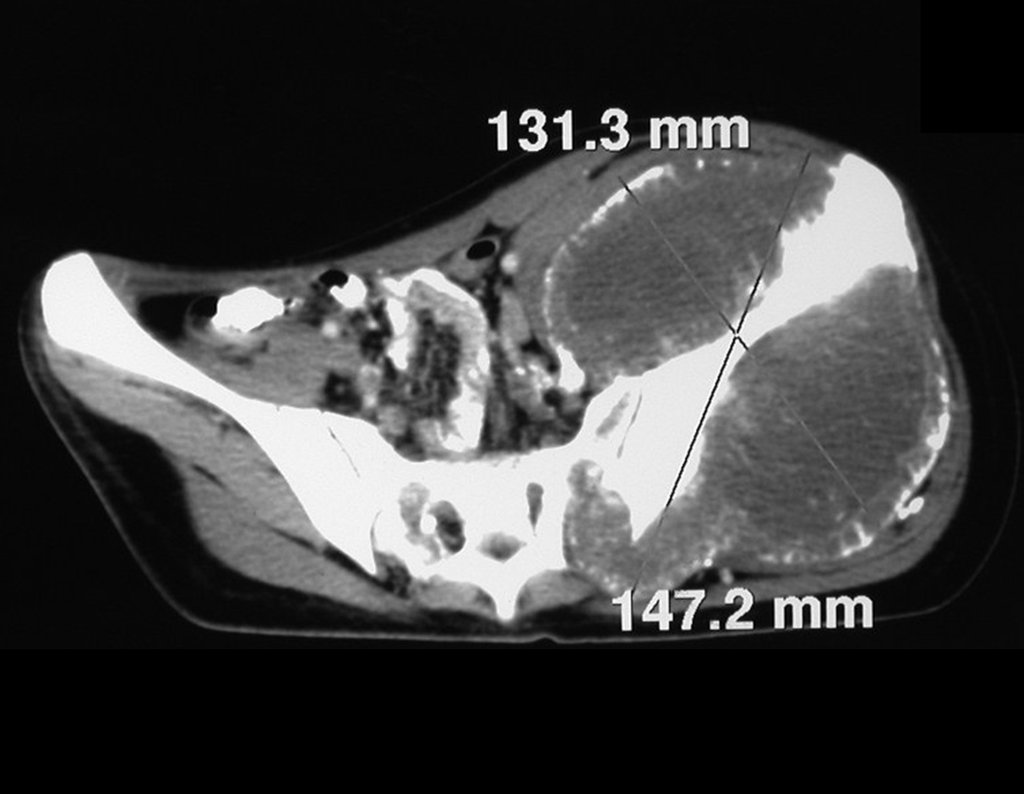
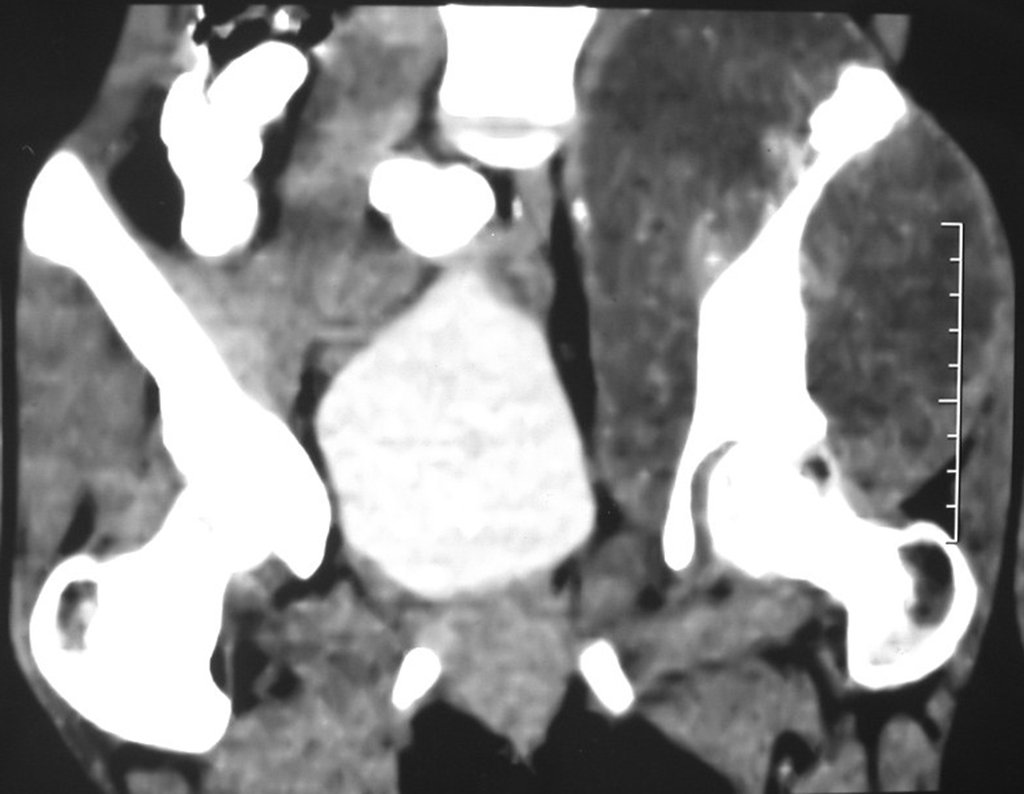
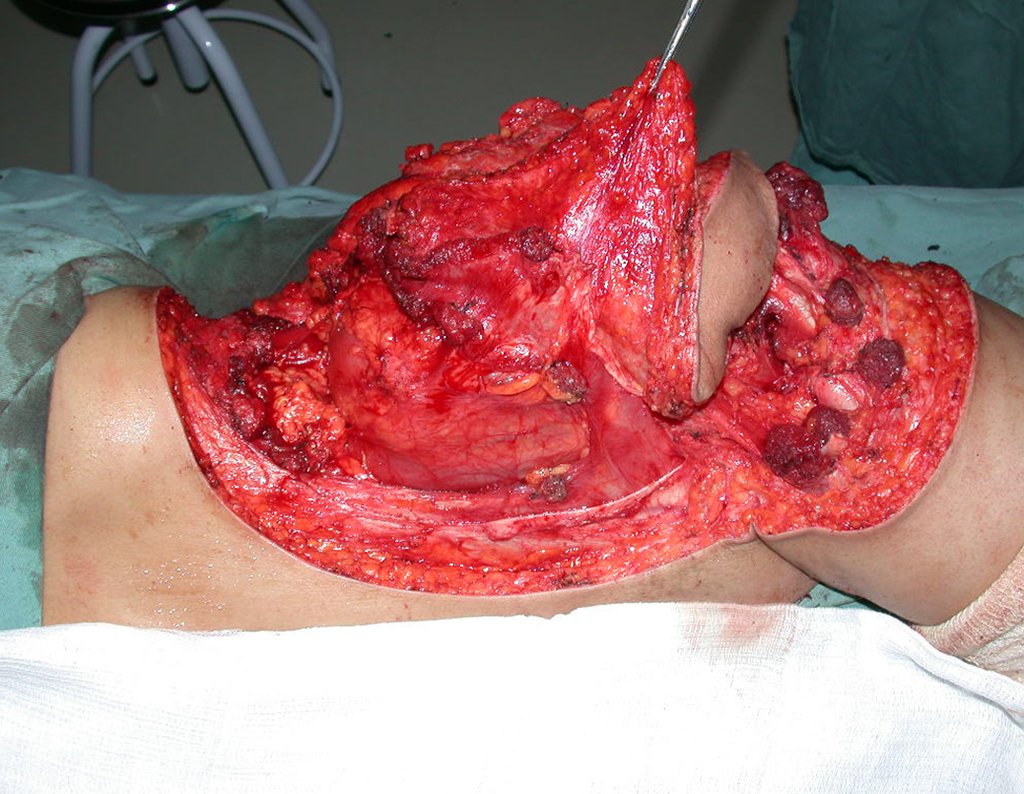
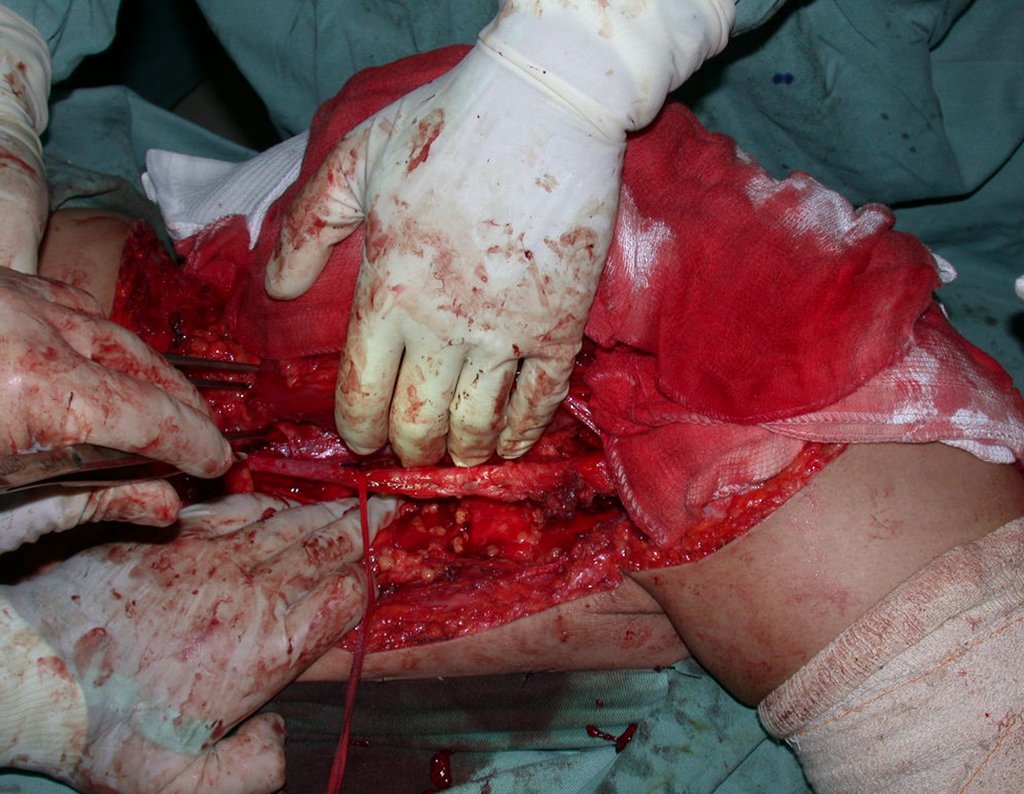
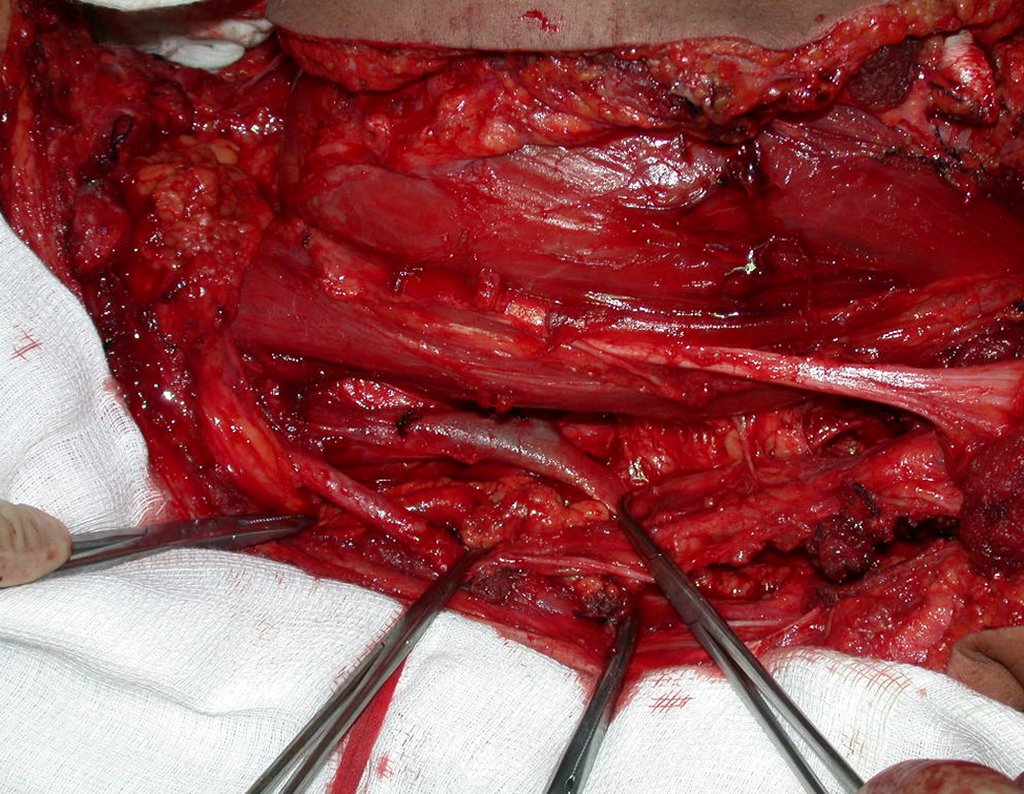
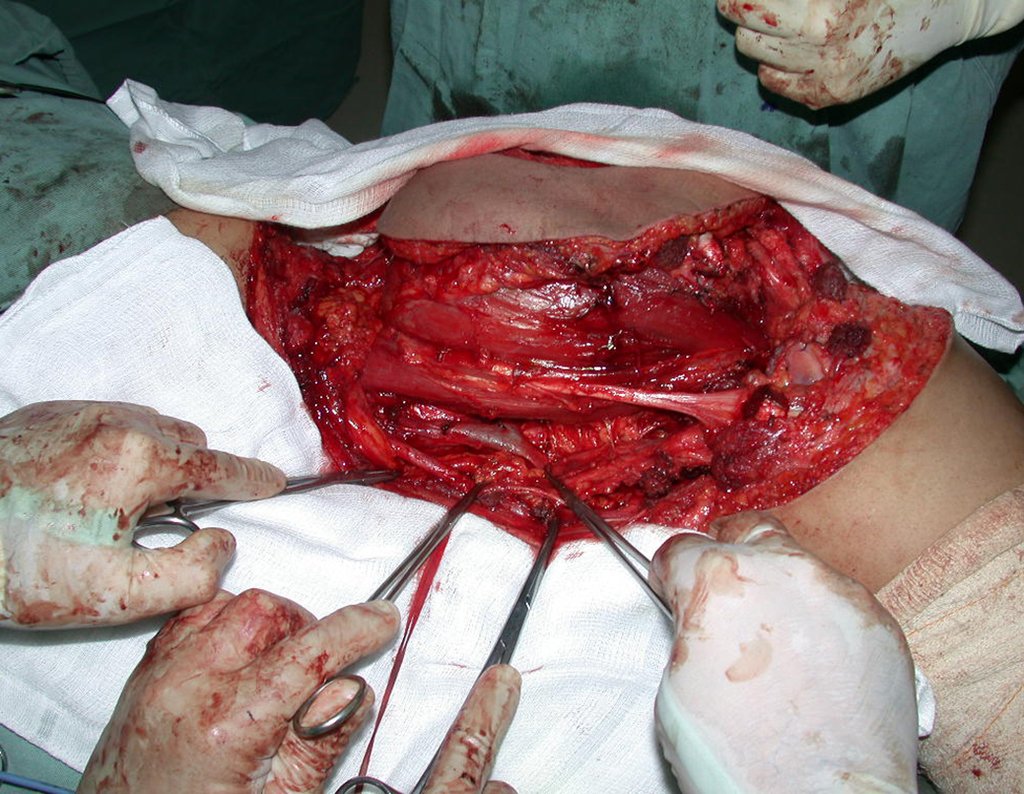
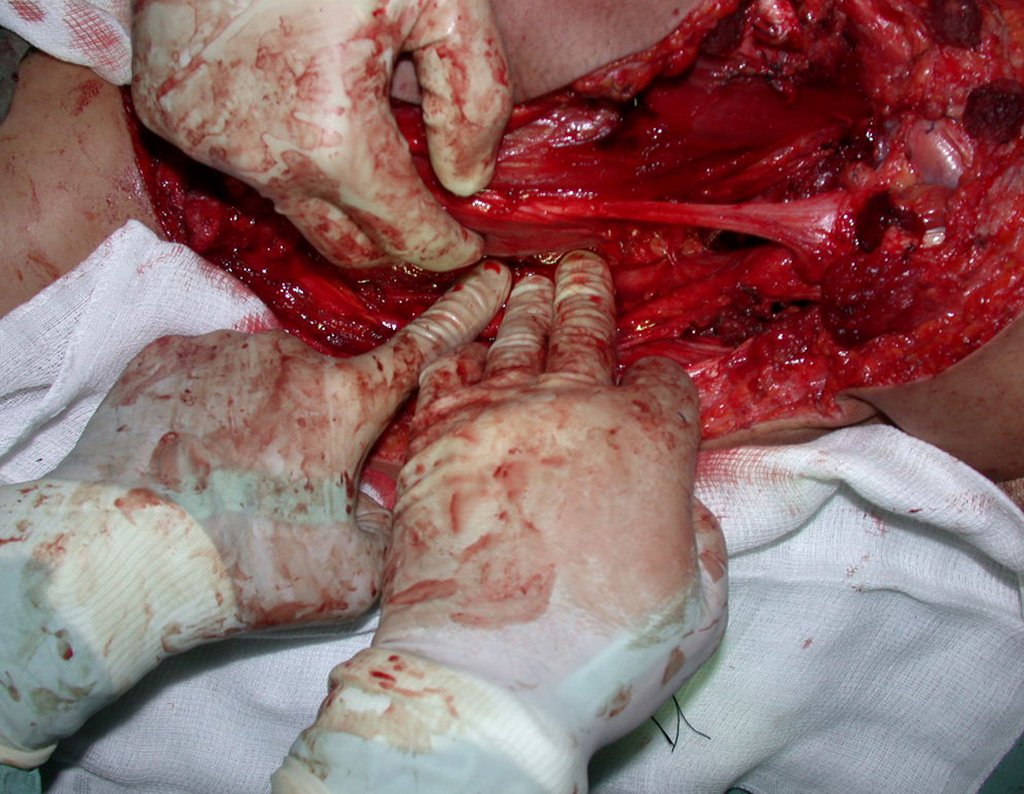
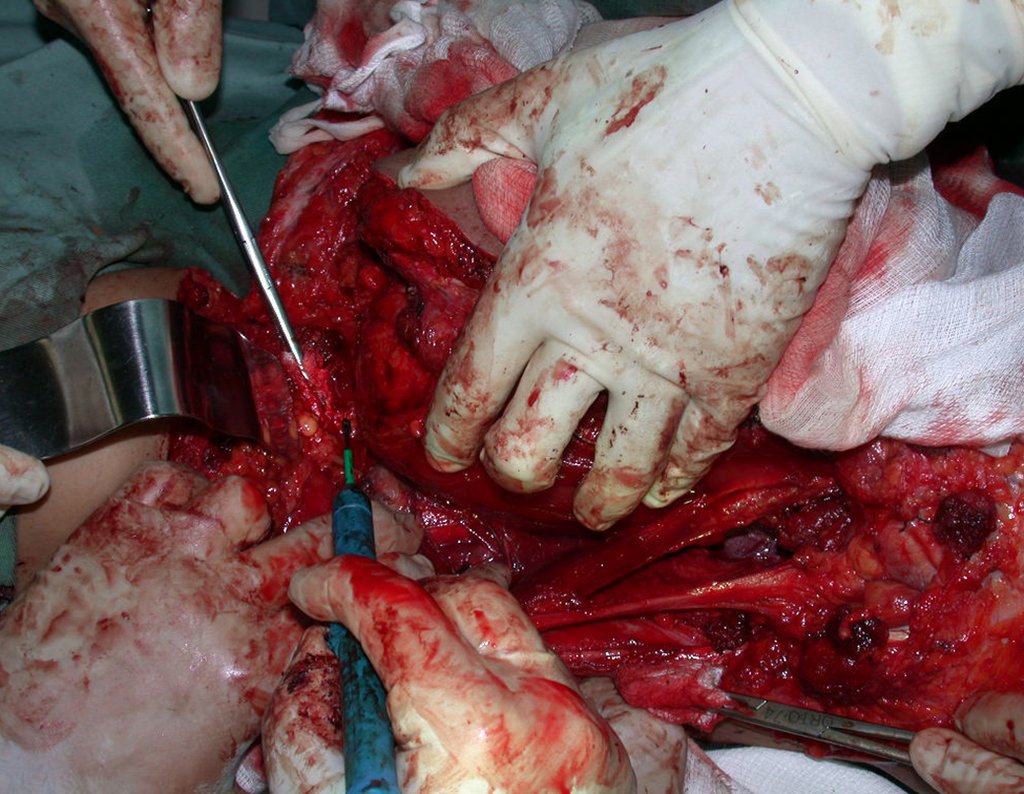
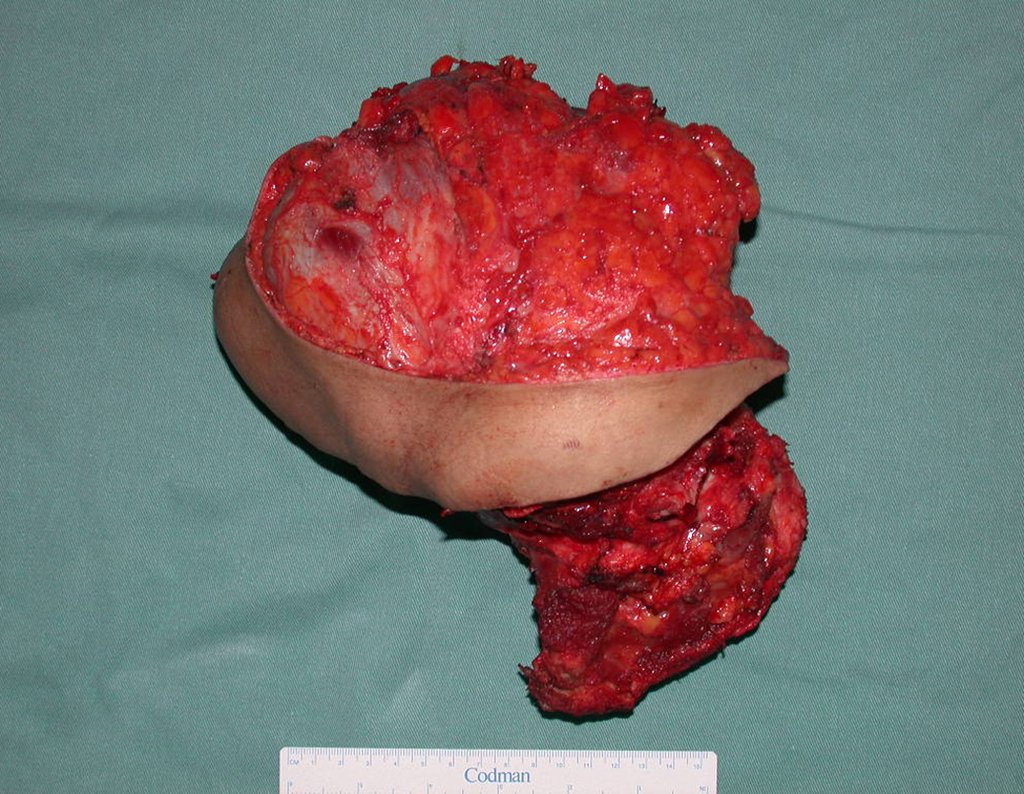
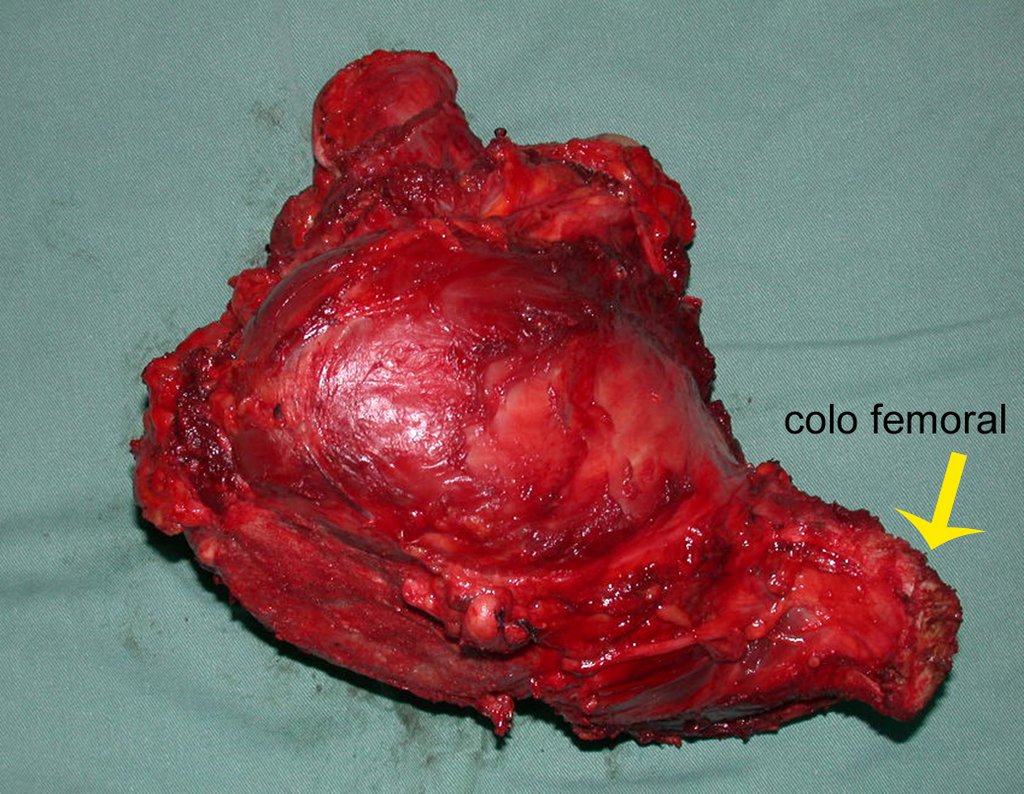
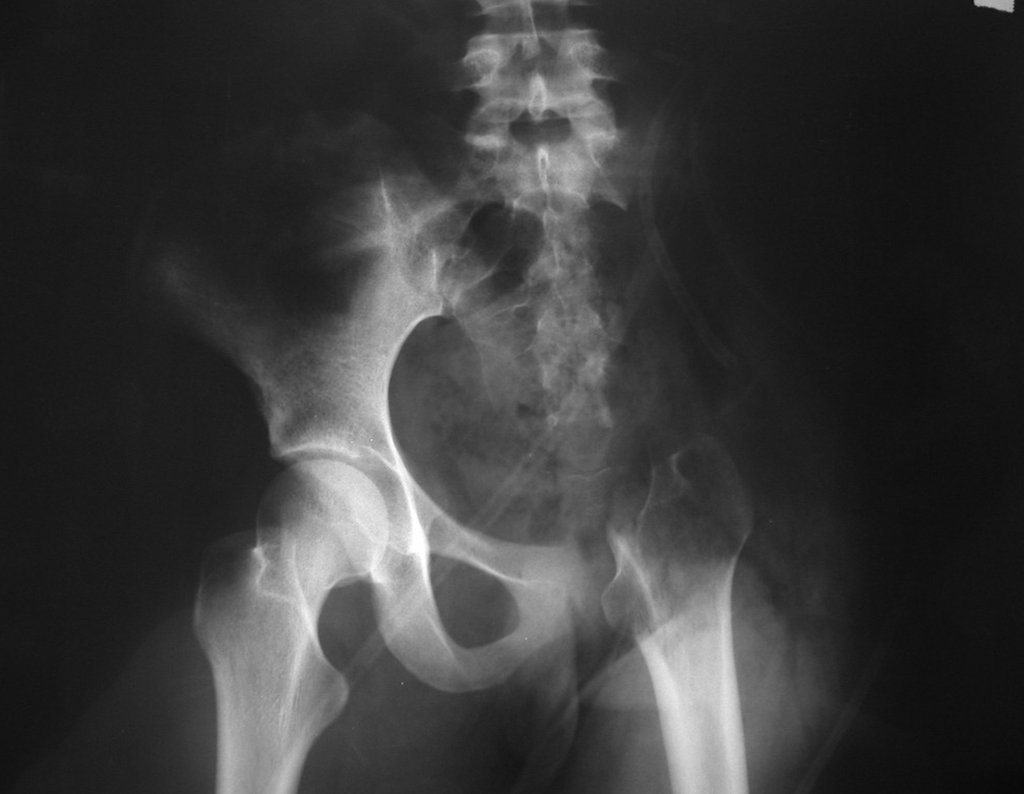
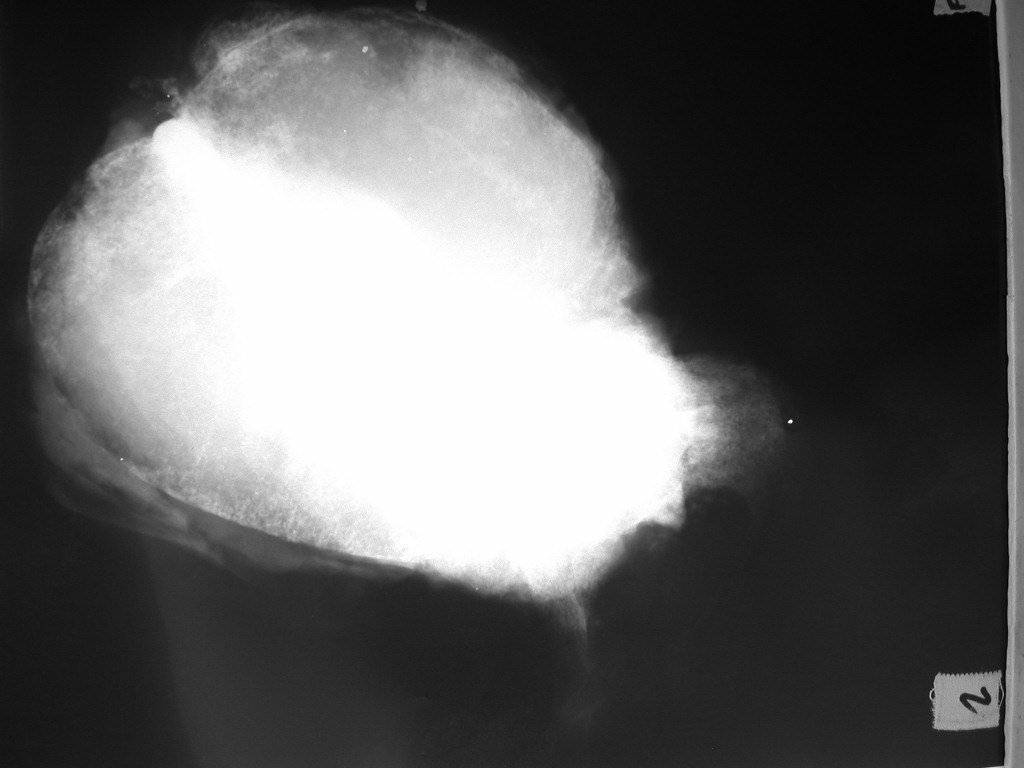
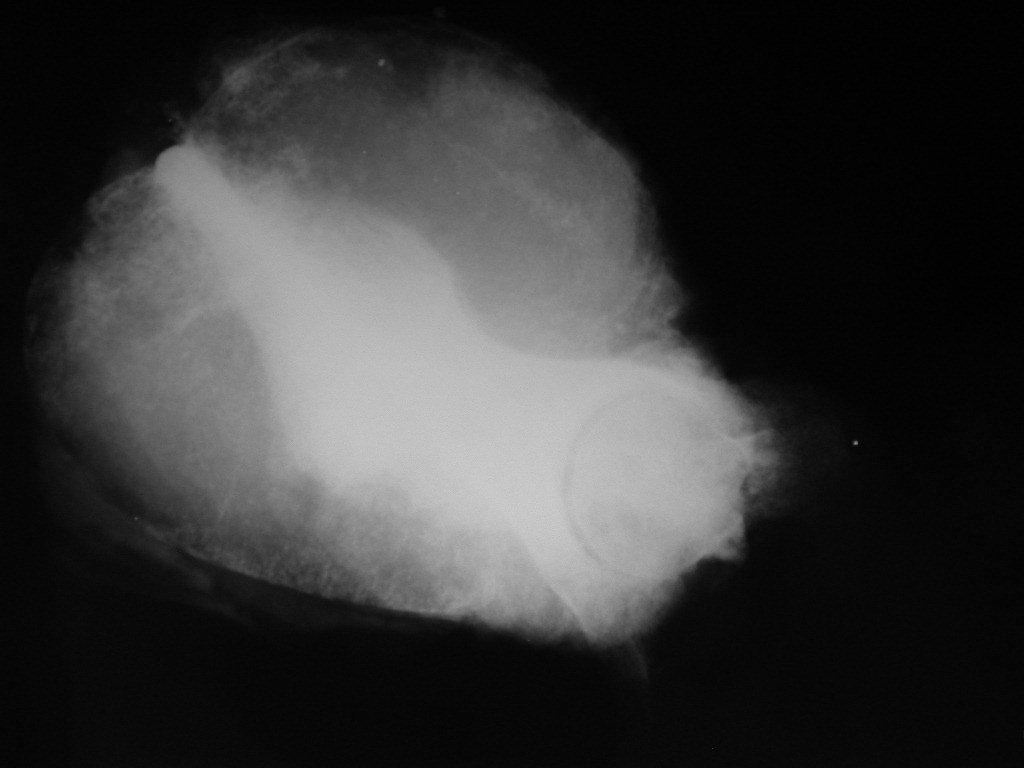
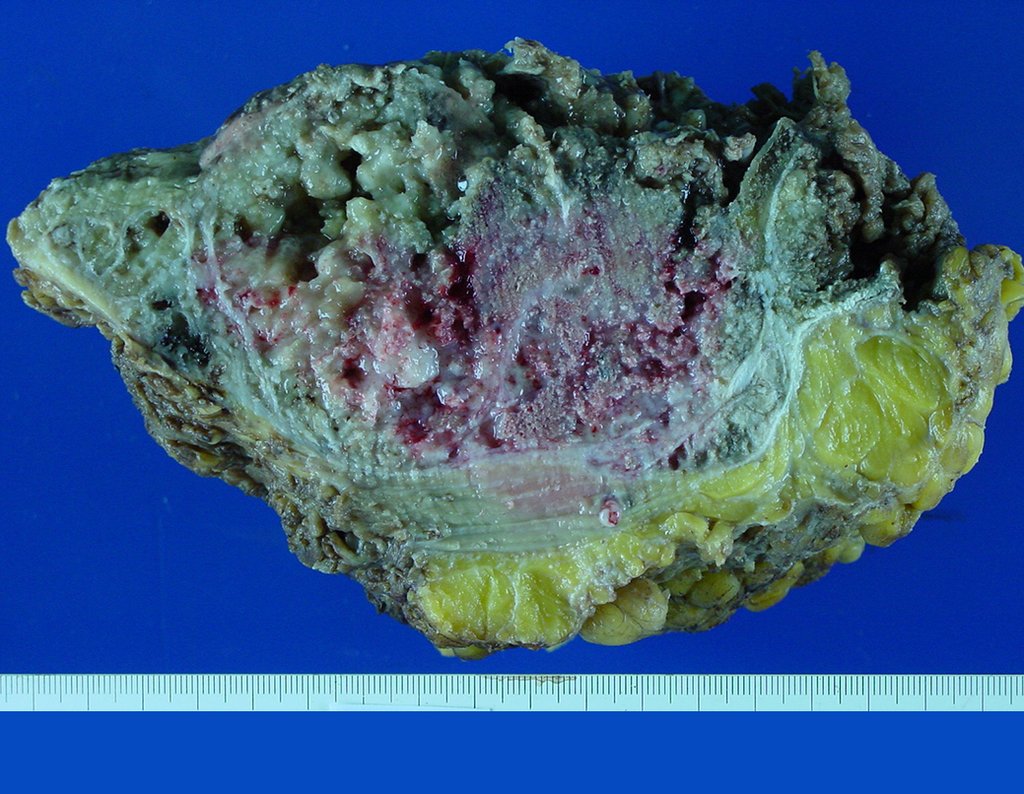
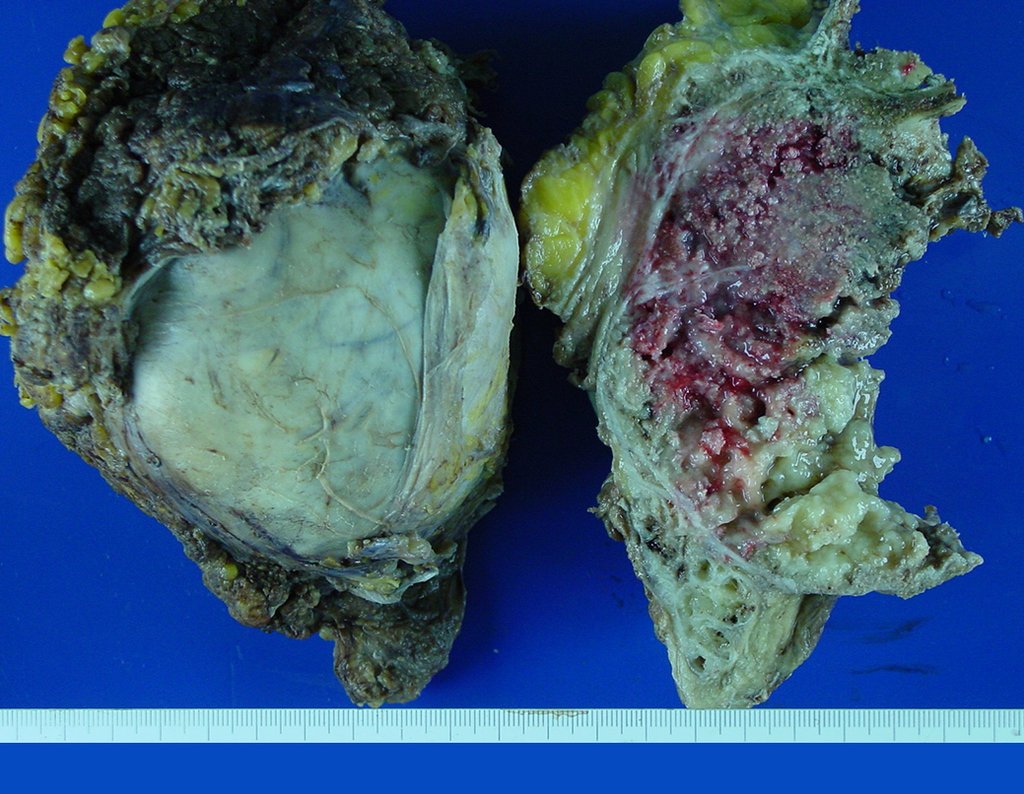
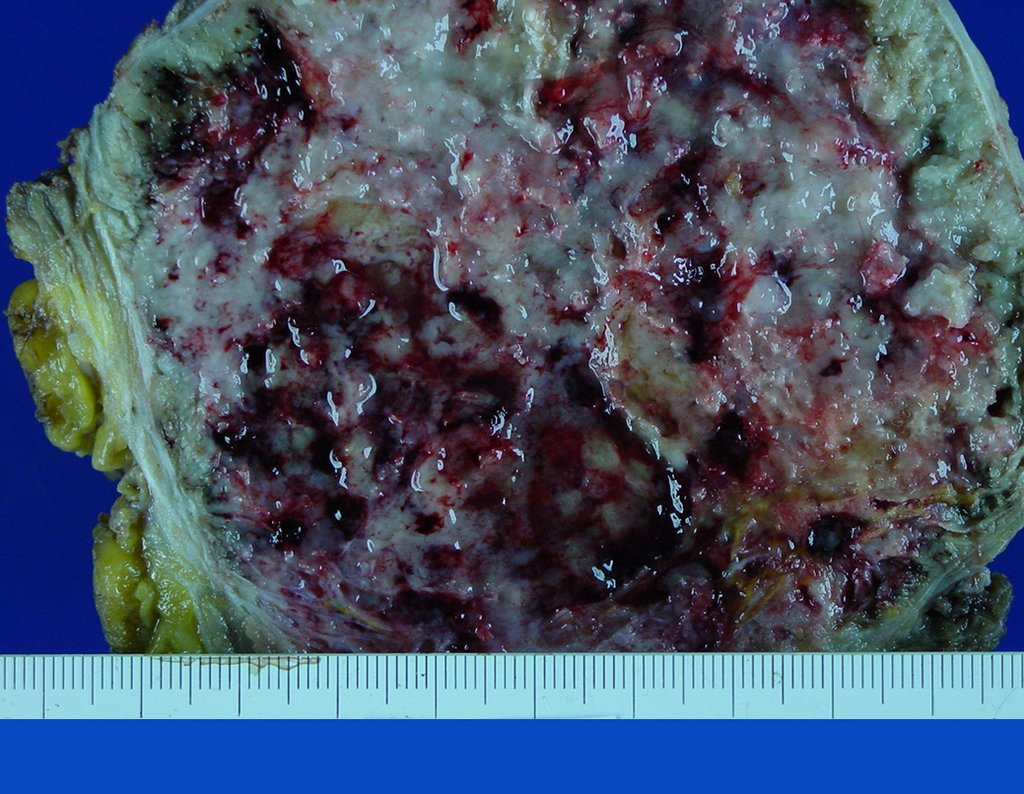
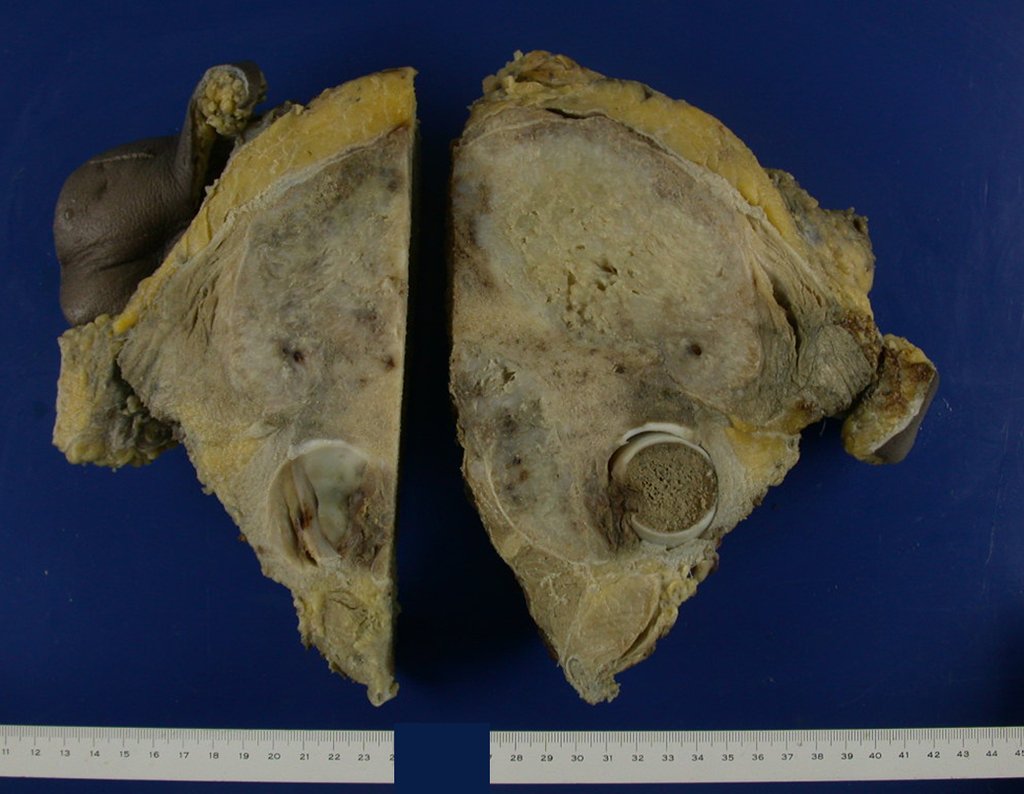
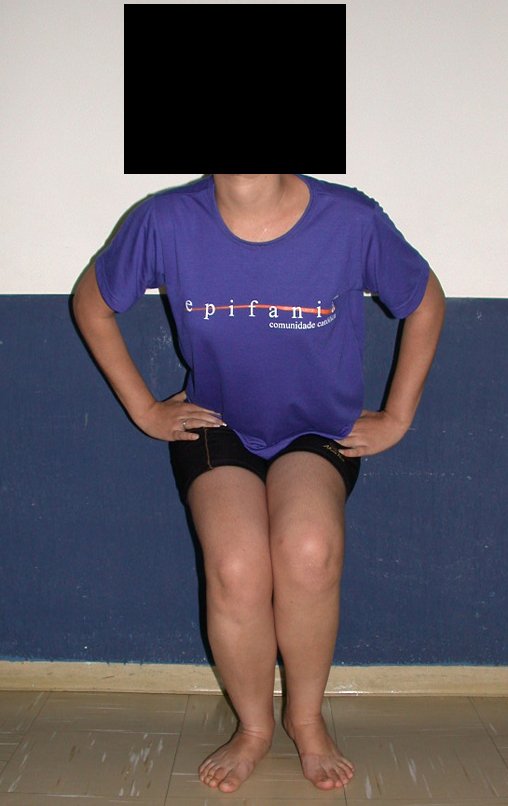
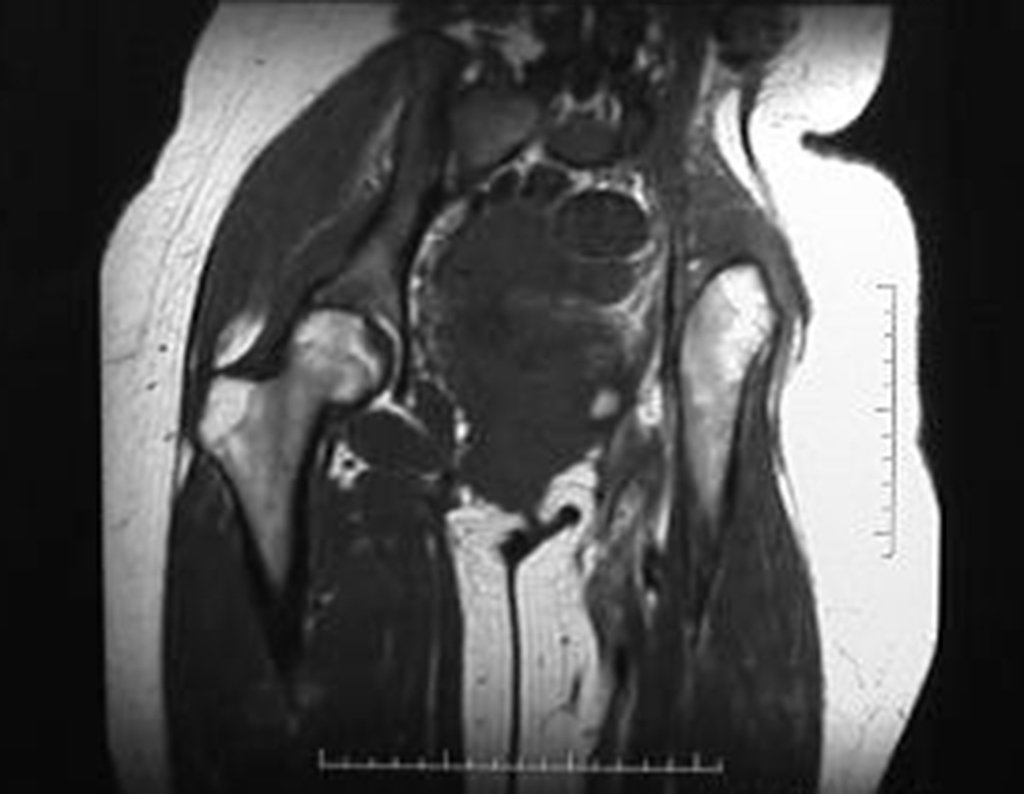
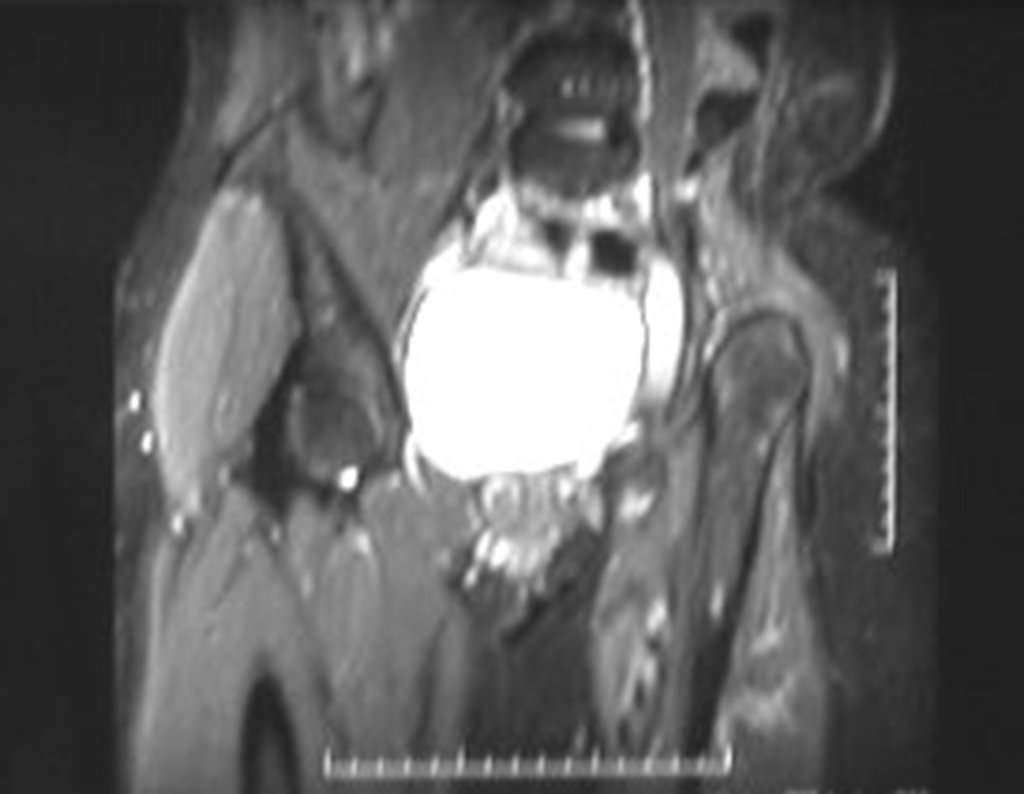
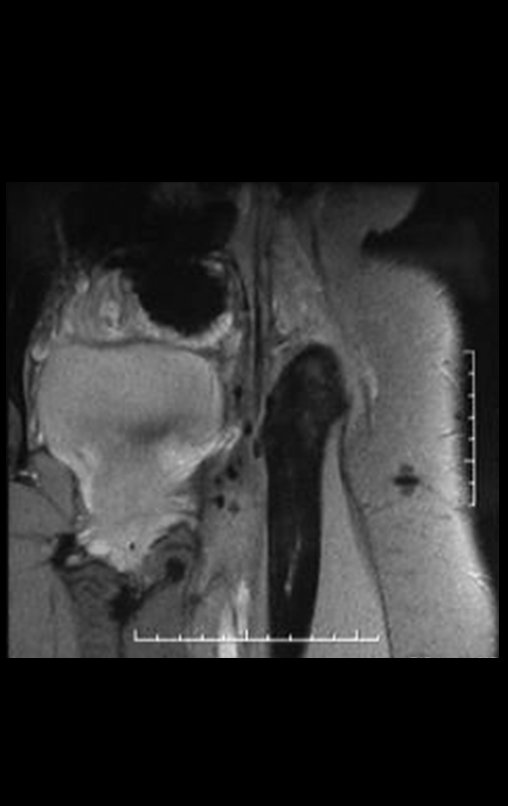
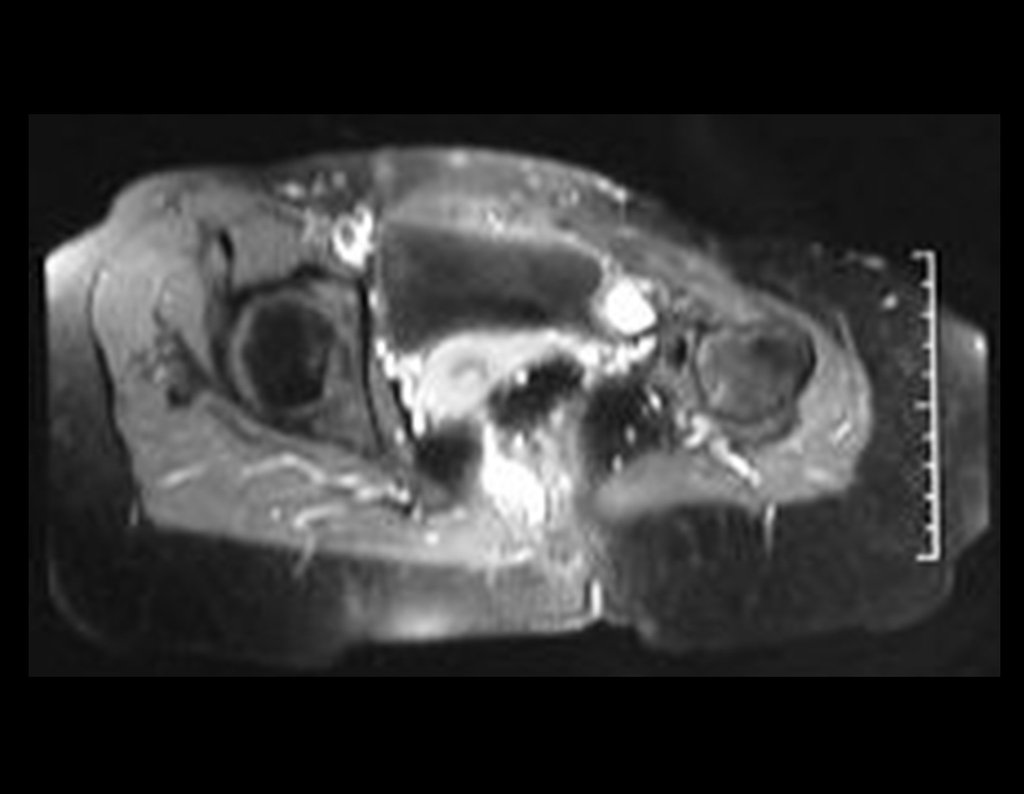
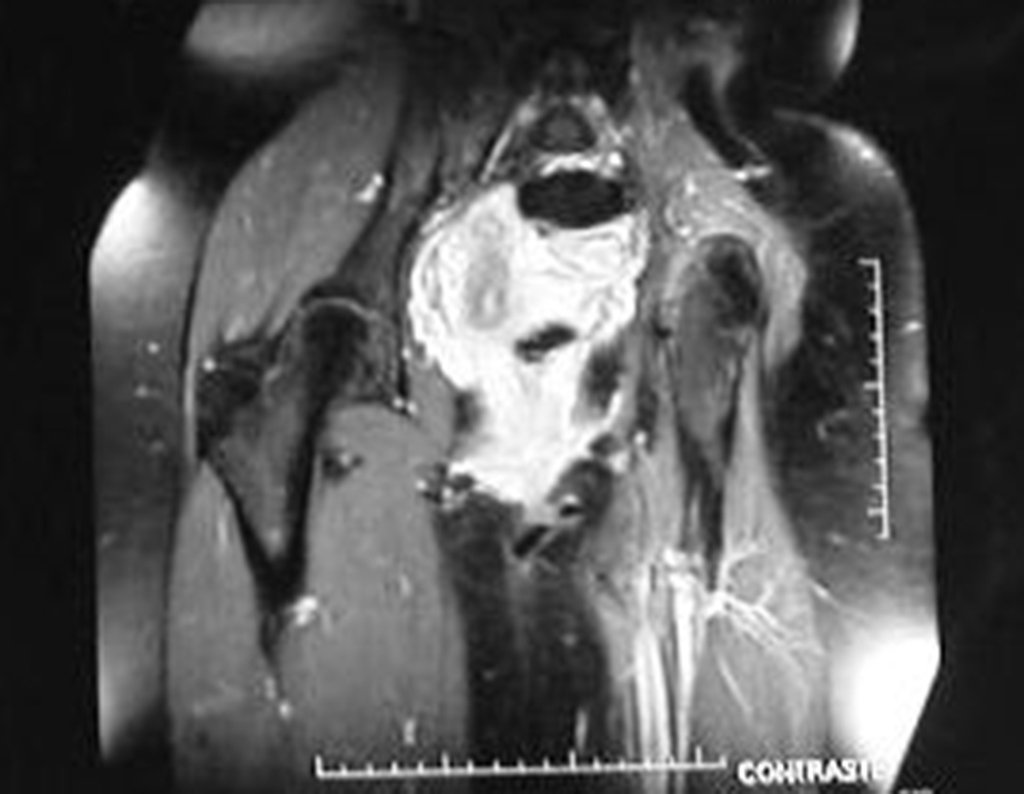
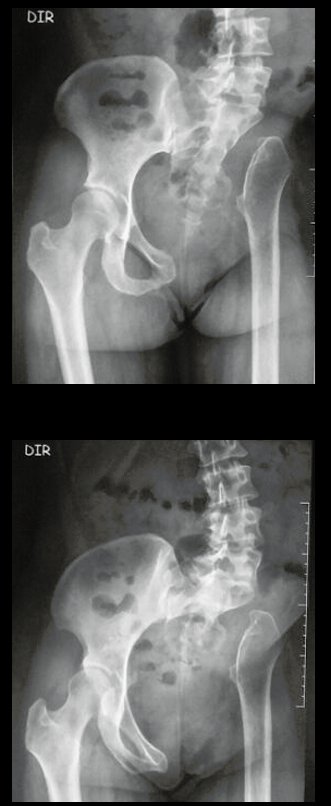
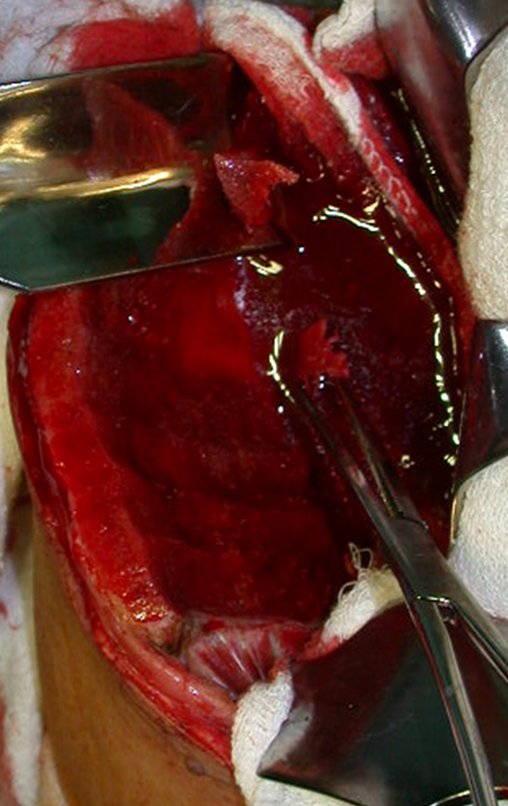
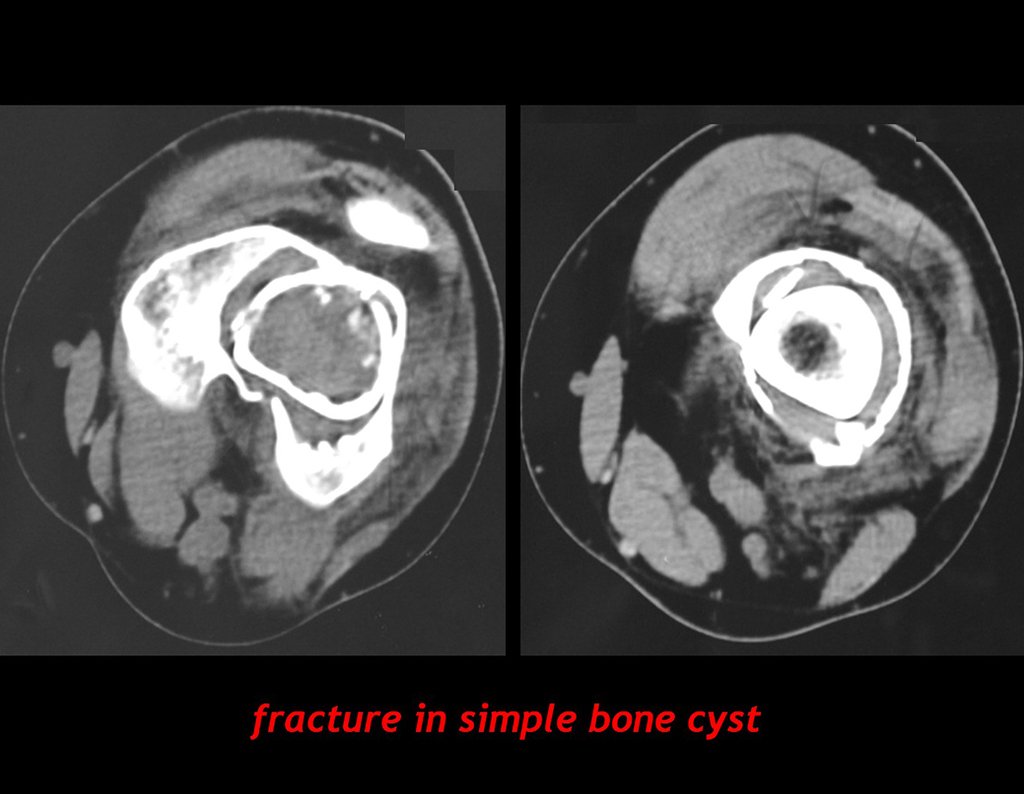
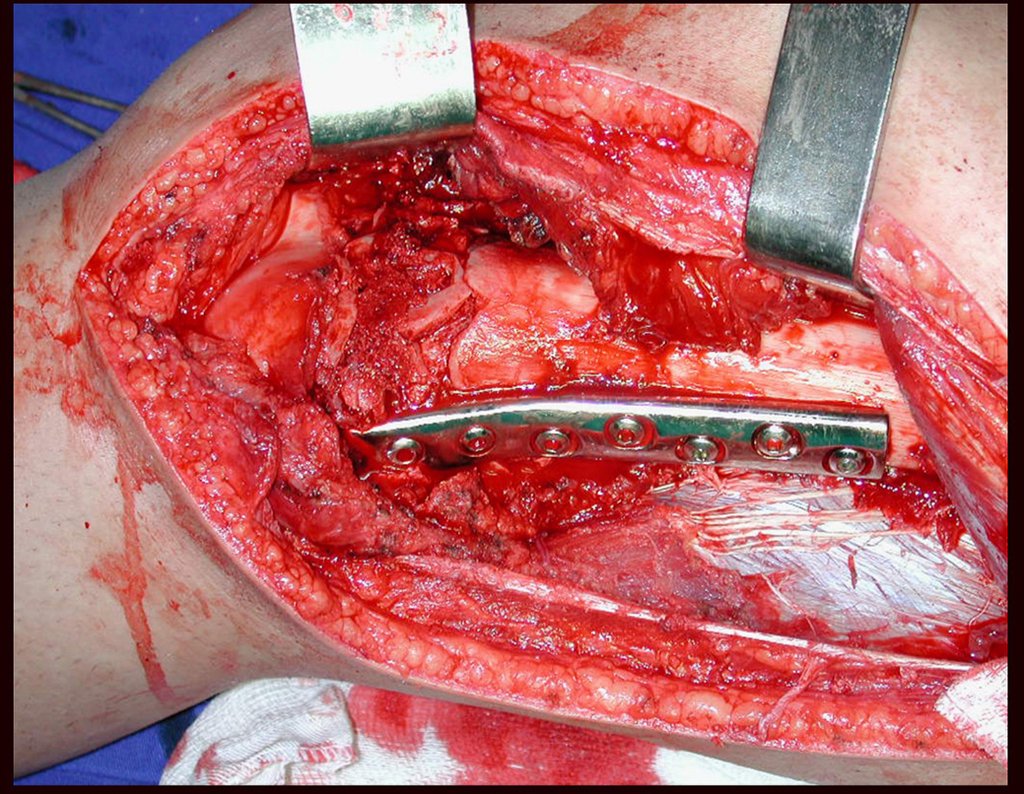
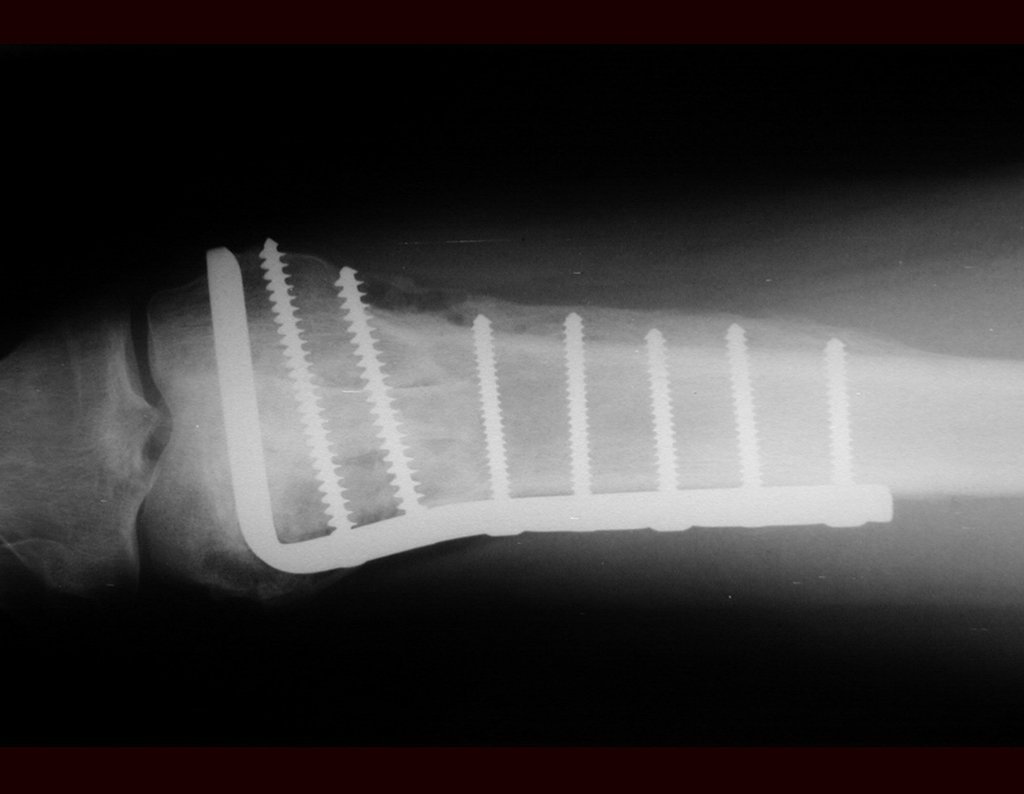
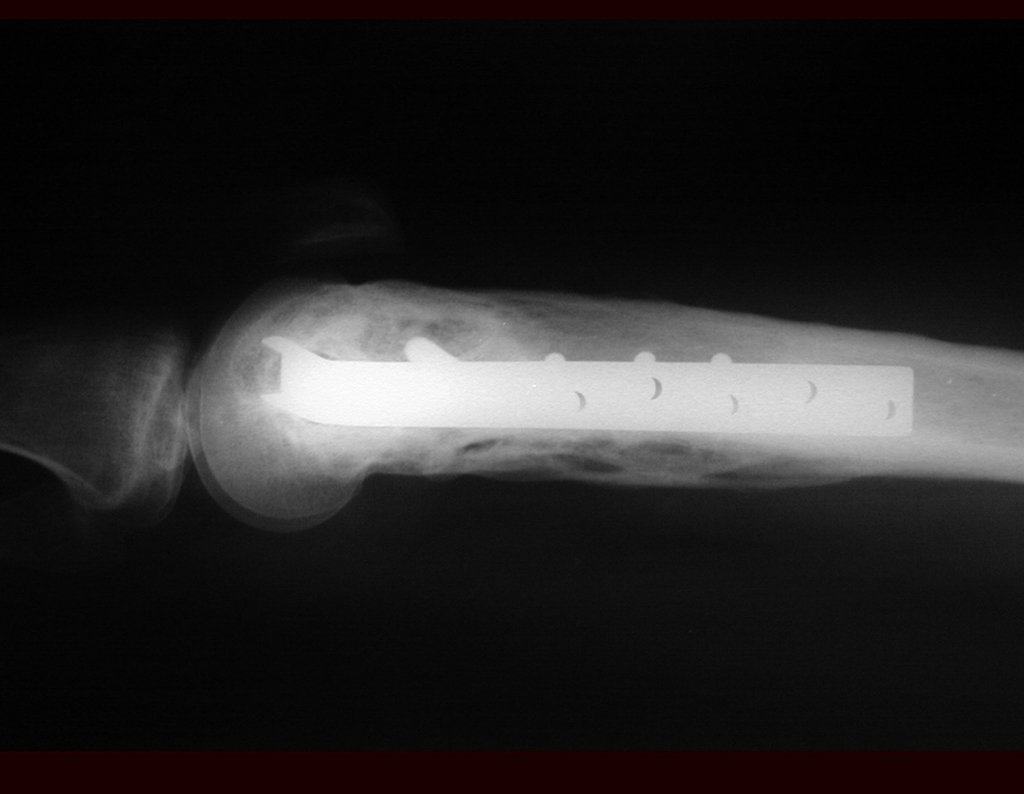
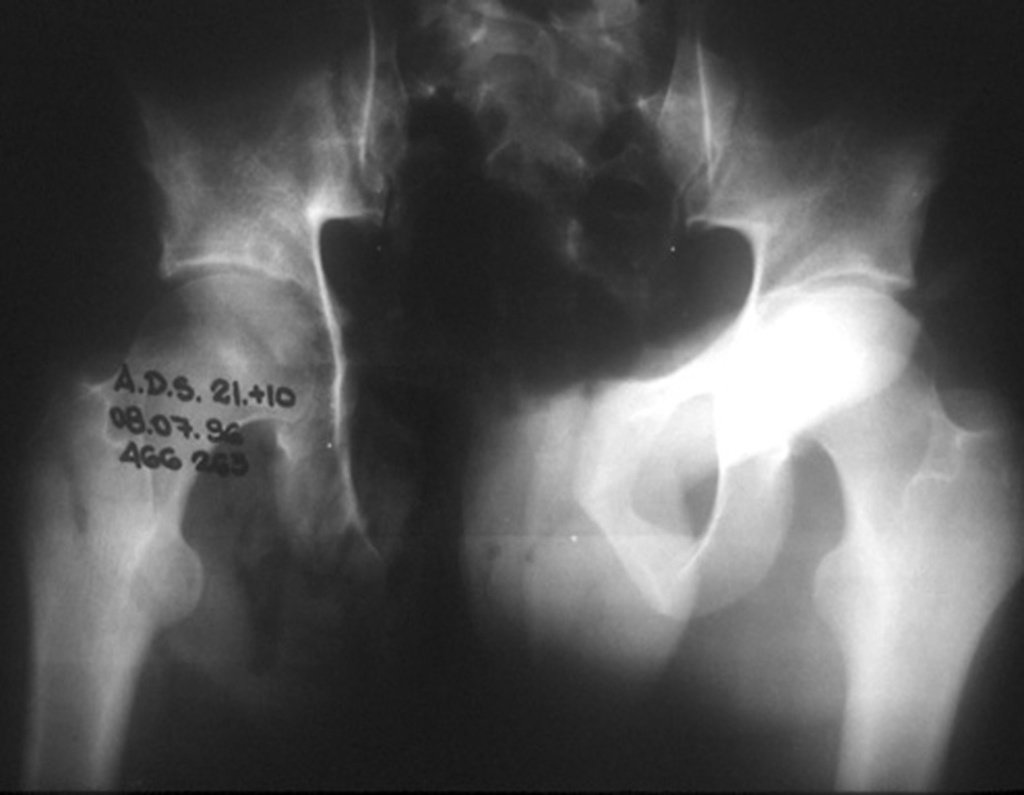
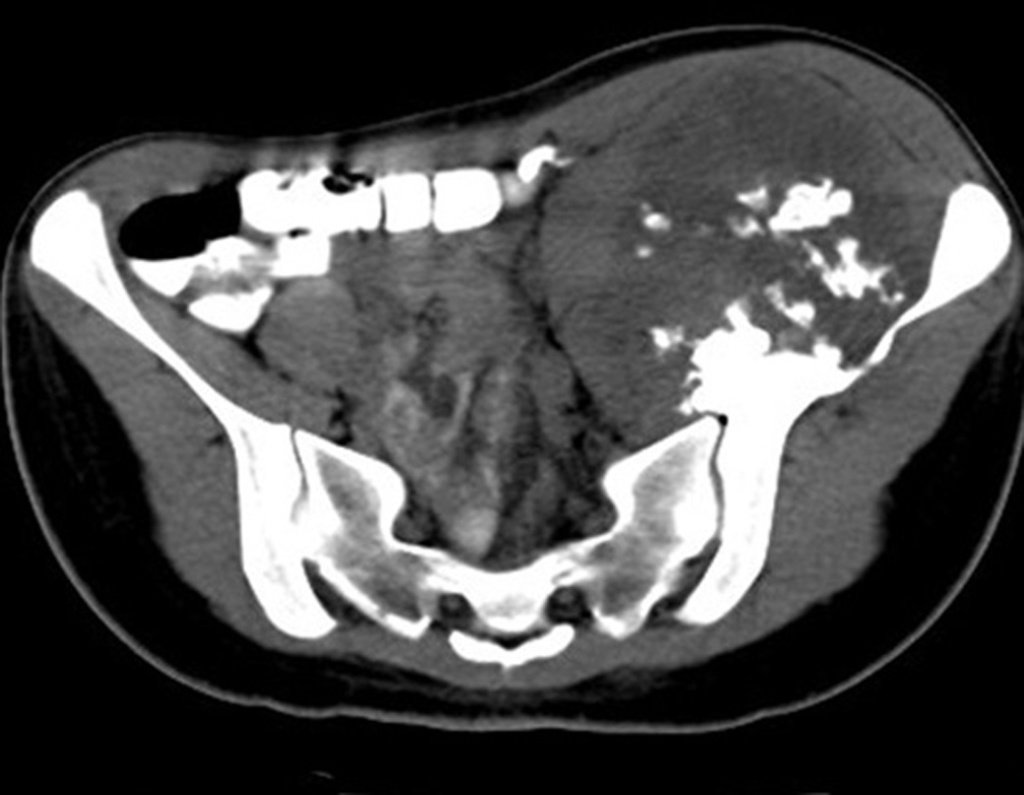
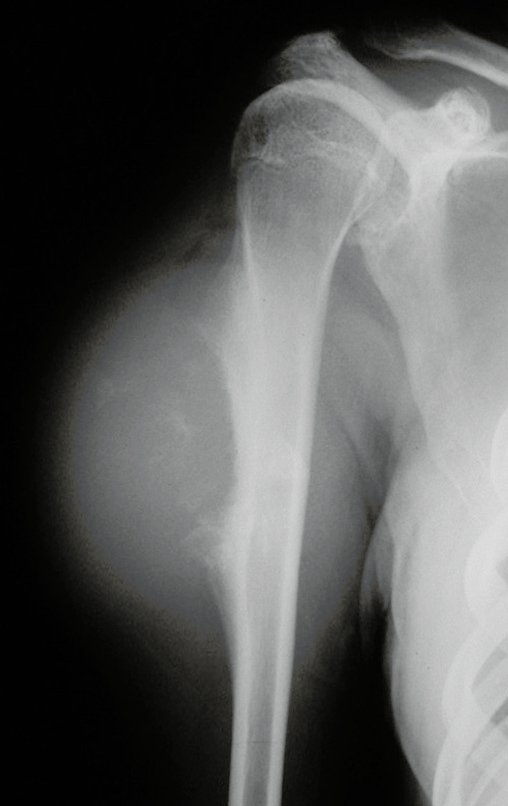
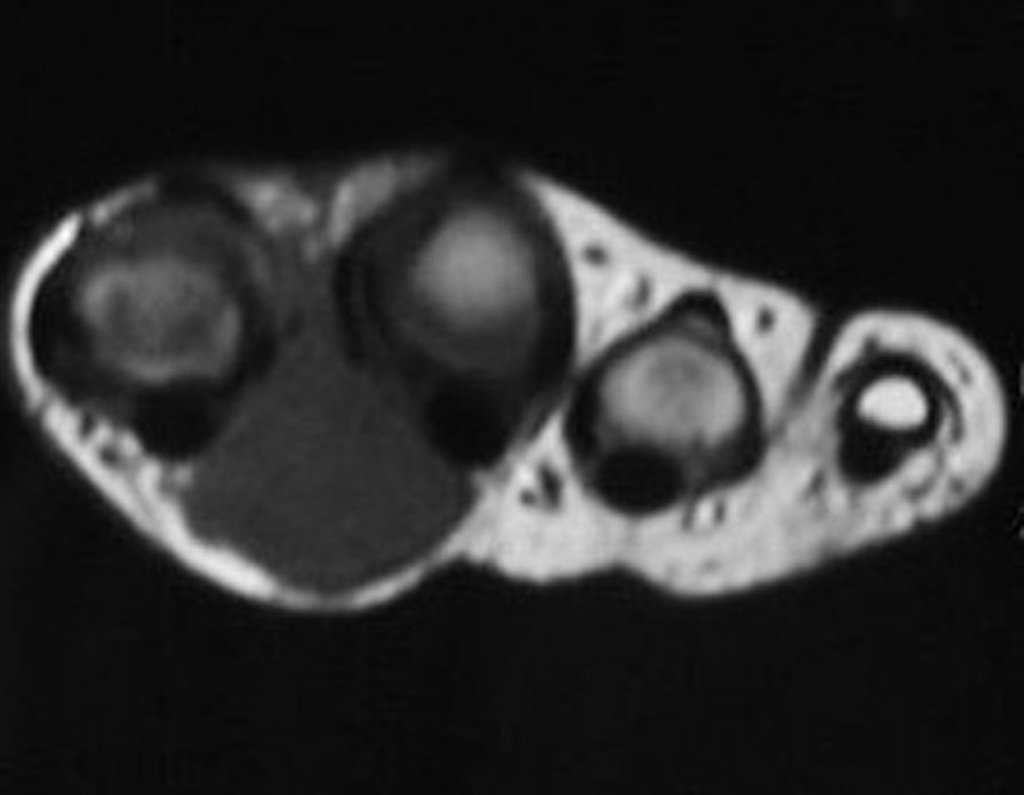
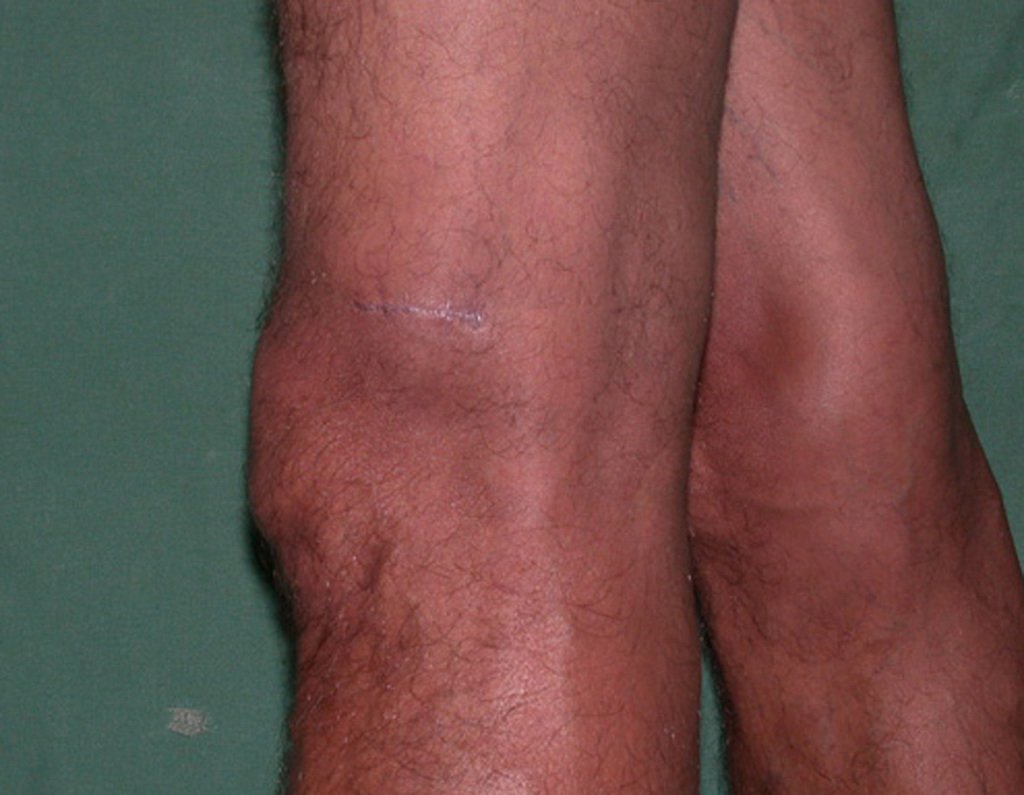
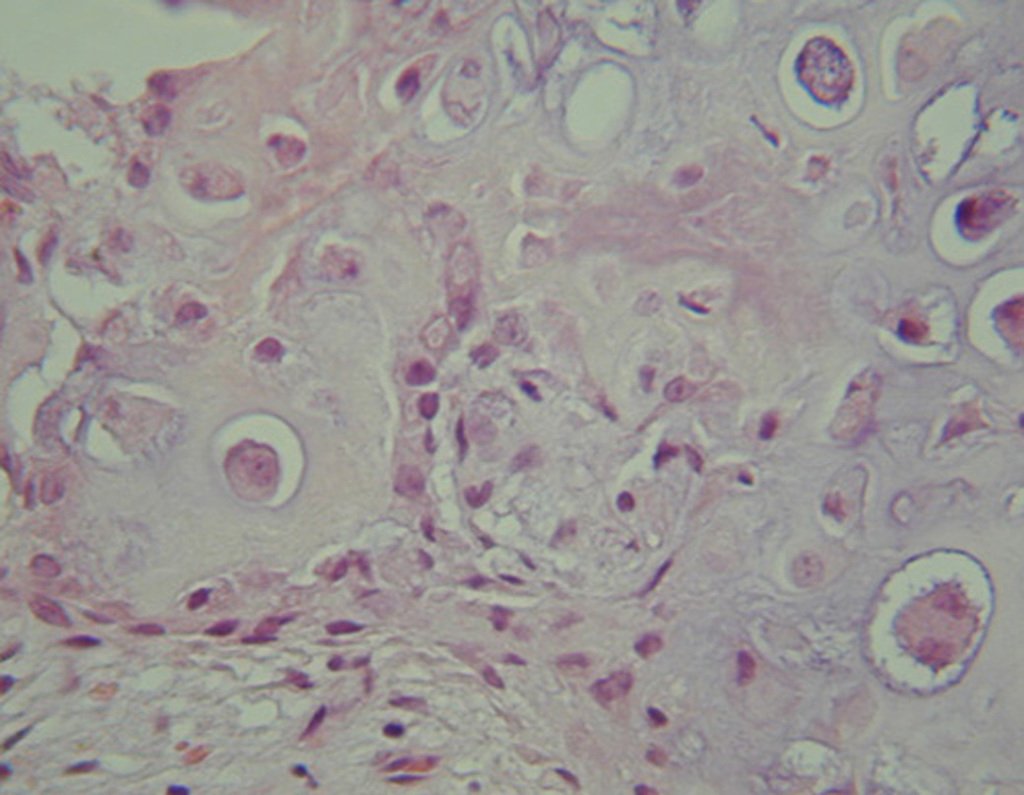
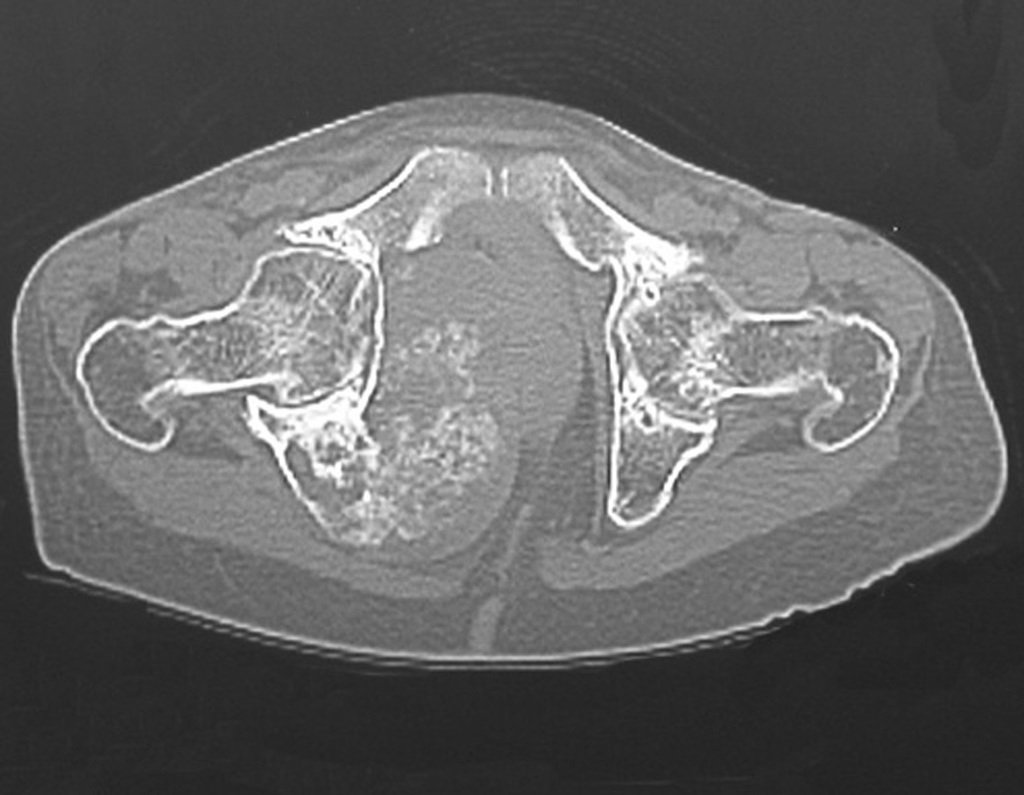
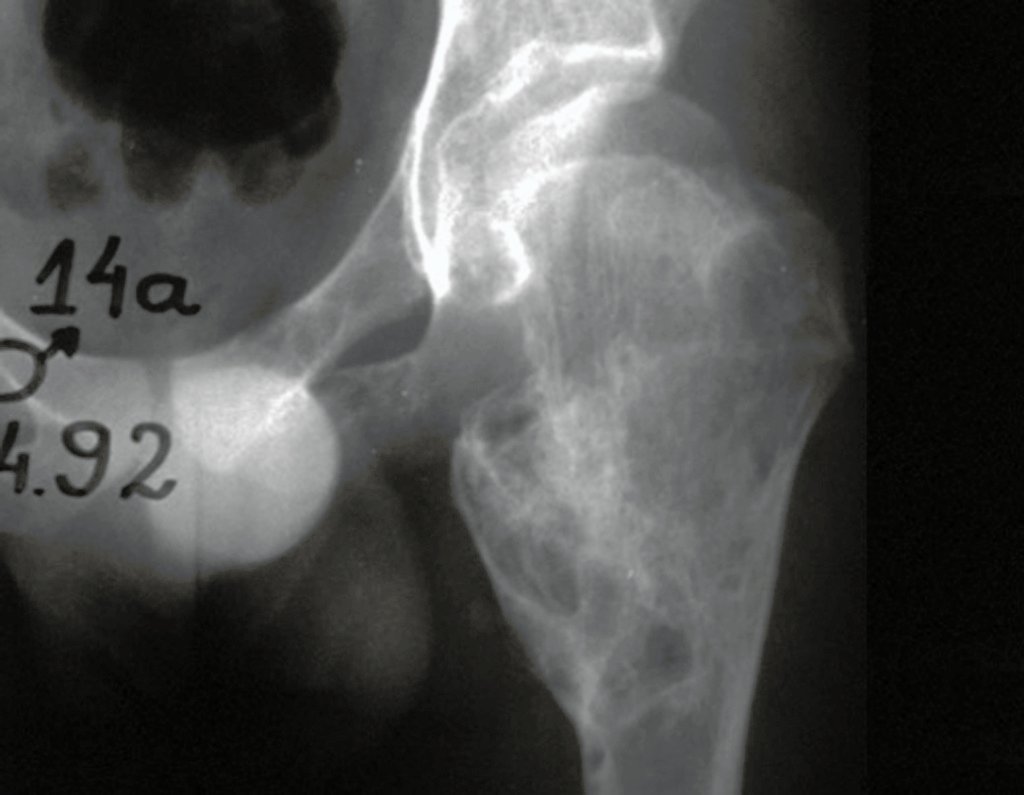
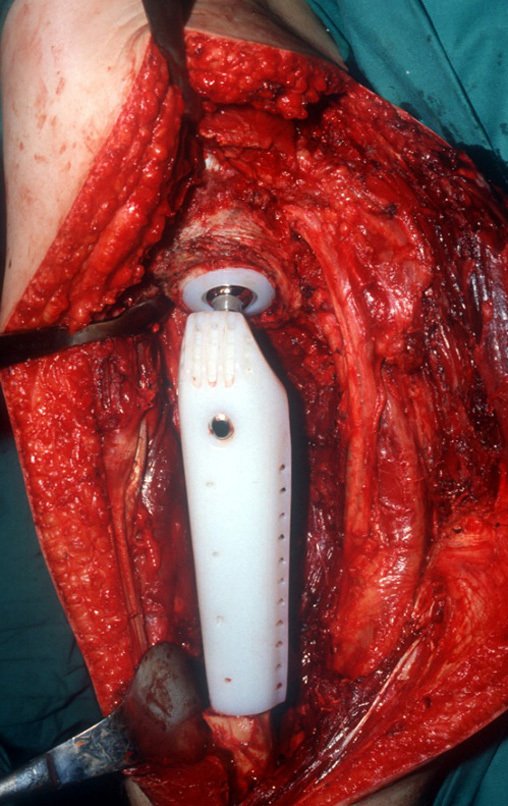
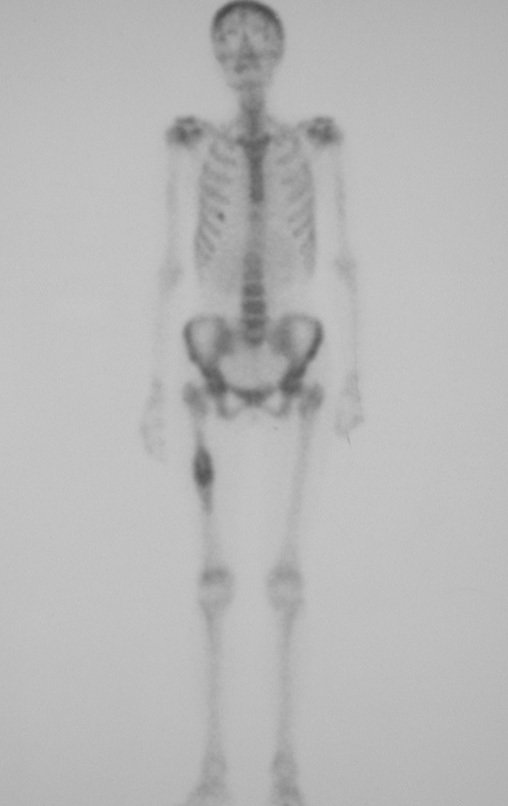
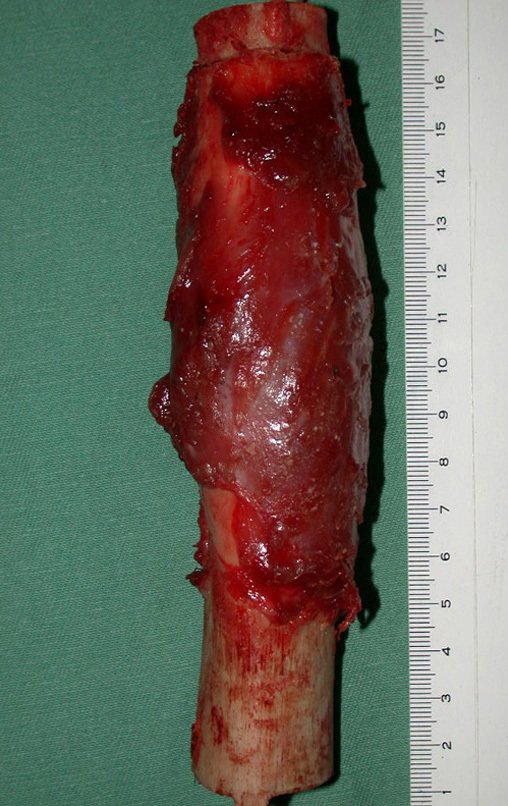
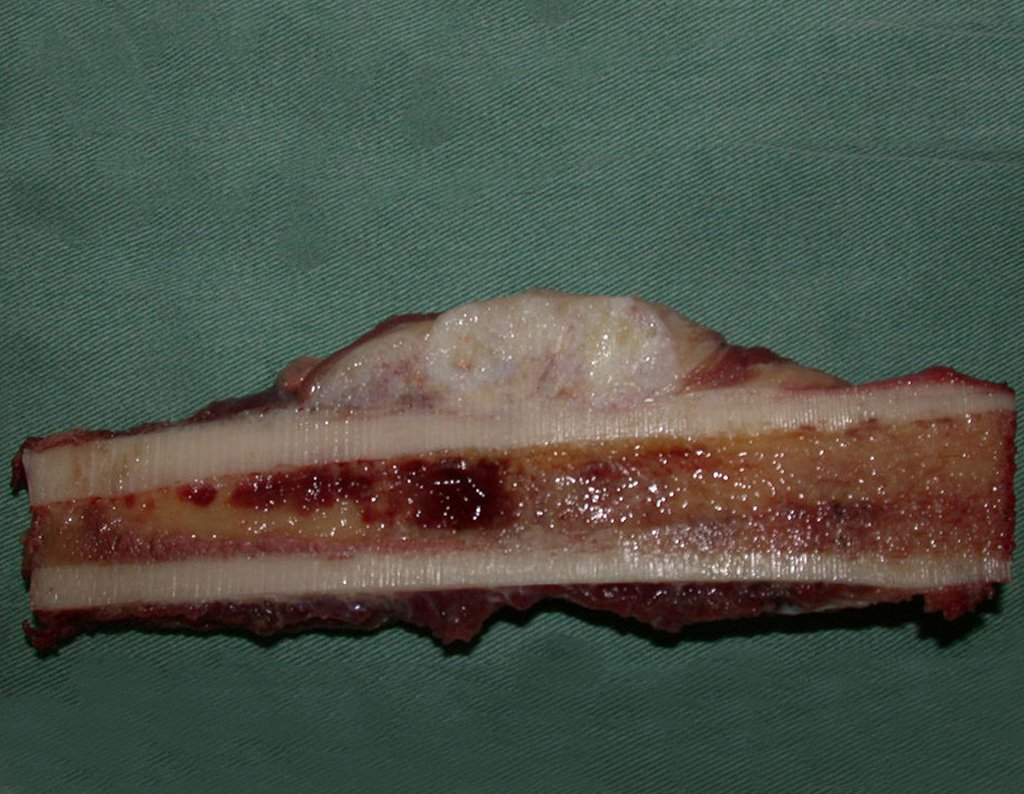
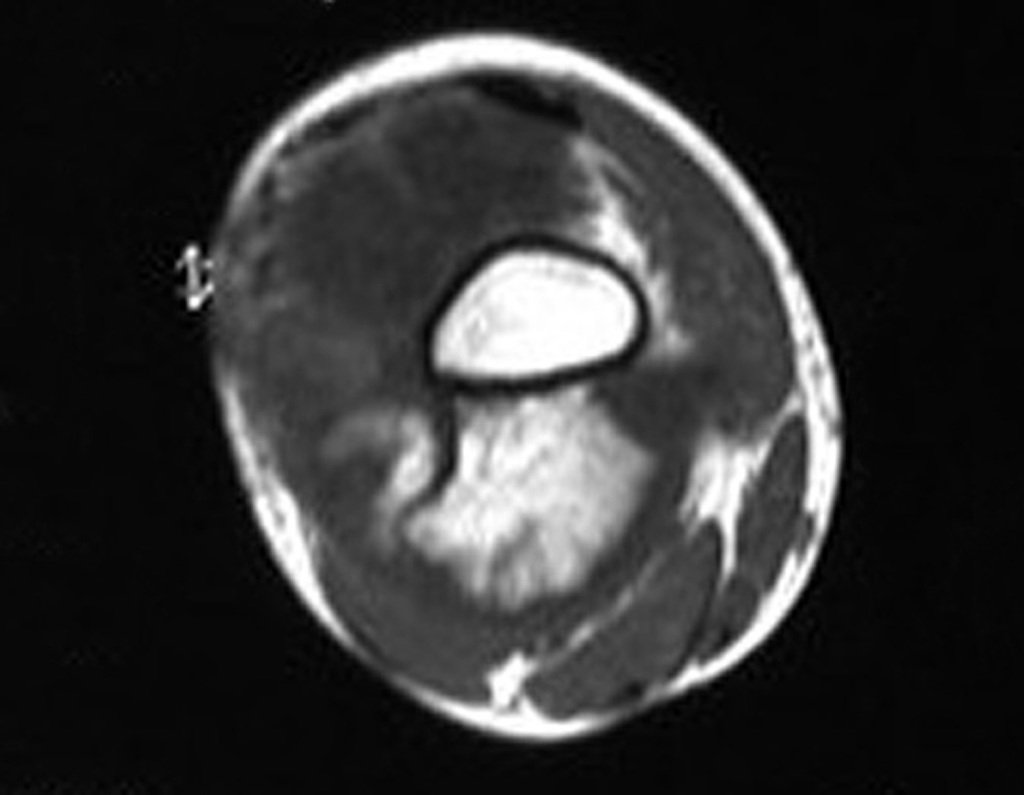
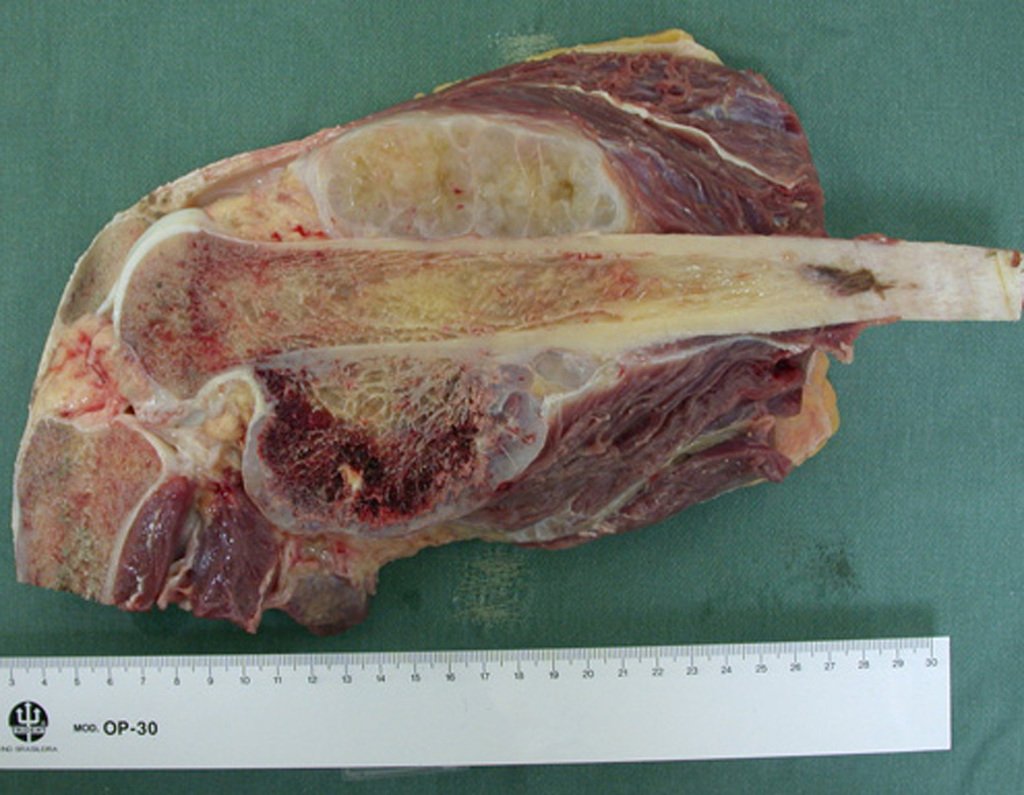
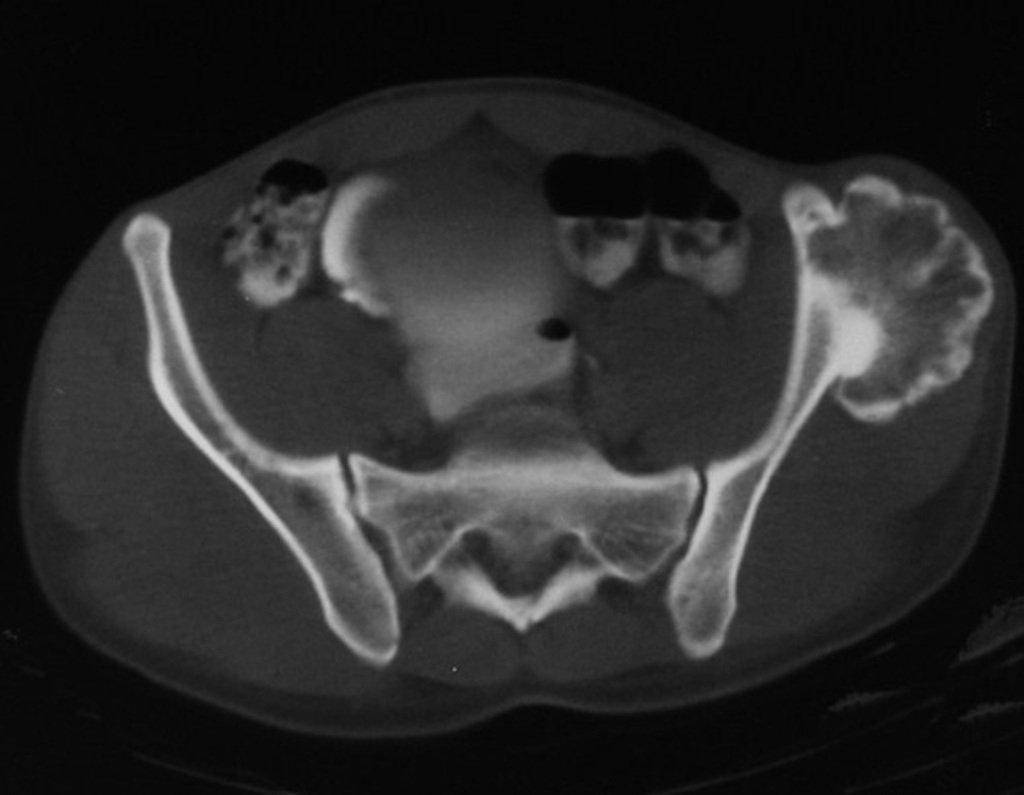
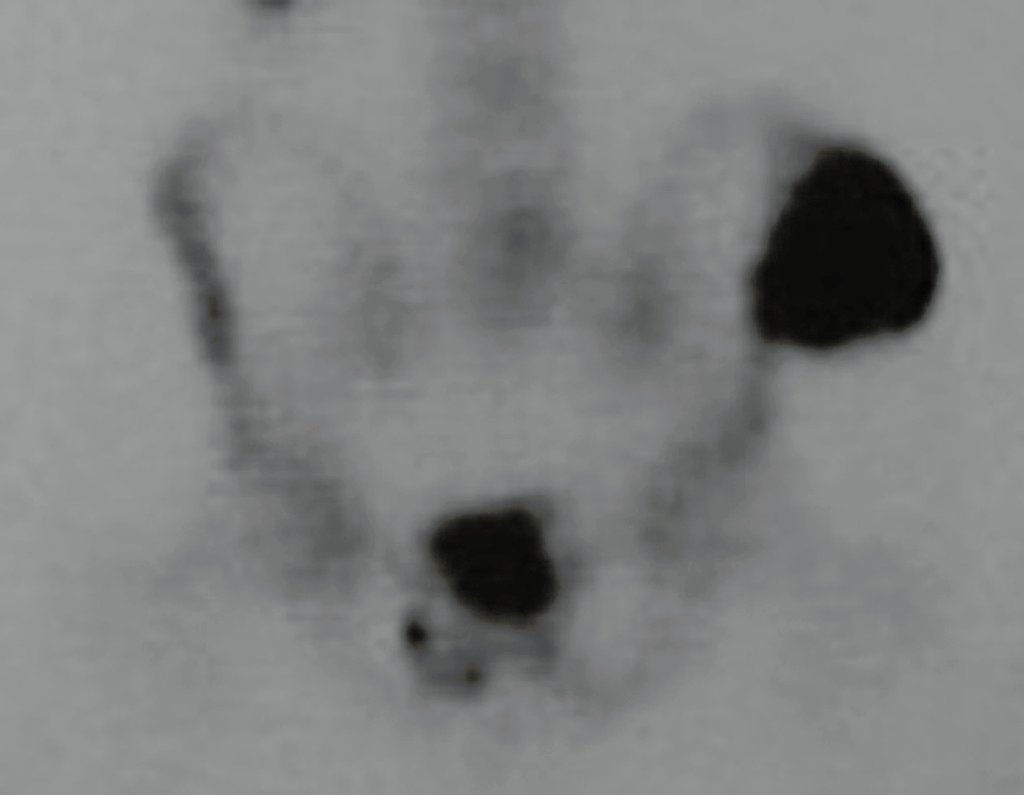
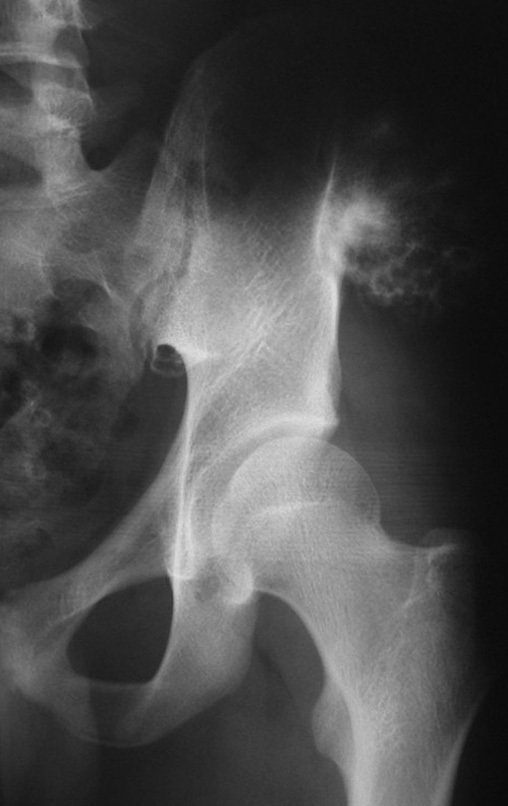
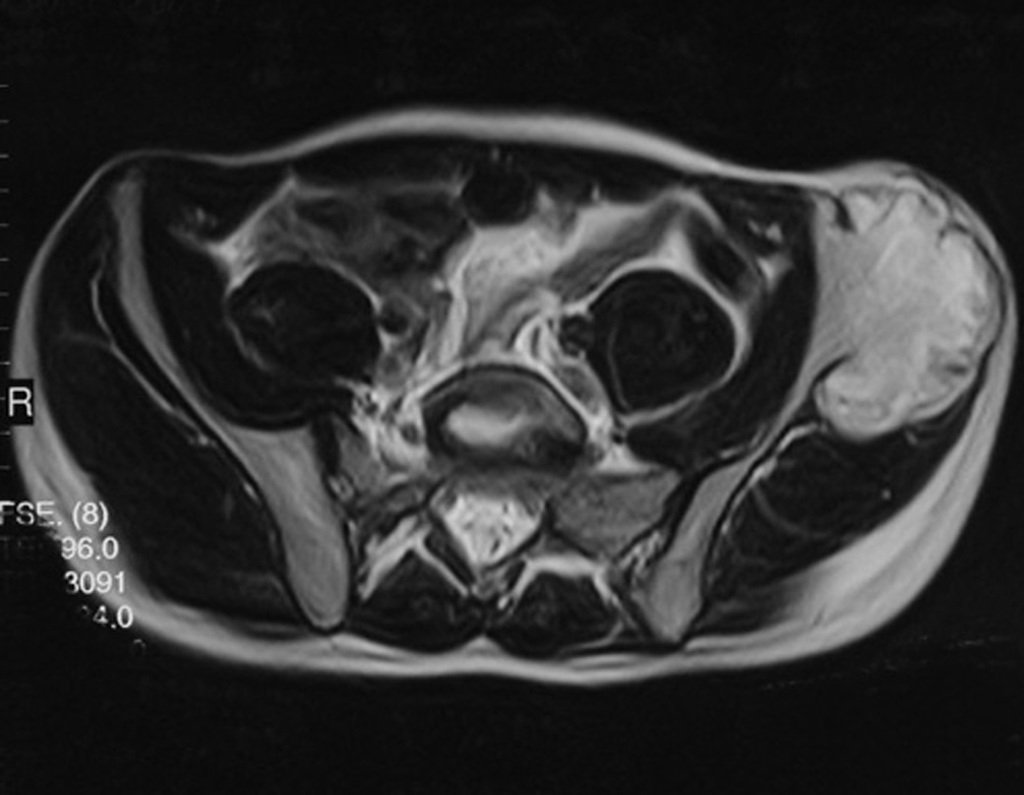
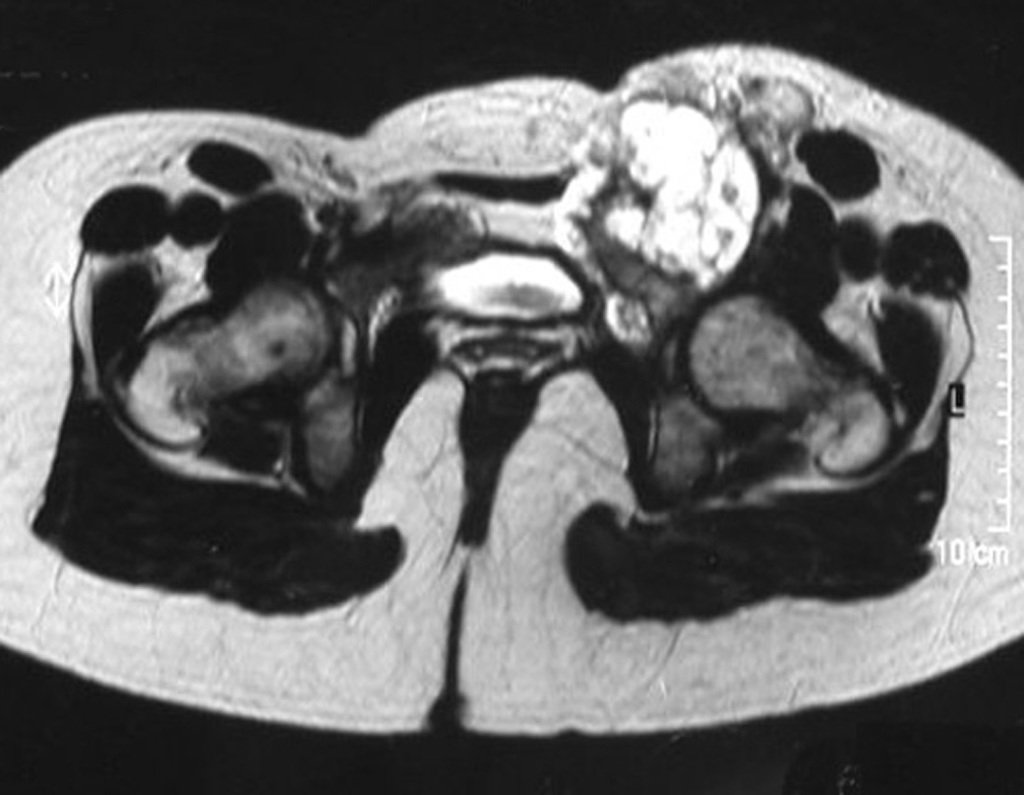
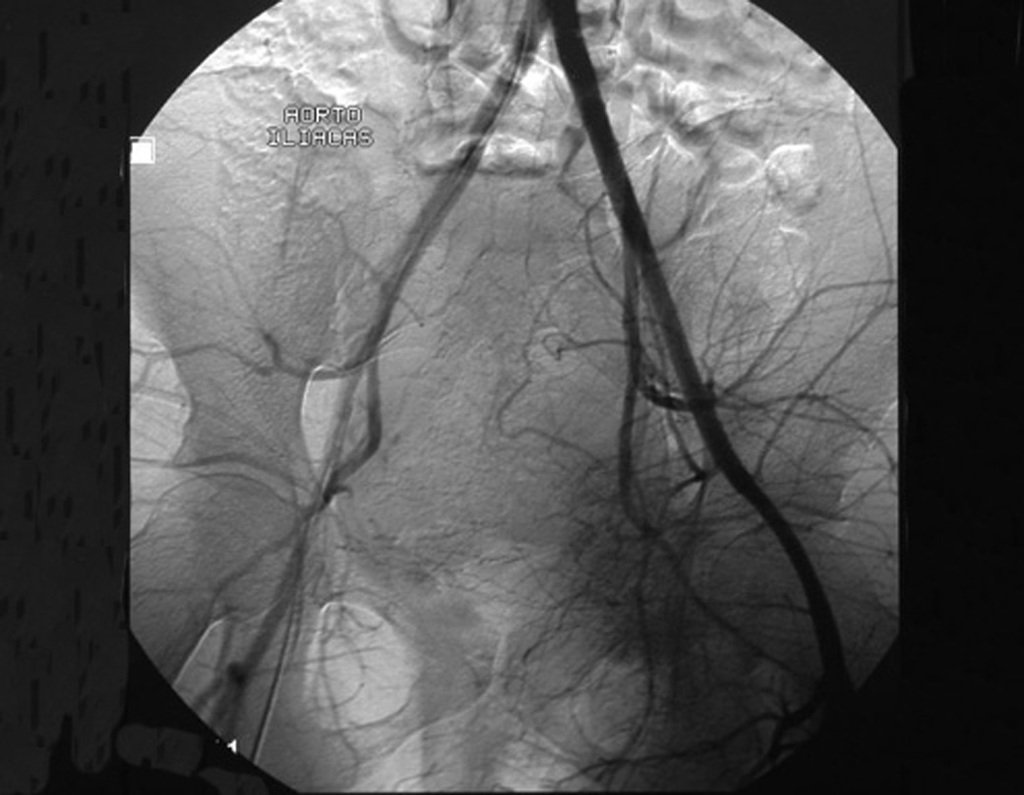
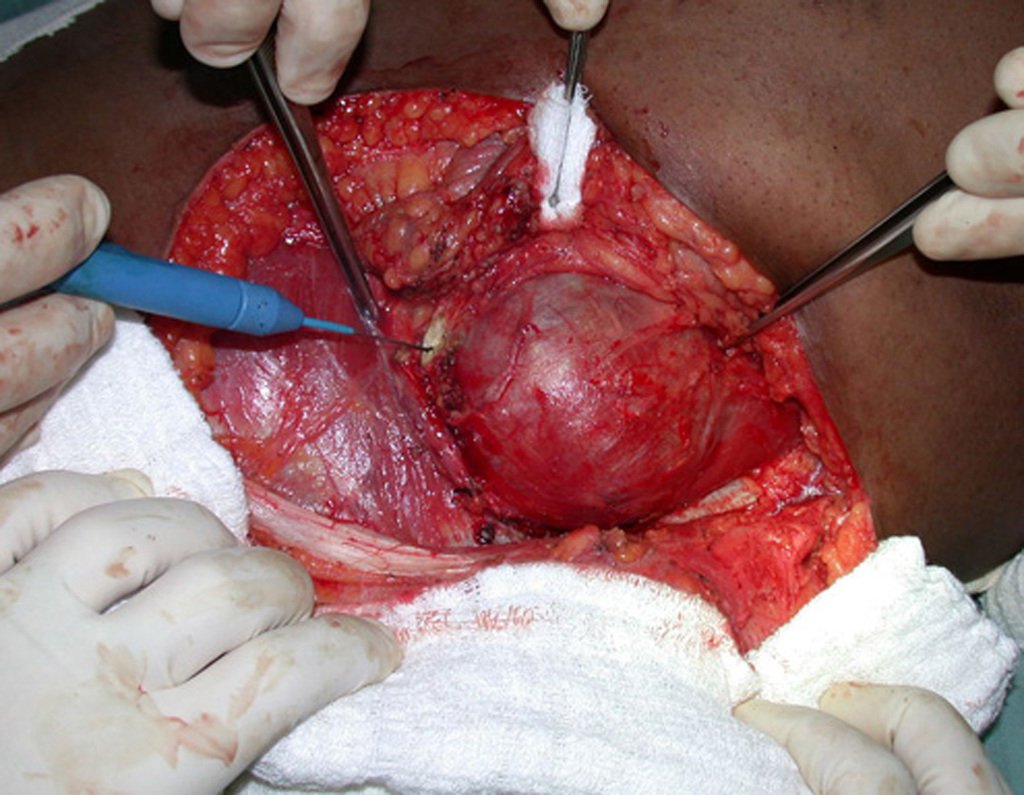
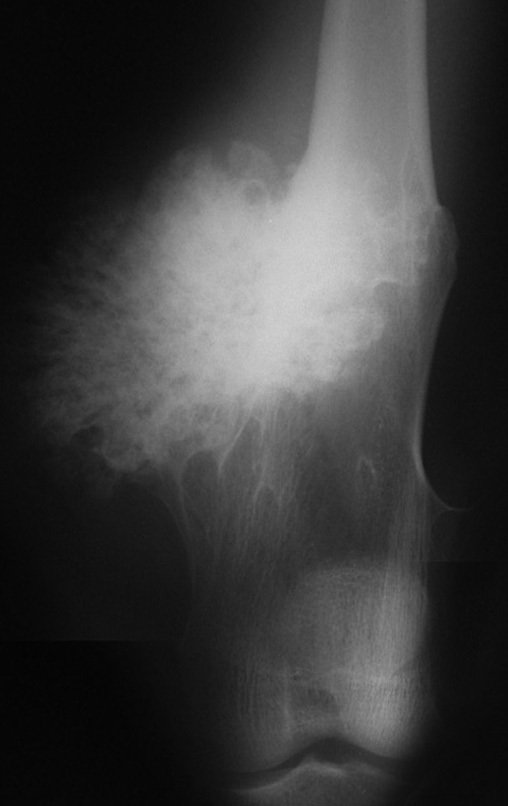
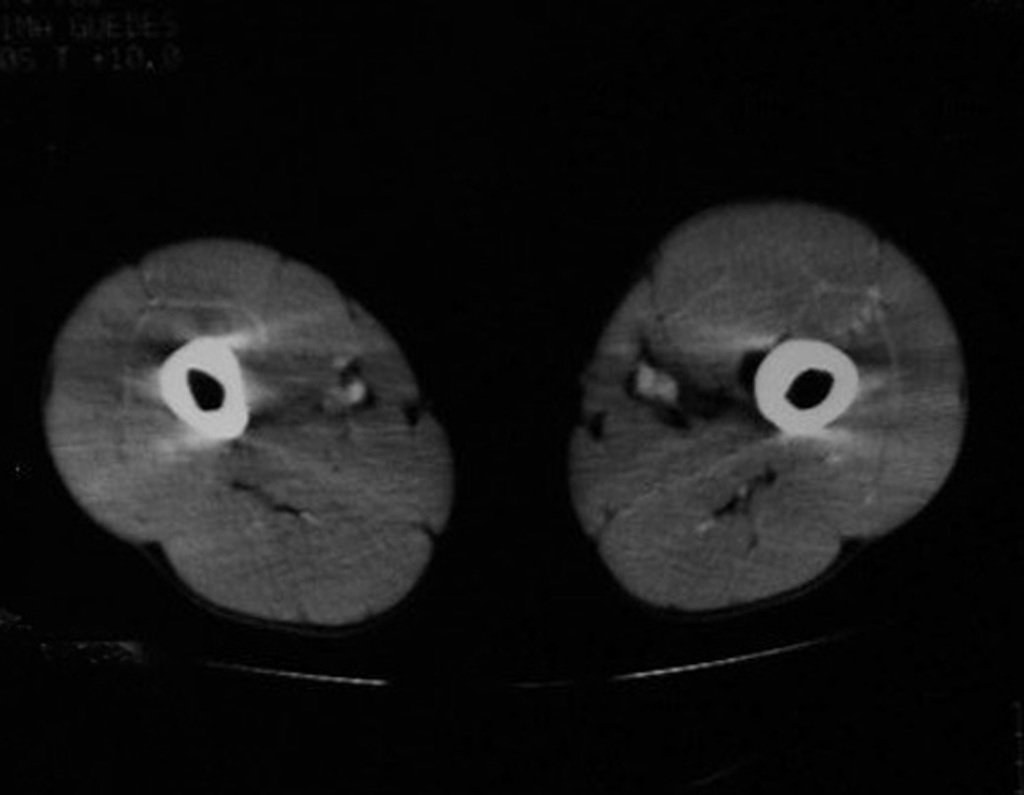
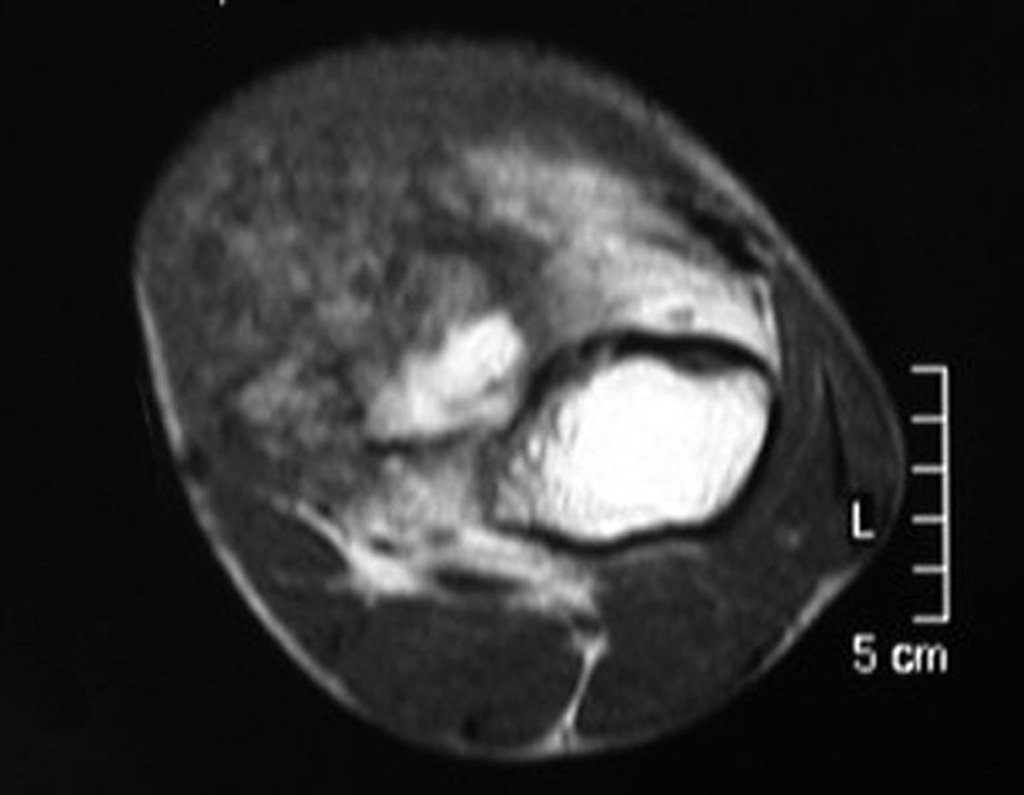
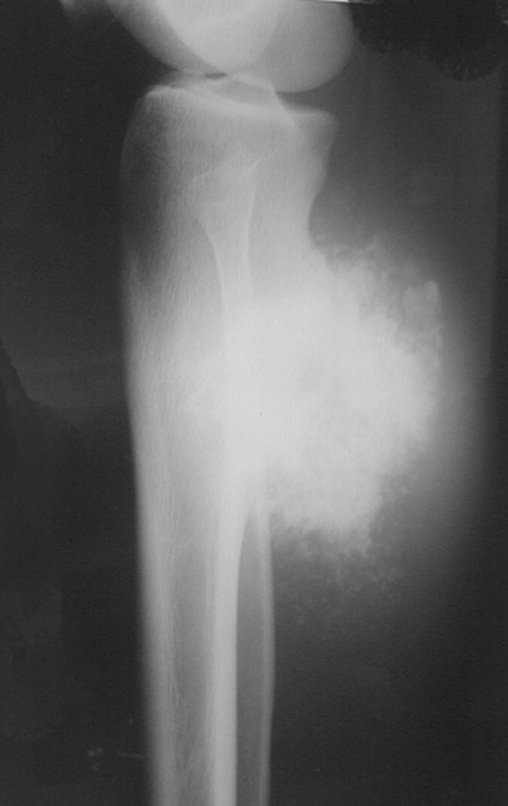
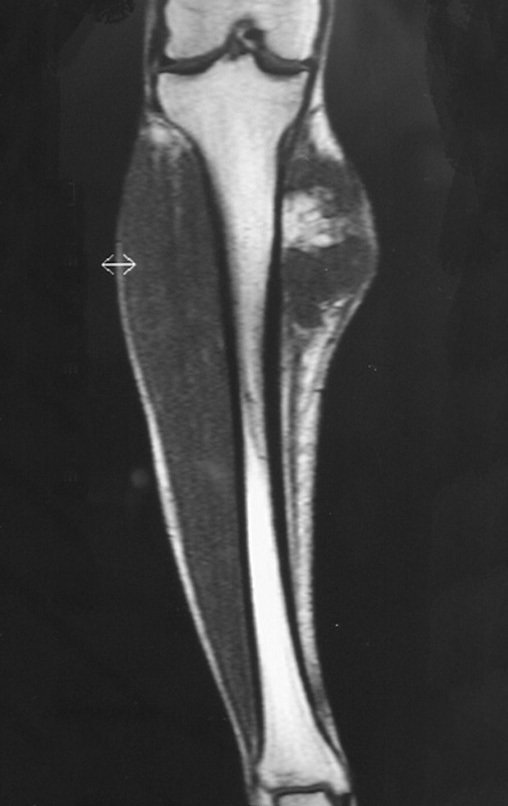
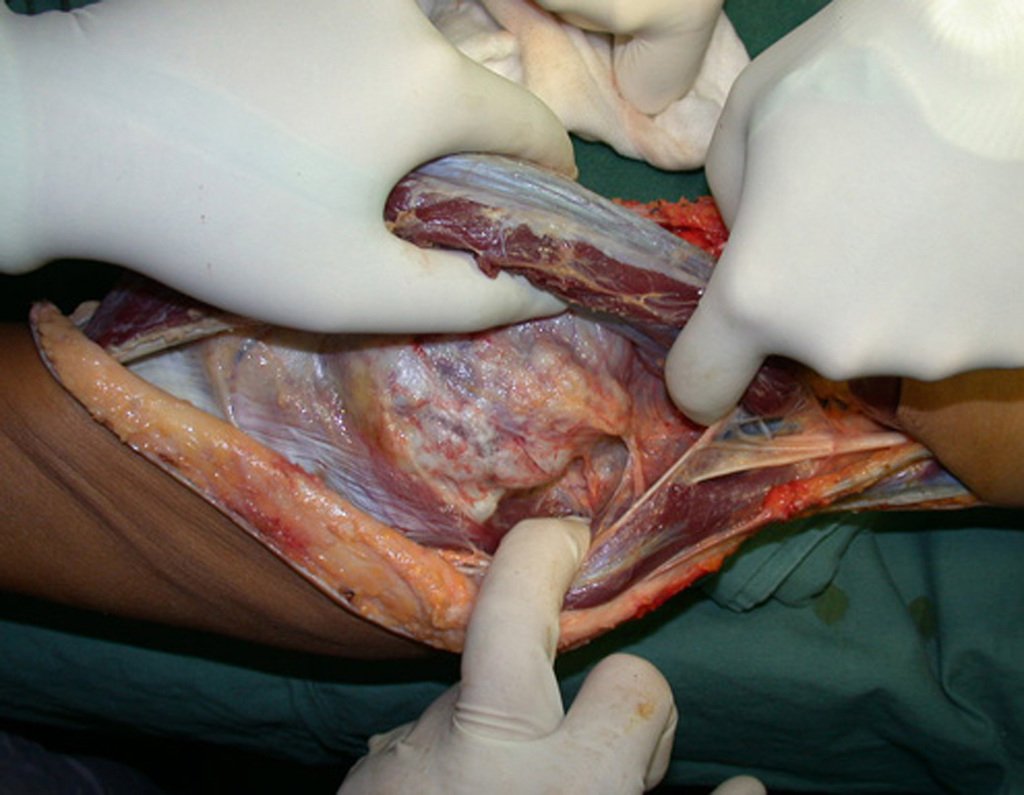
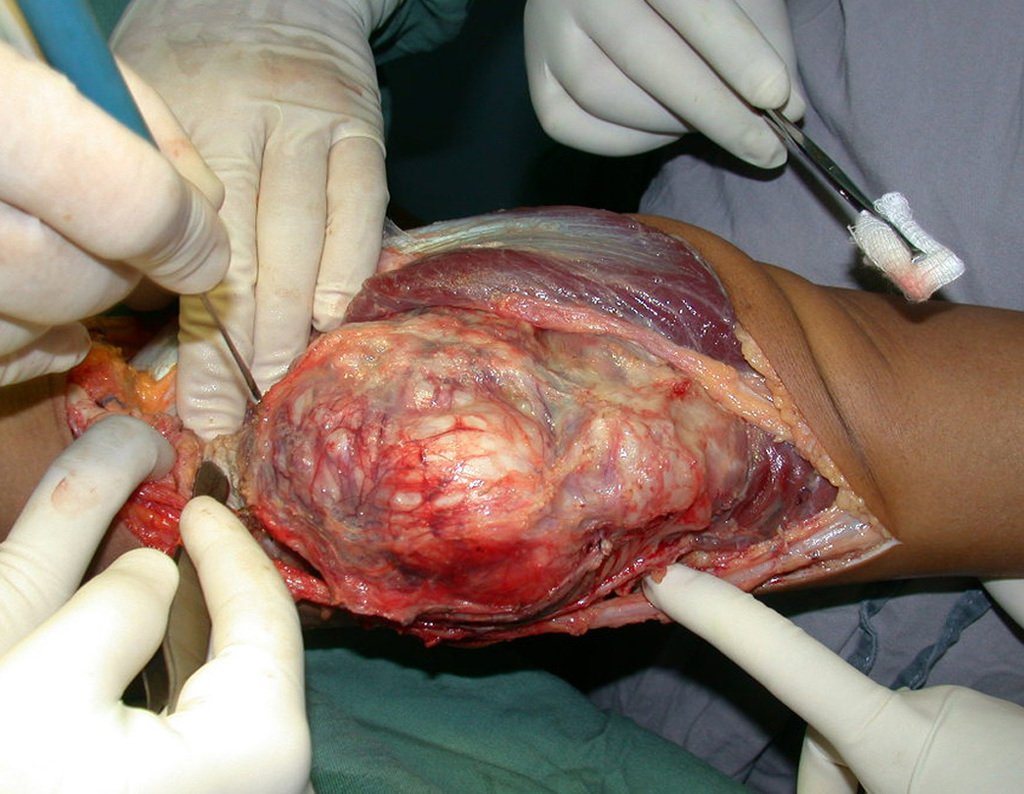
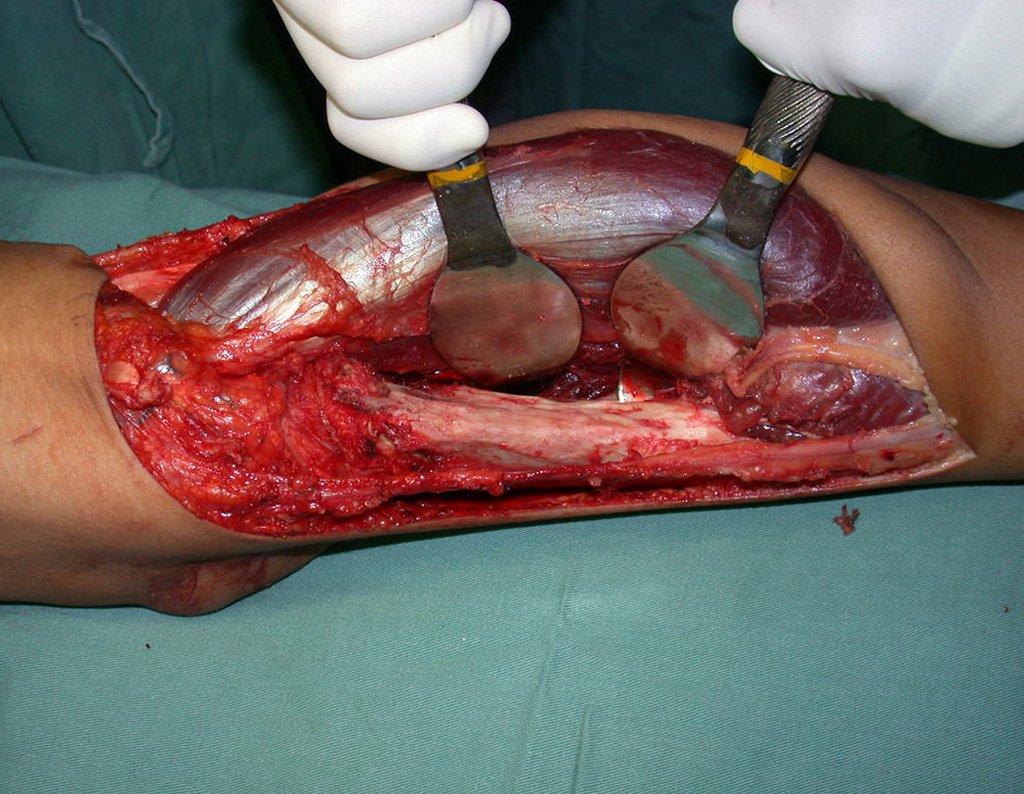
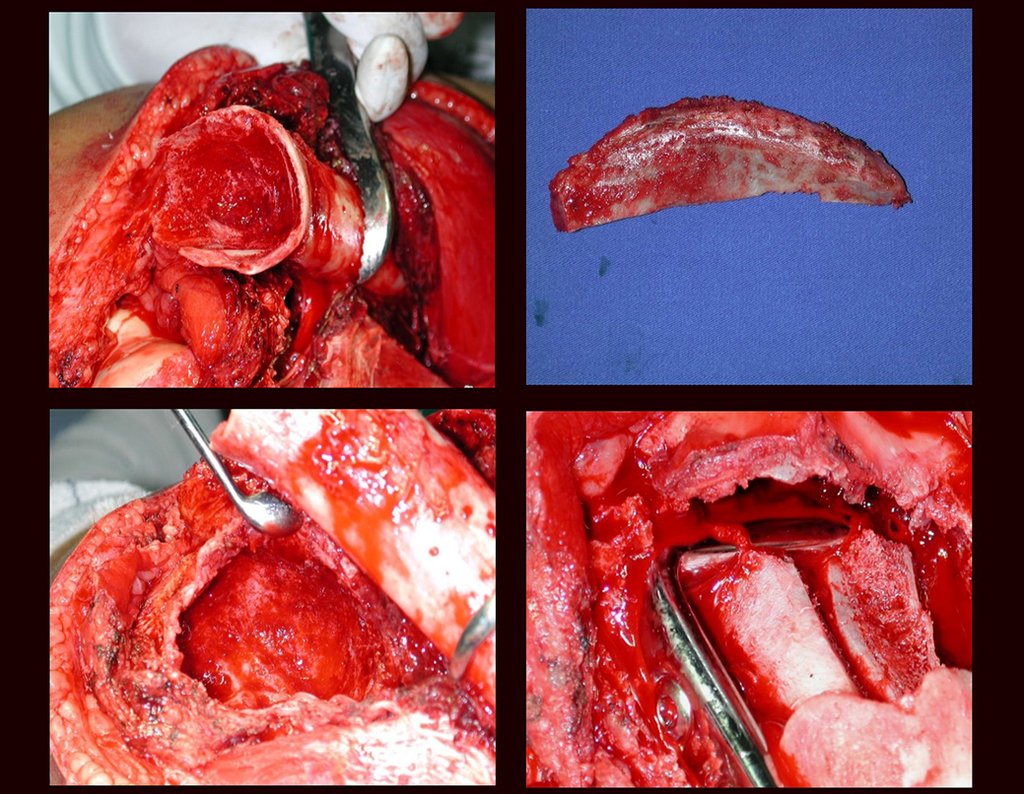
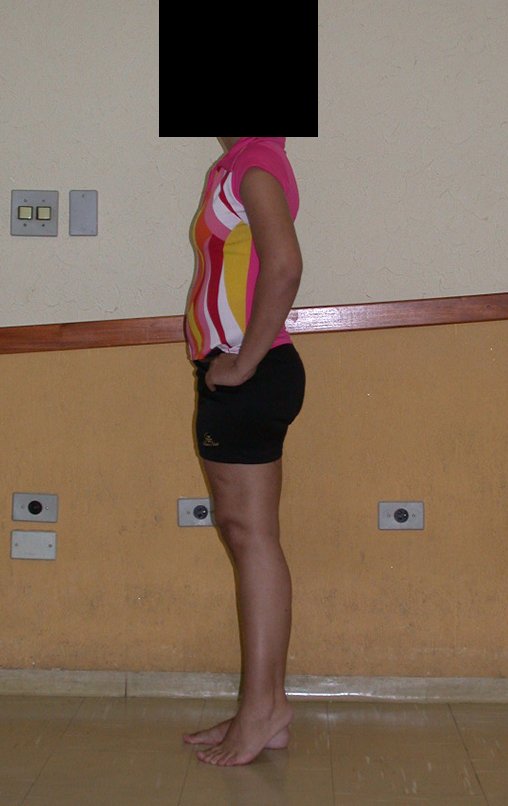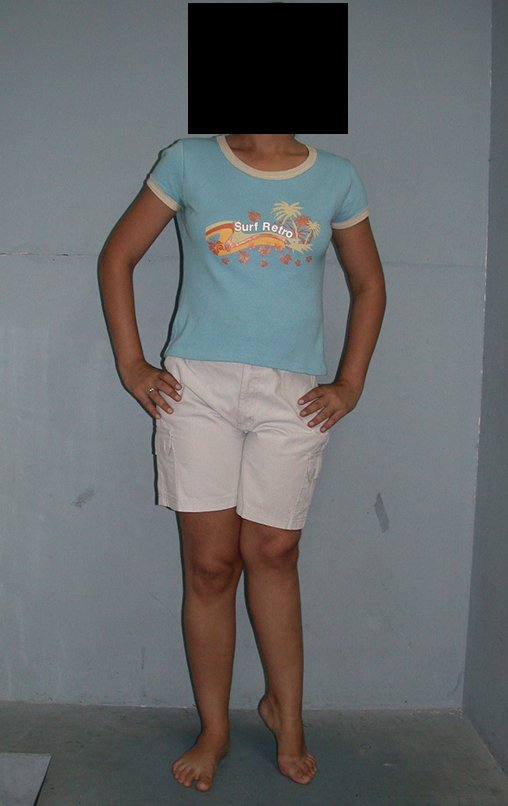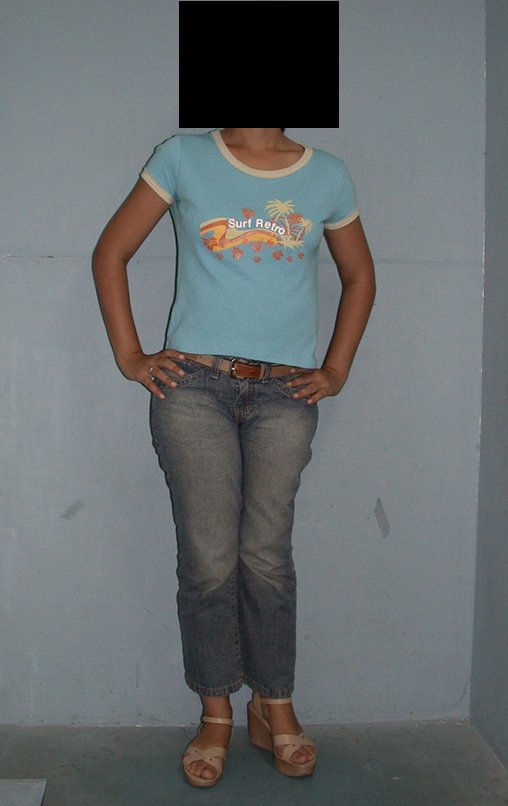03. Condrossarcoma da Pelve – Conduta – Técnica de pelvectomia interna total
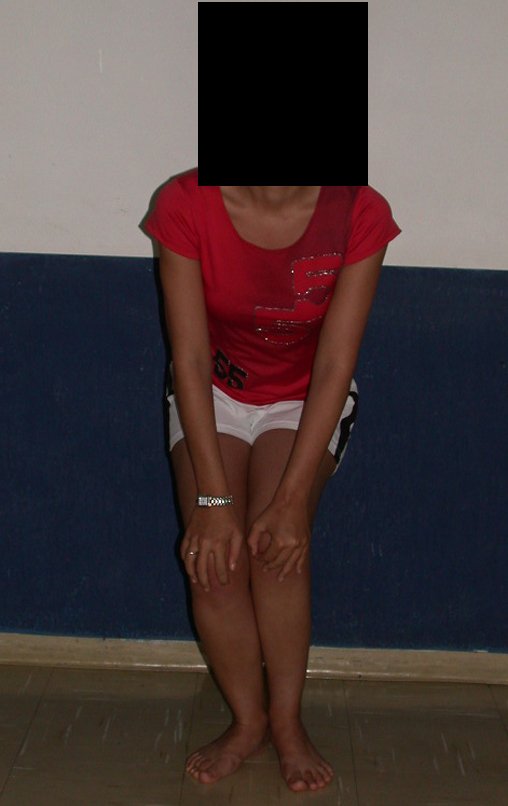
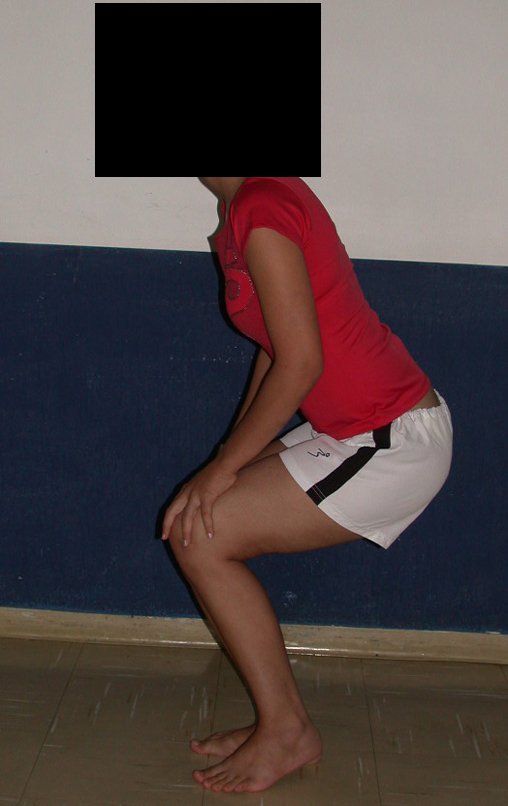
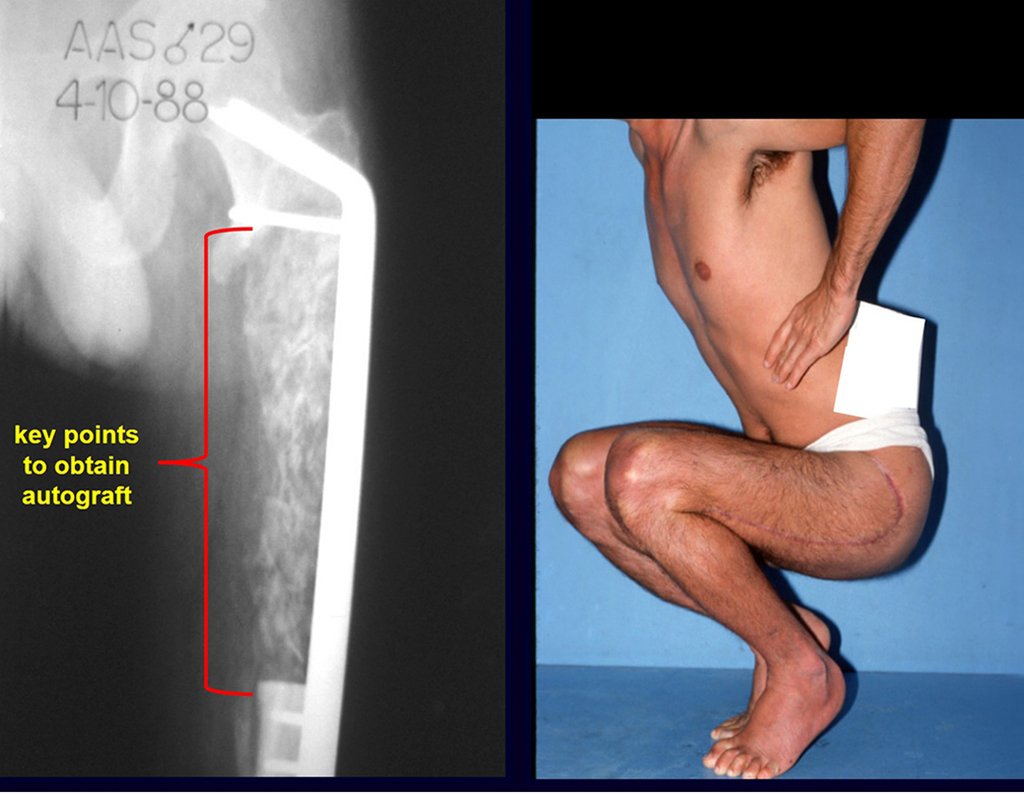
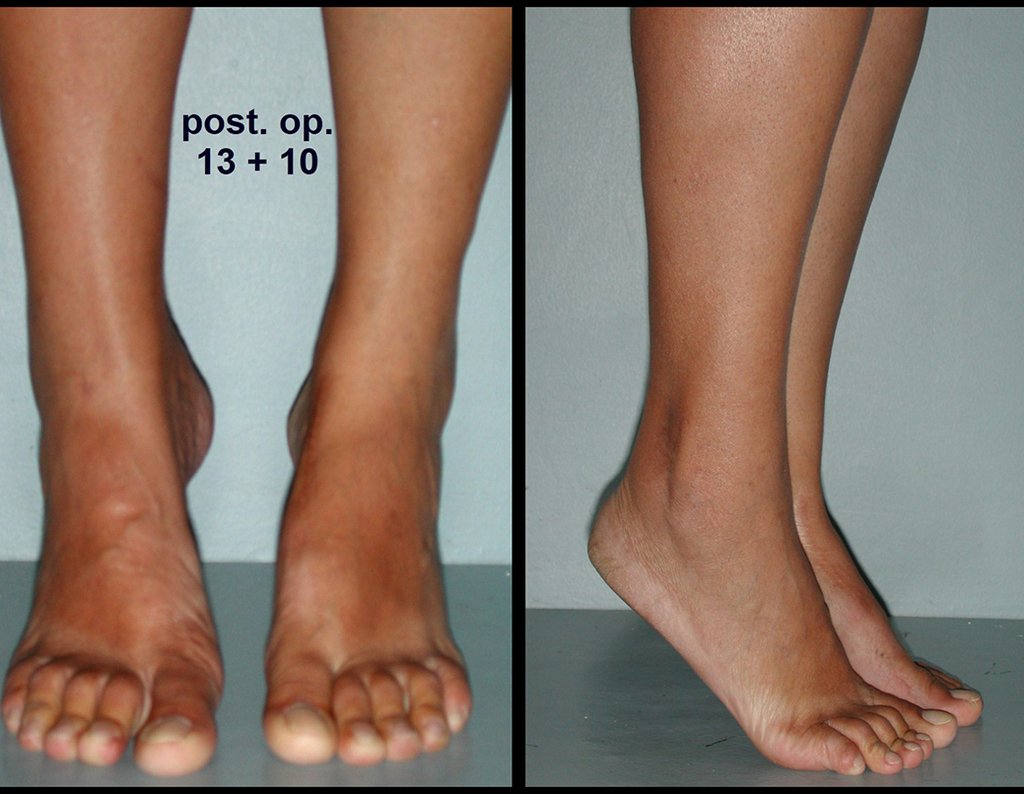
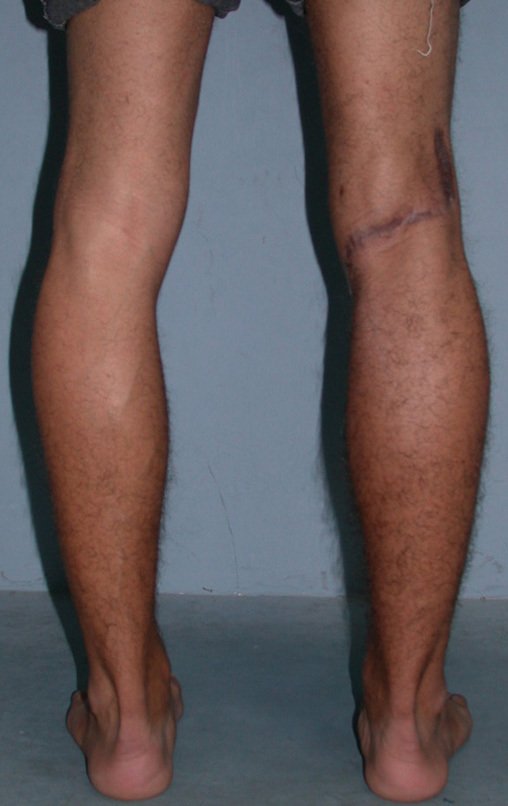
Vídeo 1 : Marcha con apoyo total en la extremidad operada, carga en una sola pierna con buen equilibrio, buena función de flexión de caderas y rodillas con carga. Excelente resultado funcional de una hemipelvectomía interna total, sin reconstrucción, a 12 años y tres meses de la cirugía.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
El injerto óseo autólogo se utiliza en diversas situaciones en ortopedia, traumatología y principalmente en reconstrucciones de cirugías ortopédicas oncológicas.
En los defectos óseos, sin duda es lo que promueve la mejor y más rápida consolidación ósea, tiene la mejor integración y la más rápida remodelación.
En segundo lugar, podemos recurrir al injerto óseo homólogo, hueso procedente de banco de tejidos, obtenido de cadáver, que tiene el inconveniente de la antigenicidad, tiene mayor tasa de infección, tarda más en incorporarse y puede producirse fragilidad estructural en el proceso de integración. Por último, podemos mencionar los productos liofilizados artificiales, que pretenden ser osteoinductivos.
Nuestro objetivo es dar a conocer la técnica que utilizamos para obtener la mayor cantidad de injerto óseo con la menor morbilidad.
Creemos que, siempre que sea posible utilizar el injerto autólogo, estaremos brindando la alternativa que permita el mejor resultado.
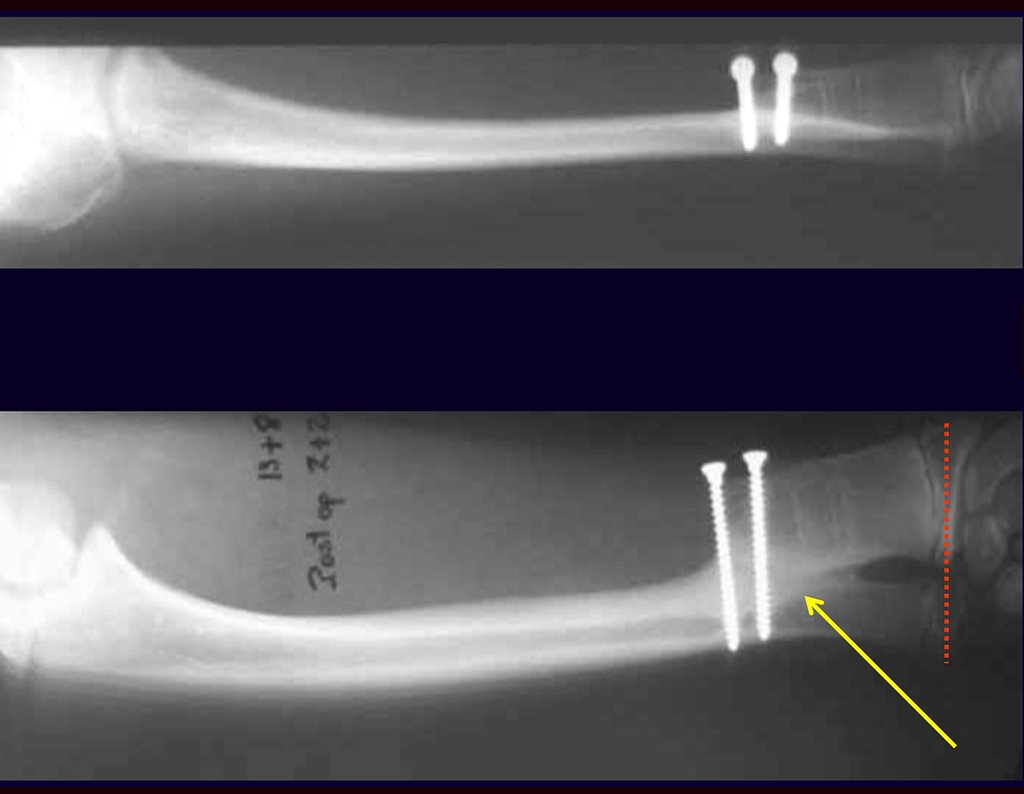
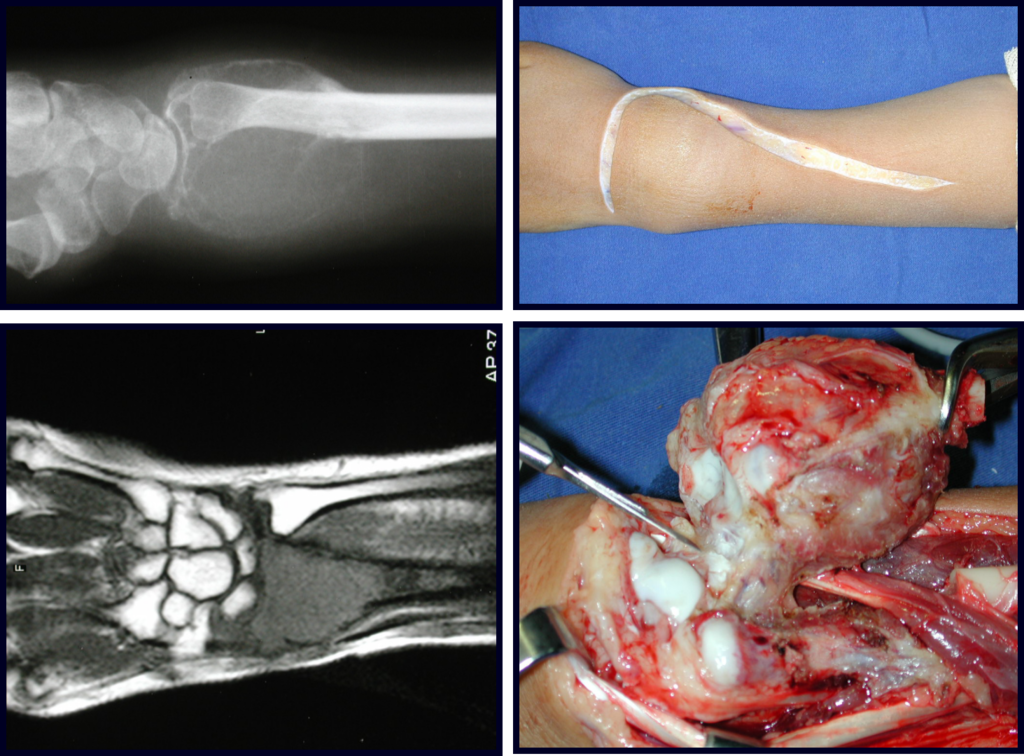
Cuando necesitamos una pequeña cantidad de injerto no cuestionamos mucho su indicación. A modo de ejemplo, en el caso de la necesidad de resecar los 3/4 proximales del radio, debido a una lesión tumoral, que pretendemos resolver realizando una “sinostosis” radiocubital distal, figuras 1 a 4.
01. Injerto óseo autólogo – Técnicas de obtención
Cuando necesitamos Reconstrucción con apertura de la sindesmosis radiocubital distal, interposición de un injerto óseo autólogo y fijación con dos tornillos Inter fragmentarios, figura 2.
Tres años después de realizar la sinostosis radiocubital distal, podemos verificar la consolidación, la integración total del injerto y observar que las fases de radio y cúbito continúan con crecimiento simétrico, con buena función, figuras 3 y 4.
La necesidad de obtener injertos en cantidad, para viabilizar grandes reconstrucciones biológicas, nos hizo mejorar la técnica quirúrgica para obtener injertos autólogos con menor morbilidad y en cantidades significativamente mayores.
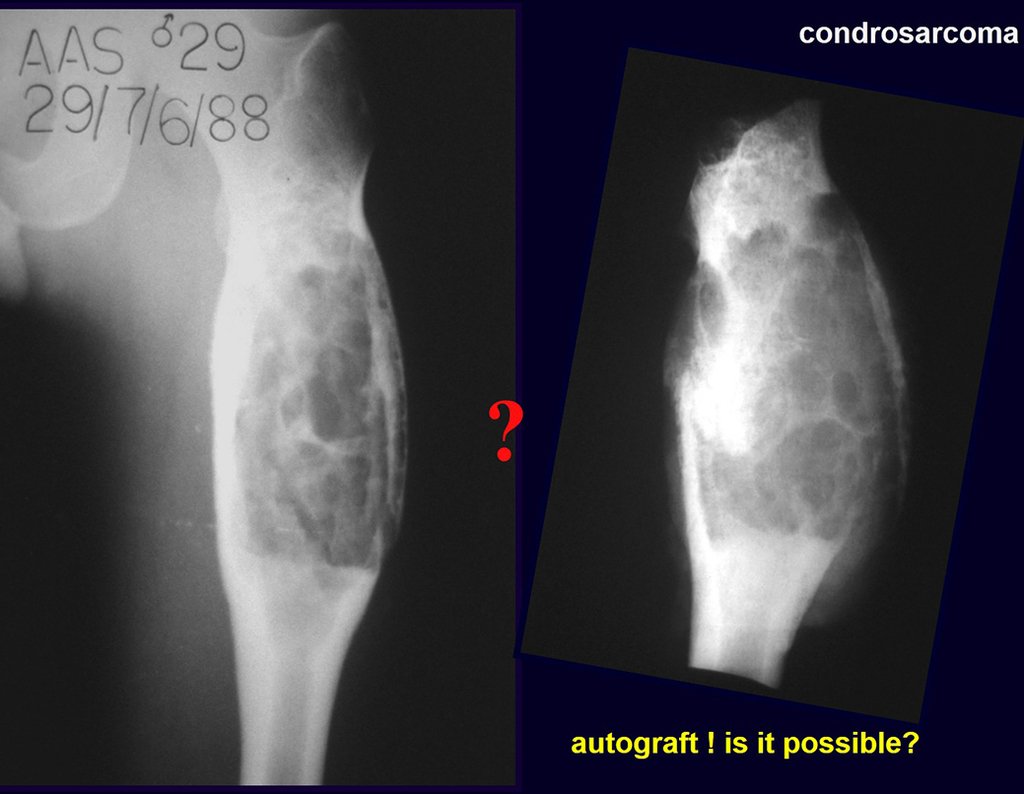
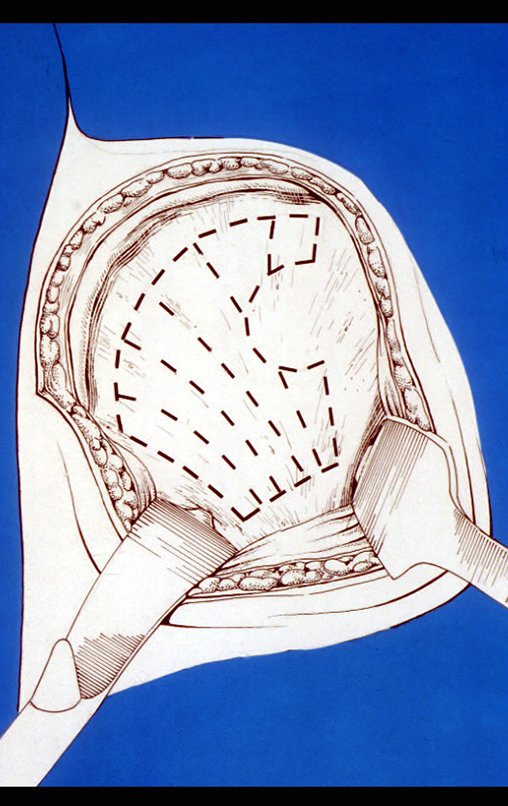
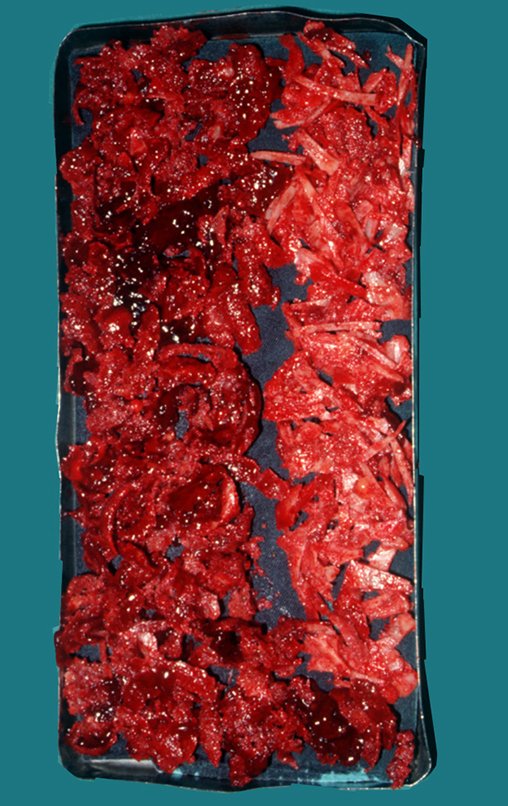
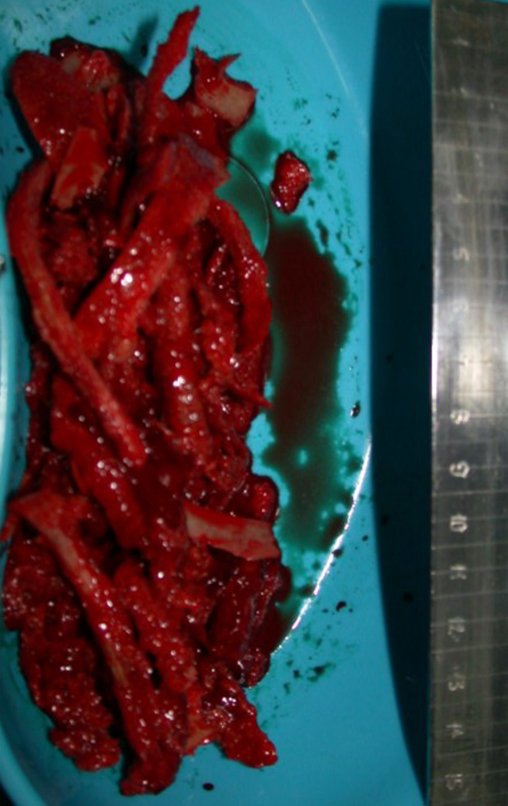
¿Es posible obtener un injerto óseo autólogo para rellenar un defecto óseo grande, de una sola placa interna de la ilíaca, como el de la figura 7? Demostremos que sí es posible, figura 8.
El injerto obtenido debe aplicarse en la reconstrucción para evitar la formación de líneas de pseudoartrosis, lo cual se explicará más adelante.
Los puntos clave y la técnica para obtener un buen injerto de hueso ilíaco se describen en
figuras. La incisión debe ser superficial, únicamente en la piel y tejido subcutáneo, para no dañar el nervio sensitivo cutáneo femoral lateral. Antes de proceder a la disección cauterizamos cuidadosamente los vasos subcutáneos con electrocauterio. figuras 9 y 10.
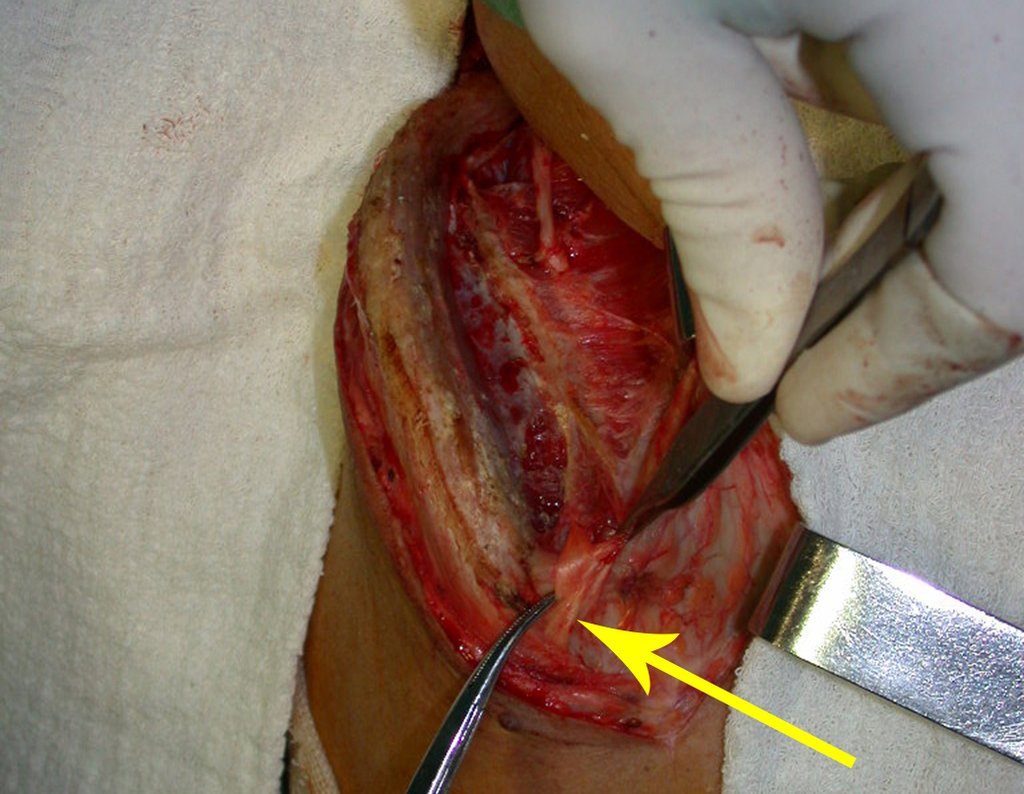
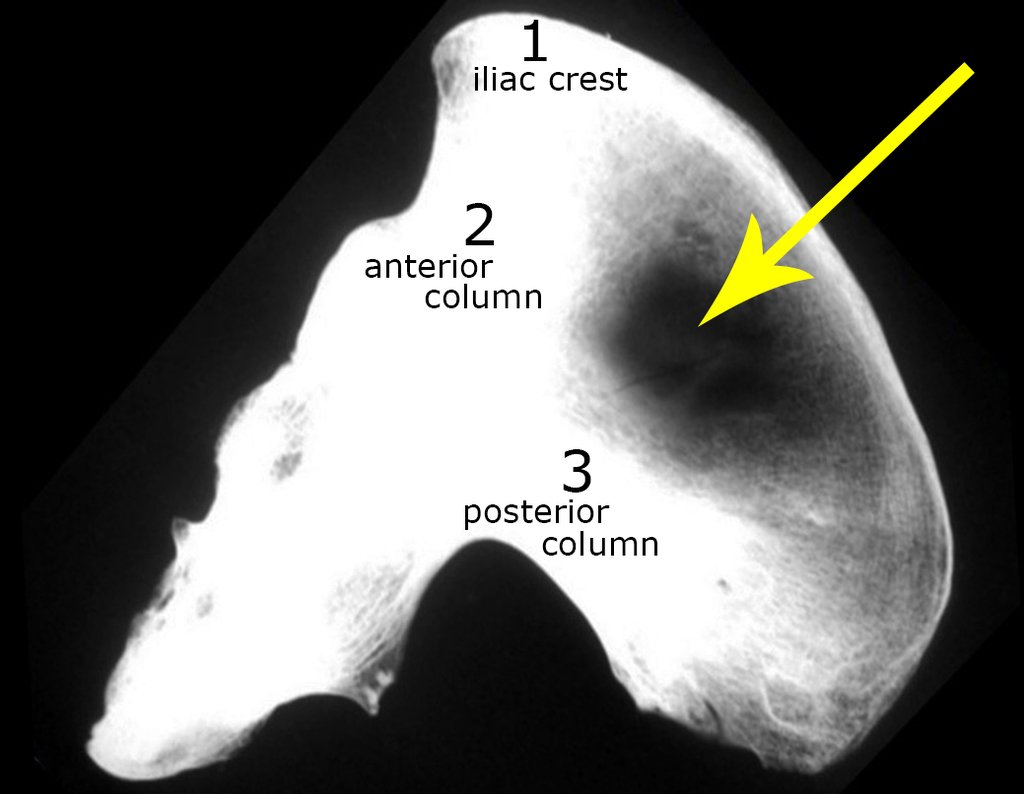
En esta etapa, con el desprendimiento del delgado periostio, se produce una gran cantidad de vasos nutritivos por los que comienza a fluir sangre. Estos deben eliminarse con hemostático de tejido óseo, con el objetivo de amortiguarlos. Debemos notar que hay una pequeña zona del hueso ilíaco donde las placas externa e interna están muy juntas, casi fusionadas. En esta pequeña “isla” no existe ningún injerto (marcado con la flecha amarilla), figura 15.
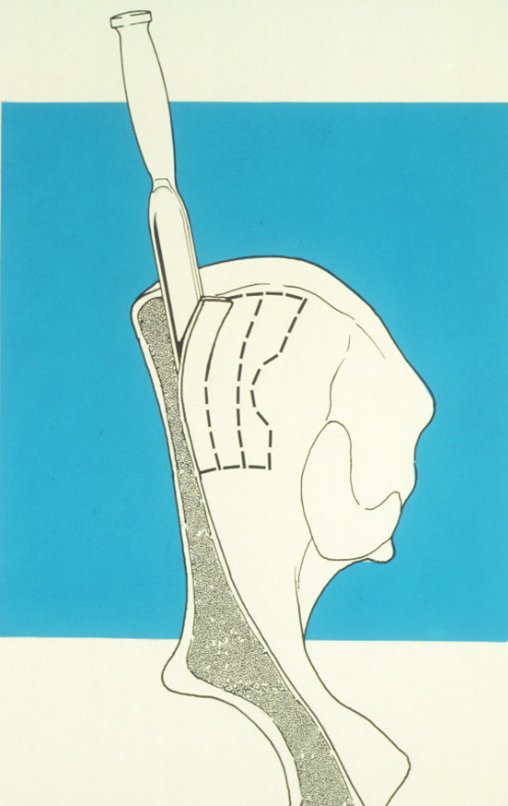
Luego de esta adecuada hemostasia, colocamos la punta de una compresa en la incisura ciática mayor y la dejamos sobre la sacroilíaca, para retener la sangre y el injerto. Comenzamos con un osteótomo para extirpar la corteza superior de la cresta ilíaca. Debemos iniciar la retirada del injerto con hemostasia controlada, figura 16.
Después de retirar toda la corteza interna, guardamos el injerto en una tina, empapado del coágulo recogido, preservando así las células totipotentes, que también se colocarán en el defecto óseo. A continuación, con un cincel afilado y SIN utilizar martillo, procedemos a la extracción del hueso ilíaco esponjoso, figuras 20 a 23.
Cuando es necesario colocar al paciente en decúbito prono, como en las cirugías de columna, podemos obtener más fácilmente un injerto autólogo, dejando expuesto el hueso ilíaco.
En este abordaje, la mejor incisión es horizontal, al nivel de la espina ilíaca posterosuperior. Esta incisión es más estética y puede ocultarse fácilmente con un bikini, además de facilitar tanto la exposición de la cresta ilíaca como de la columna posterior, figuras 30 y 31.
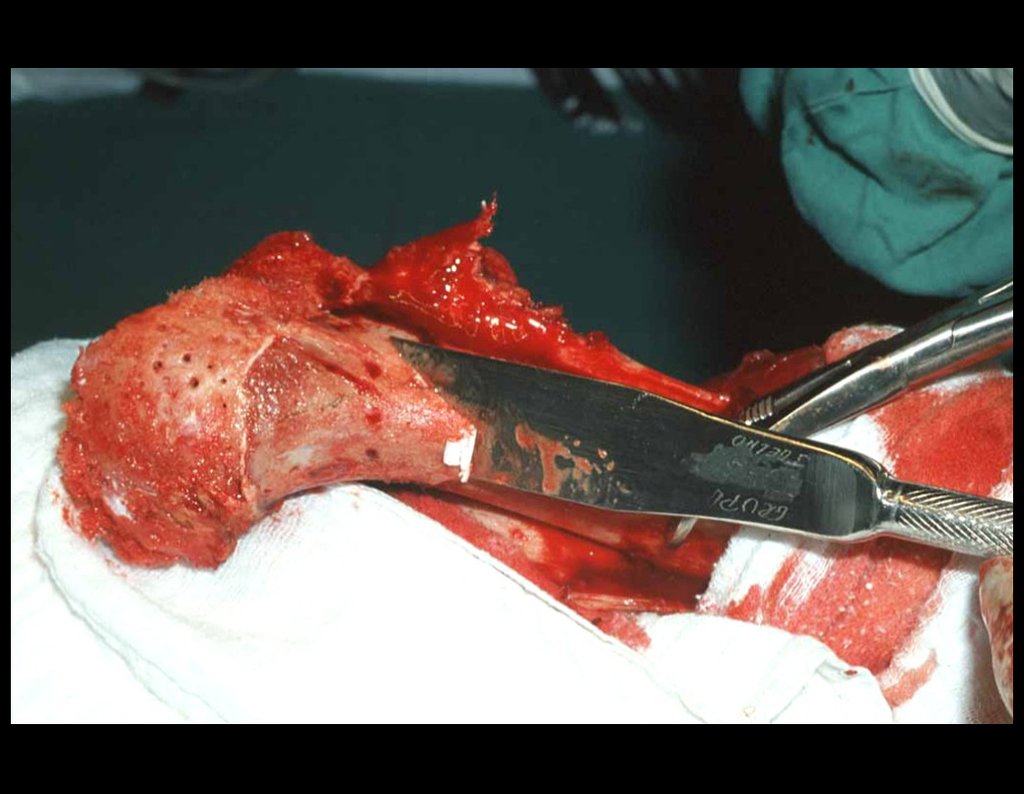
Es importante recordar el concepto de reparación de defectos óseos con injertos óseos: EN UNA RECONSTRUCCIÓN BIOLÓGICA, TODO INJERTO ÓSEO COLOCADO PARA LLENAR CAVIDADES O FALTAS SEGMENTALES PASA POR UNA FASE DE REABORTO PARA POSTERIOR REINTEGRARSE , REPARANDO LA PÉRDIDA ÓSEA. El injerto debe estar entrelazado y sobrepasar el nivel de la osteotomía, evitando pseudoartrosis, como ejemplifica este caso de condrosarcoma en las figuras 36 a 38, flechas azules.
Video 3: Buena estética y función, 22 años después de la cirugía.
Este caso puede verse completo accediendo al enlace: http://bit.ly/sarcoma-de-Ewing
El peroné también se puede utilizar vascularizado en reconstrucciones, incluso con la placa de crecimiento para reemplazar la que será resecada debido al tumor. Se trata de un autotrasplante de peroné con la placa fisaria, realizándose osteosíntesis con el dispositivo de fijación interna extensible, figuras 63 y 64.
En la reconstrucción de pequeños segmentos, como en la reconstrucción del radio, por traumatismos o tumores, podemos utilizar el peroné libre con buenos resultados, figuras 65 y 66.
Este caso puede verse completo accediendo al enlace: http://bit.ly/tgc_radio
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
Condrosarcoma – Condroma: Historia, Aspectos Clínicos. Historia: En 1920, el Comité de Registro de Sarcoma Óseos de Colegio Americano de Cirugía, compuesto por Ewing, Codman y Bloodgood, publicó la primera clasificación sistemática de los tumores óseos. Esta clasificación englobó una gran variedad de entidades clínico-patológicas que se subdividían básicamente en:
Condrosarcoma - Condroma: Historia, Aspectos Clínicos, Clasificación, Diagnóstico Diferencial, Tratamiento, Complicaciones y Pronóstico
– Tumores primarios de los huesos.
– Tumores desarrollados en tumores óseos pre-existentes.
– Tumores derivados de radiación ionizante.
– Tumores que invaden los huesos originados en los tejidos blandos.
– Tumores primarios de las articulaciones.
– Tumores metastásicos no esqueléticos23.
En 1925, Keiller y posteriormente Phemister, 1930, fueron los primeros en separar el Condrosarcoma de los sarcomas osteogénicos, considerando la distinción entre sus características morfológicas y clínico-radiológica, evolución más lenta y mejor pronóstico. En 1939 el ¨Comité de Registro de Sarcomas óseos¨, incluyó al Condrosarcoma como una entidad distinta.
Lichtenstein y Jaffe, en 1943, establecen la clara diferencia entre Osteosarcoma y Condrosarcoma. El Osteosarcoma es un tumor productor de osteóide neoplásico, en cambio el Condrosarcoma ocurre a partir del cartílago totalmente desarrolado, muchas veces presentando calcificaciones y osificaciones, pero nunca produciendo osteóide neoplásico2.
Definición:El Condrosarcoma e una neoplasia maligna de naturaleza mesenquimal, productora desustancia intersticial y células que asumen aspecto de cartílago hialino, con grados variables de inmadurez y focos de calcificación frecuente. Es la lesión maligna más frecuente después del Osteosarcoma23,24 y el tumor de Ewing (silabus), puede aparecer en cualquier edad, con predominio entre los 30 y 40 años7,11,22, con relatos en la literatura entre 3 y 73 años15.
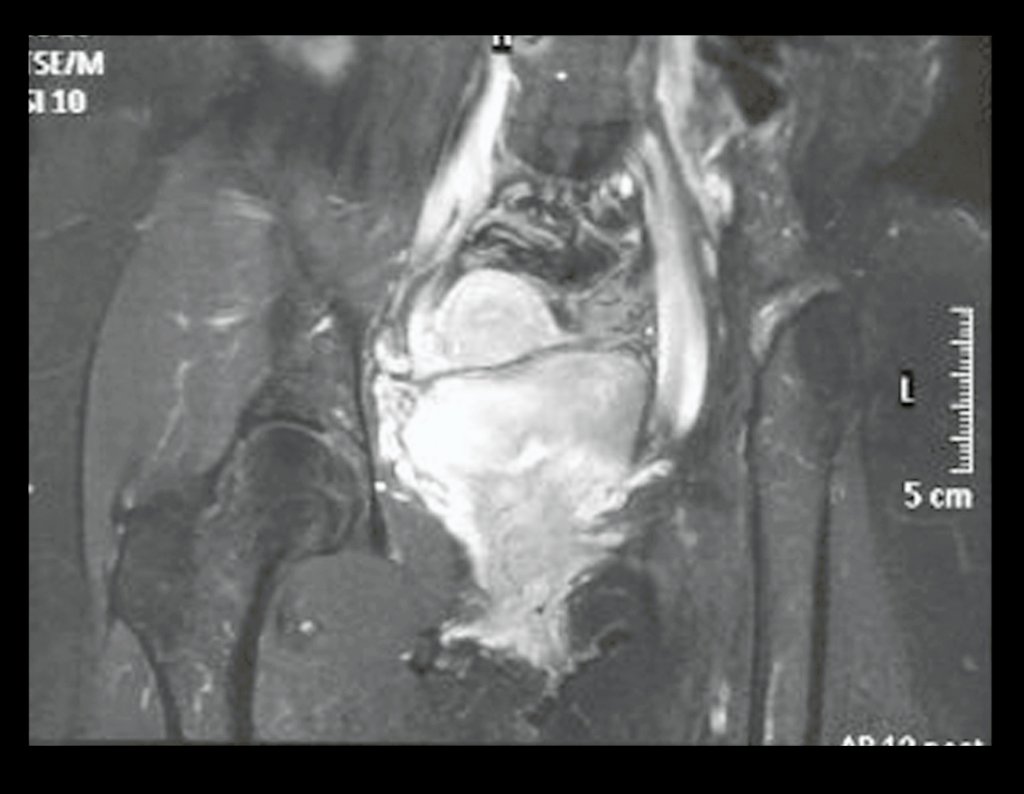
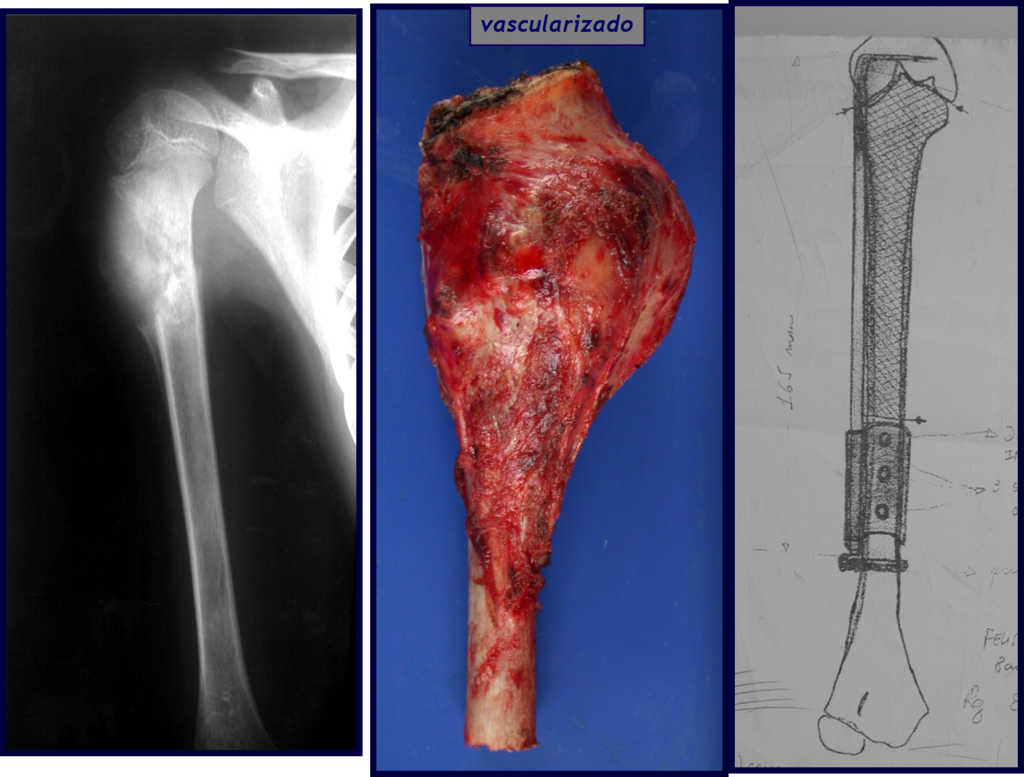
El Condrosarcoma ocurre en los huesos de origen endocondral, principalmente en la raíz de los miembros: hombro (Figuras 1 a 3), pelvis (Figuras 4 a 10), costillas y esqueleto axial1, siendo raro en los huesos de origen membranoso11,14,15,24.
La mayoría de los casos son indoloros y no causan déficit motor. La ocurrencia de fracturas es poco frecuente7,10,13,22 y los pacientes buscan atención después de muchos años de aparecido el tumor, pues los síntomas surgen tardíamente. Huvus11 relató un caso de Condrosarcoma de costilla que progreso durante 15 años, antes de que el paciente buscara atención médica.
Las figuras 1 a 10 ilustran grandes Condrosarcomas de la cintura escapular y la cintura pélvica, que evolucionaron lentamente.
Clasificación: Pueden ser clasificados en cuanto a la localización, histología y origen.
En cuanto a la localización pueden ser:
A- central (Figuras 11 a 15);
B- juxtacortical, paraostal o periostal2,6,23,24 (Figuras 16 y 17);
C- periférico o exofitico, que ocurre sobre osteocondroma28 (Figuras 18 y 19);
D- de tejidos blandos13 (Figuras 20 a 31).
GI=253]
En cuanto a la HISTOLOGÍA presentan diferentes aspectos, y podemos separarlos en:
A) Grado de Anaplasia: clasificándose en grado I, II y III, dependiendo de la celularidad y mitosis atípicas11,24, siendo:
–Condrosarcoma grado I, bien diferenciado, estructura semejante al cartílago hialino pero con celularidad aumentada, distribución irregular de las lagunas y número variado de células por laguna, por veces binucleadas, hipercomaticas y polimórficas (Figura 10.32);
–Condrosarcoma grado II, moderadamente diferenciado, mayor número de células por lagunas con gran pleomorfismo y desarrollo celular (Figura 10.33);
–Condrosarcoma grado III, indiferenciado, acentuada anaplasia, áreas mixoides, células iniferenciadas y escasa matriz hialina (Figura 34).
B) Desdiferenciado: áreas nítidas de cartílago maduro y otras áreas de inmadurez, presentando alta celularidad y mitosis atípicas8 (Figura 35);
C) Mesenquimal: raro, presentando campos de cartílago hialino entrecruzado por neoplasia indiferenciada de células pequeñas y redondas8 (Figura 35);
D) Células Claras: raro, presentando células redondas con citoplasma claro y vascularizado y con poca atípia celular2 (Figura 37).
GI=265]
En cuanto al ORIGEN pueden ser:
1- Primario, cuando ocurre en un tejido que no ha tenido lesión previa (Figura 38 y 39).
2- Secundario, que se origina sobre una lesión cartilaginosa benigna preexistente2,3,6,8,13,14,23,24 (Figuras 40 a 44).
Quanto à ORIGEM podem ser:
1- Primário, quando ocorre em tecido que não havia lesão prévia (Figuras 38 e 39).
2- Secundário, que se origina sobre uma lesão cartilaginosa benigna preexistente2,3,6.8,13,14,23,24 (Figuras 40 a 44).
El condrosarcoma secundario ocurre en la enfermedad de Ollier o en el Sindrome de Maffucci en 20 a 30% de los casos2,29
pudiendo ocurrir también a partir de un encondroma único, aunque es rara esta situación.
Puede incluso ocurrir a partir de la capa cartilaginosa de un osteocondroma solitario, menos de 1%, o en la osteocondromatosis múltiple, cerca del 10%2 y más raramente secundario a la enfermedad de Paget.
Cuando en un osteocondroma se observa aumento de la lesión después de la maduración esquelética, se debe pensar en la posibilidad de malignización.
Esta malignización es caracterizada por aumento del espesor de la capa cartilaginosa mayor de 2cm29, calcificaciones irregulares, aparición de dolor y aspecto heterogéneo de la lesión2,6.
Debido a las características morfológicas y del comportamiento clínico distintos, consideramos didáctico discutir individualmente sobre la incidencia, aspectos clínicos, radiográficos y anatomopatólogos de cada subtipo:
1. Condrosarcoma Central o Convencional:
Es el más frecuente de los condroarcomas, correspondiendo al 90%. Representa entre 10,0 a 14,5% de todos los tumores malignos primarios2,23.
Según Dahlin y Jaffe afecta a hombres y mujeres igualmente, en cuanto para otros autores la prevalencia por el sexo masculino varia de 10%6,9,14,29 a cerca de 70% conforme Schajowicz2.
Ocurre mas frecuentemente en adultos entre 30 a 60 años2,14,24,29.
Su localización es mas frecuente en el segmento proximal del fémur, del húmero y de la tibia; siendo raro en huesos cortos2,23.
El dolor puede ser un síntoma insidioso por varios años, evolucionando con crecimiento lento, aumento de volumen, restricción de la movilidad, permaneciendo la piel a veces roja y caliente23. Por ser poco sintomático, muchas veces la fractura patológica es la primera manifestación de dolencia2,24.
La radiografía muestra lesión metafisáriaradiolúcida, sustituyendo la medular ósea. El tumor crece en dirección de la epífisis a la diáfisis y rodea la cortical interna, provocando lesiones en saca bocado. Puede ocurrir expansión de la porción medular del hueso, con insuflación cortical (Figuras 45 y 46).
A radiografia evidencia calcificações frequentes (Figura 47 ). Esta decorre da neoangiogênese do tecido cartilaginoso, que se degenera. Este processo é acelerado nos condrossarcomas e lento nas lesões cartilaginosas benignas e de baixo grau. As calcificações podem ser salpicadas, em flocos de algodão ou anelares23,2,24,13,6,29,5.
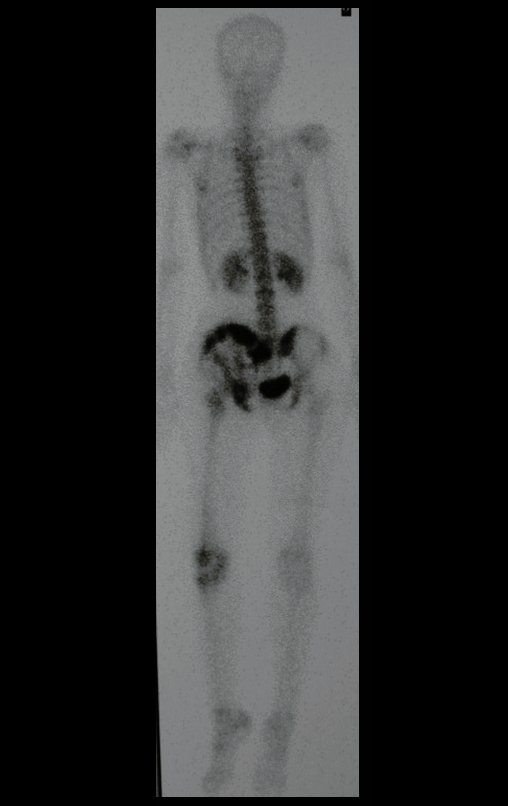
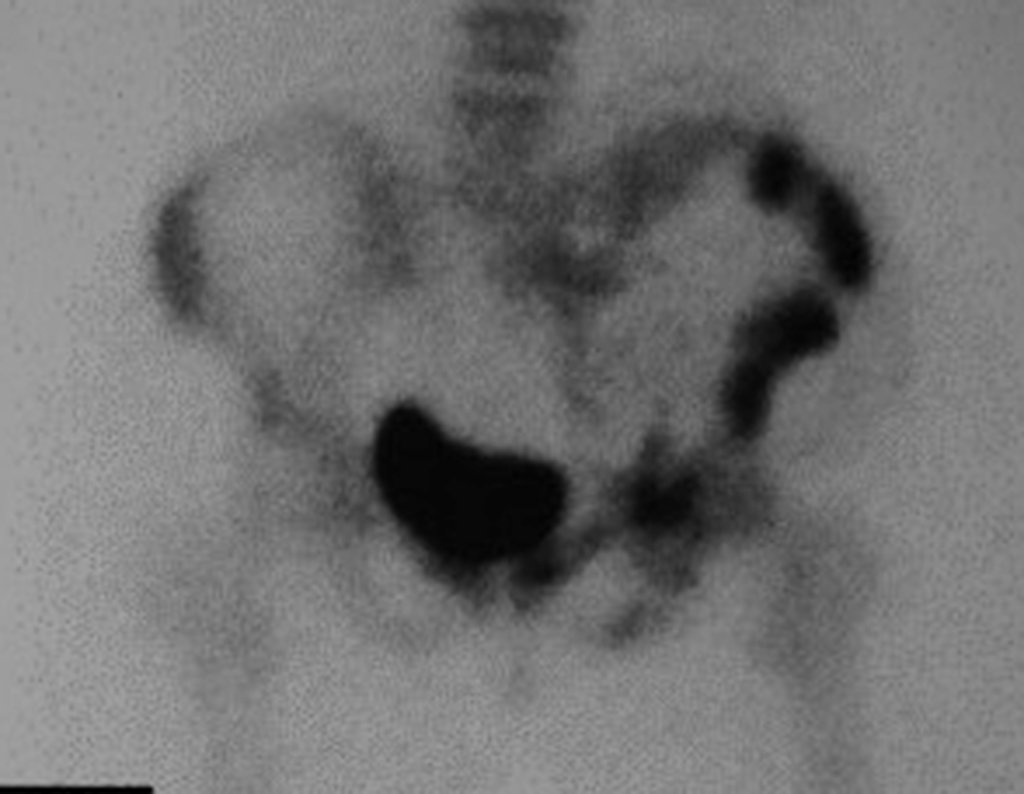
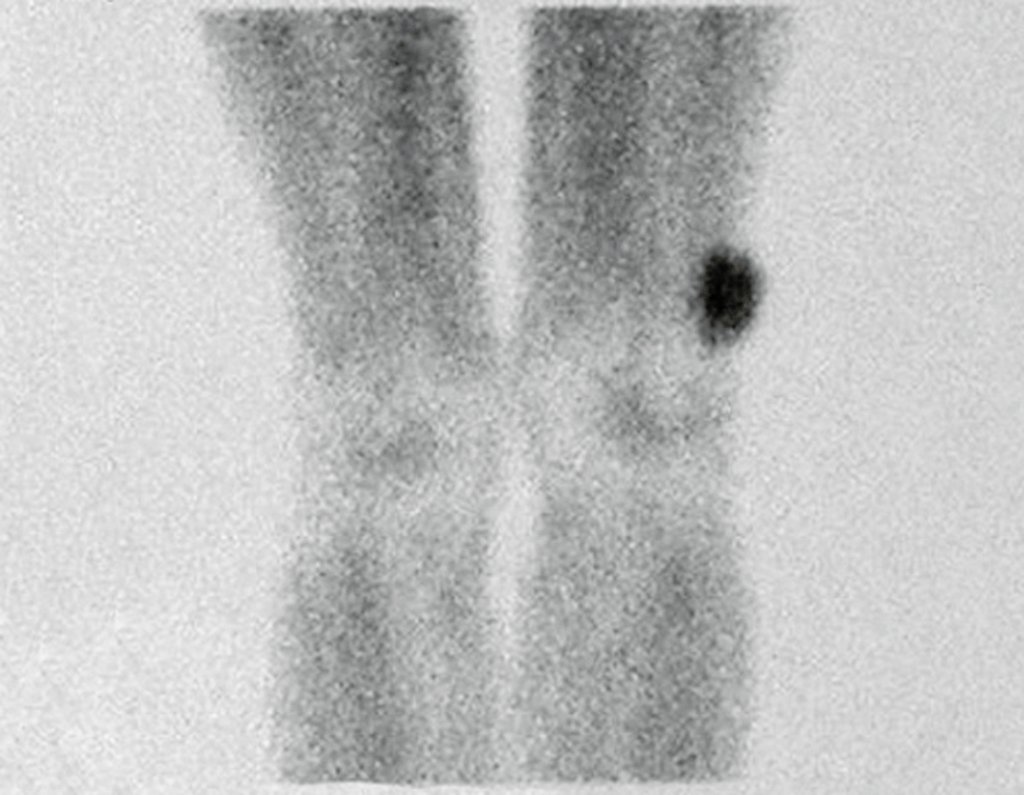
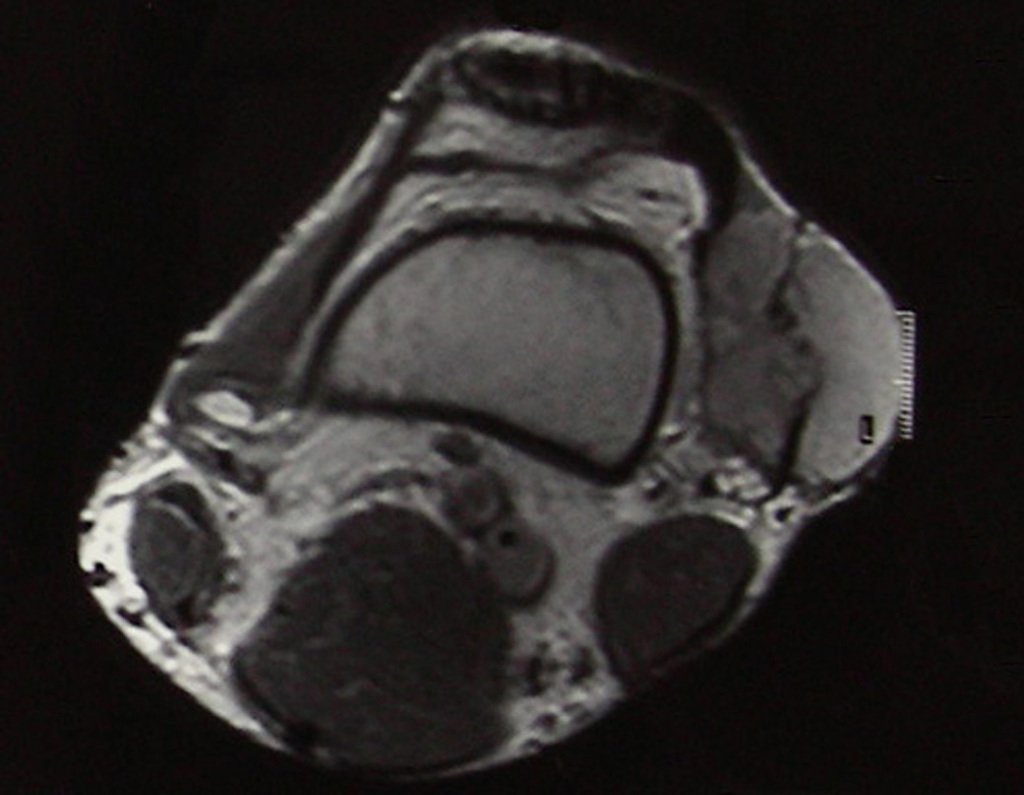
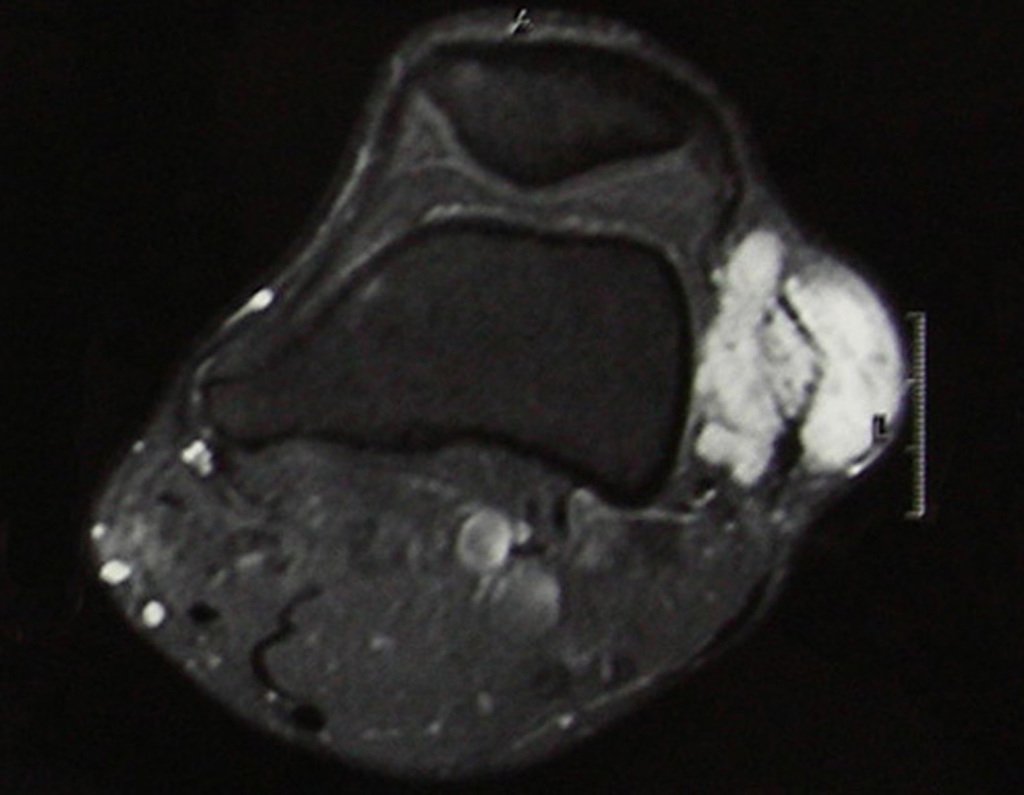
O mapeamento ósseo auxilia no estadiamento do tumor (Figura 48 ). A ressonância magnética e a tomografia são importantes para a avaliação da extensão intramedular e comprometimento extra-ósseo da lesão2.
A macroscópia apresenta coloração brancoazulada com focos de calcificação amarelada, formando lóbulos separados por septos de tecido conjuntivo e áreas de necrose2,24,6,14 (Figura 49 e 50).
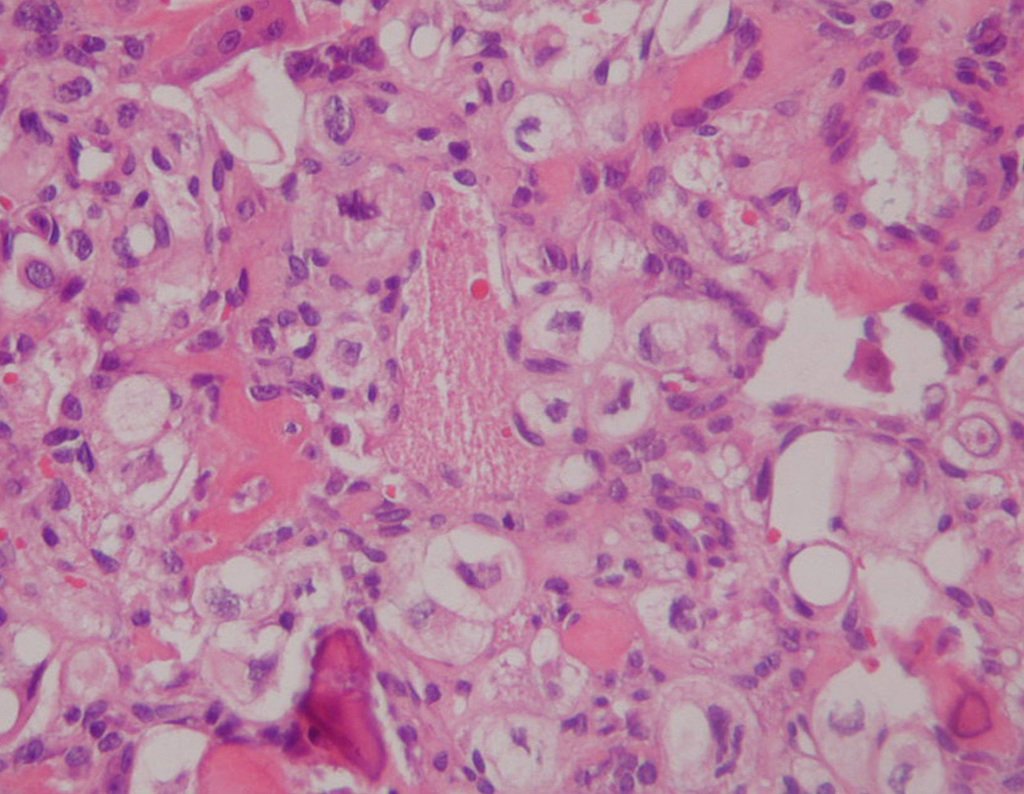
Histológicamente, el condrosarcoma central muestra hipercelularidad, núcleos grandes, a veces binucleados, polimorfismo, atipia, matriz mixoide intercelular y la invasión y destrucción del hueso trabecular adyacente. Esta histología puede también presentar bajo o alto grado de diferenciación.
Las lesiones de bajo grado pueden confundirse con tumores cartilaginosos benignos, ya que la diferencia histológica de estos tumores es sutil. Se considera una lesión de bajo grado cuando hay celularidad, atipia, polimorfismo y celulas binucleadas en grado moderado12 (Figura 51).
En los de alto grado hay hipercelularidad, atípias y polimorfismo acentuado, con varias figuras mitóticas en matriz intercelular mixoide14,12.
2. Condrosarcoma Yuxtacortical (o de superficie)
También llamado parostal o periostal, estos tumores se desarrollan en la superficie ósea. Son raros, representan 20% de los condrosarcomas en general son de bajo grado e inciden en adultos jóvenes23. Se ubican en la región metadiafisaria de los huesos largos con preferencia a la región posterior y distal del fémur, anterior y proximal de la tibia y proximal del húmero14.
La lesión envuelve la cortical, con márgenes mal definidos y crecen de modo mas rápido que un condrosarcoma convencional. Presentan consistencia endurecida, generalmente indolora y sin signos de flogosis en la piel subyacente23 (Figura 52 a 60).
En la variable altamente maligna ha erosionado la cortical, presenta tumor palpable y tejidos blandos dolorosos2.
En la radiografía se puede ver lesión de rarefacción ósea, transparente, con focos de calcificaciones entre la cortical ósea erosionada y el periostio elevado.
Macroscopicamente el diagnóstico es una lesión mayor de cinco centímetros, lobulada y adherida a la superficie del hueso.
La microscopia es similar al condrosarcoma convencional. Nódulos del tumor pueden invadir los tejidos blandos periféricos.
3. Condrosarcoma periférico o exofitico: Diferenciandose del tipo yuxtacortical, pues surge a partir de un osteocondroma pre-existente. Se debe considerar malignización de un osteocondroma cuando presenta crecimiento de la lesión después de la maduración esquelética, sin trauma previo o fricción repetitiva.
La radiografía presenta tumores de gran volumen, con áreas radiopacas en la periferia, de aspecto globoso u ovoide, superficie lisa o multilobulada, calcificando la porción central, fuertemente implantado en el hueso huésped, aparentando ser un tumor vegetante o que no siempre se confirma, pues tiene limites externos bien definidos23.
Crecen mas lentamente que el de tipo central y frecuentemente son grandes al diagnóstico12,14.
Este tipo de condrosarcoma se trata con resección adecuada. Se debe hacer resección parietal de la porción ósea donde se encuentra insertado el condrosarcoma29,12, evitándose la disección roma de la superficie de la lesión.
En la degeneración sarcomatosa ocurre aumento del grosor de la capa cartilaginosa, con calcificaciones irregulares y dolor en donde anteriormente no había dolor2,4.
Son más frecuentes en el ilíaco y en la escápula, seguido de la región proximal del fémur, distal del fémur, proximal del húmero y proximal de la tibia3,12,23,29.
Las figuras 61 a 103 ilustran ejemplos de condrosarcoma periférico, secundarios a osteocondroma, con diferentes aspectos, las principales localizaciones en frecuencia.

El diagnóstico histológico del condrosarcoma bien diferenciado es un desafío.
El mismo aspecto histológico de irregularidades la disposición del numero de células dentro de la matriz condróide, con alteraciones nucleares de hipercromasia, discreto pleomorfismo y alguna mitosis atípicas, pueden representar entidades diferentes: condrosarcoma, cuando están situados en raíces de miembros y condroma cuando se encuentran en los pies y manos.
La microscopía ha descrito los condromas de las manos y los pies, semejantes al condrosarcoma central23.
Los datos de la historia clínica, la localización y los aspectos de imagen deben ser valorizados para la conclusión del diagnóstico y la definición de la conducta adecuada12,14,23.
4. CondrosarcomaMesenquimal
Descrito inicialmente por Lichtenstein y Bernstein en 195916, es extremadamente raro24. La mayor casuística, treinta casos, fue publicada por Salvador18.
Caracterizado por áreas de cartílago diferenciada, alternadas por tejido mesenquimático con células redondeadas o fusiformes, altamente vascularizadas con patrón hemangiopericitico2 (Figura 104).
Presenta discreto predominio del sexo femenino, ocurre entre la segunda y tercera década de la vida2,6,14, surge frecuentemente en las extremidades inferiores, los maxilares, mandíbula y costillas. El dolor y el aumento de volumen son los principales síntomas clínicos2.
Puede semejar al condrosarcoma convencional.
Radiográficamente tiene aspecto agresivo29 con compromiso de los tejidos blandos y metástasis pulmonares frecuentes12.
Presenta alto grado de malignidad, con pequeñas células azules redondeadas y fusiformes que rodean islas de cartílago, de apariencia benigna bien diferenciada, patrón semejante al hemangiopericitoma24,29.
Las células asemejándose a condroblastos indiferenciados6.
Macroscópicamente presentan áreas de coloración blanco-grisácea o colorada, de consistencia blanda alternada con áreas endurecidas, de aspecto cartilaginoso y focos de calcificación.
5.Condrosarcoma de Células Claras.
Neoplasia rara, localizada en las epífisis de los huesos largos y compuesto por células redondas con citoplasma abundante, claro y numerosas células gigantes2,24,29 (Figura 105).
Afecta esencialmente a los adultos e involucra al fémur proximal, húmero y tíbia2,29.
La radiografía muestra como una lesión epifisaria, bien definida, semejante al tumor de células gigantes (T.C.G)2 o al condroblastoma, interpretado por algunos autores como la evolución maligna de esta neoplasia4.
La duda diagnóstica con un condroma puede ocurrir, debiéndose siempre considerar la agresividad radiográfica para la definición de la conducta adecuada.
6. Condrosarcoma Desdiferenciado
Es un sarcoma altamente anaplásico junto a un condrosarcoma maligno de bajo grado, presentando transición abrupta entre ambos29 (Figura 106).
Puede tener aspecto de fibrohistiocitoma maligno, fobrosarcoma, osteosarcoma o rabdomiosarcoma2,29.
Aparece en la pelvis y los huesos largos, particularmente al fémur o húmero. Ocurre en pacientes mayores de los veinte años de edad y presenta pico de incidencia entre los 40 y 50 años, sin predilección entre hombres o mujeres.
En radiografía las lesiones son semejantes al condrosarcoma común, mas la presencia de un área mayor de destrucción cortical sugiere lesión agresiva29.
Diagnóstico Diferencial:
Presenta diagnóstico diferencial con la miositisosificante, o fibroma condromixóide, o T.C.G., o linfoma no Hodgkin6,23,29 y con un quiste óseo aneurismatoco, por ser de carácter multiloculado. Histológicamente, el subtipo cortical asemeja al condroma, al osteocondroma, al condroblastoma y al osteosarcoma de superficie16.
El condrosarcoma de células claras tiene condrocitos malignos con citoplasma claro, células gigantes tipo osteoclastos y formación de hueso reactivo intralesional causando confusión con osteosarcoma.
El osteosarcomamesenquimal es formado por islas de cartílago hialino bien diferenciado circundado por laminas de células pequeñas y redondas, que asemejan al hemangiopericitoma y sarcoma de Ewing14.
El condroma central de los huesos largos, o condrosarcoma y el infarto óseo son muchas veces de difícil diferenciación, necesitando acompañamiento clínico y radiológico para evaluar la progresión de una lesión, antes de definir la conducta. La biopsia muchas veces no es definitiva para el diagnóstico12,23,29.
Tratamiento:
El tratamiento del condrosarcoma es quirúrgico25, dibiendo elegir una resección amplia, incluyendo el trayecto de la biopsia13,21.
La radioterapia es ineficaz6, no controla esta neoplasia. Para las lesiones de alto grado se puede discutir la indicación de quimioterapia utilizando el protocolo para sarcomas de grandes células, basado en antraciclicos9999. Para el condrosarcomamesenquimal, que presenta predominio de células pequeñas e indiferenciadas, cuando esta indicada la quimioterapia recae sobre el protocolo de tratamiento del tumor de Ewing.888
En ambos casos la respuesta a la quimioterapia suele ser mala6. El tratamiento de esta neoplasia debe ser particularizado para cada subtipo clínico:
– Condrosarcoma central:presenta altos índices de cura con la cirugía adecuada, por lo tanto no se puede subestimar su tratamiento con curetajeintralesional seguido de métodos adyuvantes complementarios, sea con fenol, nitrógeno liquido, electrotermia o laser CO221.
De esta manera. En caso de dusa diagnóstica entre condroma y condrosarcoma de grado I es preferible observar la evolución de la lesión, pues es sabido que la biopsia no será concluyente, ya que el diagnóstico diferencial histológico entre condroma y condrosarcoma de grado I es difícil.
En algunos casos, estas lesiones pueden ser tratados con cirugía conservadoras sin la realización de biopsia previa21.
Cuando los exámenes de imagen: radiografía, TAC y RM, muestran una lesión central, sin erosión de la cortical interna, de grosor normal y sin dolor, se debe reevaluar dentro de tres meses, si no hay alteración se repite evaluación en seis meses y si permanece inalterado se programa reevaluaciones anuales.
Si en cualquier momento hubiese alteración del cuadro clínico o de la imagen, se debe tratar como condrosarcoma central, realizándose la resección amplia de la lesión y reconstrucción con endoprótesis no convencional, osteosíntesis con injerto autólogo u homólogo o cirugía ablativa conforme a la necesidad de cada caso.
En experiencia de esto autores no es necesario operar un condroma indoloro, cuando es hallazgo casual, sin características de agresividad radiologíca. Realizar curetajeintralesional, con adyuvante local e injerto o cemento, no dará necesidad de observación cuidadosa. En caso de que el examen anatomopatológico de toda el curetaje revele un condrosarcoma, será mucho peor volver a operar esta región ya manipulada quirúrgicamente.
Hay varios casos de ¨condroma¨ que la histología del curetajeintralesional corroboró el aspecto de la biopsia de ¨condroma¨ y sin embargo tuvieron evolución desfavorable. El seguimiento de los exámenes de imagen de estos pacientes revelaran que estaba creciendo ¨nueva¨ lesión local y que se trataba ahora de un condrosarcoma.
En estos curetajes puede ocurrir diseminación local, a distancia y hasta diferenciación a condrosarcoma, empeorando significativamente el pronóstico.
– CondrosarcomaYuxtacortical, el tratamiento es esencialmente quirúrgico, pudiéndose realizar la resección parcial parietal EJEMPLO cuando es posible , procedimiento eficaz y de menor morbilidad en relación a la resección segmentaria.
El perimísio de los tejidos blandos alrededor debe ser removido como margen oncológico, para evitar la recurrencia local.
Es importante resaltar que cuando ocurre crecimiento de una exostosis ósea después de la madurez esquelética, calcificaciones espesas, sin relación con fricción o trauma, probablemente se trate de un condrosarcoma.
Esta situación, una muestra de biopsia negativa no excluye la posibilidad de malignidad de la lesión restante, debiéndose realizar la cirugía de resección con margen oncológico, con especial atención a la superficie de la lesión.
– Condrosarcoma Mesenquimal, tiene la necesidad del control local con cirugía amplia, pudiendo eventualmente tener indicación de quimioterapia con cisplastina y doxirubicina9999.
– Condrosarcoma Desdiferenciado, como el Condrosarcoma de Células claras, se debe realizar el control local con cirugía amplia y quimioterapia con cisplatina y doxirubicina9999.
Complicaciones:
El curetajeintralesional del condrosarcoma puede llevar a la recurrencia local de la enfermedad y a desdiferenciación histológica mas agresiva.
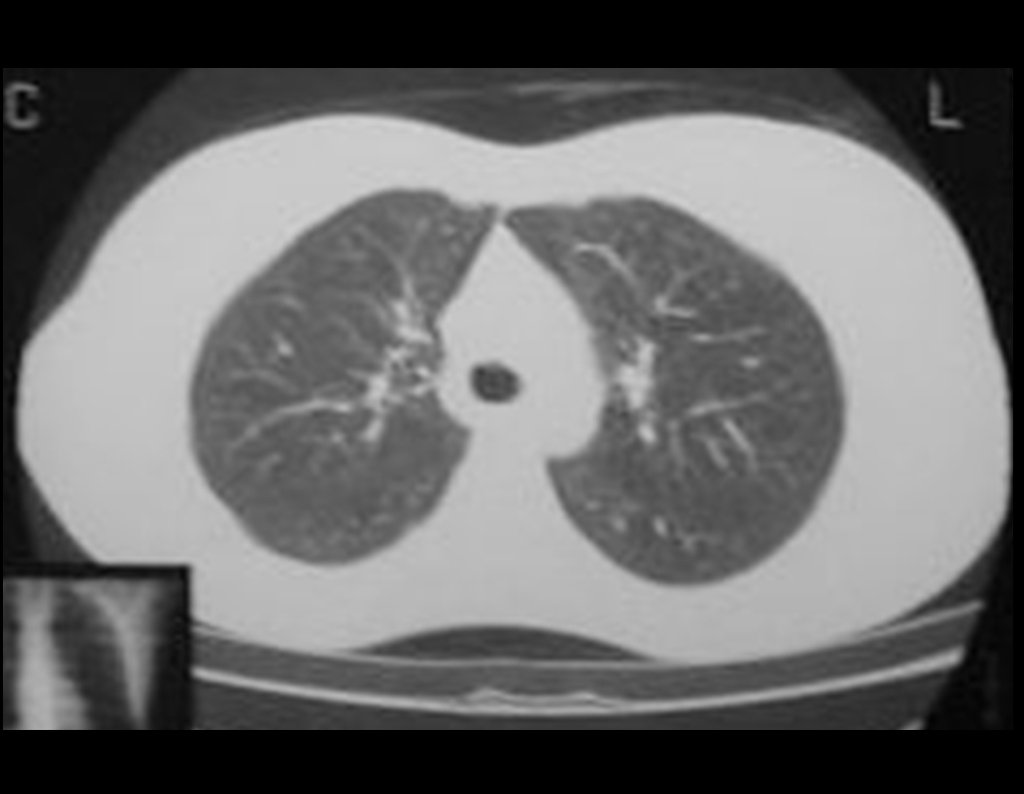
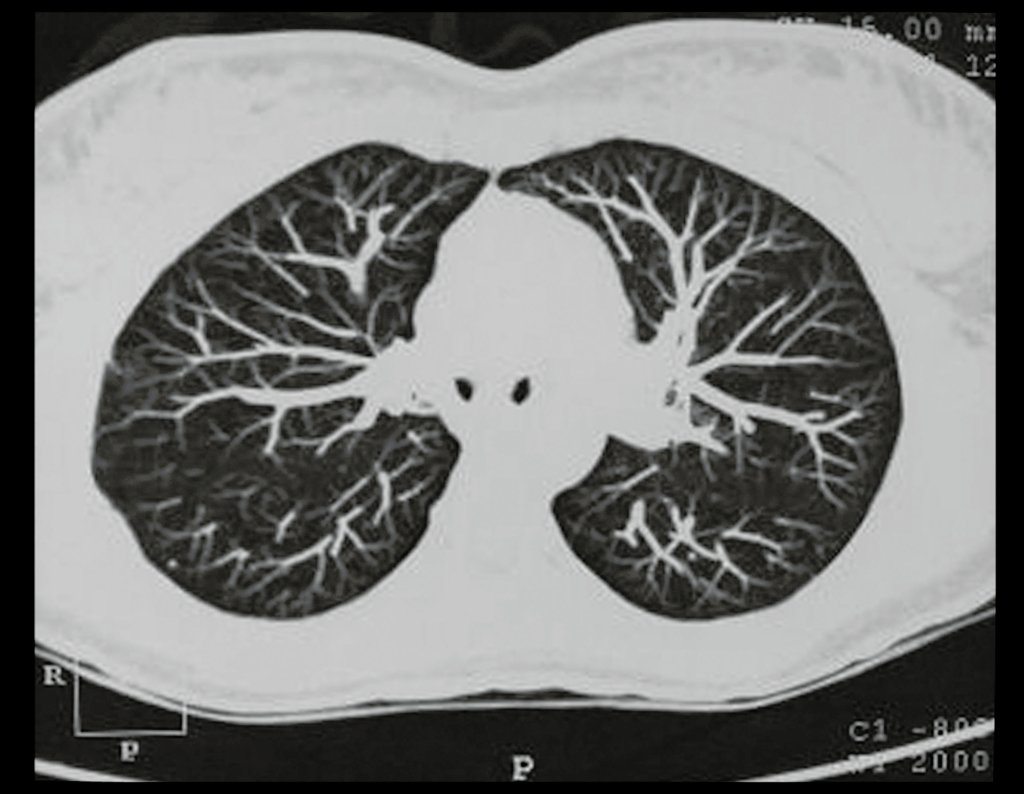
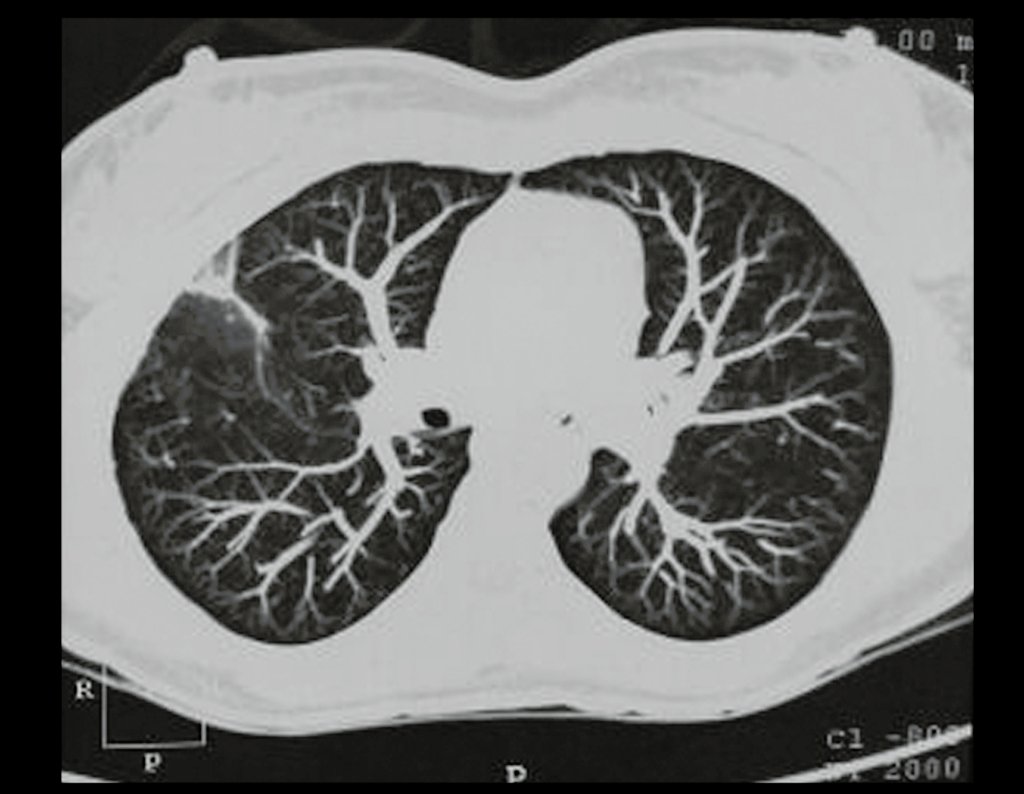
Los casos de condrosarcomadesdiferenciados, las metástasis hematógenas para los pulmones son frecuentes, pudiendo presentar diseminación linfática y recidiva local29. Muchos condrosarcomas presentan tendencia de diseminación local14, consiguiendo tamaños enormes y tornándose inoperables, causando muerte por compresión o complicaciones de la propagación local.
La recidiva local aumenta la incidencia de metástasis pulmomares21.
Bibliografia
1. ACKERMAN, L.V.; SPJUT, H.J. Tumors of bone and cartilage. Atlas of tumor pathology. Washington,Air Force Inst. Pathology, 1962, fasc, 4.
2. CANALE, S.T. Cirurgia ortopédica de Campbell.Barueri: Manole; 2006
3. DAHLIN, D.C. Tumores óseos . Barcelona: Ediciones Toray S/A; 1982
4. DORFMAN, H.D.; CZERNIAK, B. Bone tumors. St Louis, C.V. Mosby Co., 1997, cap. 7, p.410.
5. EDEIKEN, J.; HODES, P.J. Diagnóstico radiológico de las enfermedades de los huesos. Buenos Aires, Panamericana, 1977, cap. 15.
6. ETCHEBEHERE, M. Tumores cartilaginosos malignos: Condrossarcomas. In: Camargo O.P. Clínica Ortopédica. Rio de Janeiro: Med si; 2002. p. 753-759
7. FELDMAN, F. Cartilaginous tumors and cartilage-forming tumor like conditions of the bonés and soft tissues. In: Diseases of the Skeleton System (Roentgen Diagnosis). Part. 6 – Bone Tumors, New York, Springer-Verlag, 1977,p.177.
8. FLETCHER, C.D.M., Unni K.K., OMS – Merters F. (Eds.): World Health Organization. Classification of Tumors. Pathology and Genetics of Tumors of Soft Tissue and Bone. IARC Press: Lyon 2002.
9. GREENSPAN, A. Radiologia ortopédica. Rio de Janeiro: Guanabara; 2001.
10. HENDERSON, E.D.; Le PAGE, G. A. Apud FELDAMAN, F. Cartilaginius tumors and cartilage forming tumor like conditions of the bone and soft tissues. In: Disease of the Skeletal System (Roentgen Diagnosis).
Part. 6 – Bone tumors, New York, Springer Verlag, 1977, p.182.
11. HUVOS, A.G. Bone tumors Diagnosis, Treatment and Prognosis. Philadelphia, W. B. Saunders Co., 1979, p. 13.
12. JAFFE, H.L. Tumores y estados tumorales oseos y articulares. México: La Prensa Medica Mexicana;1966.
13. JESUS-GARCIA, R. – Reynaldo Jesus-Garcia
14. LICHTENSTEIN, L. Barcelona: Talleres Gráficos Ibero-Americanos; 1975.
15. LICHTESTEIN, L. Bone Tumor. 4 Ed St. Louis,C.V. Mosby Co., 1972, cap. 15.
16. LICHTESTEIN, L.; BERNSTEIN, D. Unusual benign and malignant chondroid tumors of bone. Cancer, 12:1142, 1959.
17. MARCOVE, R.C. Condrosarcoma: Diagnóstico y tratamiento. In: Clínicas Ortopécias de Norteamérica. Tumores del aparato musculosquelético. Buenos Aires, Panamericana, 1977, cap. 7.
18. MARCOVE, R.C. et al. Chondrosarcoma of the pélvis and upper end of the femur. Na analisys of factors influencing survival time in113 cases. J. Bone Joint Surg., 54A:61, 1972.
19. MARCOVE, R.C.; SHOJI, H,; HARLEN, M. Altered carbohidrate metabolism in cartilaginous tumors. Contemp. Surg. 5:53, 1974.
20. McFARLAND, G.B.Jr.; McKINLEY, L.M.; REED, R.J. Dedifferentiation of low grade chondrosarcomas. Clin. Orthop., 122:157, 1971.
21. MENENDEZ, L.R. Orthopaedic knowledge update: Actualizaciones en cirugía ortopédica y traumatología. Barcelona: Ars Medica; 2003.
22. O’NEAL, L.W.; ACKERMAN, L. V. Chondrossarcoma of boné. Cancer, 5:551, 1952.
23. PRÓSPERO, J.D. Tumores Ósseos. São Paulo, Roca, 2001, cap. II.
24. ROBBINS. Patologia estrutural e funcional. Rio de Janeiro: Guanabara; 1996.
25. ROMSDAHL, M.; EVANS, H.L.; AYALA, A.G. Surgical treatment of chondrosarcoma. In: Managment of primary bone and soft tissue tumors. Chicago, Year book med. Publisher Inc., 1977, p. 125.
26. ROMSDAHL, M.; Evans, H.L.; Ayala, A.G. Surgical treatment of chondrosarcoma. In: Managment of primary bone and soft tissue tumors. Chicago. Year book med. Publisher Inc., 1977, p.125.
27. SALVADOR, A.H.; BEABOUT, J.W.; DAHLIN, D.C. Mesenchimal chondrosarcoma. Cancer, 28:605, 1971.
28. SCHAJOWICZ, F. Justacortical Chondrosarcoma. J. Bone Joint. Surg., 59B:473, 1977.
29. SCHAJOWICZ, F. Tumores y Lesiones Seudotumorales de Huesos y Articulaciones. Buenos Aires: Editora Médica Panamericana; 1982.
30. TORNBERG, D.N.; RICE, R.W.; JOHNSTON, A.D. The ultrastructure of chondromyxoid fibroma.Clin. Orthop. Rel. Research, 95:295, 1973.
999. J Clin Oncol 30:abstrat 100:23,2012(maluf)
888. Buzaide, A.C.; Maluf, F.C.; Rocha Lima, C.M.
Manual de Oncologia Clinica do Brasil. Dendrix Edição e Design ltda. São Paulo (XI) Sarcomas Ósseos do Adulto, 560-79. 2013
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com