Granuloma eosinofílico
Granuloma eosinófilo: Historia: En 1938, Schairer diagnosticó una lesión en el cráneo de un niño como mieloma eosinófilo u osteomielitis eosinofílica 1 . Esta condición fue descrita posteriormente como una nueva entidad clínica por Otani y Ehrlich en 1940 con el nombre de Granuloma Solitario de Hueso 2 .
Farber y Green, en 1942, demostraron que la lesión podía ocurrir de forma localizada o múltiple en el esqueleto y posiblemente estar relacionada con la enfermedad de Hand-Schuller-Christian y la enfermedad de Letter-Siwe 3 .
En 1944, Jaffe y Lichtenstein introdujeron el término granuloma eosinofílico de hueso 4 . La relación entre esta lesión y las formas sistémicas de la enfermedad fue confirmada por Lichtenstein en su publicación de 1953, englobándolas bajo el nombre de Histiocitosis X 5 .
Actualmente, esta entidad se denomina Histiocitosis de Células de Langerhans, la cual presenta cuatro formas clínicas distintas: Granuloma Eosinofílico, forma restringida al esqueleto, que puede ser localizada o múltiple; Hand-Schuller-Christian, forma crónica y diseminada; Letter-Siwe, forma diseminada aguda o subaguda y Hashimoto-Pritzker, forma posnatal con resolución espontánea 6 .
Introducción: El granuloma eosinofílico solitario del hueso es la más común de las cuatro formas de presentación de la Histiocitosis de Células de Langerhans, representando entre el 60% y el 80% de los casos 7 .
Entre las lesiones óseas benignas, es una entidad rara, representando menos del 1% 8 . Afecta preferentemente a niños y adolescentes con predominio masculino 2:1 9 . Alrededor del 80% de los pacientes tienen menos de 21 años y la mayoría de ellos tienen entre cinco y 15 años 6,7,9 .
Algunos pacientes pueden comenzar con una lesión ósea aislada y luego desarrollar múltiples lesiones óseas. Estos casos pueden eventualmente evolucionar hacia formas sistémicas de la enfermedad. Cuando esto ocurre, generalmente ocurre dentro de los primeros seis meses del diagnóstico y prácticamente nunca después del año de evolución, lo que es criterio de buen pronóstico, cuando no aparecen nuevas lesiones después de este período de seguimiento clínico 10 .
El síndrome de Hand-Schuller-Christian es la forma crónica de histiocitosis de células de Langerhans, caracterizada por afectación sistémica con múltiples lesiones óseas, principalmente en cráneo, exoftalmos y diabetes insípida, afectando a niños mayores de 3 años 10 .
El Síndrome de Letter-Siwe afecta a niños menores de tres años, es la forma aguda o subaguda, también con afectación sistémica. Se presenta con fiebre, otitis media, infecciones bacterianas recurrentes, anemia, hemorragias, viceromegalia, adenopatías difusas y dolorosas con afectación cutánea similar al eczema seborreico y lesiones ostelíticas generalizadas, con progresión frecuente a la muerte 10 .
El síndrome de Hashimoto-Pritzker es una forma de histiocitosis de células de Langerhans que afecta exclusivamente a la piel. Afecta a niños en el primer mes de vida, manifestándose con erupciones eccematosas que se resuelven espontáneamente 6 .
Etiología: Desconocida.
Genética: No hay informes significativos al respecto.
Definición: El granuloma eosinofílico es una lesión pseudotumoral, de etiología desconocida, caracterizada por rarefacción ósea que puede ser solitaria o múltiple. Microscópicamente presenta un perfil de células histiocíticas mononucleares, presentando antígenos de origen dendrítico, conocidos como células de Langerhans, en medio de una cantidad variable de leucocitos, eosinófilos, linfocitos y células gigantes.
Epidemiología: El Granuloma Eosinofílico afecta principalmente al esqueleto axial, en este orden: cráneo, pelvis, vértebras, costillas, mandíbula, clavícula y escápula.
En el esqueleto apendicular el fémur, región proximal y diáfisis, húmero y tibia 9 . Afecta con mayor frecuencia a la diáfisis o región metadiafisaria, siendo rara en la epífisis 7 .
La columna representa el 10% de los casos en la población pediátrica, la mayoría en la región lumbar.
En los adultos, ocurre con mayor frecuencia en las costillas y menos frecuentemente en la columna, respectivamente 25% y 3% 6 .
Cuadro clínico: El síntoma más frecuente del Granuloma Eosinofílico es el dolor localizado, pulsátil, de corta duración, que empeora por la noche asociado a calor local y edema. Cuando afecta al cráneo, este dolor puede confundirse con otras causas de dolor de cabeza.
El compromiso de los cuerpos vertebrales puede producir una escoliosis dolorosa. Las desviaciones angulares son pequeñas, inferiores a 10 0 , ya que el aplanamiento vertebral suele ser uniforme y rara vez produce síntomas neurológicos.
En otras formas de histiocitosis de células de Langerhans, pueden presentarse síntomas sistémicos como fiebre, erupciones cutáneas y diabetes insípida. La hepatoesplenomegalia puede ocurrir en el síndrome de Letter-Siwe, que es la forma más grave de la enfermedad 6
Clasificación: El granuloma eosinofílico puede manifestarse en dos formas clínicas: Solitario o Múltiple .
Pruebas de laboratorio: los cambios de laboratorio que se pueden encontrar son un aumento en la VSG y la PCR, y ocasionalmente puede ocurrir una eosinofilia leve en el recuento sanguíneo.
Pruebas de imagen: La imagen radiográfica es de rarefacción ósea, redondeada u ovalada, que comienza en el hueso medular y progresa con erosión del hueso cortical.
En la fase inicial los bordes son irregulares y poco definidos.
En la fase tardía, puede producirse una ligera esclerosis alrededor de la lesión. En los huesos largos hay una reacción perióstica evidente que se manifiesta como múltiples capas laminares gruesas, lo que caracteriza lesiones benignas de evolución lenta o la reacción de la osteomielitis.
Este tipo de reacción perióstica sólida diferencia al Granuloma Eosinofílico del Sarcoma de Ewing, donde la reacción perióstica es laminar delgada, debido a la rápida evolución del tumor maligno.
Otra diferencia radiográfica entre estas dos lesiones es que el tumor de Ewing presenta tempranamente tejido tumoral extracortical, de gran volumen, lo que no ocurre en el Granuloma Eosinofílico.
En huesos planos, como el cráneo o la pelvis, la erosión afecta a ambas cortezas de forma irregular y asimétrica, produciendo la impresión visual de un agujero dentro de otro agujero, lo que se denomina lesión de doble contorno.
En la mandíbula, la destrucción del hueso alveolar produce la impresión radiográfica de dientes flotantes.
En la columna, la enfermedad afecta al cuerpo vertebral, produciéndose un aplanamiento en un 15% de los casos, produciéndose la llamada vértebra plana de Calvè 6 . Los elementos posteriores y los discos intervertebrales se conservan, incluso cuando la lesión se produce en más de una vértebra.
Anatomía patológica:
Aspecto macroscópico: tiene consistencia blanda, gelatinosa, de color amarillento, es común la licuefacción necrótica.
Aspecto microscópico: Aparecen como cúmulos de células histiocíticas de gran tamaño, con citoplasma ligeramente basófilo, nucléolos globosos, lobulados o dentados, en estos casos similares a un grano de frijol, que corresponden a células de Langerhans.
Estos cúmulos se intercalan con células gigantes, linfocitos, numerosos eosinófilos y zonas de necrosis, simulando un absceso. La microscopía electrónica muestra gránulos citoplasmáticos típicos llamados cuerpos de Birbeck 11,12 .
La inmunohistoquímica muestra positividad para proteína S-100, vimentina y CD1a 11,13 .
Diagnóstico:
Diagnóstico diferencial: Los principales diagnósticos diferenciales radiológicos del Granuloma Eosinofílico son la Osteomielitis y el Tumor de Ewing.
Cuando la lesión se produce en el cráneo hay que diferenciarla de un quiste epidermoide o de una metástasis. Los principales diagnósticos diferenciales histológicos son la Osteomielitis y el Linfoma.
Puesta en escena:
Tratamiento: La literatura presenta informes de que el tratamiento expectante o la biopsia sola pueden estar indicados como una estrategia terapéutica eficaz para lesiones esqueléticas aisladas 7,14 .
El granuloma eosionofílico puede resolverse espontáneamente, especialmente en niños. La capacidad del hueso afectado para reconstruirse existe, ya que la mayoría de los pacientes son afectados antes de la madurez esquelética, por lo tanto con gran potencial de remodelación por parte de las fisis de crecimiento, que normalmente no se ven afectadas 15,16 .
En nuestra experiencia hubo resolución en cinco casos, que retrocedieron sólo con la biopsia percutánea. Lo mismo ocurre tras el colapso vertebral en lesiones de columna, probablemente por fuga del contenido de la lesión, asemejándose al drenaje de un absceso, siendo extremadamente rara la indicación quirúrgica en la columna. Se han reportado casos donde hubo restitución completa de la altura del cuerpo vertebral 15 . En nuestra serie tuvimos dos casos que presentaron esta evolución.
Aunque puede haber una resolución espontánea, el tiempo requerido es impredecible y puede haber una morbilidad significativa secundaria al dolor intenso y la limitación funcional.
Actualmente, el mejor abordaje terapéutico para el Granuloma Eosionofílico es realizar una biopsia percutánea, si es posible con diagnóstico inmediato por sección congelada, seguida de una infusión intralesional de corticosteroides (metilpredinisolona – 40 mg a 120 mg dependiendo del tamaño de la lesión) 7 . El resultado anatomopatológico debe ser confirmado posteriormente mediante histología en bloques de parafina.
El granuloma eosionofílico puede tardar hasta tres meses en retroceder y puede ser necesario repetir la infusión 6 . En nuestra experiencia sólo tuvimos un caso, de lesión aislada en el húmero, que requirió complementación del tratamiento inicial en el que realizamos corticoides orales, prednisolona 5 mg/24 h, durante cuatro meses. En el granuloma eosinofílico poliostótico, se utiliza la terapia con corticosteroides sistémicos.
Cuando es necesaria una biopsia incisional, se pueden aplicar corticoides localmente tras el curetaje de la lesión, lo que facilita la resolución del proceso. Este legrado debe ser cuidadoso, realizándose abriéndolo en forma de una hendidura estrecha, longitudinal al hueso, procurando no añadir mayor fragilidad local. Con el tiempo, la cavidad se puede rellenar con un injerto óseo, pero esto generalmente es innecesario debido al gran potencial de regeneración que existe.
La radiofrecuencia fue propuesta como tratamiento percutáneo del Granuloma Eosionofílico, aplicándose en una segunda etapa, de dos a cuatro semanas después de la biopsia 17 . El autor restringe la técnica a pequeñas lesiones que se encuentren al menos a un centímetro de las estructuras neurales o viscerales, advirtiendo del riesgo de fracturas en los miembros que soportan carga. Este enfoque, además de aumentar los costes y provocar morbilidad local, no añade ninguna ventaja al tratamiento. La propia biopsia puede haber sido curativa, y la infusión de corticoides tiene mayor justificación, ya que está indicada tanto en casos aislados como en lesiones múltiples. Hasta el momento no existen estudios que comparen las técnicas percutáneas con la infusión de corticoides en relación al uso de radiofrecuencia que justifiquen su uso.
Históricamente, la radioterapia se utilizó en dosis bajas y fraccionadas para el tratamiento de la histiocitosis de células de Langerhans. Actualmente, la indicación de radioterapia en lesiones benignas es controvertida.
En casos de granuloma eosinofílico con más de una lesión esquelética, sin afectación visceral, puede estar indicado tratamiento sistémico por un período aproximado de seis semanas con terapia con corticosteroides (2 mg/kg) y vinblastina (6 mg/kg).
Pronóstico: Las lesiones solitarias del granuloma eosinofílico evolucionan bien en el 97% de los casos, con biopsia sola o además de infusión de corticoides o tratamiento quirúrgico 6 .
Bibliografía:
1 SCHAIRER, E. Ueber eine eigenartige Erkrankung des kindlichen Schädels. Zentralbl Allg Patho Pathol. Anat., 71:113, 1938.
2 Otani S, Ehrlich JC; Granuloma solitario de hueso que simula neoplasia primaria. Soy J Pathol 16:479–90. 1940
3 Verde WT, Faber S; “granuloma eosinofílico o solitario” de hueso. J Bone Joint Surg (Am) 24:499-526. 1942
4 Jaffe HL, Lichtenstein L; Granuloma eosinofílico del hueso. Arco Pathol 37: 99-118. 1944.
5 Lichtenstein L.: Histiocitosis Patol. 56:84, 1953
6 Escuela Secundaria Schwartz. Actualización de conocimientos ortopédicos: tumores musculoesqueléticos 2. Academia Estadounidense de Cirujanos Ortopédicos, Rosemont, Illinois. Capítulo 12 (128-32), 2007
7 Mavrogenis AF, Abati CN, Bosco G, Ruggieri P. Metilprednisolona intralesional para el granuloma eosinofílico solitario doloroso del esqueleto apendicular en niños. J PediatrOrthop 2012;32:416–422
8 Chadha M, Agarwal A, Agarwal N, et al. Granuloma eosinofílico solitario del radio. Un diagnóstico diferencial inusual. Acta Orthop Belg. 2007; 73:413–417.
9 Campanacci, M. Tumores óseos y de tejidos blandos; Springer-Verlag Viena Nueva York. Segunda edición, (54); 857-75. 1999.
10 SCHAJOWICZ, F. Buenos Aires: Tumores Óseos; Talleres de editorial Médica Panamericana SA (9); 464-80. 1981.
11 CHRISTIAN, HA Defectos en huesos membranosos, exosftalmos y diabetes insípida: en un síndrome habitual de dispituitarismo: un estudio clínico. Med.Clin. Norte. Am., 3:849, 1920.
12ARCECI, RJ; BRENNER, MK; PRITCHARD, J. Controversias y nuevos enfoques para el tratamiento de la histiocitosis de células de Langerhans. Hemtol. Oncol. Clínica. Norte. Am., 12:339, 1998
13 ALBRIGHT, F.; REIFNSTEIN, EC Las glándulas paratiroides y la enfermedad metabólica. Baltmore, Williams y Wilkins, 1948.
14 Plasschaert F, Craig C, Bell R, et al. Granuloma eosinofílico. Un comportamiento diferente en los niños que en los adultos. J Bone Joint Surg Br 2002;84:870–872.
15 Greenlee JD, Fenoy AJ, Donovan KA, et al. Granuloma eosinofílico en la columna pediátrica. Neurocirujano Pediatra. 2007; 43:285–292.
16 Sessa S, Sommelet D, Lascombes P, et al. Tratamiento de la histiocitosis de células de Langerhans en niños. Experiencia en el Hospital Infantil de Nancy. J Cirugía de la articulación ósea Am. 1994; 76:1513–1525.
17 Corby RR, Stacy GS, Peabody TD, et al. Ablación por radiofrecuencia del granuloma eosinofílico solitario de hueso. Am J Roentgenol.2008;190:1492–1494.
Diagnóstico de tumores.
2. Parámetros:
Debemos analizar los siguientes aspectos de la lesión:
1) Identificar el hueso o huesos comprometidos;
2) En cuanto al número de heridos:
2.1) Localizado en un hueso: monotópico;
2.2) Lesión en varios huesos: monotópica y poliostótica;
2.3) Lesiones múltiples en un hueso: politópicas y monostóticas;
2.4) Lesiones múltiples en diferentes huesos: politópicas y poliostóticas.
3) Respecto a la localización en el hueso:
3.1) Epífisis, metáfisis o diáfisis;
3.2) Región cortical, esponjosa, subperióstica, paraóstica o yuxtacortical;
3.3) Central o excéntrica.
4) Límites de la lesión ósea:
4.1) Precisa, imprecisa, infiltrativa o permeativa, rodeada o no de esclerosis reaccionaria;
4.2) Va más allá de la corteza con una lesión extraósea;
4.3) Llega a los tejidos blandos (sí/no) (desplaza/infiltra);
4.4) Supera la línea de crecimiento.
5) Respecto a otros aspectos de la lesión:
5.1) Destructivo (osteolítico)
5.2) Condensante u osteogénico
5.3) Multiloculado, “en pompas de jabón”
5.4) Calcificaciones: focales, difusas, estriadas
6) Tipo de reacción perióstica:
6.1) En rodajas finas – “con piel de cebolla”
6.2) En láminas gruesas
6.3) Espiculadas – “en los rayos del sol” o “en un peine”
6.4) Estudio perióstico interrumpido por el tumor – Triángulo de Codman
3. Diagnóstico:
Métodos de estudio para el examen anatómico patológico:
Citología:
Es el estudio de células descamadas obtenidas de secreciones, excreciones u obtenidas con agujas y realizando “imprints” (impresión de fragmentos de tejido en portaobjetos). Rara vez debe usarse para diagnosticar neoplasia ósea. Su importancia radica principalmente en la correlación citohistológica.
Biopsia por punción:
Recolección de material con trefinas para inclusión en parafina y examen microscópico. Aunque el material obtenido por este método es pequeño, cuando es recolectado de un área importante de la neoplasia y por un ortopedista con experiencia en el manejo de estas lesiones, posibilita un diagnóstico definitivo. El lugar de obtención de este material debe ser planificado por el cirujano, con el fin de evitar la alteración del equilibrio del tumor en los tejidos vecinos, evitando su diseminación.
Biopsia incisional:
Es el método más utilizado para diagnosticar tumores óseos. Se debe planificar el sitio de la biopsia, no sólo en términos del área que permitirá un mejor diagnóstico histológico sino también para predecir la resección futura del tumor, que debe incluir la piel de la región biopsiada. La biopsia no debe realizarse en localizaciones inadecuadas del tumor, como zonas de necrosis, hemorragia, triángulo de Codman o en zonas que sólo presenten esclerosis ósea reaccional peritumoral.
biopsia congelada
Se realiza durante el procedimiento quirúrgico. Este método no se recomienda cuando hay tejido óseo. En esta situación, la posibilidad de que se produzca un error de diagnóstico es alta. Los errores diagnósticos en numerosas lesiones óseas con células gigantes multinucleadas, en los diversos tumores de células indiferenciadas, de células pequeñas y de células redondas, la imposibilidad de un diagnóstico diferencial histológico cuando existe tejido óseo neoformado en el callo de fractura, el osteosarcoma y la miositis osificante, son algunos Ejemplos que contraindican el método. El examen congelado puede ser útil en casos de lesiones metastásicas y aun así, la velocidad del método no alterará el abordaje operatorio.
Estudio microscópico:
Los fragmentos obtenidos por punción o biopsia incisional deben incluirse en parafina y posteriormente teñirse con hematoxilina-eosina. Para el diagnóstico diferencial se suelen utilizar métodos especiales como el PAS (ácido de Schiff periódico) y la impregnación con plata para estudiar la reticulina, por ejemplo, entre sarcoma de Ewing, linfomas y PNET (tumor neuroectodérmico primitivo). El PAS, que demuestra glucógeno y una cantidad escasa de reticulina, es común para diagnosticar el sarcoma de Ewing. En los Linfomas la reticulina es abundante y el PAS es negativo. Las técnicas de inmunohistoquímica con inmunoperoxidasa están entrando en la rutina de los exámenes anatomopatológicos. Están indicados principalmente en la búsqueda del diagnóstico del órgano de origen de neoplasias metastásicas en los huesos. El uso de marcadores que permiten identificar el origen de la célula neoplásica es cada vez más utilizado en la práctica diaria. Algunos ejemplos son el PSA, para identificar neoplasias originadas en la próstata, CK7 para neoplasias primitivas de pulmón, CK20 para neoplasias primitivas del tracto digestivo y receptores de estrógenos y progesterona para neoplasias de mama.
Piezas quirúrgicas:
Rutinariamente se debe examinar una muestra quirúrgica externamente y en los cortes. Externamente para análisis de márgenes quirúrgicos con el fin de verificar si la neoplasia fue extirpada por completo. En los cortes comprobamos la afectación del hueso, extensión y dimensiones de la neoplasia y sus principales caracteres macroscópicos para un adecuado estudio microscópico. (Figura 1)
Cuando el estudio de una resección quirúrgica es de un paciente sometido a quimioterapia preoperatoria, particularmente en osteosarcoma y sarcoma de Ewing, el estudio de la pieza debe seguir un examen sistematizado, ya que el objetivo es analizar la respuesta de la neoplasia a la terapia. Las etapas del estudio serán las siguientes:
A) Se realizarán cortes de la pieza quirúrgica en toda su longitud con un espesor máximo de 0,5 cm,
B) Uno o más cortes deben reproducirse en un “escáner” de computadora o fotografiarse y radiografiarse,
C) Esta reproducción debe ser cuadriculada desde el extremo proximal al distal,
D) Los fragmentos de cada zona accidentada deben examinarse minuciosamente al microscopio para cuantificar la necrosis de la neoplasia y la persistencia de células tumorales histológicamente viables,
E) El informe final del estudio de toda la muestra debe calificarse según la respuesta a la quimioterapia preoperatoria según los criterios de Huvos.
Criterios de Huvos:
Grado I: hasta un 50% de necrosis tumoral;
Grado II: 50 a 90% de necrosis tumoral;
Grado III: más del 90% de necrosis;
Grado IV: 100% necrosis tumoral – Ausencia de células neoplásicas histológicamente viables.
Con esta titulación, el oncólogo podrá orientar el tratamiento postoperatorio teniendo en cuenta el peor pronóstico estadístico en los casos de grúas I y II y mejor en los de III y IV.
Diagnóstico dos tumores
2. Parâmetros:
Devemos analisar os seguintes aspectos da lesão:
1) Identificar o osso ou ossos comprometidos;
2) Quanto ao número de lesões:
2.1) Localizada em um osso: monotópica;
2.2) Uma lesão em diversos ossos: monotópica e poliostótica;
2.3) Múltiplas lesões em um osso: politópica e monostótica;
2.4) Múltiplas lesões em diversos ossos: politópica e poliostótica.
3) Quanto à localização no osso:
3.1) Epífise, metáfise ou diáfisa;
3.2) Região cortical, esponjosa, subperiostal, paraosteal ou justa-cortical;
3.3) Central ou excêntrica.
4) Limites da lesão no osso:
4.1) Precisos, imprecisos, infiltrativo ou permeativo, circundado ou não por esclerose reacional;
4.2) Ultrapassa a cortical com lesão extra-óssea;
4.3) Atinge as partes moles (sim/não) (desloca/infiltra);
4,4) Ultrapassa a linha de crescimento.
5) Quanto ais aspectos da lesão:
5.1) Destrutiva (osteolítica)
5.2) Condensante ou osteogênica
5.3) Multiloculada, “em bolhas de sabão”
5.4) Calcificações: focais, difusas, estriadas
6) Tipo de reação periostal:
6.1) Em lâminas finas – “em casca de cebola”
6.2) Em lâminas grossas
6.3) Espiculadas – “em raios de sol” ou “em pente”
6.4) Levantamento periostal interrompido pelo tumor – Triângulo de Codman
3. Diagnóstico:
Métodos de estudo para exame anátomo patológico:
Citologia:
É o estudo de células descamadas obtidas em secreções, excreções ou obtidas com agulhas e realizando-se “imprints” (impressão de fragmentos de tecidos em lâminas). Raramente devera ser utilizado para diagnóstico de uma neoplasia óssea. Sua importância reside principalmente, na correlação cito-histológica.
Punção-biópsia:
Coleta de material com trefinas para inclusão em parafina e exame microscópico. Embora o material obtido por este método seja pequeno, quando é colhido em área significativa da neoplasia e por ortopedista com experiências no manuseio destas lesões, possibilita o diagnóstico definitivo. O local de obtenção deste material deve ser planejado pelo cirurgião, a fim de impedir ruptura do equilíbrio do tumor nos tecidos vizinhos, evitando sua disseminação.
Biópsia incisional:
É o método mais utilizado para diagnóstico de tumores ósseos. O local da biópsia deve ser planejado, não só quanto à área que possibilitará melhor diagnóstico histológico como para prever a futura ressecção do tumor, na qual deverá ser incluída a pele da região biopsiada. A biópsia não deverá ser realizada em locais inadequados do tumor como áreas de necrose, hemorragia, no triângulo de Codman ou em áreas que apresentam apenas esclerose óssea reacional peritumoral.
Biópsia de congelação
É realizada durante o ato cirúrgico. Este método não é indicado quando existir tecido ósseo. A possibilidade de erro diagnóstico é grande, nesta situação. Os erros de diagnóstico nas numerosas lesões ósseas com células gigantes multinucleadas, nos diversos tumores de células indiferenciadas, de células pequenas e redondas, a impossibilidade de diagnóstico diferencial histológico quando há tecido ósseo neoformado no calo de fratura, osteossarcoma e miosite ossificante, são alguns exemplos que contra-indicam o método. O exame em congelação poderá ser útil em casos de lesões metastáticas e mesmo assim, a rapidez do método não alterará a conduta operatória.
Estudo microscópico:
Os fragmentos obtidos por punção ou biópsia incisional devem ser incluídos em parafina e posteriormente faz-se a coloração com hematoxilina-eosina. Métodos especiais como PAS (Acido periódico de Schiff) e impregnação pela prata para estudo da reticulina são usualmente utilizados para diagnóstico diferencial, por exemplo, entre Sarcoma de Ewing, Linfomas e PNET (Tumor neuroectodérmico primitivo). O PAS, demostrando glicogênio e a escassa quantidade de reticulina, são usuais para diagnóstico de sarcoma de Ewing. Nos Linfomas a reticulina é abundante e o PAS é negativo. Técnicas de imuno-histoquímica com imunoperoxidase estão entrando na rotina dos exames anatomopatológicos. São principalmente indicadas na procura do diagnóstico do órgão de origem de neoplasias metastáticas nos ossos. O uso de marcadores que permitem identificar a origem da célula neoplásica é cada vez mais usado na prática diária. Exemplos são o PSA, para identificar neoplasia originária da próstata, CK7 para neoplasia primitiva do pulmão, CK20 para neoplasia primitiva do tudo digestivo e receptores de estrógeno e progesterona para neoplasia da mama.
Peças cirúrgicas:
Rotineiramente uma peça cirúrgica deve ser examinada externamente e aos cortes. Externamente para análise das margens cirúrgicas com a finalidade de se verificar se a neoplasia foi completamente extirpada. Aos cortes verificamos o comprometimento do osso, extensão e dimensões da neoplasia e seus caracteres macroscópicos principais para adequado estudo microscópico. (Figura 1)
Quando o estudo de uma ressecção cirúrgica for de paciente submetido a quimioterapia pré-operatória, particularmente no osteossarcoma e no sarcoma de Ewing, o estudo da peça deverá obedecer uma sistematização de exame, pois a finalidade é analisar a resposta da neoplasia à terapêutica. As etapas do estudo serão as seguintes:
A) Serão feitas fatias da peça cirúrgica em toda sua extensão com espessura máxima de 0,5 cm,
B) Uma ou mais fatias deverão ser reproduzidas em “scanner” de computador ou fotografadas e radiografadas,
C) Esta reprodução deverá ser quadriculada da extremidade proximal até a distal,
D) Os fragmentos de cada área quadriculada deverão ser minuciosamente examinados ao microscópico com a finalidade de quantificar a necrose da neoplasia e a persistência de células tumorais histológicamente viáveis,
E) O relatório final do estudo de toda a peça deverá ser graduado quanto à resposta de quimioterapia pré-operatória nos critérios de Huvos.
Critérios de Huvos:
Grau I: Até 50% de necrose tumoral;
Grau II: de 50 a 90/% de necrose tumoral;
Grau III: Acima de 90% de necrose;
Grau IV: 100% de necrose tumoral – Ausência de células neoplásicas histológicamente viáveis.
Com esta graduação o oncologista poderá orientar o tratamento pós-operatório tendo em vista o pior prognóstico estatístico nos casos de gruas I e II e melhor nos de III e IV.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
Granuloma eosinofílico – Lesión pseudotumoral
Farber y Green, en 1942, demostraron que la lesión podía ocurrir de forma localizada o múltiple en el esqueleto y posiblemente estar relacionada con la enfermedad de Hand-Schuller-Christian y la enfermedad de Letter-Siwe3.
En 1944, Jaffe y Lichtenstein introdujeron el término granuloma eosinofílico del hueso4. La relación de esta lesión con las formas sistémicas de la enfermedad fue confirmada por Lichtenstein en su publicación de 1953, englobándolas bajo el nombre de Histiocitosis X5.
Actualmente, esta entidad se denomina Histiocitosis de Células de Langerhans, la cual presenta cuatro formas clínicas distintas: Granuloma Eosinofílico, forma restringida al esqueleto, que puede ser localizada o múltiple; Hand-Schuller-Christian, forma crónica y diseminada; Letter-Siwe, forma diseminada aguda o subaguda y Hashimoto-Pritzker, forma posnatal con resolución espontánea6.
Introducción: El granuloma eosinofílico solitario del hueso es la más común de las cuatro formas de presentación de la Histiocitosis de Células de Langerhans, representando entre el 60% y el 80% de los casos7.
Entre las lesiones óseas benignas, es una entidad rara, representando menos del 1%8. Afecta preferentemente a niños y adolescentes con predominio masculino 2:19. Alrededor del 80% de los pacientes tienen menos de 21 años y la mayoría de ellos tienen entre cinco y 15 años6,7,9.
Algunos pacientes pueden comenzar con una lesión ósea aislada y luego desarrollar múltiples lesiones óseas. Estos casos pueden eventualmente evolucionar hacia formas sistémicas de la enfermedad. Cuando esto ocurre, suele ocurrir dentro de los primeros seis meses del diagnóstico y prácticamente nunca después del año de evolución, lo que es criterio de buen pronóstico, cuando no aparecen nuevas lesiones después de este período de seguimiento clínico10.
El síndrome de Hand-Schuller-Christian es la forma crónica de histiocitosis de células de Langerhans, caracterizada por afectación sistémica con múltiples lesiones óseas, principalmente en cráneo, exoftalmos y diabetes insípida, afectando a niños mayores de 3 años10.
El Síndrome de Letter-Siwe afecta a niños menores de tres años, es la forma aguda o subaguda, también con afectación sistémica. Se presenta con fiebre, otitis media, infecciones bacterianas recurrentes, anemia, hemorragias, viceromegalia, adenopatías difusas y dolorosas con afectación cutánea similar al eccema seborreico y lesiones ostelíticas generalizadas, con frecuente progresión a la muerte10.
El síndrome de Hashimoto-Pritzker es una forma de histiocitosis de células de Langerhans que afecta exclusivamente a la piel. Afecta a niños en el primer mes de vida, manifestándose con erupciones eccematosas que se resuelven espontáneamente6.
Etiología: Desconocida.
Genética: No hay informes significativos al respecto.
Definición: El granuloma eosinofílico es una lesión pseudotumoral, de etiología desconocida, caracterizada por rarefacción ósea que puede ser solitaria o múltiple. Microscópicamente presenta un perfil de células histiocíticas mononucleares, presentando antígenos de origen dendrítico, conocidos como células de Langerhans, en medio de una cantidad variable de leucocitos, eosinófilos, linfocitos y células gigantes.
Epidemiología: El Granuloma Eosinofílico afecta principalmente al esqueleto axial, en este orden: cráneo, pelvis, vértebras, costillas, mandíbula, clavícula y escápula.
En el esqueleto apendicular el fémur, región proximal y diáfisis, húmero y tibia9. La mayoría de las veces afecta a la diáfisis o región metadiafisaria, siendo rara en la epífisis7.
La columna representa el 10% de los casos en la población pediátrica, la mayoría en la región lumbar.
En adultos ocurre con mayor frecuencia en las costillas y con menor frecuencia en la columna, respectivamente 25% y 3%6.
Cuadro clínico: El síntoma más frecuente del Granuloma Eosinofílico es el dolor localizado, pulsátil, de corta duración, que empeora por la noche asociado a calor local y edema. Cuando afecta al cráneo, este dolor puede confundirse con otras causas de dolor de cabeza.
El compromiso de los cuerpos vertebrales puede producir una escoliosis dolorosa. Las desviaciones angulares son pequeñas, inferiores a 100, ya que el aplanamiento vertebral suele ser uniforme y rara vez produce síntomas neurológicos.
En otras formas de histiocitosis de células de Langerhans, pueden presentarse síntomas sistémicos como fiebre, erupciones cutáneas y diabetes insípida. La hepatoesplenomegalia puede ocurrir en el síndrome de Letter-Siwe, que es la forma más grave de la enfermedad6
Clasificación: El granuloma eosinofílico puede manifestarse en dos formas clínicas: Solitario o Múltiple .
Pruebas de laboratorio: los cambios de laboratorio que se pueden encontrar son un aumento en la VSG y la PCR, y ocasionalmente puede ocurrir una eosinofilia leve en el recuento sanguíneo.
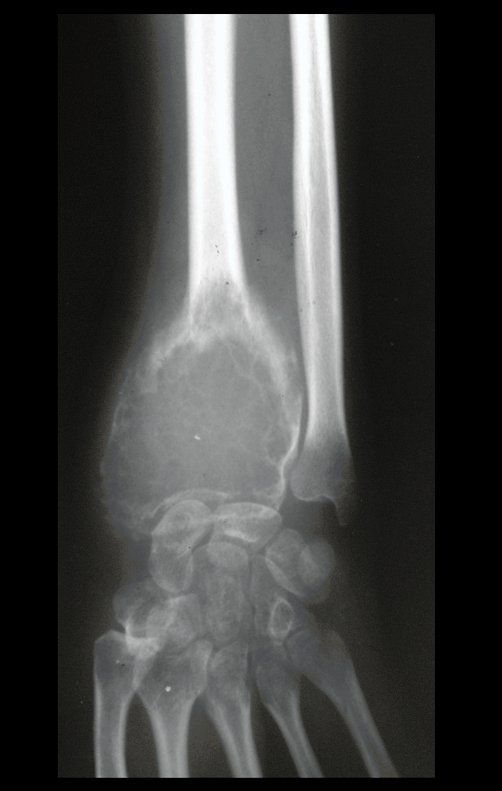
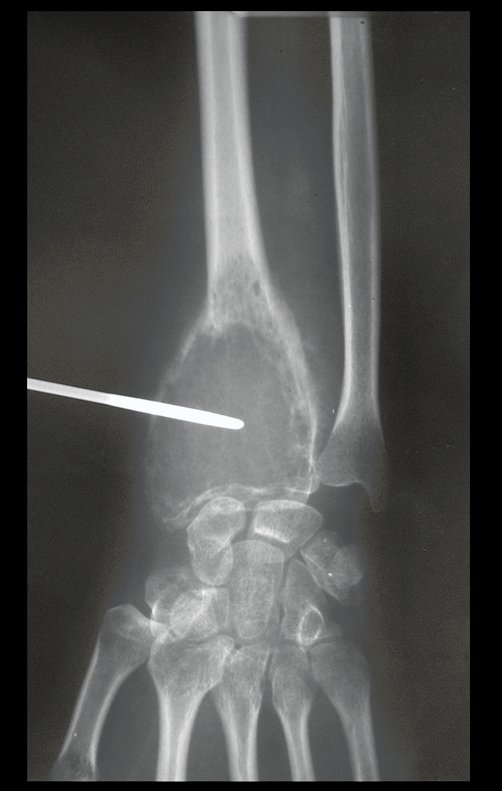
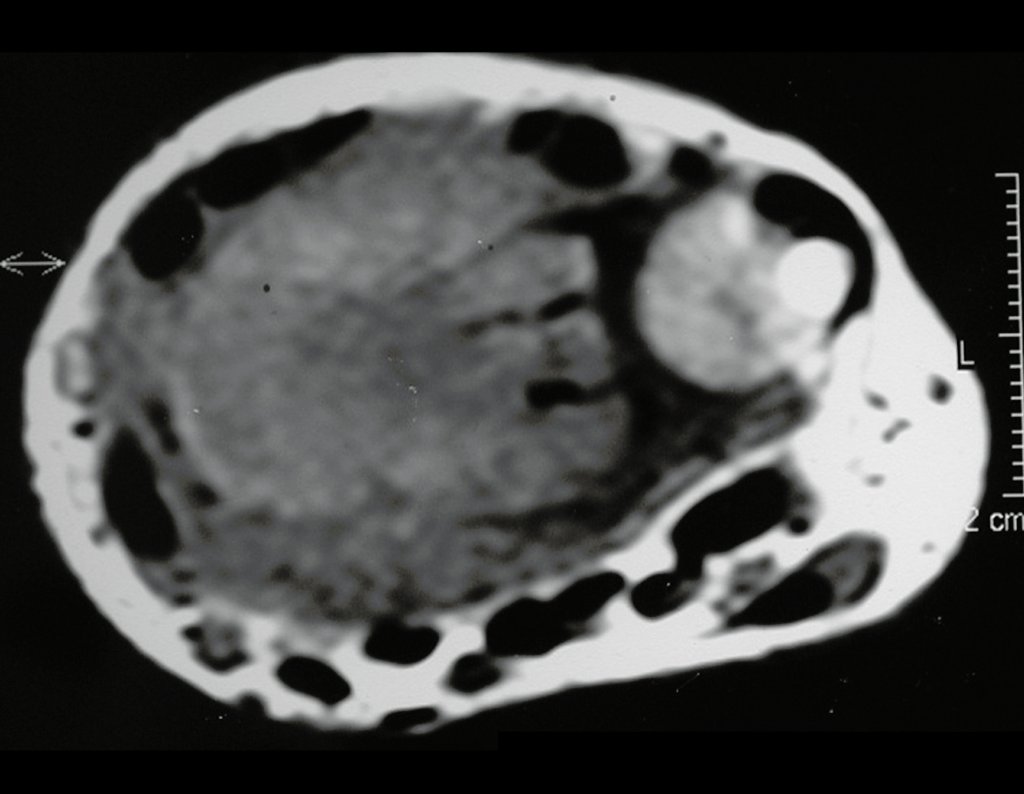
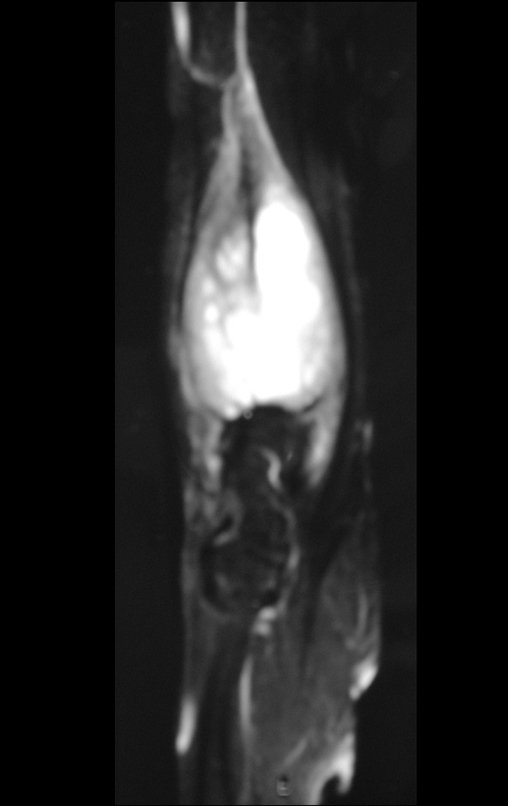
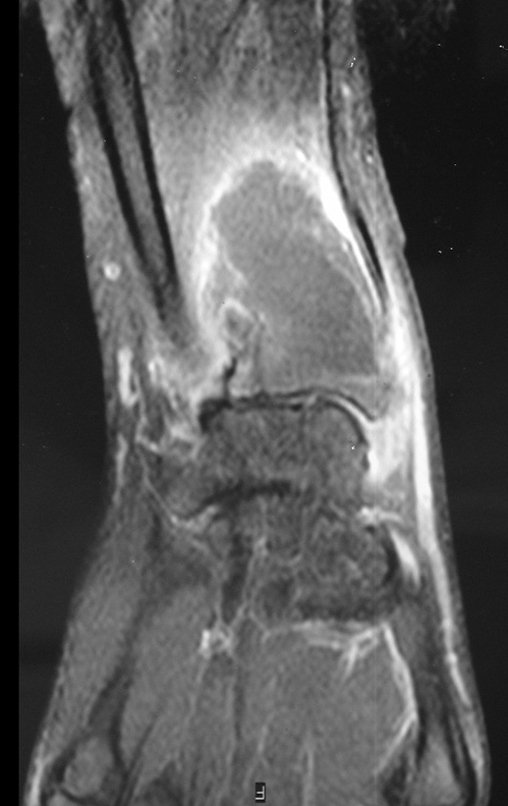
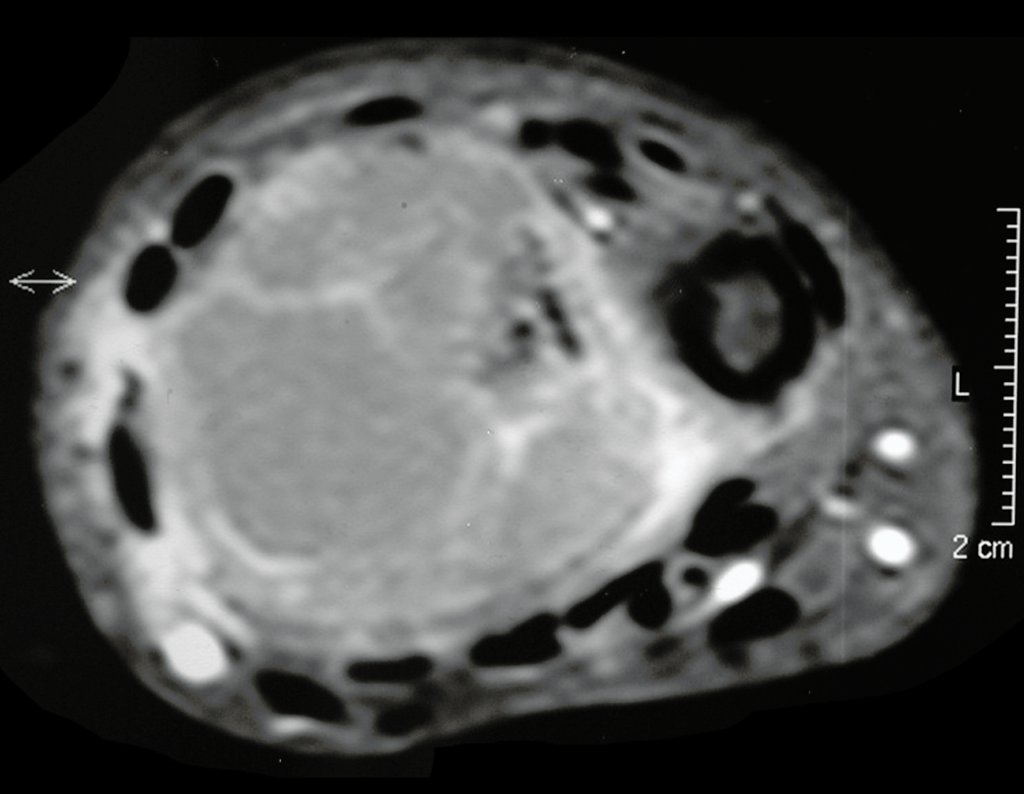
Pruebas de imagen: La imagen radiográfica es de rarefacción ósea, redondeada u ovalada, que comienza en el hueso medular y progresa con erosión del hueso cortical.
En la fase inicial los bordes son irregulares y poco definidos.
En la fase tardía, puede producirse una ligera esclerosis alrededor de la lesión. En los huesos largos hay una reacción perióstica evidente que se manifiesta como múltiples capas laminares gruesas, lo que caracteriza lesiones benignas de evolución lenta o la reacción de la osteomielitis.
Este tipo de reacción perióstica sólida diferencia al Granuloma Eosinofílico del Sarcoma de Ewing, donde la reacción perióstica es laminar delgada, debido a la rápida evolución del tumor maligno.
Otra diferencia radiográfica entre estas dos lesiones es que el tumor de Ewing presenta tempranamente tejido tumoral extracortical, de gran volumen, lo que no ocurre en el Granuloma Eosinofílico.
En huesos planos, como el cráneo o la pelvis, la erosión afecta a ambas cortezas de forma irregular y asimétrica, produciendo la impresión visual de un agujero dentro de otro agujero, lo que se denomina lesión de doble contorno.
En la mandíbula, la destrucción del hueso alveolar produce la impresión radiográfica de dientes flotantes.
En la columna, la enfermedad afecta al cuerpo vertebral, produciéndose un aplanamiento en un 15% de los casos, produciéndose la llamada vértebra plana de Calvè6. Los elementos posteriores y los discos intervertebrales se conservan, incluso cuando la lesión se produce en más de una vértebra.
Anatomía patológica:
Aspecto macroscópico: tiene consistencia blanda, gelatinosa, de color amarillento, es común la licuefacción necrótica.
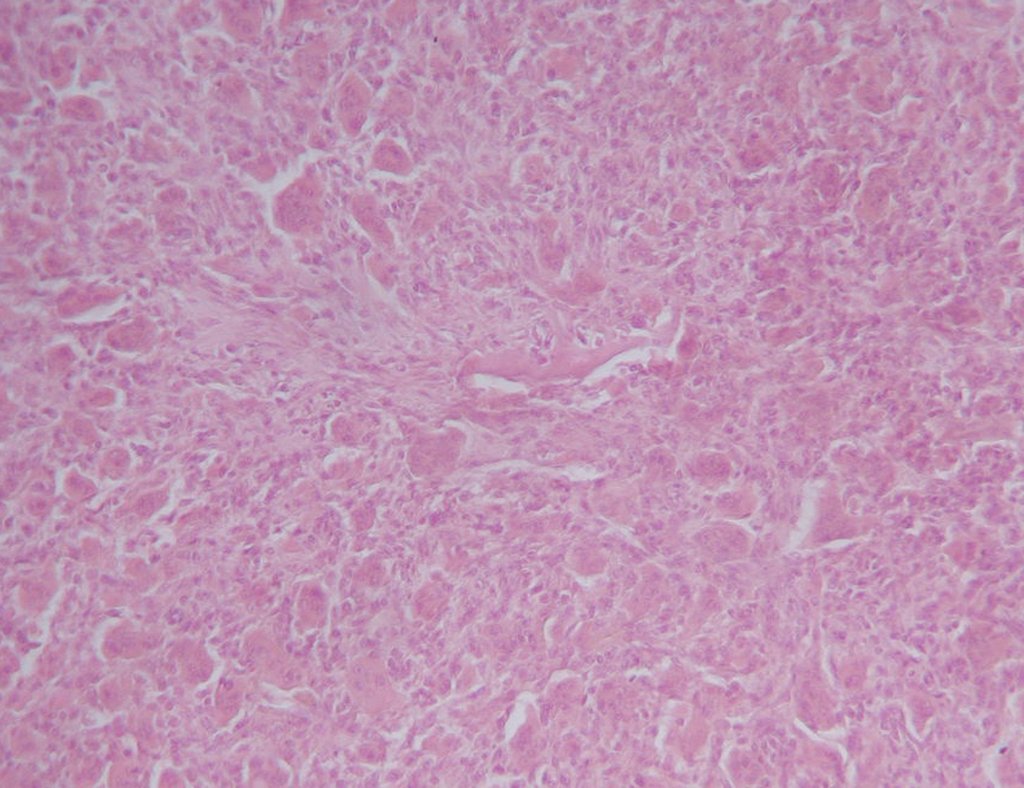
Aspecto microscópico: Aparecen como cúmulos de células histiocíticas de gran tamaño, con citoplasma ligeramente basófilo, nucléolos globosos, lobulados o dentados, en estos casos similares a un grano de frijol, que corresponden a células de Langerhans.
Estos cúmulos se intercalan con células gigantes, linfocitos, numerosos eosinófilos y zonas de necrosis, simulando un absceso. La microscopía electrónica presenta gránulos citoplasmáticos típicos llamados cuerpos de Birbeck11,12.
La inmunohistoquímica muestra positividad para proteína S-100, vimentina y CD1a11,13.
Diagnóstico:
Diagnóstico diferencial: Los principales diagnósticos diferenciales radiológicos del Granuloma Eosinofílico son la Osteomielitis y el Tumor de Ewing.
Cuando la lesión se produce en el cráneo hay que diferenciarla de un quiste epidermoide o de una metástasis. Los principales diagnósticos diferenciales histológicos son la Osteomielitis y el Linfoma.
Puesta en escena:
Tratamiento: La literatura presenta informes de que el tratamiento expectante o la biopsia sola pueden estar indicados como una estrategia terapéutica eficaz para lesiones esqueléticas aisladas7,14.
El granuloma eosionofílico puede resolverse espontáneamente, especialmente en niños. La capacidad del hueso afectado para reconstruirse existe, ya que la mayoría de los pacientes se ven afectados antes de la madurez esquelética, por lo que tienen un gran potencial de remodelación por parte de las fisis de crecimiento, que normalmente no se ven afectadas15,16.
En nuestra experiencia hubo resolución en cinco casos, que retrocedieron sólo con la biopsia percutánea. Lo mismo ocurre tras el colapso vertebral en lesiones de columna, probablemente por fuga del contenido de la lesión, asemejándose al drenaje de un absceso, siendo extremadamente rara la indicación quirúrgica en la columna. Se han reportado casos donde hubo restitución completa de la altura del cuerpo vertebral15. En nuestra serie tuvimos dos casos que presentaron esta evolución.
Aunque puede haber una resolución espontánea, el tiempo requerido es impredecible y puede haber una morbilidad significativa secundaria al dolor intenso y la limitación funcional.
Actualmente, el mejor abordaje terapéutico para el Granuloma Eosionofílico es realizar una biopsia percutánea, si es posible con diagnóstico inmediato por sección congelada, seguida de infusión intralesional de corticosteroides (metilpredinisolona – 40 mg a 120 mg dependiendo del tamaño de la lesión)7. El resultado anatomopatológico debe ser confirmado posteriormente mediante histología en bloques de parafina.
El granuloma eosionofílico puede tardar hasta tres meses en retroceder y puede ser necesario repetir la infusión6. En nuestra experiencia sólo tuvimos un caso, de lesión aislada en el húmero, que requirió complementación del tratamiento inicial en el que realizamos corticoides orales, prednisolona 5 mg/24 h, durante cuatro meses. En el granuloma eosinofílico poliostótico, se utiliza la terapia con corticosteroides sistémicos.
Cuando es necesaria una biopsia incisional, se pueden aplicar corticoides localmente tras el curetaje de la lesión, lo que facilita la resolución del proceso. Este legrado debe ser cuidadoso, realizándose abriéndolo en forma de una hendidura estrecha, longitudinal al hueso, procurando no añadir mayor fragilidad local. Con el tiempo, la cavidad se puede rellenar con un injerto óseo, pero esto generalmente es innecesario debido al gran potencial de regeneración que existe.
La radiofrecuencia fue propuesta como tratamiento percutáneo del Granuloma Eosionofílico, aplicándose en una segunda etapa, de dos a cuatro semanas después de la biopsia17. El autor restringe la técnica a pequeñas lesiones que se encuentren al menos a un centímetro de las estructuras neurales o viscerales, advirtiendo del riesgo de fracturas en los miembros que soportan carga. Este enfoque, además de aumentar los costes y provocar morbilidad local, no añade ninguna ventaja al tratamiento. La propia biopsia puede haber sido curativa, y la infusión de corticoides tiene mayor justificación, ya que está indicada tanto en casos aislados como en lesiones múltiples. Hasta el momento no existen estudios que comparen las técnicas percutáneas con la infusión de corticoides en relación al uso de radiofrecuencia que justifiquen su uso.
Históricamente, la radioterapia se utilizó en dosis bajas y fraccionadas para el tratamiento de la histiocitosis de células de Langerhans. Actualmente, la indicación de radioterapia en lesiones benignas es controvertida.
En casos de granuloma eosinofílico con más de una lesión esquelética, sin afectación visceral, puede estar indicado tratamiento sistémico por un período aproximado de seis semanas con terapia con corticosteroides (2 mg/kg) y vinblastina (6 mg/kg).
Pronóstico: Las lesiones solitarias del granuloma eosinofílico evolucionan bien en el 97% de los casos, con biopsia sola o además de infusión de corticoides o tratamiento quirúrgico 6 .
Ver también: granuloma eosinofílico del radio
Bibliografía:
1 SCHAIRER, E. Ueber eine eigenartige Erkrankung des kindlichen Schädels. Zentralbl Allg Patho Pathol. Anat., 71:113, 1938.
2 Otani S, Ehrlich JC; Granuloma solitario de hueso que simula neoplasia primaria. Soy J Pathol 16:479–90. 1940
3 Verde WT, Faber S; “granuloma eosinofílico o solitario” de hueso. J Bone Joint Surg (Am) 24:499-526. 1942
4 Jaffe HL, Lichtenstein L; Granuloma eosinofílico del hueso. Arco Pathol 37: 99-118. 1944.
5 Lichtenstein L.: Histiocitosis Patol. 56:84, 1953
6 Escuela Secundaria Schwartz. Actualización de conocimientos ortopédicos: tumores musculoesqueléticos 2. Academia Estadounidense de Cirujanos Ortopédicos, Rosemont, Illinois. Capítulo 12 (128-32), 2007
7 Mavrogenis AF, Abati CN, Bosco G, Ruggieri P. Metilprednisolona intralesional para el granuloma eosinofílico solitario doloroso del esqueleto apendicular en niños. J PediatrOrthop 2012;32:416–422
8 Chadha M, Agarwal A, Agarwal N, et al. Granuloma eosinofílico solitario del radio. Un diagnóstico diferencial inusual. Acta Orthop Belg. 2007; 73:413–417.
9 Campanacci, M. Tumores óseos y de tejidos blandos; Springer-Verlag Viena Nueva York. Segunda edición, (54); 857-75. 1999.
10 SCHAJOWICZ, F. Buenos Aires: Tumores Óseos; Talleres de editorial Médica Panamericana SA (9); 464-80. 1981.
11 CHRISTIAN, HA Defectos en huesos membranosos, exosftalmos y diabetes insípida: en un síndrome habitual de dispituitarismo: un estudio clínico. Med.Clin. Norte. Am., 3:849, 1920.
12ARCECI, RJ; BRENNER, MK; PRITCHARD, J. Controversias y nuevos enfoques para el tratamiento de la histiocitosis de células de Langerhans. Hemtol. Oncol. Clínica. Norte. Am., 12:339, 1998
13 ALBRIGHT, F.; REIFNSTEIN, EC Las glándulas paratiroides y la enfermedad metabólica. Baltmore, Williams y Wilkins, 1948.
14 Plasschaert F, Craig C, Bell R, et al. Granuloma eosinofílico. Un comportamiento diferente en los niños que en los adultos. J Bone Joint Surg Br 2002;84:870–872.
15 Greenlee JD, Fenoy AJ, Donovan KA, et al. Granuloma eosinofílico en la columna pediátrica. Neurocirujano Pediatra. 2007; 43:285–292.
16 Sessa S, Sommelet D, Lascombes P, et al. Tratamiento de la histiocitosis de células de Langerhans en niños. Experiencia en el Hospital Infantil de Nancy. J Cirugía de la articulación ósea Am. 1994; 76:1513–1525.
17 Corby RR, Stacy GS, Peabody TD, et al. Ablación por radiofrecuencia del granuloma eosinofílico solitario de hueso. Am J Roentgenol.2008;190:1492–1494.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
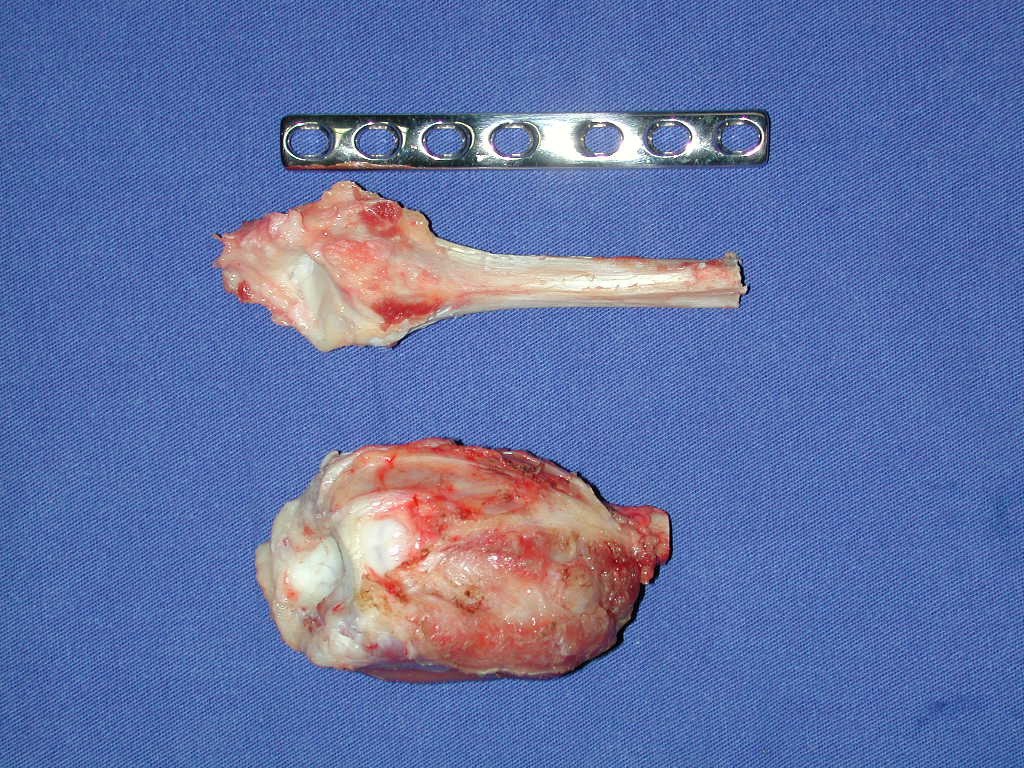
Tumor radial de células gigantes – Técnica de resección del tumor – Técnica de obtención de injerto autólogo de peroné – Técnica de reconstrucción de muñeca

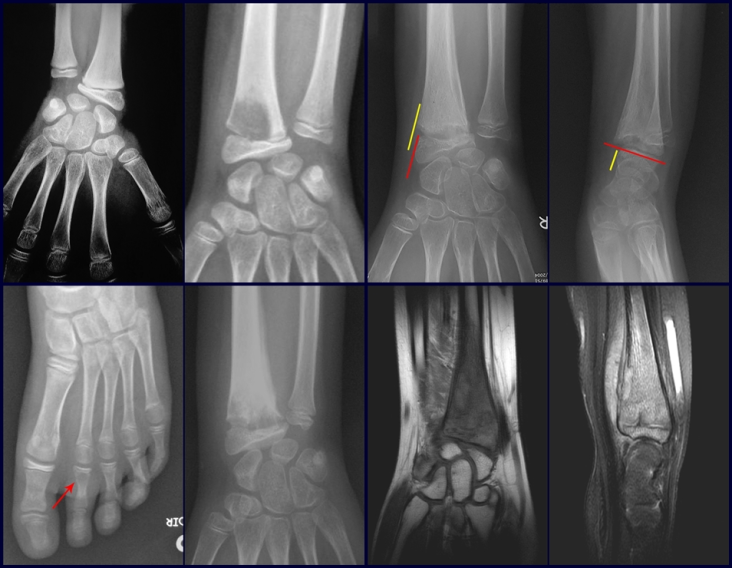
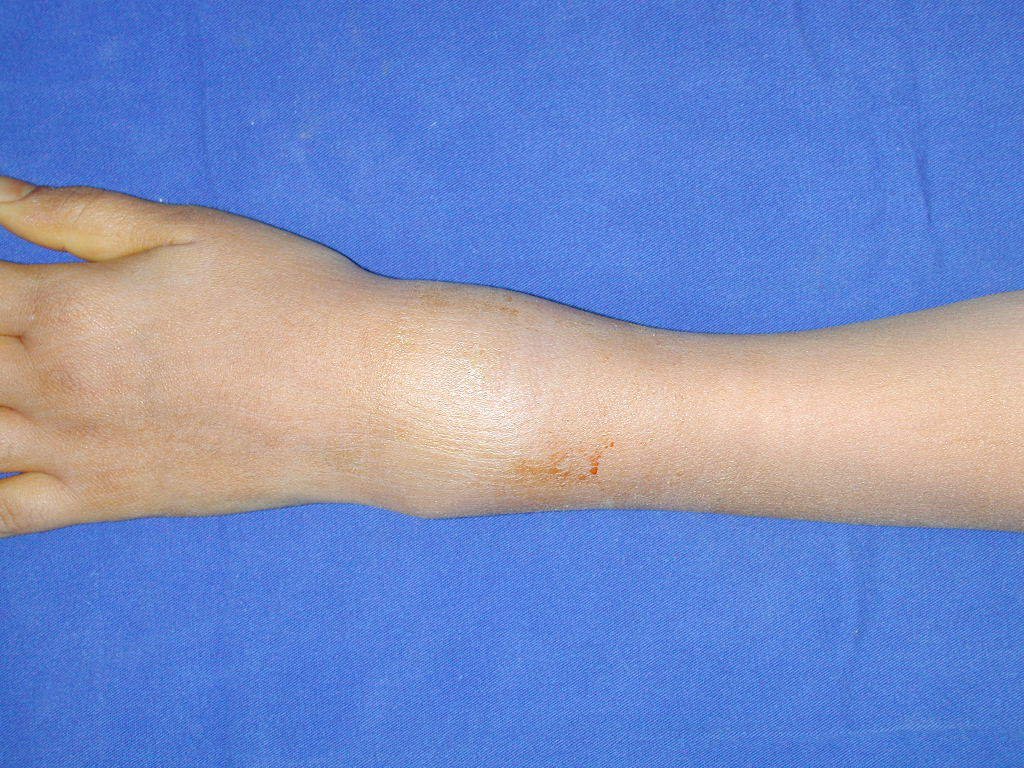
En Mayo de 2005, con sospecha de tumor de células gigantes, fue referida a un segundo hospital, cinco meses después de la primera atención. Se hizo nueva referencia ahora para nuestra atención, en Octubre del mismo año (Figuras 7 a 10).
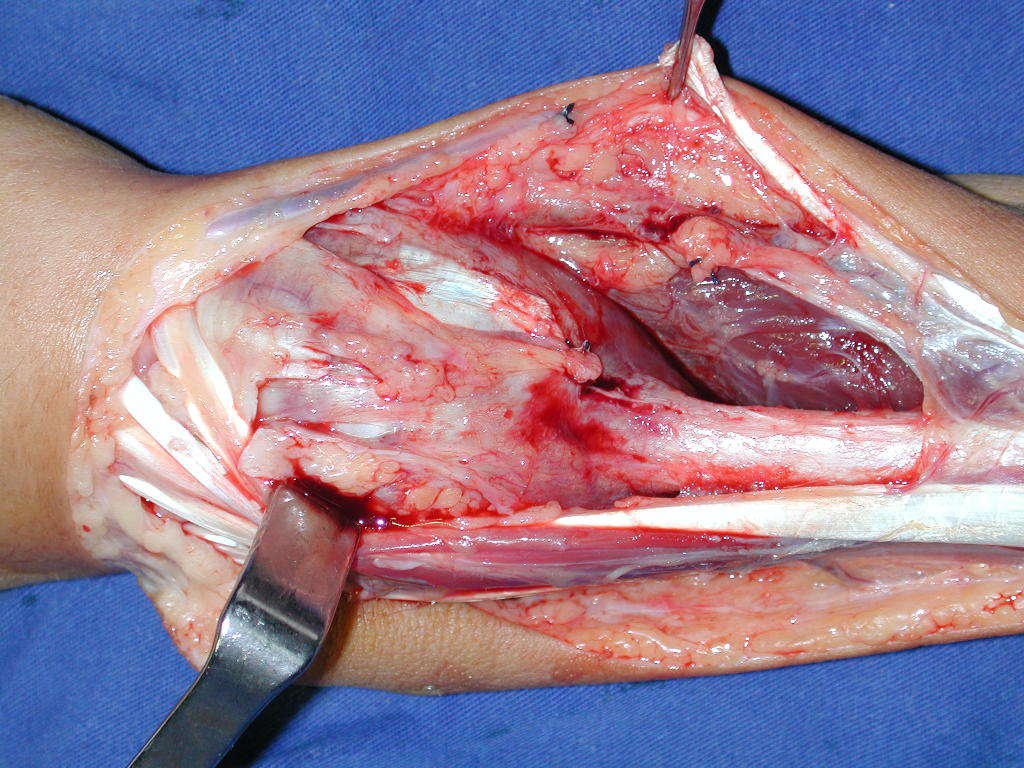
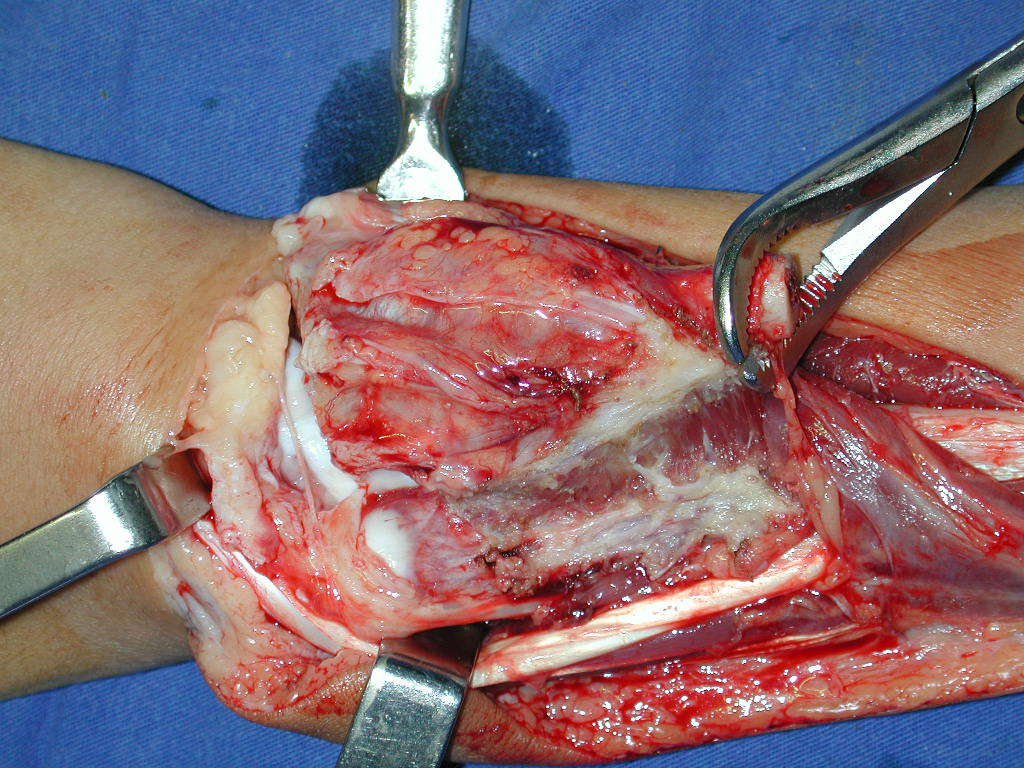
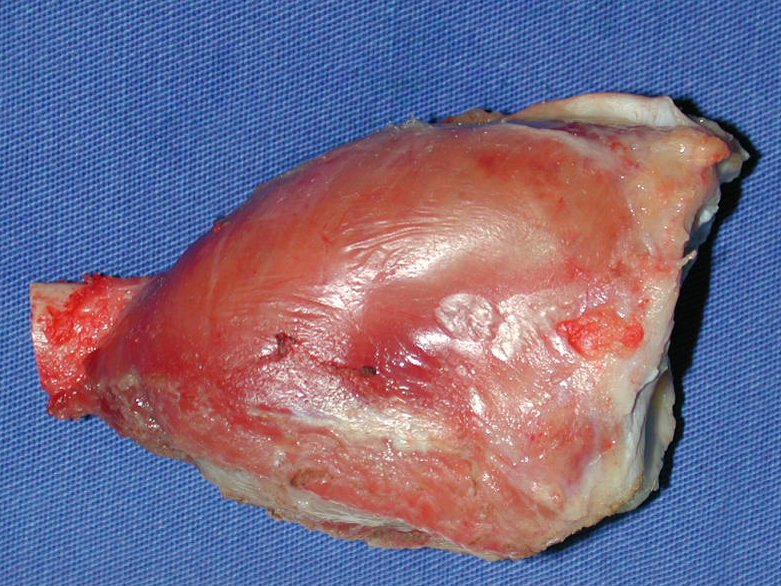
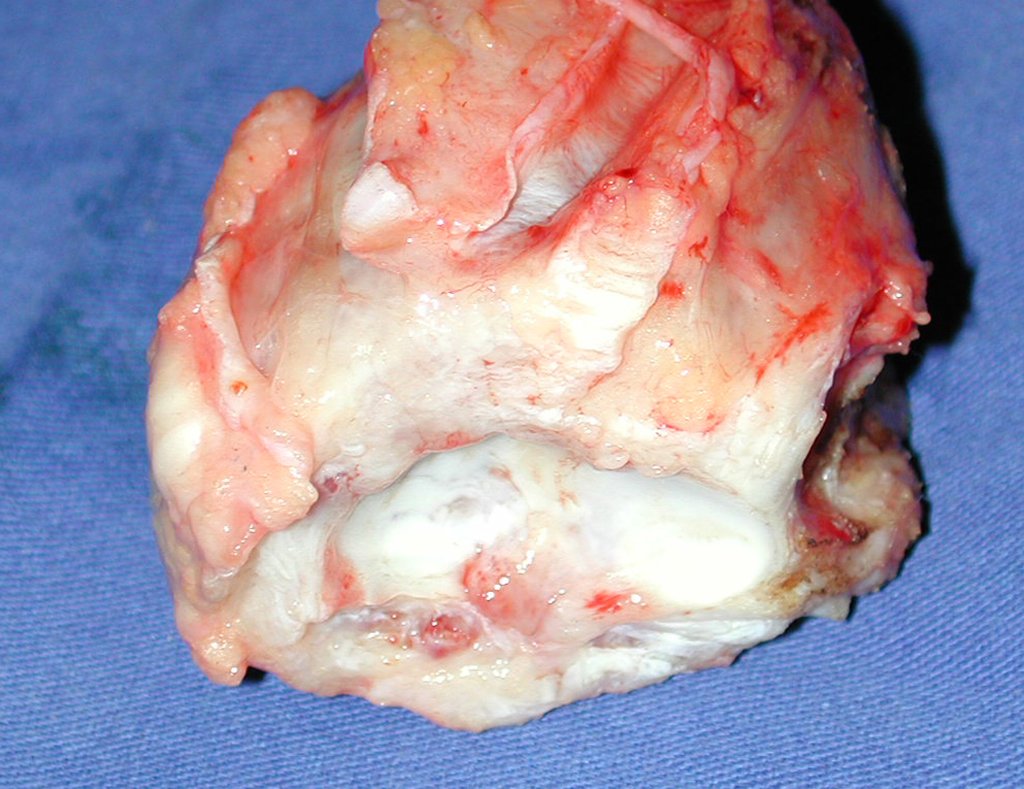
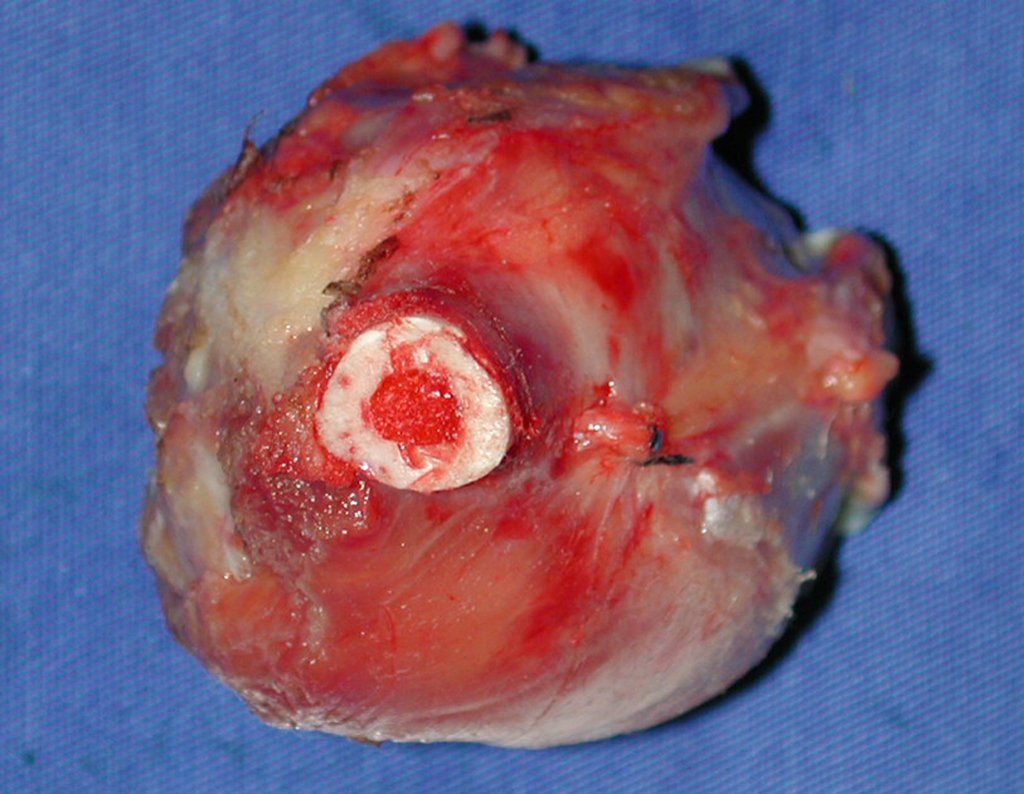
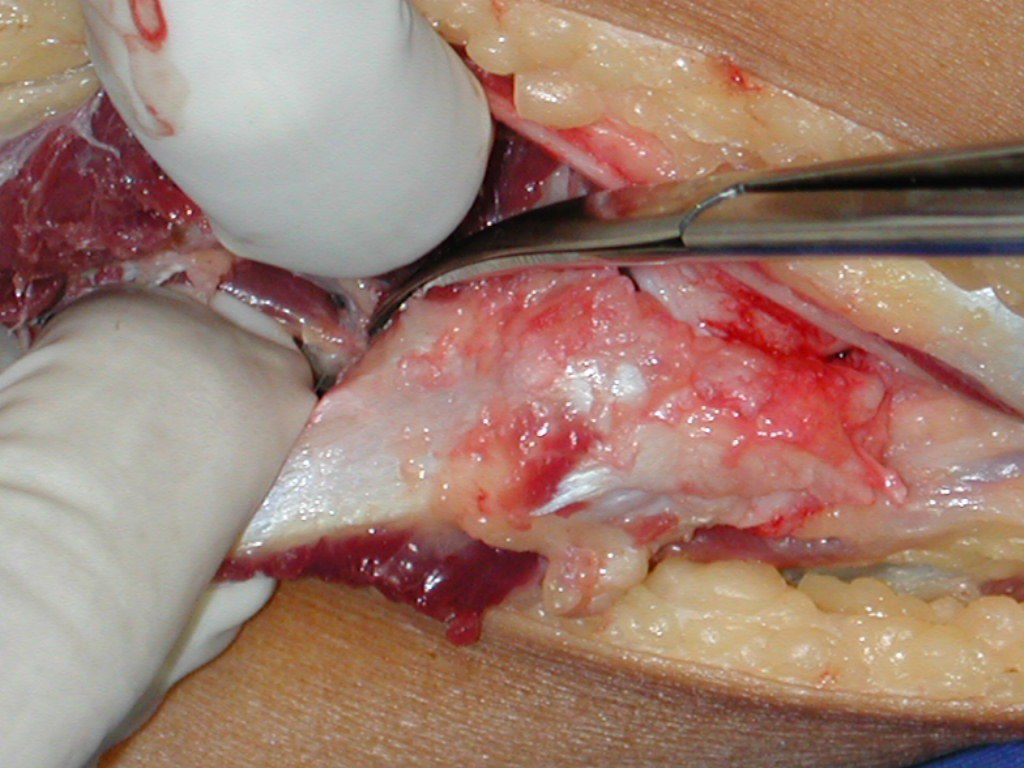
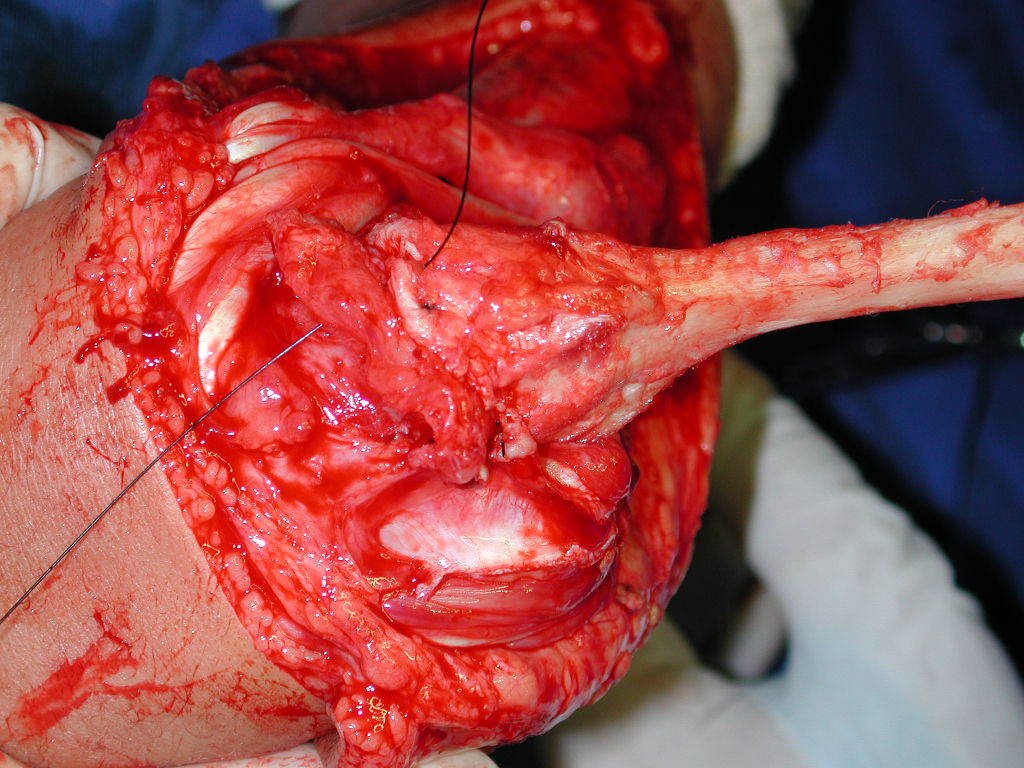
La demora de la atención compromete el tratamiento. La lesión evoluciona, destruye la estructura ósea, fractura y requiere procedimientos quirúrgicos mayores. En esta ocasión fue realizado el estadiamiento del tumor, que no presentó otro foco de enfermedad. Fue realizada la biopsia de la lesión, con aguja de Jamshidi con anestesia local y control radiológico, planificación de resección y aspecto clínico pre operatorio (Figuras 11 a 18).
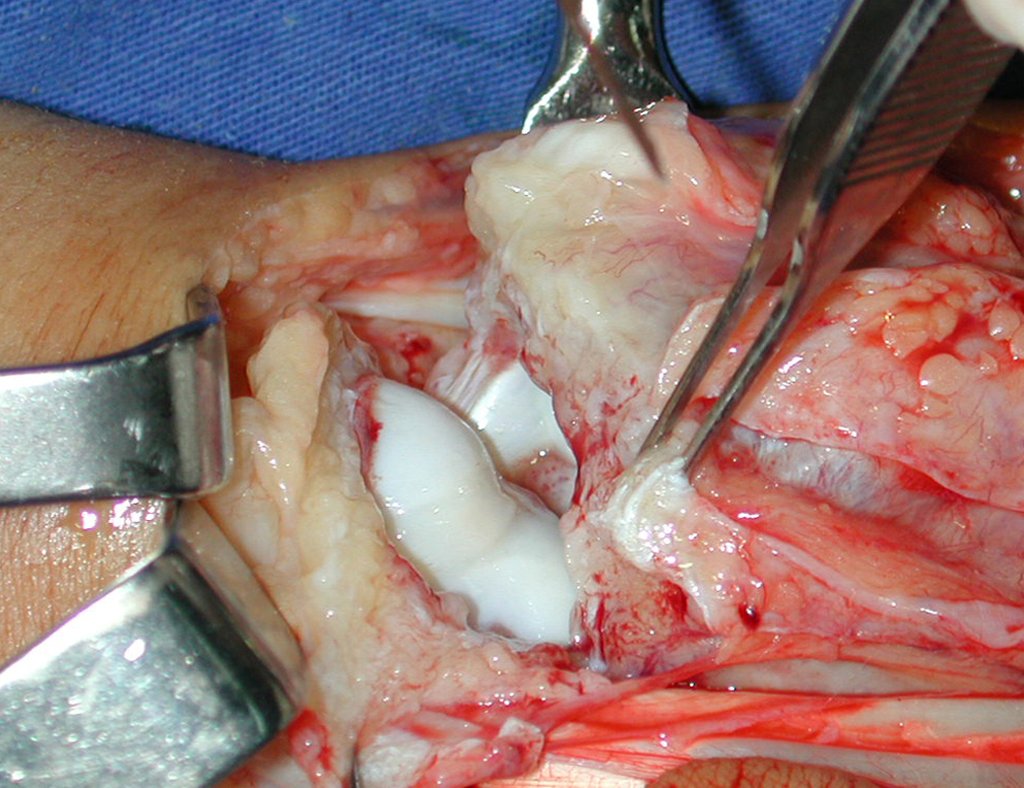
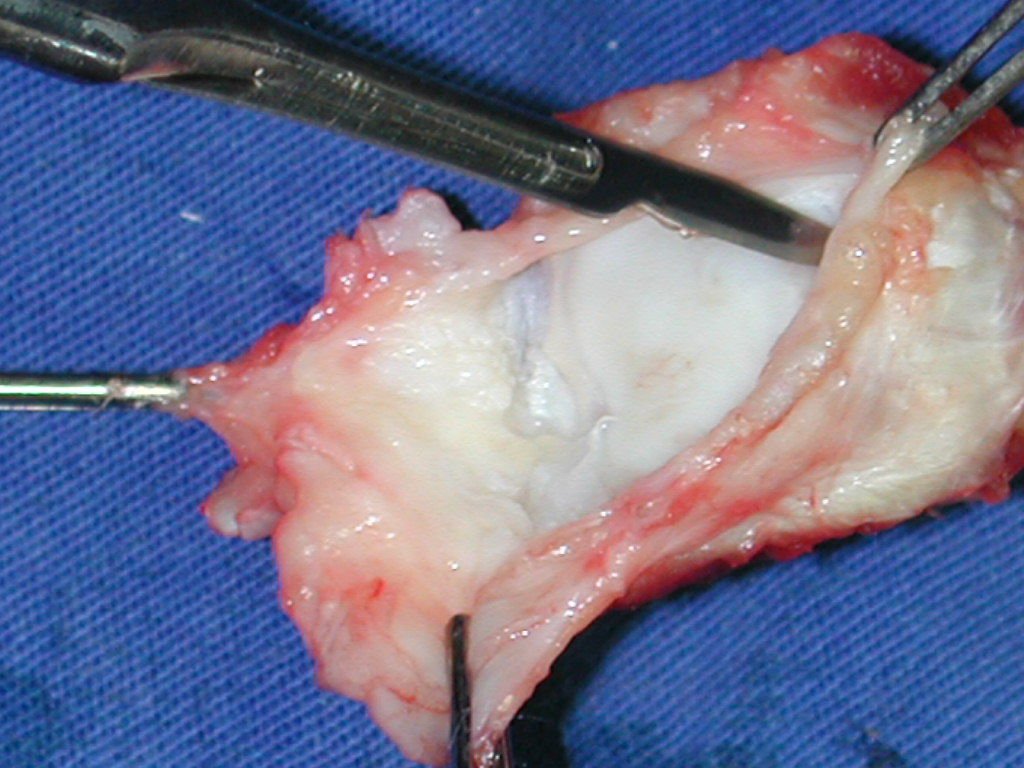
El diagnóstico histológico de la biopsia confirma la sospecha clínica de tumor de células gigantes (Figura 19 a 24).
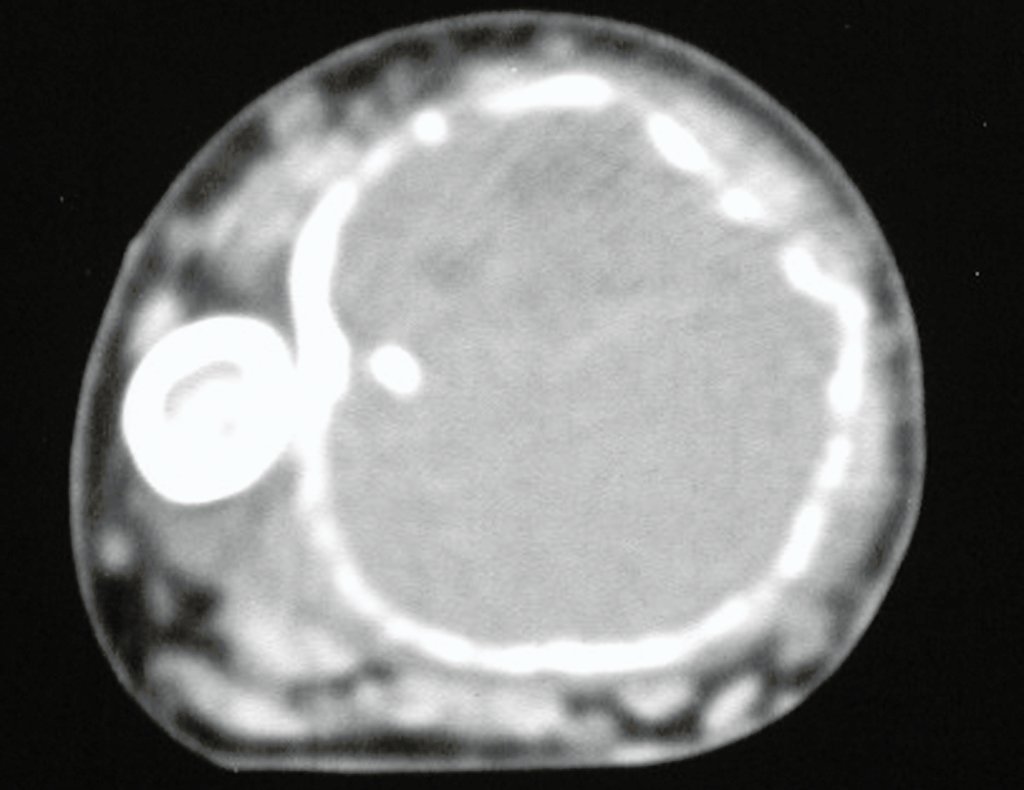
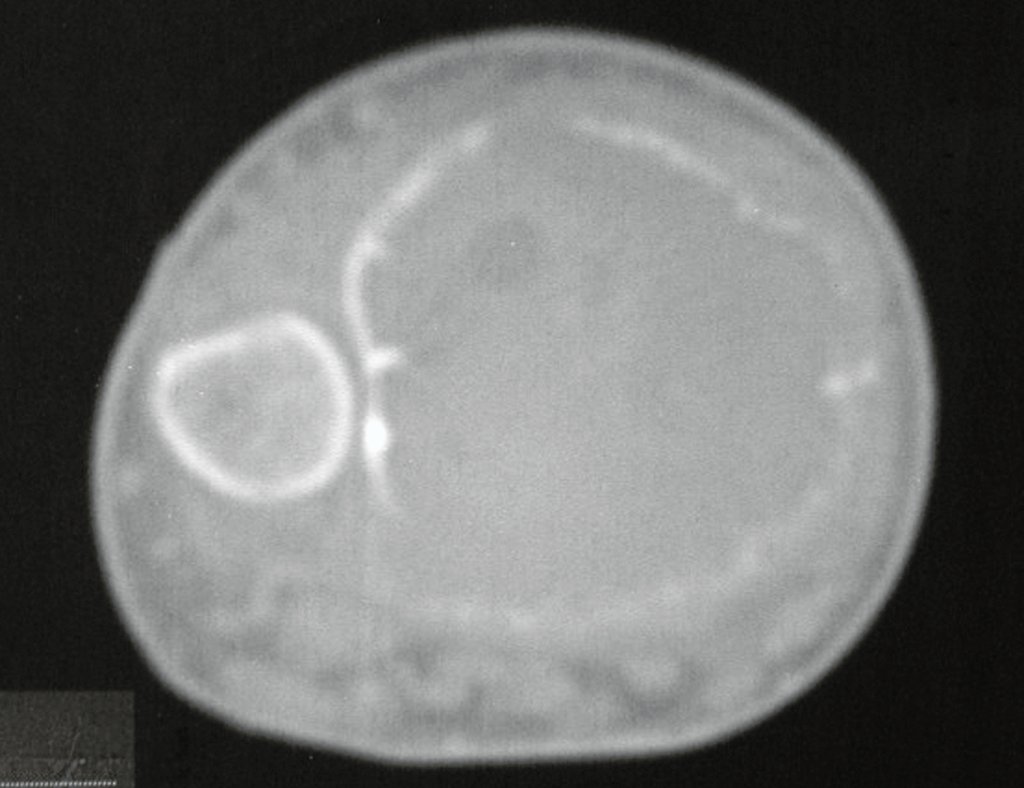
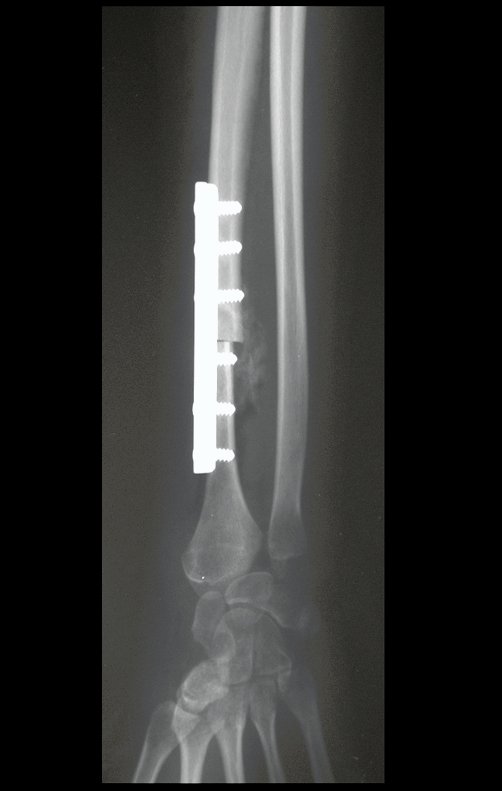
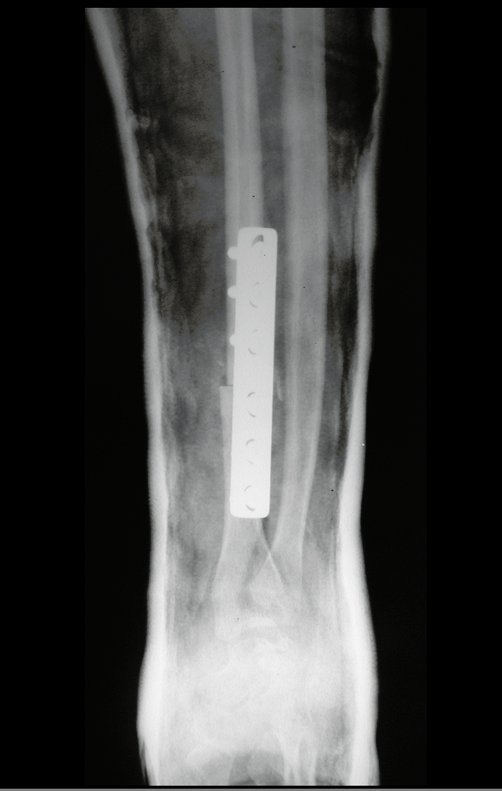
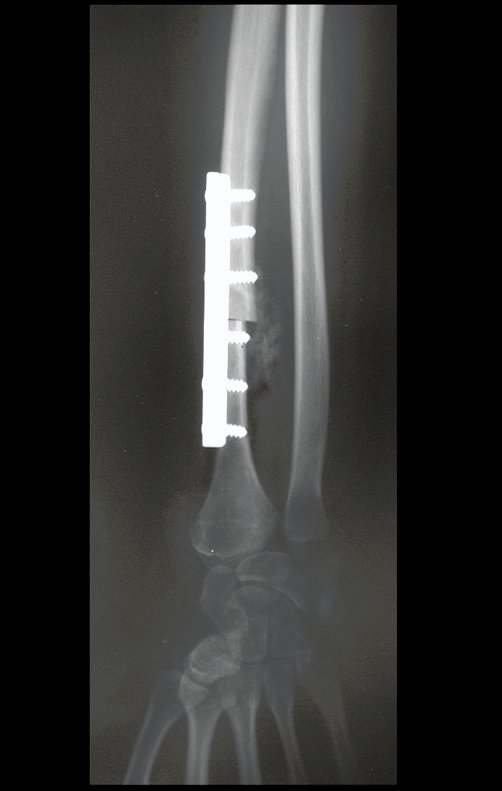
El estudio de resonancia magnética muestra lesión de rarefacción ósea, con áreas de necrosis, erosión, insuflación y fractura e infracción de la cortical, con deformidad y hundimiento de la superficie articular (figuras 25 à 36).
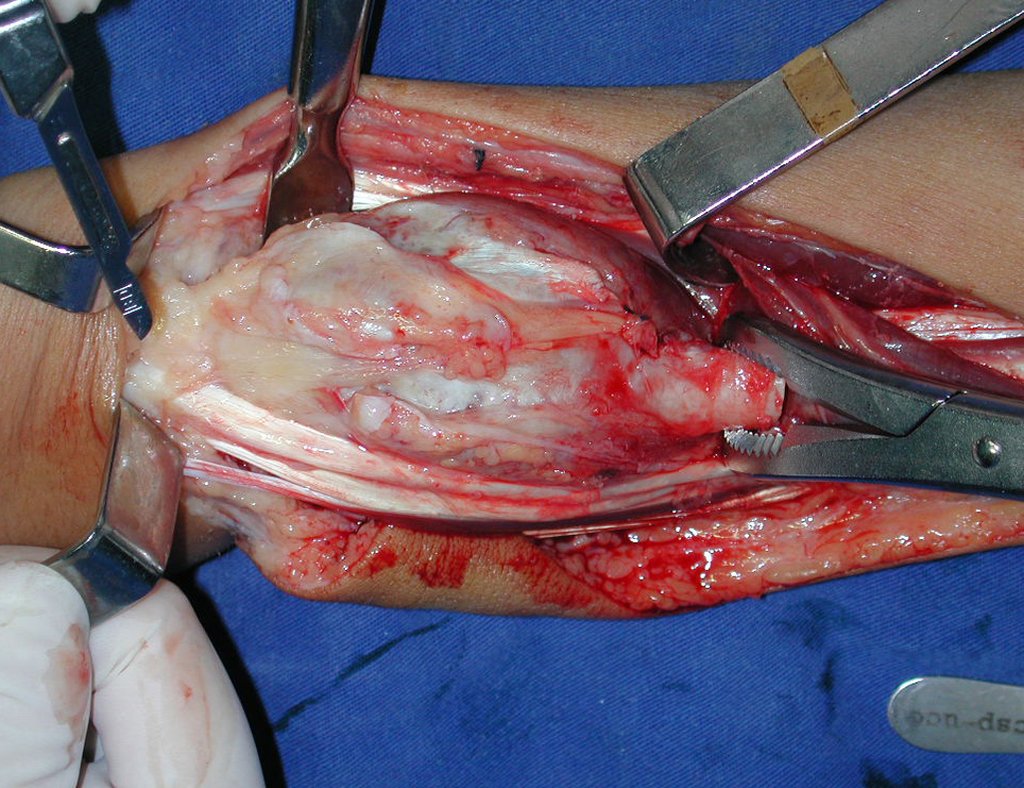
Con este estudio, confirmamos la agresividad local del tumor y la gran destrucción de la extremidad distal del radio izquierdo, con fractura por infracción, deformidad articular y hundimiento del radio. En esta situación el tratamiento intralesional esta contraindicado, debido a las altas posibilidades de recidiva local, además de perdida de la función. Oncológicamente esta indicada la resección segmentaria del radio y reconstrucción de la muñeca. La artrodesis puede ser una alternativa, mas preferimos preservar la función y la anatomía de la muñeca, siempre que sea posible. En este caso optamos por reconstruir con injerto autólogo no vascularizado, obtenido del segmento proximal del peroné ipsilateral, que imita mejor al radio.
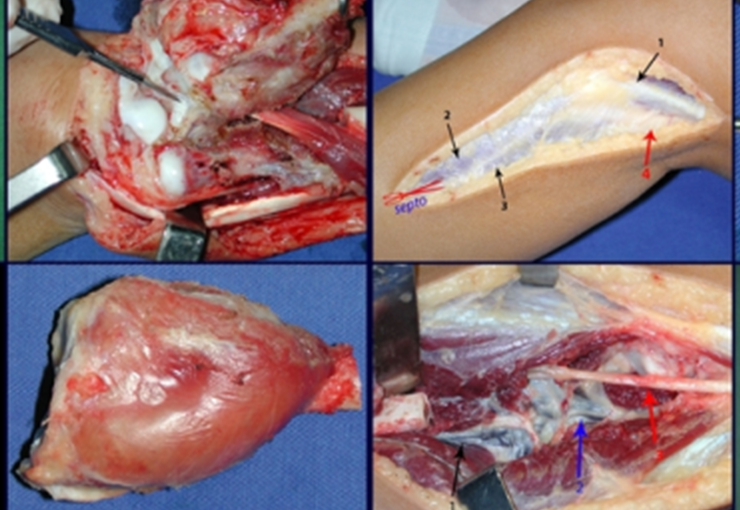
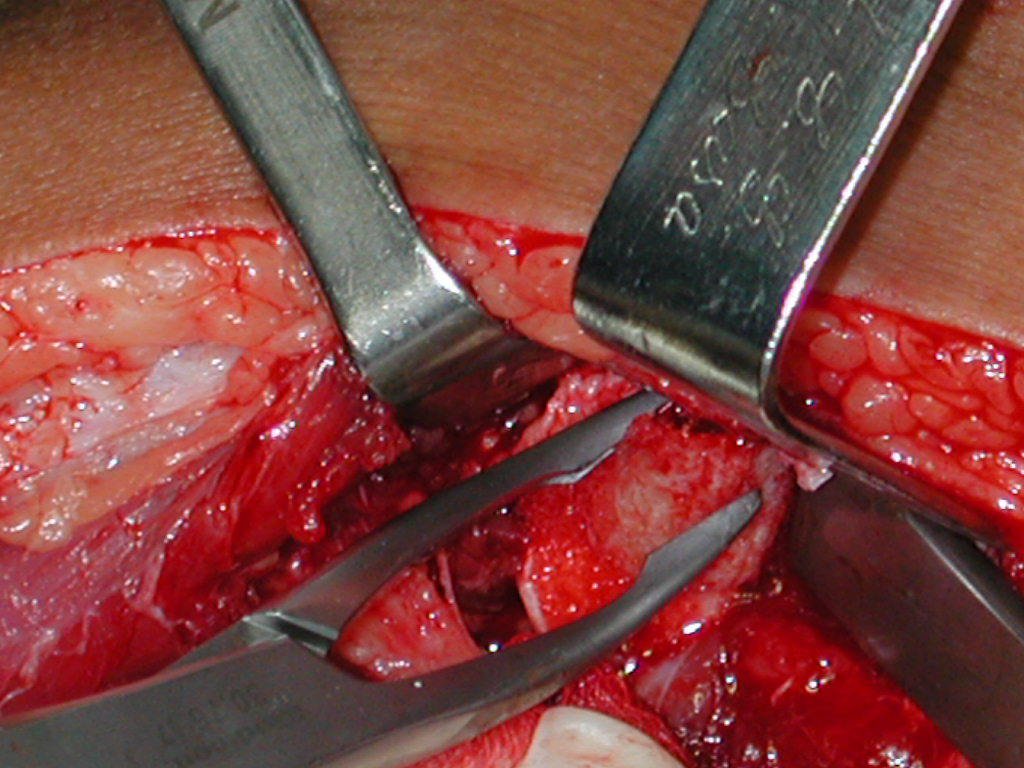
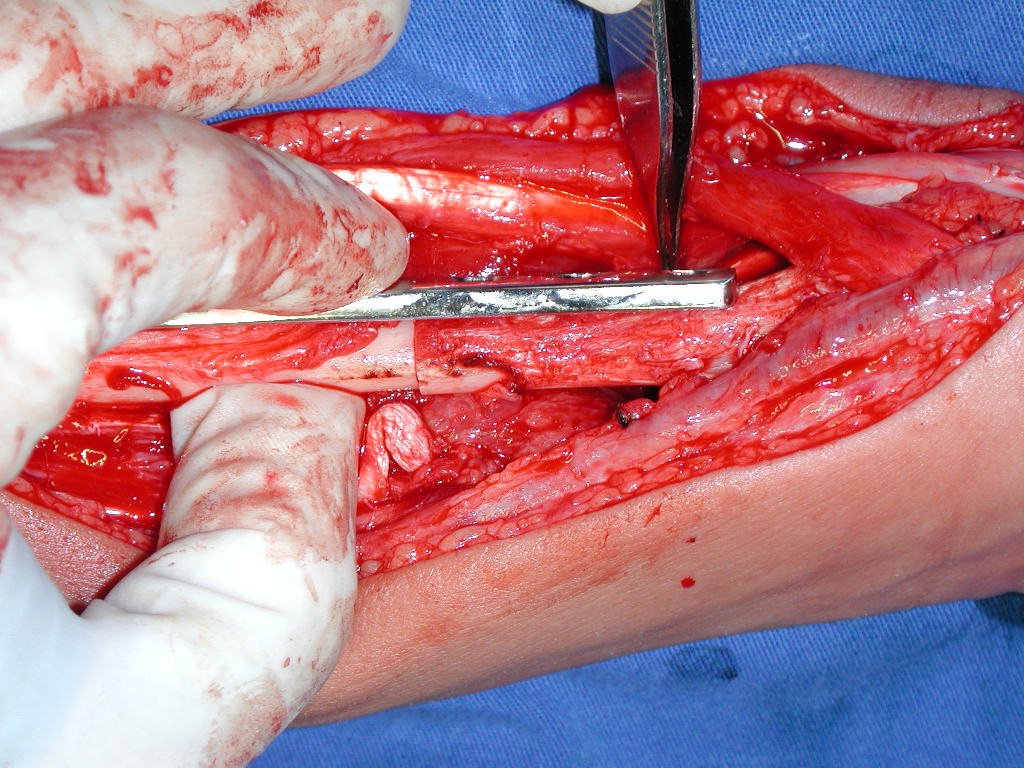
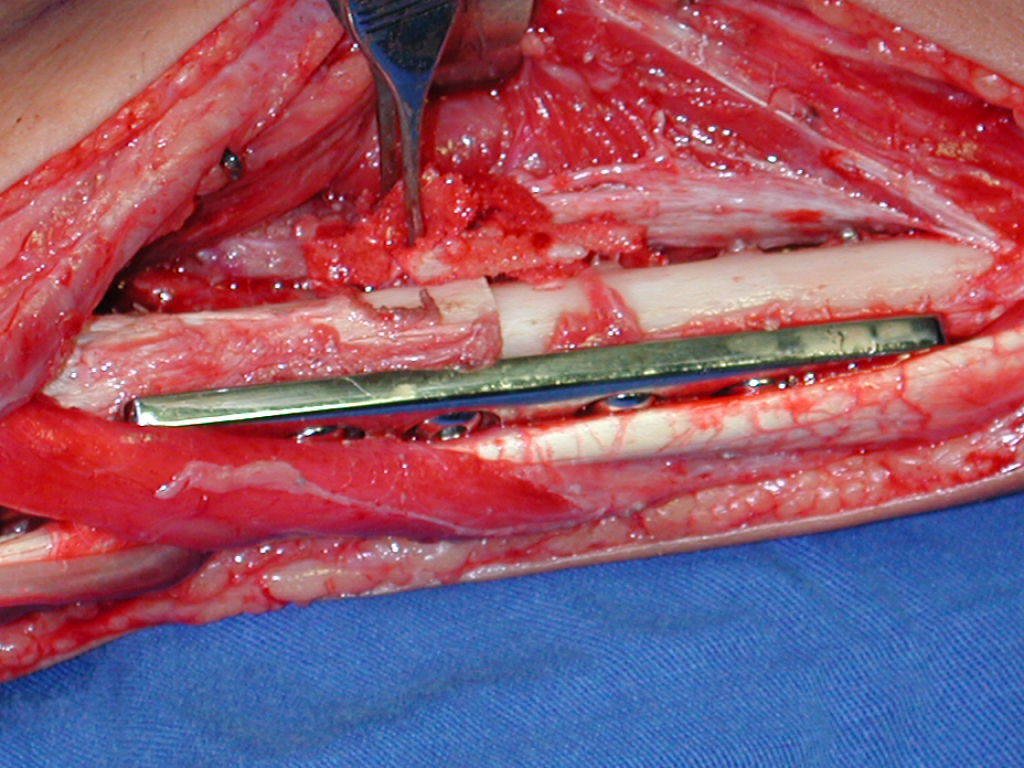
La cirugía es realizada en decúbito dorsal horizontal, preferiblemente sin uso de vaciamiento del miembro. Los detalles de la resección los mostramos en las figuras 38 a 57.
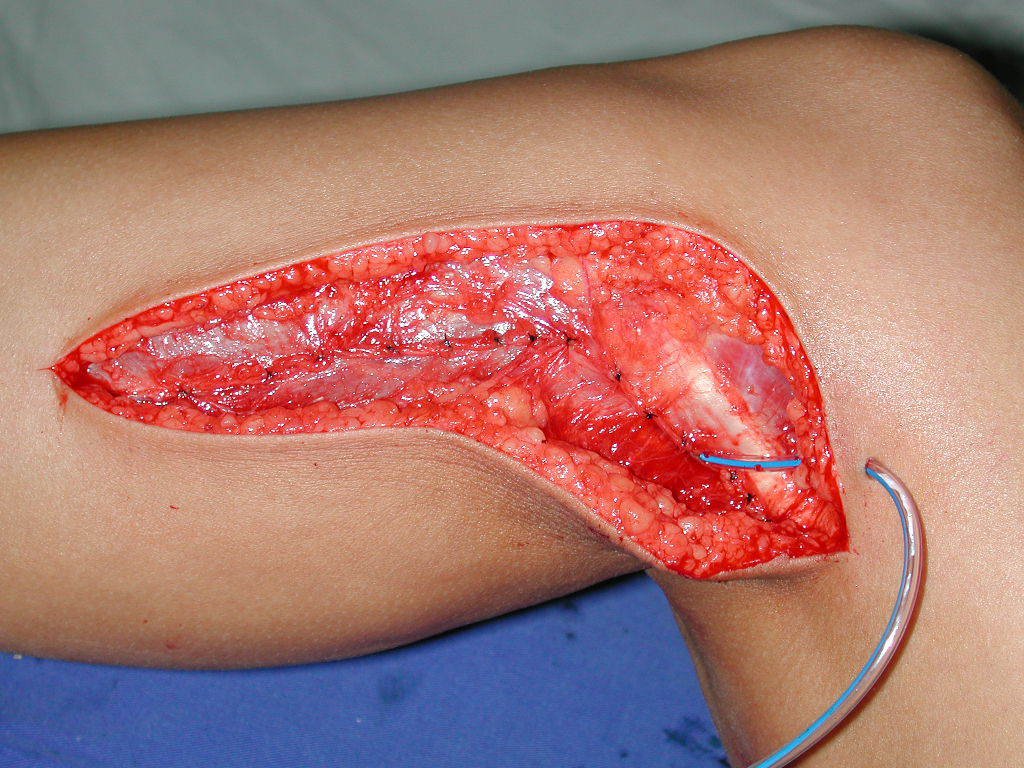
Después de la resección del segmento distal del radio y la revisión cuidadosa de la hemostasia, colocamos compresas humedecidas con suero fisiológico en lecho quirúrgico y enfajamos con faja crepe.
Pasamos para la segunda etapa: la obtención del injerto autólogo no vascularizado, obtenido del segmento proximal del peroné ipsilateral. Es preferible utilizar un injerto obtenido del mismo lado, pues la cara lateral del peroné y la tuberosidad de inserción del ligamento colateral lateral imitan mejor la cara dorsal del radio del mismo lado. De esta forma la pieza del peroné sustituirá a la estiloide radial.
Es importante obtener este injerto con capsula articular de la articulación tibio-peroneal proximal en toda la circunferencia de la epífisis peroneal.
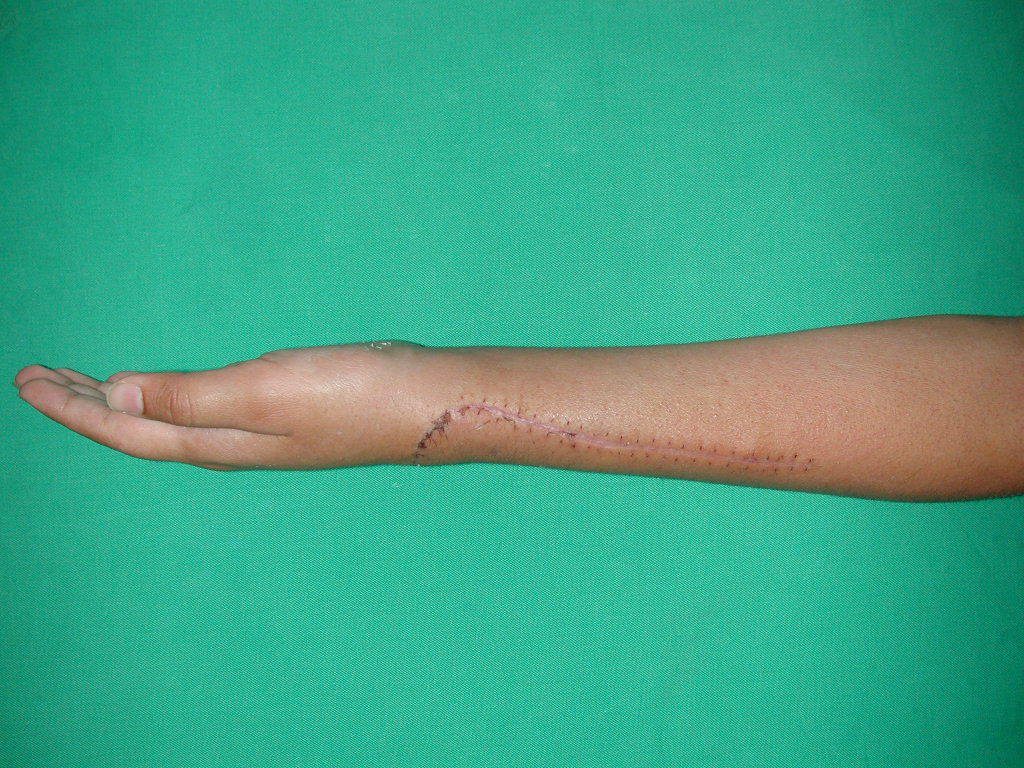
De esta manera tendremos tejidos blandos para la reconstrucción circunferencial de la nueva articulación peroneo-carpal. A continuación detallamos la obtención del injerto del peroné (Figuras 58 à 75).


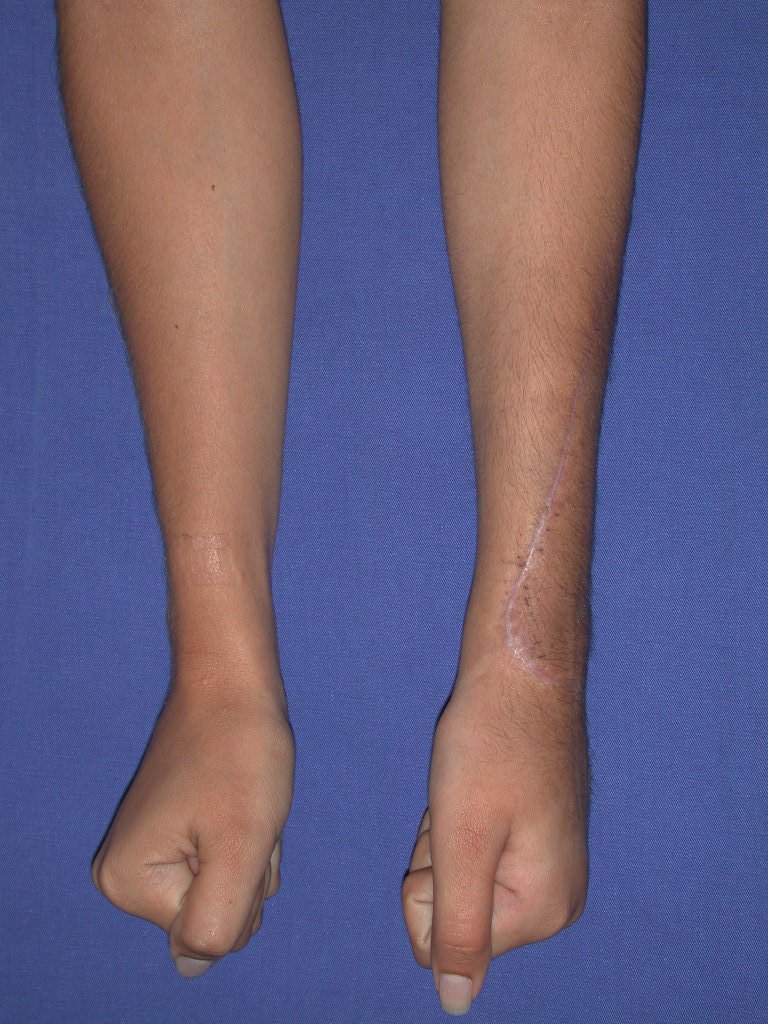
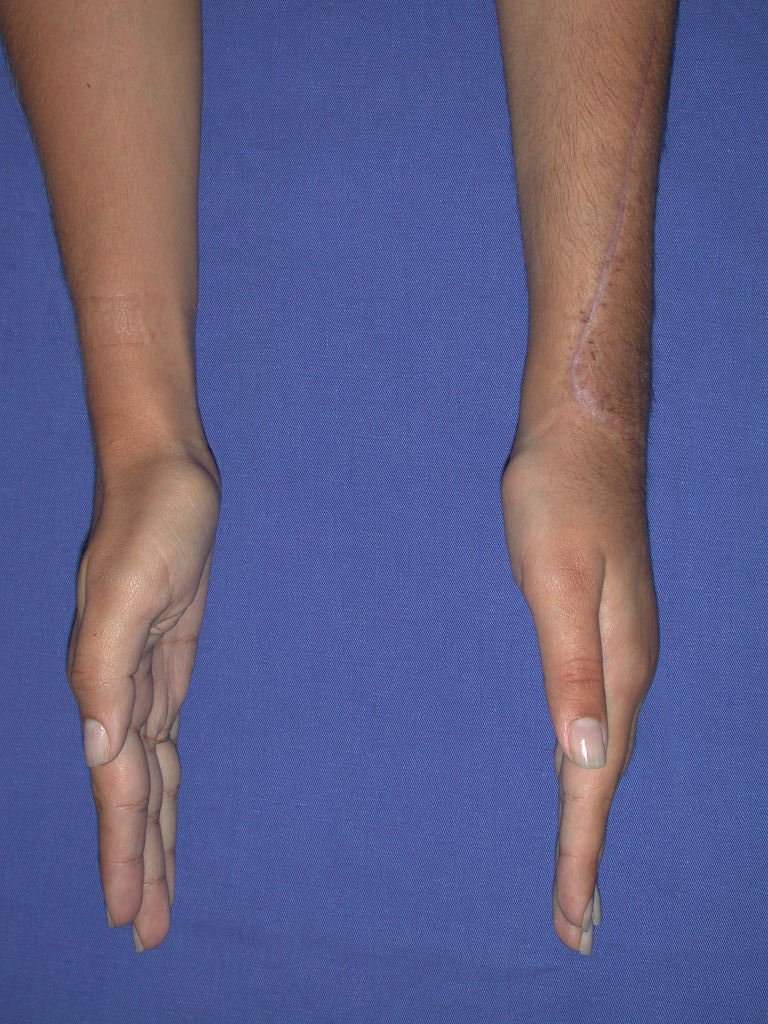
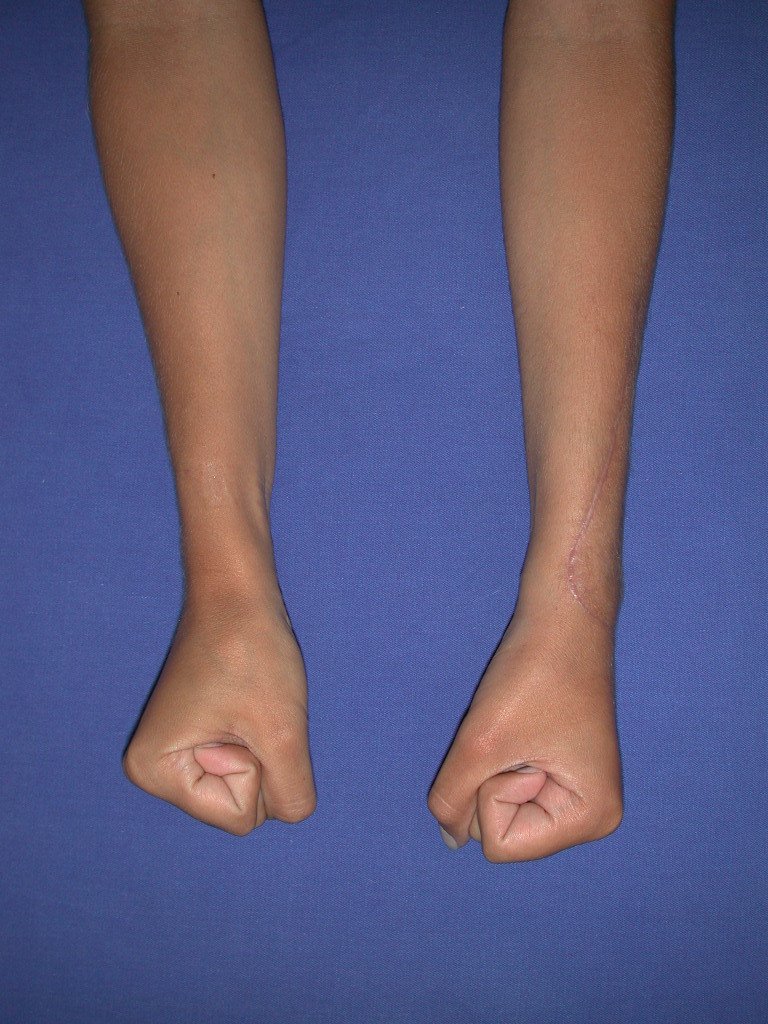
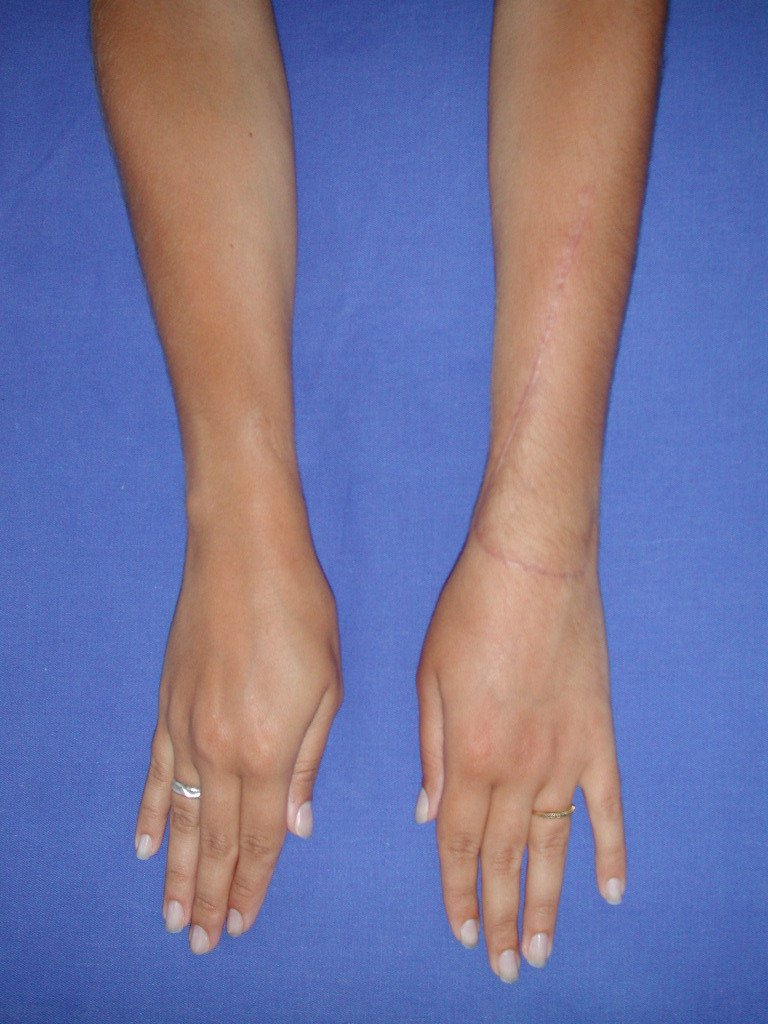
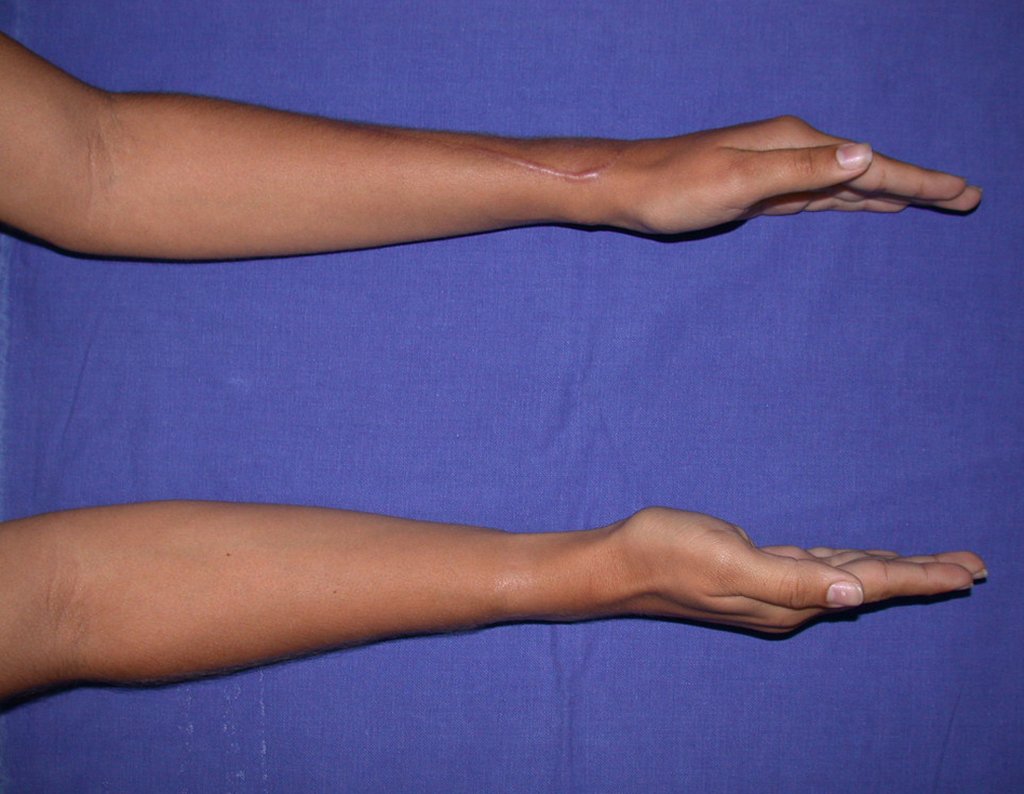
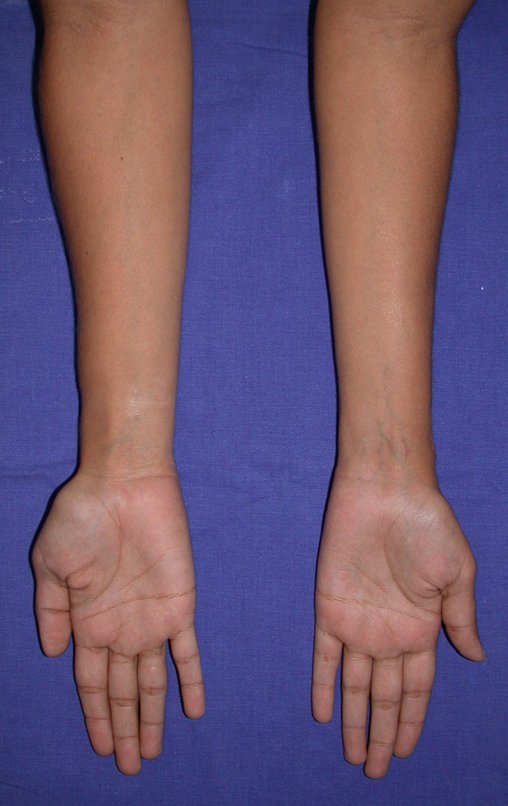
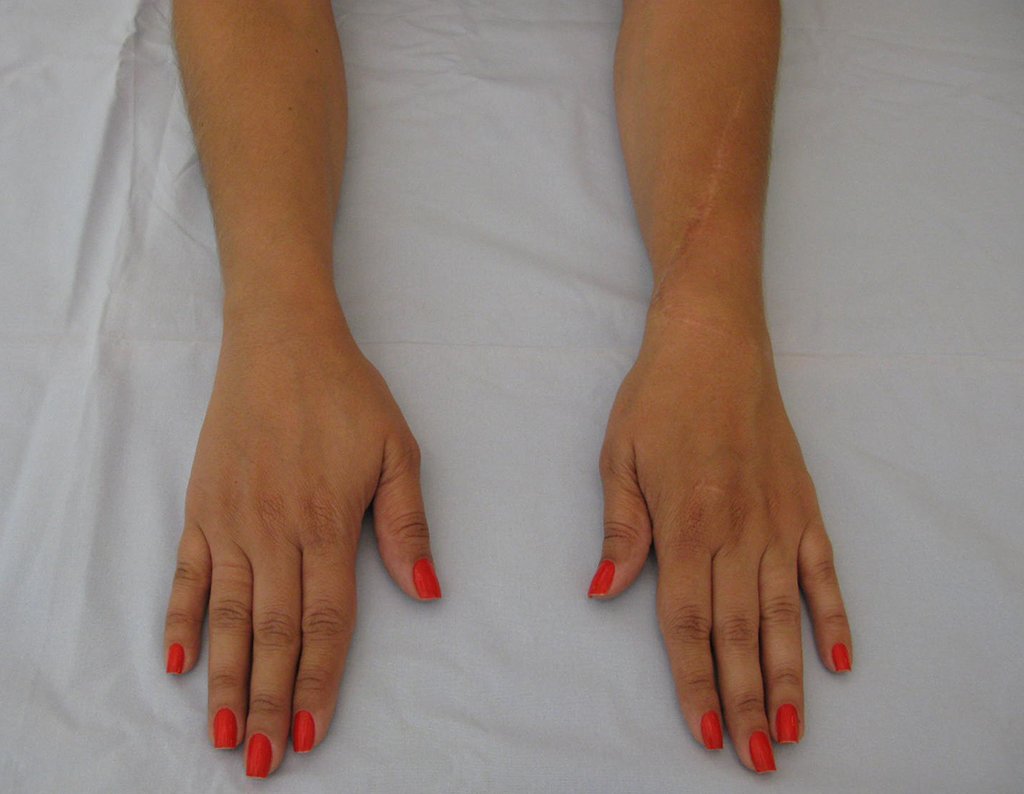
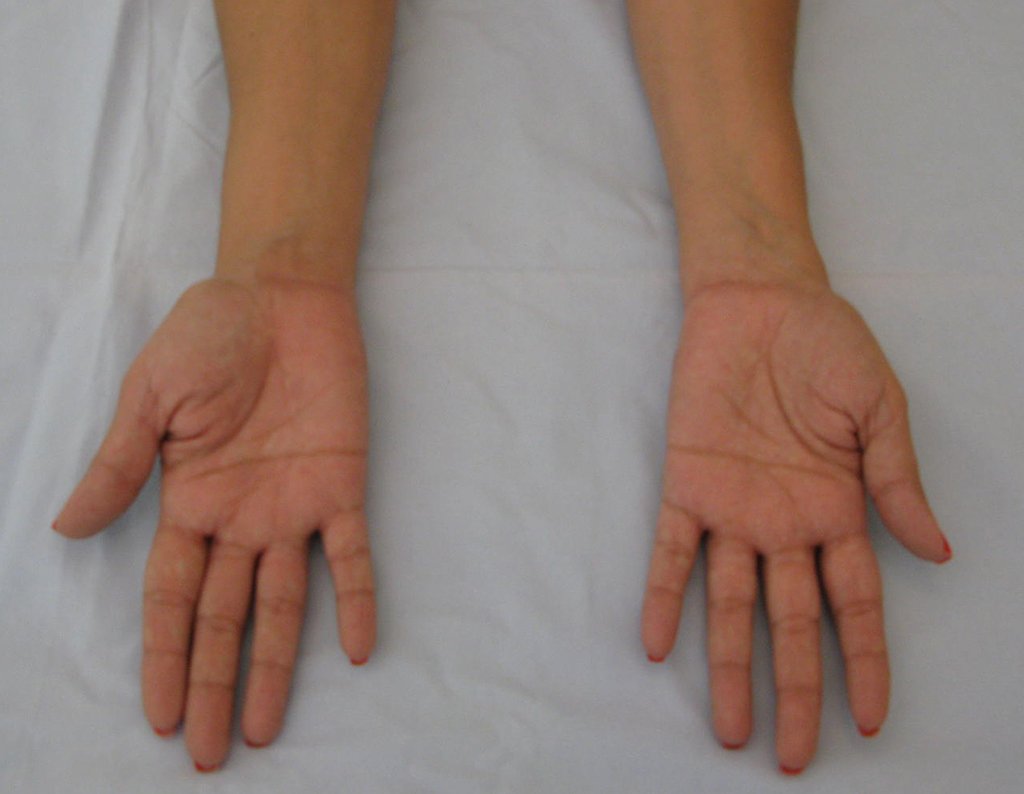
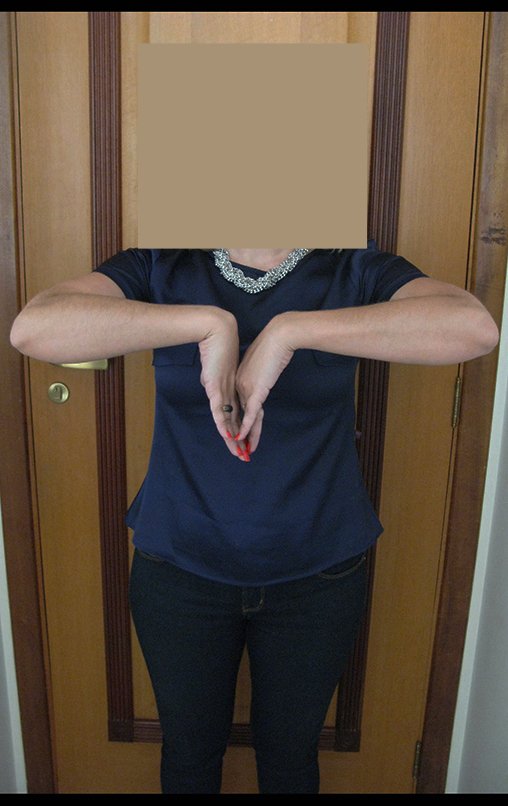
Vídeo 1: Supinação e pronação ativa e simétrica dos punhos, seis meses após a cirurgia. Boa função.
Vídeo 2: Flexão e extensão ativa e simétrica dos dedos, após seis meses. Boa função.
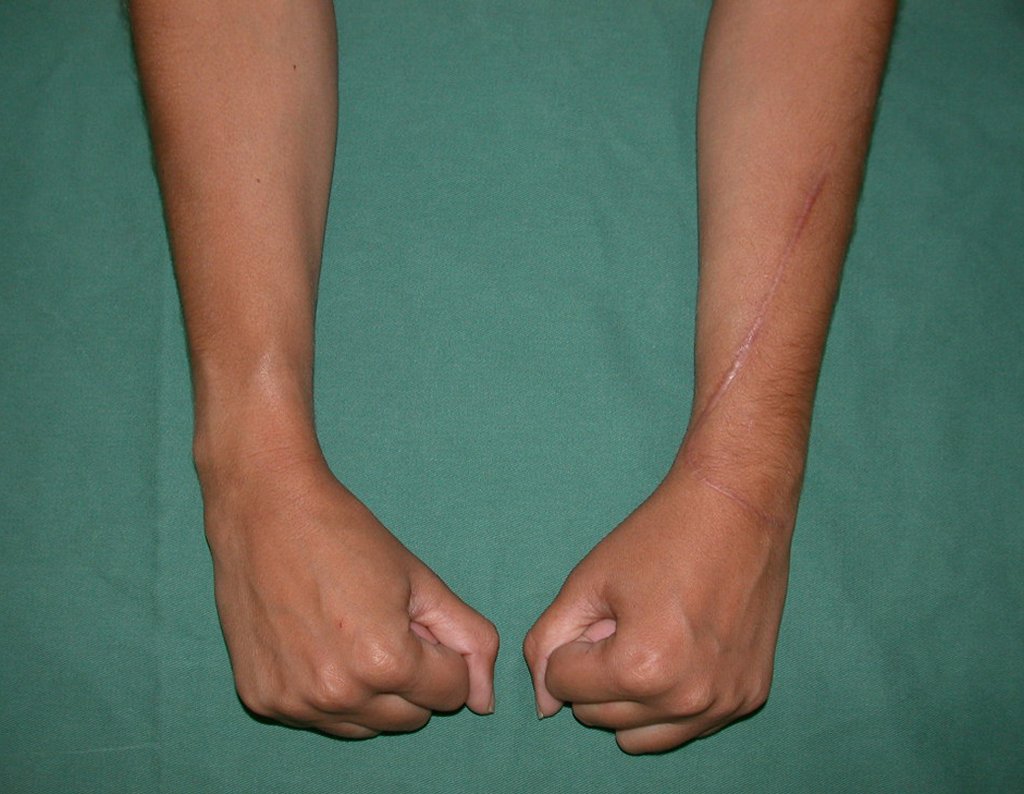
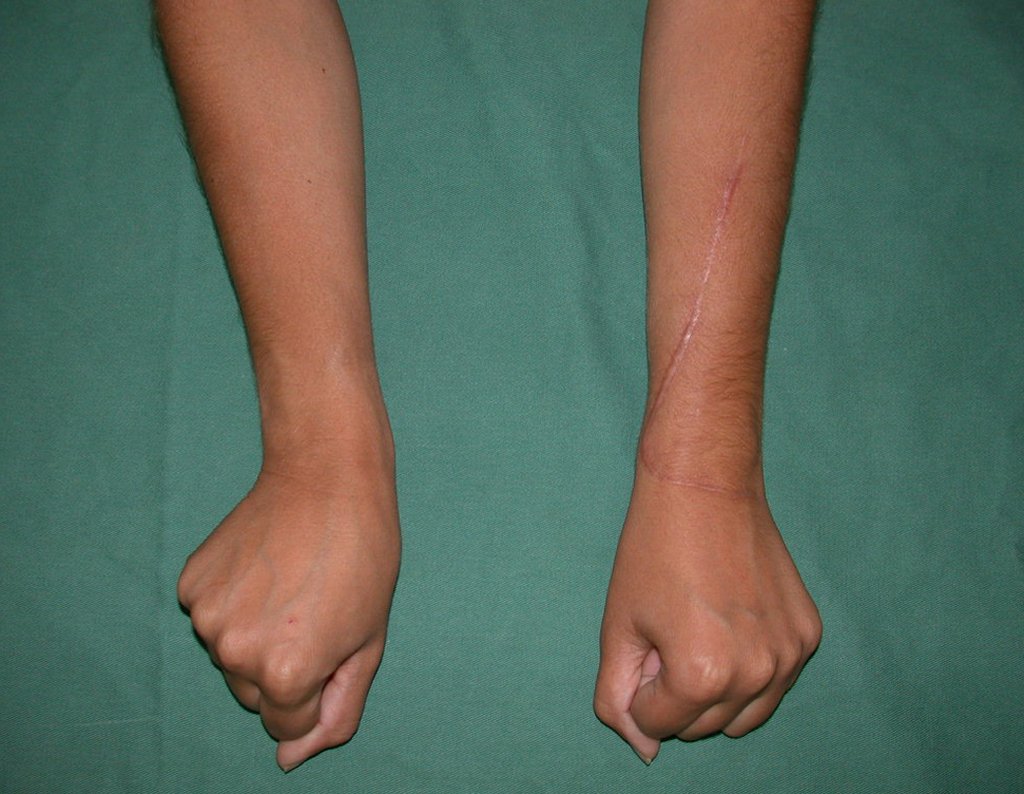
Vídeo 3: Pronação e supinação simétrica, após quinze anos da cirurgia.
Vídeo 4: Flexão e extensão em 29 de setembro de 2015, após quinze anos de pós-operatório.
Vídeo 5: Atitude indiferente e espontânea dos punhos. Boa simetria e função em 29/15/2015. Pós-operatório de quinze anos.
Vídeo 6: Boa força muscular e estabilidade do punho esquerdo, levantando significativo peso após 19 anos de cirurgia, em 22 de agosto de 2019.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com