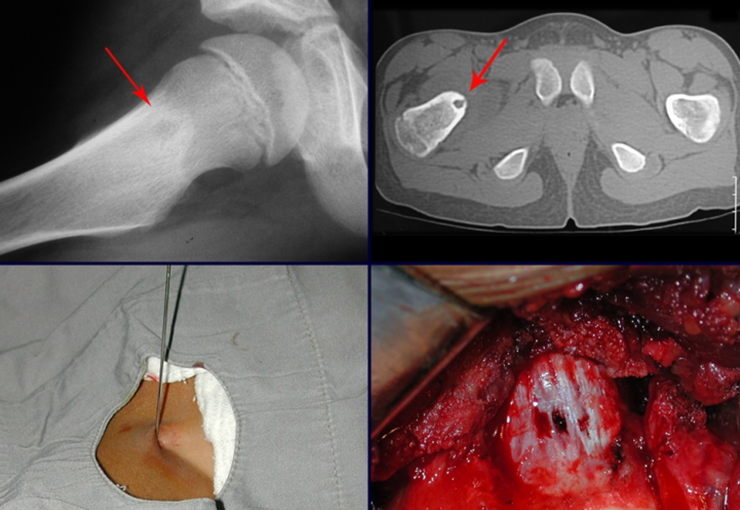
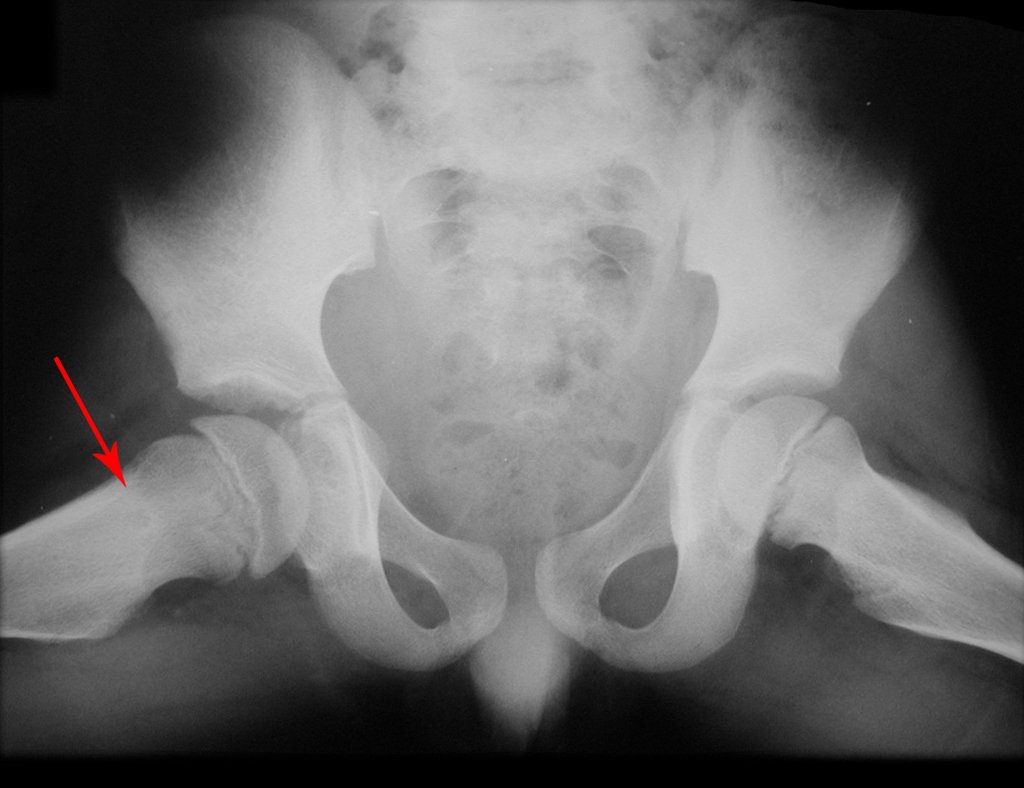
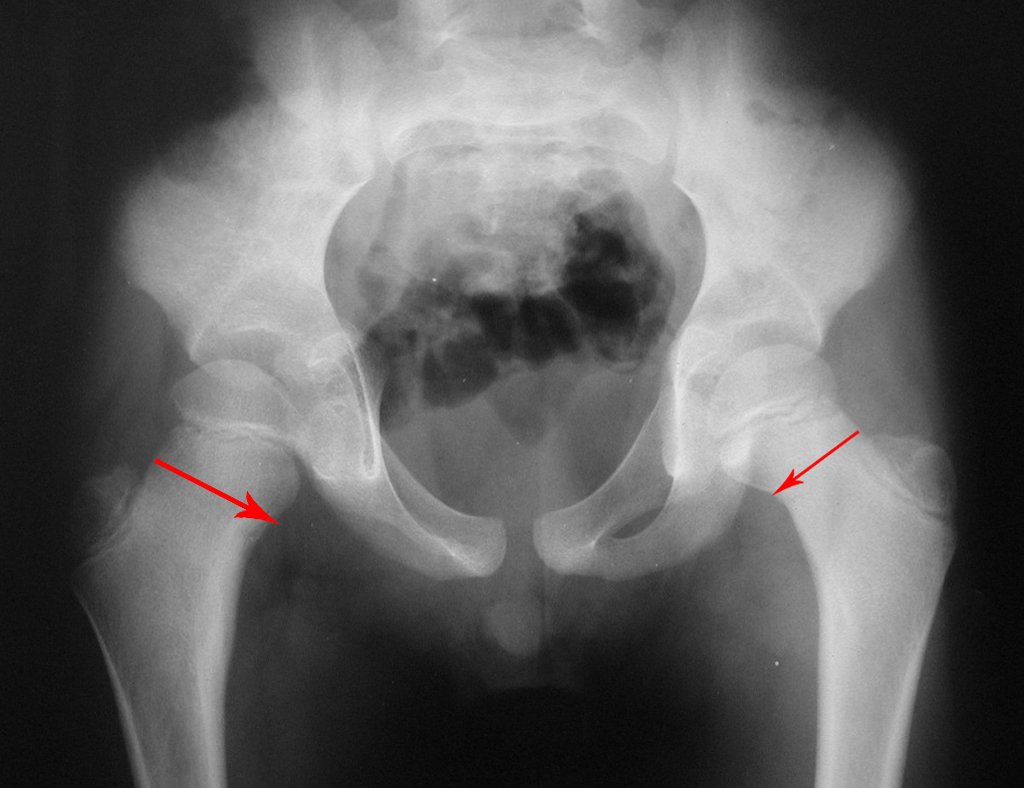
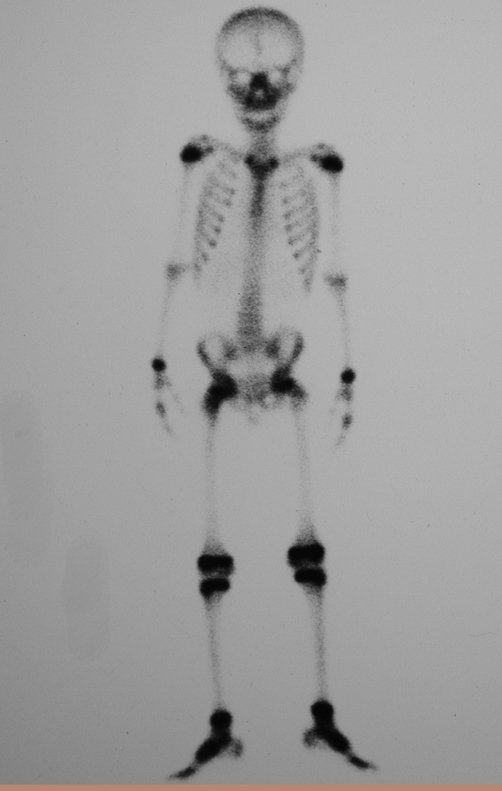
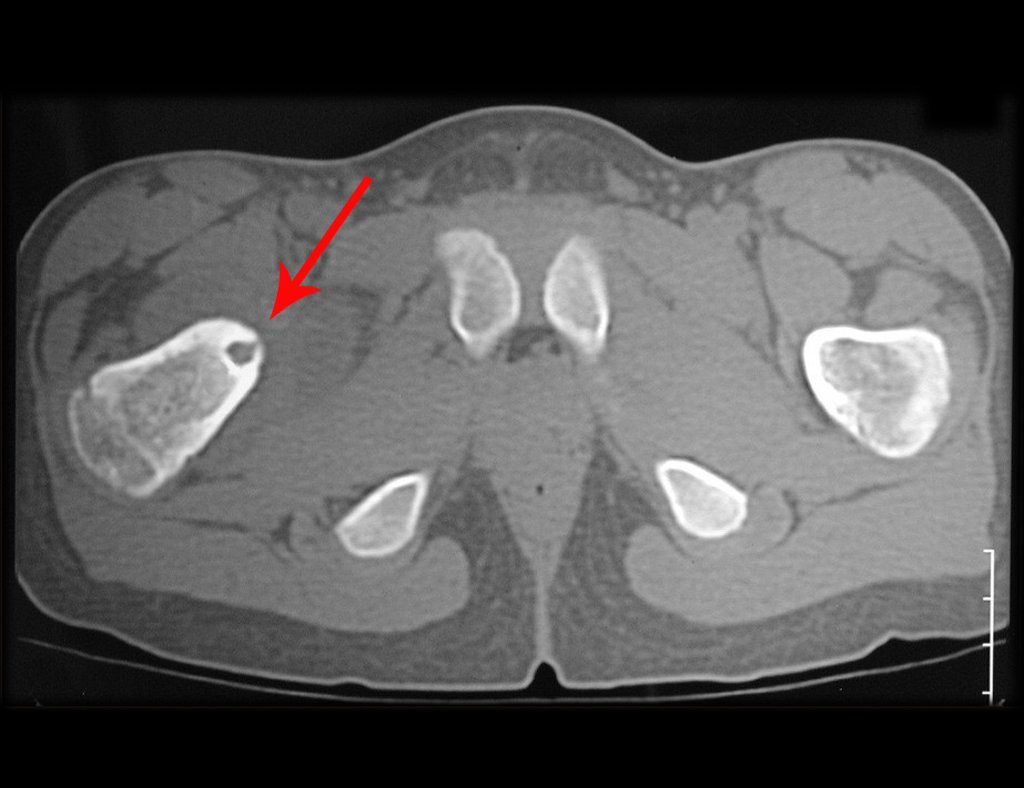
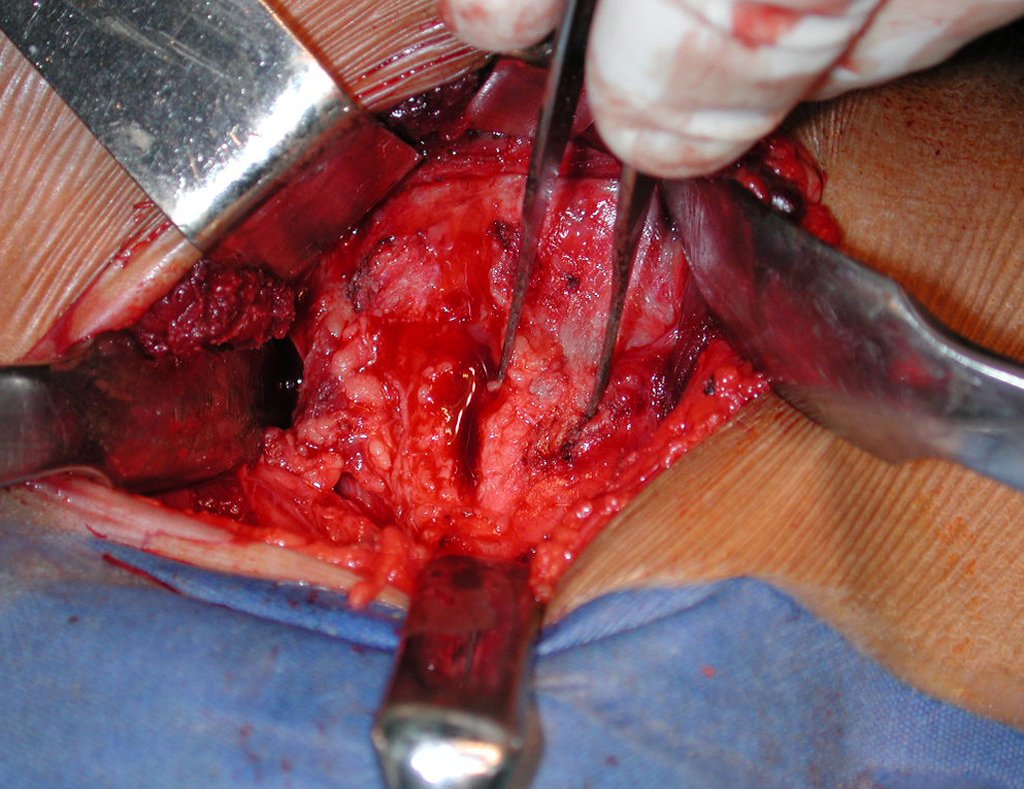
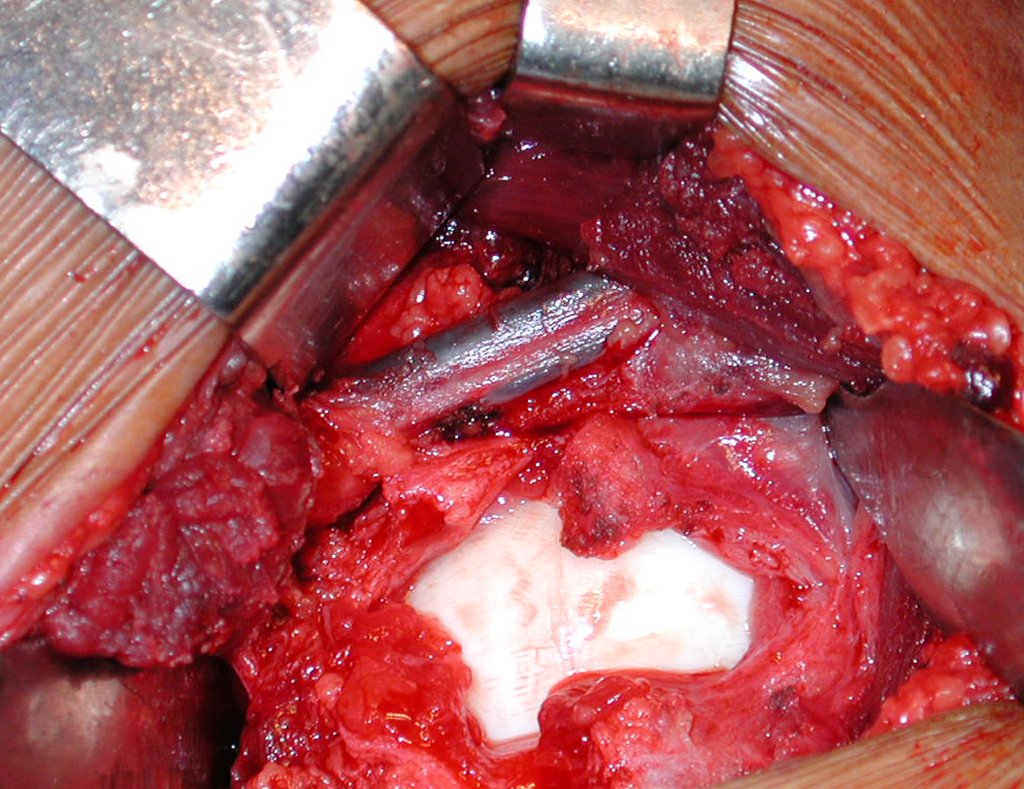
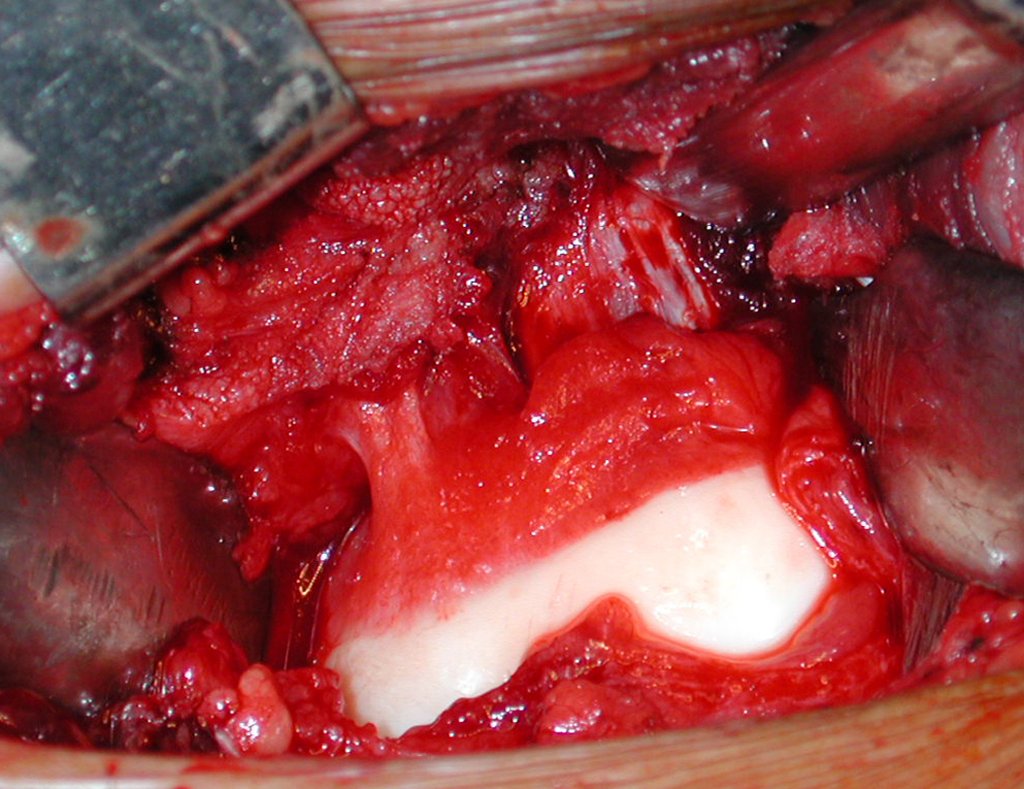
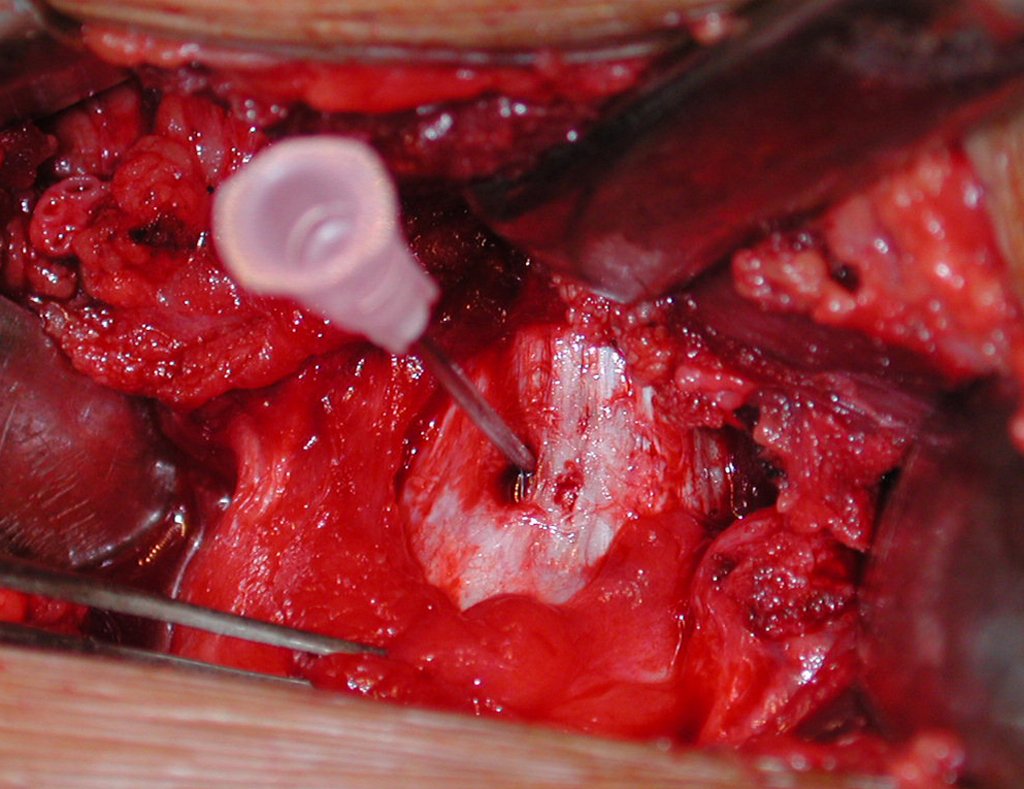
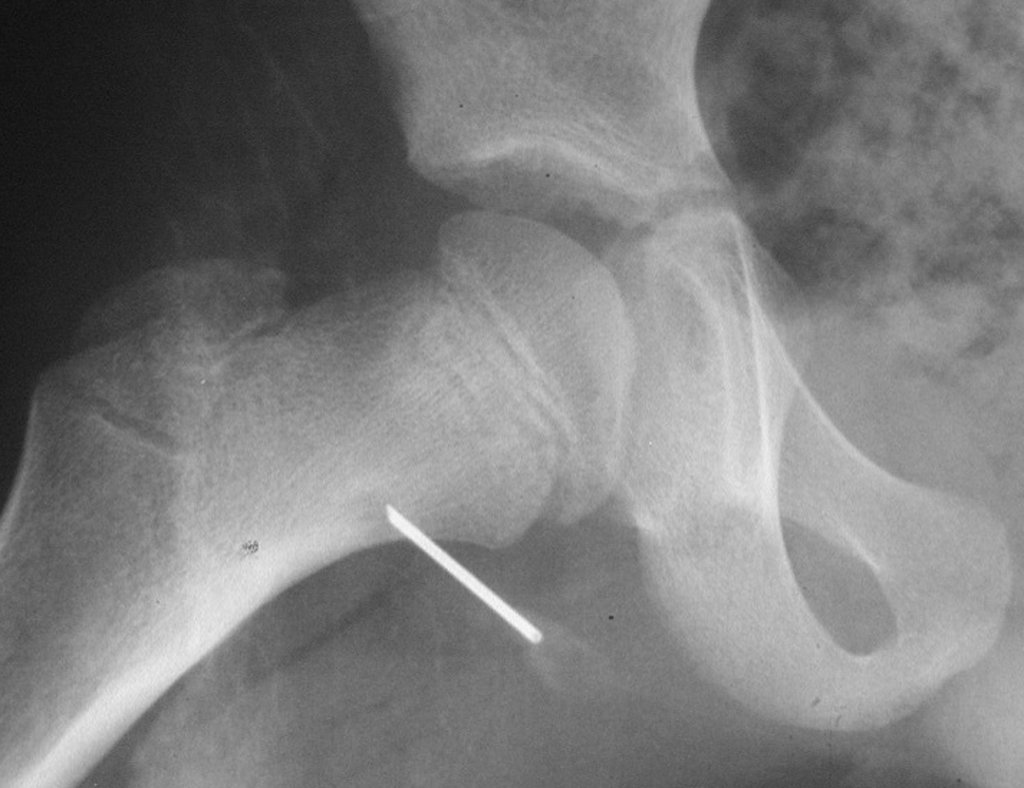
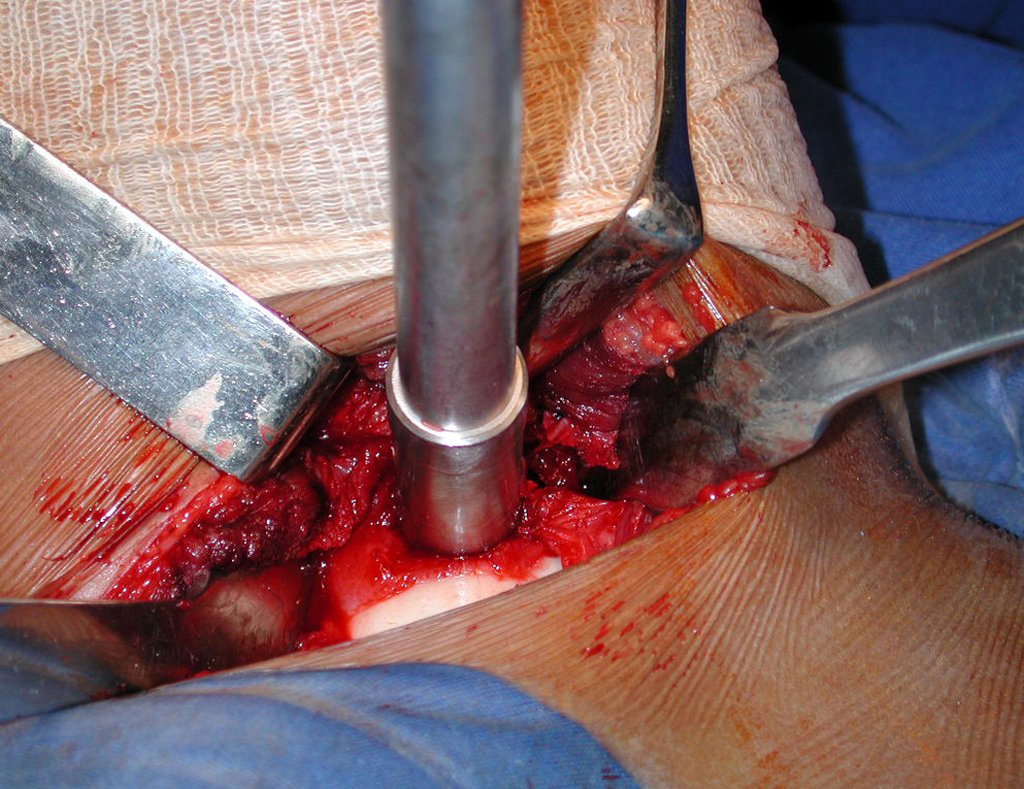
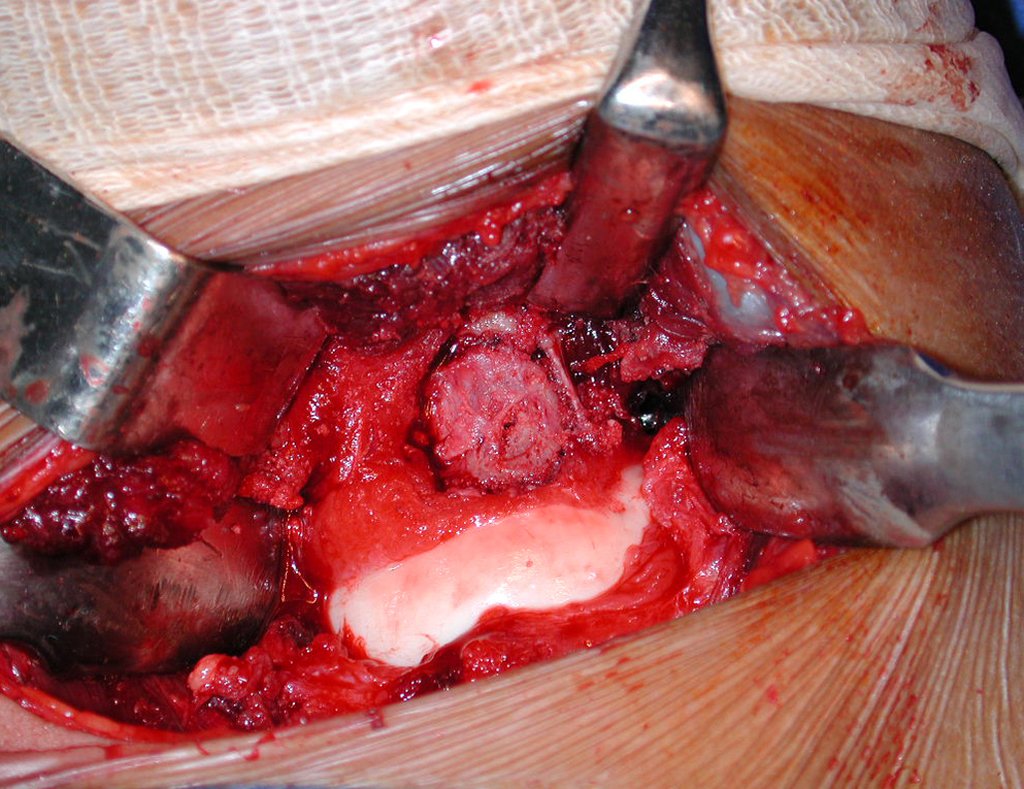
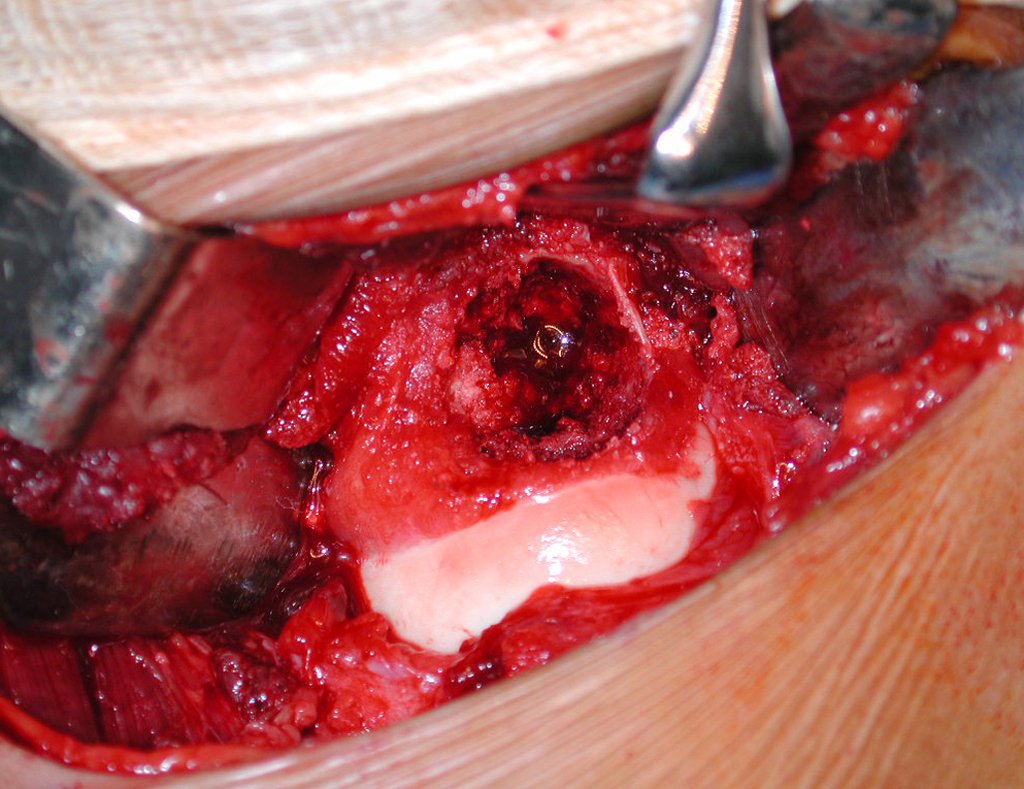
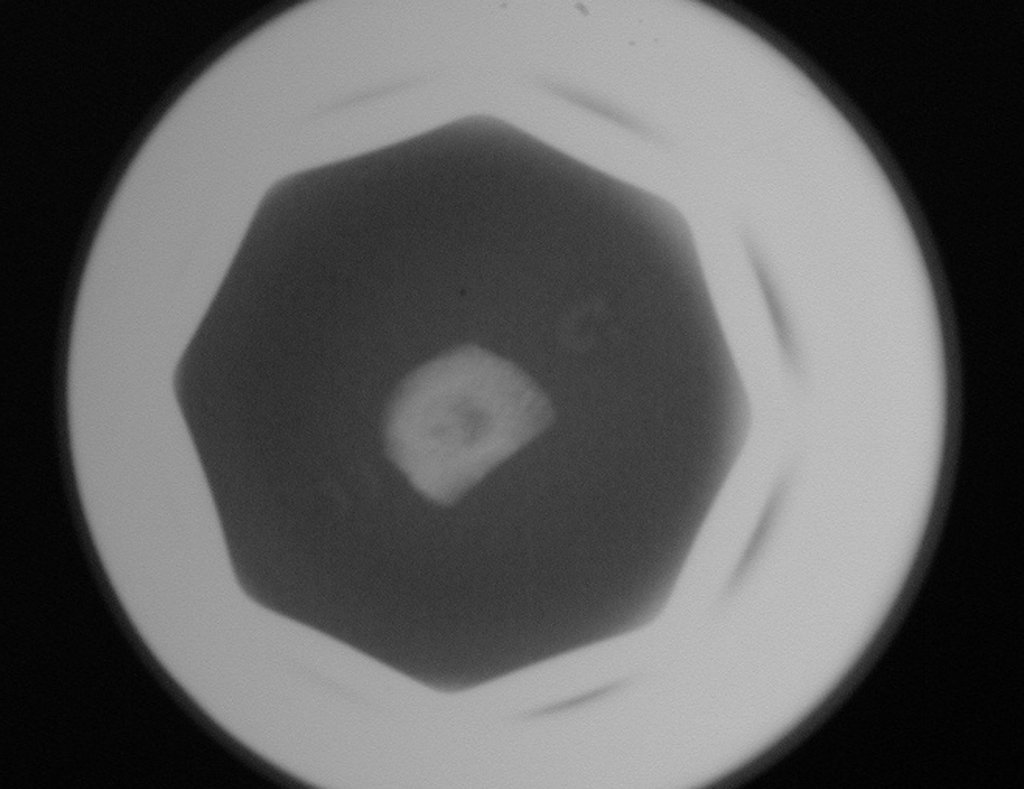
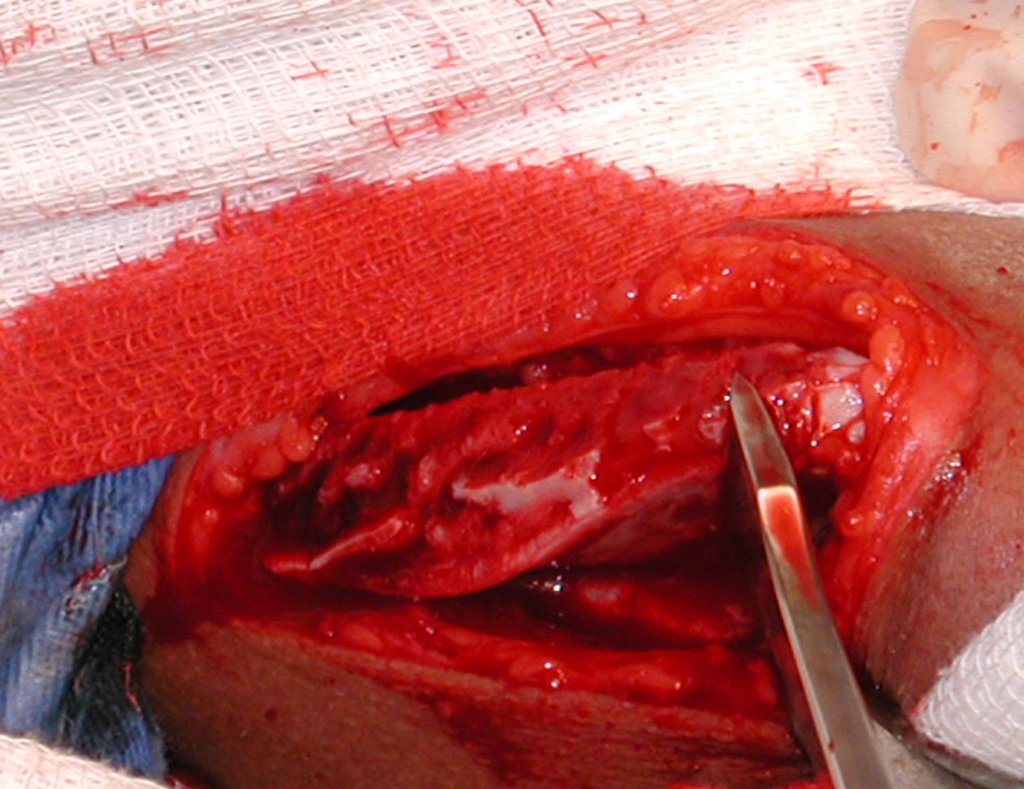
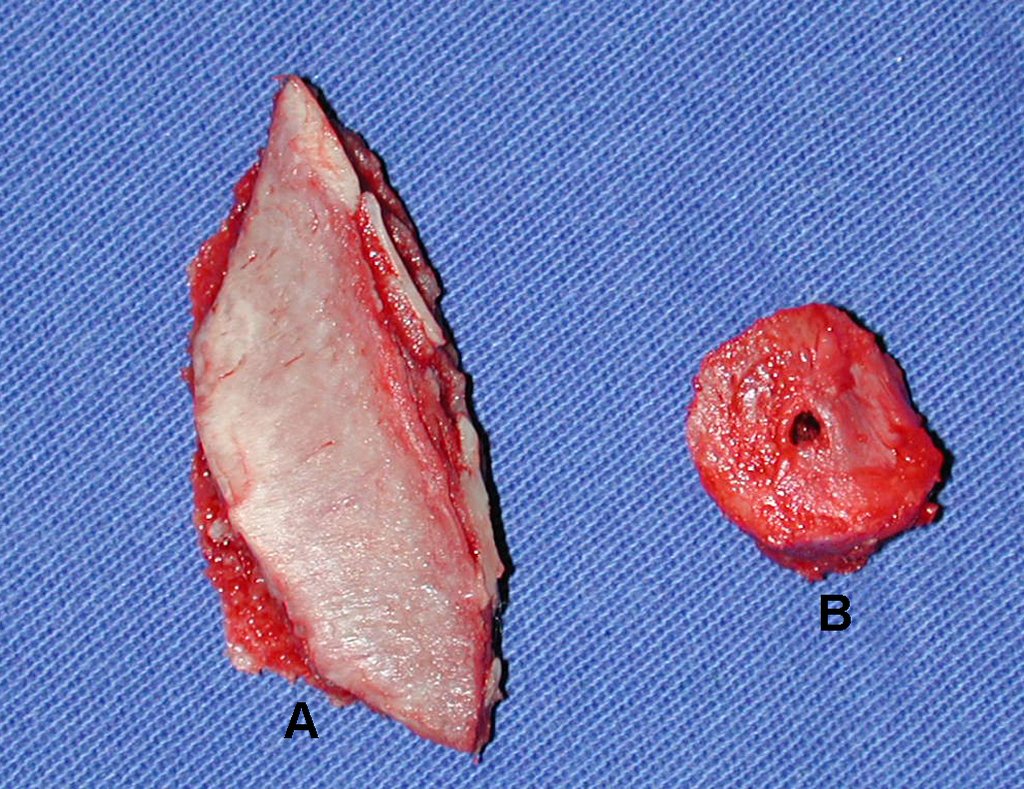
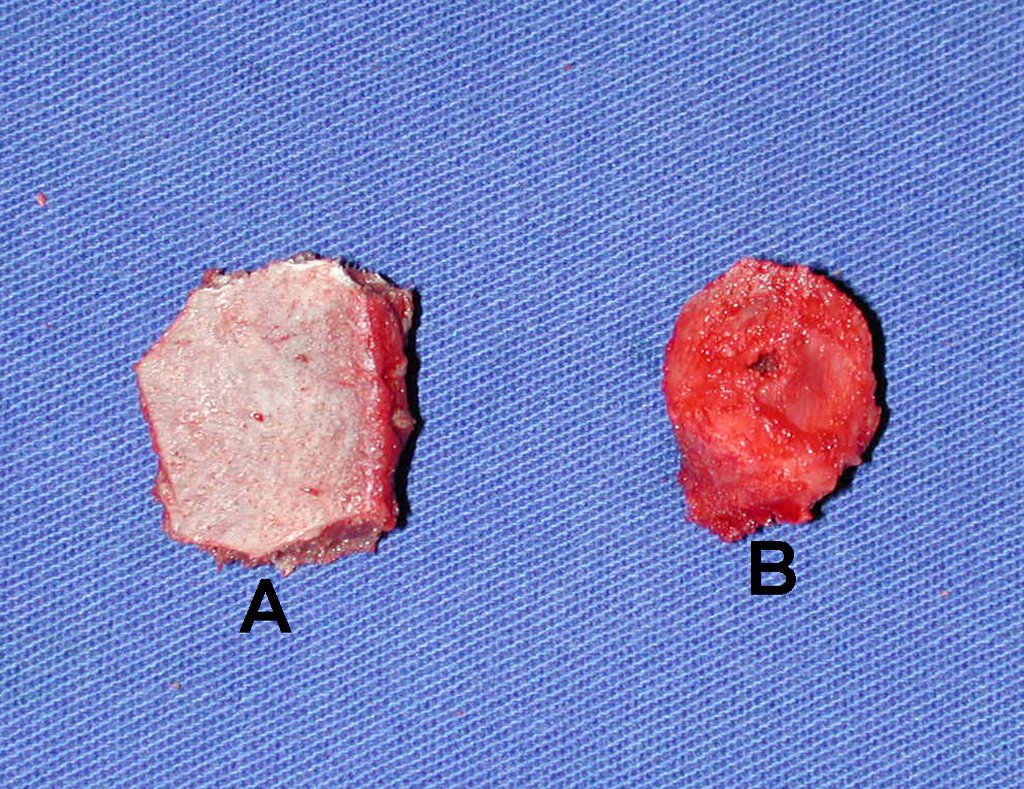
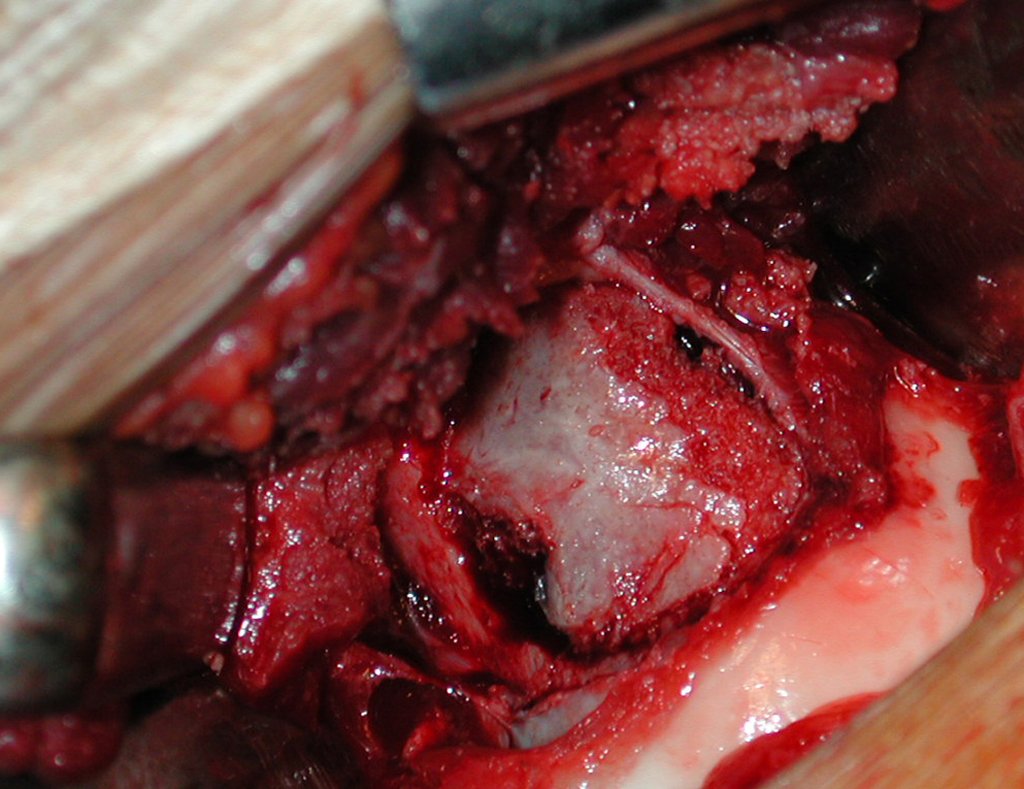
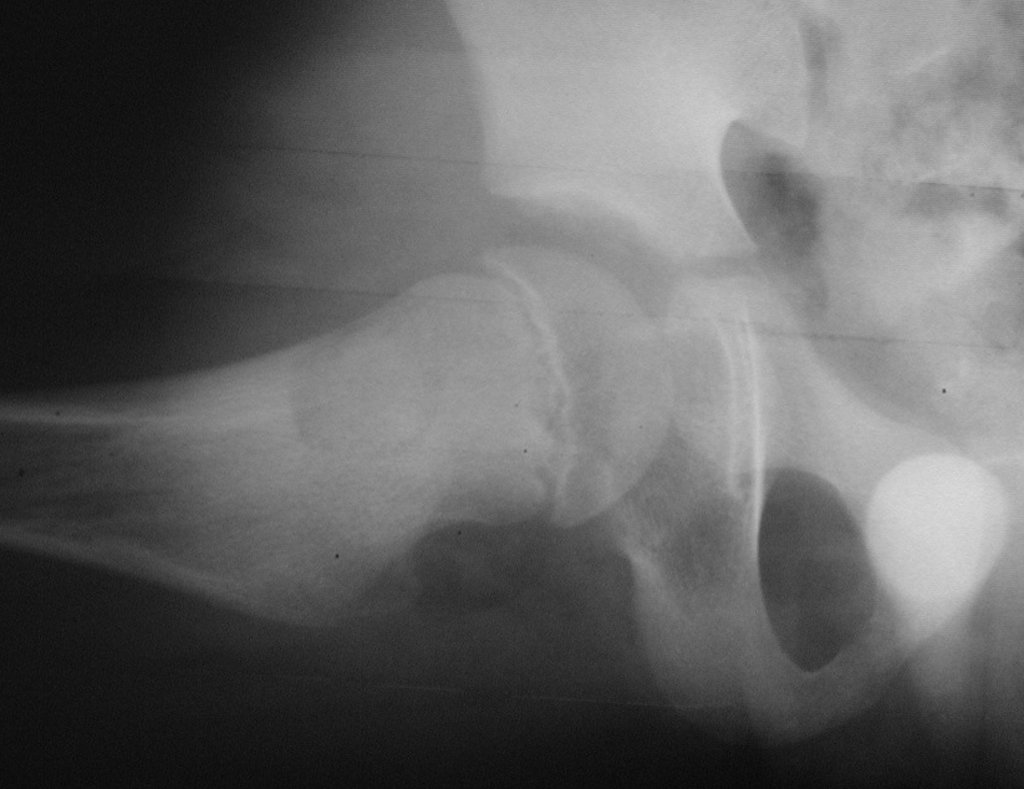
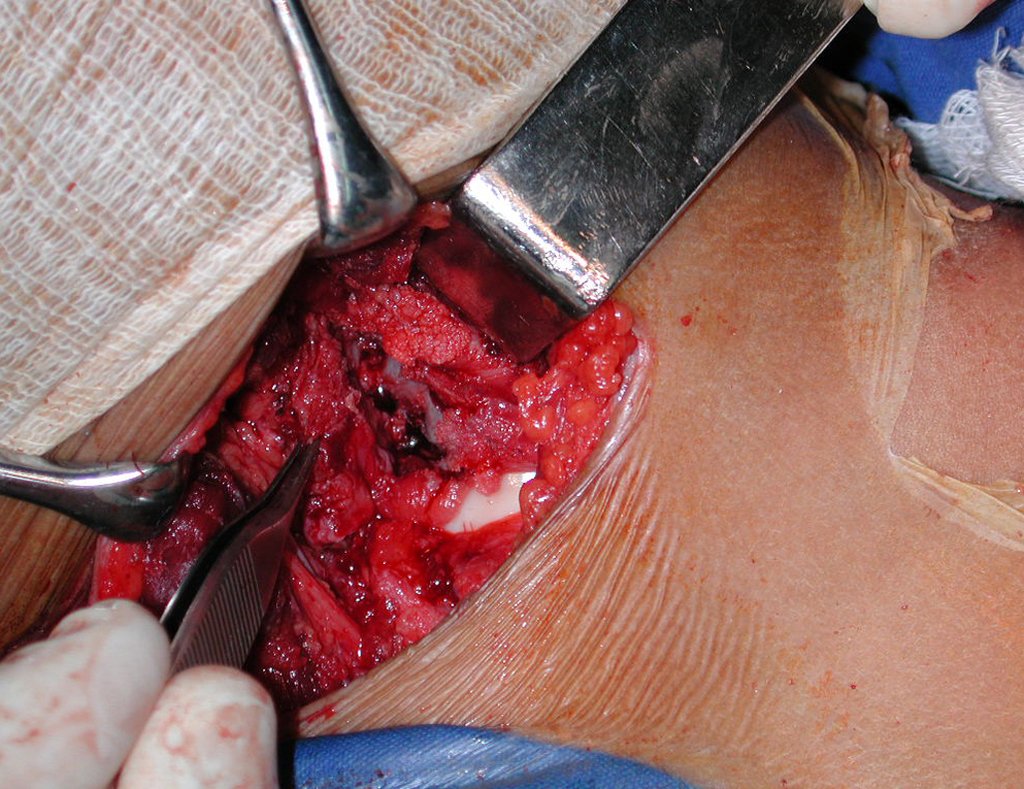
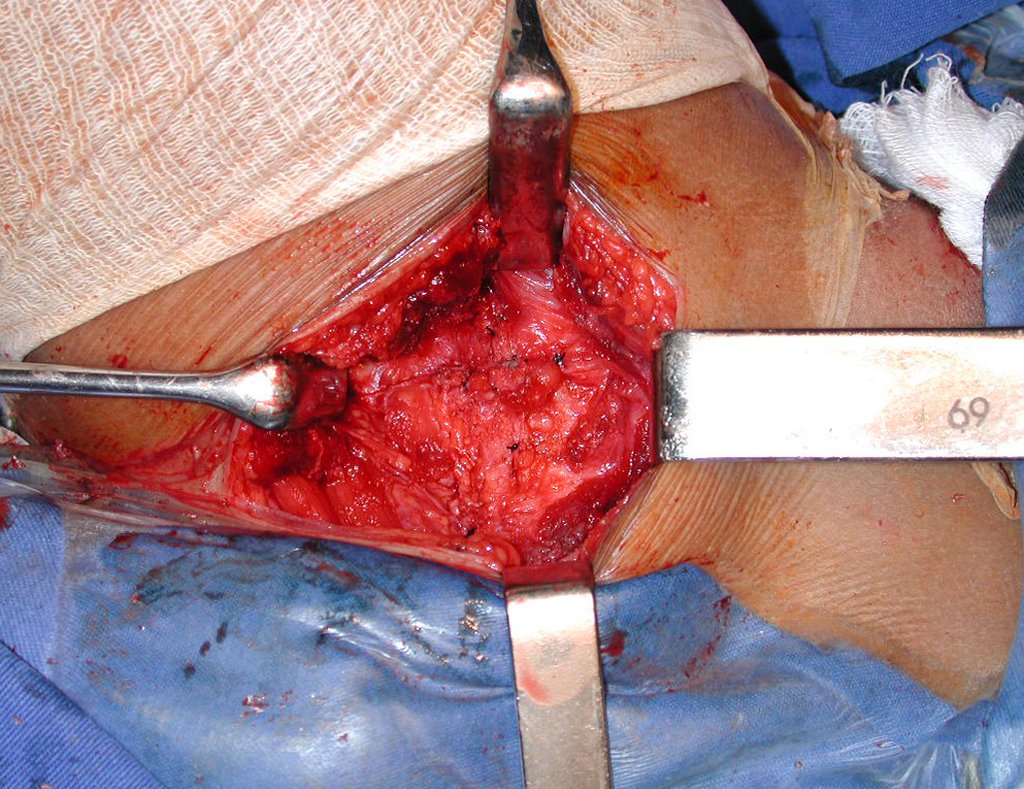
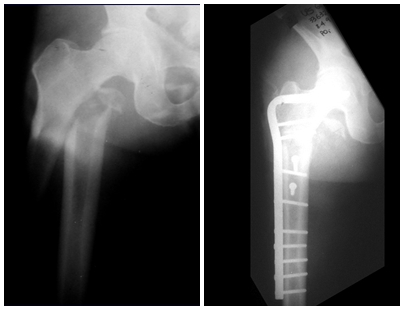
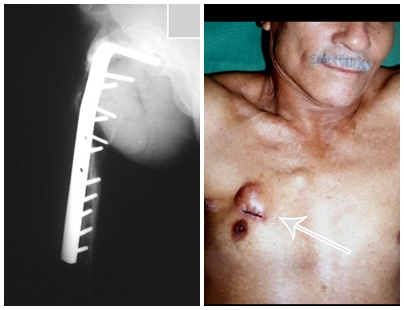
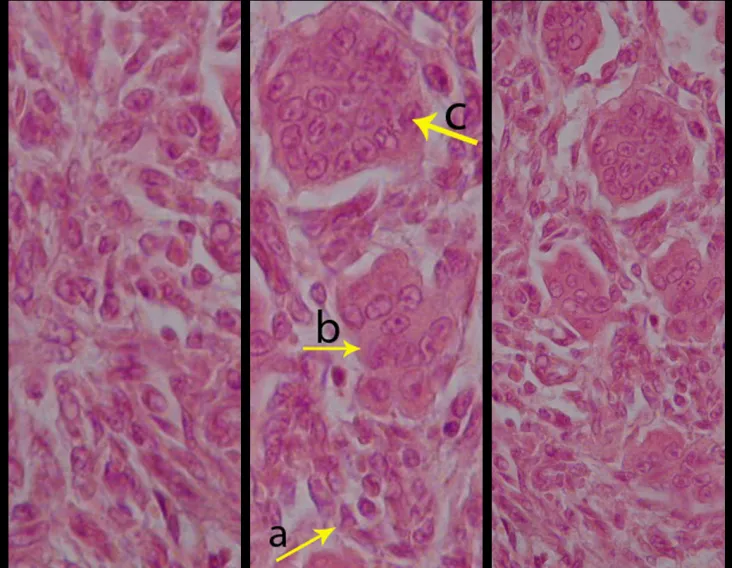
El injerto óseo es una solución biológica y definitiva; sin embargo, dificulta la visualización de posibles recidivas tempranas, que pueden confundirse con la reabsorción fisiológica durante el proceso de integración del injerto, además de requerir aproximadamente seis meses en promedio para la carga total. El injerto homólogo no autólogo tiene un período de integración más largo, no siempre está disponible, pero, por otro lado, acorta el tiempo quirúrgico. El injerto autólogo tiene la ventaja de la inmunocompatibilidad y una integración más rápida, pero prolonga el tiempo quirúrgico. Debido al riesgo de transformación maligna, la radioterapia solo puede considerarse como opción de tratamiento en tumores de células gigantes ubicados en estructuras de difícil acceso quirúrgico. Por lo tanto, especialmente para la región de la rodilla, el ortopedista familiarizado con el tratamiento de lesiones oncológicas debe evaluar los aspectos clínicos, radiográficos, el grado de destrucción articular, la profesión del paciente, en fin, todos los factores pertinentes, para realizar la mejor indicación terapéutica. Las complicaciones inherentes a este tumor son las recidivas, hundimientos de la superficie articular, que pueden llevar a desviaciones en varo, valgo, antecurvatum o retrocurvatum. Excepcionalmente, pueden ocurrir metástasis pulmonares o malignización.
(43-46).REFERÊNCIAS1. Cooper A., Travers B.: Surgical Essays. London, Cox and Son, 1818. 2. Paget J.: Lectures on Surgical Pathology. London, Longmans, 1853. 3. Nelaton E.: D’une Nouvelle Espece de Tumeurs à Mieloplaxes. Paris, Adrien Delahaye, 1860. 4. Gross S.W.: Sarcoma of the long bones: based upon a study of one hun- dred and sixty five cases. Am J Med Sci 78: 17-19, 1879. 5. Bloodgood J.C.: Benign giant cell tumor of bone: its diagnosis and conservative treatment. Am J Surg 37:105-106, 1923. 6. Geschikter D.F., Copeland N.M.: Tumors of Bone. Philadelphia, J.B. Lippincott, 1949. 7. Willis G.E.: The pathology of osteoclastoma or giant cell tumors of bone. J Bone Joint Surg [Br] 31: 236-238, 1949. 8. Jaffe H.L., Lichtenstein L., Portis R., R.B.: Giant cell tumor of bone. Pathologic appearance, grading, supposed variants and treatment. Arch Pathol 30: 993-995, 1940. 9. Sherman M.: “Giant cell tumor of bone” in Tumors of bone and soft tissue. Chicago, Year Book Medical Publishers, 1965. 10. Schajowics F.: Giant cell tumors of bone (osteoclastoma): a pathologi- cal and histochemical study. J Bone Joint Surg [Am] 43: 1-3, 1961. 11. Hanaoka H., Friedman N.B., Mack R.P.: Ultrastructure and histogenesis of giant cell tumor of bone. Cancer 25: 1408-1423, 1970. 12. Wilson Jr. P.D.: A clinical study of the biochemical behavior defects. Clin Orthop 87: 81-109, 1972. 13. Ackerman M., Berg N.O., Person B.M.: Fine needle aspiration biopsy in the evaluation of tumor-like lesions of bone. Acta Orthop Scand 47: 129-136, 1976. 14. Eideken J., Hodes P.J.: Roentgen Diagnosis of Diseases of Bone. Balti- more, Williams and Wilkins, p.p. 6588-6593, 1967. 15. Chaix C., Trifaud A.: Evolution and treatment of giant cell tumors of bone. Rev Chir Orthop 61: 429-434, 1975. 16. Derqui J.C.: Diagnostico de las Osteopatias Giganto-celulares en la Infancia. Buenos Ayres, Macchi HMS, 1962. 17. Lichtenstein L: Current status of problems in diagnosis and treatment. J Bone Joint Surg [Am] 33: 143-152, 1951. 18. Tornberg D.N., Dick H.M., Johnston A.D.: Multicentric giant cell tumor in the long bones. A case report. J Bone Joint Surg [Am] 57: 420-422, 1975. 19. Aegerter E., Kirkpatrick J.A.: Orthopaedic Diseases. Philadelphia, W.B. Saunders, 1975. 20. Dahlin D.C., Cupps R.E., Johnson Jr. E.W.: Giant cell tumor: a study of 195 cases. Cancer 25: 1061-1070, 1970. 21. Goldenberg R.R., Campbell C.J., Bonfiglio M.: Giant cell tumor of bone. An analysis of 218 cases. J Bone Joint Surg [Am] 52: 619-664, 1970. 22. Larsson S.E., Lorentzon R., Boquist L.: Giant cell tumor of bone. A demographic, clinical and histopathological study recorded in the Swed- ish Cancer Registry. J Bone Joint Surg [Am] 57: 167-173, 1975. 23. Lichtenstein L.: Bone Tumors. St. Louis, C.V. Mosby, 1972. 24. McGrath P.J.: Giant cell tumor of bone. An analysis of fifty two cases. J Bone Joint Surg [Br] 54: 216-227, 1972. 25. Marcove R.C., Weiss L.D., Vaghaiwalla M.R.: Cryo surgery in the treat- ment of giant cell tumors of bone. A report of 52 consecutive cases. Cancer 41: 957-964, 1978. 26. Rodrigues J.S.: Tumores de células gigantes do osso [Tese]. Recife, Pernambuco, Faculdade de Medicina da Universidade Federal de Pernambuco, 1972. 27. Sissons H.A.: “Bone tumors” in Wright P., Symmers W. St. C.: Systemic pathology. London, Longmans, Green and Co., 1966. 28. Huvos A.G.: Bone Tumors Diagnosis, Treatment and Prognosis. Phila- delphia, W.B. Saunders, vol. 17, p.p. 429-467, 1991. 29. Hutter R.V.P., Worcester Jr. J.N., Francis K.C.: Benign and malignant giant cell tumors of bone. A clinicopathological analysis of the natural history of the disease. Cancer 15: 663-672, 1962. 30. Levine H.A., Eurile F.: Giant cell tumor of patellar tendon coincident with Paget’s disease. J Bone Joint Surg [Am] 53: 335-341, 1971. 31. Jaffe H.L.: Tumors and tumorous conditions of the bones and joints. Philadelphia, Lea & Febiger, 1958. 32. Cameron G.W.: Giant cell tumor of the patella. J Bone Joint Surg [Am] 37: 184-187, 1955. 33. Baptista P.P.R.: Tratamento do tumor de células gigantes por curetagem, cauterização pela eletrotermia, regularização com broca e enxerto ósseo autólogo. Rev Bras Ortop 30: 819-827, 1995. 34. Ottolenghi C.E.: Massive osteo and osteoarticular bone graft. Technic and results of 62 cases. Clin Orthop 87: 156-164, 1972. 35. Kambin P.: Giant cell tumor of thoracic spine with pathological fracture paraparesis: a method of stabilization. J Bone Joint Surg [Am] 48: 774- 779, 1966. 36. Parrish F.F.: Treatment of bone tumors by total excision and replace- ment with massive autologous and homologous grafts. J Bone Joint Surg [Am] 48: 968-990, 1966. 37. Baptista P.P.R.: Tratamento do tumor de células gigantes da extremidade distal do fêmur e proximal da tíbia – Curetagem, cauterização pela eletrotermia e enxerto ósseo autólogo [Tese]. São Paulo: Faculdade de Ciências Médicas da Santa Casa de São Paulo, 1994. 38. Murphy W.R., Ackerman L.: Benign and malignant giant cell tumor of bone. Cancer 9: 317-324, 1956. 39. Camargo F.P.: Ressecção segmentar em tumores ósseos e reconstituição cirúrgica do esqueleto [Tese]. São Paulo: Faculdade de Medicina da Universidade de São Paulo, 1968. 40. Forrest M.: The pathologic of giant cell tumors of bone. Rev Chir Or- thop 61: 359-366, 1975. 41. Barnes R.: Giant cell tumor of bone. J Bone Joint Surg [Br] 54: 213-215, 1972. 42. Campbell C.J., Akbarnia B.A.: Giant cell tumor of the radius treated by massive resection and tibial bone graft. J Bone Joint Surg [Am] 57: 982- 986, 1975. 43. Frangakis E.K.: Soft tissue spread of giant cell tumor. J Bone Joint Surg [Am] 52: 994-998, 1971. 44. Caballos R.L.: The mechanism of metastasis in the called “benign giant cell tumor of bone”. Hum Pathol 12: 762-768, 1981. 45. Schajowics F.: Sobre la degeneración y la variedad maligna de los tumo- res a células gigantes. Rev Orthop Traum 10: 349-355, 1941. 46. Riley L.D., Hartmann W.: Soft tissue recurrence of giant cell tumor of bone after irradiation and excision. J Bone Joint Surg [Am] 49: 365-368, 1967.