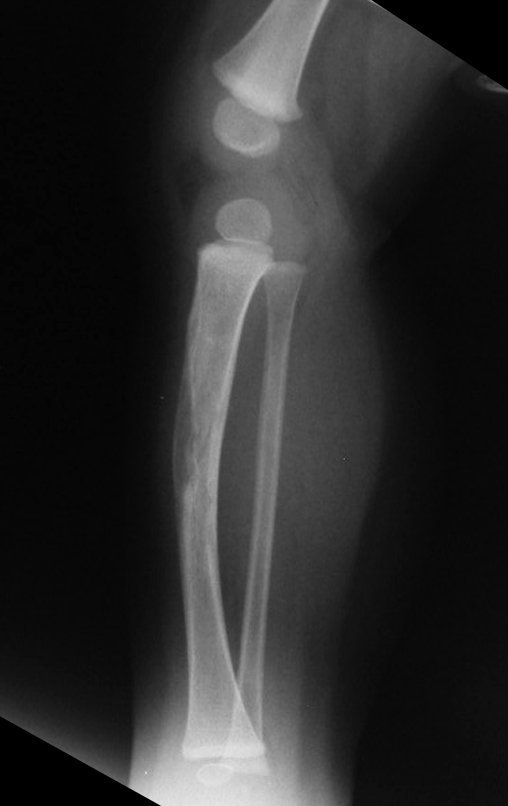
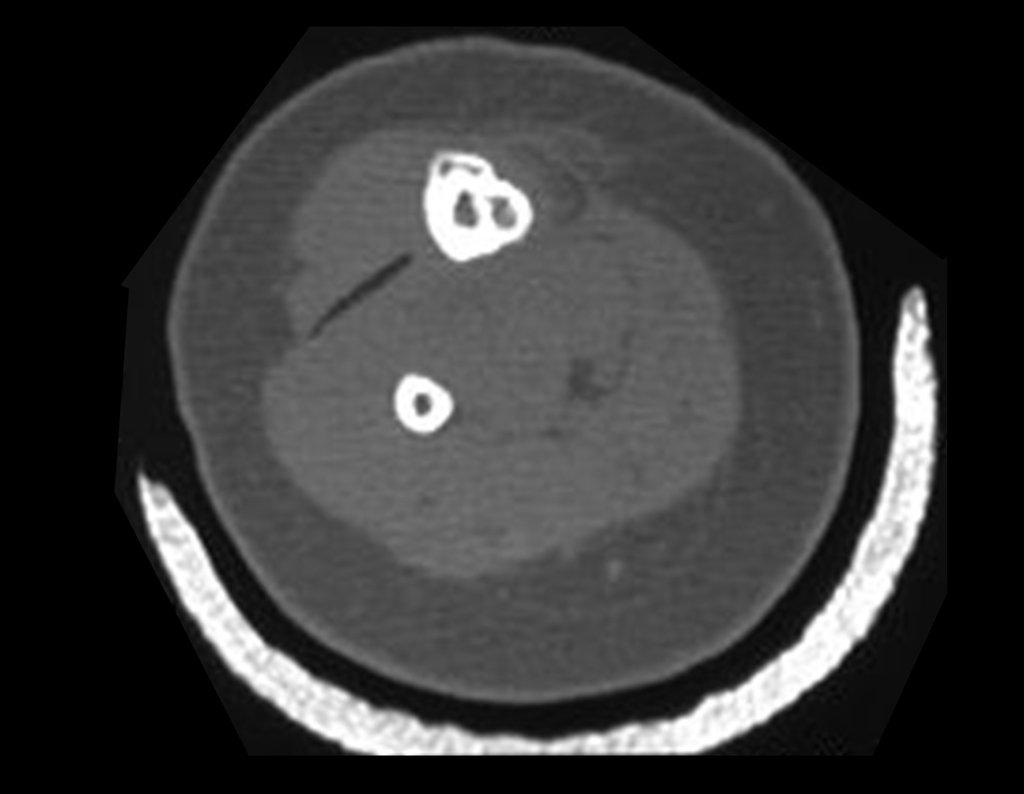
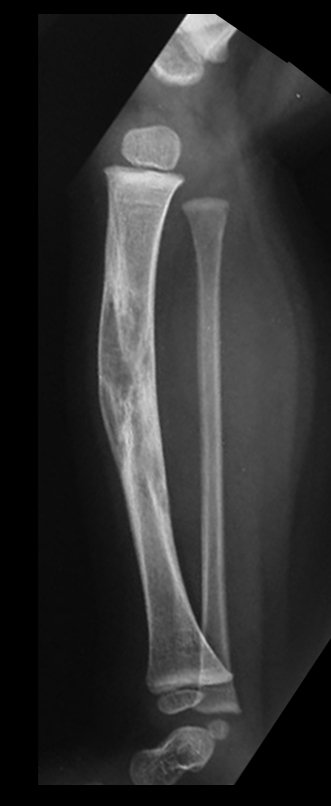
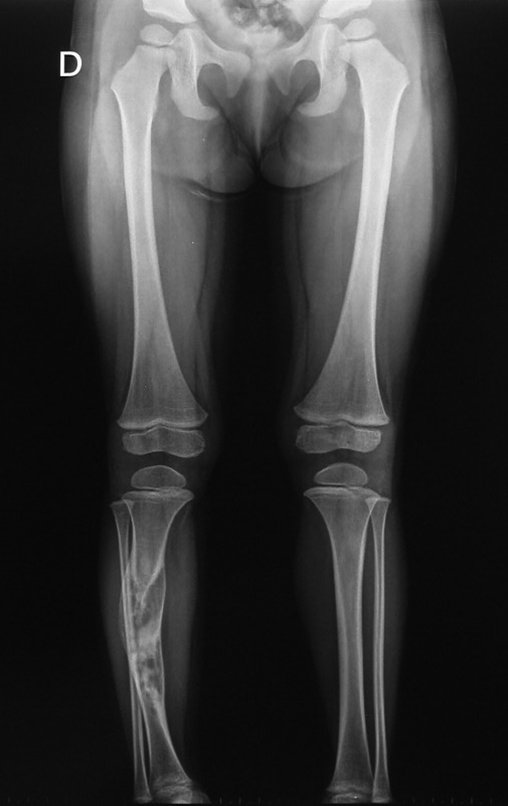
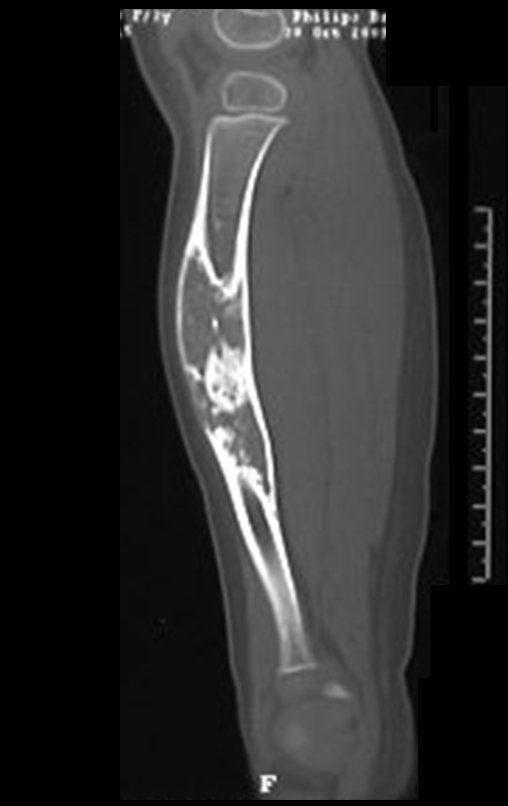
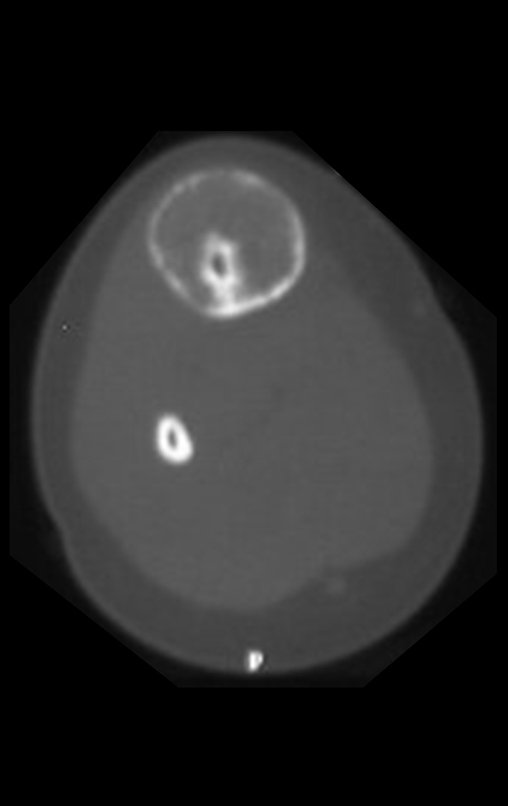
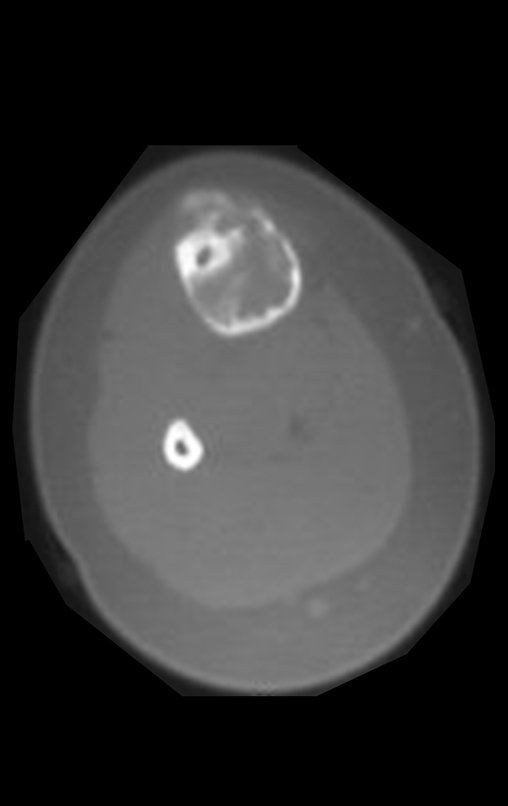
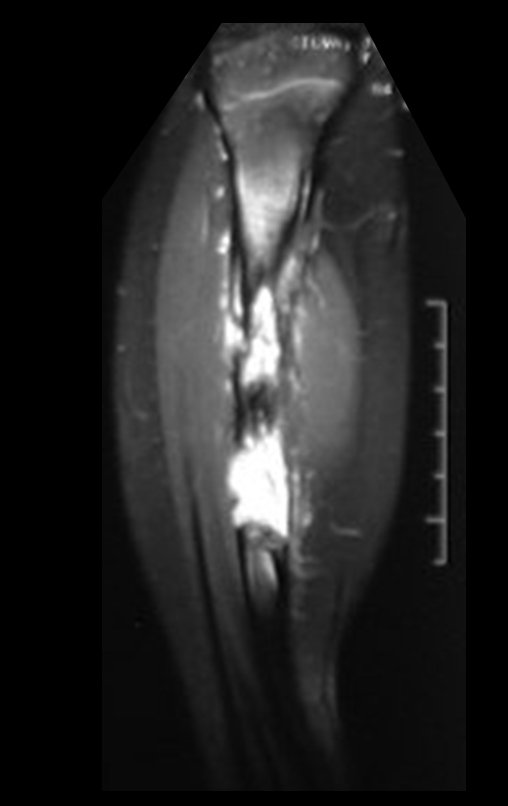
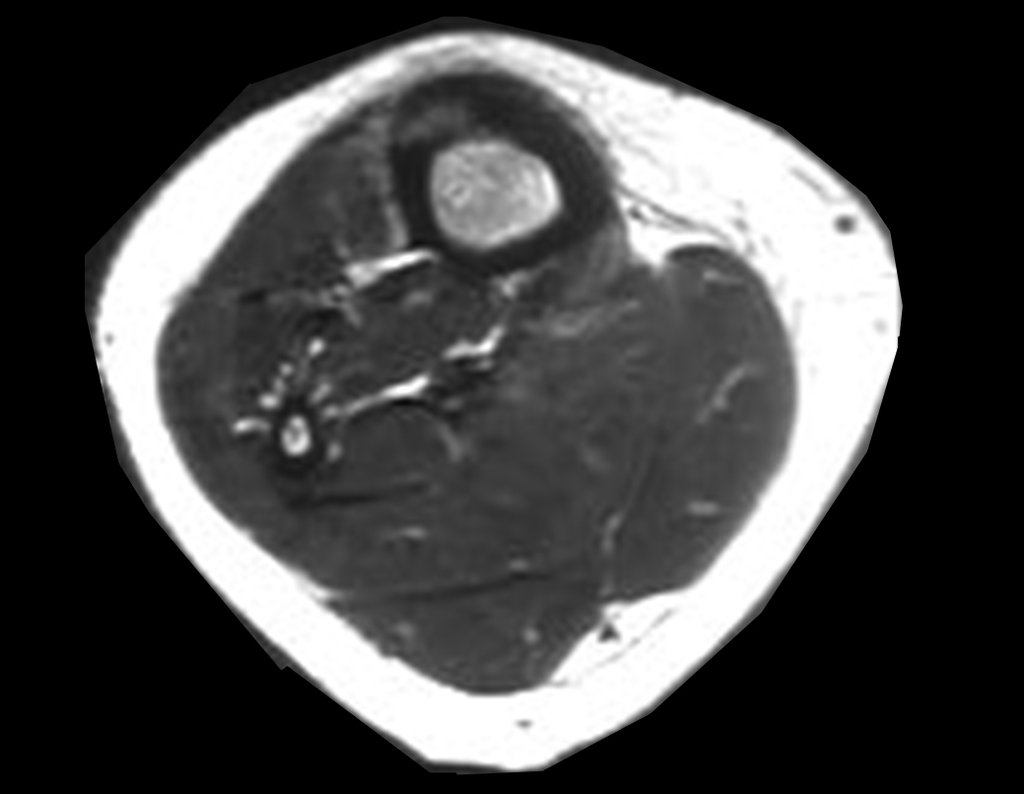
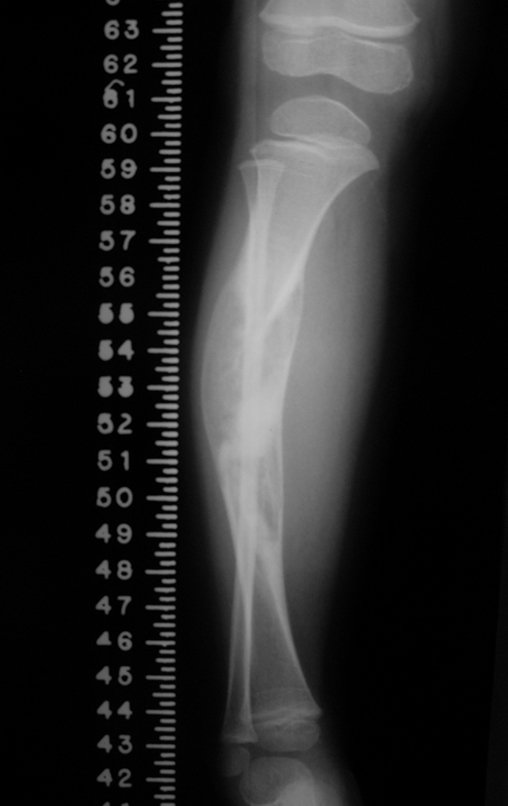
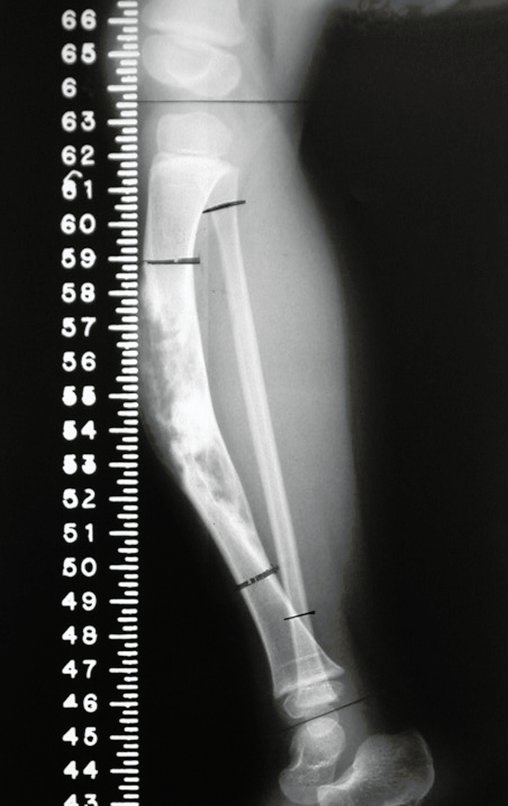
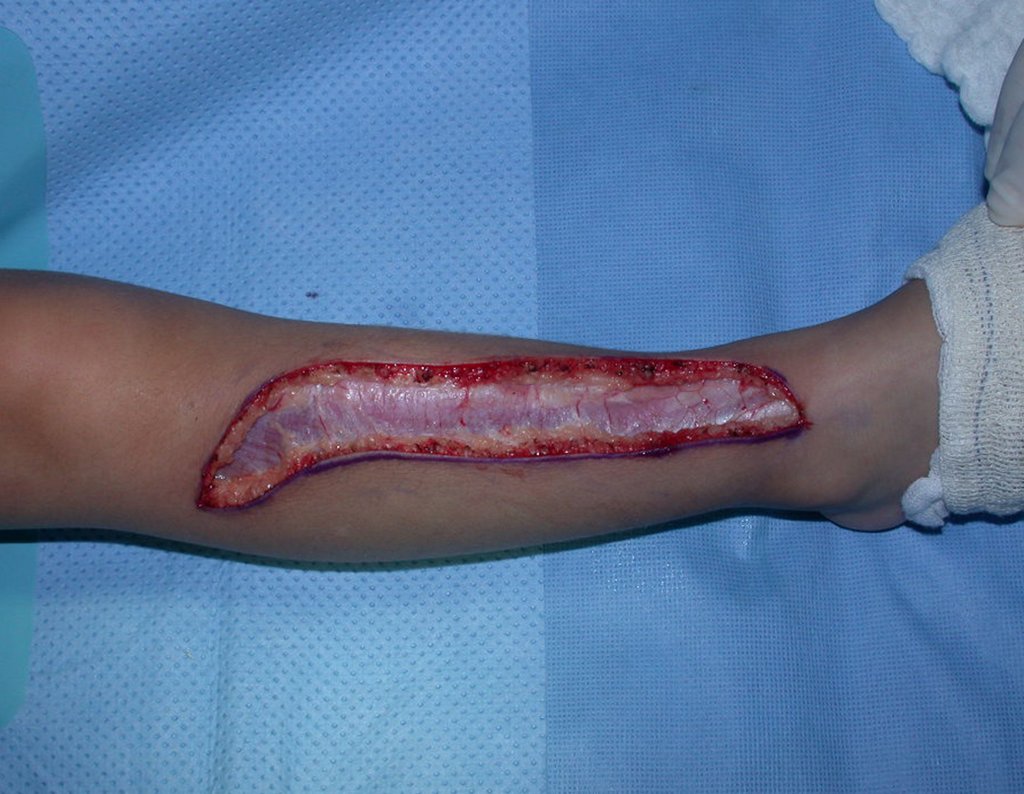
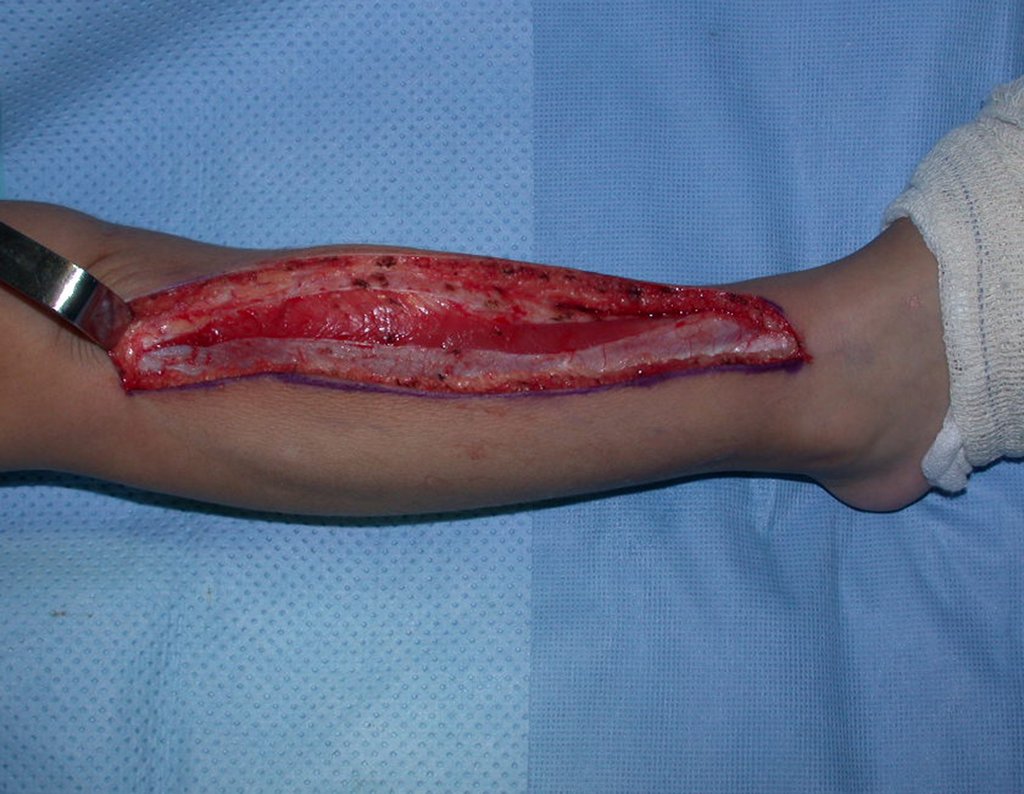
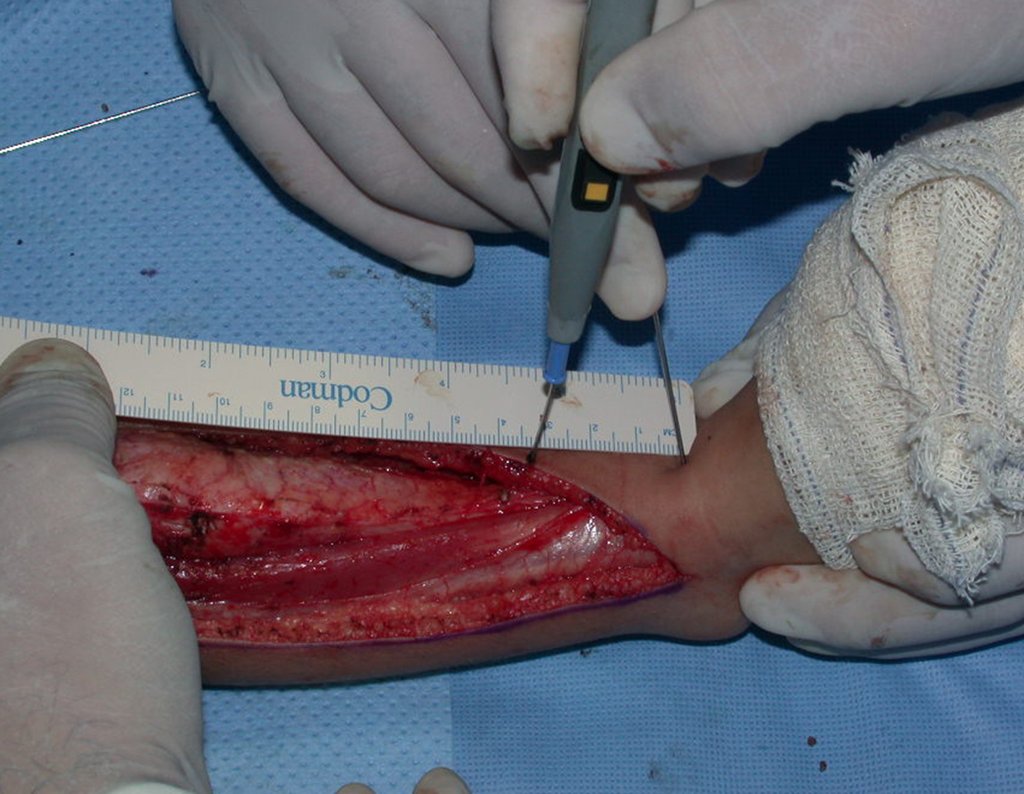
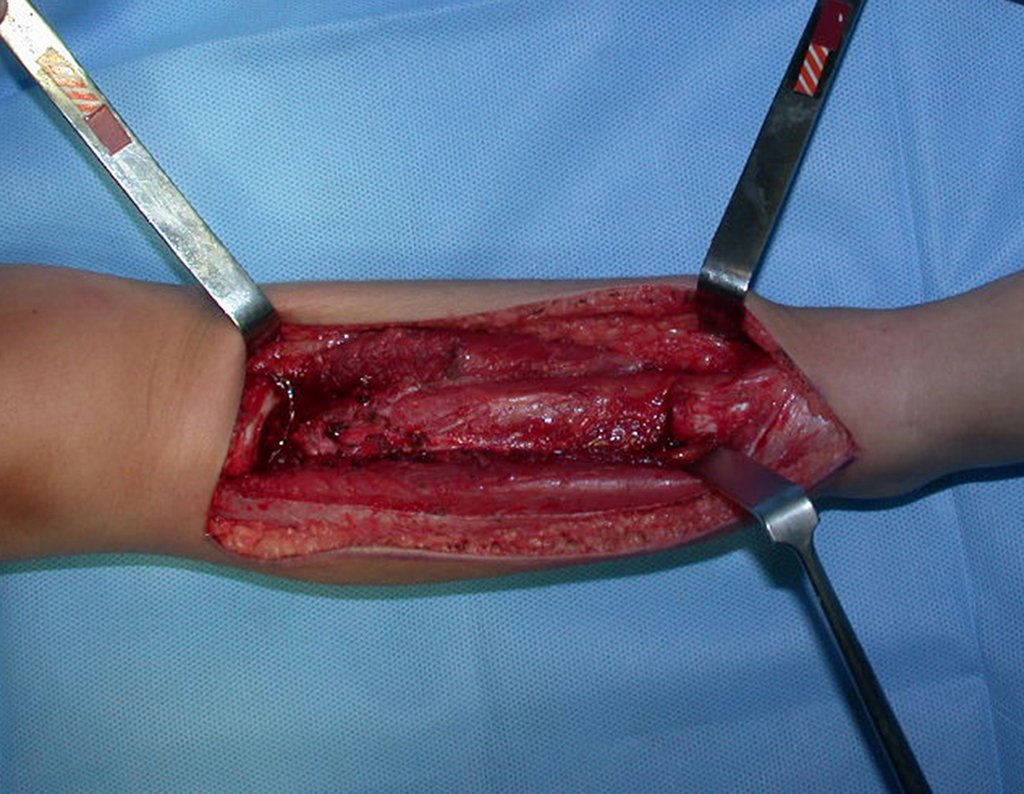
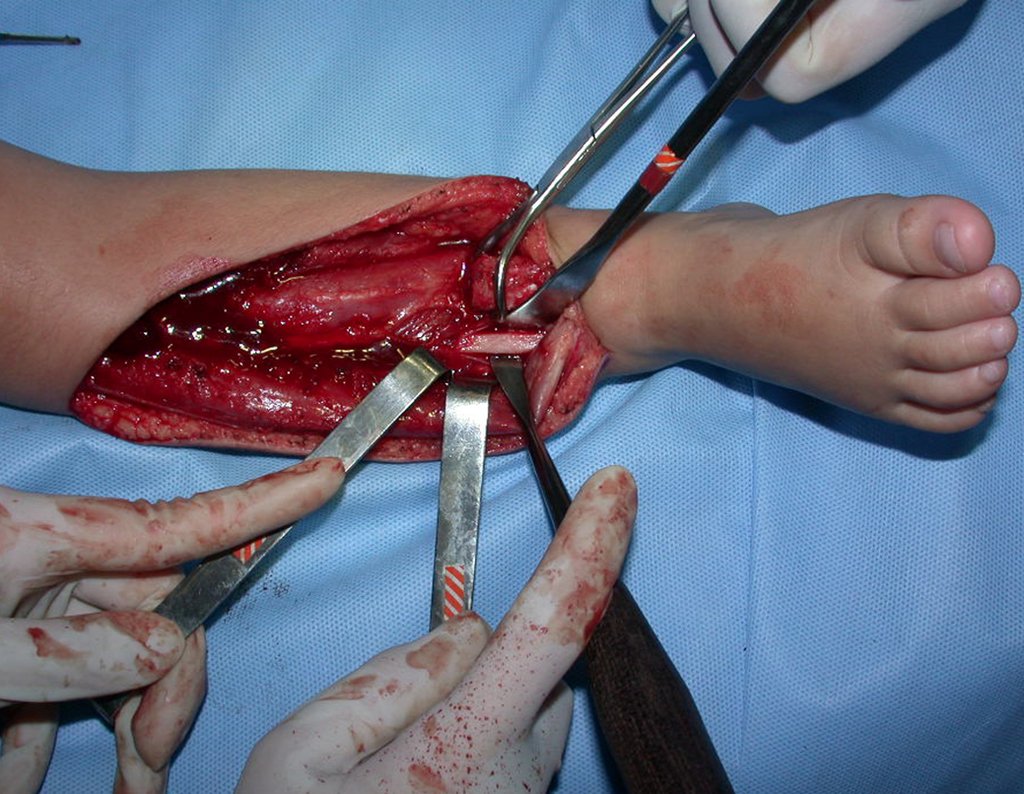
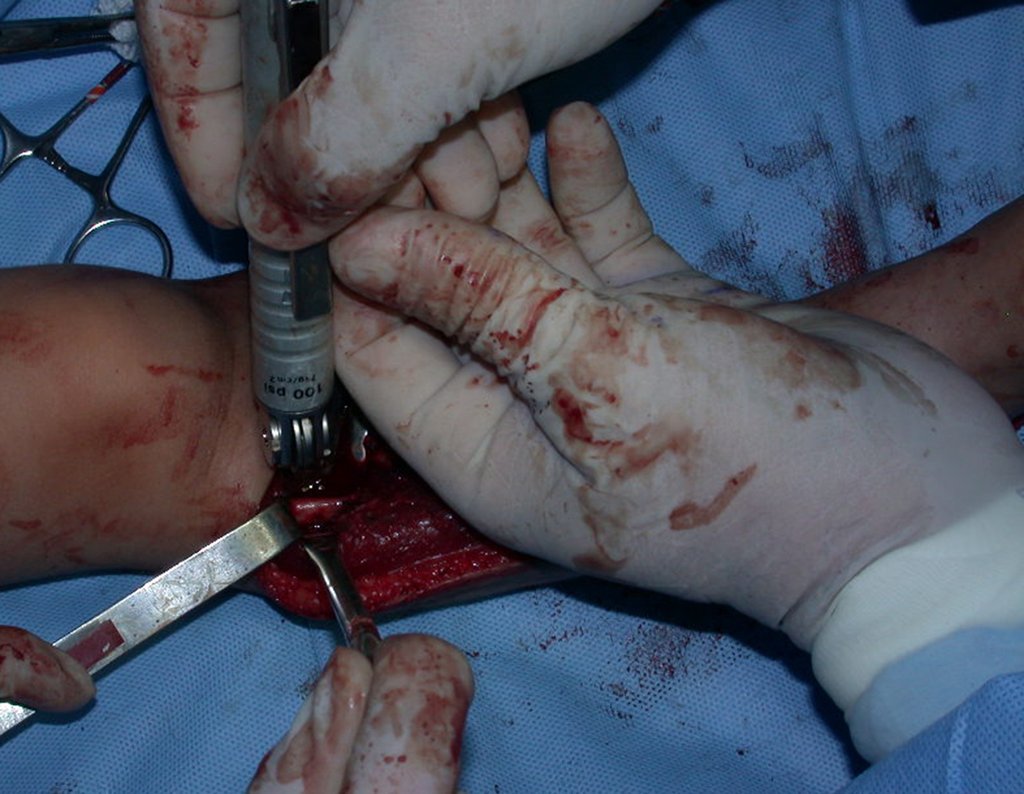
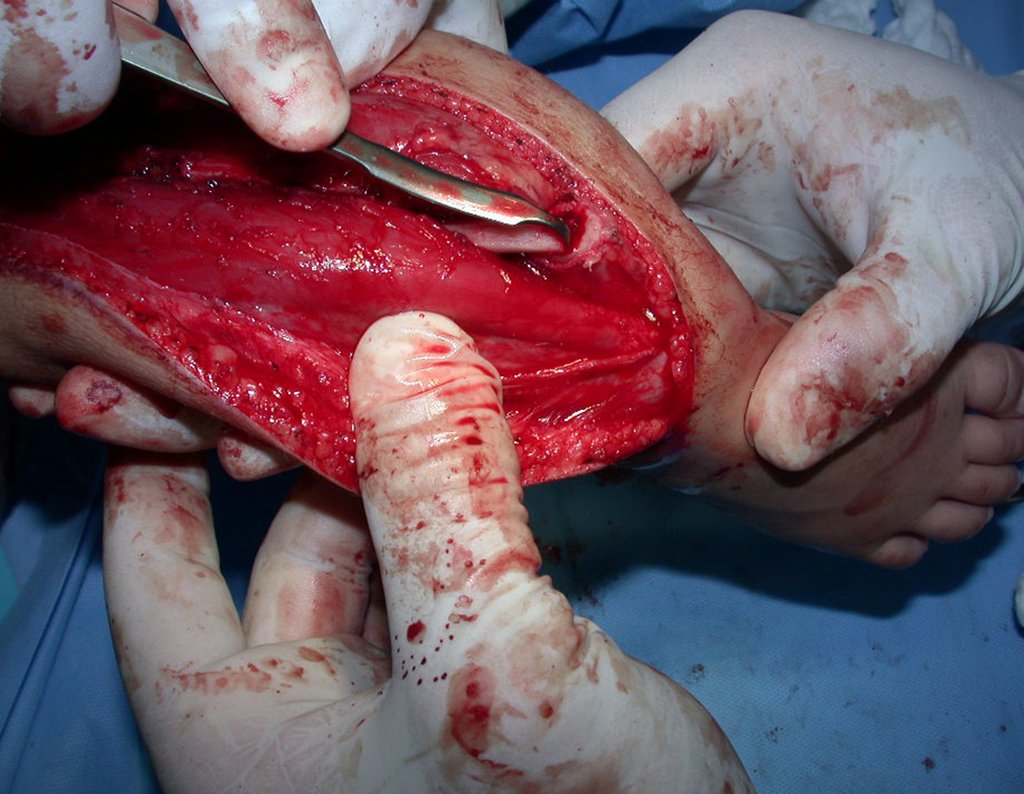
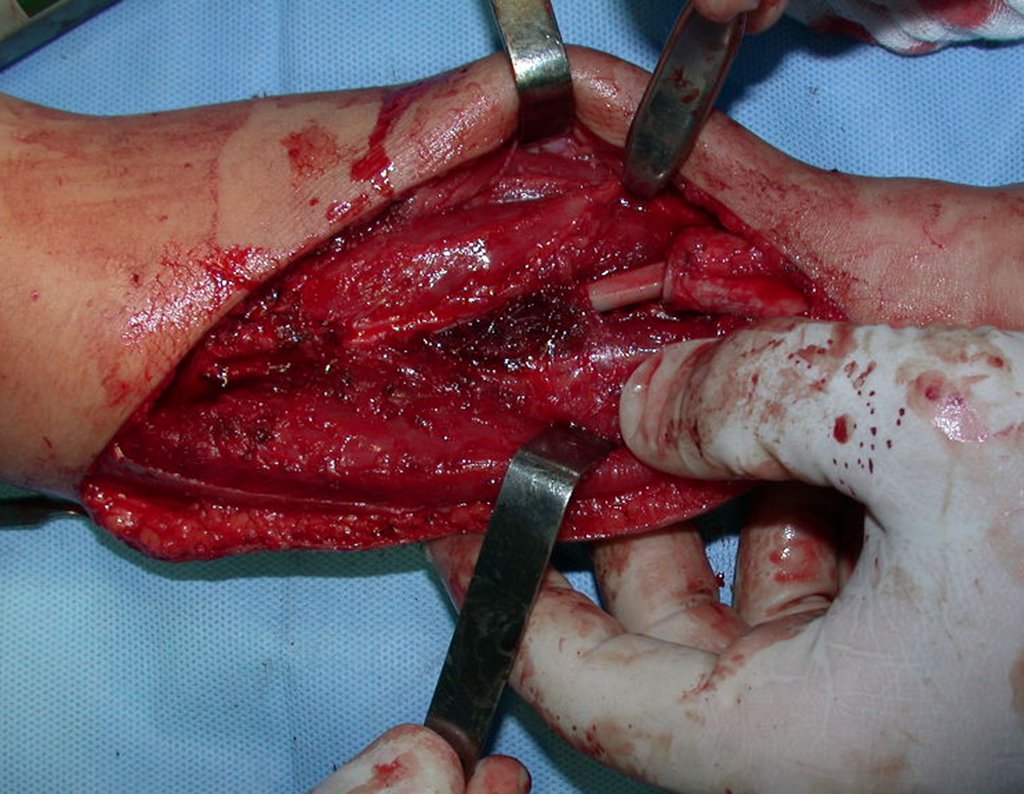
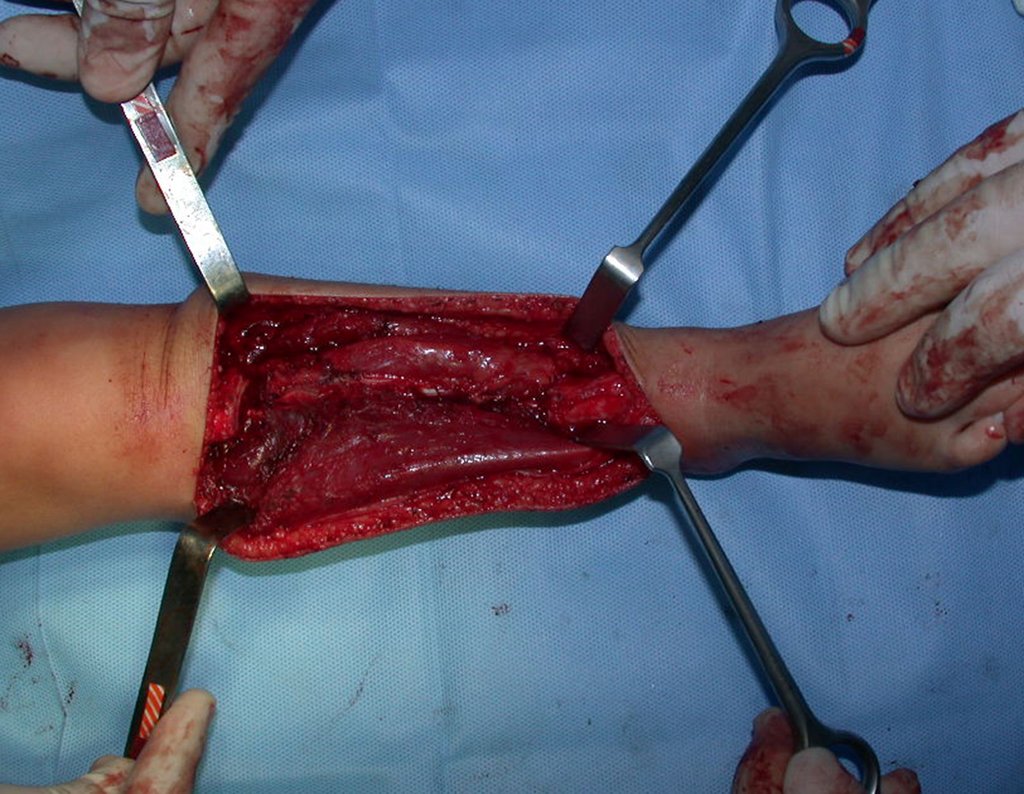
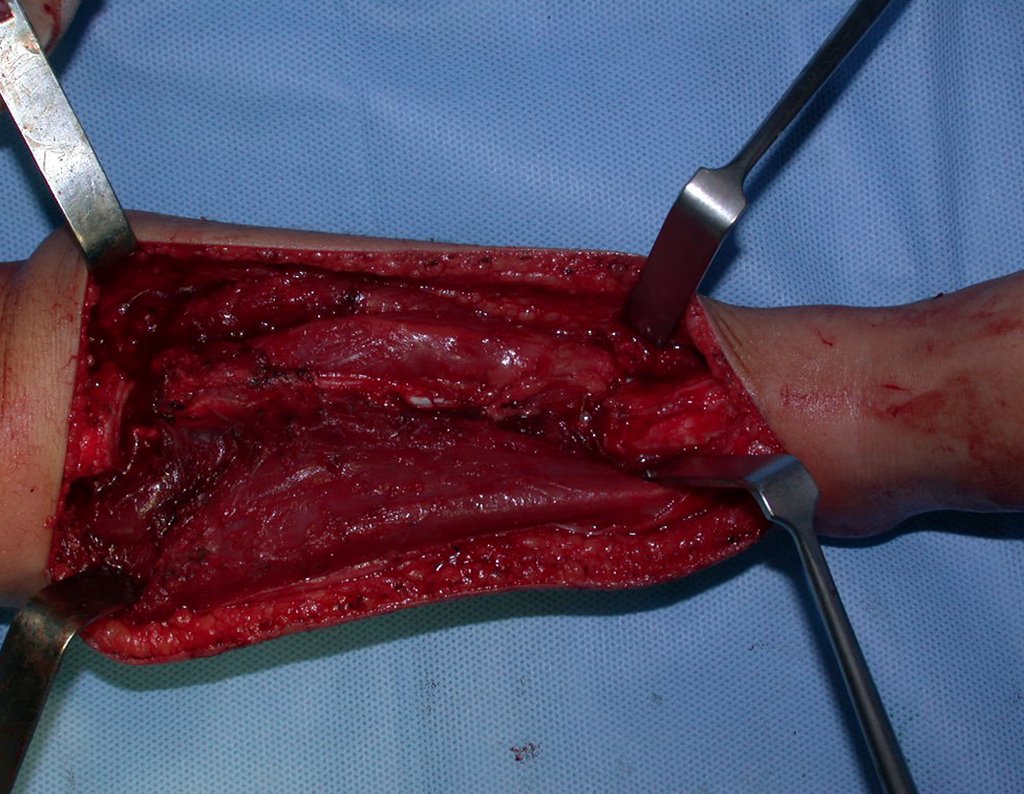
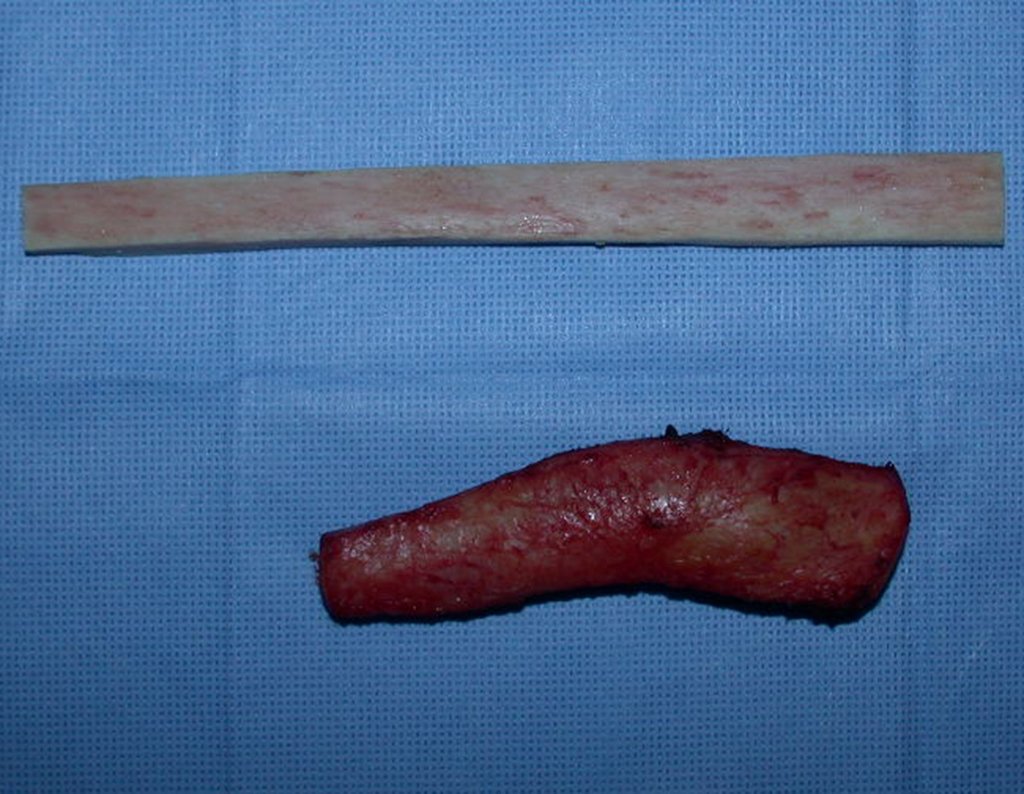
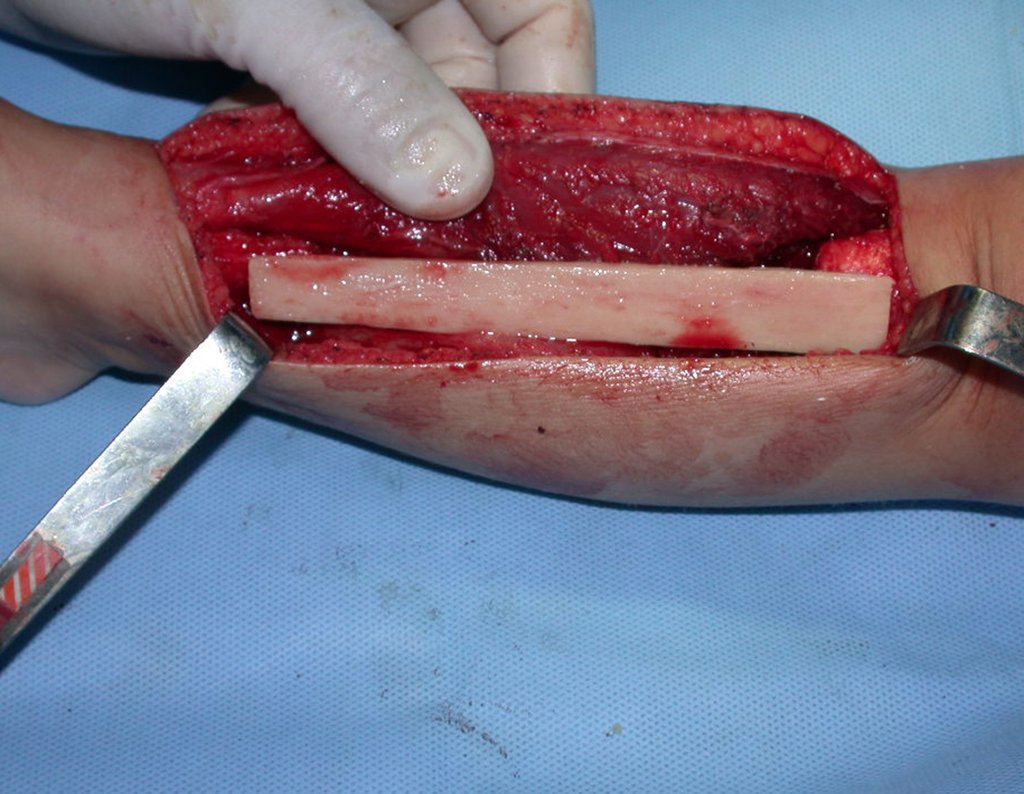
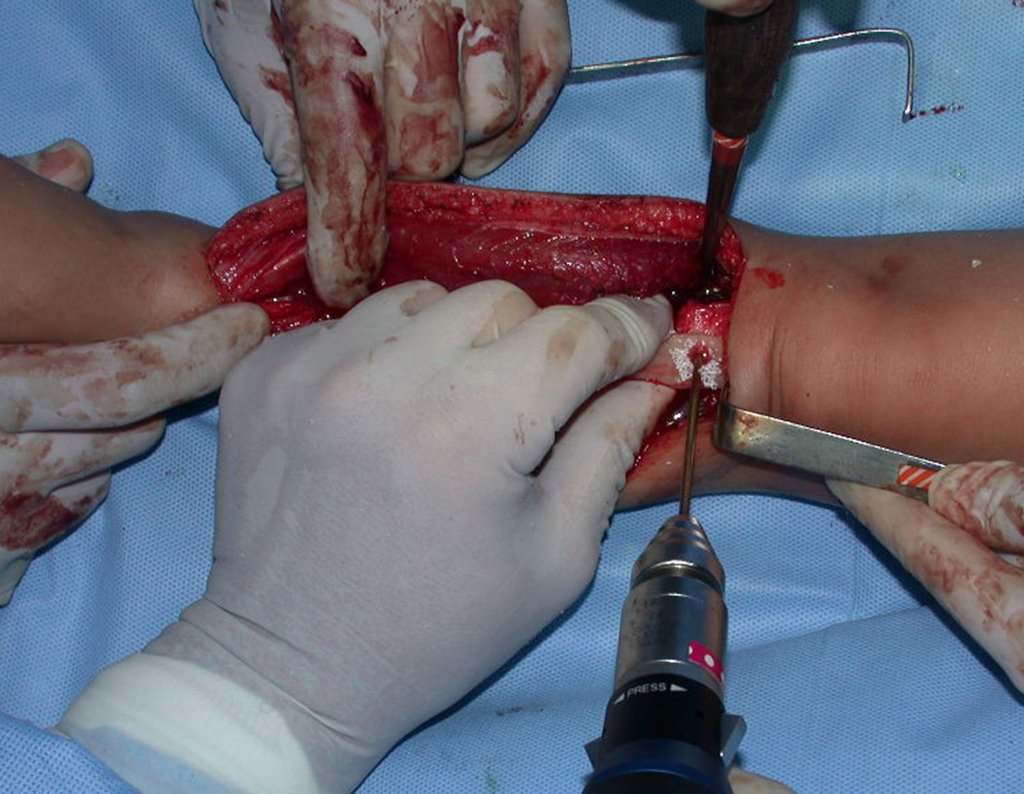
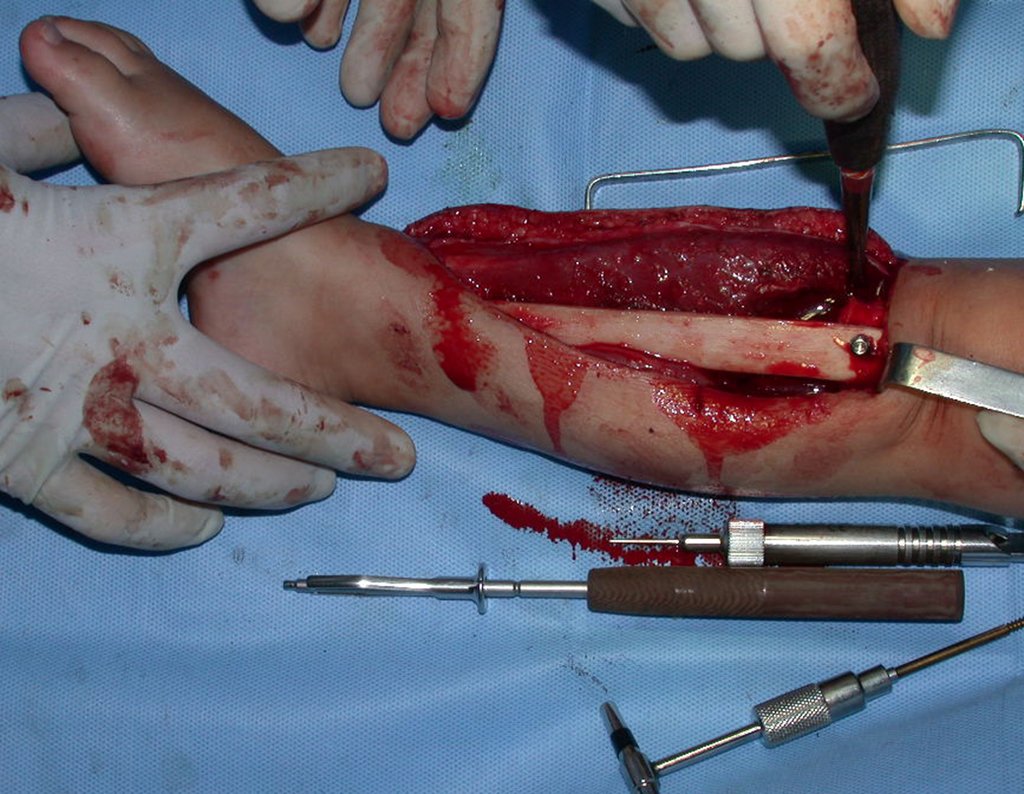
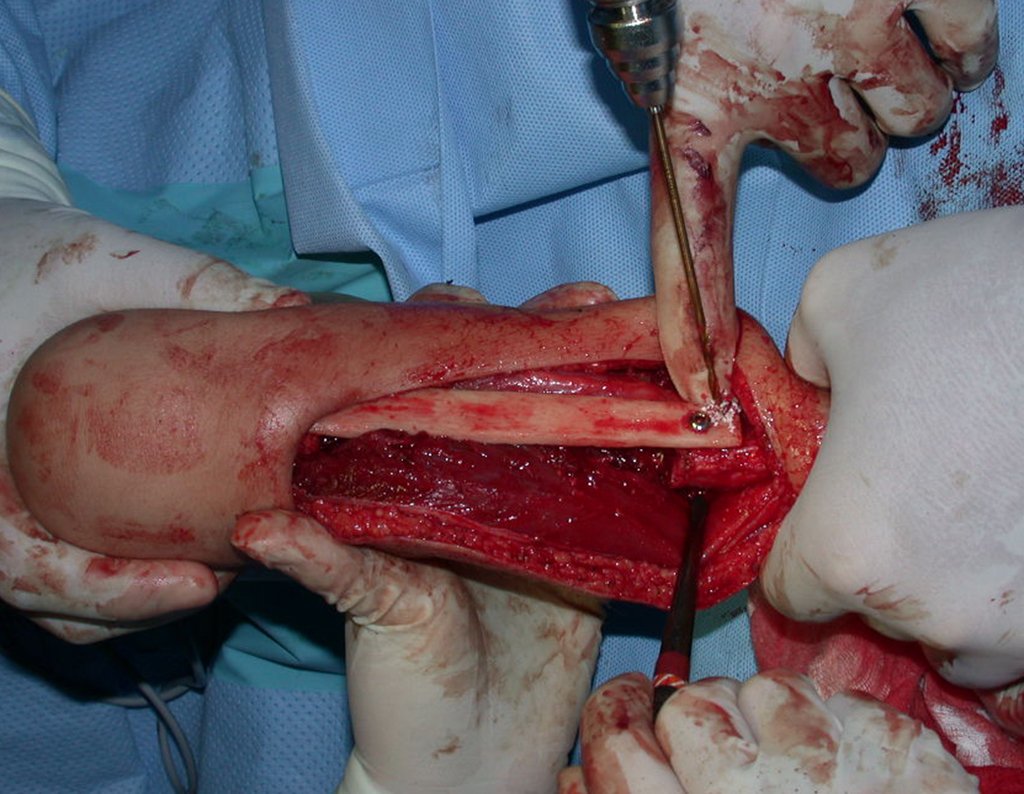
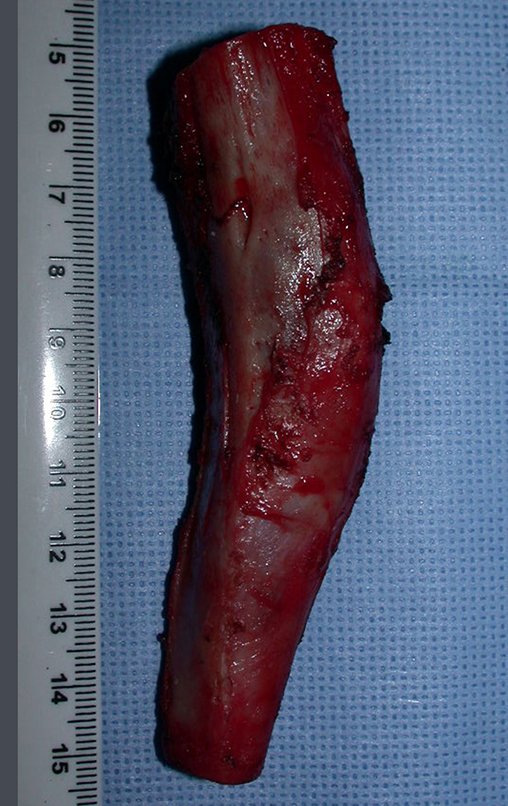
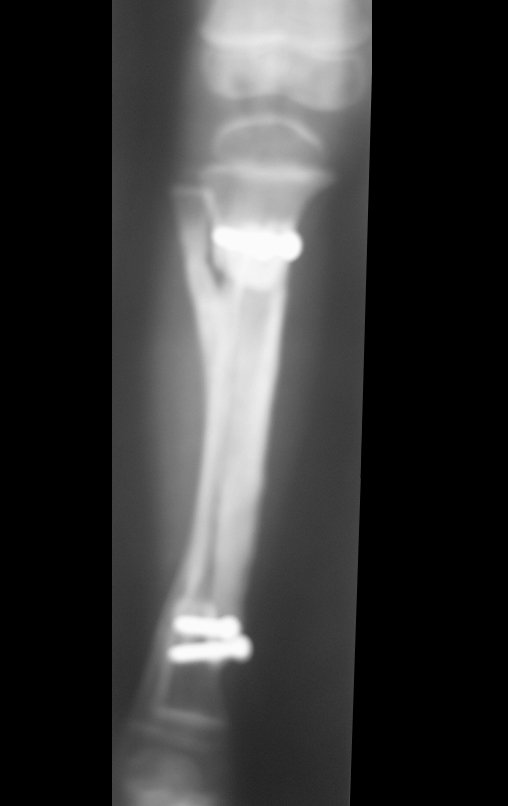
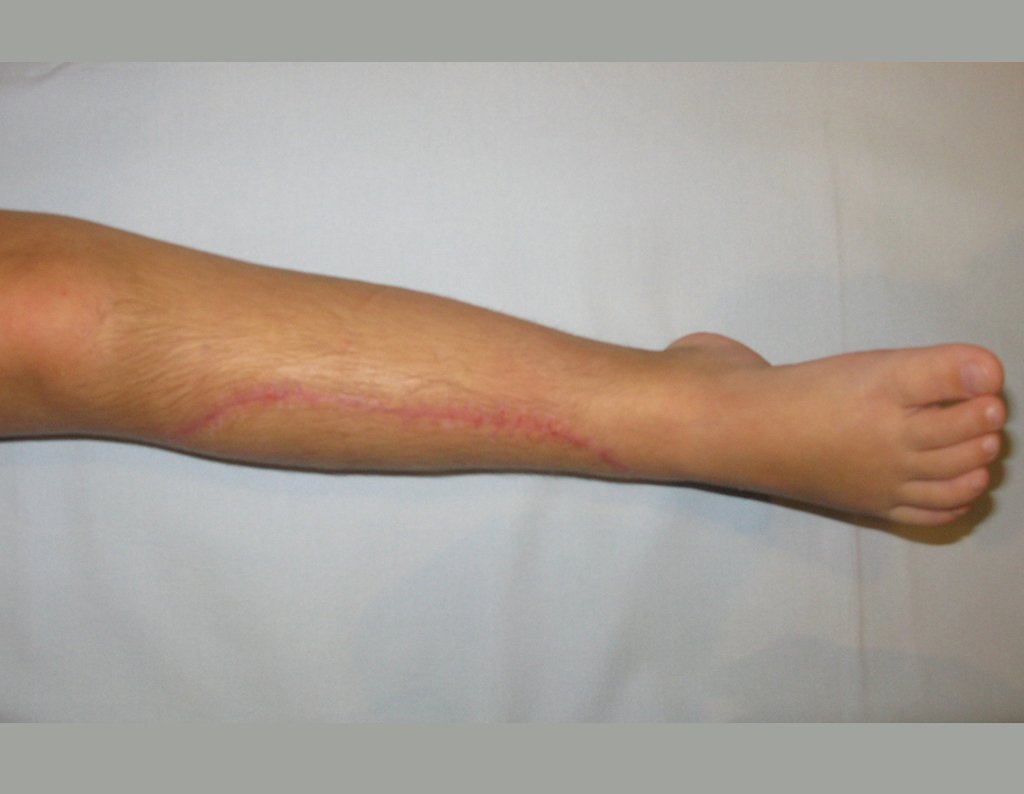
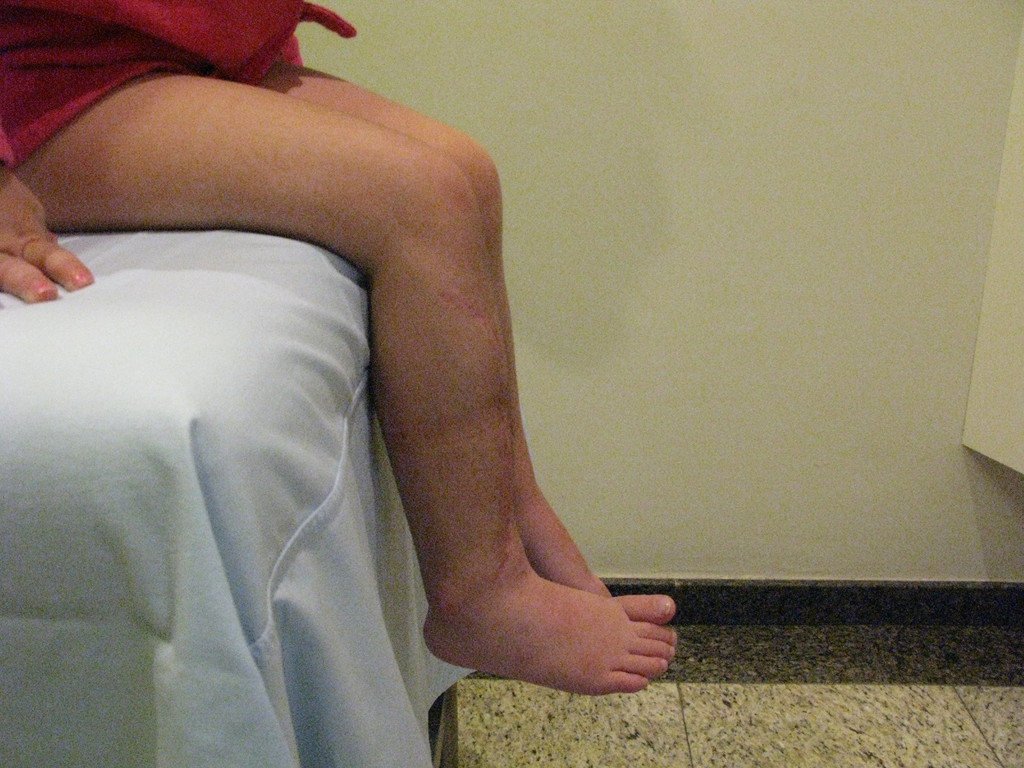
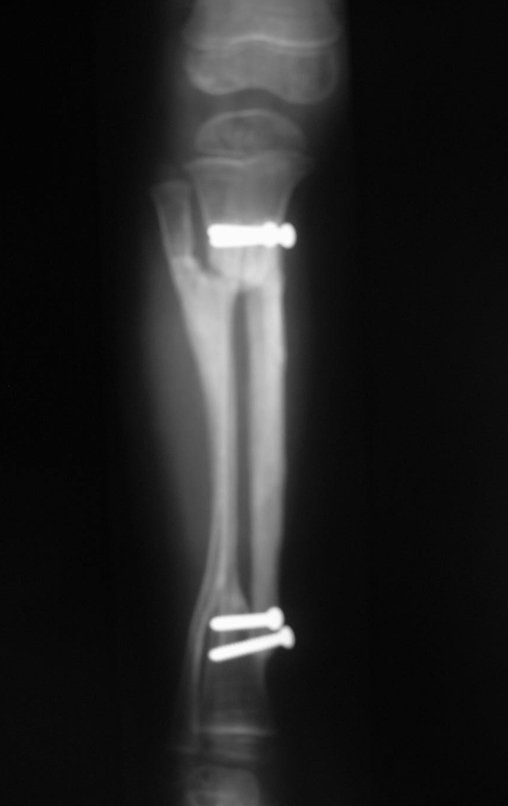
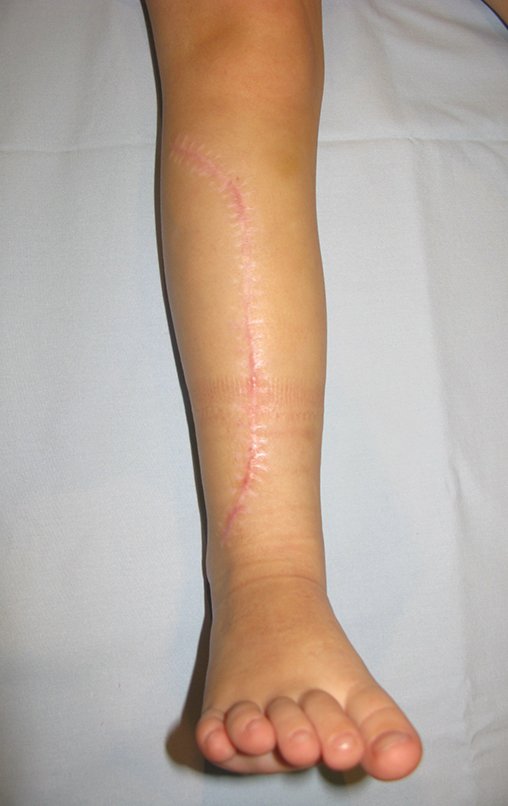
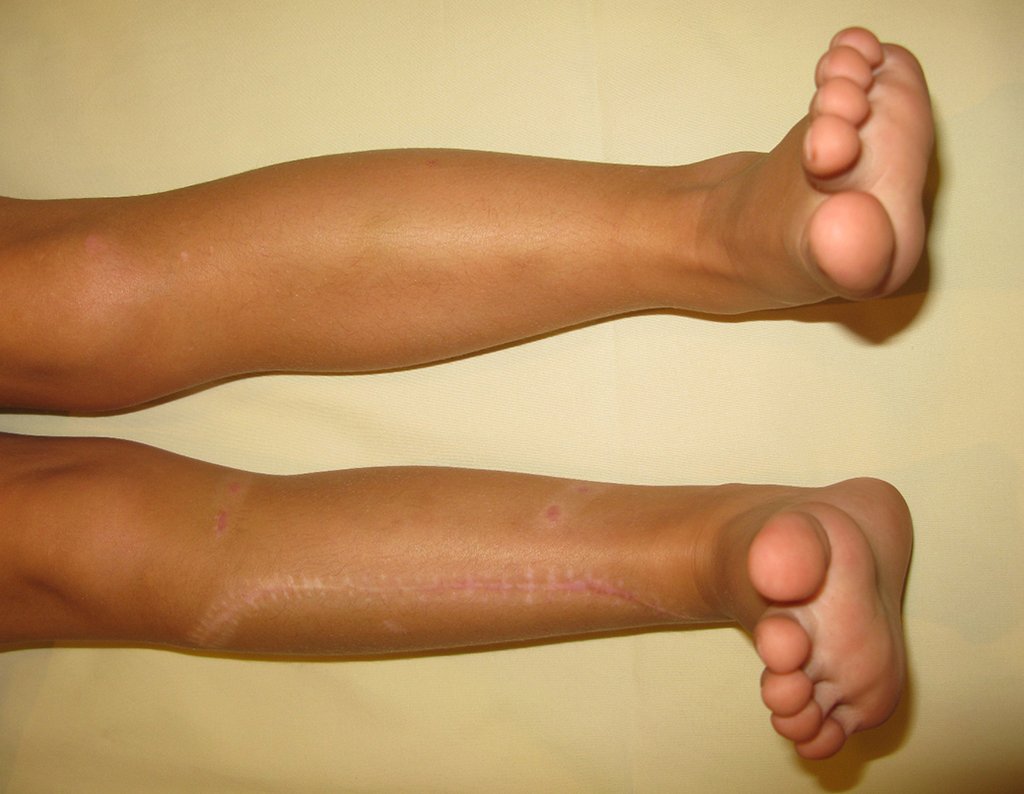
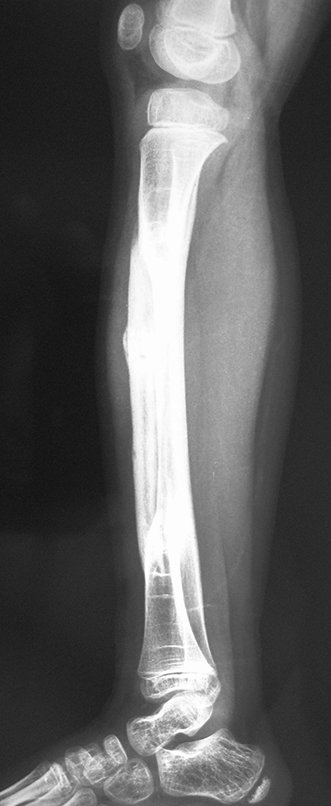
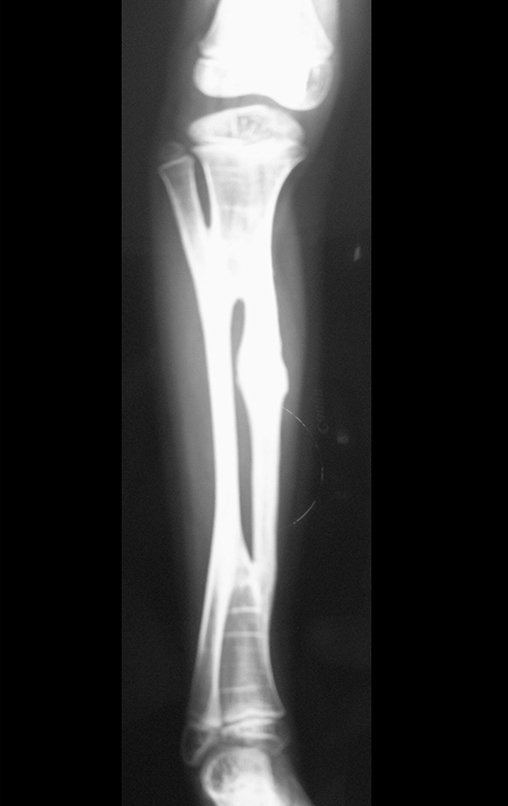
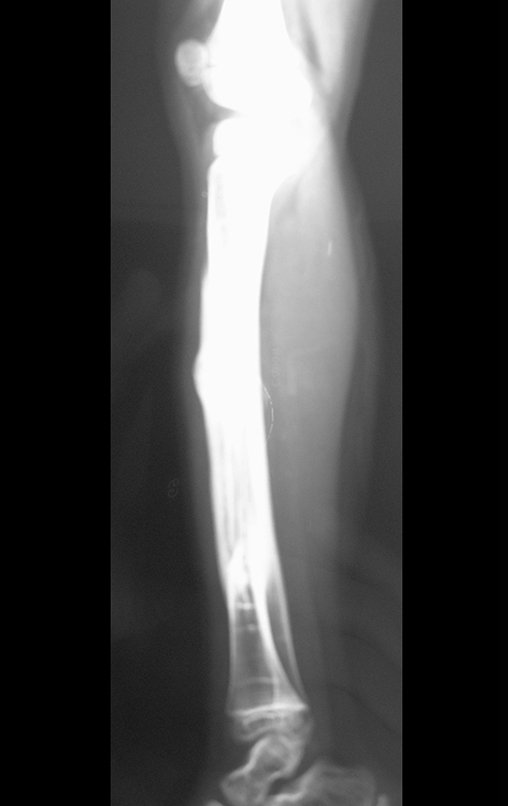
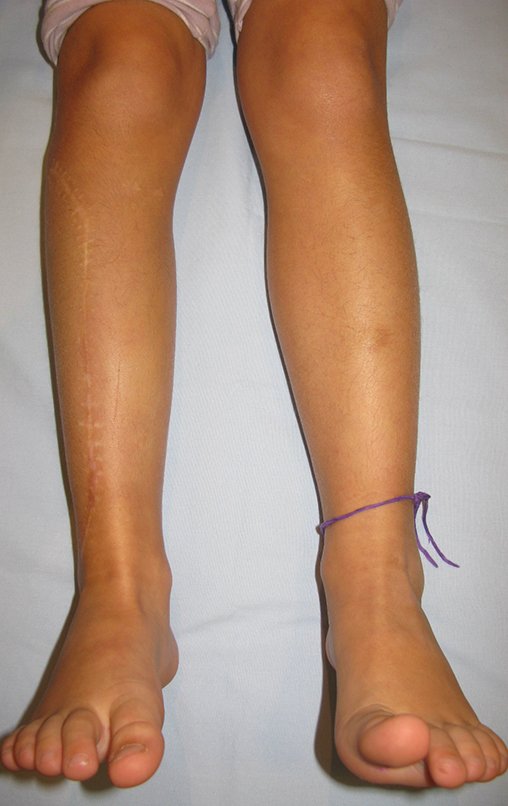
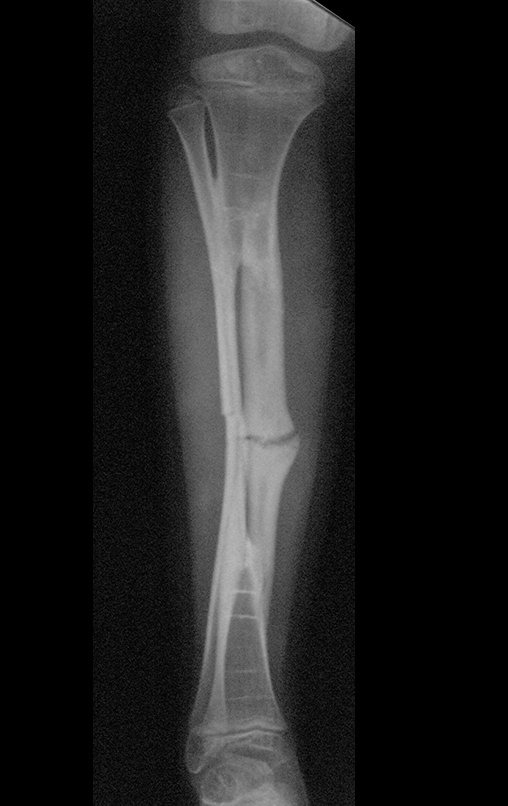
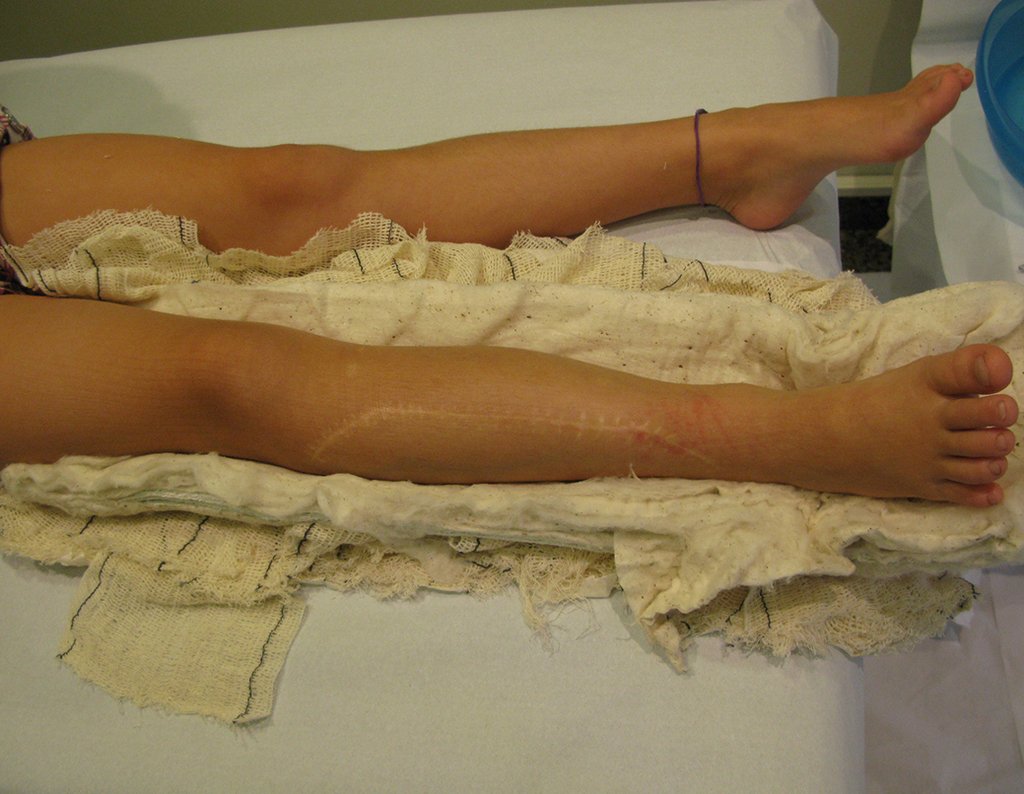
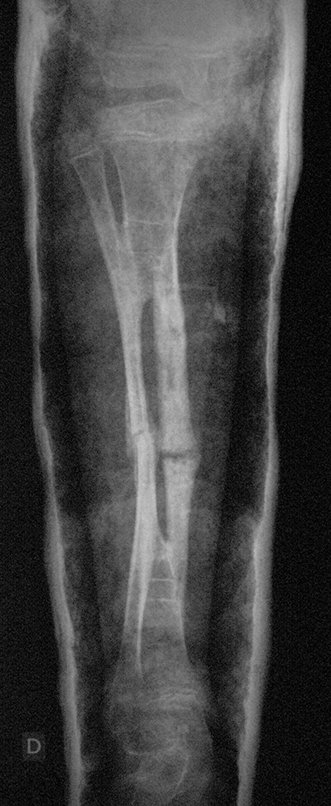
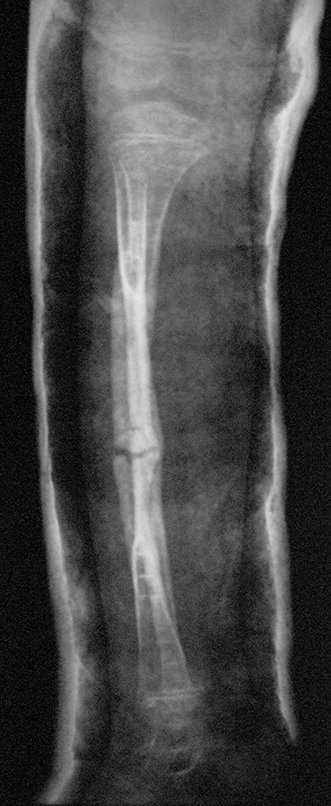
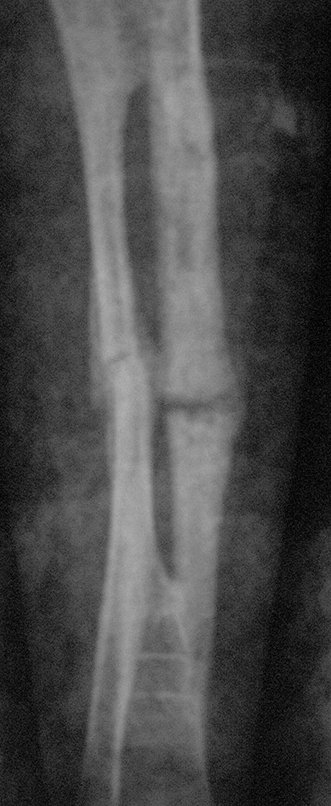
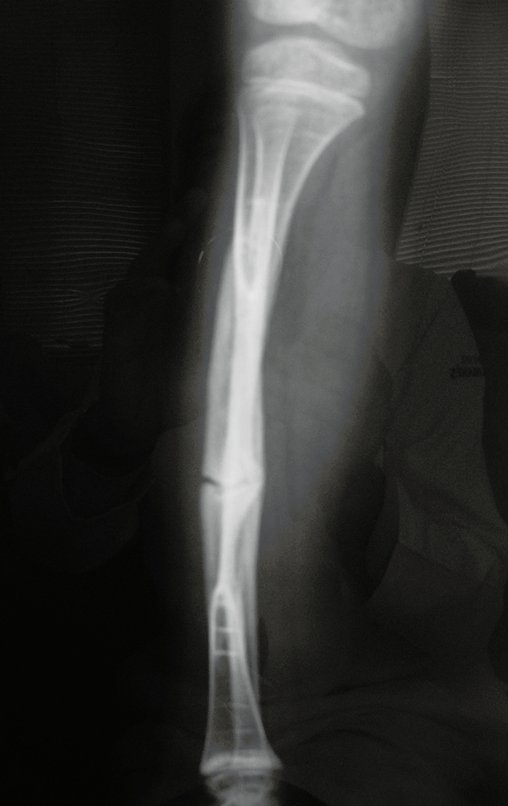
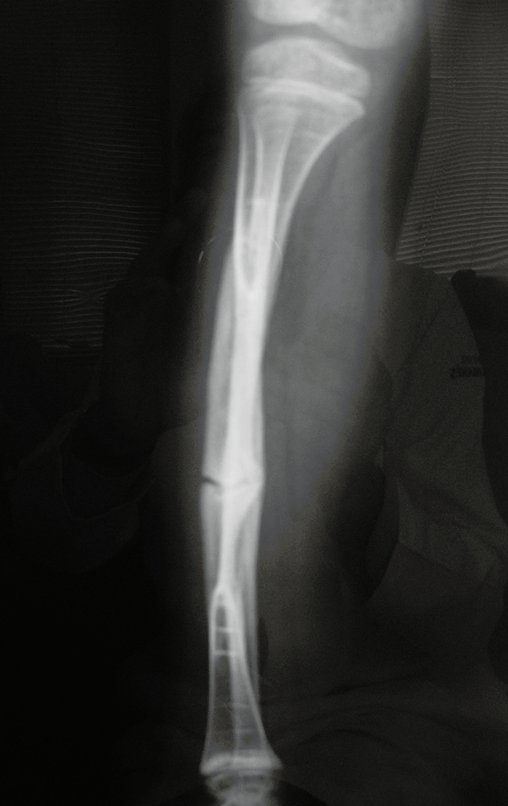
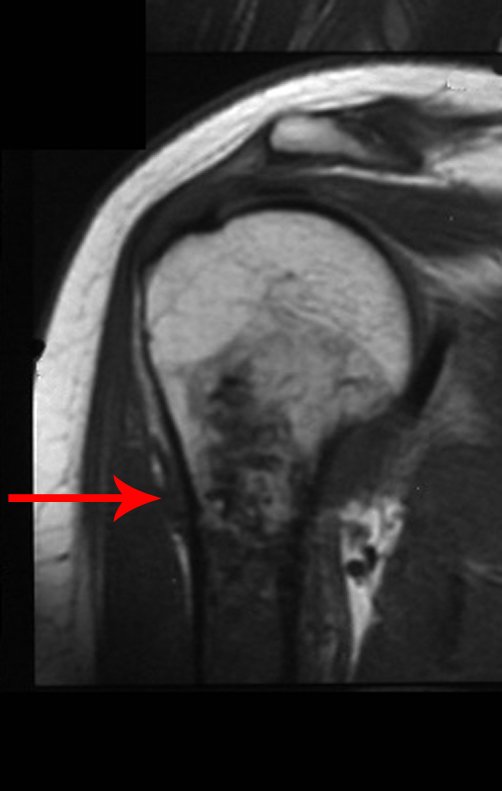
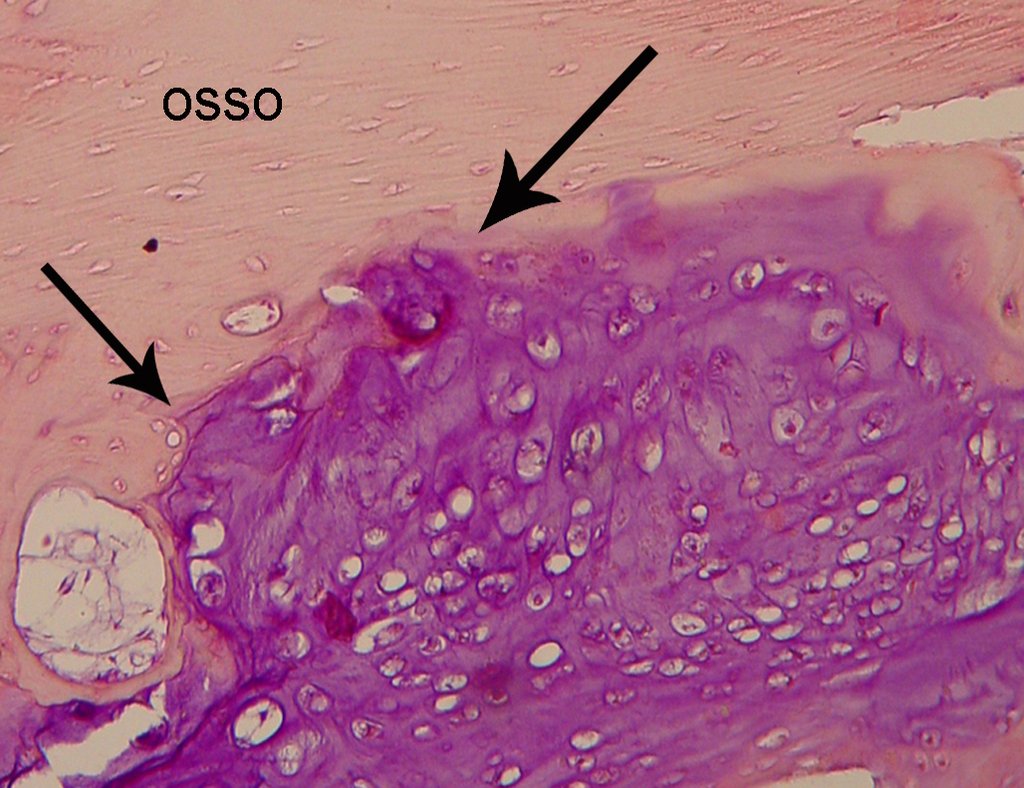
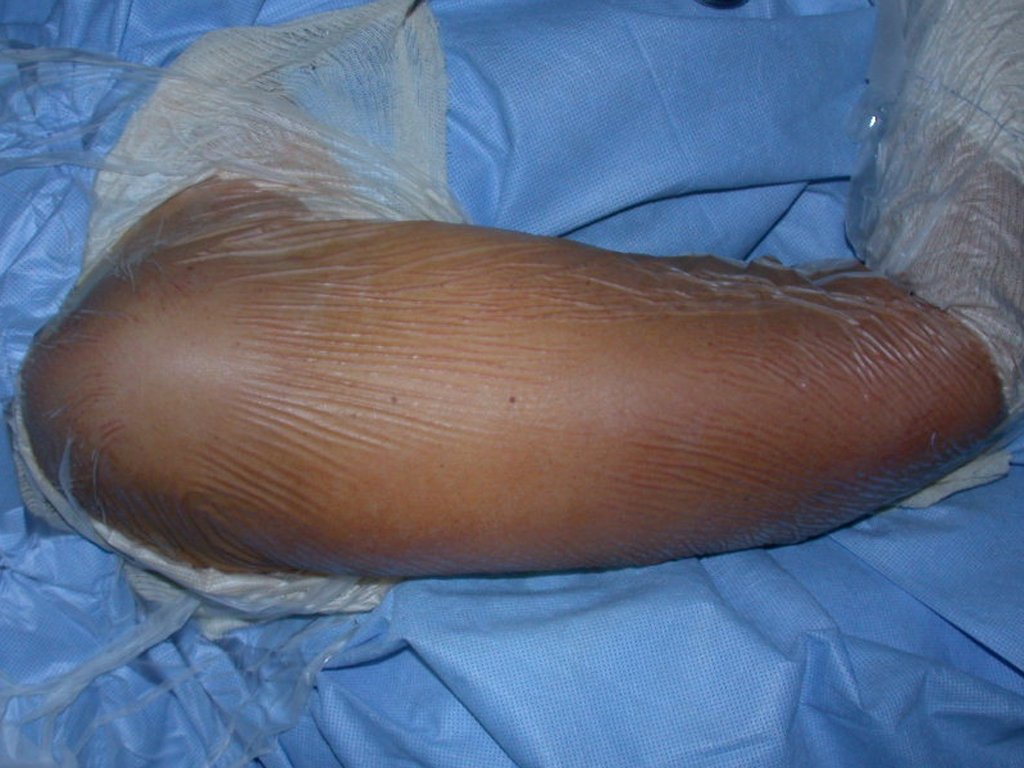
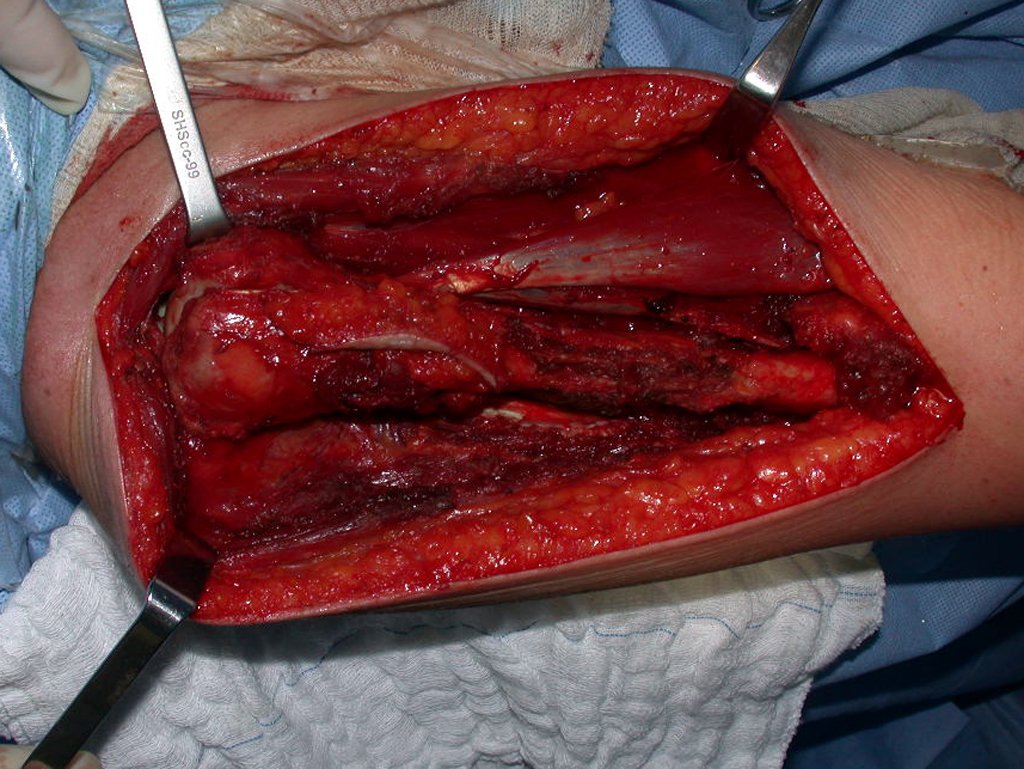
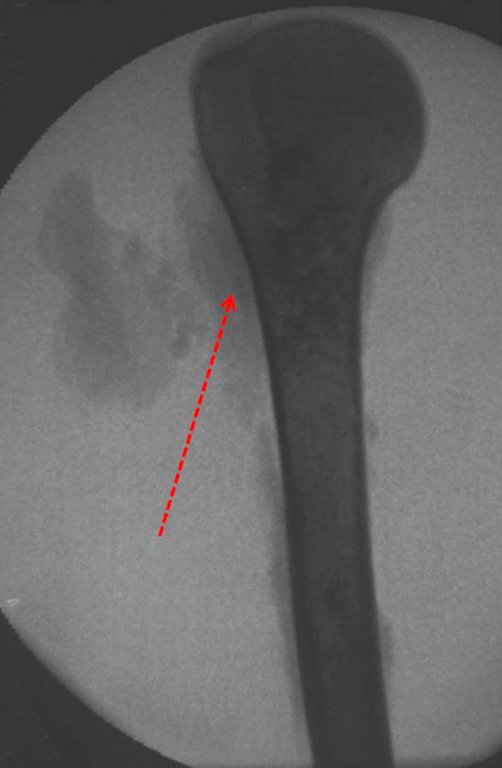
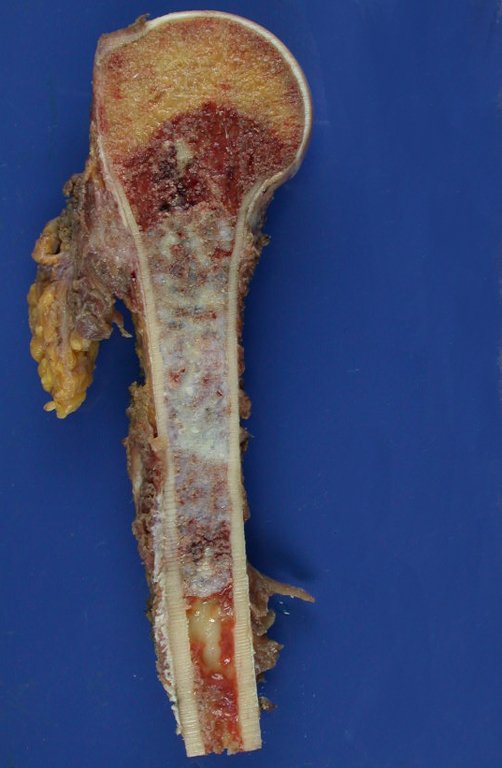
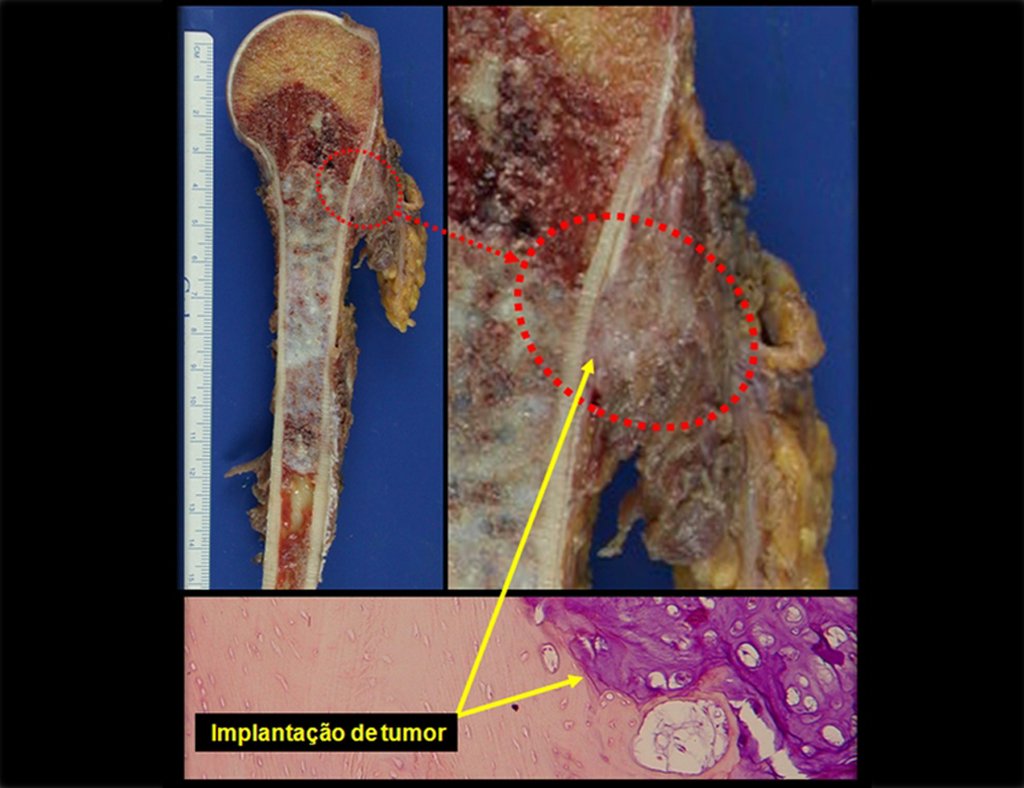
Fractura ósea patológica
Fratura em osso patológico. Em nossa experiência dedicada ao estudo e tratamento de pacientes com doenças ósseas, vivenciamos inúmeros casos de fraturas que ocultavam doenças não diagnosticadas.
Fractura ósea patológica. En nuestra experiencia dedicada al estudio y tratamiento de pacientes con enfermedades óseas, hemos vivido numerosos casos de fracturas que ocultaban enfermedades no diagnosticadas.
Fractura ósea patológica. La denominación simplificada de “fractura patológica” no es apropiada, ya que toda fractura es un proceso patológico. Es correcto utilizar el término: fractura ósea patológica, que con mayor frecuencia se relaciona con neoplasias, ya sean primitivas o metastásicas.
Los procesos patológicos que pueden provocar fracturas se clasifican en displasias óseas, trastornos circulatorios, cambios degenerativos, inflamatorios e infecciosos o neoplásicos.
Para el correcto diagnóstico es necesario considerar los aspectos clínicos del paciente, mecanismos de fractura, aspectos imagenológicos, de laboratorio y anatomopatológicos.
Las fracturas óseas, que ocultan procesos patológicos no diagnosticados, pueden provocar un tratamiento ortopédico inadecuado.
Los organizaremos didácticamente dentro de los cinco capítulos de Patología General, a saber: disgenesias o displasias, procesos degenerativos, trastornos circulatorios, inflamaciones y enfermedades neoplásicas.
DISPLASIAS ÓSEAS:
– dis (del griego = alteración), plasien (= forma). Cualquier cambio en la morfología ósea, ya sea congénito o hereditario, puede provocar deformidades y/o fracturas. Debido a la frecuencia y polimorfismo de los cambios anatómicos que presentan, destacamos los siguientes:
1 – Osteopsatirosis u Osteogénesis imperfecta:
En cualquiera de sus manifestaciones, en la clasificación de Rubin, es una enfermedad hereditaria que predomina en la diáfisis de los huesos largos y determina cambios en la morfología ósea por deficiente aposición ósea subperióstica. El crecimiento óseo longitudinal se produce al nivel de la línea epifisaria, donde el cartílago se transforma en tejido óseo. Sin embargo, el crecimiento transversal depende de la resorción endóstica y de la aposición ósea subperióstica. El fallo de este mecanismo de modelado en los huesos provoca un deterioro del crecimiento en dirección transversal. Debido a esta patogénesis, los huesos se vuelven muy delgados y frágiles, sujetos a frecuentes fracturas.
2 – Osteopetrosis o Enfermedad de Albers Schomberg:
Es una enfermedad caracterizada por cambios en la línea epifisaria de los huesos de origen endocondral. Las lesiones se condensan debido a la falla en la actividad de los osteoclastos que, en condiciones normales, actúan en la resorción fisiológica de los huesos. Al prevalecer la aposición sobre la resorción, los huesos se condensan inicialmente en la metáfisis y, progresivamente, en todo el hueso, cuya consistencia se vuelve pétrea. Además de la anemia, que resulta de la reducción e incluso de la ausencia de los espacios medulares, sede de la hematopoyesis, los huesos más densos pierden su elasticidad y pueden fracturarse.
3 – Displasia fibrosa, mono o poliostótica:
Es una condición en la que hay reemplazo parcial del hueso por proliferación fibrosa entre haces de osteoides con poca mineralización y tiene menor densidad radiográfica. Con el crecimiento y la maduración esquelética, generalmente se produce una osificación progresiva, que incluso puede parecerse a la estructura ósea normal. La zona lesionada tiene una densidad menor que la del hueso normal y, por tanto, la principal manifestación anatómica es la deformidad, que en ocasiones conduce a la fractura.
CAMBIOS METABÓLICOS :
Para que los huesos mantengan una estructura normal, los mecanismos de aposición y reabsorción deben estar en equilibrio. La aposición depende de la actividad de los osteoblastos que elaboran el
Fibras de colágeno, matriz proteica de los huesos. A lo largo de las fibras de colágeno se producirán depósitos de minerales, fosfato tricálcico, en forma de cristales de hidroxiapatita. Las fibras proteicas de colágeno representan el 95% de la estructura de la matriz ósea. El 5% restante son mucopolisacáridos, ácido hialurónico y condroitinsulfúrico, que predominan en las “líneas de cemento” o “líneas inversas”, que delimitan las diferentes bandas de aposición de matriz, manteniendo el crecimiento óseo normal. Al mismo tiempo, la resorción ósea la llevan a cabo los osteoclastos bajo estimulación de la hormona paratiroidea. Estos mecanismos de aposición y reabsorción, que representan el llamado remodelado óseo ( recambio ), son intensos en la primera década de la vida, menos en la segunda y progresivamente menos a medida que avanza la edad, pero siempre presentes a lo largo de nuestra vida.
El metabolismo óseo normal, por tanto, consiste en: a- aposición de la matriz proteica cuyas fibras colágenas son producidas por los osteoblastos, los cuales requieren actividad muscular para cumplir sus funciones; b- ingesta dietética de proteínas, vitaminas A y C, minerales principalmente calcio y fósforo; c- las hormonas gonádicas, tiroideas, pituitarias y suprarrenales también son necesarias para la formación y mineralización de la matriz. Para la reabsorción, los osteoclastos producen enzimas que permiten la disolución de la matriz y la solubilización de minerales, que actúan bajo el estímulo de la hormona paratiroidea.
Los cambios en cualquiera de los elementos que contribuyen a alterar el recambio conducirán a la enfermedad ósea metabólica, especialmente los siguientes:
1 – Osteoporosis:
Es una causa importante y frecuente de fracturas, provocada por la reducción de la consistencia ósea debido a la reducción cuantitativa de la matriz, reduciendo el lecho de depósito mineral que conlleva mayor fragilidad ósea y fracturas, especialmente de vértebras y fémur. La osteoporosis no depende de la falta de calcio o fosfatos, ya que significa deficiencia de matriz, lo que reduce el área de aposición de minerales. Las causas surgen de una menor actividad muscular en personas con estilo de vida sedentario, especialmente personas mayores o en pacientes que llevan mucho tiempo encamados, de ahí la creciente importancia del ejercicio para tratarlo, además de una dieta con un aporte adecuado de proteínas. Los estados de deficiencia proteica por deficiencia dietética o exceso de eliminación están sujetos a osteoporosis, al igual que ocurre en estados de desnutrición y enfermedades con disproteinemia, como el mieloma múltiple y la carcinomatosis ósea. La osteoporosis también ocurre con cambios en las glándulas endocrinas, como hipoestrogenismo posmenopáusico, hipertiroidismo, adenomas hipofisarios, gigantismo y acromegalia, cambios en la corteza suprarrenal, que conducen al síndrome de Cushing, y otros.
2 – Osteomalacia y raquitismo:
Son enfermedades resultantes de la deficiencia de minerales, es decir, que no dependen de cambios en la matriz proteica. En el raquitismo, la deficiencia de minerales predomina en las líneas epifisarias o placas de crecimiento, donde la demanda es mayor y necesaria para la mineralización de los haces osteoides recién formados. Debido a la menor resistencia de estas regiones, se producirá un agrandamiento “en forma de copa” en las metáfisis de los huesos largos y un “rosario desvencijado” en las costillas. La osteomalacia también se conoce como “raquitismo adulto”. Aunque es poco común, se traduce en una deficiencia mineral generalizada, ya que no existe una placa de crecimiento en los huesos. Ocurre debido a una reducción de la absorción intestinal.
en pacientes que han sido sometidos a resecciones intestinales importantes o debido a una deficiencia dietética. Las fracturas resultan de una mayor fragilidad ósea provocada por la deficiencia de minerales.
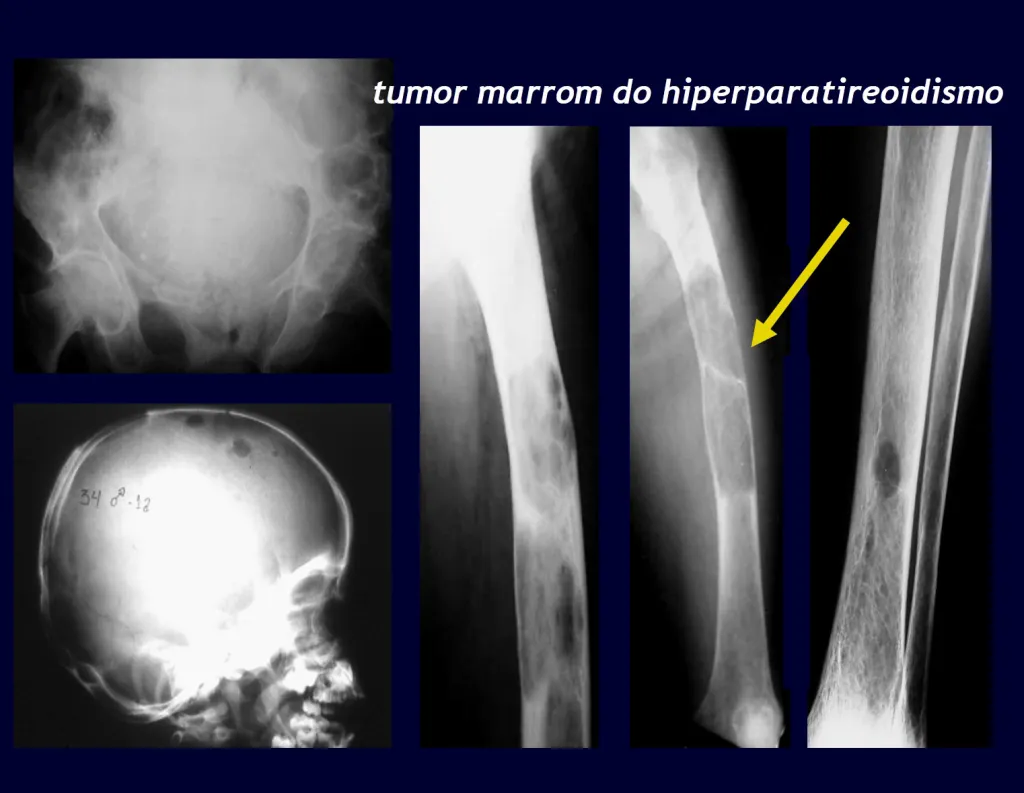
3 – Hiperparatiroidismo:
Una causa importante de fractura patológica de huesos es a menudo el signo inicial de esta enfermedad, especialmente en su forma primaria, cuya causa es el adenoma de una de las glándulas paratiroides. La parathormona normalmente actúa sobre los osteoclastos, células que llevan a cabo la reabsorción ósea. También actúa sobre los riñones, inhibiendo la reabsorción tubular de fosfatos y, de esta forma, ejerce control sobre la fosfaturia y, en consecuencia, sobre la fosfemia. Cuando hay un exceso de hormona paratiroidea se producirá hiperfosfatería, alterando el equilibrio Ca/P que, en condiciones normales, mantiene una relación 2:1, desde la sangre (9,5 calcio/4,5 mg fósforo) hasta la fórmula de hidroxiapatita. Por lo tanto, habrá hipercalcemia para mantener el equilibrio Ca/P en sangre. El calcio se elimina de los huesos, que son el mayor depósito de este mineral en nuestro organismo, reteniendo normalmente alrededor del 95% de este mineral. Como consecuencia de este proceso, los huesos se volverán más frágiles con fracturas espontáneas o por traumatismos leves. Otro signo importante de la enfermedad es la cálculos recurrente, especialmente los cálculos renales. El hiperparatiroidismo primario es una enfermedad crónica de larga duración que, si no se trata con la extirpación del adenoma paratiroideo, conducirá fatalmente a una desmineralización progresiva y generalizada de los huesos con múltiples fracturas y formaciones quísticas intraóseas, debido a la intensidad de la reabsorción por parte de los osteoclastos. Además, es común la presencia de los llamados “tumores pardos”, aislados o múltiples, cuya patogénesis se debe a hemorragias intraóseas con presencia de pigmento férrico hemosiderina, además de cúmulos de osteoclastos. Todos estos cambios óseos dan como resultado la desmineralización de los haces y su sustitución parcial por fibrosis, progresando a la llamada osteítis fibroquística generalizada o enfermedad de los huesos de Von Recklinghausen, que no debe confundirse con la neurofibromatosis, que también lleva el nombre de este autor. .
ENFERMEDADES DEGENERATIVAS:
Fractura ósea patológica
Dentro de este capítulo podemos incluir las histiocitosis de células de Langerhans , denominadas Histiocitosis X, por Lichtenstein, y las lipidosis.
1 – Histiocitosis de células de Langerhans:
-incluidos el granuloma eosinofílico y la enfermedad de Hand Schiller-Christian.
Granuloma eosinofílico:
La forma más frecuente es el Granuloma Eosinofílico , que es más común en niños, es generalmente monostótico y se caracteriza por una lesión osteolítica en la bóveda craneal en forma de lesión circular “en forma de mordida”, en el cuerpo vertebral y en la diáfisis. de huesos largos. Cuando se localiza en la vértebra, compromete el cuerpo de este hueso, con osteólisis y “colapso”, aplanando el cuerpo vertebral, lo que constituye una fractura con aspecto radiológico de la denominada vértebra plana de Calvè. En huesos largos afecta a la diáfisis y, dependiendo del tamaño de la lesión, pueden producirse fracturas.
Mano – Schuller – Enfermedad cristiana:
En la enfermedad de Hand – Schuller – Christian , que puede ser la evolución de un granuloma eosinofílico, las lesiones son múltiples con afectación ósea severa, debido a los cúmulos de macrófagos que frecuentemente se encuentran xantomilados, debido a la acumulación de ésteres de colesterol. Estos acúmulos también pueden comprometer el lecho hipofisario y la región retroocular, lo que puede derivar en la tríada sintomática, es decir, lesiones osteolíticas múltiples, diabetes insípida y exoftalmos unilateral o bilateral. Los huesos largos suelen ser el lugar de fracturas.
2 – Enfermedad de Gaucher:
Entre las lipidosis, es la forma que más compromete los huesos. En esta entidad, las células histiocíticas, debido a un defecto enzimático, se encuentran llenas de lípidos que reemplazan la estructura de los huesos, especialmente en los fémures, constituyendo una causa importante de necrosis de la cabeza de este hueso, acompañada de deformidades, que pueden provocar a fracturas.
TRASTORNOS CIRCULATORIOS :
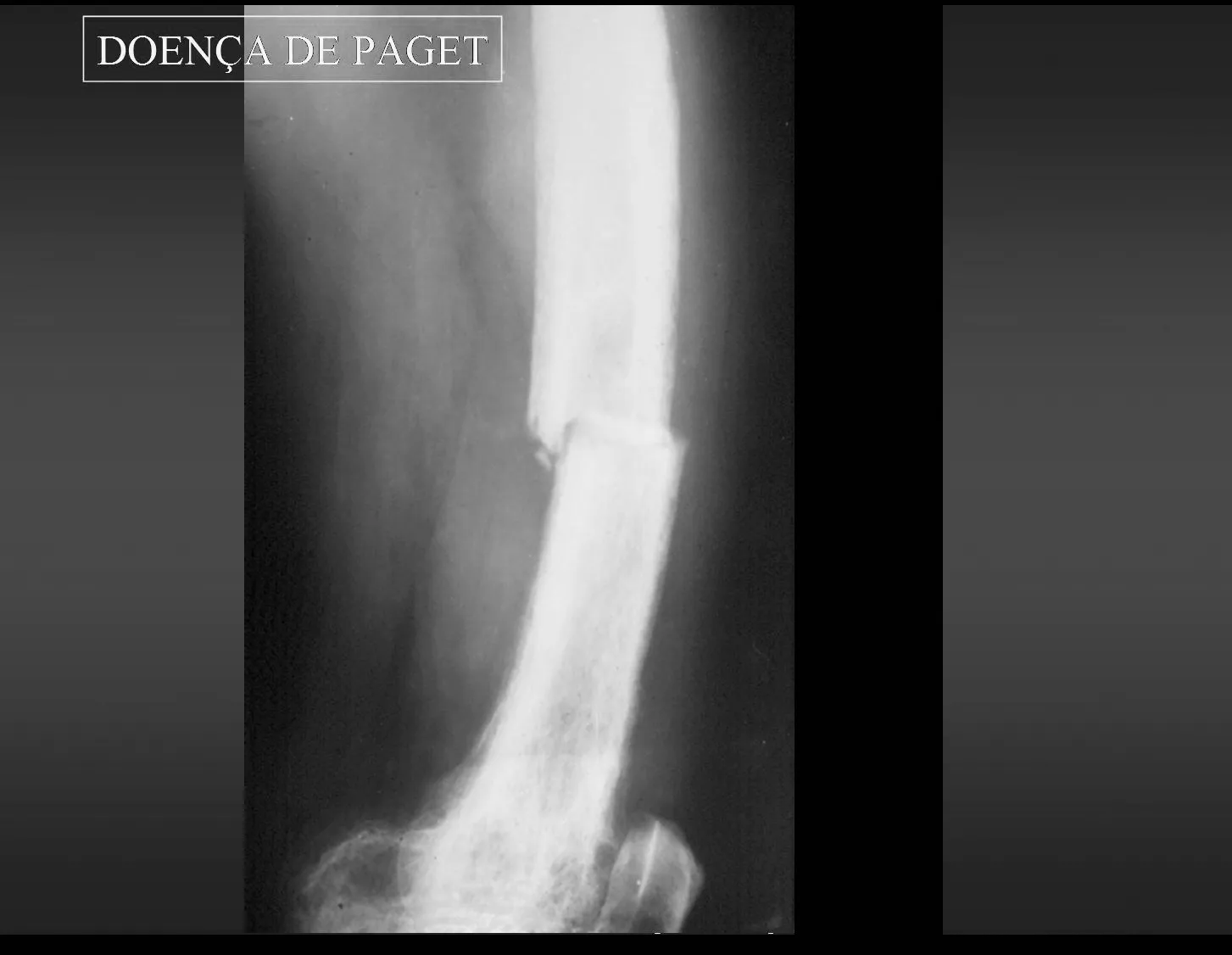
En patología ósea, el ejemplo más significativo de trastorno de la circulación sanguínea intraósea se da en la enfermedad de Paget, también conocida como osteítis deformante, descrita en 1892(), por Sir Thomas Paget, y hasta hoy considerada de causa desconocida.
1 – Enfermedad de Paget:
La enfermedad de Paget se presenta en grupos de edad avanzada, generalmente mayores de 50 años, mono o poliostótica. En las etapas iniciales de esta enfermedad existe un aumento considerable de la circulación arterial intraósea que al ser activa, arterial, hay marcada reabsorción ósea con lesiones radiológicas y anatomopatológicas que presentan características de la llamada “osteoporosis circunscrita”, más Frecuente en cráneo, pelvis, fémur y tibia. En esta etapa se pueden producir fracturas debido a la mayor fragilidad de los huesos. Los síntomas más frecuentes son dolor y malestar en la zona afectada. Algunos autores reportan casos en los que la circulación intraósea es hasta 100 veces mayor de lo normal, pudiendo progresar a insuficiencia cardíaca. Es una enfermedad de evolución lenta con deformidades y, debido al aumento progresivo de la densidad, los huesos adquieren una consistencia pétrea. El sustrato anatomopatológico muestra trastorno en los mecanismos de aposición y resorción ósea, demostrado histológicamente por el aumento numérico de las líneas de cemento que delimitan las bandas de aposición cada vez mayores en el hueso comprometido. Estas líneas se vuelven tan evidentes que asumen una “disposición en mosaico”, con un aumento numérico progresivo y desordenado de osteoclastos y osteoblastos en los márgenes de los haces óseos, que se vuelven irregulares, intercalados con fibrosis en los espacios intertrabeculares. Las “fracturas de tiza” resultan de una mayor densidad ósea y menor elasticidad, por lo que tienen una línea recta, similar a la tiza rota.
2 – Discrasias sanguíneas:
En discrasias sanguíneas como leucemia o enfermedades hemolíticas como anemia (drepanocítica, esferocítica y de Cooley). Son raros, pero pueden ocurrir trastornos circulatorios, con infartos óseos extensos, causas de fracturas óseas patológicas.
INFLAMACIONES :
Las inflamaciones en general se dividen en dos grandes grupos: inespecíficas , en las que la disposición de las células no permite identificar el agente etiológico, y específicas , o granulomatosas, en las que la disposición celular permite identificar la etiología, como en tuberculosis.
1 – Osteomielitis hematógena:
Entre los procesos inespecíficos destaca la osteomielitis hematógena , más frecuente en niños y adolescentes. Afectan principalmente a los huesos largos, con mayor frecuencia en las metáfisis del fémur y la tibia. La ubicación se debe a la estasis sanguínea en las líneas epifisarias donde la demanda es intensa, lo que la hace apta para el desarrollo de bacterias. Debido a la intensidad del proceso inflamatorio, aunque poco frecuentes, pueden producirse fracturas.
2 – Tuberculosis:
La tuberculosis es un proceso específico, cuya lesión osteolítica puede provocar fracturas. Cuando se localiza en la columna, la enfermedad de Pott, la enfermedad compromete los espacios intervertebrales, con osteólisis secundaria que puede resultar en fracturas con acuñamiento de las vértebras con posterior cifosis.
3 – Micosis profundas:
Entre las micosis profundas, la blastomicosis sudamericana , cuyo agente es paracoccidioidis brasiliensis , aunque poco común en la localización ósea, es la que con mayor probabilidad produce fracturas.
4 – Parásitos:
Echinococus granulosus, entre los parásitos, es el que provoca más fracturas óseas . Es una enfermedad rara en nuestro país, conocida como quiste hidatídico. En nuestra experiencia tuvimos dos casos, uno de ellos con lesión vertebral osteolítica severa y el otro, lesión femoral, que también se fracturó. El tratamiento es quirúrgico.
NEOPLASIAS:
Independientemente de si son benignos o malignos, los tumores pueden provocar fracturas, dependiendo de la agresividad de la estructura ósea. Los huesos con mayor sobrecarga, como las vértebras y los del miembro inferior, son más propensos a fracturarse que el resto. Los tumores benignos incluyen osteoblastoma, encondroma, fibroma condromixoide, tumor gigantocelular y hemangioma.
1 – Osteoblastoma:
El osteoblastoma es una neoplasia más agresiva, por lo que se manifiesta con osteólisis y puede ser causa de fracturas, más frecuentemente en huesos largos o en la columna.
2 – Encondroma:
El encondroma , que en aproximadamente el 50% de los casos está presente en las falanges de las manos, aunque es benigno y muchas veces asintomático, puede manifestarse como una fractura espontánea o traumática. Cuando se localizan en huesos largos, principalmente en húmero y fémur, también pueden provocar fracturas y deben diferenciarse del infarto óseo mediante métodos de imagen, a veces sólo aclarados con una biopsia de la lesión.
3 – Tumor de Células Gigantes – TGC:
El tumor gigantocelular es más común en la epífisis de los huesos largos, principalmente distal al fémur y proximal a la tibia y el húmero. La posibilidad de fractura surge de la frecuencia con la que se extiende hasta la metáfisis, en ocasiones con elevada agresividad local.
4 – Fibroma condromixoide:
El fibroma condromixoide , más común en el fémur y la tibia, es de crecimiento lento, excéntrico en relación con el eje óseo y rara vez puede ser causa de fractura.
5 – Hemangioma:
El hemangioma , en huesos largos o en la columna, puede ser asintomático y en ocasiones se diagnostica por hallazgo casual en un examen radiográfico realizado por otros motivos. Sin embargo, en determinadas condiciones se manifiesta como una fractura y/o un “colapso” del cuerpo vertebral. Puede ser aislado o múltiple, caracterizando la hemangiomatosis ósea.
6 – Osteosarcoma – Condrosarcoma:
Todas las neoplasias óseas malignas primitivas presentan posibilidad de fractura. Las que más comúnmente lo hacen son las formas osteolíticas de osteosarcoma , principalmente teleangectásicas.
7 – Hemangioendotelioma maligno:
hemangioendotelioma maligno, debido a la intensidad de la vascularización y las hemorragias intraóseas resultantes.
8 – Plasmacitoma / Mieloma múltiple:
Las lesiones osteolíticas del plasmocitoma/mieloma , causadas por grupos intramedulares de células plasmáticas atípicas, suelen ser el primer signo de la enfermedad.
9 – Linfoma:
Otros tumores líticos como los linfomas intraóseos .
10 – Fibrosarcoma / Fibrohistiocitoma Maligno:
Menos común es el fibrosarcoma , histiocitoma fibroso maligno.
11 – Liposarcoma:
El liposarcoma , el tumor de tejidos blandos más común, también puede presentarse con una fractura .
Metástasis óseas: cáncer de mama, próstata, pulmón, riñón y tiroides:
La principal manifestación de las fracturas óseas patológicas se debe a neoplasias secundarias o metástasis (del griego: meta=más allá, estasis=parada). Las metástasis óseas más frecuentes en los hombres se originan en la próstata y los pulmones. En las mujeres son de origen mamario y pulmonar. Los que se originan en el carcinoma de próstata son generalmente osteocondensantes, porque, debido a la lentitud con la que las células llegan a las vértebras, a través del plexo venoso paravertebral de Batson y en los demás huesos a través de la sangre arterial, el tejido óseo reacciona con la neoformación de inter- haces trabeculares que reducen los espacios medulares, con el fin de condensar el hueso, claramente evidente en métodos de imagen o examen patológico. Al igual que en la enfermedad de Paget, la mayor densidad y menor elasticidad de los huesos pueden provocar “fracturas en línea de tiza”. Las metástasis pulmonares, en ambos sexos, son osteolíticas con afectación más frecuente del húmero, pelvis y fémur. En la columna la lesión afecta inicialmente a los pedículos, mientras que en el plasmocitoma/mieloma la afectación predomina en el cuerpo vertebral. Las metástasis del carcinoma de mama son generalmente osteolíticas. Las fracturas osteolíticas tienen una patogénesis basada en la mayor velocidad con la que las células llegan al hueso, impidiendo una adecuada reacción osteogénica, al contrario de lo que se observa en el carcinoma de próstata. Otras neoplasias, con origen en el riñón (carcinoma de células claras) y la tiroides (carcinoma folicular), debido a la intensa vascularización que forma parte de estas estructuras, destruyen rápidamente el tejido óseo dando lugar a fracturas óseas intensamente osteolíticas, a veces clínicamente pulsátiles.
Lesiones pseudotumorales: quiste óseo simple, quiste aneurismático y fibroma no osificante:
En cuanto a las lesiones pseudoneoplásicas , la que con mayor frecuencia provoca fracturas es el quiste óseo aneurismático . Este proceso, de etiología desconocida, que no tiene aspecto quístico y mucho menos es de carácter vascular, se conoce como la lesión benigna que presenta un comportamiento más agresivo, simulando muchas veces neoplasias malignas.
Otras lesiones pseudoneoplásicas que pueden fracturar son el quiste óseo simple de localización metafisaria, cuando en un hueso con mayor carga como el fémur y la tibia, es propenso a fracturarse. El fibroma no osificante , una evolución del defecto fibroso metafisario cortical, también puede fracturarse por su progresivo aumento de volumen, cuando se localiza en la metáfisis del fémur o la tibia.
No es raro que las fracturas óseas simples o complejas oculten cambios patológicos y puedan dar lugar a un tratamiento ortopédico inadecuado.
Para tratar las fracturas óseas patológicas es necesario estudiar todo el contexto que las rodea. Las fracturas óseas siempre deben analizarse bajo aspectos multidisciplinarios, que tengan en cuenta la historia, grupo etario de los pacientes, aspectos clínicos, imágenes, pruebas de laboratorio y examen anatomopatológico. El estudio conjunto multidisciplinar de estos datos es fundamental para el diagnóstico y manejo de cada caso. Con el diagnóstico correcto, el ortopedista definirá el tratamiento. Siguiendo lo descrito en este capítulo:
Displasias óseas:
1 – Osteopsatirosis u Osteogénesis imperfecta.
Tratamiento : Clínico: Actualmente se utiliza el uso de bifosfonatos.
Ortopédico: osteosíntesis intramedulares para apoyar el crecimiento alineado, con varillas telescópicas, asociadas o no a osteotomías para corregir deformidades.
2 – Osteopetrosis
Tratamiento : Clínico: Prevención de deformidades
Ortopédico: osteosíntesis de fracturas.
3 – Displasia fibrosa, mono o poliostótica,
Tratamiento : Clínico: El uso de bifosfonatos puede tener efecto.
Ortopédico: osteosíntesis
Cambios metabólicos:
1 – Osteoporosis
Tratamiento : Clínico: prevención de fracturas, evitar la cafeína, caminar. Puede estar indicado el uso de bifosfonatos.
Ortopédico: osteosíntesis de fracturas.
2 – Osteomalacia y raquitismo
Tratamiento : Clínico: Corrección de la homeostasis, vitamina D, prevención de deformidades.
Ortopédico: osteosíntesis de fracturas.
3 – Hiperparatiroidismo
Tratamiento : Clínico: resección del tumor de paratiroides y compensación de la condición metabólica, teniendo en cuenta la marcada hipocalcemia que se produce tras la cirugía, ya que el tejido óseo comienza a compensar rápidamente la desmineralización ósea existente. El aporte de proteínas es fundamental para la creación de la matriz ósea.
Ortopédico: osteosíntesis de fracturas, que curan rápidamente, ya que el hueso carece de calcio.
Enfermedades degenerativas:
1 – Granuloma eosinofílico
Tratamiento : Clínico: terapia con corticosteroides.
Ortopédico: curetaje de la lesión ósea. En la vértebra plana de Calvé, la propia fractura en cuña conduce a la curación del proceso. En niños y adolescentes el cuerpo vertebral crece espontáneamente corrigiendo la deformidad.
2 – enfermedad de Gaucher
Tratamiento : Clínico:
Ortopédico:
Trastornos circulatorios:
1 – enfermedad de Paget
Tratamiento : Clínico: Bifosfonatos y antiinflamatorios.
Ortopédico: osteosíntesis de fracturas.
2 – En discrasias sanguíneas
Tratamiento : Clínico:
Ortopédico:
Inflamaciones:
1 – Osteomielitis hematógena
Tratamiento : Clínico: terapia con antibióticos.
Ortopédico: drenaje de abscesos, eliminación de secuestros óseos y estabilización de fracturas.
2 – Tuberculosis
Tratamiento : Clínico: pauta triple para la tuberculosis.
Ortopédico: limpieza de abscesos caseosos e inmovilización, estando frecuentemente indicada artrodesis de las articulaciones afectadas y osteosíntesis de fracturas.
3 – Blastomicosis Sudamericana , cuyo agente es paracoccidioidis brasiliensis y
Tratamiento : Clínico: tratamiento farmacológico específico para la tiña.
Ortopédico: limpieza quirúrgica y cuidados específicos para cada caso.
4 – La equinococosis, en forma de quiste hidatídico, debe tratarse quirúrgicamente.
Neoplasias:
1 – Primitivos benignos : El tratamiento ortopédico puede incluir legrado intralesional, adyuvante local, reconstrucción con osteosíntesis e injerto autólogo o metacrilato de metilo.
2 – Primitivas Malignas : Pueden requerir tratamiento de quimioterapia orientada a la neoplasia y tratamiento quirúrgico de resección y reconstrucción con endoprótesis o reconstrucción biológica, si es posible, o cirugía ablativa.
3 – Secundario a metástasis : Restaurar la función es fundamental para la calidad de vida del paciente. La opción de tratamiento para estas fracturas requiere cierta consideración para tomar la decisión adecuada para cada paciente. Algunas de ellas son subjetivas, ya que debemos asumir el tiempo probable de supervivencia del paciente, la posibilidad clínica de que recupere completamente sus funciones, la capacidad de resistir la anestesia, etc.
Buscamos sustentar nuestras decisiones en los siguientes parámetros:
- ¿La lesión es en el miembro superior, miembro inferior, cintura pélvica o columna?
- ¿La lesión es única o hay múltiples lesiones?
- ¿La fractura ya se ha producido o existe riesgo de fractura?
- Si no se produjo ninguna fractura, ¿ya está comprometido 1/3 de la circunferencia del hueso? ¿La lesión cubre un área larga?
- ¿El paciente caminaba antes de la fractura? ¿Tenía una función motora normal?
- ¿Cuánto tiempo lleva el paciente tratado por la enfermedad primaria?
- ¿Está actualmente recibiendo tratamiento de quimioterapia?
- ¿Cuál es el pronóstico temporal de este paciente?
- ¿Qué comorbilidades tienes además de la neoplasia?
- El tipo de neoplasia primaria responde a la radioterapia.
El análisis de estas cuestiones permitirá tomar una decisión terapéutica que ayude al paciente a recuperar su función motora, en consonancia con el tratamiento de su enfermedad de base.
Los pacientes con mieloma tienen una alta tasa de infecciones postoperatorias y suelen beneficiarse de la radioterapia local, especialmente en lesiones de la columna torácica o del miembro superior, en los primeros años de la enfermedad. Después de unos años, cuando la enfermedad se vuelve refractaria a la quimioterapia o al trasplante de médula ósea, incluso las opciones quirúrgicas se ven limitadas debido a la intensidad de la afectación ósea.
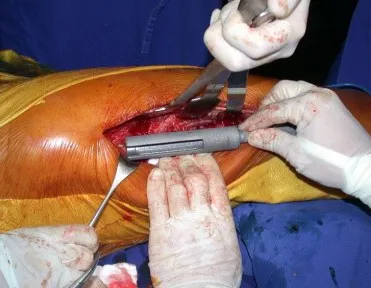
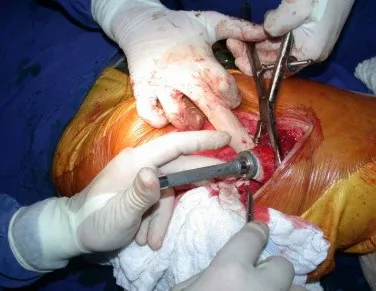
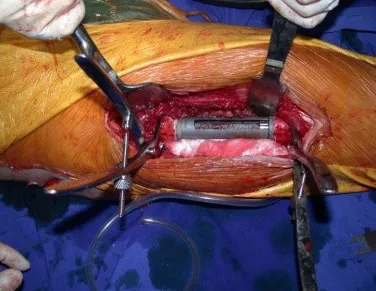
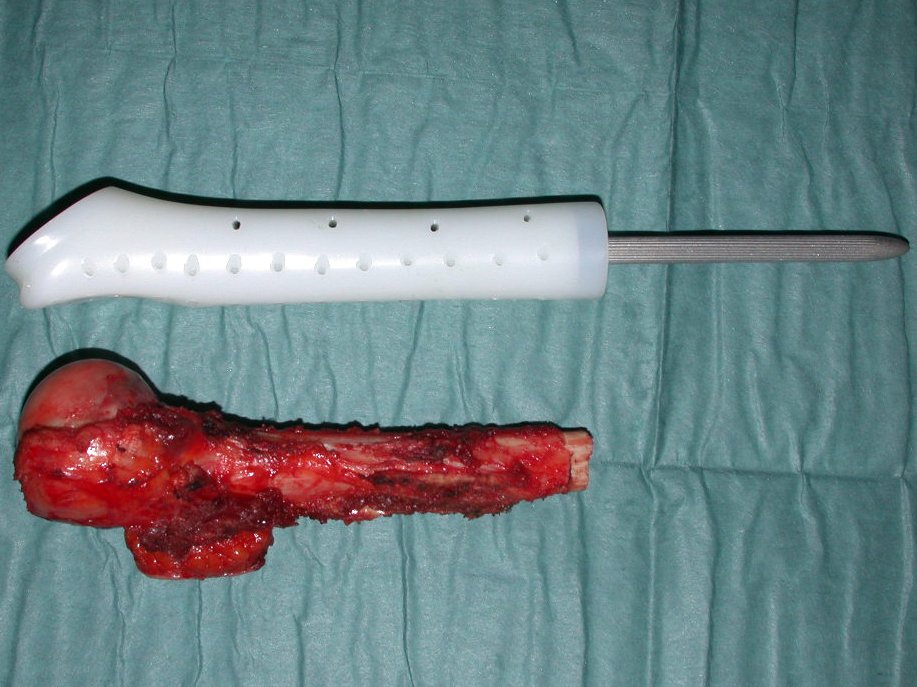
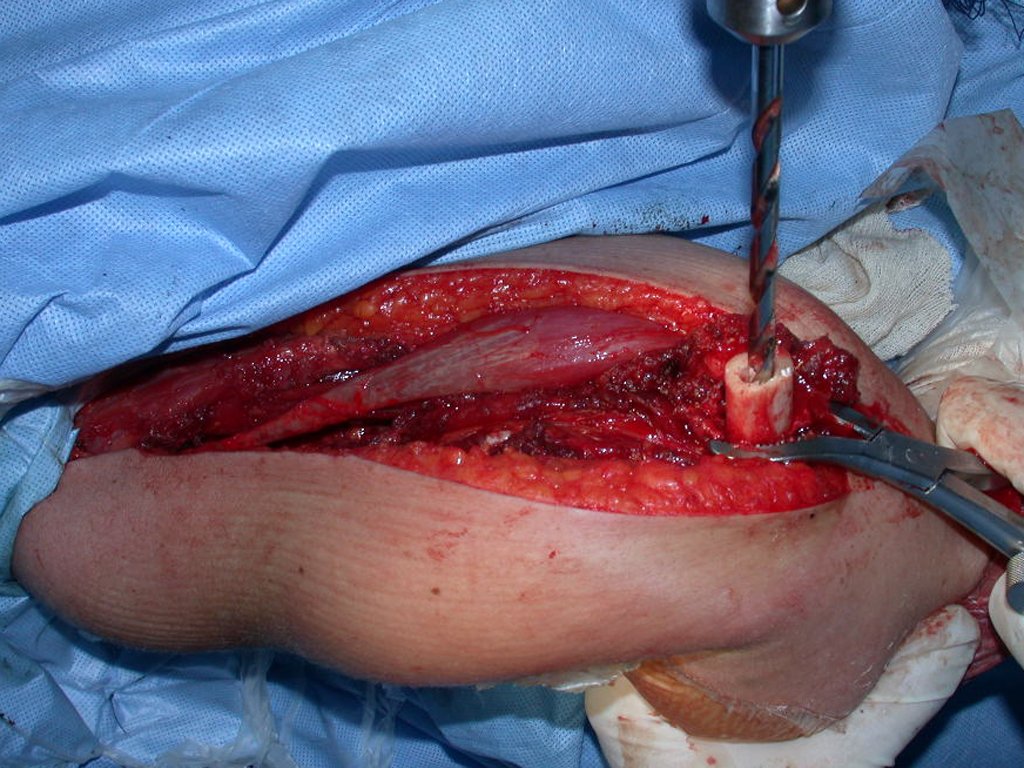
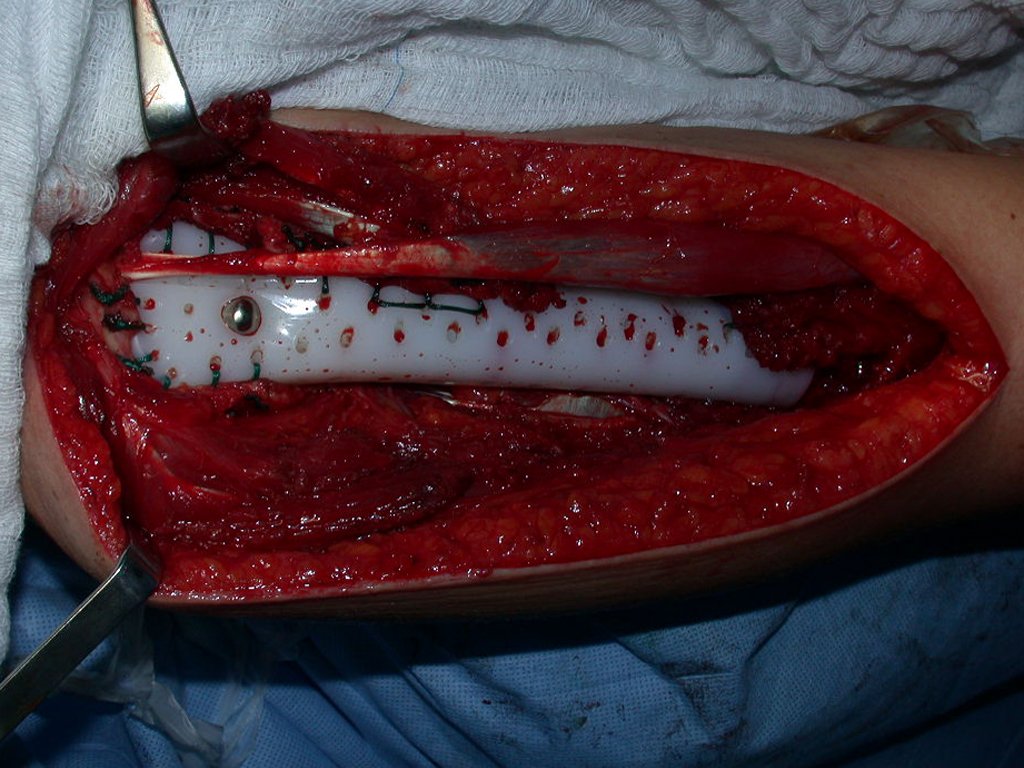
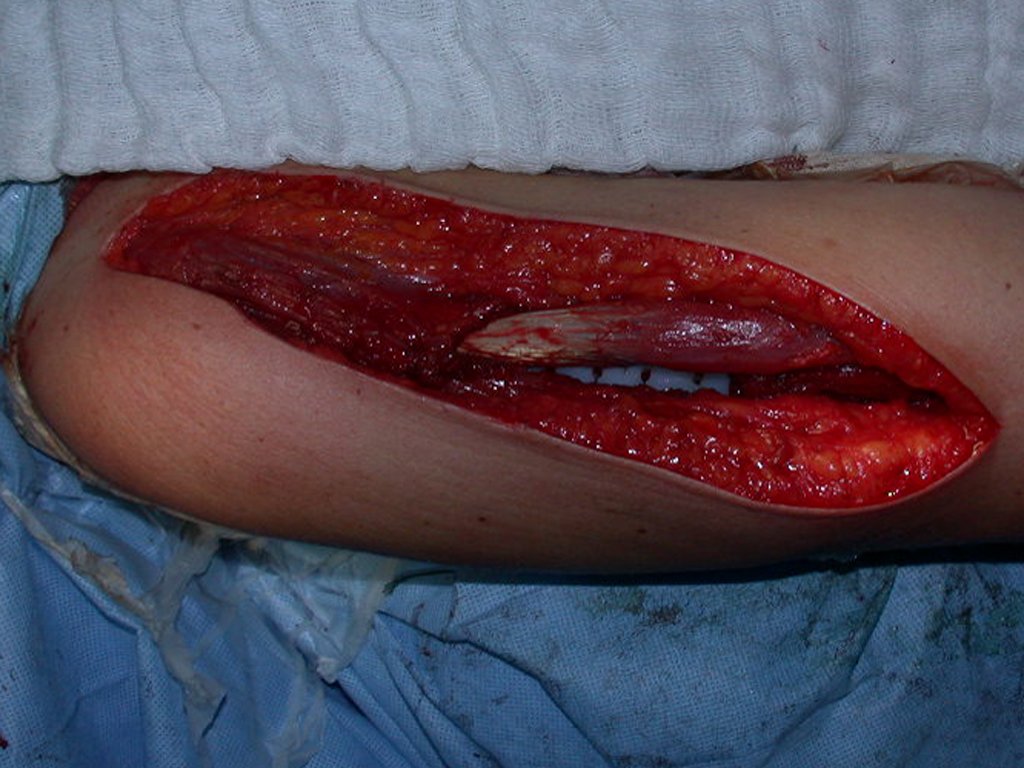
Este caso en las figuras 8 a 12 ejemplifica un paciente con mieloma múltiple, que presenta una lesión extensa en la mitad proximal del húmero derecho. A pesar de ser mieloma, que responde bien a quimioterapia y radioterapia e incluso en el miembro superior, existe indicación de resección de la lesión y reconstrucción con endoprótesis no convencional debido a la destrucción de la anatomía y al rápido restablecimiento de la función.
Las lesiones del miembro inferior, al ser un miembro de carga, se resuelven mejor con tratamiento quirúrgico. El uso de radioterapia paliativa, al considerarse de “pronóstico reservado”, puede provocar más sufrimiento cuando la lesión se fractura, ya que todas las neoplasias provocan la sustitución del tejido óseo normal por tejido tumoral. Por tanto, existe lisis ósea en todas las neoplasias, incluidas las metástasis de próstata. Muchas veces se dice erróneamente que las metástasis óseas de la próstata son osteoblásticas, pero lo que ocurre fisiopatológicamente es que en las neoplasias de evolución lenta hay tiempo para que el tejido óseo reaccione ante la lesión, en un intento de reparar el hueso lesionado, o lisado. . si tu prefieres.
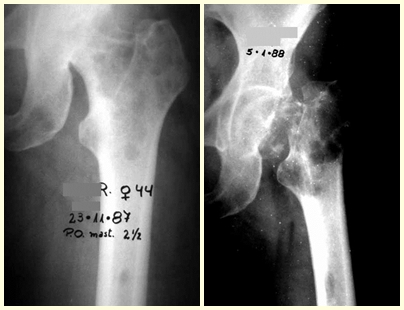
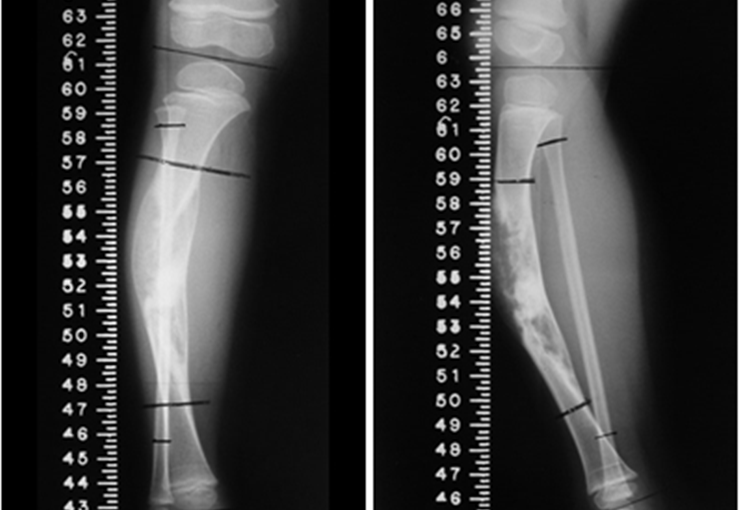
En las figuras 13 a 19 ilustramos un caso de metástasis de cáncer de mama en una paciente a la que se le realizó una mastectomía hace dos meses. Observamos numerosas lesiones líticas en la región metafisaria proximal del fémur izquierdo el 23 de diciembre de 1987. Se recomendó radioterapia local. La lesión no respondió al tratamiento y en esta localización, miembro inferior, en apenas 40 días la lesión progresó y se fracturó, aumentando el dolor del paciente y el malestar de la familia.
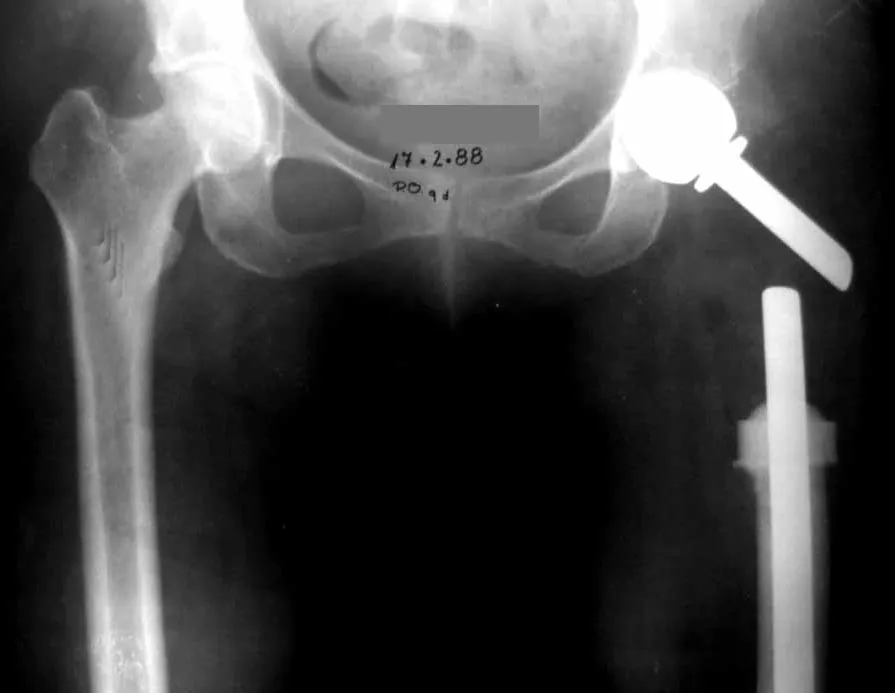
La lesión fue resecada y reemplazada por una endoprótesis.
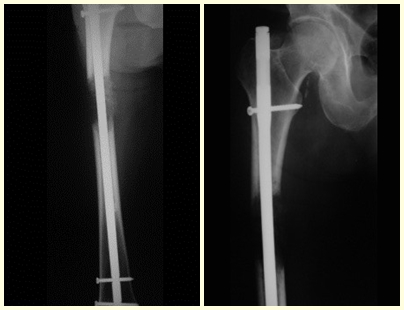
En este último ejemplo se observa una única lesión en la diáfisis femoral. Fue tratado con un clavo femoral bloqueado. Observábamos la progresión de la lesión cada mes, quejándonos de dolor y dificultad para caminar que empeoraban progresivamente. Obsérvese la destrucción local y la inestabilidad de la osteosíntesis, figuras 20 a 26.
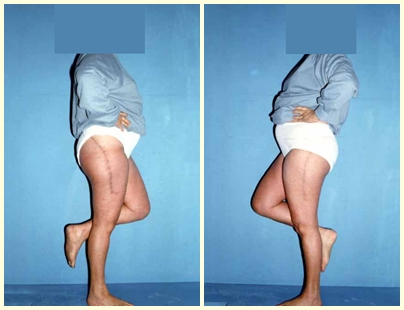
El paciente puede caminar desde el primer día postoperatorio, pudiendo reincorporarse a su actividad laboral y tratamiento complementario de la enfermedad de base.
Estos ejemplos ilustran las dificultades en el abordaje de las fracturas patológicas y la necesidad de profesionales con experiencia en el tratamiento de estas lesiones.
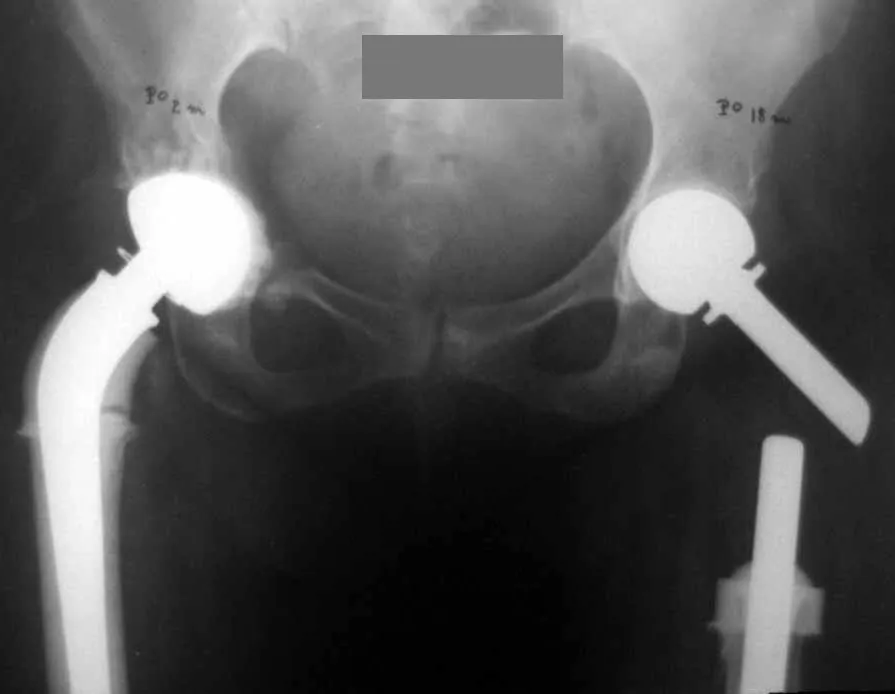
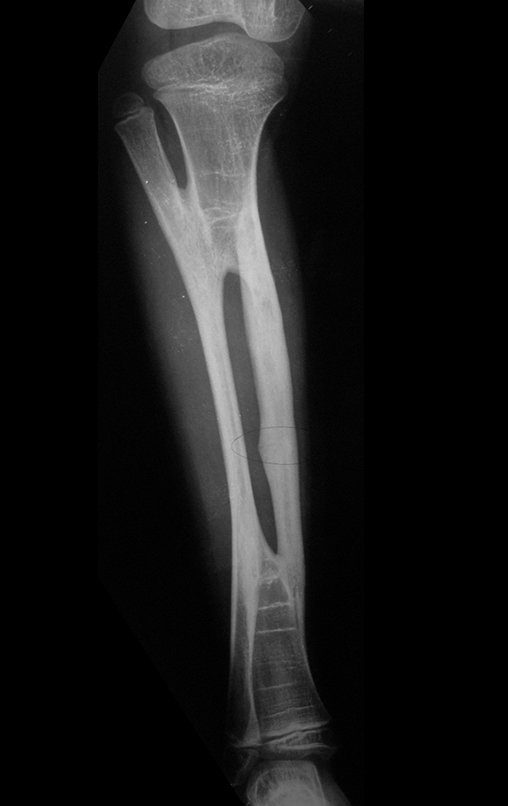
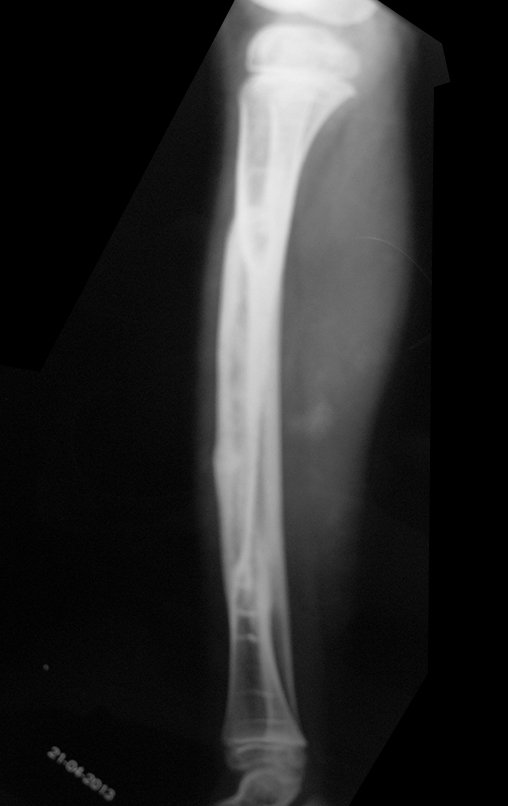
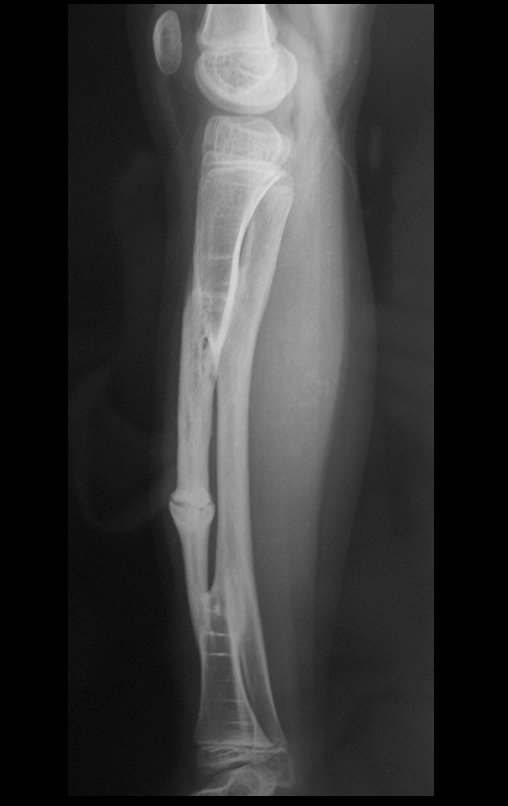
Ver fractura del cuello femoral en un niño debido a un quiste óseo simple.
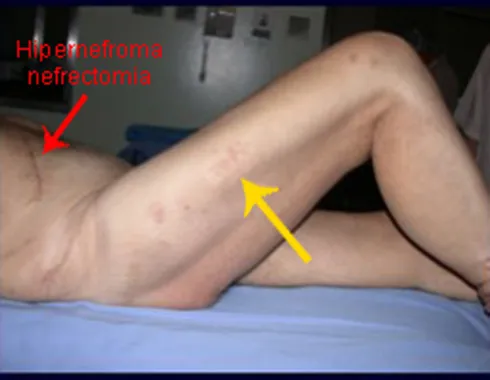
Véase fractura incompleta del cuello femoral en un adulto debido a metástasis renal.
REFERENCIAS BIBLIOGRÁFICAS:
ALBRIGHT, F., REIFENSTEIN, EC: La glándula paratiroides y el metabolismo de las enfermedades óseas. Estudios seleccionados. Baltimore: William y Wilkins; 1948.
BATSON, OV: La función de las venas vertebrales y su papel en la propagación de metástasis. Ana. Surg., 112:138, 1940.
BRASILEIRO FILHO, G.: Patología de Bogliolo. Guanabara Koogan, 7ª ed., 2006, pág. 846-847.
DORFMAN, HD & CZERNIAK, B: en tumores óseos, Mosby, St. Louis, EE.UU., 1997, pág.194-204.
GALASKO, CBS & BENNET, A.: Mecanismo de las enfermedades de metástasis óseas líticas y blásticas. Clin Orthop, 169:20, 1982.
GORHAN, LV. & WEST, WT.: Cambios circulatorios en reacciones osteolíticas y osteoblásticas. Arco Pathol, 78:673, 1964.
JAFFE, HL.: Enfermedades metabólicas, degenerativas e inflamatorias de huesos y articulaciones. Lea y Febiger, Filadelfia, 1972, págs. 17l-180.
LICHTENSTEIN, L. : Histiocitosis Camino., 56:84, 1953.
PROSPERO, JD., RIBEIRO BAPTISTA, PP, AMARY, MFA, & CREM DOS SANTOS, P.: Paratiroides: estructura, funciones y patología. Acta Orthop. Brasil., 17:2, 2009.
PRÓSPERO, JD. en Tumores Óseos. Ed. Roca, São Paulo, Brasil, 2001, págs.211-226.
RUBIN, P: Clasificación dinámica de las displasias óseas, Year Book Medical editor Inc. Osteogénesis imperfecta pág.322 -324
RUBIN, P.: Clasificación dinámica de la displasia ósea, Year Book Medical Publishers Inc., 1964. Osteopetrosis pág. 258 – 280
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
Osteofibrodisplasia – Técnica de tibialização da fíbula – Técnica de reconstrução combinada de enxerto autólogo e homólogo
Después de este tiempo, con el empeoramiento de la deformidad, los padres llevan la paciente para nuestra evaluación.
Se diagnosticaron que era displasia osteofibrosa, enfermedad de Kempson-Campanacci.
Quitamos la inmovilización y estadiamos, con radiografías esqueléticas, dada la baja edad de la paciente, figuras 10 a 17.
Después de esta etapa, se explica sobre el pronóstico de esta enfermedad a los padres e indicamos la necesidad de intervención quirúrgica. La familia se fue al extranjero, donde consultado otro profesional de la especialidad ysiguió con el, volviendo a nuestra evaluación en diciembre de 2009, con lo que las imágenes que siguen de aquel periodo de acompañamiento, figuras 18 a 31.
Debido a la proximidad de las fiestas de Navidad, propusimos reevaluación en el principios del año y planificación de la cirugia de resección de la lesión y tibialization del peroné para la reconstrucción.
El paciente se reevalúa a principios de febrero de 2010, con la RM, figuras 32 a 43.
Llevamos a cabo la planificación para la resección de la lesión y la osteotomía de la tibia y el peroné, las figuras 44 a 47.
En esta ocasión realizamos un molde con yeso para la fabricación de aparato ortopédico, que se utilizará para la inmovilización después de la cirugía, las figuras 48 y 49.
En la planificación preoperatorio solicitó la preparación de piezas de hueso homólogo, de banco de tejido, de la tibia, para su uso como apoyo.
Encavilhamos generalmente el peroné con alambre de Kirchnner, pero en este paciente no era posible debido a que el canal medular del peroné era demasiado estrecho.
Lo injerto homólogo de tibia se elige y se preparó para la reconstrucción auxiliar. Para regularilzar el espesor se utiliza una fresa hasta que alcanza el tamaño adecuado, las figuras 74 a 77.
Se necesita un cuidado especial con los niños. En el tercer día post-operatorio, en el curativo se observa el inicio de una escara por la compresión, la Figura 94 y 95. Los padres recibieron instrucciones de cómo cuidar el vendaje, dejando sin aumento de volumen a nivel local, evitando la compresión y póngase en contacto conmigo en cualquier caso.
Visitado el paciente en el sexto día del postoperatorio, 25/02/2010, en su casa. Paciente con la ortesis, buen aspecto clínico. Su sonrisa se confirma nuestra tranquilidad de saber que todo está bien, figura 96.
Sorprendentemente, al día siguiente, a las 23h00 la madre hace llamadas que indica que el niño estaba inquieto y febril. Instruido para administrar antipiréticos y mantenerme informado. En la mañana del día siguiente, Sábado, 02.27.2010 hecho llamada para obtener la información. La fiebre no cede y el niño está postrado. Voy a visitar a su casa muy preocupado. Sera infección? Al exponer la pierna encuentro este aspecto clínico !!!, figuras 97 a 99.
Hay proceso eritematoso ocurriendo sólo cuando hay contacto con el revestimiento del aparato ortopédico. Alergia?
Alergia !!!. El paciente era alérgico a lo revestimiento. Alergia al E.V.A. (Etileno Acetato de Vinilo).
Hablando con la madre, recordó que el niño estaba con nalgas llenas de manchas rojas cuando se juega en la estera de goma. Junto con su padre, retiramos todo el revestimiento de EVA de la óstesis, forramos con pañal de tela y administrado antihistamínico , que se resolvió la complicación.
La paz reinó de nuevo en aquel sábado 27/02/2010. Tenga en cuenta que el rango de la reacción alérgica es solamente un contacto con E.V.A..
El paciente regresa a la oficina después de seis semanas de la cirugía, figuras 100 a 102 y 1 video.
A la semana siguiente ya puede caminar sin ayuda, vídeo 2.
Reevaluación clínica y de imagen en la décima semana después de la cirugía.
Después del tercer mes, liberamos el uso de ortesis y el paciente empieza a caminar sin muletas.
Como mencionamos en las figuras 112 y 114, el homoinjerto tiene sus limitaciones. Cuando comienza a ser integrado, que está empezando a ser reabsorbido para después ocurrir la re-osificación. En esta fase hay el debilitamiento del hueso estructural. En este caso ocurre una fractura de estrés en el mismo hueso “trasplantado”. Considere las figuras 121 a 125, siguiente.
El paciente tenía cojera por el dolor. El homoinjerto recibe parte de la carga lo que impide el engrosamiento del peroné, retrasando el fenómeno de la tibialization. En los casos anteriores, no use injertos de banco de hueso y no tenía dificultades con la integración del peroné, que tibializou sin dificultad.
A pesar de esta complicación, se ha formado en el callo hipertrófico y la cojera desapareció.
La fisis proximal de la tibial , en la rodilla, crece más que la fisis distal, en lo tobillo, lo que conduce a la migración distal de la cicatriz del callo óseo.
Vídeo 13: Função em 28/05/2013.
Autor: Profr. Dr. Pedro Péricles Ribeiro Baptista
Oncocirugía Ortopédica en el Instituto Oncológico Dr. Arnaldo Vieira de Carvalho
Oficina : Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – SP
Teléfono: +55 11 3231-4638 Celular:+55 11 99863-5577 Correo electrónico: drpprb@gmail.com
Infección Postoperatoria. Objetivo: Realizar un análisis retrospectivo de casos sometidos a control de daños ortopédicos en una sala de emergencias ortopédicas de un hospital universitario con el fin de evaluar a los pacientes con infección postoperatoria después de ser convertidos a osteosíntesis interna. Métodos: Análisis retrospectivo de pacientes desde junio de 2012 hasta junio de 2013 sometidos a control de daños ortopédicos con fijador externo que posteriormente fueron convertidos a osteosíntesis definitiva, con varilla o placa. Resultados: Encontramos una tasa de infección del 13,3% en nuestra muestra y observamos errores técnicos en la elaboración del fijador en el 60,4% de las ocasiones. Conclusión: Se encontró una tasa de infección que consideramos alta, así como deficiencias en la fabricación del fijador externo. Destacamos que este procedimiento no está exento de riesgos y el entrenamiento para los médicos que lo realizan debe ser obligatorio.
Infección postoperatoria en pacientes sometidos a control de daños ortopédicos mediante fijación externa.
Departamento de Ortopedia, Santa Casa de São Paulo, São Paulo, SP, Brasil
Serviço de Ortopedia e Traumatologia, Hospital Israelita Albert Einstein, Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil
Instituto de Ortopedia, Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo (USP), São Paulo, SP, Brasil
Escola Paulista de Medicina, Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil
Introducción
El control de daños en ortopedia es una táctica quirúrgica indicada para pacientes politraumatizados o con lesiones graves en tejidos blandos consagrada en la literatura. Sin embargo, este procedimiento no está exento de riesgos. Se reportan complicaciones locales y sistémicas asociadas con la fijación externa para el control de daños, y una de ellas es la infección ósea. Estudios muestran tasas de infección en los trayectos de los clavos que varían del 0,5 al 30%.
La correlación entre la infección en el trayecto de los clavos de los fijadores externos y la osteomielitis postraumática después de la osteosíntesis interna que configura una infección crónica del sistema locomotor está bien establecida.
El objetivo de nuestro trabajo es identificar en los pacientes sometidos a control de daños musculoesqueléticos admitidos en la sala de emergencias durante un año, la calidad de la reducción y fijación y la frecuencia de infección ósea después del tratamiento definitivo.
Casuística y métodos
Este trabajo fue debidamente sometido y aprobado por el Comité de Ética de la institución y está registrado bajo el protocolo CEP no624.307.
Se evaluaron retrospectivamente 120 pacientes sometidos a fijación externa para control de daños musculoesqueléticos de junio de 2012 a junio de 2013 atendidos en la sala de emergencias del Departamento de Ortopedia y Traumatología de nuestra institución.
En este estudio retrospectivo incluimos a los pacientes sometidos a cirugía de control de daños mediante fijación externa que, después de la conversión a osteosíntesis definitiva, desarrollaron infección.
Se excluyeron pacientes que presentaron complicaciones infecciosas en presencia de alteraciones locales y sistémicas, como vasculopatías, diabetes mellitus o enfermedad consuptiva, y pacientes con trastornos psiquiátricos que pudieran haber afectado la evolución o los cuidados del fijador de alguna manera.
Todas las radiografías fueron generadas en formato digital y analizadas en el programa Impax. Las distancias entre el orificio y los clavos de Schanz hasta la síntesis definitiva se analizaron en el propio programa. Buscamos identificar la presencia de errores técnicos durante la perforación (caracterizados por múltiples perforaciones) o análisis subjetivo realizado por tres grupos diferentes de dos evaluadores. Un grupo formado por médicos asistentes con al menos cinco años de experiencia en traumatología ortopédica, otro con dos residentes de tercer año y otro con dos residentes de segundo año de ortopedia. Los evaluadores fueron denominados (tabla 1):
– Evaluador 1: asistente con más de cinco años de experiencia
– Evaluador 2: asistente con más de cinco años de experiencia
– Evaluador 3: residente de tercer año
– Evaluador 4: residente de tercer año
– Evaluador 5: residente de segundo año
– Evaluador 6: residente de segundo año
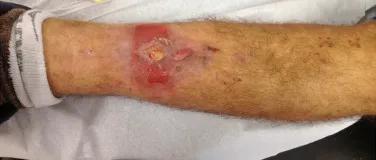
La infección postoperatoria fue caracterizada mediante examen clínico, durante la hospitalización o en la investigación ambulatoria, según los datos registrados en los expedientes médicos. Los criterios clínicos para la infección incluyeron eritema, hiperemia o fístula en el trayecto de los clavos o la incisión quirúrgica (fig. 1).
Durante la fijación externa, siempre se respetaron la perforación previa con broca y la inserción manual de los clavos
Em ningún caso tuvimos clavos en la zona de exposición de la fractura.
En la evaluación de las radiografías, observamos los exámenes pre y postoperatorios, medimos la posición y distancia de los clavos de Schanz con respecto a la síntesis definitiva, la presencia de perforaciones en número mayor que los clavos instalados, lo que podría sugerir dificultad y daño adicional en la instalación del fijador externo, presencia de osteólisis en los orificios de los clavos de Schanz y si el lugar de perforación de los clavos causó problemas para la fijación interna definitiva. Entre estos, destacamos cirugías postergadas debido a infección en el trayecto del clavo, cambios en la incisión quirúrgica para la osteosíntesis definitiva y procedimientos quirúrgicos no planificados para volver a montar el fijador debido a un montaje inestable.
Se evaluó el tiempo medio de conversión de los fijadores externos a osteosíntesis definitiva mediante análisis retrospectivo de los registros médicos.
Resultados
De los 120 pacientes sometidos a control de daños, 16 (13,3%) desarrollaron osteomielitis post-traumática después de la síntesis definitiva. En estos 16 pacientes, pudimos relacionarla directamente con la osteosíntesis interna definitiva, ya que no había signos de infección local después de la fijación externa en urgencias.
La edad media de estos 16 pacientes fue de 43,4 años, con un rango de 19 a 81. Observamos una predominancia masculina, con 13 pacientes (81,2%), y los tres restantes (18,8%) eran mujeres.
En cuanto al tiempo de conversión del fijador externo a osteosíntesis definitiva, el período más corto fue de cinco días y el más largo de 30. La media fue de 15 días para la conversión definitiva.
La infección ocurrió en ocho fracturas aisladas de la pierna (50%), dos pacientes con fracturas de fémur y tibia ipsilaterales (rodilla flotante), dos (12,5%) con fracturas de tobillo, dos (12,5%) con fracturas de platillo tibial, uno (6,2%) con fractura de fémur aislada y uno (6,2%) con fractura de húmero.
De los 16 pacientes con infección post-traumática, en el 37,5% de los casos (seis pacientes) ocurrió después de fracturas cerradas y en el 62,5% (10) después de fracturas expuestas de grado 3 A de Gustillo.
En el 62,5% (10 pacientes), el fijador se montó transarticularmente y en los seis restantes (37,5%) monostótico con configuración monolateral, con conexión tubo a tubo.
En cuanto al agente etiológico, se identificó adecuadamente en 10 pacientes (62,5%) de los 16 infectados, y en un tercio de estos había múltiples bacterias y se requirió cirugía para limpieza, debridamiento y curetaje del trayecto del orificio del clavo. Los hallazgos polimicrobianos en los cultivos intraoperatorios fueron: Staphylococcus aureus, Staphylococcus coagulasa negativa, Klebsiella sp, Acinetobacter baumannii y Pseudomonas aeruginosa.
En cuanto a la evaluación objetiva de las múltiples perforaciones óseas, observamos un número mayor que el de clavos utilizados en ocho pacientes (50%) de los 16 pacientes infectados después de la osteosíntesis definitiva.
Cuando medimos la distancia entre la posición del pin de Schanz y la de la osteosíntesis, obtuvimos un promedio de 2,2 cm, con una variación de hasta 6 cm. En siete casos (43,8%) de los 16 infectados, la distancia medida fue de 0 cm, dos entre 1 y 2 cm, dos entre 3 y 4 cm, uno entre 4 y 5 cm, tres con 5 cm y uno con 6 cm (tabla 2). En cuanto a la evaluación de la calidad de la fijación y reducción, pudimos observar que de los 16 casos, en cuatro (25%) los seis evaluadores estuvieron de acuerdo, en dos la fijación fue considerada adecuada y en los otros dos inadecuada; en cinco casos (31,3%) cinco evaluadores estuvieron de acuerdo en cuanto a la calidad de la evaluación, en dos fue considerada adecuada y en tres inadecuada; en cuatro casos (25%) cuatro evaluadores estuvieron de acuerdo con la evaluación, todas fueron consideradas inadecuadas; en tres casos (18,7%) no hubo concordancia entre los evaluadores, tres consideraron la fijación y reducción adecuadas y otros tres inadecuadas (tabla 3).
En los 13 casos (81,2%) en los que hubo alguna concordancia (adecuada o inadecuada), esta fue considerada adecuada en cuatro (30,8%) y inadecuada en nueve (69,2%).
Al analizar las evaluaciones, obtuvimos 96 evaluaciones, en 38 ocasiones (39,6%) se consideraron adecuadas y en 58 (60,4%) inadecuadas. Al analizar las evaluaciones de cada evaluador, obtuvimos para el evaluador uno: cinco casos (31,3%) evaluados como adecuados y 11 (68,7%) inadecuados; evaluador dos: 10 casos
Cuando evaluamos aisladamente a los ortopedistas con más de cinco años de experiencia, obtuvimos 32 evaluaciones, 15 (46,9%) se consideraron adecuadas y 17 (53,1%) inadecuadas (tabla 4). En este grupo hubo concordancia en la calidad de la fijación y reducción en nueve casos (56,3%) y falta de concordancia en los siete restantes (43,7%), de los nueve casos con concordancia en cuatro (44,4%) la calidad de la reducción y fijación se consideró adecuada y en cinco (55,6%) inadecuada.
Al observar las evaluaciones consideradas adecuadas, podemos notar una tendencia a la similitud de evaluaciones entre los asistentes y los residentes de tercer año, pero una menor evaluación de casos considerados adecuados para los residentes de segundo año (tabla 5).
Al comparar los casos en los que hubo acuerdo entre los asistentes y la evaluación de los residentes de tercer año, observamos que hubo concordancia en cinco (31,3%) de los 16 casos, en tres la reducción y fijación se consideraron adecuadas y en dos inadecuadas. De los 11 casos restantes, en cuatro, a pesar del acuerdo de evaluación de los asistentes, no hubo concordancia con los residentes de tercer año, en un caso la reducción y fijación fue considerada adecuada por los asistentes y en tres inadecuada.
Al comparar los casos en los que hubo acuerdo entre los asistentes y la evaluación de los residentes de segundo año, observamos que hubo concordancia en siete (77,8%) de los nueve casos, en dos de estos la reducción y fijación se consideraron adecuadas y en cinco inadecuadas. En un caso en el que hubo acuerdo de los asistentes (considerado adecuado) los residentes de segundo año lo consideraron inadecuado.
Al evaluar los siete casos en los que no hubo acuerdo entre los asistentes con más de cinco años de experiencia, observamos que en un caso los residentes, ya sean de tercer o segundo año, tampoco estuvieron de acuerdo. En cuatro casos, los dos evaluadores residentes de tercer año tampoco estuvieron de acuerdo y en tres casos los dos evaluadores residentes de tercer año estuvieron de acuerdo y consideraron la reducción y fijación inadecuada. De los siete casos en los que los asistentes no estuvieron de acuerdo, los evaluadores residentes de segundo año consideraron la reducción y fijación adecuadas en un caso e inadecuadas en cuatro.
Discusión
Los fijadores externos, dispositivos de fijación más versátiles que permiten diversos tipos de montajes y configuraciones, pueden colocarse de manera rápida, se aplican en el tratamiento de las fracturas en situaciones de urgencia y emergencia (control de daños) y de forma percutánea, con un menor daño a los tejidos blandos.
Este procedimiento, tanto provisional como definitivo, sigue siendo rutina en muchos servicios y varía del 32% al 89% de la elección de un grupo de ortopedistas en un estudio previo. Sin embargo, este procedimiento no está exento de riesgos.
En nuestra muestra, encontramos una frecuencia del 13,3% de infección después del uso de fijador externo para control de daños. Aunque compatible con los datos de la literatura, que varían del 0,5% al 30%, nos preocupamos por considerar este índice muy alto entre las posibles complicaciones.
La primera cuestión siempre recordada en la búsqueda de la etiología de la infección es el entorno en el que se realiza el tratamiento, en nuestro caso un hospital escuela. Parece una correlación causa y efecto débil, porque el procedimiento se considera de pequeña complejidad y había al menos un médico con tres años de entrenamiento en el equipo quirúrgico.
Otro factor que está involucrado en la complicación de la infección después de la osteosíntesis interna es la infección del trayecto de los pinos de Schanz. En nuestros pacientes, la presencia de sospecha clínica de infección fue indicación del cambio del pin por instalación en otra ubicación o la continuación del tratamiento con osteosíntesis mediante fijador externo.
La reducción y fijación se consideraron inadecuadas en el 60% de las evaluaciones, un valor considerado muy alto, y en promedio los asistentes y residentes de tercer año consideraron la reducción y fijación adecuadas en solo
1. Scalea TM, Boswell SA, Scott JD, Mitchell KA, Kramer ME,Pollak AN. External fixation as a bridge to intramedullarynailing for patients with multiple injuries and with femurfractures: damage control orthopedics. J Trauma.2000;48(4):613-21.2. Parameswaran AD, Roberts CS, Seligson D, Voor M. Pin tractinfection with contemporary external fixation: how much of aproblem? J Orthop Trauma. 2003;17(7):503-7.3. Mahan J, Seligson D, Henry SL, Hynes P, Dobbins J. Factors inpin tract infections. Orthopedics. 1991;14(3):305-8.4. Harwood PJ, Giannoudis PV, Probst C, Krettek C, Pape HC. Therisk of local infective complications after damage controlprocedures for femoral shaft fracture. J Orthop Trauma.2006;20(3):181-9.5. Green SA, Ripley MJ. Chronic osteomyelitis in pin tracks. JBone Joint Surg Am. 1984;66(7):1092-8.6. Clasper JC, Cannon LB, Stapley SA, Taylor VM, Watkins PE.Fluid accumulation and the rapid spread of bacteria in thepathogenesis of external fixator pin track infection. Injury.2001;32(5):377-81.7. Moroni A, Vannini F, Mosca M, Giannini S. State of the artreview: techniques to avoid pin loosening and infection inexternal fixation. J Orthop Trauma. 2002;16(3):189-95.8. Cardozo RT, Silva LG, Bragante LA, Rocha MA. Tratamento dasfraturas diafisárias da tíbia com fixador externo comparadocom a haste intramedular bloqueada. Rev Bras Ortop.2013;48(2):137-44.9. Balbachevsky D, Belloti JC, Martins CVE, Fernandes HJA,Faloppa F, Reis FB. Como são tratadas as fraturas expostas datíbia no Brasil? Estudo transversal. Acta Ortop Bras.2005;13(5):229-32.10. Petinne KA, Chao EY, Kelly PJ. Analysis of the external fixatorpin-bone interface. Clin Orthop Relat Res. 1993;293:18-27.
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com
Condrosarcoma y Chondroma. Para una mejor comprensión del diagnóstico diferencial de chondroma y condrosarcoma de grado I, vamos a discutir el caso:
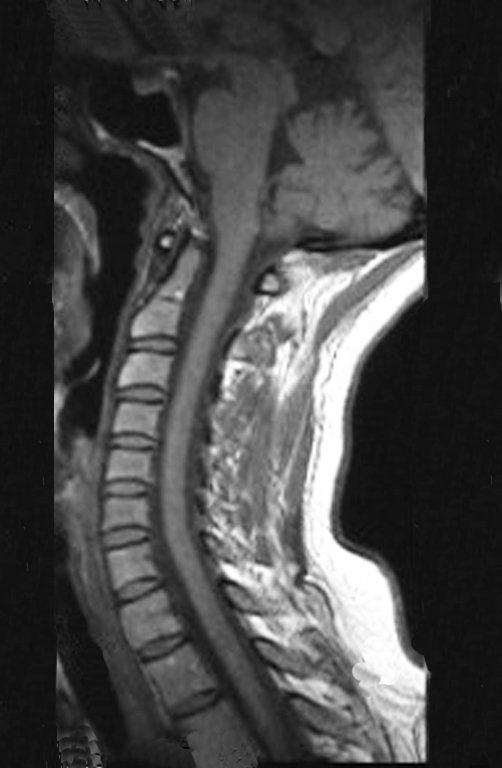
Paciente femenino de 39 años de edad, odontóloga, diestra, quien refiere dolor en hombro derecho de 8 meses de evolución. Es evaluada por facultativo quien luego de solicitar estudio radiológico indica fisioterapia para manejo de cervicobraquialgia. (Figura 1). No obtiene mejoría clínica y se solicita estudio de Resonancia Magnética de columna cervical sin evidencia de alteración cervical. (Figura 2)
Condrosarcoma y Chondroma – Diagnóstico Diferencial, Conduta e Tratamento. Reconstrução do Úmero com Endoprótese.
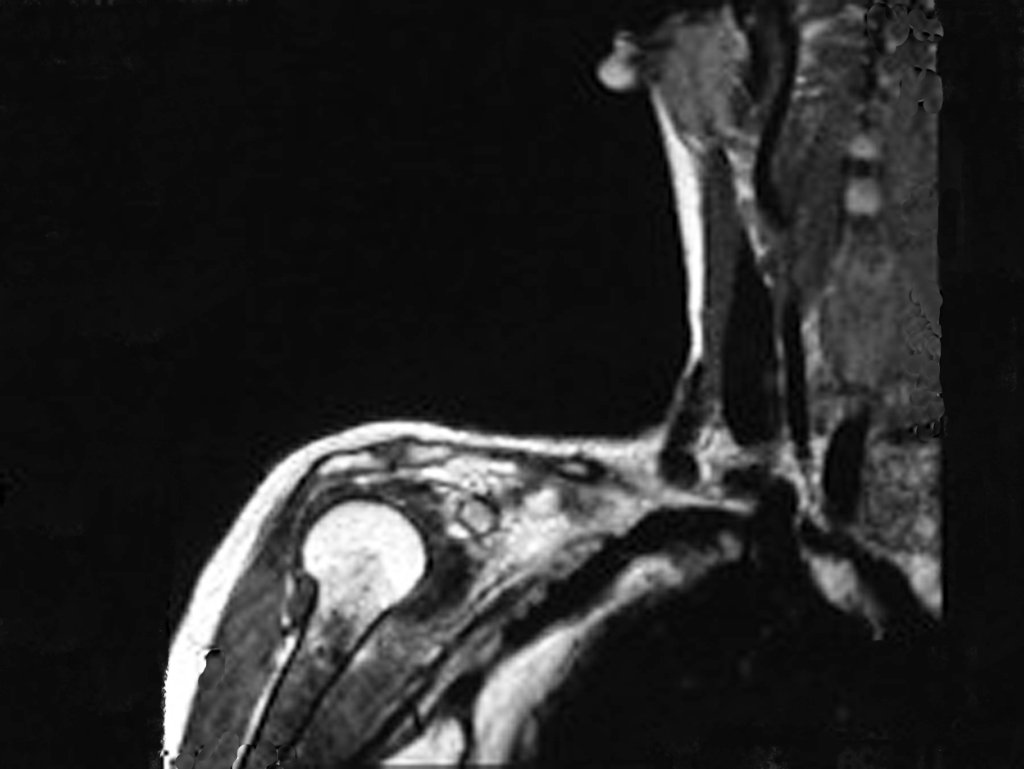
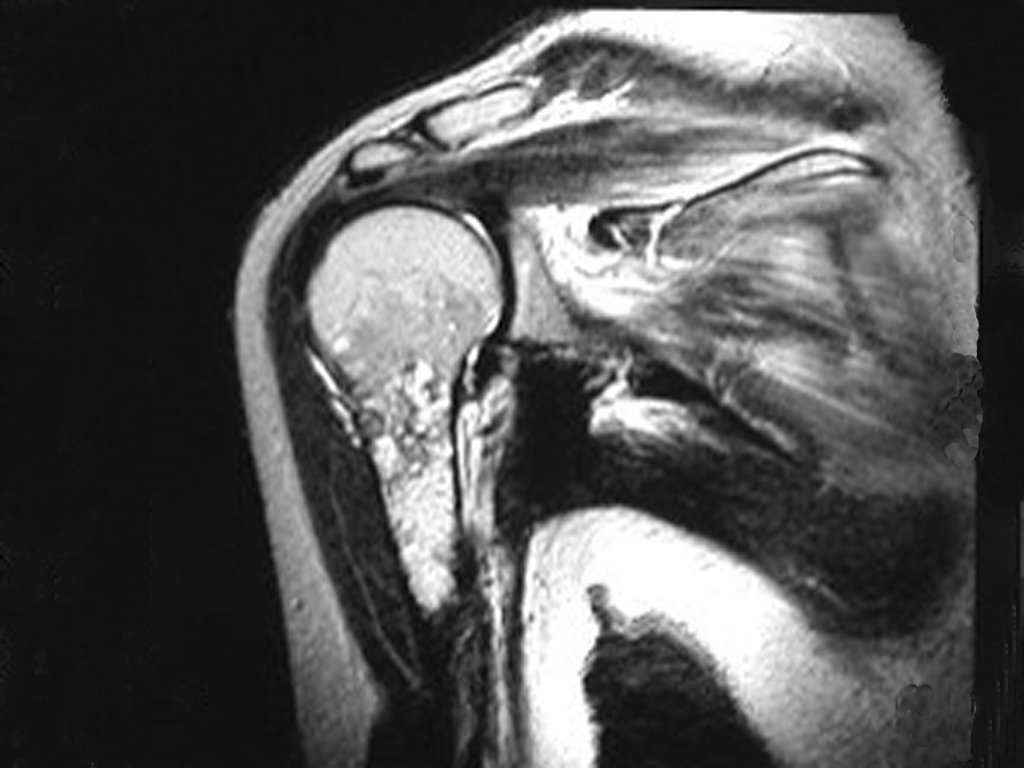
Sin embargo, el análisis de este examen evidencia como hallazgo una lesión en metáfisis proximal del húmero, hipointensa en T1 e Hipertintensa en T2. (Figuras 3 y 4)
Luego de una semana se realiza nuevo estudio de resonancia magnética para evaluar este hallazgo, observando una lesión sólida, heterogénea hipointensa y de señal intermedia en T1, ocupando todo el ancho del canal endomedular (Figura 4.A). En corte sagital T1 spir, se observa erosión de la cortical interna, simulando lesiones en saca bocado (Figura 4.B).
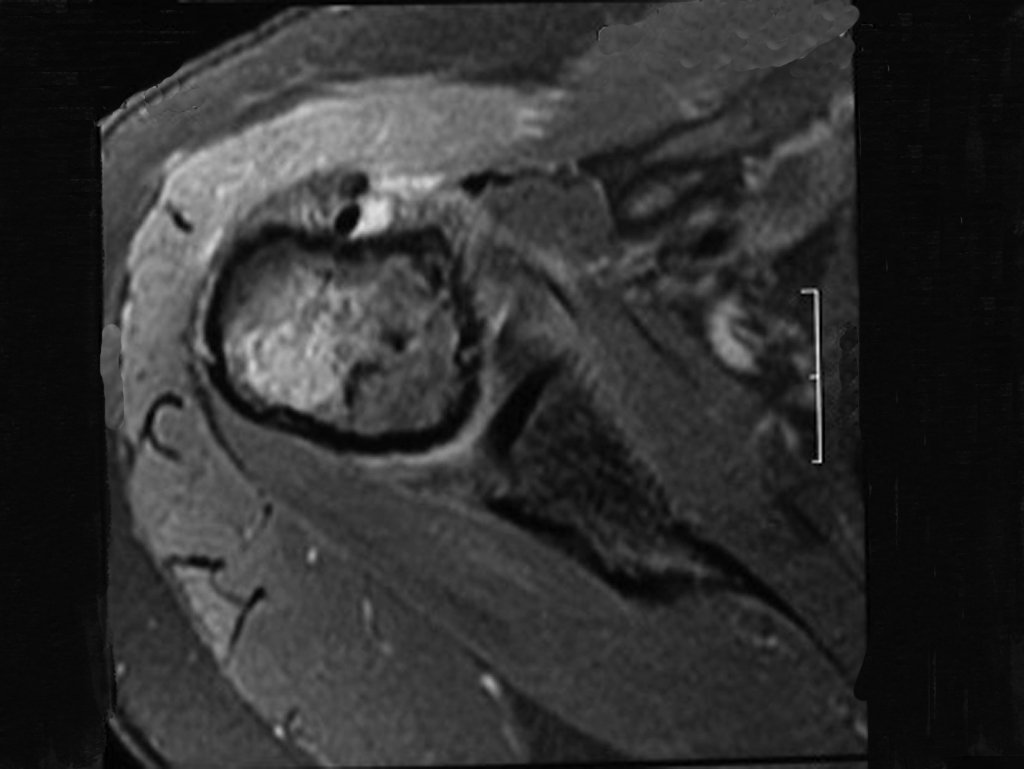
El análisis cuidadoso de las imágenes de resonancia magnética mostraba las características agresivas de la lesión, apreciando erosión de la cortical interna, áreas hipointensas e hiperintensas, heterogéneas, con captación de contraste y focos de calcificación, que son más evidentes en resonancia con densidad de protones (DP) (Figuras 5.A – 5.D).
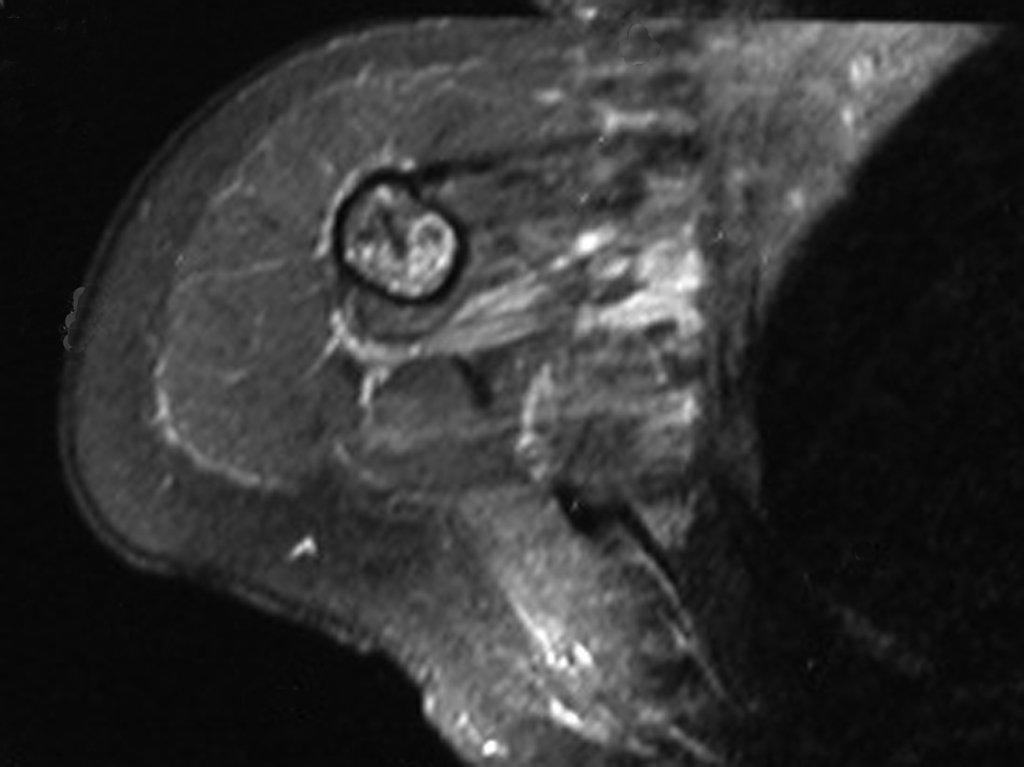
La radiografía de esta lesión se realiza el 24 de Julio de 2003, dos semanas mas tarde, destaca la presencia de esta lesión metafisodiafisiaria, ocupando dos tercios de la extremidad proximal del húmero.
Esta imagen presenta áreas de rarefacción en “saca bocado”, ensanchamiento de la medular ósea debido a erosión de la cortical interna con áreas alternas radiopacas de aspecto algodonoso que sugieren focos de calcificación (Figura 6,A).
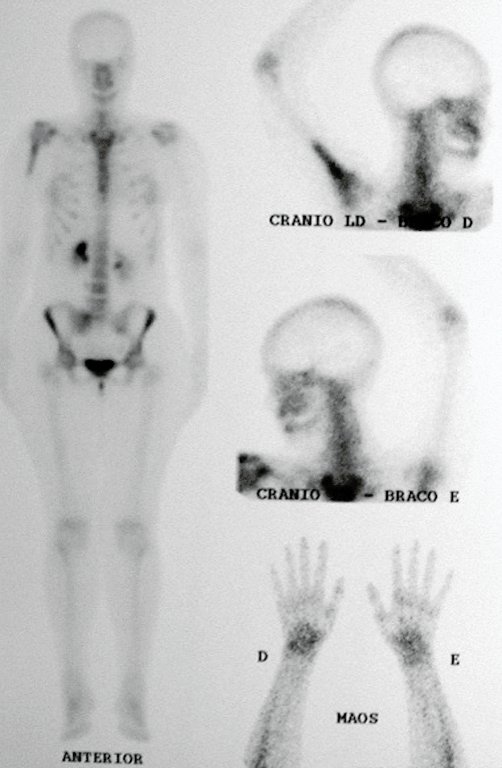
Después de este hallazgo fue referida a médico oncólogo el cual solicita estudios complementarios para estadiamiento de la lesión. Se realiza centellografía observandohipercaptación leve en húmero derecho. (Figura 6.B)
Fue entonces realizada la biopsia del húmero que reporta tejido cartilaginoso, sin atípias, y en cuyo informe sugirien nueva biopsia. (Figura 7).
Con un cuadro clínico de dolor en hombro y hallazgo de imagen de lesión agresiva con focos de calcificación surge la hipótesis de Condrosarcoma. En esta ocasión los diagnósticos diferenciales de condroma y mas remotamente de infarto óseo deben ser descartados debido a las siguientes considereciones:
- El paciente acudió al medico debido a dolor de carácter progresivo, no fue un hallazgo casual.
- La radiografía muestra ensanchamiento metafisiario, erosión cortical interna y focos de calcificación que asociados con el cuadro clínico indica que se trata de una lesión activa, con agresividad local que apunta a un diagnóstico de condrosarcoma.
- Los cortes de RMN aportan los datos de imagen que complementan el análisis apuntando a un mismo diagnóstico.
- La biopsia revela tratarse de “tejido cartilaginoso”, no se justifica realizar una nueva biopsia en esta situación.
Una nueva biopsia sería académica, pues el diagnóstico histológico entre condroma y condrosarcoma de grado I es muchas veces difícil, y el tratamiento en este caso es la cirugía. Como sabemos que la cirugía es el único tratamiento que puede curar el condrosarcoma, este caso debe ser abordado y tratado como un condrosarcoma, independientemente de un eventual diagnóstico de condroma previo por biopsia. La biopsia puede tener indicación apenas para confirmar que se trata de una lesión cartilginosa.
El primer médico opto por realizar una biopsia con aguja de JamShidi. El resultado del examen anatomopatológico fue una lesión cartilaginosa sin atipias. Preocupado con la imagen agresiva de la lesión no sintió seguridad en tratar el caso como un condroma ni de asumir la conducta de tratar como un condrosarcoma. Propuso al paciente observación durante dos meses.
Luego de este tiempo el paciente regresa con el mismo cuadro clínico. El medico solicita nueva RMN observando los mismos aspectos anteriores y el trayecto de la biopsia ahora presenta un tumor extracortical contaminando todo el tejido subcutáneo (Figuras 8.A, 8.B, 8.C y 9).
Después de este último examen el médico propone realizar una nueva biopsia. El paciente decide consultar con otro profesional buscando una segunda opinión y nos consulta.
El especialista en oncología ortopédica debe concluir el diagnóstico y definir la conducta en este momento. No debe realizar nueva biopsia, pues ¿que conducta tomará si la biopsia no es concluyente para condrosarcoma?¿qué hacer si es condroma?
Con datos clínicos que revelan dolor de carácter progresivo, estudios de imagen con lesión agresiva localque incluyen análisisanatomopatológico de lesión cartilaginosa, el especialista tiene todos los parámetros paraindicar el tratamiento de esta lesión como condrosarcoma , pues el diagnóstico histopatológico entre condroma y condrosarcoma de grado I es difícil y a veces controversial. (Figura 10 y 11).
La misma lamina presentada al mismo patólogo después de algún tiempo puede ser interpretada como transformación de condroma a condrosarcoma grado I o de condrosarcoma grado I a condroma. Aun presentando esta lamina a distintos anatomopatólogos, podemos obtener los dos diagnósticos diferentes.
Sabemos que el diagnóstico final de estos tumores debe tener correlación CLINICA-RADIOLÓGICA y ANATOMOPATOLÓGICA. El patólogo generalmente solo analiza la lamina, y quien esta manejando el caso dispone de todos los datos, por tanto debemos evaluar los exámenes de imagen y todo el cuadro clínico en esta situación.
Luego de estas consideraciones, el tratamiento quirúrgico se impone. El condrosarcoma no responde a quimioterapia ni a radioterapia. Puede curarse con la resección quirúrgica con margen oncológico, pues lamentablemente progresa localmente cuando este margen no se obtiene. La recidiva puede ocurrir de forma desdiferenciada, invadiendo los tejidos adyacentes que dificultan o impiden la cirugía de salvamiento del miembro, y además propicia la aparición de metástasis.
No se puede perder la oportunidad de curar esta lesión con la cirugía adecuada
El análisis cuidados de las imágenes de este caso indica la necesidad de una resección amplia con márgenes y sustitución por prótesis no convencional.
Esta contraindicado el curetajeintralesional aun con adyuvancia local o relleno con cemento, pues la recurrencia a una desdiferenciación es frecuente con esta conducta.
Después de explicar esto al paciente, realizamos la cirugía de resección de los dos tercios proximales del húmero incluyendo el trayecto de la biopsia, pues el condrosarcoma puede también implantarse en los tejidos blandos, y esto ya estaba ocurriendo en el trayecto de la biopsia de este caso.
Para reconstruir el húmero empleamos una prótesis no convencional de polietileno. Estas son mas livianas que las metálicas, tienen elasticidad semejante a la ósea y permiten la realización de orificios donde fuese necesario para la reinserción de los ligamentos y músculos remanentes. Alrededor del polietileno ocurre una reacción fibrótica que envuelve la prótesis y fija definitivamente los tejidos blandos reinsertados.
En detalle presentamos los pasos de la cirugía, la reconstrucción con la endoprotesis y la anatomía patológica de la pieza (Figuras 12 a 23)
La cirugía oncológica debe estar dirigida inicialmente a la resección con márgenes adecuados disminuyendo las posibilidades de recurrencia local. Conseguido este objetivo se debe realizar la mejor reconstrucción para restaurar la función lo mas parecido a lo normal. Con las prótesis no convencionales realizadas para reconstrucciones tumorales no podemos esperar la misma función que dan las prótesis convencionales utilizadas en artrosis y otras indicaciones , ya que en estos casos tenemos perdida mayor o menor de músculos y tejidos blandos sanos resecados por la necesidad de obtener márgenes oncológicos.
La fisioterapia orientada por profesional que conozca la cirugía es fundamental para conseguir buenos resultados funcionales (Figuras 24 a 27).
Podemos observar la función dinámica tres años después de la cirugía (Video 1)
Después de año y siete meses la paciente no presenta ninguna queja. Se apoya de forma relajada en la poltrona sobre el codo derecho del brazo operado (Figura ), consigue elevar la mano hasta la boca (Figura), buena rotación interna (Figura)
La paciente presenta buena función y ejerce muy bien sin ninguna dificultad sus actividades profesionales. (Video 2 )
REVISIÓN:
El condrosarcoma es el tumor maligno primario de hueso más frecuente después del osteosarcoma (23,24). El subtipo central es el más común y su incidencia es cinco veces mayor que el periférico (3), siendo raros los subtipos de células claras y mesenquimal (2).
El en grado I no ocurre metastasis y és uno sarcoma pues és de naturaleza mesenquimal, portanto no se trata de cancer, que és derivado del tejido ectodermico. El condrosarcoma és el tumor ósseo maligno mas frequente después del osteosarcoma e del sarcoma de Ewing.
Surge normalmente en los huesos de origen endocondral y principalmente en la raíz de los miembros (hombro,pelvis, costillas y esqueleto axial (1) siendo raros los de origen membranoso (24,11,15,14). Son de crecimiento lento y el paciente muchas veces busca tratamiento cuando la lesión es de grandes proporciones. Este tumor puede aparecer a cualquier edad con predominio entre los 30 a 40 años (7,11,22), con referencias en la literatura desde los tres años (15) hasta los setenta y tres años de edad (1).
Es una neoplasia maligna de naturaleza mesenquimal, productora de sustancia intersticial y células que asumen aspecto de cartílago hialino, con variados grados de inmadurez y focos de calcificaciones frecuentes pudiendo ocurrir en diferentes lugares.
Pueden ser clasificados en cuanto a su Localización: A- central, B- cortical (parostal o periostal)(23,2,24,6,3), C- periférico ( o exofítico, que recorre la capa cartilaginosa de un osteocondroma) (28) y D-de tejidos blandos (13); en cuanto a la histología: A- grado de anaplasia: clasificadas en grados I,II, y III, B- desdiferenciado, C- mesenquimal y D- células claras; en cuanto a su origen:1- primario y 2- secundario que se origina localmente en una lesión benigna preexistente como la enfermedad de Ollier (encondromatosis) o el Sindrome de Maffuci , la transformación a condrosarcoma es frecuente (20 a 30%) (2,28), pudiendo ocurrir a partir de osteocondroma solitario (en menos de uno %) o múltiplo (10%) (2) y más raramente secundario a enfermedad de Paget.
El dolor puede ser un síntoma insidioso durante varios años, evoluciona con crecimiento lento, aumento de volumen, restricción de la movilidad quedando a veces la piel ruborizada y caliente. El primer síntoma muchas veces es la fractura del hueso patológico.
La radiografía muestra lesiones metafisiarias radio transparentes sustituyendo la medular ósea que se extiende a la epífisis o diáfisis, erosionando la cortical interna (lesión en saca bocado), insuflando o expandiendo la porción medular del hueso pero permaneciendo delimitada por la cortical que se engrosa.
La aparición de calcificaciones (salpicadas como nubes de algodón (5)o anillos) son frecuentes (23,2,24,13,6,28). Estas son derivadas de la degeneración del cartílago que recibe nueva vascularización o se calcifica. Este proceso es acelerado en los condrosarcomas y lento en las lesiones cartilaginosas benignas de bajo grado.
El mapeo óseo ayuda al estadiamiento de la lesión y la resonancia magnética y la tomografía son importantes para valorar la extensión intramedualrextraosea de la lesión (2).
El diagnóstico de condrosarcoma bien diferenciado presenta dificultades histológicas y los datos de la historia clínica, localización y aspectos de imagen deben ser valorados para la conclusión diagnostica y definición de la conducta adecuada (23,14,12). Los detalles histológicos de irregularidades en la disposición y el numero de células dentro de la matriz condroide, las alteraciones nucleares e hipercromasia, pleomorfismo y mitosis atípicas, cuando están situadas en los extremos de los miembros deben considerarse condrosarcomas de I grado, aunque estos mismos aspectos histológicos pueden ser encontrados en condroma benignos de manos y pies. La microscopía las descripciones son semejantes a los condrosarcomas céntricos.
Para el diagnóstico es preciso aun diferenciar las semejanzas anatomopatológicas clínicas y radiológicas con otras lesiones.
Hacer diagnóstico con el quiste óseo aneurismático, por si carácter multiloculado, con el condroma, el osteocondroma, el condroblastoma, el osteosarcomaparostal y periostal (con el condrosarcomayuxtacortical) (16), miositisosificante, fibroma condromixoide, tumor de células gigantes y linfoma no Hodgkin (23,6,28). El condrosarcoma de células claras tiene formación intralesional de hueso reactivo pudiendo confundir con el osteosarcoma. El condrosarcomamesenquimal es formado por láminas de células pequeñas redondeadas que recuerdan al hemangiopericitoma y sarcoma de Ewing (14). El condroma central de los huesos largos, el condrosarcoma y el infarto óseo son muchas veces de difícil diagnóstico, necesitando periódicamente la evaluación clínica y radiológica para el acompañamiento de la evolución de la lesión y definición de la conducta.
La biopsia muchas veces puede no ser definitiva para el diagnóstico (23,28,12)
El tratamiento del condrosarcoma es exclusivamente quirúrgico (25), debiéndose elegir una resección amplia, incluyendo el trayecto de la biopsia (21,13). La radioterapia es ineficaz (6) no controla esta neoplasia. Para los casos de III grado se puede discutir la indicación de quimioterapia con protocolo empleado para los sarcomas de grandes células de alto grado. En condrosarcomamesenquimal que presenta predominio de células pequeñas indiferenciadas, la quimioterapia discutida recae sobre un protocolo de tratamiento de sarcoma de Ewing. En ambos casos la respuesta a la quimioterapia suele ser pobre (6). El tratamiento de esta neoplasia debe ser particularizado para cada subtipo clínico.
Como complicaciones ocurren metástasis hematógenas para los pulmones (28), pueden también presentar diseminación linfática y recidiva local. Muchos condrosarcomas presentan tendencia de invasión local (14), consiguiendo tamaños enormes, tornándose inoperables y causando la muerte por esta propagación local.
La recidiva local aumenta la incidencia de metástasis pulmonares.
EJERCICIOS:
1. ¿Cuales son las características radiográficas del condrosarcoma central?
a. Osificación intra y extra medular.
b. Lesión diafisiária con rarefacción ósea y triangulo de Codman con reacción lamelar gruesa
c. Áreas de rarefacción ósea, erosión de la cortical interna y focos de calcificación.
d. Áreas de condensación ósea con reacción periostal en hojas de cebolla.
Respuesta:c) el tejido cartilaginoso es mas radiopaco que el óseo y por tanto se presenta como rarefacción ósea que provoca expansión de la medular en saca bocado de la cortical interna, provocando erosiones. Este tejido cartilaginoso en reproducción recibe brotes vasculares y el cartílago entra en regresión calcificándose.
2. ¿Cuáles son las características del condrosarcoma en la resonancia?
a. Hiper señal en T1, baja señal en T2 y captación de contraste.
b. Hipo señal en T1, hipo señal en T2 y captación del contraste.
c. Hipo señal en T1, hiper señal en T2 y sin captación del contraste.
d. Baja señal en T1, alta señal en T2 y captación del contraste.
Respuesta:d) el tejido cartilaginoso tienen señal baja e intermedia en T1. Intermedio a través del cartílago y bajo a través de los focos de calcificación. Presenta captación del contraste a través del aumento del metabolismo local debido a la neoplasia.
3. ¿Cuales son los principales diagnósticos diferenciales del condrosarcoma central?
a. Infarto óseo y condroma.
b. Osteocondroma y sarcoma de Ewing
c. Osteomielitis y T.C.G.
d. Osteosarcoma y condroblastoma.
Respuesta: a) el infarto óseo ocasiona lesión condensante en la medular ósea, mas no causa erosión de la cortical interna y no presenta dolor de carácter evolutivo. Generalmente es un hallazgo diagnostico en una radiografía ocasional. El mismo ocurre con el condroma que no evoluciona y representa apenas restos cartilaginosos de desarrollo.
4. ¿Cuál es el tratamiento indicado para el condrosarcoma central?
a. Curetajeintralesional e injerto óseo autólogo.
b. Resección amplia y sustitución con endoprotesis no convencional.
c. Curetajeintralesional, adyuvante local con nitrógeno líquido e injerto óseo homologo.
d. Curetajeintralesional, adyuvante local con electrotermia y cemento óseo.
Respuesta:b) la cirugía de resección amplia segura y tratamiento oncológico y la reconstrucción con endoprótesis que confiera el mejor restablecimiento de la función.
5. Histológicamente es difícil el diagnóstico diferencial entre:
a. osteosarcoma y granuloma eosinofilo.
b. Condrosarcoma de grado I y condroma.
c. T.C.G y sarcoma de Ewing.
d. Osteoblastoma y encondroma.
Respuesta:b) el condroma central de los huesos largos y el condrosrcoma de grado I son muchas veces de difícil diagnóstico histológico, necesitándose el respaldo radiográfico para definición y conducta.
Referencias bibliográficas:
- ACKERMAN, L.V.; SPJUT, H.J. Tumors of bone and cartilage. Atlas of tumor pathology. Washington, Air Force Inst. Pathology, 1962, fasc, 4.
- CANALE, S.T. Cirurgia ortopédica de Campbell. Barueri: Manole; 2006
- DAHLIN, D.C. Tumores óseos . Barcelona: Ediciones Toray S/A; 1982
- DORFMAN, H.D.; CZERNIAK, B. Bone tumors. St Louis, C.V. Mosby Co., 1997, cap. 7, p.410.
- EDEIKEN, J.; HODES, P.J. Diagnóstico radiológico de las enfermedades de los huesos. Buenos Aires, Panamericana, 1977, cap. 15.
- ETCHEBEHERE, M. Tumores cartilaginosos malignos: Condrossarcomas. In: Camargo O.P. Clínica Ortopédica. Rio de Janeiro: Med si; 2002. p. 753-759
- FELDMAN, F. Cartilaginous tumors and cartilage-forming tumor like conditions of the bonés and soft tissues. In: Diseases of the Skeleton System (Roentgen Diagnosis). Part. 6 – Bone Tumors, New York, Springer-Verlag, 1977,p.177.
- FLETCHER, C.D.M., Unni K.K., OMS – Merters F. (Eds.): World Health Organization. Classification of Tumors. Pathology and Genetics of Tumors of Soft Tissue and Bone. IARC Press: Lyon 2002.
- GREENSPAN, A. Radiologia ortopédica. Rio de Janeiro: Guanabara; 2001.
- HENDERSON, E.D.; Le PAGE, G. A. Apud FELDAMAN, F. Cartilaginius tumors and cartilage forming tumor like conditions of the bone and soft tissues. In: Disease of the Skeletal System (Roentgen Diagnosis). Part. 6 – Bone tumors, New York, Springer Verlag, 1977, p.182.
- HUVOS, A.G. Bone tumors Diagnosis, Treatment and Prognosis. Philadelphia, W. B. Saunders Co., 1979, p. 13.
- JAFFE, H.L. Tumores y estados tumorales oseos y articulares. México: La Prensa Medica Mexicana; 1966.
- JESUS-GARCIA, R. – Reynaldo Jesus-Garcia
- LICHTENSTEIN, L. Barcelona: Talleres Gráficos Ibero-Americanos; 1975.
- LICHTESTEIN, L. Bone Tumor. 4 Ed St. Louis, C.V. Mosby Co., 1972, cap. 15.
- LICHTESTEIN, L.; BERNSTEIN, D. Unusual benign and malignant chondroid tumors of bone. Cancer, 12:1142, 1959.
- MARCOVE, R.C. Condrosarcoma: Diagnóstico y tratamiento. In: Clínicas Ortopécias de Norteamérica. Tumores del aparato musculosquelético. Buenos Aires, Panamericana, 1977, cap. 7.
- MARCOVE, R.C. et al. Chondrosarcoma of the pélvis and upper end of the femur. Na analisys of factors influencing survival time in113 cases. J. Bone Joint Surg., 54A:61, 1972.
- MARCOVE, R.C.; SHOJI, H,; HARLEN, M. Altered carbohidrate metabolism in cartilaginous tumors. Contemp. Surg. 5:53, 1974.
- McFARLAND, G.B.Jr.; McKINLEY, L.M.; REED, R.J. Dedifferentiation of low grade chondrosarcomas. Clin. Orthop., 122:157, 1971.
- MENENDEZ, L.R. Orthopaedic knowledge update: Actualizaciones en cirugía ortopédica y traumatología. Barcelona: Ars Medica; 2003.
- O’NEAL, L.W.; ACKERMAN, L. V. Chondrossarcoma of boné. Cancer, 5:551, 1952.
- PRÓSPERO, J.D. Tumores Ósseos. São Paulo, Roca, 2001, cap. II.
- ROBBINS. Patologia estrutural e funcional. Rio de Janeiro: Guanabara; 1996.
- ROMSDAHL, M.; EVANS, H.L.; AYALA, A.G. Surgical treatment of chondrosarcoma. In: Managment of primary bone and soft tissue tumors. Chicago, Year book med. Publisher Inc., 1977, p. 125.
- SCHAJOWICZ, F. Tumores y Lesiones Seudotumorales de Huesos y Articulaciones. Buenos Aires: Editora Médica Panamericana; 1982.
- TORNBERG, D.N.; RICE, R.W.; JOHNSTON, A.D. The ultrastructure of chondromyxoid fibroma. Clin. Orthop. Rel. Research, 95:295, 1973.
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com