Clasificación:
La Organización Mundial de la Salud (OMS) clasifica los sarcomas de tejidos blandos según el subtipo histológico al que se asemeja la neoplasia, como liposarcoma, sarcoma sinovial, rabdomiosarcoma, etc. 1
En algunos casos, la histología es incierta y el aspecto morfológico se utiliza para clasificarlos como sarcoma alveolar o sarcoma de células claras.
Los sarcomas de tejidos blandos más frecuentes en adultos son: indiferenciados, liposarcoma, sarcoma sinovial, leiomiosarcoma y tumor maligno de la vaina del nervio periférico, el cual se incluye en este capítulo, a pesar de tener origen en el ectodermo, ya que presenta comportamiento biológico, tratamiento y pronóstico similar. a sarcomas de tejidos blandos 1,2 .
El grado histológico también se utiliza para clasificar los sarcomas de tejidos blandos, dividiéndose clásicamente en Grado 1 , bien diferenciados y con bajo grado de malignidad histológica; Grado 2 , moderadamente diferenciado y Grado 3 , poco diferenciado con alto grado de malignidad 1 .
Cuadro clínico:
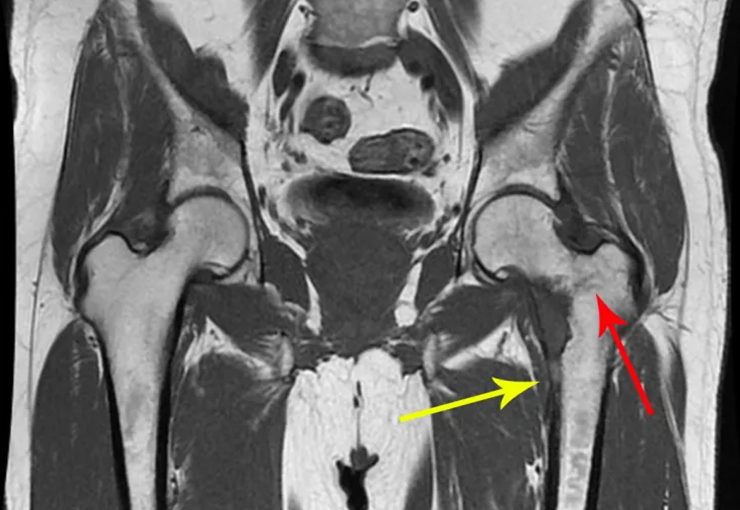
El cuadro clínico inicial es palpable como tumoración abultada, muchas veces indolora, con crecimiento progresivo que puede alcanzar un tamaño considerable, especialmente en el muslo.
Algunos pacientes pueden llegar a experimentar dolor y parestesia debido al efecto compresivo del tumor. Son clínicamente eutróficos en la mayoría de los casos, siendo síntomas excepcionales la fiebre o la pérdida de peso.
Los sarcomas de tejidos blandos tienden a crecer entre músculos adyacentes, empujando y comprimiendo las estructuras circundantes, y rara vez se extienden más allá de los compartimentos anatómicos. La velocidad de crecimiento varía entre los subtipos histológicos.
No existen criterios clínicos absolutos para diferenciar los tumores de tejidos blandos benignos de los malignos. Sin embargo, todos los tumores profundos, es decir, por debajo del plano de la fascia muscular, y los tumores superficiales mayores de 5 cm, tienen una alta probabilidad de ser malignos 2 .
Puesta en escena:
En el momento del diagnóstico, el sarcoma de tejido blando rara vez metastatiza y no supera el 10 por ciento de los casos. Esto ocurre con mayor frecuencia en tumores de gran volumen, profundos a la fascia muscular y de alto grado 2 .
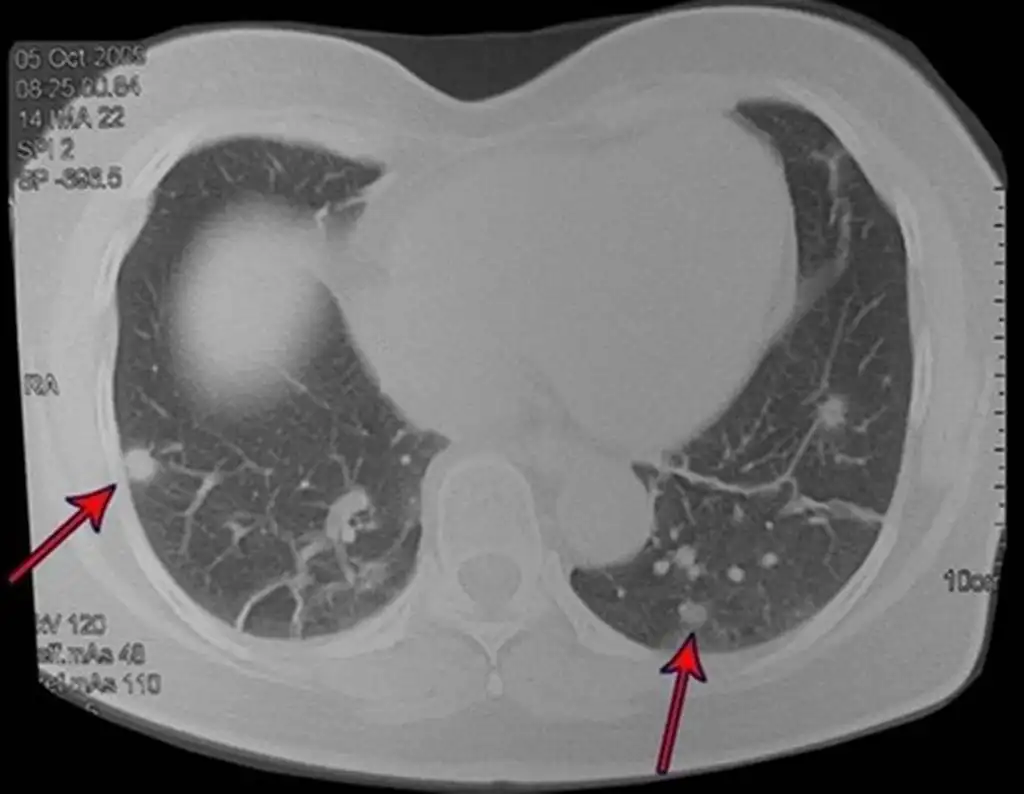
El patrón de diseminación de la mayoría de los sarcomas es hematógeno y el sitio principal de metástasis es el pulmón. Por este motivo, a todos los pacientes con sarcoma de tejidos blandos se les debe realizar una estadificación torácica. Siempre debe estar indicada la tomografía de tórax para buscar metástasis pulmonares, especialmente en pacientes de alto riesgo, como lesiones superficiales mayores a 5 cm, tumores profundos y aquellos con alto grado de malignidad.
Los ganglios linfáticos regionales son sitio de metástasis en el 2,6% de los casos, sin embargo, en algunos subtipos histológicos estas pueden ser más frecuentes y deben ser investigadas, como rabdomiosarcoma, sarcoma sinovial, sarcoma epitelioide, sarcoma de células claras y angiosarcoma 2 .
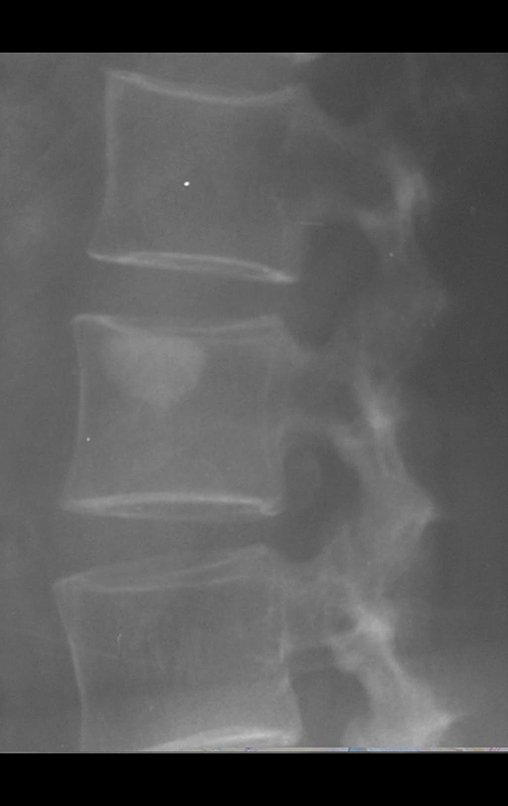
Se recomienda la tomografía del abdomen y la pelvis, especialmente en la estadificación del sarcoma de células redondas de tejido blando y del liposarcoma mixoide, debido a la alta tasa de metástasis extrapulmonares al abdomen y al retroperitoneo. En el caso del angiosarcoma, la evaluación del sistema nervioso central, mediante tomografía de cráneo, es necesaria debido a la propensión a metástasis al cerebro.
Exámenes de imágenes:
a) Radiografía:
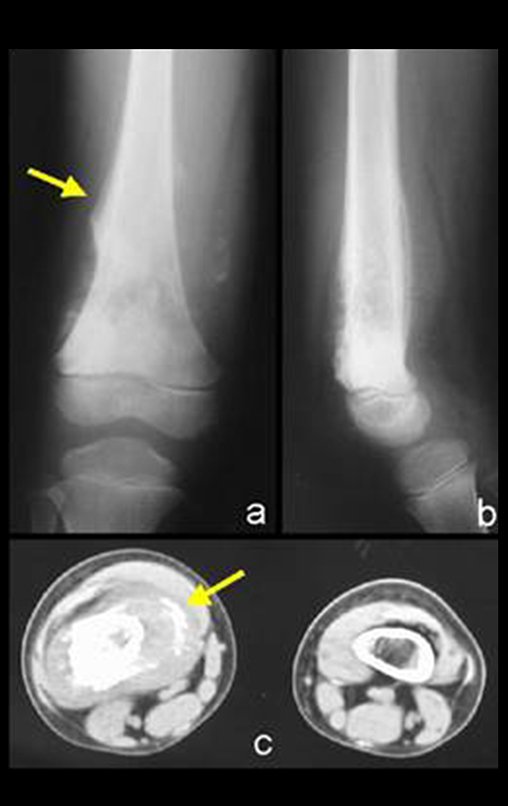
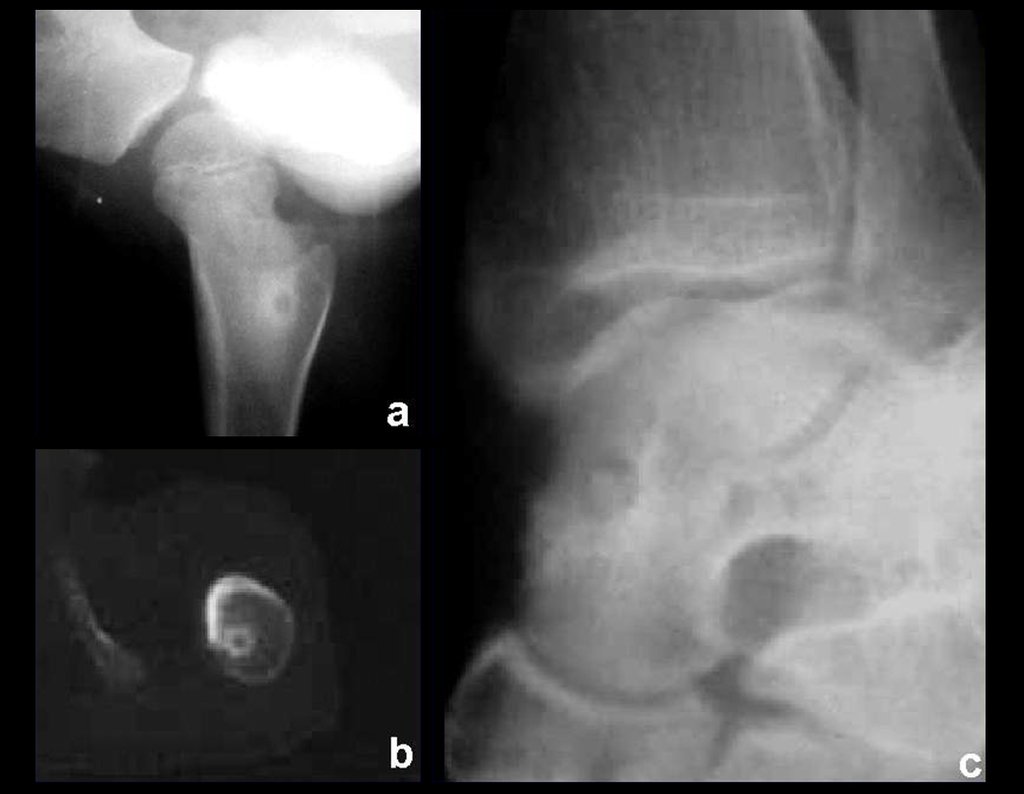
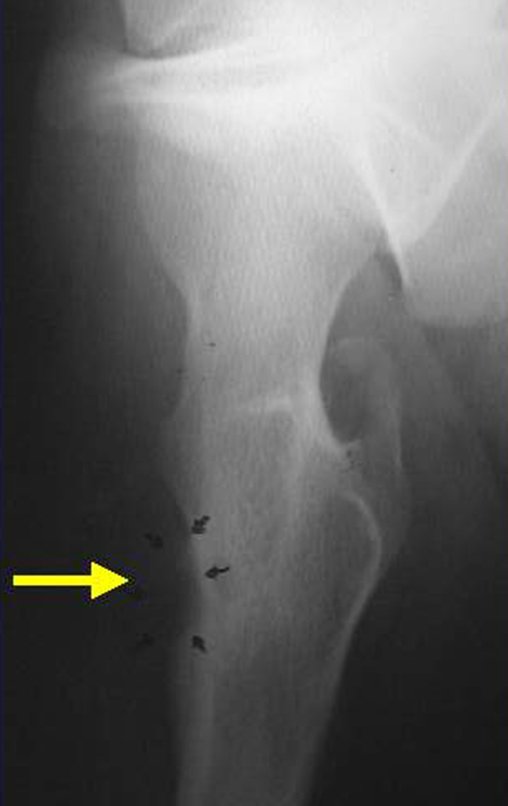
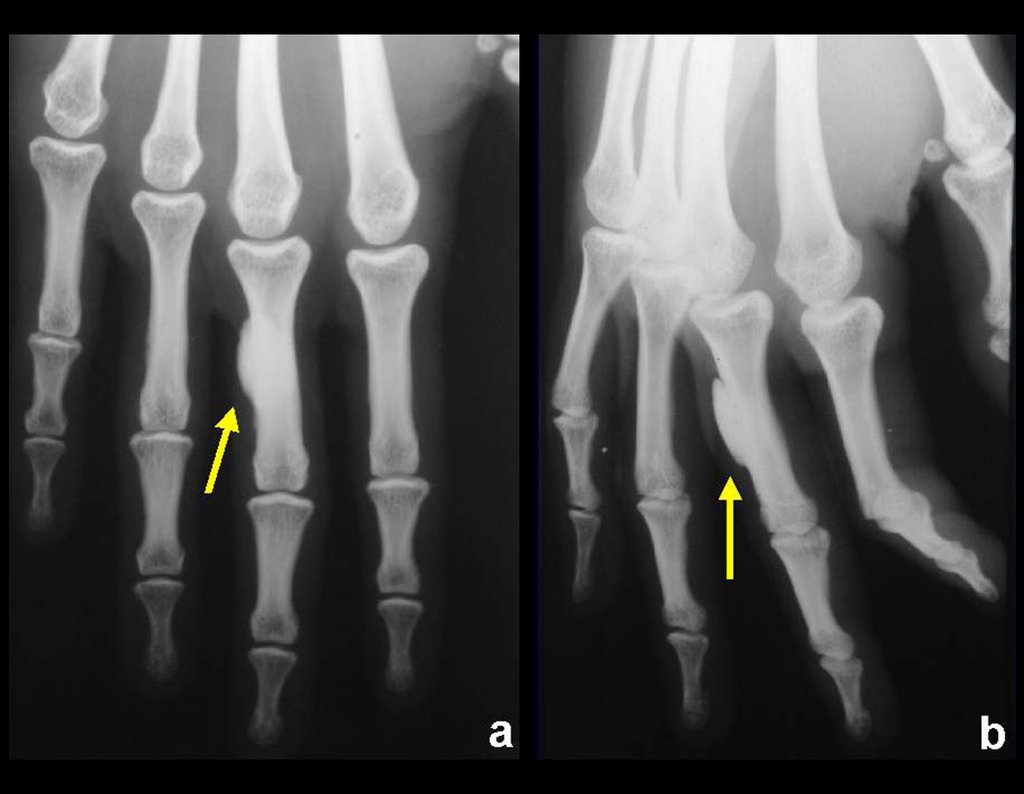
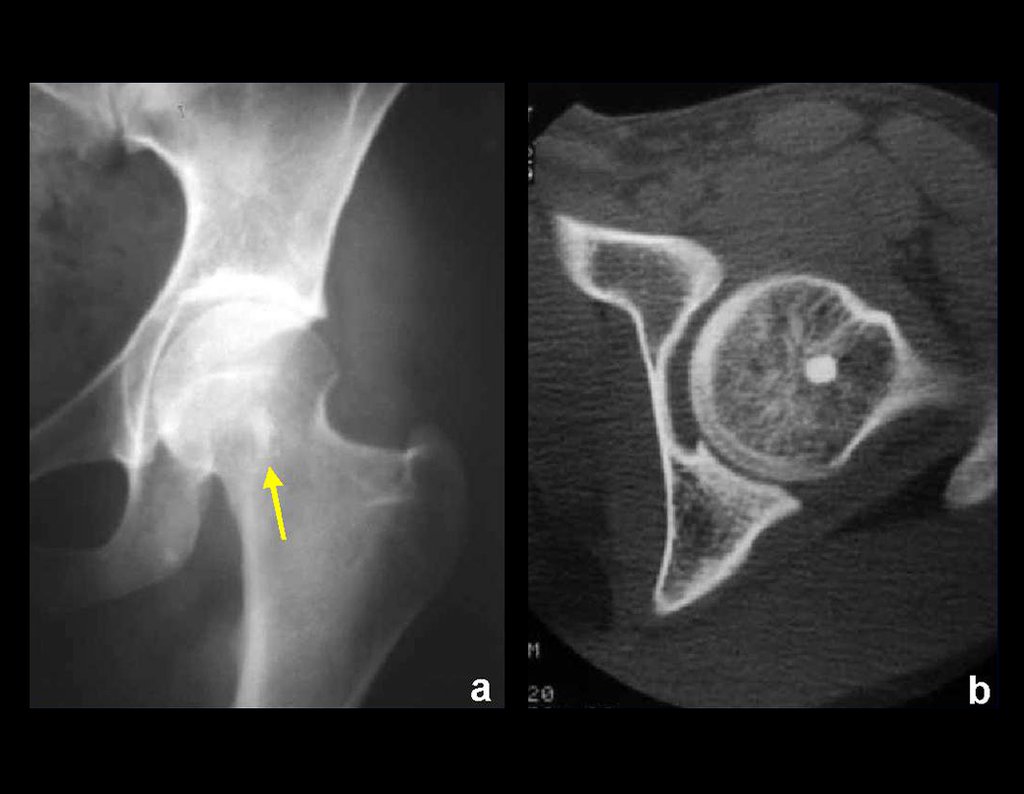
La radiografía es la prueba de imagen más barata y accesible. Puede utilizarse como primera línea de evaluación tumoral, para diferenciar un tumor de origen esquelético de un sarcoma de tejidos blandos. Además, puede presentar calcificaciones en su interior.
b) Resonancia magnética:
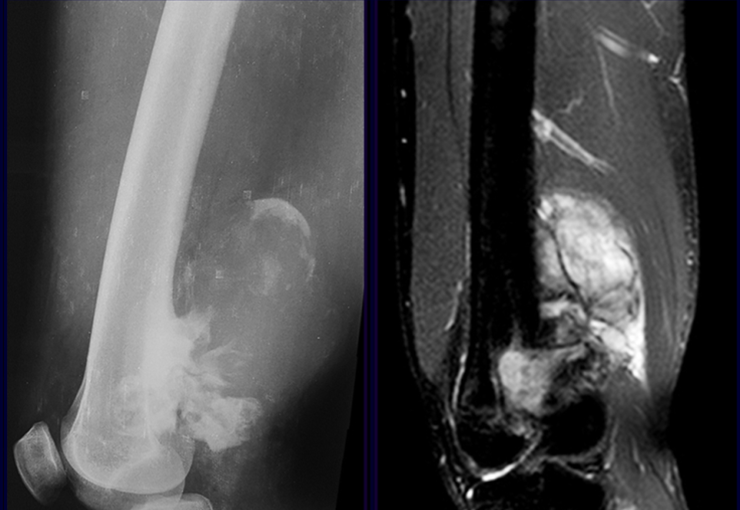
La resonancia magnética sigue siendo la prueba de elección para evaluar sarcomas de tejidos blandos cuando no existen elementos metálicos, como una prótesis ortopédica. Puede detallar los límites del tumor y su relación con las estructuras vecinas. El uso de contraste también puede diferenciar lesiones sólidas de lesiones llenas de líquido, por lo que se debe solicitar la exploración con contraste.
c) Tomografía:
La tomografía es el examen de elección en tumores retroperitoneales y en la búsqueda de metástasis pulmonares, ya que la resonancia no es adecuada por el movimiento respiratorio y el peristaltismo intestinal. En el estudio del MTS de las extremidades, la resonancia es superior para delimitar la extensión neoplásica 2 .
d) Pet-Cet:
La tomografía por emisión de positrones con flúor desoxiglucosa (FDG-PET/CT) permite, con alta sensibilidad, diferenciar el sarcoma de tejido blando de alto grado de los tumores benignos de tejido blando. Sin embargo, pierde valor para diferenciar entre tumores de bajo grado y de bajo grado. 2 .
La FDG-PET/CET no debe utilizarse de forma rutinaria en la evaluación inicial de un paciente con tumor tisular, sin embargo su uso está indicado para determinar el pronóstico y la respuesta al tratamiento de quimioterapia 2 , 3 .
El valor de absorción estándar (SUV) es una cuantificación de la glucosa marcada con flúor consumida por el tumor y demuestra el metabolismo del tumor. El sarcoma de tejidos blandos con SUV igual o superior a 6, que después de la quimioterapia muestra una reducción de este valor inferior al 40 por ciento, presenta mayor riesgo de recurrencia sistémica de la enfermedad 2 .
e) Gammagrafía:
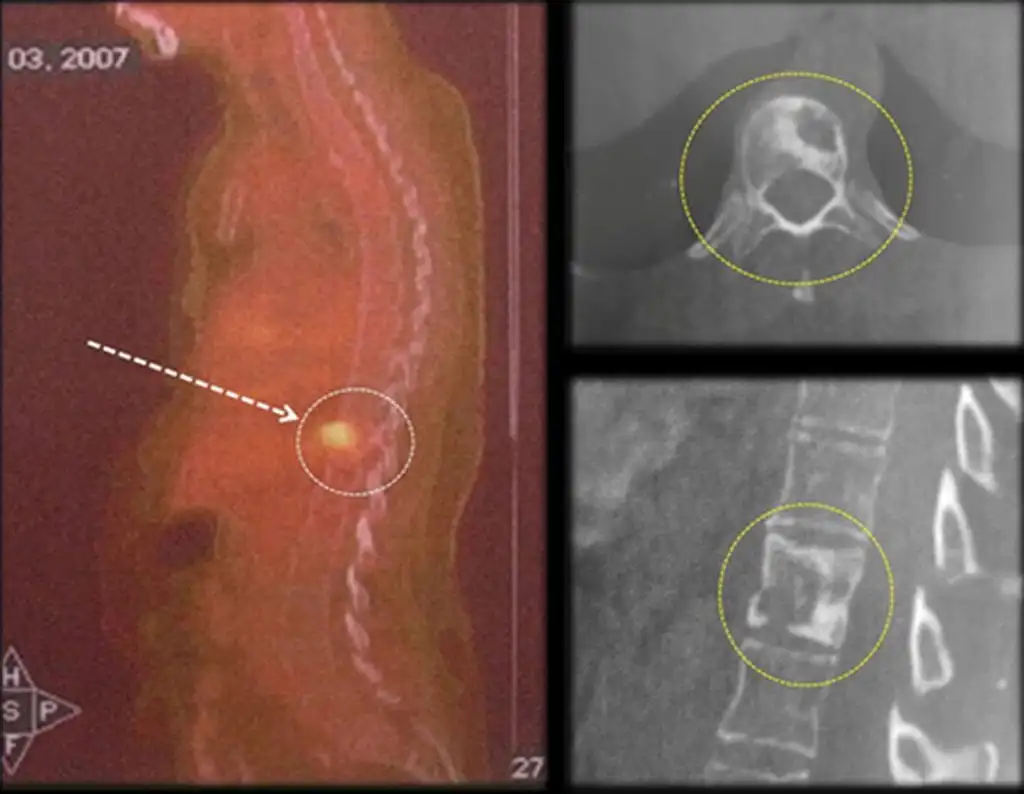
La gammagrafía ósea no siempre se realiza en la estadificación inicial del sarcoma de tejidos blandos, ya que las metástasis óseas en adultos son poco frecuentes en la etapa inicial de la enfermedad. La excepción son los tumores de células redondas y el liposarcoma mixoide, pero el mapeo esquelético puede ser falso negativo y se recomienda la evaluación mediante resonancia magnética 2 .
Biopsia:
La biopsia está indicada para el diagnóstico histológico del SMT, ya que las pruebas de imagen no presentan características sugestivas del subtipo histológico, como podemos inferir en algunas neoplasias óseas, como el osteosarcoma.
No siempre es necesaria una biopsia para el tratamiento, ya que el tratamiento del MTS sigue siendo principalmente quirúrgico y, en algunos casos, la biopsia puede sustituirse por una resección por escisión o también llamada biopsia por escisión.
Los tumores superficiales, por encima de la fascia muscular, menores de 5 cm, tienen baja probabilidad de ser malignos. En estos casos se pueden resecar sin diagnóstico histológico si se someten a cirugía oncológica (resección amplia con margen oncológico, sin comprometer las estructuras nobles circundantes) , ya que este sería el tratamiento correcto en el caso de que estemos ante una alta -grado de sarcoma de tejidos blandos de calidad.
La biopsia debe ser realizada por el cirujano que realizará el tratamiento definitivo o ser guiada por él. El trayecto de la biopsia debe estar alineado con la incisión que se utilizará para la resección y todo este trayecto de la biopsia debe extirparse en bloque, junto con el tumor.
La biopsia incisional, realizada a través de una incisión quirúrgica, exponiendo parte del tumor, fue la más utilizada para el diagnóstico del sarcoma de tejidos blandos. Actualmente, las biopsias percutáneas han ganado terreno con el desarrollo de agujas adecuadas, como la Trucut®, y métodos de imagen como la ecografía y la tomografía para guiarlas.
Patología:
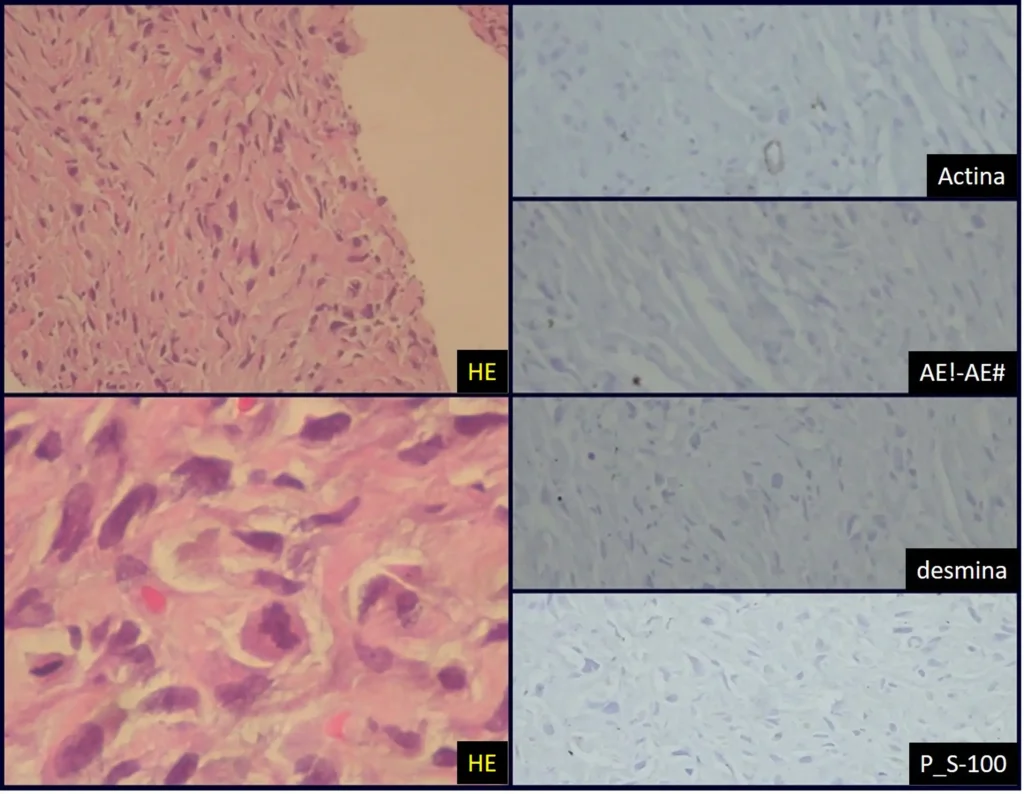
El patólogo siempre debe estar presente para realizar el examen de la sección congelada, con el fin de confirmar y asegurar que el material recolectado sea representativo de la lesión, evitando la necesidad de repetir el procedimiento. El resultado histológico definitivo debe esperar la histología con parafina y posiblemente la inmunohistoquímica.
La biopsia percutánea con aguja, realizada con estas precauciones, generalmente permite diferenciar los tumores malignos de los benignos y los patólogos experimentados son capaces de determinar correctamente el grado histológico de los tumores en un 97,6 y 86,3 por ciento respectivamente, además de que esta técnica provoca una menor diseminación local. del tumor durante el procedimiento 3 .
Sarcoma de tejidos blandos – Tratamiento:
El tratamiento de los tumores de tejidos blandos es generalmente quirúrgico, sin embargo, como ocurre con la mayoría de las neoplasias, el seguimiento de los pacientes con cáncer debe ser siempre multidisciplinario.
Desde el diagnóstico hasta la estadificación y el tratamiento, en el manejo del caso interactúa un equipo de varios profesionales, como el ortopedista que realizará la cirugía oncológica , el patólogo, el radiólogo, el oncólogo clínico, el radioterapeuta, el psicólogo, el trabajador social, etc. .
El objetivo del tratamiento es preservar la vida del paciente, evitando la recurrencia local, maximizando la función del miembro afectado y minimizando la morbilidad del tratamiento.
Quimioterapia:
Los sarcomas de tejidos blandos, en la población pediátrica, responden a la quimioterapia sistémica presentando una mayor respuesta a los fármacos, proporcionando una mejora en la supervivencia, ya que el niño es capaz de soportar las dosis de quimioterapia necesarias para controlar la enfermedad, a diferencia de los adultos.
En los niños, los sarcomas de tejidos blandos más comunes son el rabdomiosarcoma, la forma extraósea del osteosarcoma y la forma extraósea del sarcoma de Ewing. Todos ellos con protocolos de quimioterapia neoadyuvante y adyuvante.
En los raros casos de que estas neoplasias se presenten en adultos, se opta por el protocolo de quimioterapia pediátrica, en dosis compatibles con los adultos y sus posibles comorbilidades.
En los sarcomas de tejidos blandos del adulto existe una gran controversia respecto al uso de la quimioterapia. El metaanálisis publicado en 1997 por la colaboración Sarcoma Meta-analysis mostró que el uso de doxorrubicina en estos pacientes aumentó el tiempo libre de recurrencia local y metástasis a distancia, pero no hubo beneficio estadísticamente significativo en la supervivencia global de los pacientes 3 .
En 2008 se publicó un nuevo metanálisis actualizado que demuestra que el uso de doxorrubicina asociada a ifosfamida promovió una mejora en la supervivencia de los pacientes 3 . Sin embargo, la quimioterapia es extremadamente tóxica, especialmente en la población adulta donde la presencia de comorbilidades clínicas puede hacer inviable un tratamiento eficaz. La recomendación actual es individualizar cada caso, recordando que el tratamiento sistémico no corrige una resección quirúrgica inadecuada.
En general, los MTS adultos responden mal a la quimioterapia. Por tanto, el tratamiento se basa en la resección quirúrgica.
Cirugía oncológica:
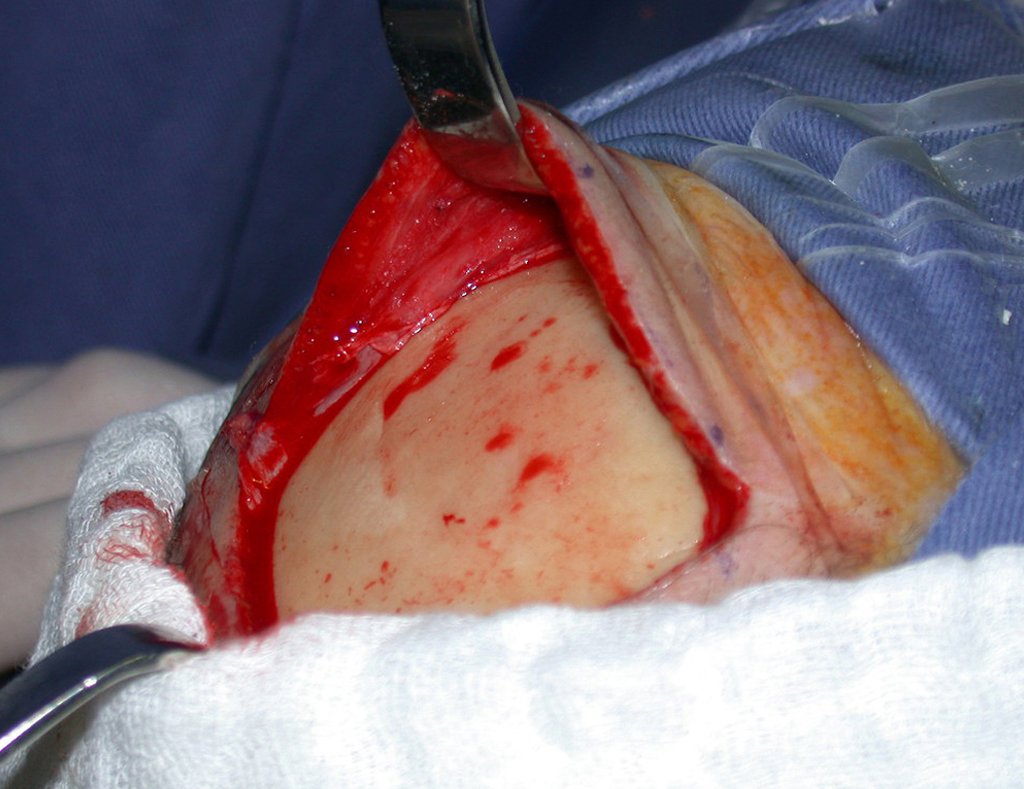
La cirugía de resección del sarcoma de tejidos blandos debe realizarse con márgenes amplios, de modo que todo el tumor sea extirpado en bloque y cubierto por tejido sano, con el objetivo de garantizar que no queden células neoplásicas residuales después de la resección.
Los sarcomas de tejidos blandos tienen una pseudocápsula circundante. Esta estructura está representada por un proceso inflamatorio producido por la agresión tumoral y no siempre es una barrera suficiente para las células neoplásicas, que permean los tejidos circundantes. La radioterapia adyuvante puede estar indicada para actuar sobre los márgenes cuando estos deben ser pequeños, debido a la necesidad de preservar estructuras nobles, como vasos y nervios.
La resección del tumor a través de la pseudocápsula puede dejar tejido neoplásico microscópico en el paciente y puede ser un factor de riesgo de recurrencia local y peor pronóstico.
Los sarcomas de tejido blando tienden a crecer expandiéndose y empujando el tejido circundante, pero rara vez infiltrándolo. Por tanto, la invasión del hueso o de los tejidos musculares adyacentes es poco común.
La mayoría de las veces cuando el tumor se acerca al hueso es posible disecarlo extirpando el periostio que rodea el hueso en cuestión, junto con el tumor. Esta desperiostización asociada a la radioterapia, que generalmente se utiliza como adyuvante, aumenta el riesgo de fractura, especialmente en el fémur 4 .
Reaparición:
El grosor de los amplios márgenes alrededor del tumor es cuestionable, recomendándose 1 cm, pero rara vez ocurre de forma homogénea en toda su circunferencia.
Para preservar los tejidos nobles, como grandes nervios o vasos, el cirujano eventualmente reduce este margen para evitar la resección de dicha estructura, lo que puede poner en riesgo tanto al paciente como al propio miembro para preservar la mejor función.
Por otro lado, los planos de tejido anatómico representan diferentes barreras para el tumor, como la fascia muscular, donde márgenes de 1 a 2 milímetros pueden ser adecuados para una resección segura.
Otros tejidos como la grasa o el músculo del vientre requieren márgenes más amplios.
Los nervios grandes se pueden conservar diseccionando y eliminando la vaina nerviosa externa como margen, ya que los sarcomas de tejido blando no suelen infiltrar los nervios. Cuando el tumor rodea al nervio existe mayor dificultad técnica y es posible que sea necesario seccionar y reconstruir este nervio con suturas microquirúrgicas.
Los injertos nerviosos para la reconstrucción rara vez son útiles en las extremidades inferiores de los adultos, especialmente en un sitio que será necesario irradiar. Los niños, sin embargo, pueden tener mejores resultados.
Generalmente se evita la cirugía ablativa, ya que incluso una función limitada de la extremidad inferior puede ser viable, incluso en casos que requieren una resección completa del nervio ciático.
Radioterapia:
El uso de radioterapia adyuvante promueve la destrucción de las células tumorales alrededor de la lesión principal. Cuando se asocia con resección quirúrgica que preserva la extremidad, promueve un mayor control local, minimizando la recurrencia entre un 10 y un 15% 4 . Sin embargo, la combinación de esta modalidad terapéutica no aumenta la supervivencia global.
La radioterapia está indicada para casi todos los casos de sarcoma de tejidos blandos.
La resección quirúrgica exclusiva puede ser suficiente en casos de tumores superficiales de bajo grado o de pequeño volumen, totalmente intramusculares, siempre y cuando se garanticen amplios márgenes en la cirugía oncológica realizada.
Con la mejora del control local, la radioterapia como adyuvante en los sarcomas de tejidos blandos ha reducido la tasa de amputación de extremidades del 50% en los años 1970 al 1% actual, sin comprometer la supervivencia 5 .
La indicación de amputación en presencia de MTS puede ser necesaria en tumores excesivamente extensos, de modo que el muñón no tenga función.
Un ejemplo es la necesidad de resecar un tronco nervioso principal, como es el plexo braquial, ante la imposibilidad de obtener márgenes amplios. En este caso, la pérdida de sensibilidad da como resultado una extremidad restante inviable.
La afectación de grandes vasos por el tumor ya era indicación de amputación en el pasado, sin embargo con la técnica de reconstrucción vascular se hizo posible resecar el tumor en bloque con los vasos y reconstruirlos con un injerto vascular, permitiendo una extremidad viable.
Márgenes quirúrgicos:
La principal variable en el control local de la enfermedad son los márgenes quirúrgicos de resección del tumor 5 .
La presencia de márgenes coincidentes con el tumor aumenta el riesgo de recurrencia local y la recurrencia aumenta el riesgo de metástasis a distancia, lo que puede conducir a una supervivencia más corta.
La presencia de márgenes comprometidos, sin embargo, no representa certeza de recurrencia local, ya que sólo el 30 por ciento de los casos sometidos a resección incompleta y sometidos a radioterapia adyuvante sufrieron recurrencia.
Por otra parte, márgenes amplios tampoco son garantía de control local, ya que, incluso cuando se asocia con radioterapia, la recurrencia en esta situación ronda entre el 5 y el 10 por ciento.
La presencia de márgenes positivos en la resección puede requerir un nuevo abordaje del lecho quirúrgico, buscando ampliar los márgenes previamente obtenidos.
Este nuevo abordaje dependerá del análisis de qué estructura anatómica será necesario resecar para esta expansión.
En los centros de referencia en cirugía oncológica, la presencia de márgenes comprometidos suele estar relacionada con un posible tumor residual en grandes haces nerviosos que requeriría amputación para su resección. Si este es el caso, se puede utilizar una dosis más alta de radioterapia (66-68 Gy) o optar por la amputación como último recurso.
Tumores benignos de tejidos blandos:
Los tumores benignos de tejidos blandos son cien veces más frecuentes que los tumores malignos. Entre ellos, el lipoma subcutáneo se encuentra entre los más diagnosticados en la práctica clínica.
Estas lesiones no causan dolor y se diagnostican cuando son superficiales y protruyen en la piel o cuando son profundas y alcanzan un gran volumen. La excepción es el schwannoma que surge de un nervio periférico y puede presentar dolor, parestesia y, con menos frecuencia, cambios motores.
Aunque son benignos, con el crecimiento de estos tumores se puede producir la compresión de estructuras adyacentes y sólo entonces aparecerán los síntomas.
El tratamiento de la mayoría de los tumores benignos de tejidos blandos depende de los síntomas que eventualmente produzcan. Como la mayoría de ellos son asintomáticos, la resección quirúrgica está indicada cuando aumentan de tamaño, provocando molestias o cambios estéticos.
En tumores superficiales, de pequeño tamaño, asintomáticos y sin signos sugestivos de malignidad en los exámenes de imagen, se puede optar por observar la evolución clínica.
El tumor desmoide, a pesar de ser benigno, es una neoplasia de tejidos blandos localmente agresiva, que produce síntomas atacando los tejidos vecinos.
A diferencia de la mayoría de las neoplasias benignas de tejidos blandos, la resección desmoide debe estar indicada con márgenes amplios, una cirugía oncológica similar al tratamiento de los tumores malignos.
El tumor desmoide es muy recurrente, incluso después de una resección adecuada. En algunos casos, el paciente puede requerir la amputación de la extremidad debido a numerosas recurrencias, o cuando experimenta dolor o disfunción intratable y una nueva resección se vuelve imposible.
Discusión:
- ¿Una consideración es realizar una biopsia previa o biopsia escisional ( resección por biopsia ) en casos de sarcomas de tejidos blandos superficiales, pequeños, o en lugares donde es posible la cirugía oncológica, con márgenes amplios en toda la circunferencia del tumor?
- Otra consideración es respecto de los sarcomas de tejidos blandos en adultos, en los que la quimioterapia neoadyuvante no mejora localmente ni interfiere con la supervivencia. Existe controversia sobre el uso de la radioterapia neoadyuvante:
- A) Radioterapia + cirugía + radioterapia o
- B) ¿Cirugía + radioterapia?
La Tabla 2 a continuación resume los parámetros que debemos considerar.