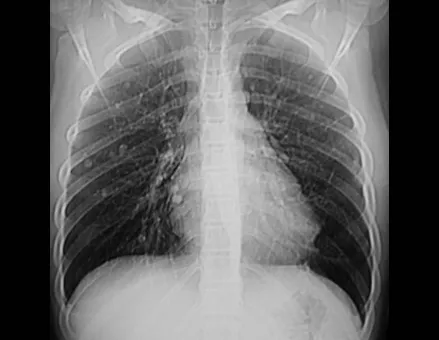
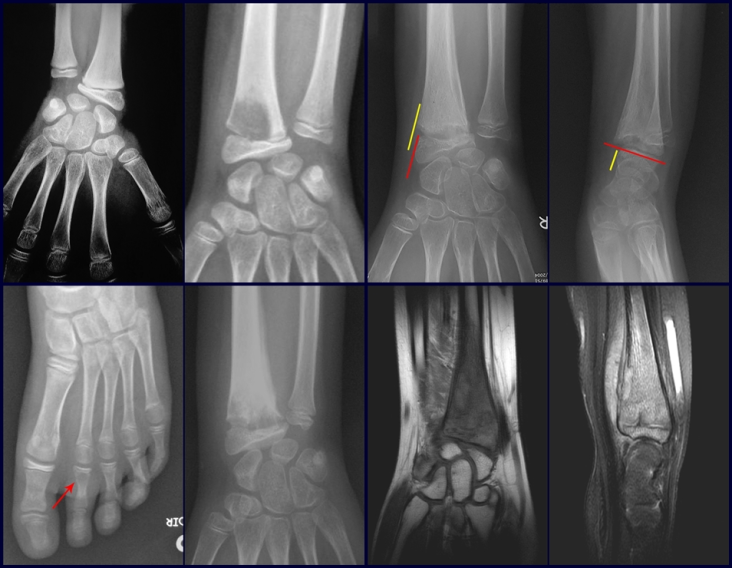
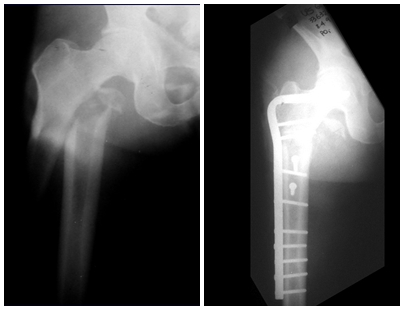
Farber y Green, en 1942, demostraron que la lesión podía ocurrir de forma localizada o múltiple en el esqueleto y posiblemente estar relacionada con la enfermedad de Hand-Schuller-Christian y la enfermedad de Letter-Siwe3.
En 1944, Jaffe y Lichtenstein introdujeron el término granuloma eosinofílico del hueso4. La relación de esta lesión con las formas sistémicas de la enfermedad fue confirmada por Lichtenstein en su publicación de 1953, englobándolas bajo el nombre de Histiocitosis X5.
Actualmente, esta entidad se denomina Histiocitosis de Células de Langerhans, la cual presenta cuatro formas clínicas distintas: Granuloma Eosinofílico, forma restringida al esqueleto, que puede ser localizada o múltiple; Hand-Schuller-Christian, forma crónica y diseminada; Letter-Siwe, forma diseminada aguda o subaguda y Hashimoto-Pritzker, forma posnatal con resolución espontánea6.
Introducción: El granuloma eosinofílico solitario del hueso es la más común de las cuatro formas de presentación de la Histiocitosis de Células de Langerhans, representando entre el 60% y el 80% de los casos7.
Entre las lesiones óseas benignas, es una entidad rara, representando menos del 1%8. Afecta preferentemente a niños y adolescentes con predominio masculino 2:19. Alrededor del 80% de los pacientes tienen menos de 21 años y la mayoría de ellos tienen entre cinco y 15 años6,7,9.
Algunos pacientes pueden comenzar con una lesión ósea aislada y luego desarrollar múltiples lesiones óseas. Estos casos pueden eventualmente evolucionar hacia formas sistémicas de la enfermedad. Cuando esto ocurre, suele ocurrir dentro de los primeros seis meses del diagnóstico y prácticamente nunca después del año de evolución, lo que es criterio de buen pronóstico, cuando no aparecen nuevas lesiones después de este período de seguimiento clínico10.
El síndrome de Hand-Schuller-Christian es la forma crónica de histiocitosis de células de Langerhans, caracterizada por afectación sistémica con múltiples lesiones óseas, principalmente en cráneo, exoftalmos y diabetes insípida, afectando a niños mayores de 3 años10.
El Síndrome de Letter-Siwe afecta a niños menores de tres años, es la forma aguda o subaguda, también con afectación sistémica. Se presenta con fiebre, otitis media, infecciones bacterianas recurrentes, anemia, hemorragias, viceromegalia, adenopatías difusas y dolorosas con afectación cutánea similar al eccema seborreico y lesiones ostelíticas generalizadas, con frecuente progresión a la muerte10.
El síndrome de Hashimoto-Pritzker es una forma de histiocitosis de células de Langerhans que afecta exclusivamente a la piel. Afecta a niños en el primer mes de vida, manifestándose con erupciones eccematosas que se resuelven espontáneamente6.
Etiología: Desconocida.
Genética: No hay informes significativos al respecto.
Definición: El granuloma eosinofílico es una lesión pseudotumoral, de etiología desconocida, caracterizada por rarefacción ósea que puede ser solitaria o múltiple. Microscópicamente presenta un perfil de células histiocíticas mononucleares, presentando antígenos de origen dendrítico, conocidos como células de Langerhans, en medio de una cantidad variable de leucocitos, eosinófilos, linfocitos y células gigantes.
Epidemiología: El Granuloma Eosinofílico afecta principalmente al esqueleto axial, en este orden: cráneo, pelvis, vértebras, costillas, mandíbula, clavícula y escápula.
En el esqueleto apendicular el fémur, región proximal y diáfisis, húmero y tibia9. La mayoría de las veces afecta a la diáfisis o región metadiafisaria, siendo rara en la epífisis7.
La columna representa el 10% de los casos en la población pediátrica, la mayoría en la región lumbar.
En adultos ocurre con mayor frecuencia en las costillas y con menor frecuencia en la columna, respectivamente 25% y 3%6.
Cuadro clínico: El síntoma más frecuente del Granuloma Eosinofílico es el dolor localizado, pulsátil, de corta duración, que empeora por la noche asociado a calor local y edema. Cuando afecta al cráneo, este dolor puede confundirse con otras causas de dolor de cabeza.
El compromiso de los cuerpos vertebrales puede producir una escoliosis dolorosa. Las desviaciones angulares son pequeñas, inferiores a 100, ya que el aplanamiento vertebral suele ser uniforme y rara vez produce síntomas neurológicos.
En otras formas de histiocitosis de células de Langerhans, pueden presentarse síntomas sistémicos como fiebre, erupciones cutáneas y diabetes insípida. La hepatoesplenomegalia puede ocurrir en el síndrome de Letter-Siwe, que es la forma más grave de la enfermedad6
Clasificación: El granuloma eosinofílico puede manifestarse en dos formas clínicas: Solitario o Múltiple .
Pruebas de laboratorio: los cambios de laboratorio que se pueden encontrar son un aumento en la VSG y la PCR, y ocasionalmente puede ocurrir una eosinofilia leve en el recuento sanguíneo.
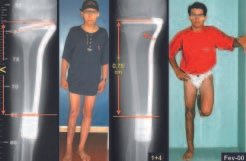
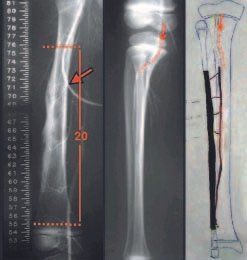
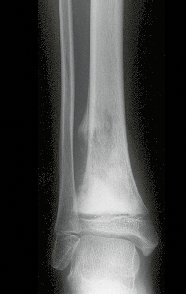
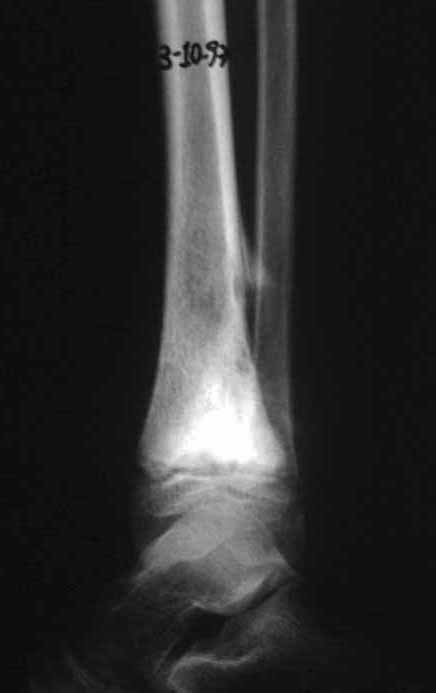
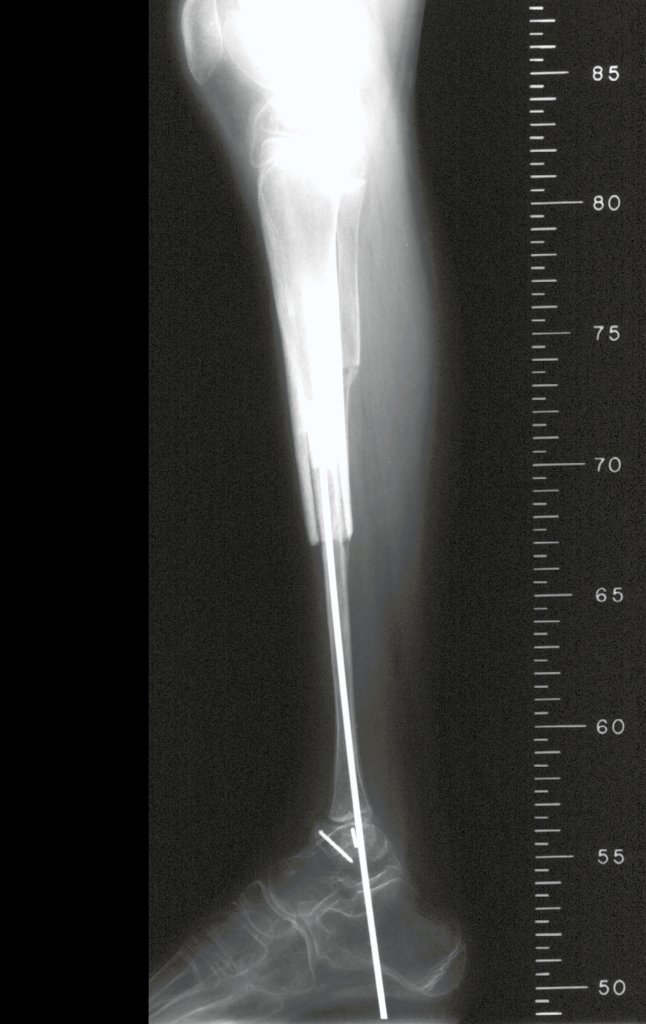
Pruebas de imagen: La imagen radiográfica es de rarefacción ósea, redondeada u ovalada, que comienza en el hueso medular y progresa con erosión del hueso cortical.
En la fase inicial los bordes son irregulares y poco definidos.
En la fase tardía, puede producirse una ligera esclerosis alrededor de la lesión. En los huesos largos hay una reacción perióstica evidente que se manifiesta como múltiples capas laminares gruesas, lo que caracteriza lesiones benignas de evolución lenta o la reacción de la osteomielitis.
Este tipo de reacción perióstica sólida diferencia al Granuloma Eosinofílico del Sarcoma de Ewing, donde la reacción perióstica es laminar delgada, debido a la rápida evolución del tumor maligno.
Otra diferencia radiográfica entre estas dos lesiones es que el tumor de Ewing presenta tempranamente tejido tumoral extracortical, de gran volumen, lo que no ocurre en el Granuloma Eosinofílico.
En huesos planos, como el cráneo o la pelvis, la erosión afecta a ambas cortezas de forma irregular y asimétrica, produciendo la impresión visual de un agujero dentro de otro agujero, lo que se denomina lesión de doble contorno.
En la mandíbula, la destrucción del hueso alveolar produce la impresión radiográfica de dientes flotantes.
En la columna, la enfermedad afecta al cuerpo vertebral, produciéndose un aplanamiento en un 15% de los casos, produciéndose la llamada vértebra plana de Calvè6. Los elementos posteriores y los discos intervertebrales se conservan, incluso cuando la lesión se produce en más de una vértebra.
Anatomía patológica:
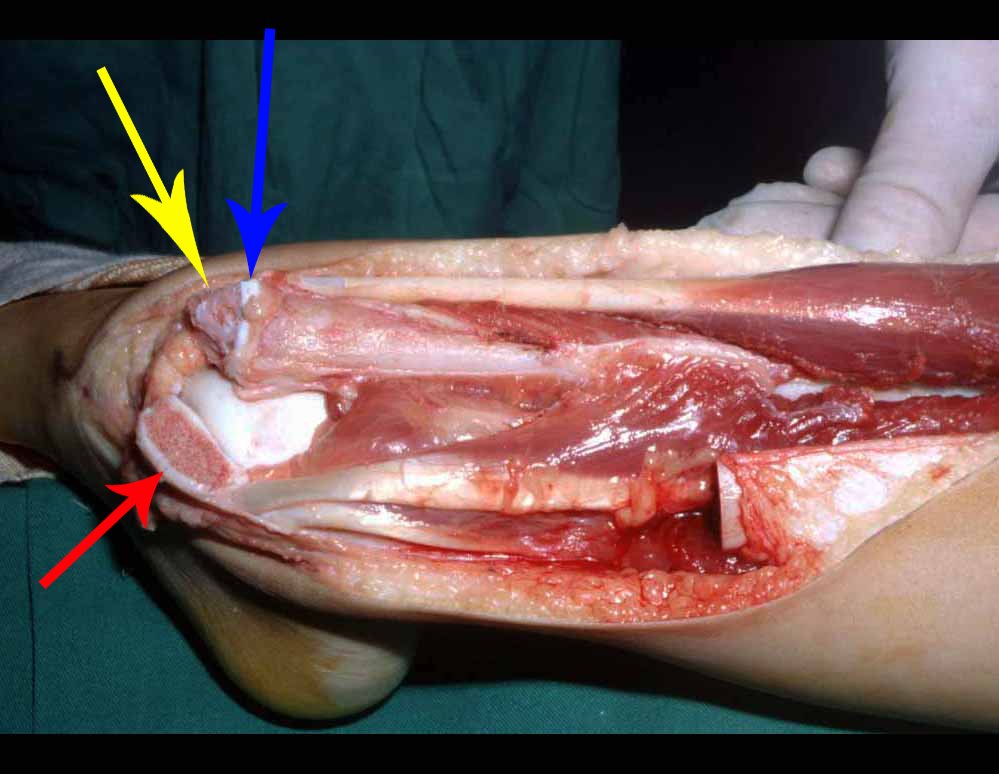
Aspecto macroscópico: tiene consistencia blanda, gelatinosa, de color amarillento, es común la licuefacción necrótica.
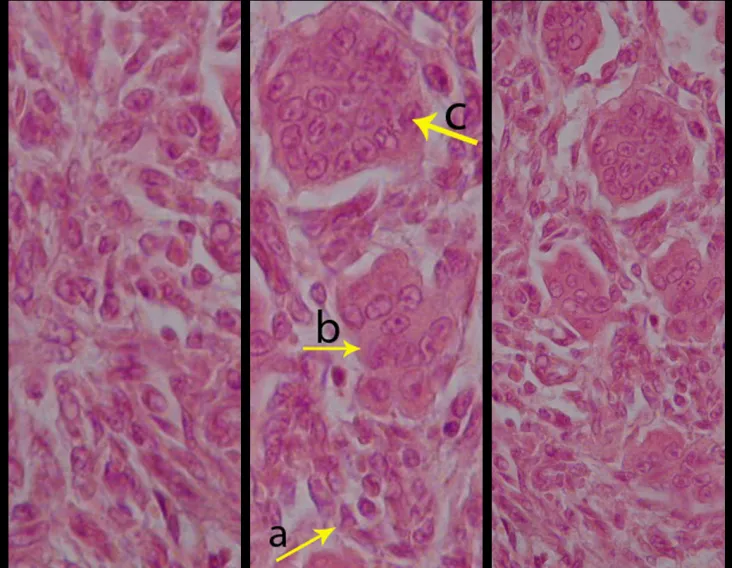
Aspecto microscópico: Aparecen como cúmulos de células histiocíticas de gran tamaño, con citoplasma ligeramente basófilo, nucléolos globosos, lobulados o dentados, en estos casos similares a un grano de frijol, que corresponden a células de Langerhans.
Estos cúmulos se intercalan con células gigantes, linfocitos, numerosos eosinófilos y zonas de necrosis, simulando un absceso. La microscopía electrónica presenta gránulos citoplasmáticos típicos llamados cuerpos de Birbeck11,12.
La inmunohistoquímica muestra positividad para proteína S-100, vimentina y CD1a11,13.
Diagnóstico:
Diagnóstico diferencial: Los principales diagnósticos diferenciales radiológicos del Granuloma Eosinofílico son la Osteomielitis y el Tumor de Ewing.
Cuando la lesión se produce en el cráneo hay que diferenciarla de un quiste epidermoide o de una metástasis. Los principales diagnósticos diferenciales histológicos son la Osteomielitis y el Linfoma.
Puesta en escena:
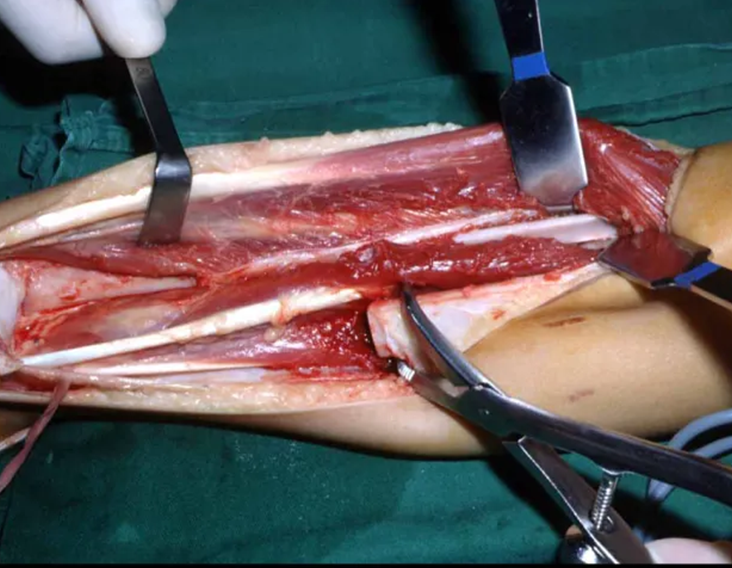
Tratamiento: La literatura presenta informes de que el tratamiento expectante o la biopsia sola pueden estar indicados como una estrategia terapéutica eficaz para lesiones esqueléticas aisladas7,14.
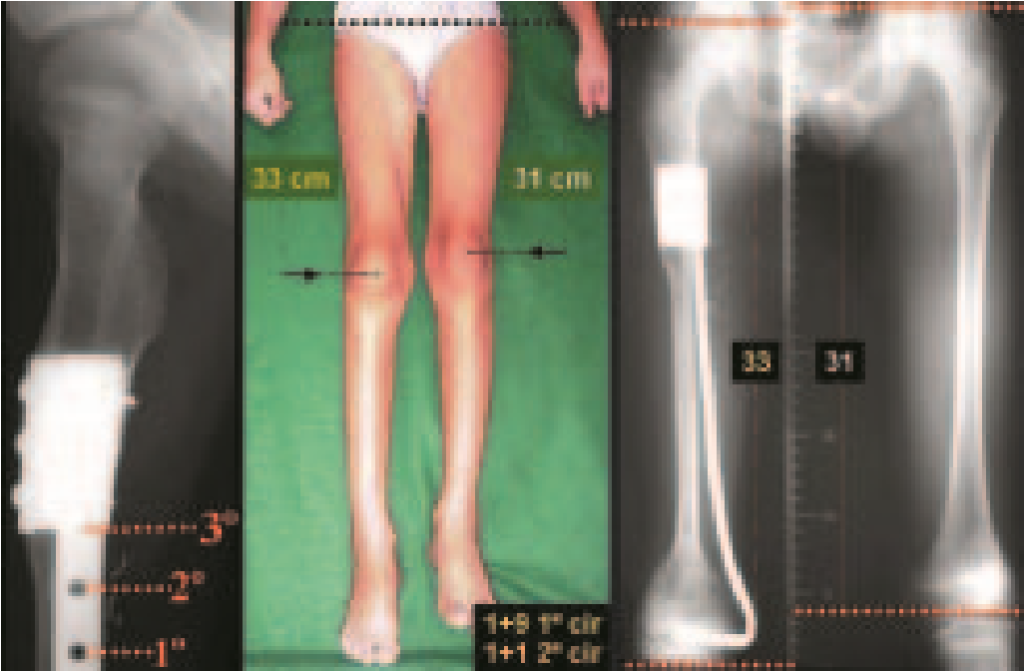
El granuloma eosionofílico puede resolverse espontáneamente, especialmente en niños. La capacidad del hueso afectado para reconstruirse existe, ya que la mayoría de los pacientes se ven afectados antes de la madurez esquelética, por lo que tienen un gran potencial de remodelación por parte de las fisis de crecimiento, que normalmente no se ven afectadas15,16.
En nuestra experiencia hubo resolución en cinco casos, que retrocedieron sólo con la biopsia percutánea. Lo mismo ocurre tras el colapso vertebral en lesiones de columna, probablemente por fuga del contenido de la lesión, asemejándose al drenaje de un absceso, siendo extremadamente rara la indicación quirúrgica en la columna. Se han reportado casos donde hubo restitución completa de la altura del cuerpo vertebral15. En nuestra serie tuvimos dos casos que presentaron esta evolución.
Aunque puede haber una resolución espontánea, el tiempo requerido es impredecible y puede haber una morbilidad significativa secundaria al dolor intenso y la limitación funcional.
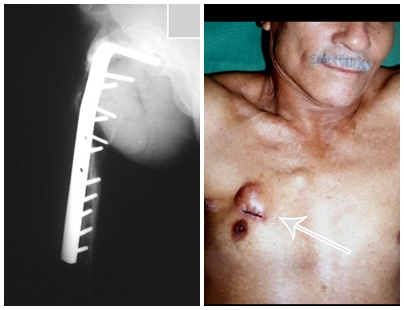
Actualmente, el mejor abordaje terapéutico para el Granuloma Eosionofílico es realizar una biopsia percutánea, si es posible con diagnóstico inmediato por sección congelada, seguida de infusión intralesional de corticosteroides (metilpredinisolona – 40 mg a 120 mg dependiendo del tamaño de la lesión)7. El resultado anatomopatológico debe ser confirmado posteriormente mediante histología en bloques de parafina.
El granuloma eosionofílico puede tardar hasta tres meses en retroceder y puede ser necesario repetir la infusión6. En nuestra experiencia sólo tuvimos un caso, de lesión aislada en el húmero, que requirió complementación del tratamiento inicial en el que realizamos corticoides orales, prednisolona 5 mg/24 h, durante cuatro meses. En el granuloma eosinofílico poliostótico, se utiliza la terapia con corticosteroides sistémicos.
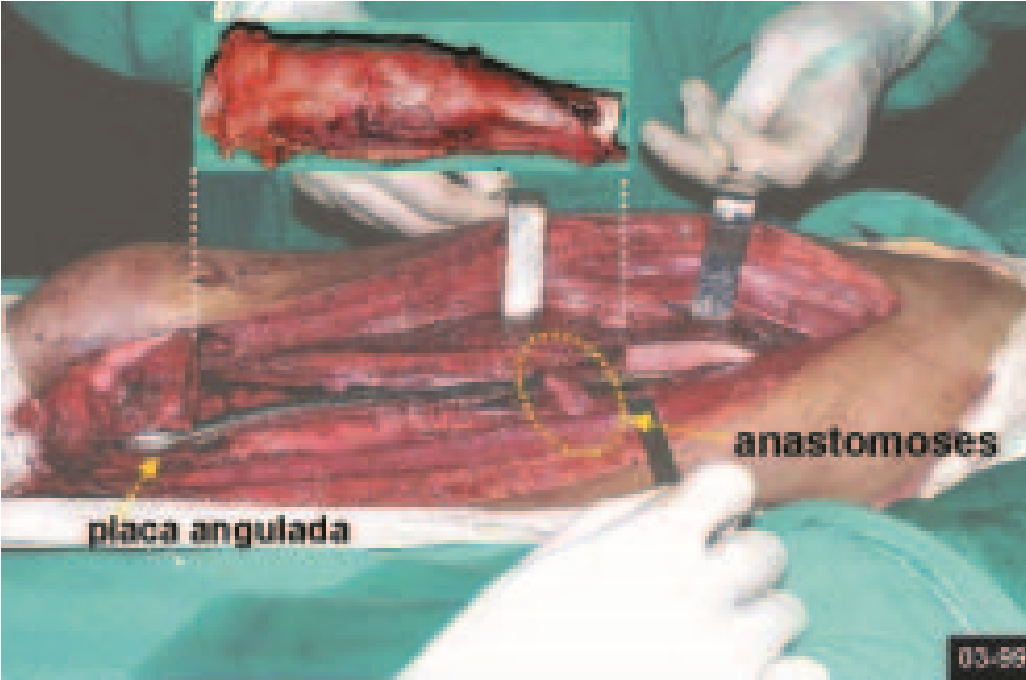
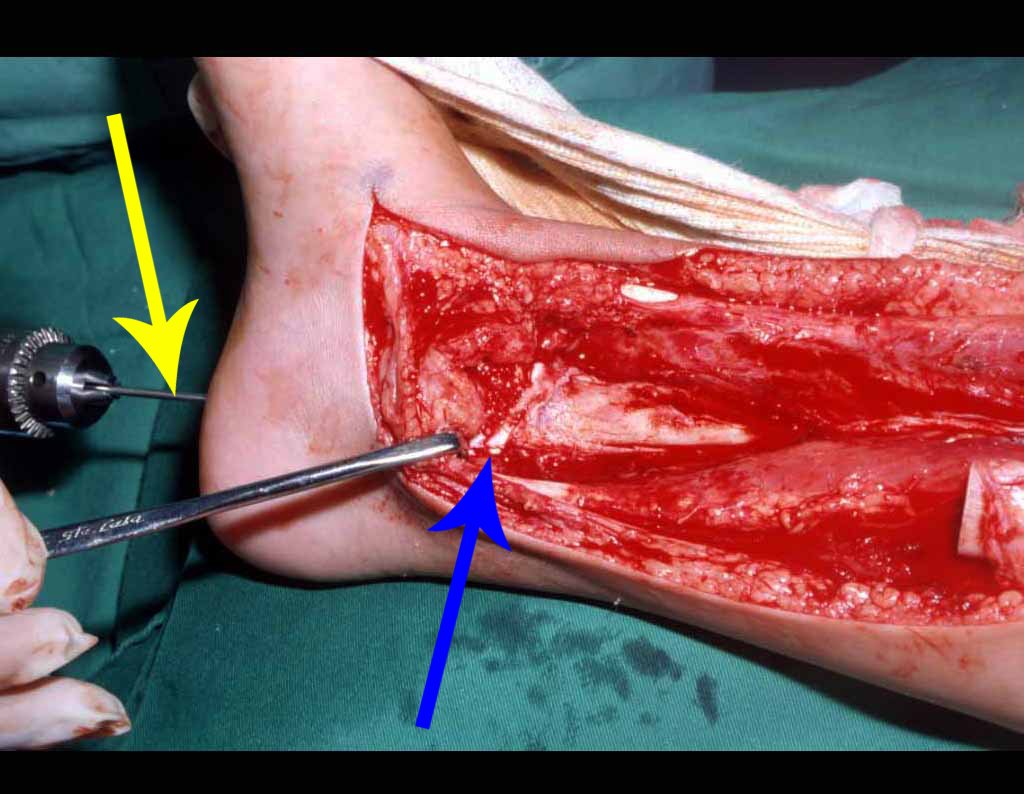
Cuando es necesaria una biopsia incisional, se pueden aplicar corticoides localmente tras el curetaje de la lesión, lo que facilita la resolución del proceso. Este legrado debe ser cuidadoso, realizándose abriéndolo en forma de una hendidura estrecha, longitudinal al hueso, procurando no añadir mayor fragilidad local. Con el tiempo, la cavidad se puede rellenar con un injerto óseo, pero esto generalmente es innecesario debido al gran potencial de regeneración que existe.
La radiofrecuencia fue propuesta como tratamiento percutáneo del Granuloma Eosionofílico, aplicándose en una segunda etapa, de dos a cuatro semanas después de la biopsia17. El autor restringe la técnica a pequeñas lesiones que se encuentren al menos a un centímetro de las estructuras neurales o viscerales, advirtiendo del riesgo de fracturas en los miembros que soportan carga. Este enfoque, además de aumentar los costes y provocar morbilidad local, no añade ninguna ventaja al tratamiento. La propia biopsia puede haber sido curativa, y la infusión de corticoides tiene mayor justificación, ya que está indicada tanto en casos aislados como en lesiones múltiples. Hasta el momento no existen estudios que comparen las técnicas percutáneas con la infusión de corticoides en relación al uso de radiofrecuencia que justifiquen su uso.
Históricamente, la radioterapia se utilizó en dosis bajas y fraccionadas para el tratamiento de la histiocitosis de células de Langerhans. Actualmente, la indicación de radioterapia en lesiones benignas es controvertida.
En casos de granuloma eosinofílico con más de una lesión esquelética, sin afectación visceral, puede estar indicado tratamiento sistémico por un período aproximado de seis semanas con terapia con corticosteroides (2 mg/kg) y vinblastina (6 mg/kg).
Pronóstico: Las lesiones solitarias del granuloma eosinofílico evolucionan bien en el 97% de los casos, con biopsia sola o además de infusión de corticoides o tratamiento quirúrgico 6 .
Ver también: granuloma eosinofílico del radio
Bibliografía:
1 SCHAIRER, E. Ueber eine eigenartige Erkrankung des kindlichen Schädels. Zentralbl Allg Patho Pathol. Anat., 71:113, 1938.
2 Otani S, Ehrlich JC; Granuloma solitario de hueso que simula neoplasia primaria. Soy J Pathol 16:479–90. 1940
3 Verde WT, Faber S; “granuloma eosinofílico o solitario” de hueso. J Bone Joint Surg (Am) 24:499-526. 1942
4 Jaffe HL, Lichtenstein L; Granuloma eosinofílico del hueso. Arco Pathol 37: 99-118. 1944.
5 Lichtenstein L.: Histiocitosis Patol. 56:84, 1953
6 Escuela Secundaria Schwartz. Actualización de conocimientos ortopédicos: tumores musculoesqueléticos 2. Academia Estadounidense de Cirujanos Ortopédicos, Rosemont, Illinois. Capítulo 12 (128-32), 2007
7 Mavrogenis AF, Abati CN, Bosco G, Ruggieri P. Metilprednisolona intralesional para el granuloma eosinofílico solitario doloroso del esqueleto apendicular en niños. J PediatrOrthop 2012;32:416–422
8 Chadha M, Agarwal A, Agarwal N, et al. Granuloma eosinofílico solitario del radio. Un diagnóstico diferencial inusual. Acta Orthop Belg. 2007; 73:413–417.
9 Campanacci, M. Tumores óseos y de tejidos blandos; Springer-Verlag Viena Nueva York. Segunda edición, (54); 857-75. 1999.
10 SCHAJOWICZ, F. Buenos Aires: Tumores Óseos; Talleres de editorial Médica Panamericana SA (9); 464-80. 1981.
11 CHRISTIAN, HA Defectos en huesos membranosos, exosftalmos y diabetes insípida: en un síndrome habitual de dispituitarismo: un estudio clínico. Med.Clin. Norte. Am., 3:849, 1920.
12ARCECI, RJ; BRENNER, MK; PRITCHARD, J. Controversias y nuevos enfoques para el tratamiento de la histiocitosis de células de Langerhans. Hemtol. Oncol. Clínica. Norte. Am., 12:339, 1998
13 ALBRIGHT, F.; REIFNSTEIN, EC Las glándulas paratiroides y la enfermedad metabólica. Baltmore, Williams y Wilkins, 1948.
14 Plasschaert F, Craig C, Bell R, et al. Granuloma eosinofílico. Un comportamiento diferente en los niños que en los adultos. J Bone Joint Surg Br 2002;84:870–872.
15 Greenlee JD, Fenoy AJ, Donovan KA, et al. Granuloma eosinofílico en la columna pediátrica. Neurocirujano Pediatra. 2007; 43:285–292.
16 Sessa S, Sommelet D, Lascombes P, et al. Tratamiento de la histiocitosis de células de Langerhans en niños. Experiencia en el Hospital Infantil de Nancy. J Cirugía de la articulación ósea Am. 1994; 76:1513–1525.
17 Corby RR, Stacy GS, Peabody TD, et al. Ablación por radiofrecuencia del granuloma eosinofílico solitario de hueso. Am J Roentgenol.2008;190:1492–1494.