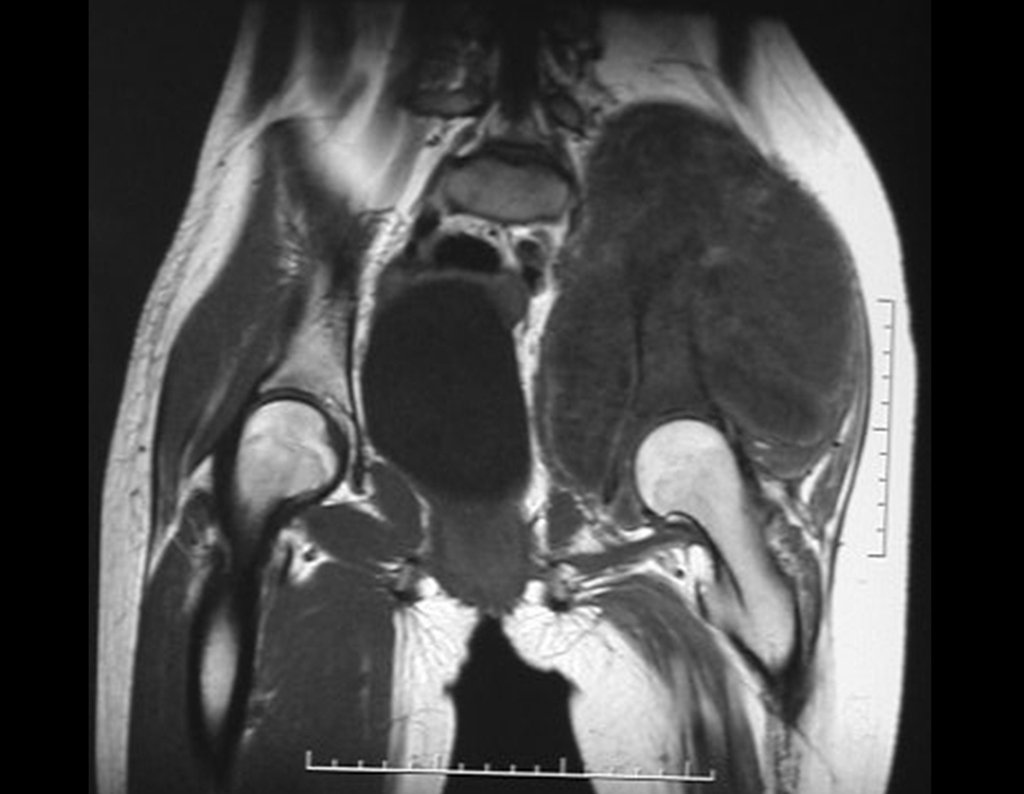
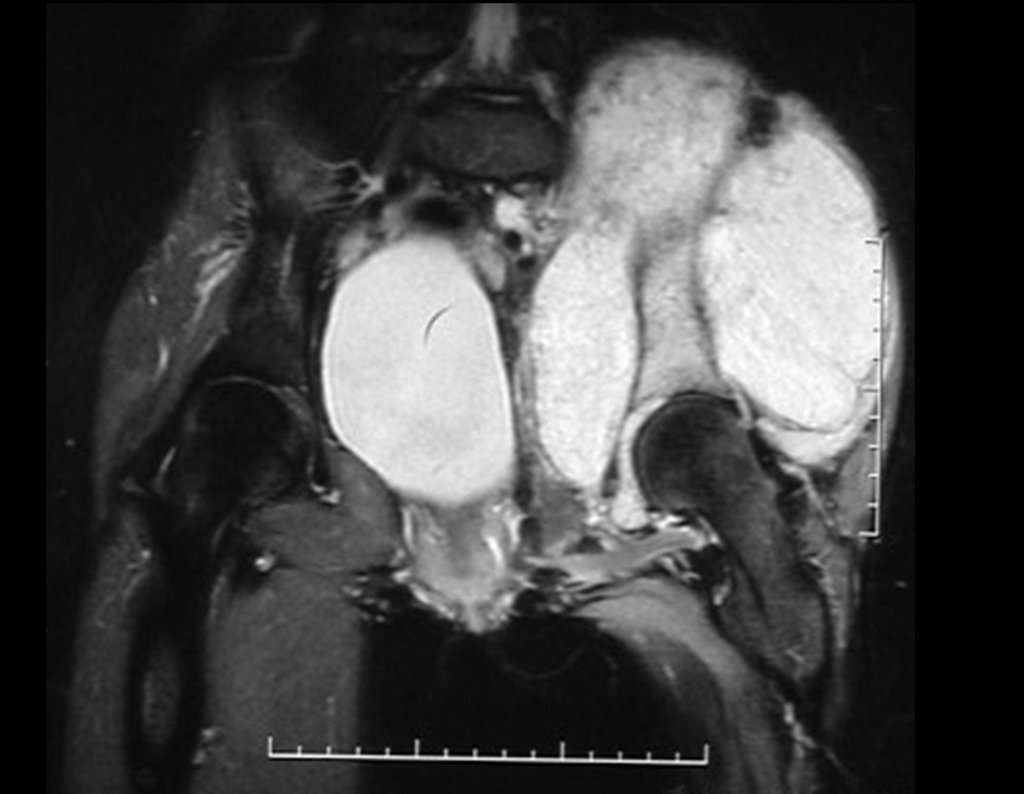
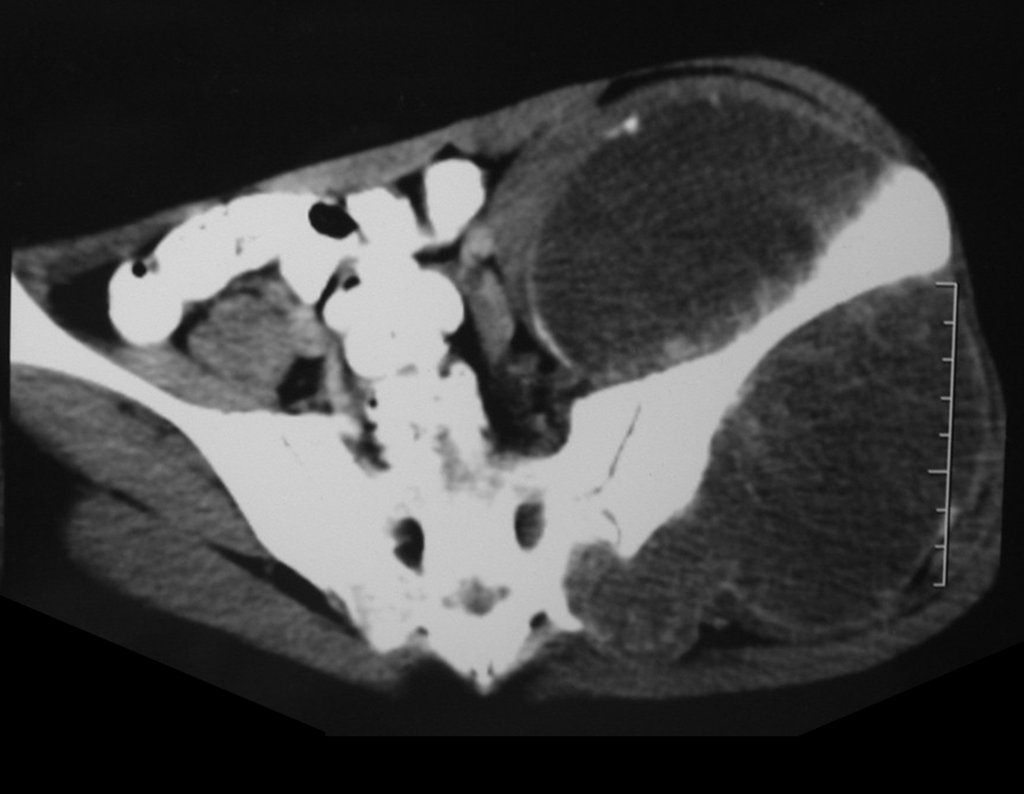
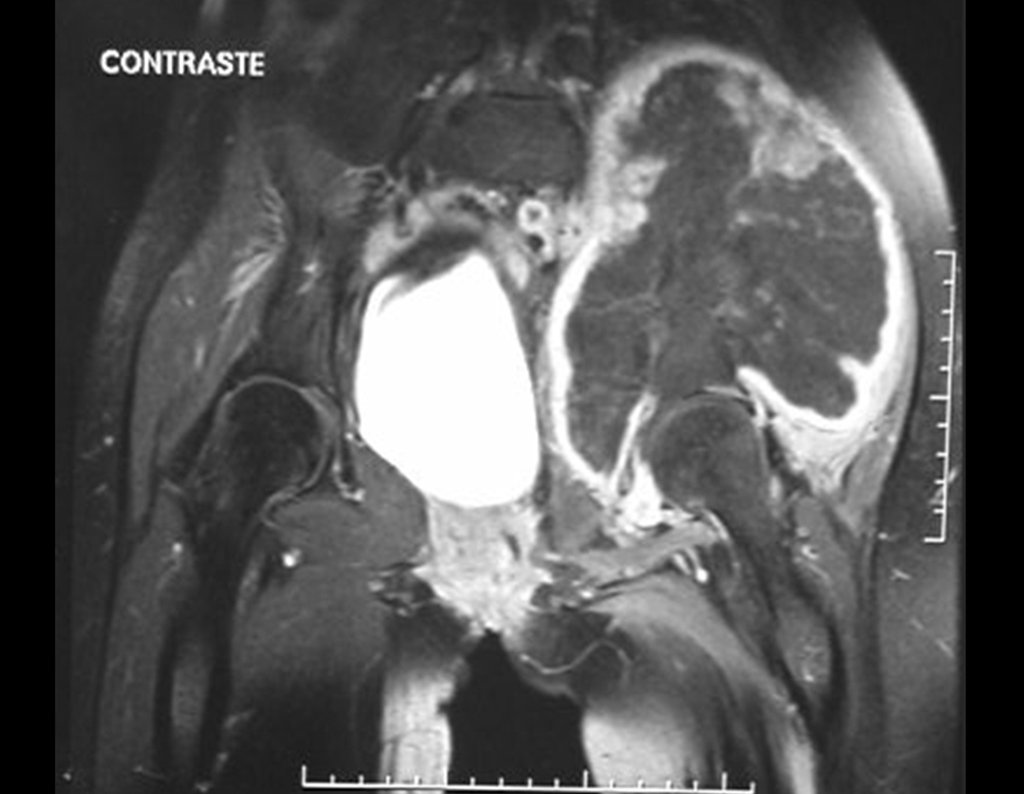
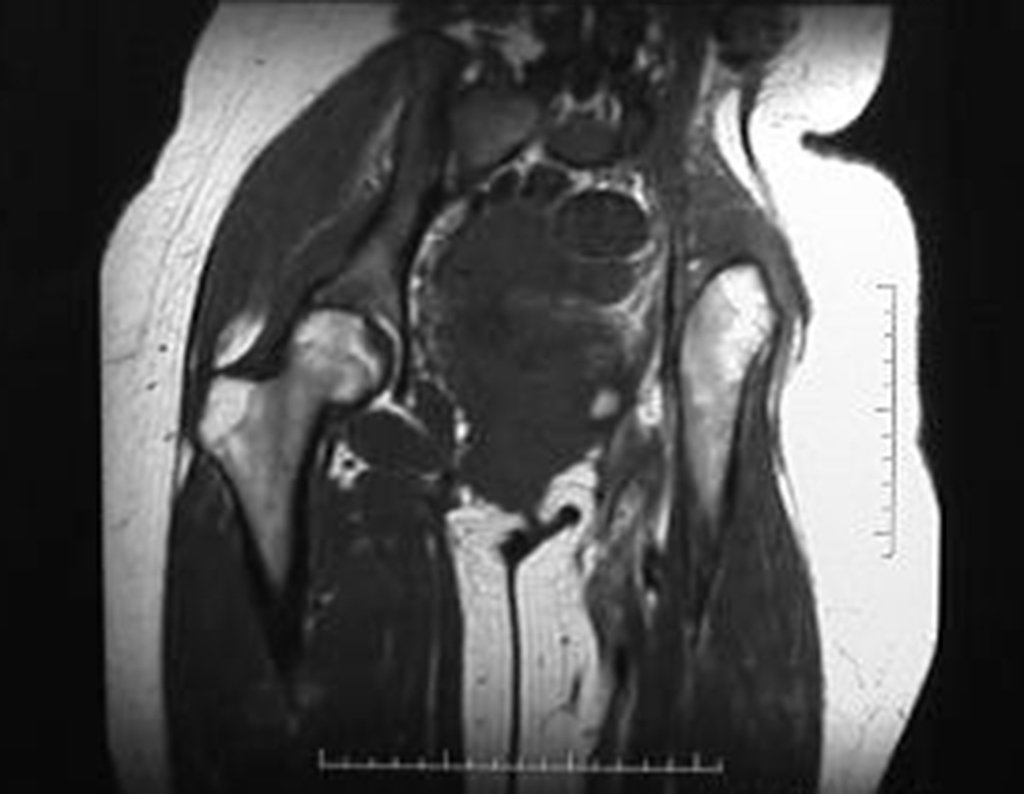
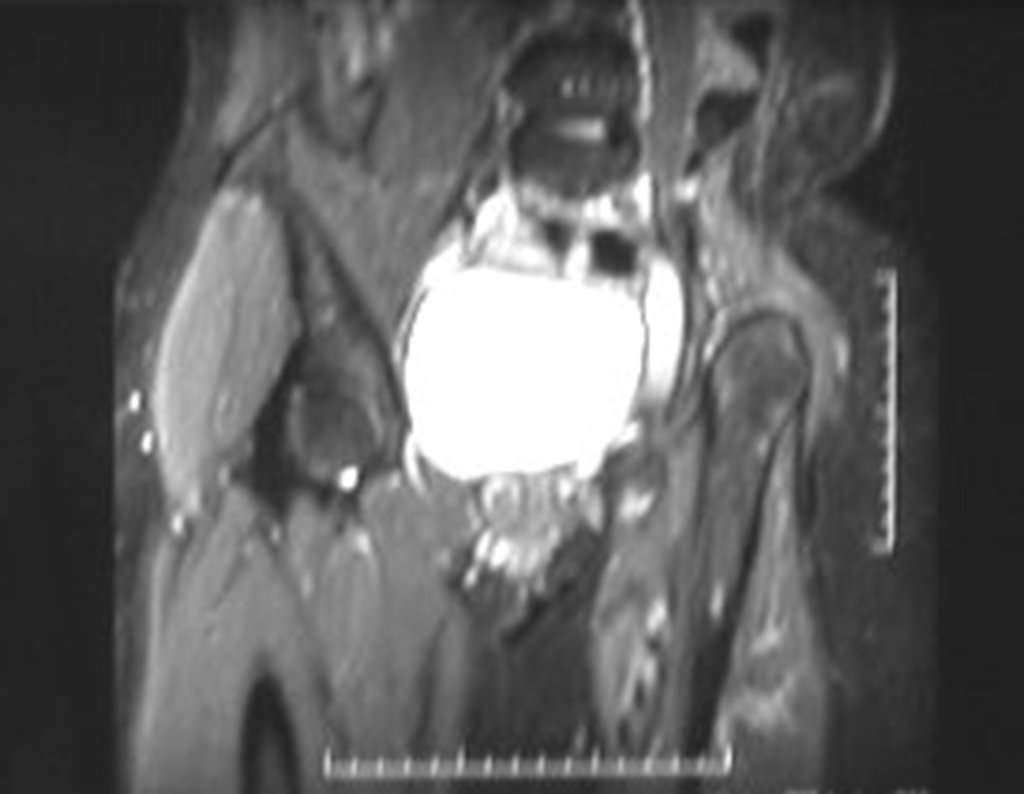
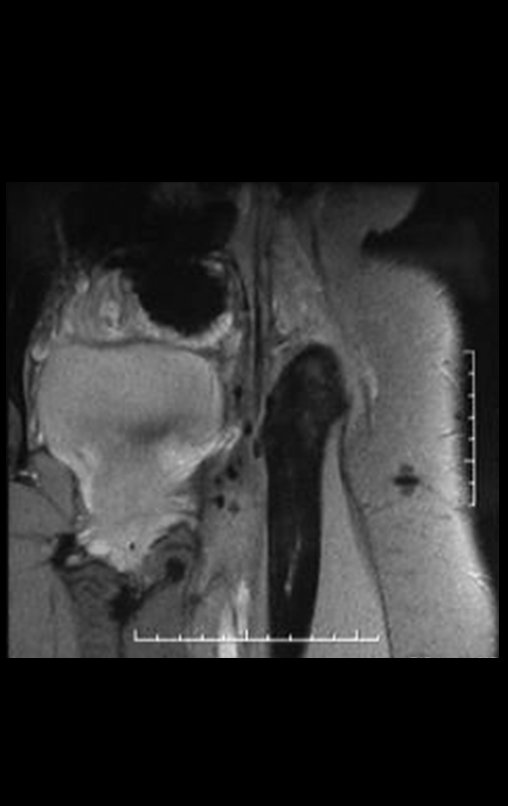
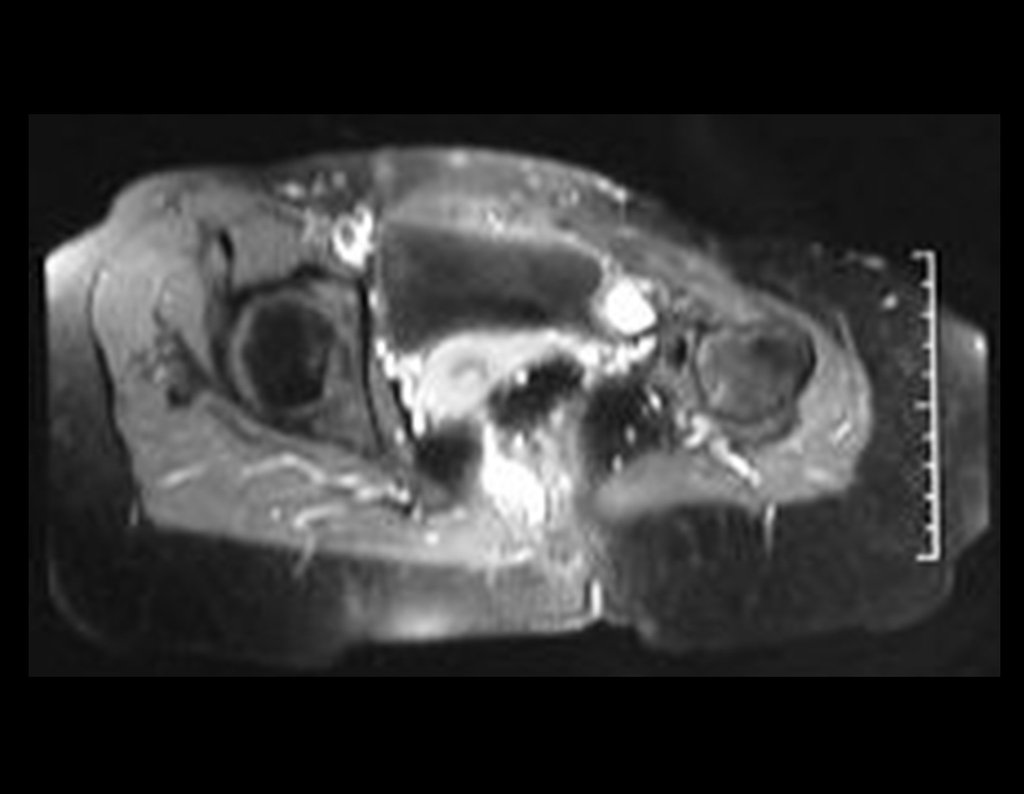
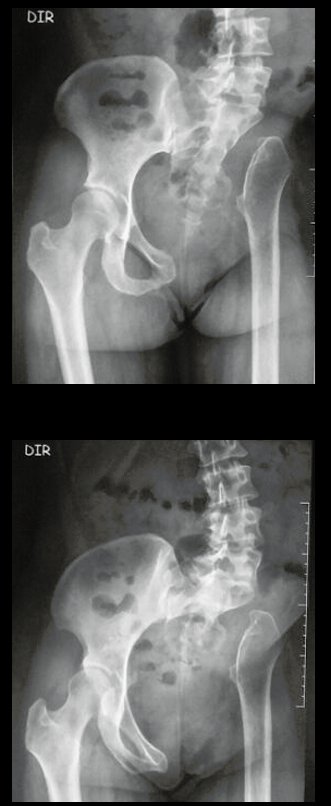
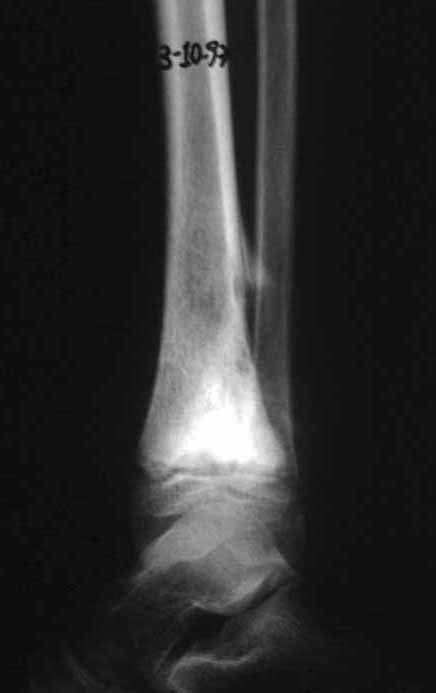
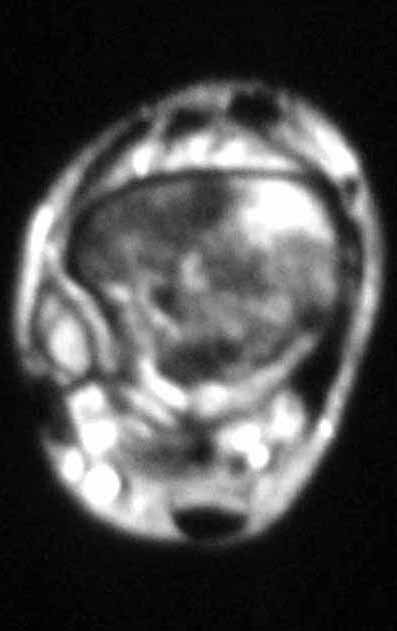
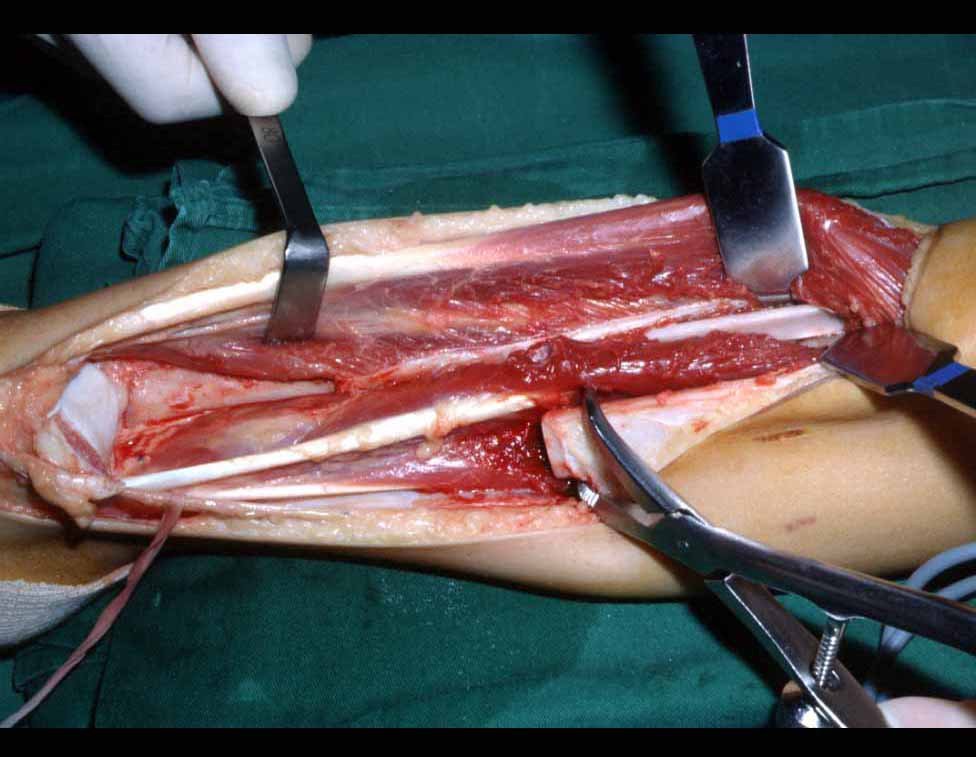
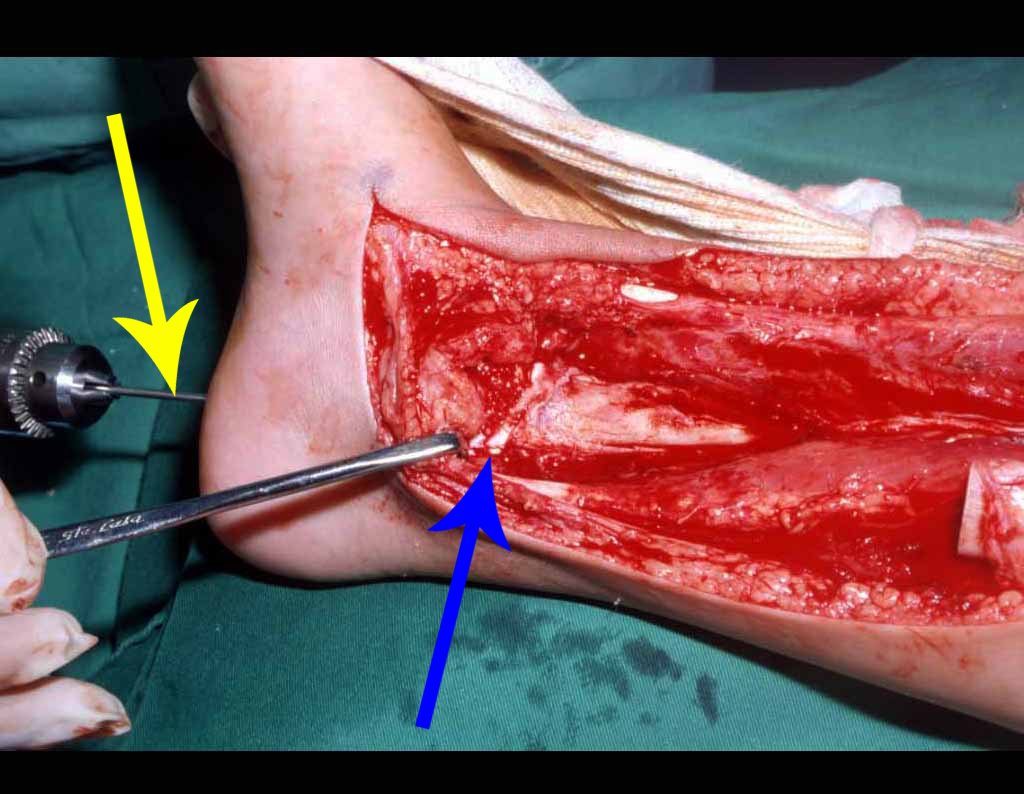
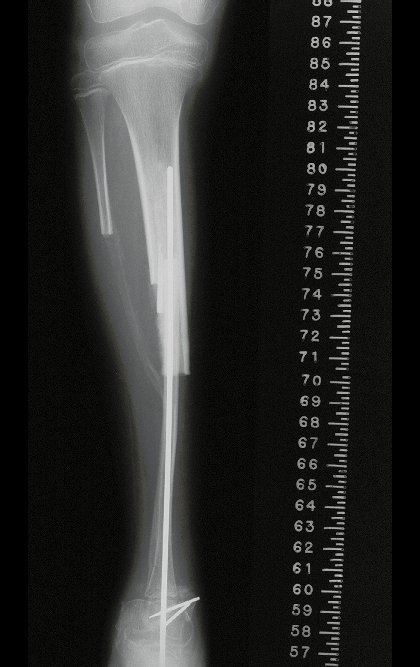
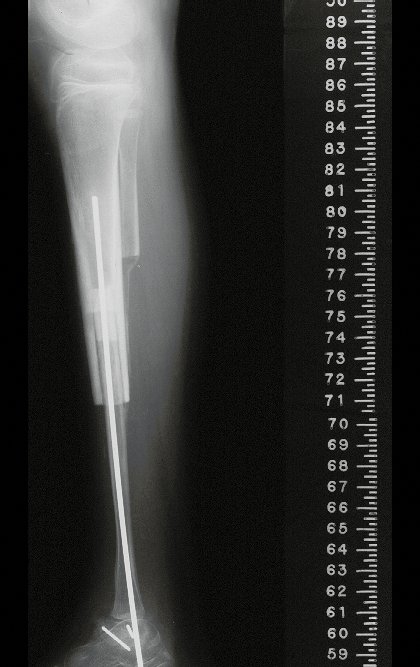
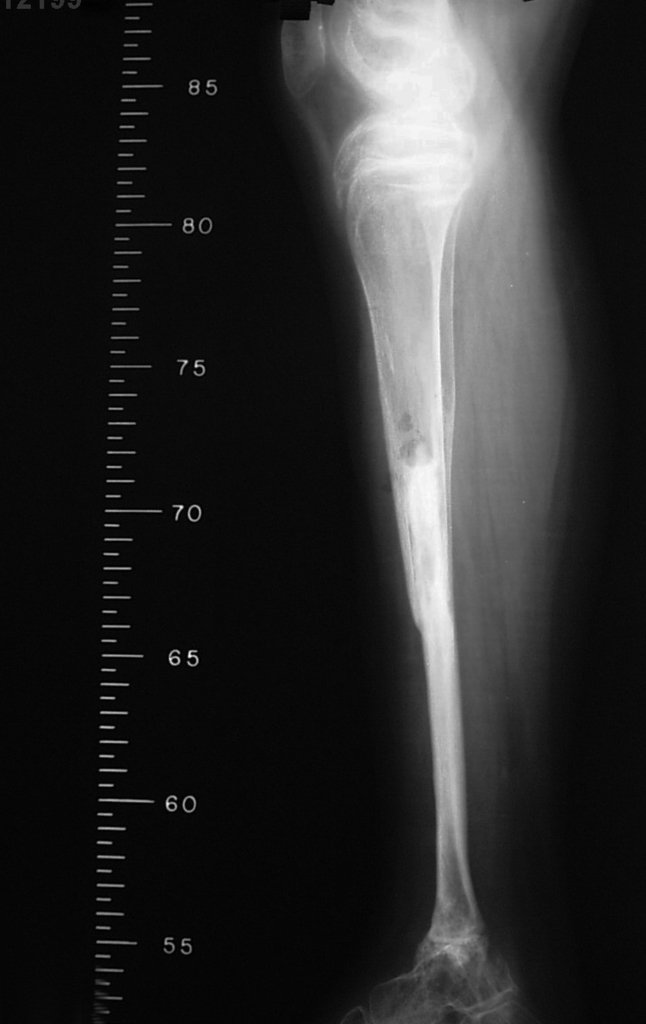
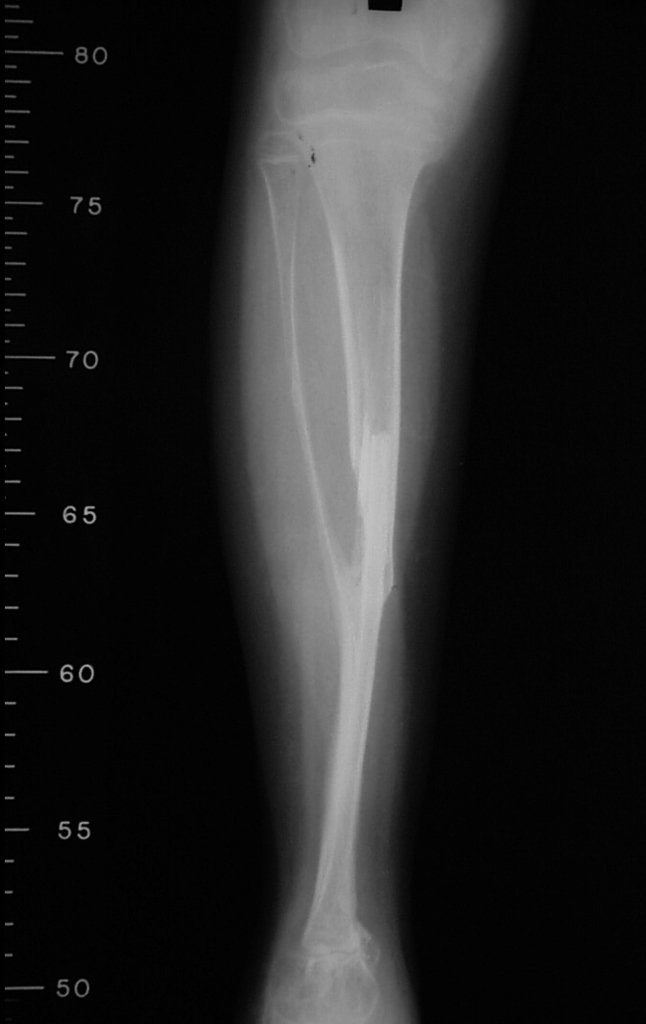
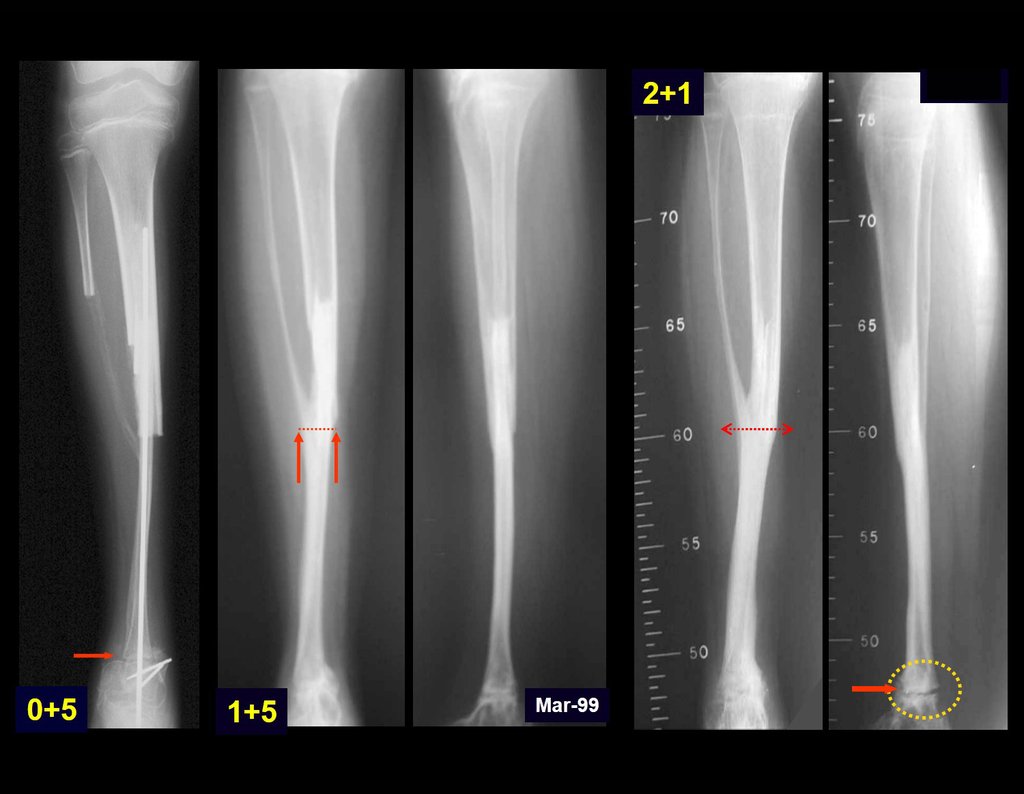
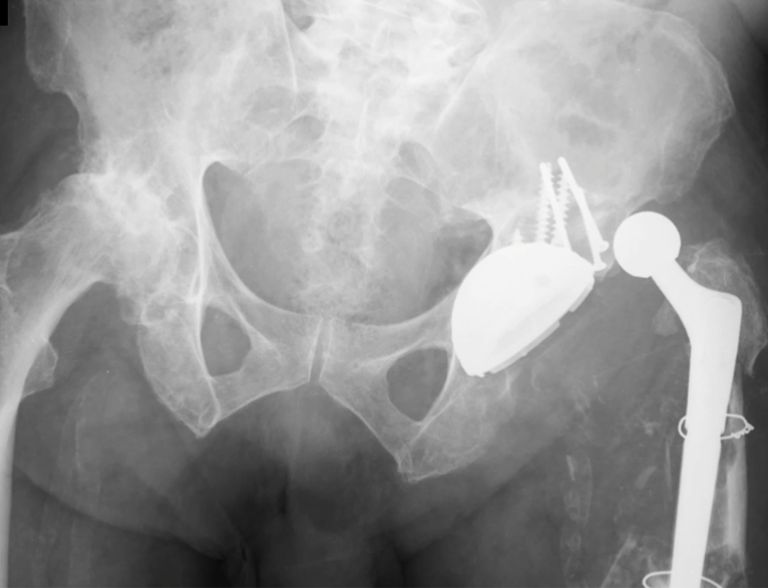
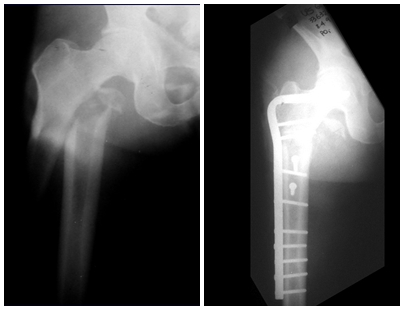
Cuando medimos la distancia entre la posición del pin de Schanz y la de la osteosíntesis, obtuvimos un promedio de 2,2 cm, con una variación de hasta 6 cm. En siete casos (43,8%) de los 16 infectados, la distancia medida fue de 0 cm, dos entre 1 y 2 cm, dos entre 3 y 4 cm, uno entre 4 y 5 cm, tres con 5 cm y uno con 6 cm (tabla 2). En cuanto a la evaluación de la calidad de la fijación y reducción, pudimos observar que de los 16 casos, en cuatro (25%) los seis evaluadores estuvieron de acuerdo, en dos la fijación fue considerada adecuada y en los otros dos inadecuada; en cinco casos (31,3%) cinco evaluadores estuvieron de acuerdo en cuanto a la calidad de la evaluación, en dos fue considerada adecuada y en tres inadecuada; en cuatro casos (25%) cuatro evaluadores estuvieron de acuerdo con la evaluación, todas fueron consideradas inadecuadas; en tres casos (18,7%) no hubo concordancia entre los evaluadores, tres consideraron la fijación y reducción adecuadas y otros tres inadecuadas (tabla 3).
En los 13 casos (81,2%) en los que hubo alguna concordancia (adecuada o inadecuada), esta fue considerada adecuada en cuatro (30,8%) y inadecuada en nueve (69,2%).
Al analizar las evaluaciones, obtuvimos 96 evaluaciones, en 38 ocasiones (39,6%) se consideraron adecuadas y en 58 (60,4%) inadecuadas. Al analizar las evaluaciones de cada evaluador, obtuvimos para el evaluador uno: cinco casos (31,3%) evaluados como adecuados y 11 (68,7%) inadecuados; evaluador dos: 10 casos
Cuando evaluamos aisladamente a los ortopedistas con más de cinco años de experiencia, obtuvimos 32 evaluaciones, 15 (46,9%) se consideraron adecuadas y 17 (53,1%) inadecuadas (tabla 4). En este grupo hubo concordancia en la calidad de la fijación y reducción en nueve casos (56,3%) y falta de concordancia en los siete restantes (43,7%), de los nueve casos con concordancia en cuatro (44,4%) la calidad de la reducción y fijación se consideró adecuada y en cinco (55,6%) inadecuada.
Al observar las evaluaciones consideradas adecuadas, podemos notar una tendencia a la similitud de evaluaciones entre los asistentes y los residentes de tercer año, pero una menor evaluación de casos considerados adecuados para los residentes de segundo año (tabla 5).
Al comparar los casos en los que hubo acuerdo entre los asistentes y la evaluación de los residentes de tercer año, observamos que hubo concordancia en cinco (31,3%) de los 16 casos, en tres la reducción y fijación se consideraron adecuadas y en dos inadecuadas. De los 11 casos restantes, en cuatro, a pesar del acuerdo de evaluación de los asistentes, no hubo concordancia con los residentes de tercer año, en un caso la reducción y fijación fue considerada adecuada por los asistentes y en tres inadecuada.
Al comparar los casos en los que hubo acuerdo entre los asistentes y la evaluación de los residentes de segundo año, observamos que hubo concordancia en siete (77,8%) de los nueve casos, en dos de estos la reducción y fijación se consideraron adecuadas y en cinco inadecuadas. En un caso en el que hubo acuerdo de los asistentes (considerado adecuado) los residentes de segundo año lo consideraron inadecuado.
Al evaluar los siete casos en los que no hubo acuerdo entre los asistentes con más de cinco años de experiencia, observamos que en un caso los residentes, ya sean de tercer o segundo año, tampoco estuvieron de acuerdo. En cuatro casos, los dos evaluadores residentes de tercer año tampoco estuvieron de acuerdo y en tres casos los dos evaluadores residentes de tercer año estuvieron de acuerdo y consideraron la reducción y fijación inadecuada. De los siete casos en los que los asistentes no estuvieron de acuerdo, los evaluadores residentes de segundo año consideraron la reducción y fijación adecuadas en un caso e inadecuadas en cuatro.
Discusión
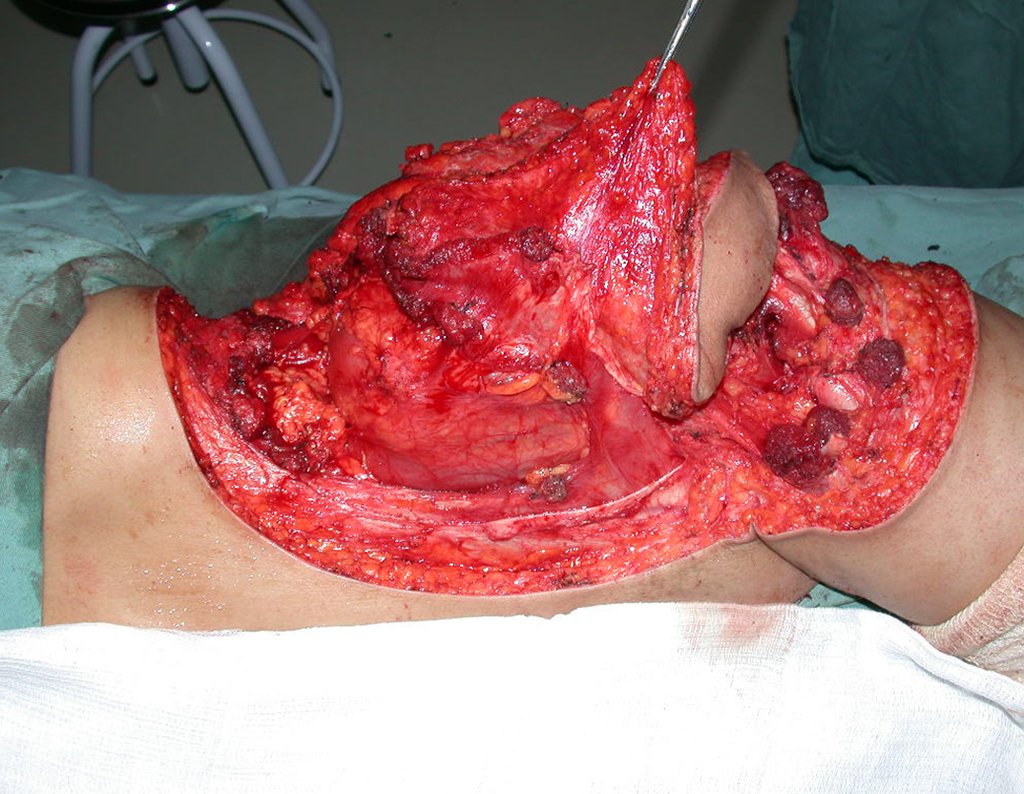
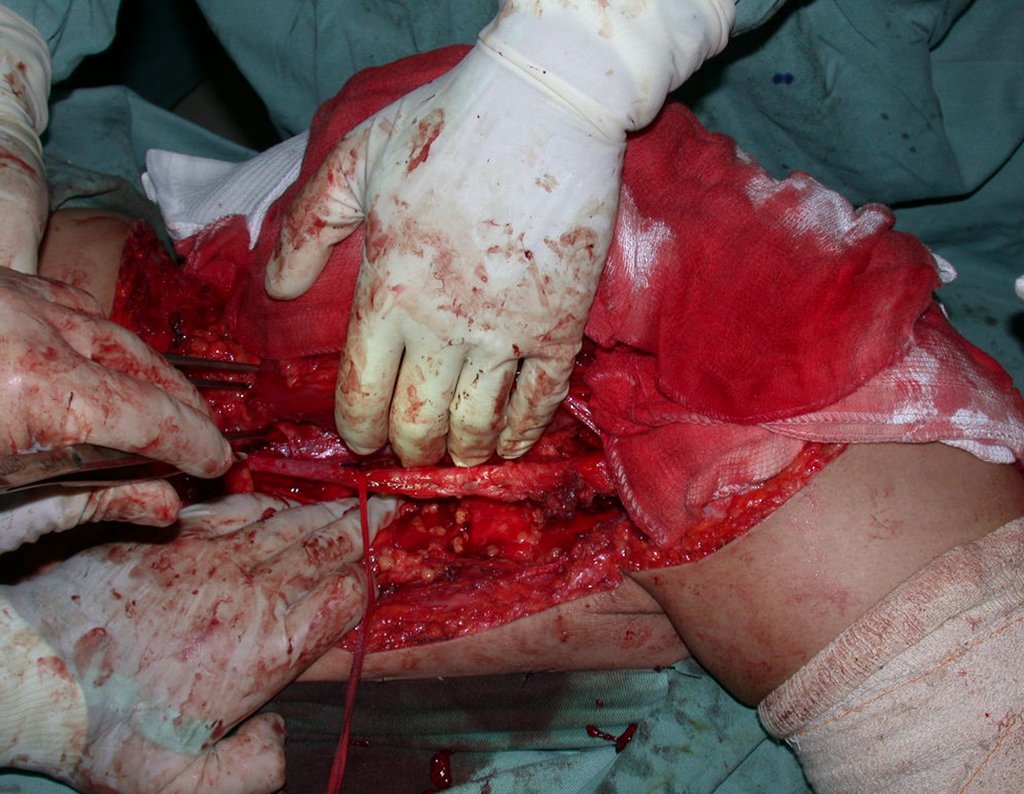
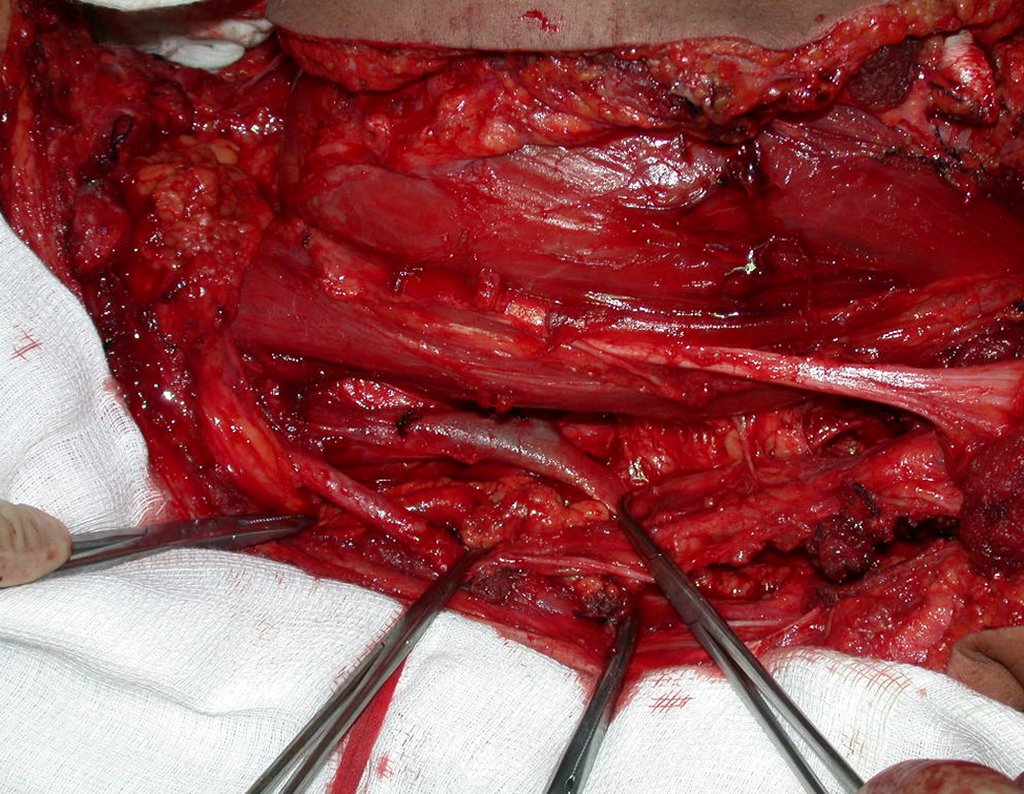
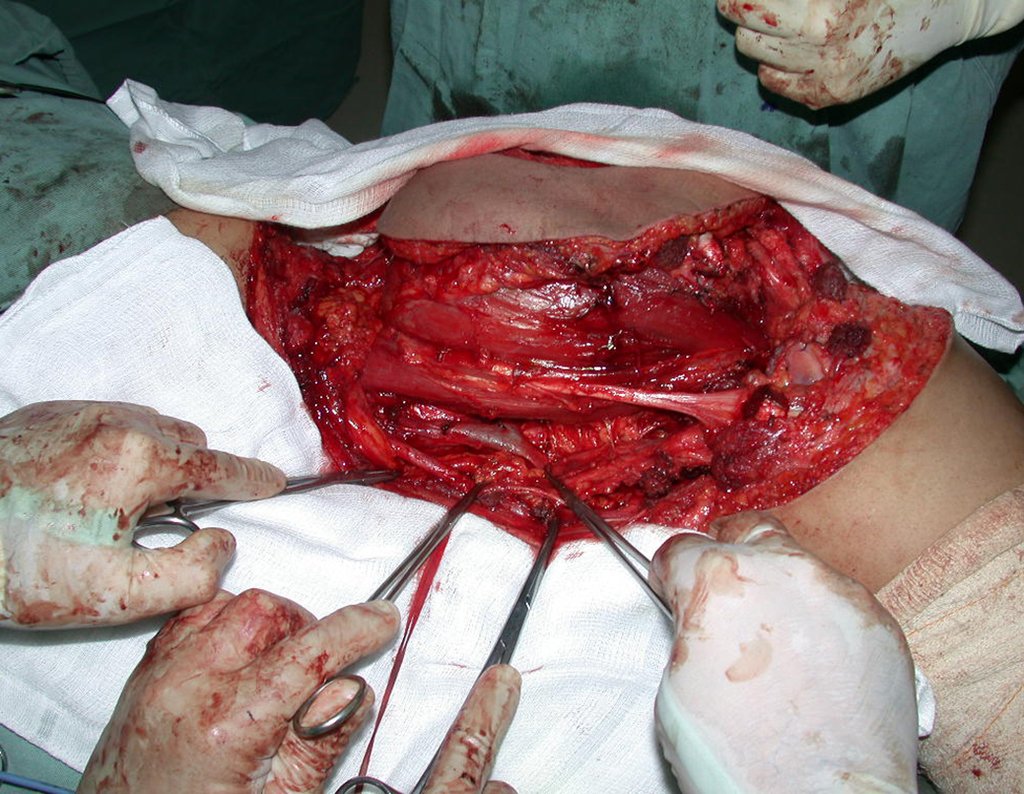
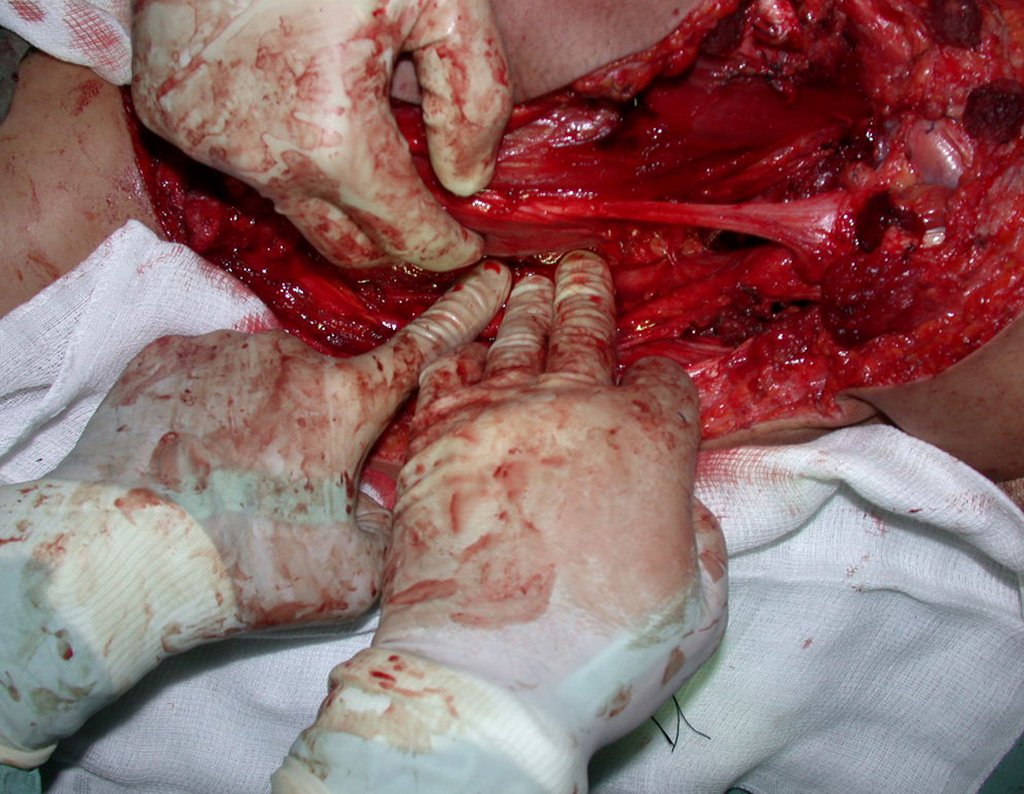
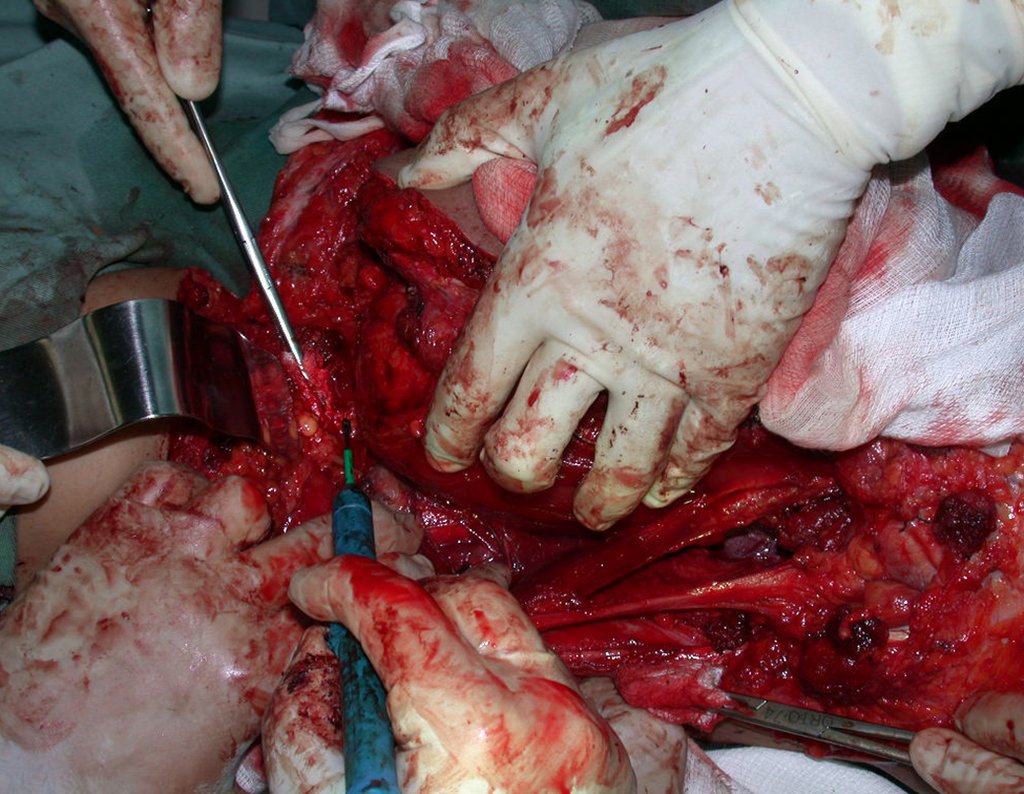
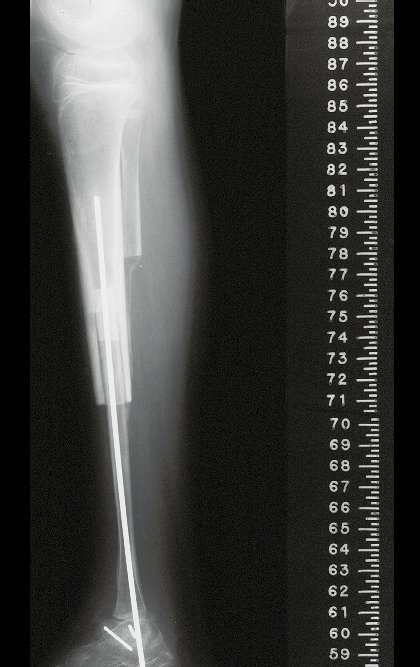
Los fijadores externos, dispositivos de fijación más versátiles que permiten diversos tipos de montajes y configuraciones, pueden colocarse de manera rápida, se aplican en el tratamiento de las fracturas en situaciones de urgencia y emergencia (control de daños) y de forma percutánea, con un menor daño a los tejidos blandos.
Este procedimiento, tanto provisional como definitivo, sigue siendo rutina en muchos servicios y varía del 32% al 89% de la elección de un grupo de ortopedistas en un estudio previo. Sin embargo, este procedimiento no está exento de riesgos.
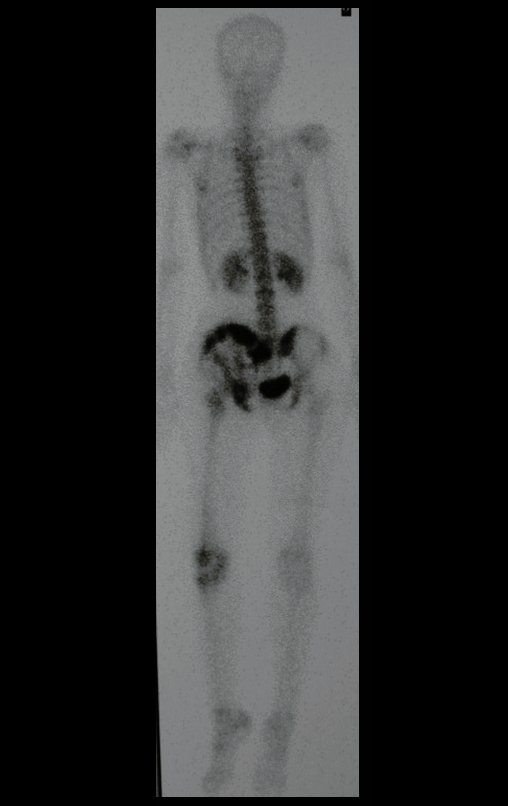
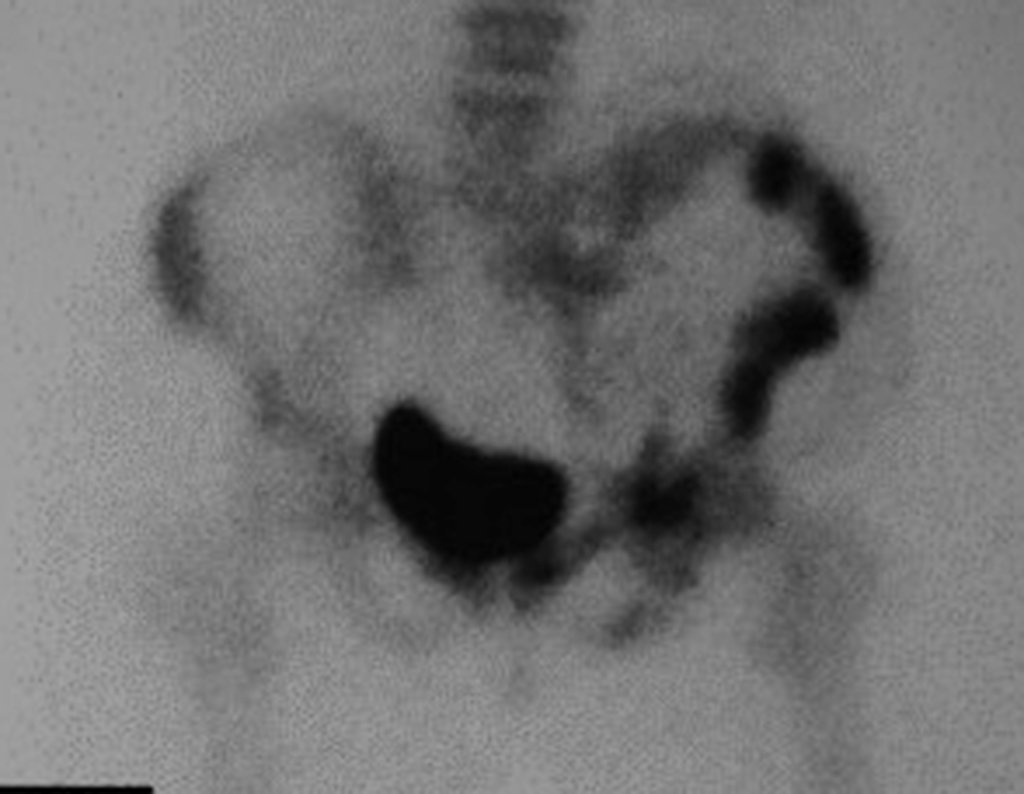
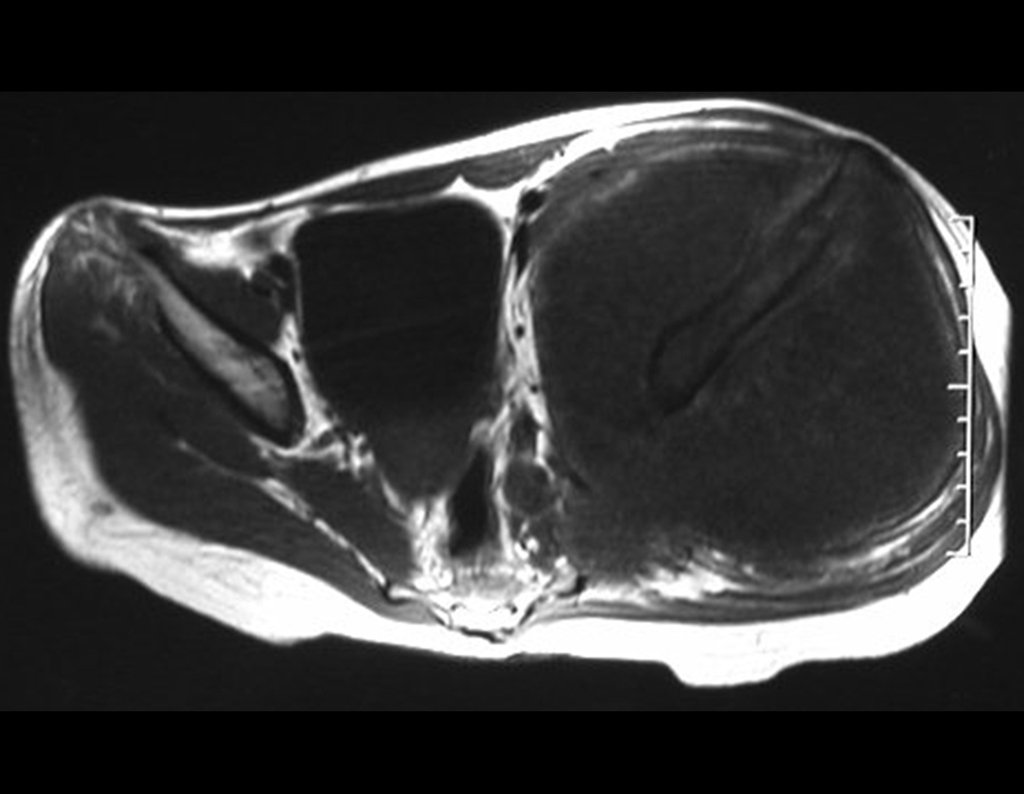
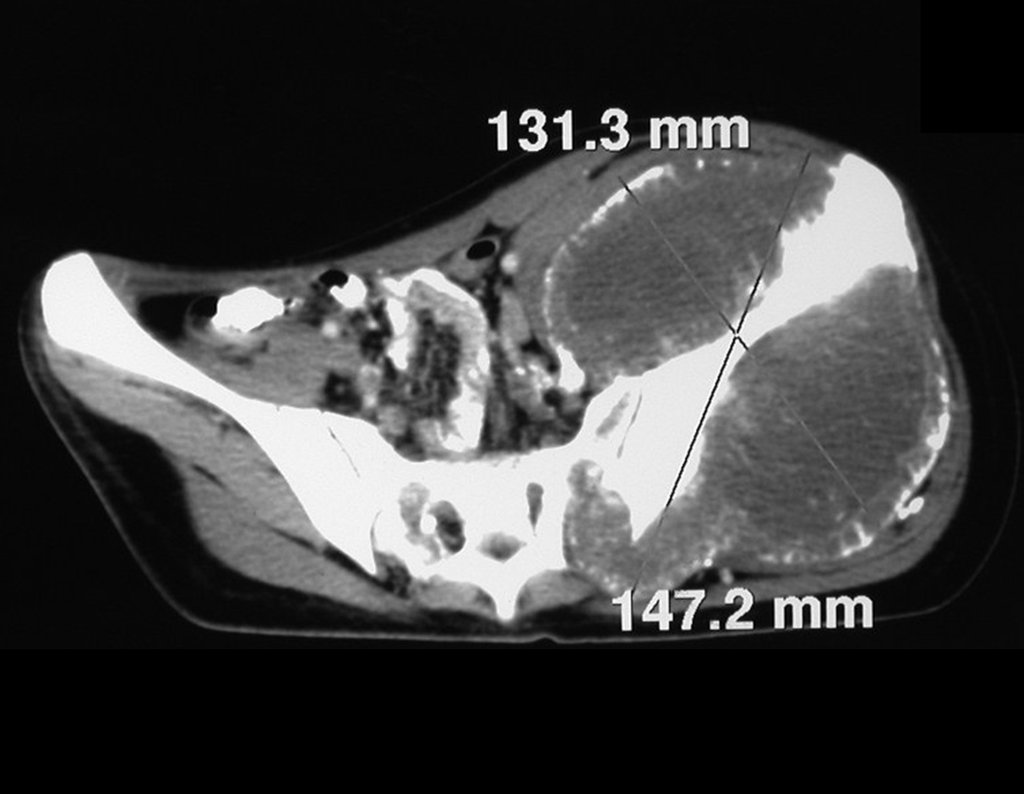
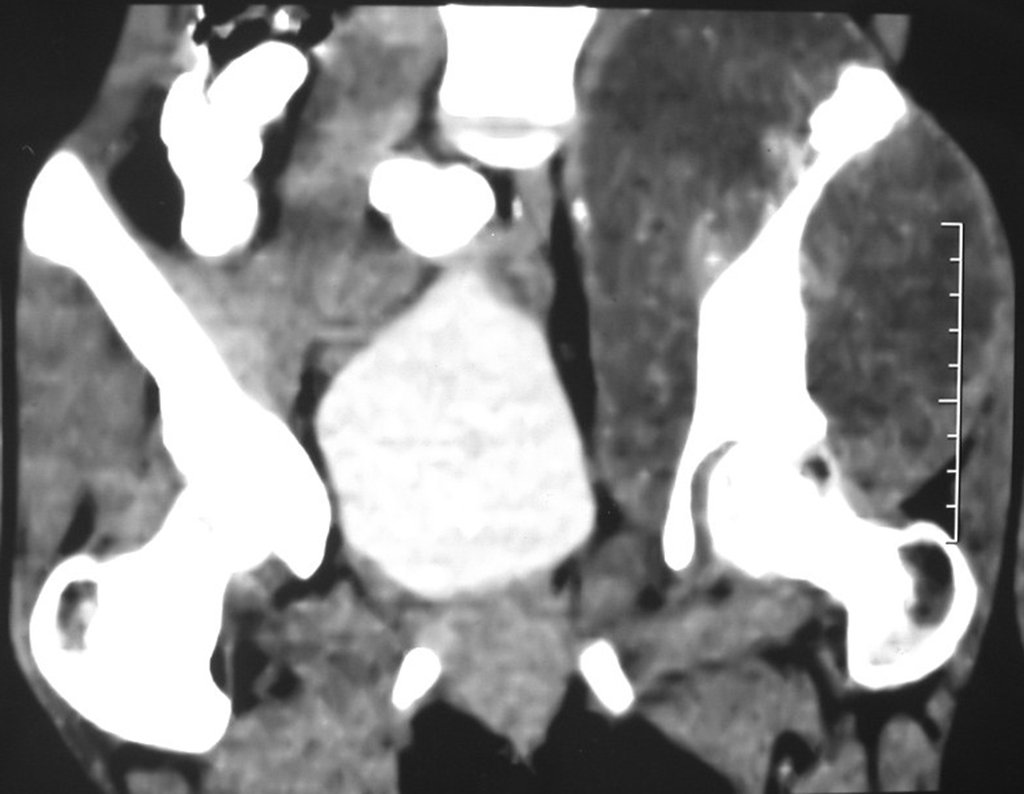
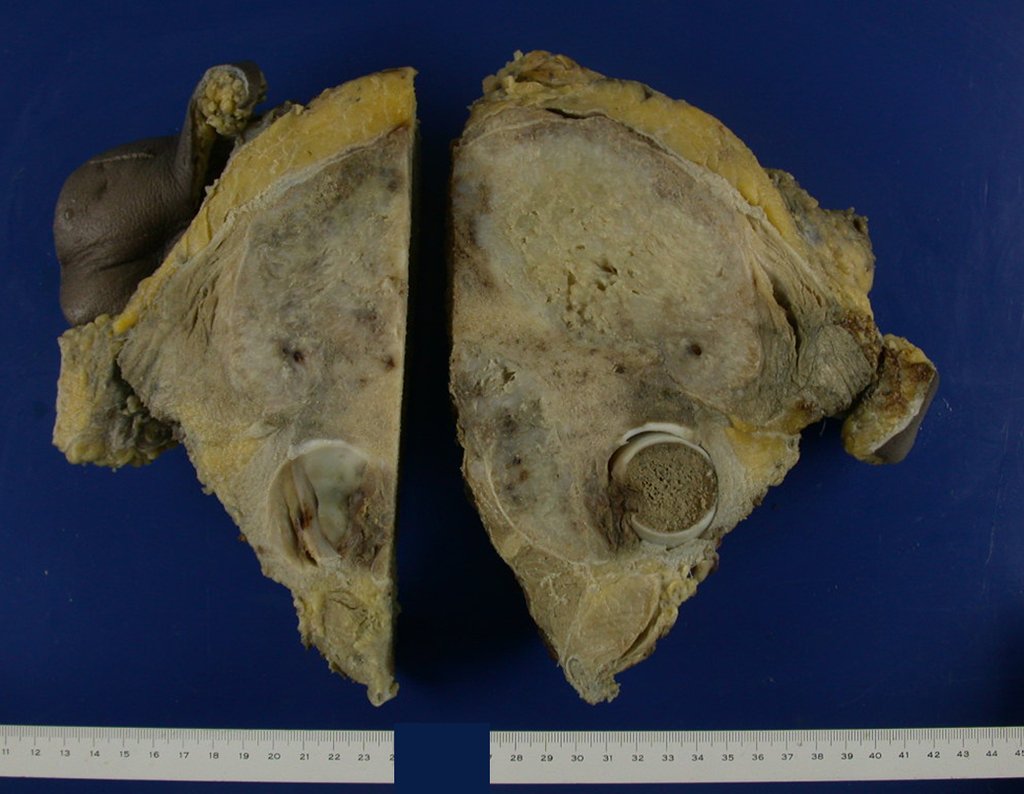
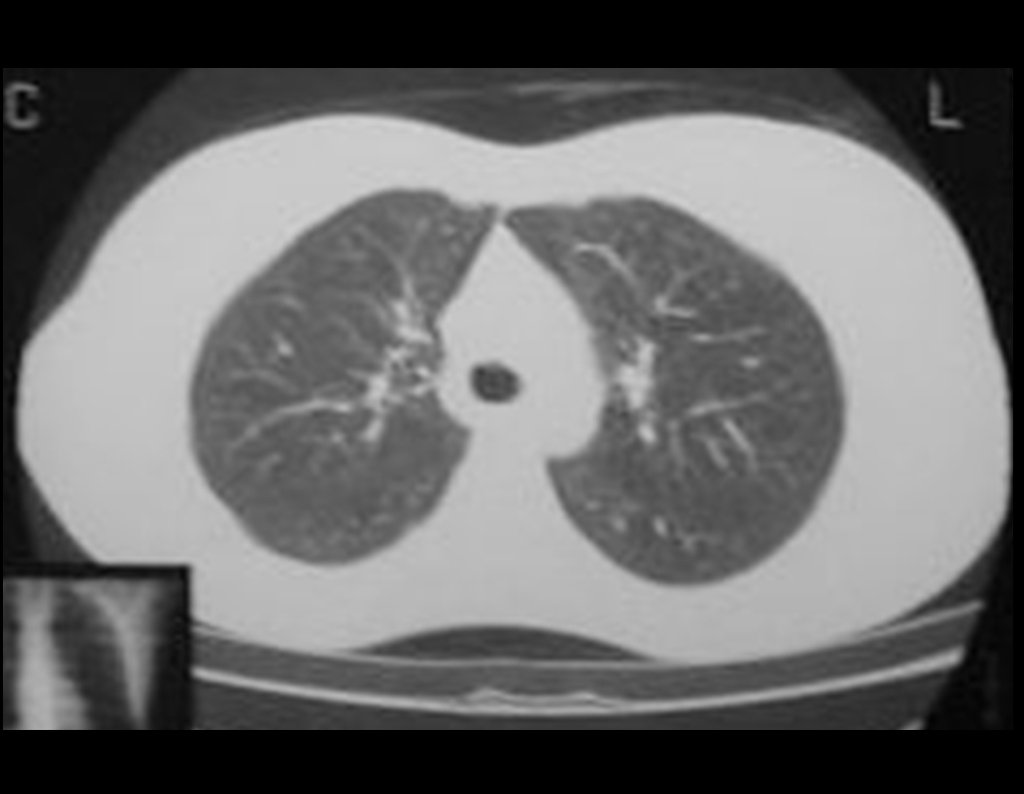
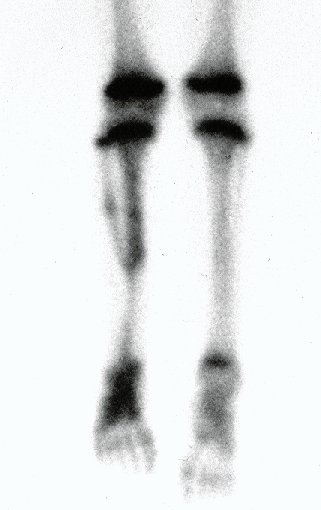
En nuestra muestra, encontramos una frecuencia del 13,3% de infección después del uso de fijador externo para control de daños. Aunque compatible con los datos de la literatura, que varían del 0,5% al 30%, nos preocupamos por considerar este índice muy alto entre las posibles complicaciones.
La primera cuestión siempre recordada en la búsqueda de la etiología de la infección es el entorno en el que se realiza el tratamiento, en nuestro caso un hospital escuela. Parece una correlación causa y efecto débil, porque el procedimiento se considera de pequeña complejidad y había al menos un médico con tres años de entrenamiento en el equipo quirúrgico.
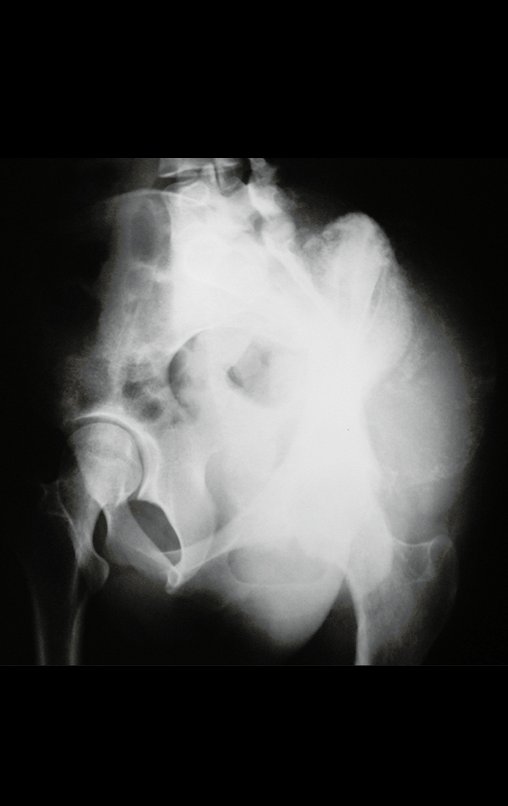
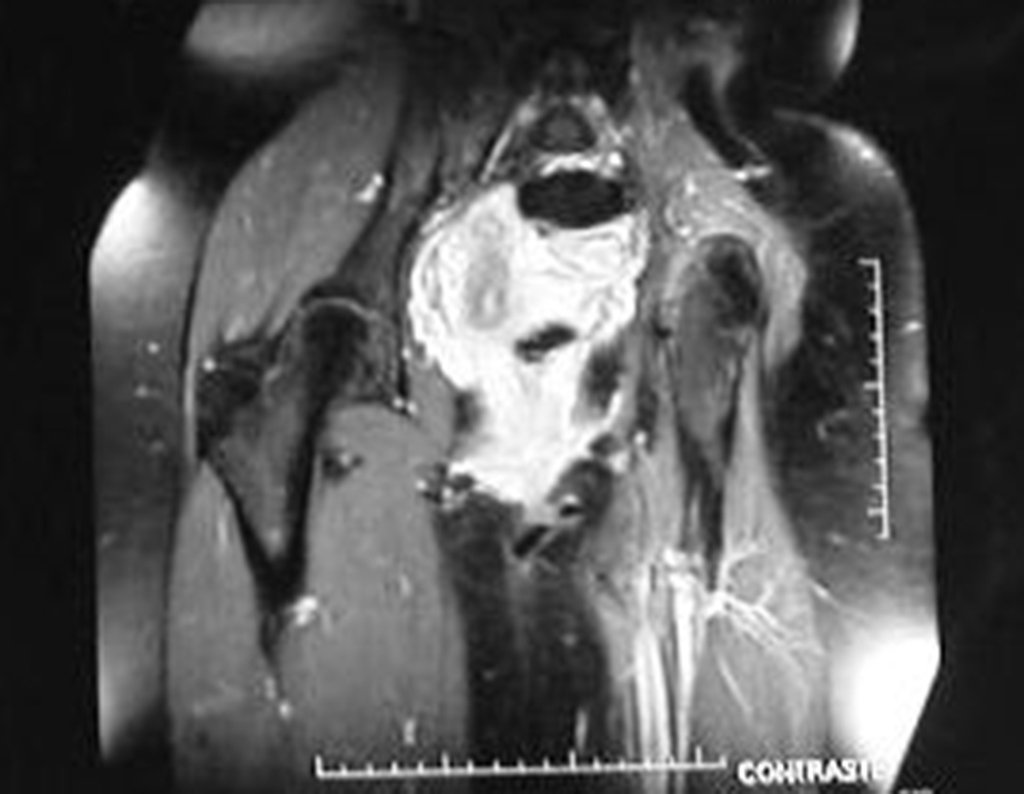
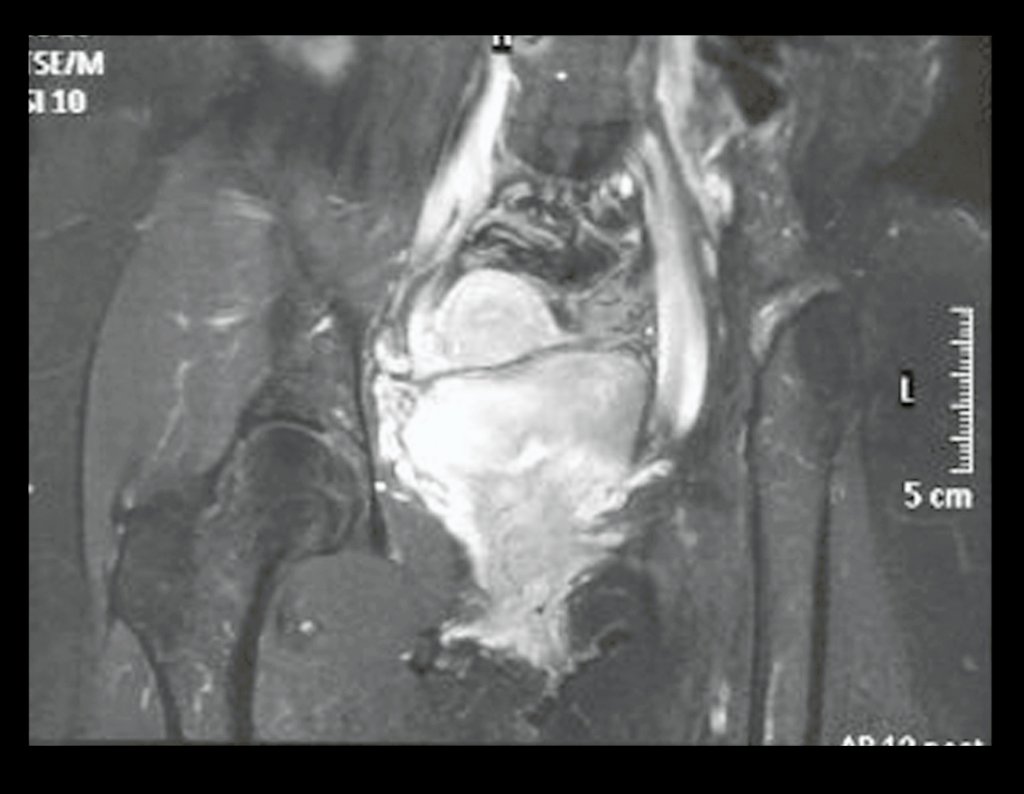
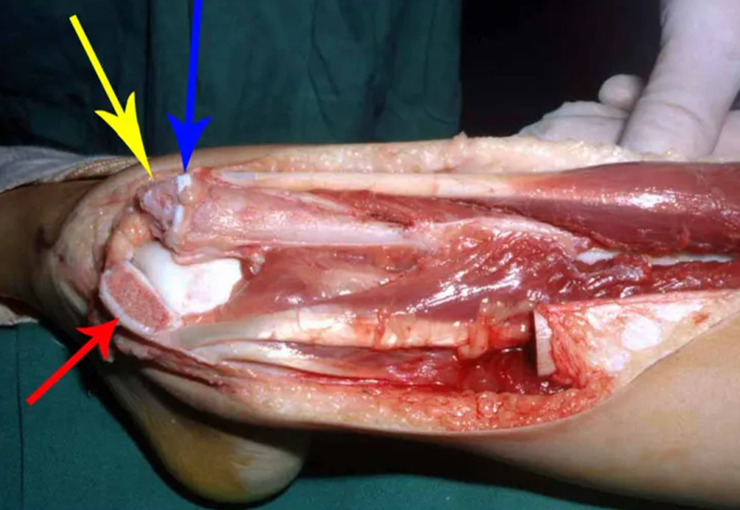
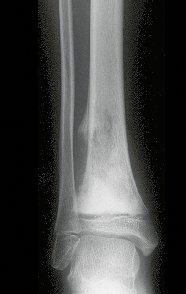
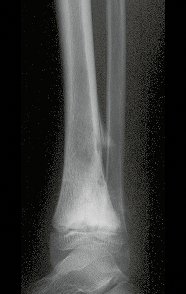
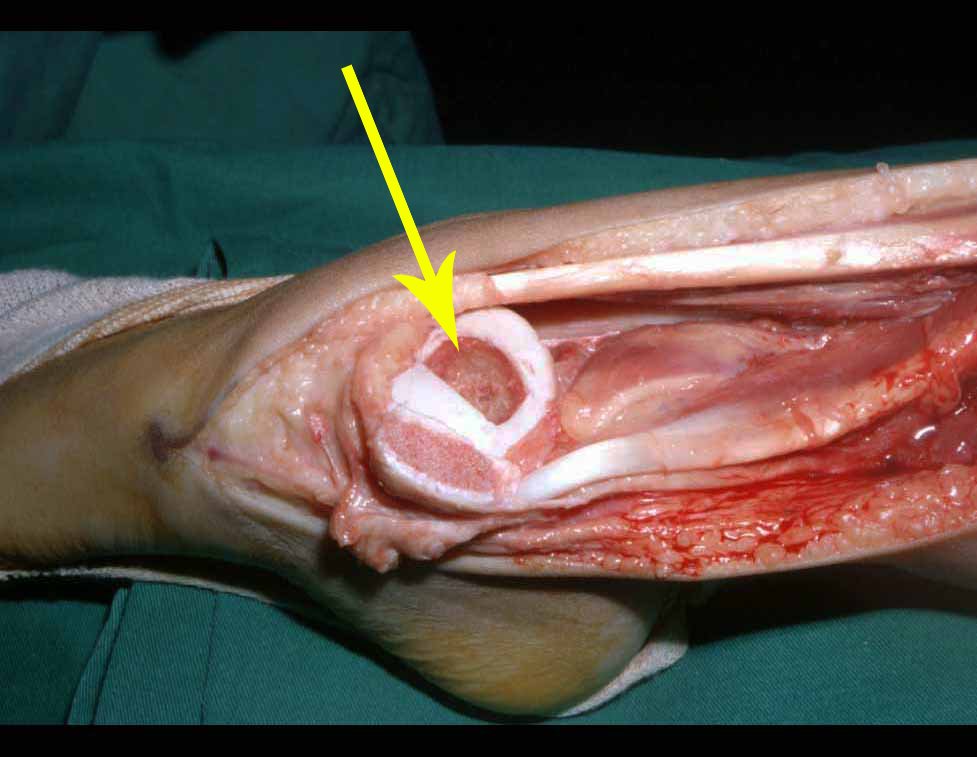
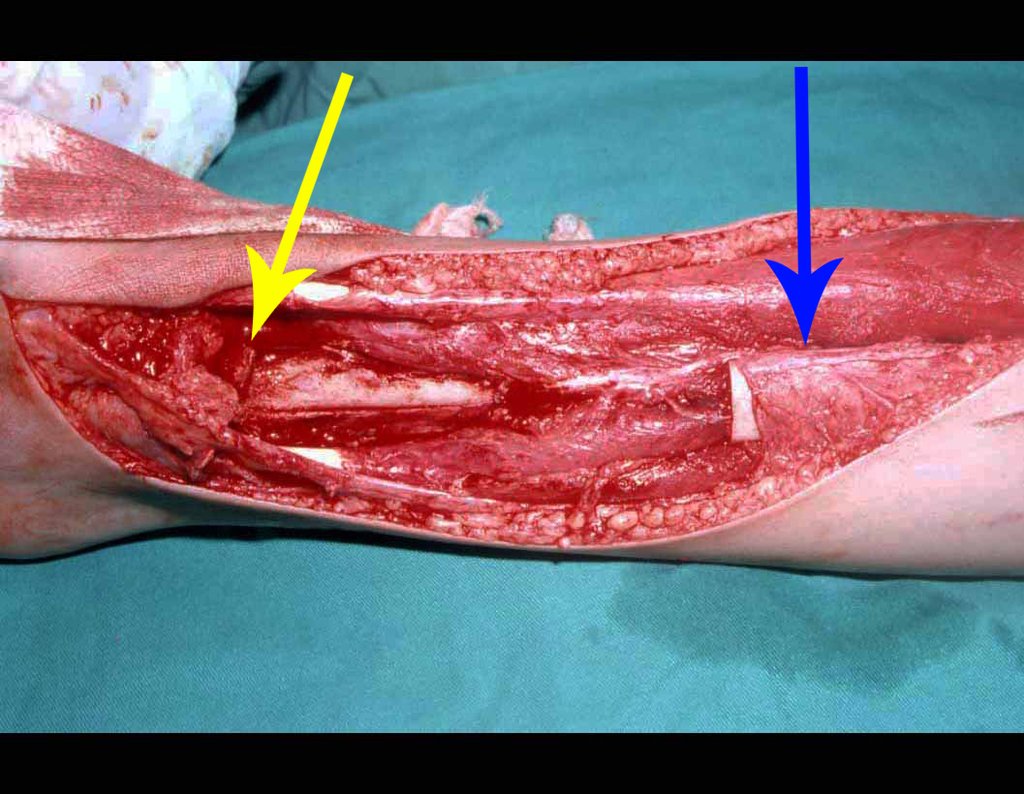
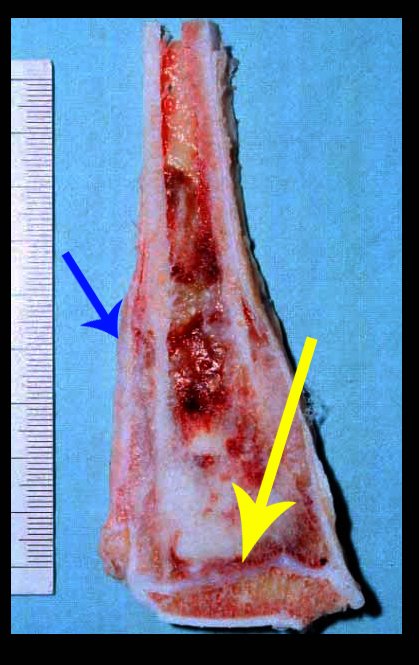
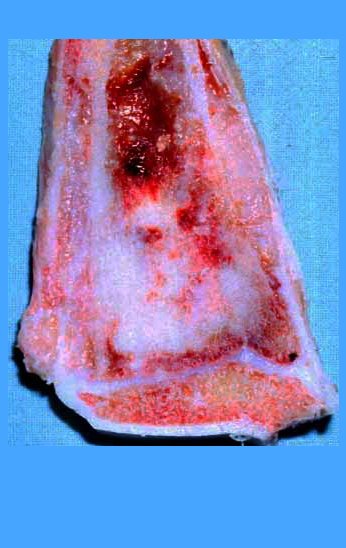
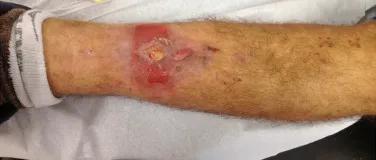
Otro factor que está involucrado en la complicación de la infección después de la osteosíntesis interna es la infección del trayecto de los pinos de Schanz. En nuestros pacientes, la presencia de sospecha clínica de infección fue indicación del cambio del pin por instalación en otra ubicación o la continuación del tratamiento con osteosíntesis mediante fijador externo.
La reducción y fijación se consideraron inadecuadas en el 60% de las evaluaciones, un valor considerado muy alto, y en promedio los asistentes y residentes de tercer año consideraron la reducción y fijación adecuadas en solo
Referencias
1. Scalea TM, Boswell SA, Scott JD, Mitchell KA, Kramer ME,Pollak AN. External fixation as a bridge to intramedullarynailing for patients with multiple injuries and with femurfractures: damage control orthopedics. J Trauma.2000;48(4):613-21.2. Parameswaran AD, Roberts CS, Seligson D, Voor M. Pin tractinfection with contemporary external fixation: how much of aproblem? J Orthop Trauma. 2003;17(7):503-7.3. Mahan J, Seligson D, Henry SL, Hynes P, Dobbins J. Factors inpin tract infections. Orthopedics. 1991;14(3):305-8.4. Harwood PJ, Giannoudis PV, Probst C, Krettek C, Pape HC. Therisk of local infective complications after damage controlprocedures for femoral shaft fracture. J Orthop Trauma.2006;20(3):181-9.5. Green SA, Ripley MJ. Chronic osteomyelitis in pin tracks. JBone Joint Surg Am. 1984;66(7):1092-8.6. Clasper JC, Cannon LB, Stapley SA, Taylor VM, Watkins PE.Fluid accumulation and the rapid spread of bacteria in thepathogenesis of external fixator pin track infection. Injury.2001;32(5):377-81.7. Moroni A, Vannini F, Mosca M, Giannini S. State of the artreview: techniques to avoid pin loosening and infection inexternal fixation. J Orthop Trauma. 2002;16(3):189-95.8. Cardozo RT, Silva LG, Bragante LA, Rocha MA. Tratamento dasfraturas diafisárias da tíbia com fixador externo comparadocom a haste intramedular bloqueada. Rev Bras Ortop.2013;48(2):137-44.9. Balbachevsky D, Belloti JC, Martins CVE, Fernandes HJA,Faloppa F, Reis FB. Como são tratadas as fraturas expostas datíbia no Brasil? Estudo transversal. Acta Ortop Bras.2005;13(5):229-32.10. Petinne KA, Chao EY, Kelly PJ. Analysis of the external fixatorpin-bone interface. Clin Orthop Relat Res. 1993;293:18-27.
Haz clic aquí para descargar el PDF